Лекция Электропроводность. Кондуктометрия.ppt
- Количество слайдов: 60

Кафедра общей и медицинской химии Лекция "Электропроводность растворов. Кондуктометрия. " 1
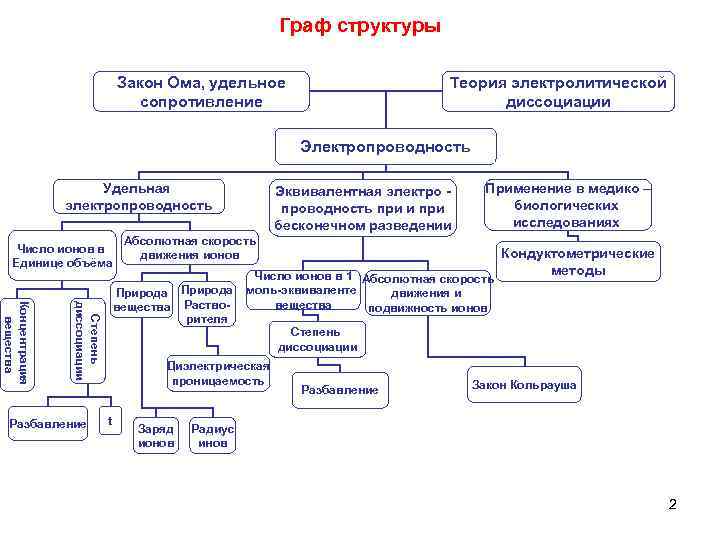
Граф структуры Закон Ома, удельное Теория электролитической сопротивление диссоциации Электропроводность Удельная Эквивалентная электро - Применение в медико – электропроводность проводность при и при биологических бесконечном разведении исследованиях Абсолютная скорость Число ионов в Кондуктометрические движения ионов Единице объёма Число ионов в 1 Абсолютная скорость методы Природа моль-эквиваленте движения и вещества Раство- вещества Концентрация подвижность ионов диссоциации рителя Степень вещества Степень диссоциации Диэлектрическая проницаемость Закон Кольрауша Разбавление t Заряд Радиус ионов инов 2

3

4

5
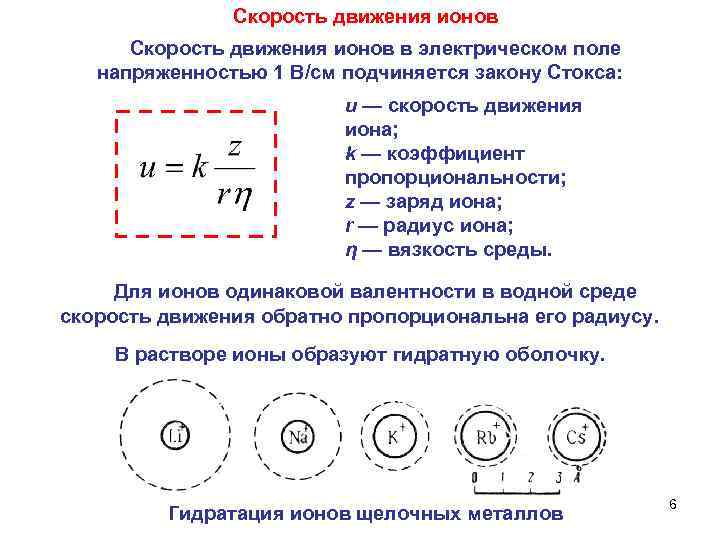
Скорость движения ионов в электрическом поле напряженностью 1 В/см подчиняется закону Стокса: u — скорость движения иона; k — коэффициент пропорциональности; z — заряд иона; r — радиус иона; η — вязкость среды. Для ионов одинаковой валентности в водной среде скорость движения обратно пропорциональна его радиусу. В растворе ионы образуют гидратную оболочку. 6 Гидратация ионов щелочных металлов
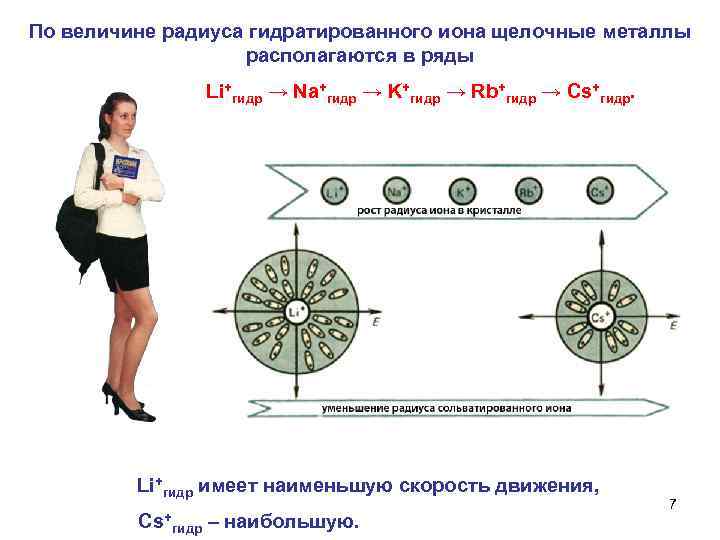
По величине радиуса гидратированного иона щелочные металлы располагаются в ряды Li+гидр → Na+гидр → K+гидр → Rb+гидр → Cs+гидр. Li+гидр имеет наименьшую скорость движения, 7 Сs+ гидр – наибольшую.
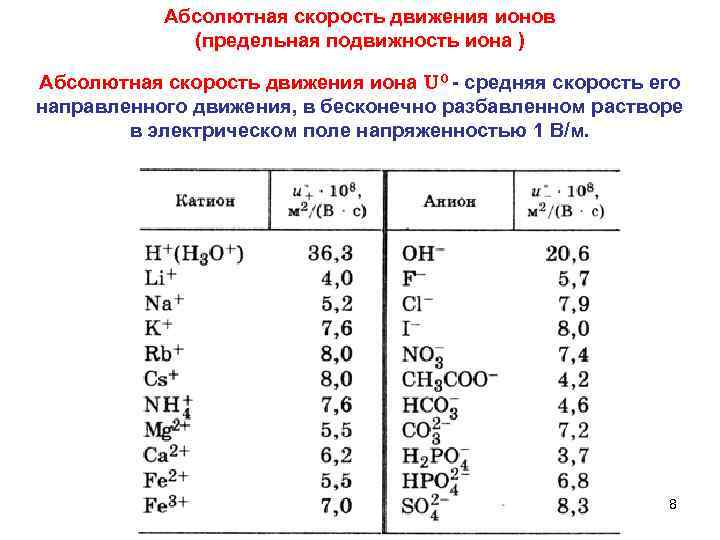
Абсолютная скорость движения ионов (предельная подвижность иона ) Абсолютная скорость движения иона U 0 - средняя скорость его направленного движения, в бесконечно разбавленном растворе в электрическом поле напряженностью 1 В/м. 8
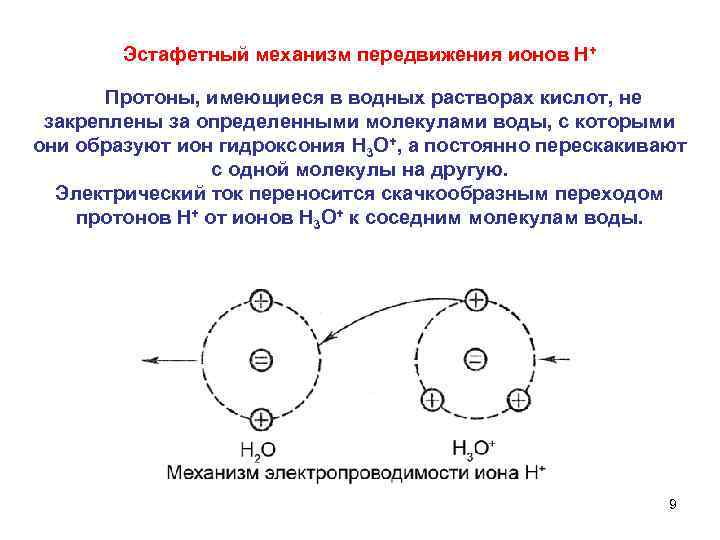
Эстафетный механизм передвижения ионов Н+ Протоны, имеющиеся в водных растворах кислот, не закреплены за определенными молекулами воды, с которыми они образуют ион гидроксония Н 3 О+, а постоянно перескакивают с одной молекулы на другую. Электрический ток переносится скачкообразным переходом протонов Н+ от ионов Н 3 О+ к соседним молекулам воды. 9

Uo зависит: 1. От заряда иона и его гидратированного радиуса: Отсутствие резких различий в подвижности многозарядных и однозарядных ионов объясняется большей гидратацией многозарядных ионов, что увеличивает размер и снижает их подвижность в электрическом поле несмотря на больший заряд. 10

2. От природы растворителя: Чем полярнее растворитель, тем меньше его подвижность (в полярных растворителях ионы сольватируются лучше) Чем больше вязкость, тем меньше подвижность иона. 3. От температуры раствора: при повышении температуры подвижность ионов увеличивается ≈ на 2 % при росте to на 1 o. C. (уменьшаются вязкость растворителя, толщина сольватных оболочек ионов, снижается межионное взаимодействие) 11

4. От ионной силы раствора: Чем больше ионная сила раствора, тем сильнее межионное взаимодействие и создаваемые им тормозящие эффекты. 5. От концентрации ионов: При разбавлении растворов сильных электролитов подвижность ионов растет (уменьшается их концентрация, снижается межионное взаимодействие) В растворах слабых электролитов (обычно α < 0, 03) подвижность ионов практически не зависит от разбавления (концентрация ионов в этих растворах всегда невелика) 12

Электропроводность растворов (L) Растворы и расплавы электролитов относятся к проводникам второго рода. Перенос электричества в них осуществляется положительными и отрицательными ионами. Величина, характеризующая способность вещества проводить электрический ток, называется электрической проводимостью (электропроводностью) Ом-1 или См (Сименс) 13

Сопротивление однородного проводника прямо пропорционально его длине, удельному сопротивлению и обратно пропорционально площади его поперечного сечения: (1) Удельной электрической проводимостью называется величина, измеряемая обратным значением его удельного сопротивления: После подстановки в формулу (1) получим: См/м 14
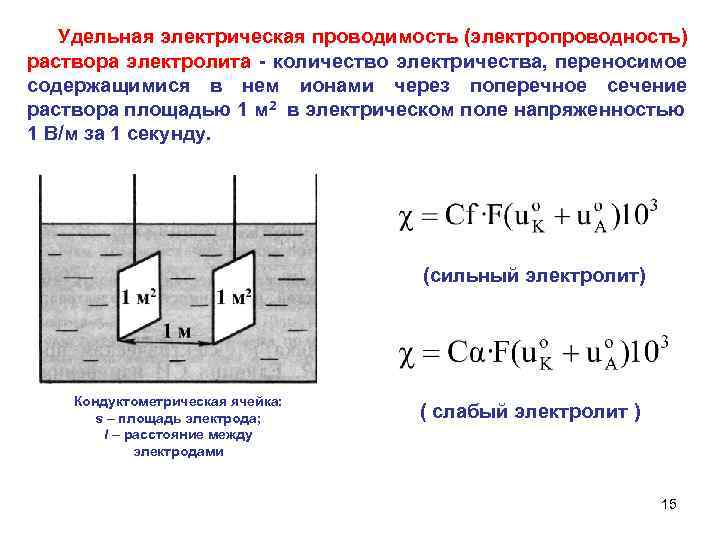
Удельная электрическая проводимость (электропроводность) раствора электролита - количество электричества, переносимое содержащимися в нем ионами через поперечное сечение раствора площадью 1 м 2 в электрическом поле напряженностью 1 В/м за 1 секунду. (сильный электролит) Кондуктометрическая ячейка: s – площадь электрода; ( слабый электролит ) l – расстояние между электродами 15

Удельная электрическая проводимость характеризует свойства проводящей среды - раствора электролита. 1 м 3 1 м 3 При равных концентрациях у сильных электролитов она больше, чем у слабых и максимальна в растворах сильных кислот и оснований вследствие высокой подвижности ионов Н + и ОН– 16
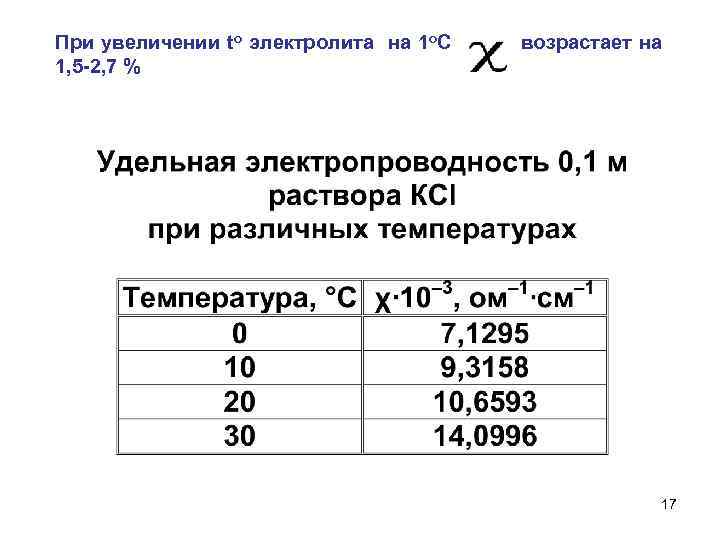
При увеличении to электролита на 1 o. С возрастает на 1, 5 -2, 7 % 17
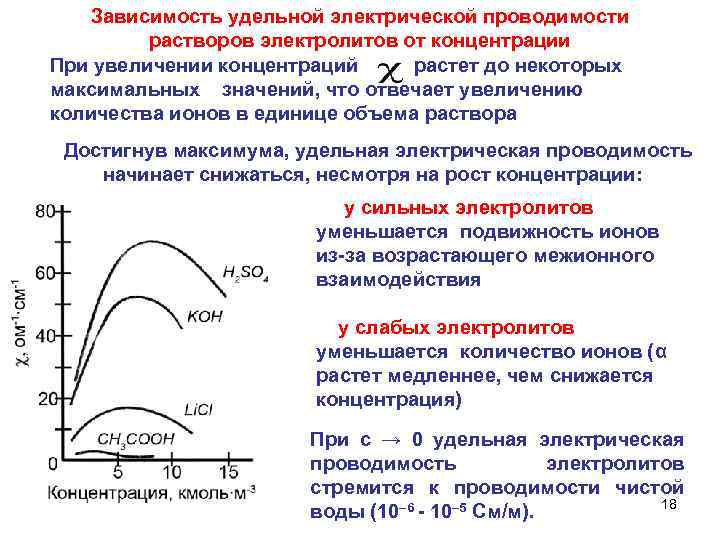
Зависимость удельной электрической проводимости растворов электролитов от концентрации При увеличении концентраций растет до некоторых максимальных значений, что отвечает увеличению количества ионов в единице объема раствора Достигнув максимума, удельная электрическая проводимость начинает снижаться, несмотря на рост концентрации: у сильных электролитов уменьшается подвижность ионов из-за возрастающего межионного взаимодействия у слабых электролитов уменьшается количество ионов (α растет медленнее, чем снижается концентрация) При с → 0 удельная электрическая проводимость электролитов стремится к проводимости чистой 18 воды (10– 6 - 10– 5 См/м).

Эквивалентная электропроводность Эквивалентная электропроводность λ - электрическая проводимость объема раствора, содержащего один моль эквивалента вещества и заключенного между электродами, отстоящими друг от друга на расстоянии 1 м. См м 2 / моль-экв V = 1/С, то есть 1/С – объем раствора (м 3), содержащий 1 моль вещества С моль электролита -----в 1 м 3 раствора 1 моль электролита -----в V м 3 Схема, объясняющая связь раствора между удельной и молярной электрическими проводимостями 19

На практике измеряют удельную электропроводность 1 см 3 при расстоянии между электродами 1 см. Связь между χ и λv в этом случае выражается формулой: См·см 2/моль-экв Зависимость эквивалентной (молярной)электропроводности сильных электролитов от имеет линейный характер и описывается уравнением Кольрауша 20

Связь эквивалентной электропроводности с предельной подвижностью ионов (1) Для сильных электролитов: Для слабых электролитов: (2) (3) После подстановки из уравнения (1) в уравнения (2) и (3) получим: 21

λv зависит от: üПрироды ионов üЗаряда ионов ü От концентрации (разбавления раствора) üОт температуры ( возрастает на ü 2 -2. 5 % при росте t 0 на 10 С ) 22
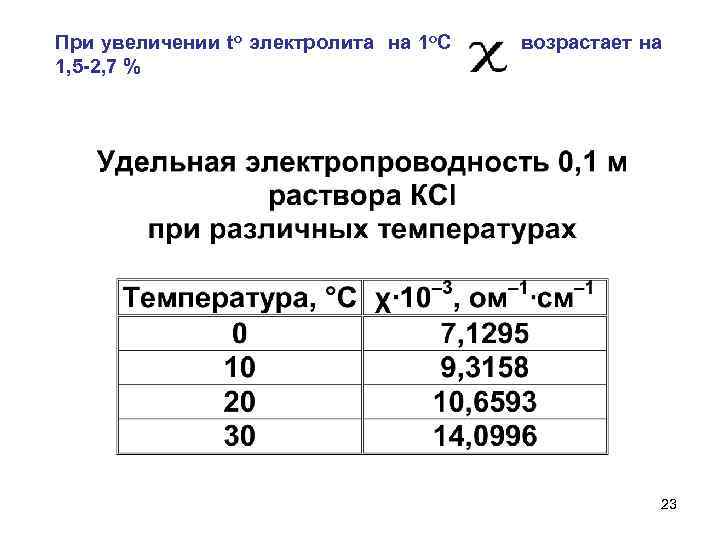
При увеличении to электролита на 1 o. С возрастает на 1, 5 -2, 7 % 23
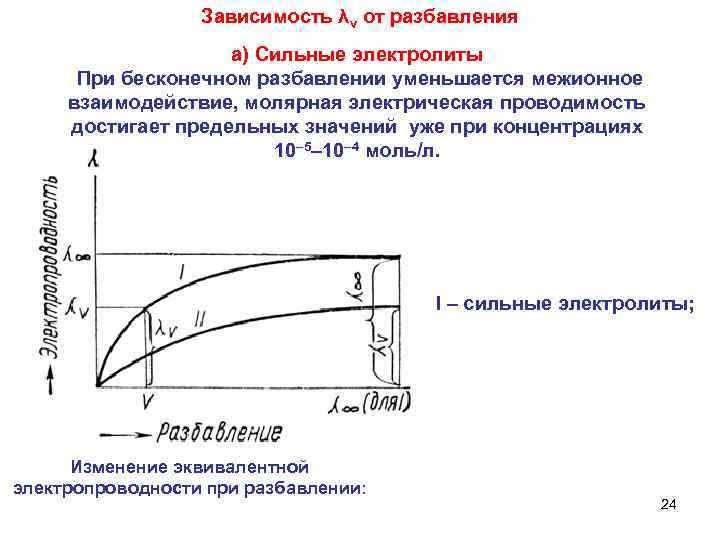
Зависимость λv от разбавления а) Сильные электролиты При бесконечном разбавлении уменьшается межионное взаимодействие, молярная электрическая проводимость достигает предельных значений уже при концентрациях 10– 5– 10– 4 моль/л. I – сильные электролиты; Изменение эквивалентной электропроводности при разбавлении: 24

б) Слабые электролиты При разбавлении раствора α возрастает и увеличивается количество ионов, образуемых 1 моль электролита. Даже при очень большом разбавлении полная диссоциация слабого электролита не достигается. II – слабые электролиты Изменение эквивалентной 25 электропроводности при разбавлении:
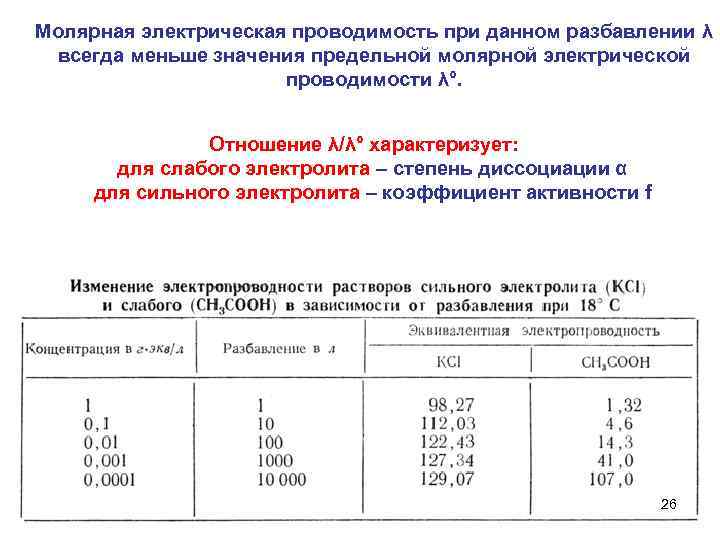
Молярная электрическая проводимость при данном разбавлении λ всегда меньше значения предельной молярной электрической проводимости λ°. Отношение λ/λ° характеризует: для слабого электролита – степень диссоциации α для сильного электролита – коэффициент активности f 26

Эквивалентная электропроводность иона при бесконечном разведении λ 0 K и λ 0 A - количество электричества, переносимое 1 моль ионов данного сорта в бесконечно разбавленном растворе в электрическом поле (Н = 1 В/м) через поперечное сечение раствора площадью 1 м 2 за 1 секунду. При бесконечном разбавлении каждый сорт ионов, присутствующих в растворе, переносит электричество независимо от присутствия других и вклад его в суммарную электрическую проводимость пропорционален заряду, подвижности и концентрации ионов. 27

Английский физик и химик, член Лондонского королевского общества Директор лаборатории (1825 г. ) и профессор Королевского института (1827 г. ). Самостоятельно проводил исследования по химии к важнейшим из которых относятся получение Майкл Фарадей бензола и сжижение хлора. Установил (1833 г. ) количественные законы (22. 09. 1791 - 25. 08. 1867) электролиза. 28

Наглядная иллюстрация смысла числа Фарадея!!! F = qe·NA Кл/моль - количество электричества, переносимое 1 моль электронов (однозарядных ионов). 29
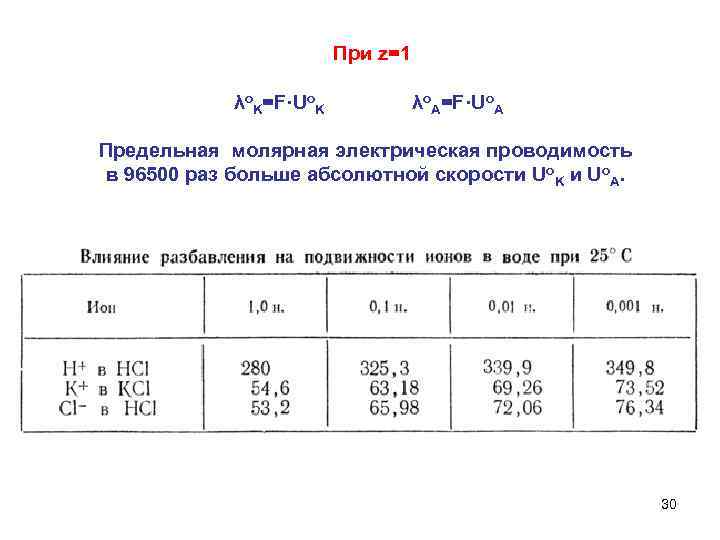
При z=1 λo. K=F·Uo. K λo. A=F·Uo. A Предельная молярная электрическая проводимость в 96500 раз больше абсолютной скорости Uo. K и Uo. A. 30

КОЛЬРАУШ Фридрих Вильгельм Георг (14. 10. 1840– 17. 01. 1910) Окончил Геттингенский университет в 1863 году. Предложил уравнение, зависимости электропроводности растворов сильных электролитов от их концентрации. В 1879 установил закон электропроводности при бесконечном разведении растворов электролитов 31

«В свою деревню в ту же пору Помещик новый прискакал И столь же строгом разбору В соседстве повод подавал. По имени Владимир Ленский, С душою прямо геттингенской…» Обмолвка Пушкина, конечно же, не случайна. «Туманная Германия» в читательском сознании немедленно ассоциировалась с романтизмом, с представлением о «прекрасной душе» ─ (Schцne Seele), описанию которой поэт посвящает последующие строки романа. В свою очередь, романтическое движение в Германии было теснейшим образом связано с университетами. 32

Закон Кольрауша. (Закон независимого движения ионов в разбавленных растворах) Эквивалентная электропроводность электролита при бесконечном разбавлении есть сумма молярных электрических проводимостей (электрических подвижностей) катиона и аниона. Сильный электролит: Слабый электролит: Так как при бесконечном разбавлении f и α стремятся к единице: Иногда λo. K и λo. A обозначают как l. K и l. A. 33
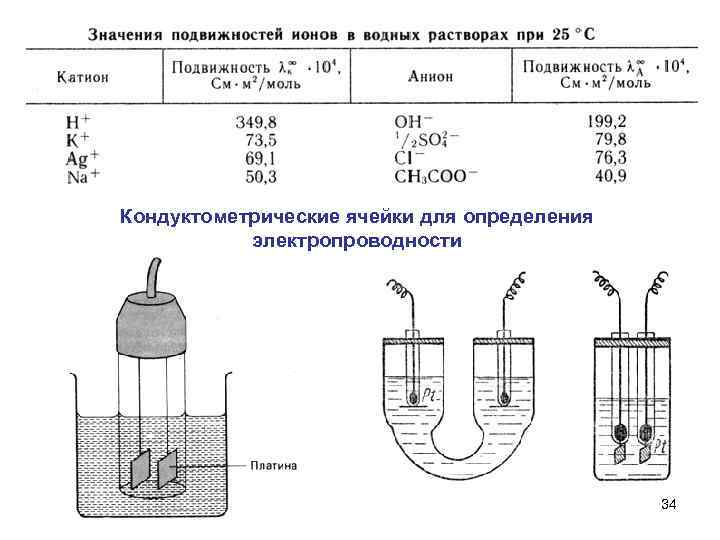
Кондуктометрические ячейки для определения электропроводности 34
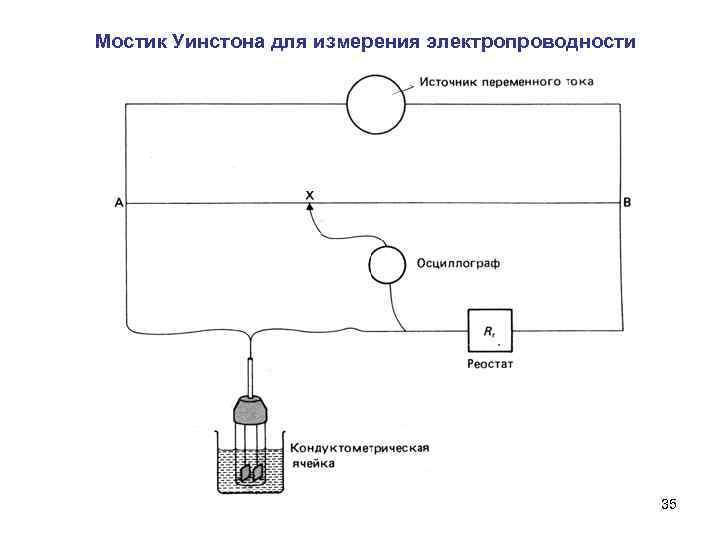
Мостик Уинстона для измерения электропроводности 35

Применение закона Кольрауша 1. Определение: 2. а) степени диссоциации слабого электролита б) коэффициента активности сильного электролита 36

в) константы диссоциации ( Кд ) слабого электролита: Подставив величину α в уравнение закона разведения легко вычислить и константу диссоциации слабых электролитов: 37
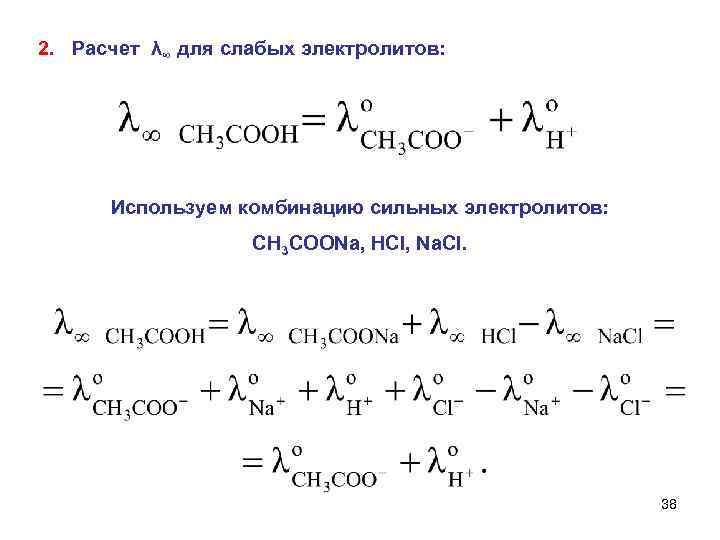
2. Расчет λ∞ для слабых электролитов: Используем комбинацию сильных электролитов: CH 3 COONa, HCl, Na. Cl. 38

3. Расчет ПР труднорастворимых соединений 39
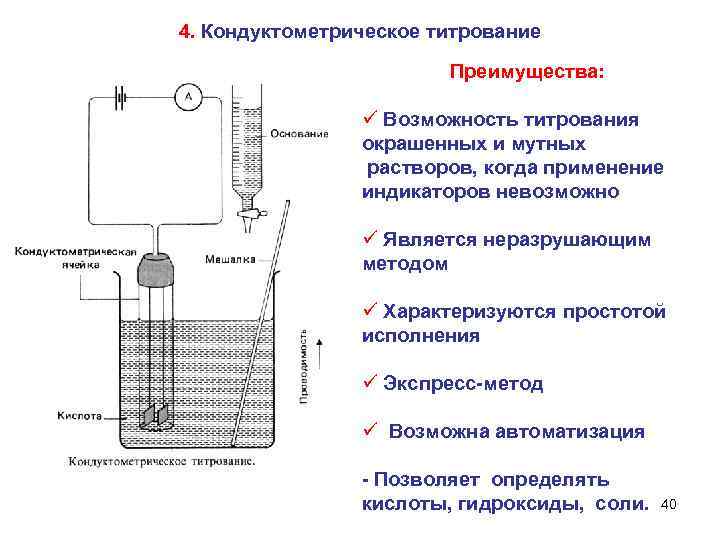
4. Кондуктометрическое титрование Преимущества: ü Возможность титрования окрашенных и мутных растворов, когда применение индикаторов невозможно ü Является неразрушающим методом ü Характеризуются простотой исполнения ü Экспресс-метод ü Возможна автоматизация - Позволяет определять кислоты, гидроксиды, соли. 40
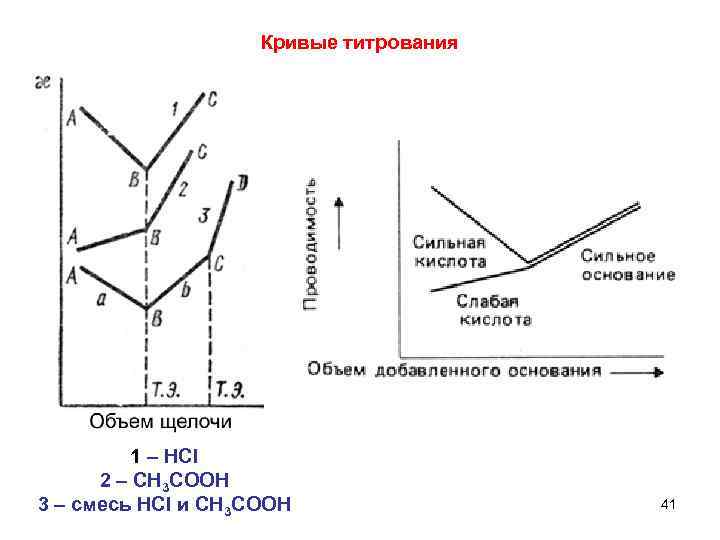
Кривые титрования 1 – HCl 2 – CH 3 COOH 3 – смесь HCl и CH 3 COOH 41

Принцип построения кривых – учет изменения концентраций ионов до и после точки эквивалентности Алгебраическая сумма электрических подвижностей дает угол наклона. HCl + Na. OH → Na. Cl + H 2 O CH 3 COOH + Na. OH → CH 3 COONa + H 2 O H+ + Cl– + Na+ + OH– → Na+ + Cl– + H 2 O CH 3 COOH + Na+ + OH– → → CH 3 COO– + Na+ + H 2 O до т. э. после т. э. H+↓ – 349. 8 Na+↑ +50. 3 CH 3 COO–↑ +40. 9 OH–↑ +199. 2 Na+↑ +50. 3 OH–↑ +199. 2 Na+↑ +50. 3 ≈ – 300 ≈ +250 ≈ +91 ≈ +250 -300 +250 +91 +250 42 т. э.
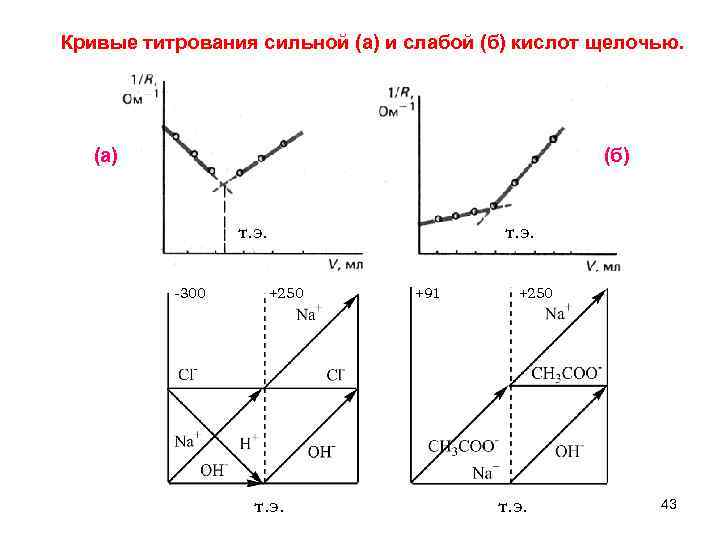
Кривые титрования сильной (а) и слабой (б) кислот щелочью. (а) (б) т. э. -300 +250 +91 +250 т. э. 43

Значение электропроводности 1. Определение ионного состава комплексов: 44

2. Определение солевого состава морской воды и засоленности почв Отбор проб воды в Гольфстриме для измерения проводимости и температуры морской воды на разной глубине 45

3. Контроль за влажностью зерна 46

47
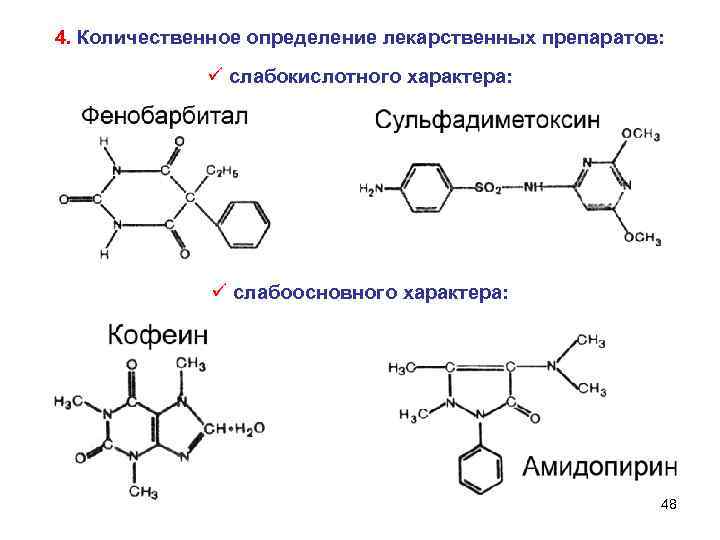
4. Количественное определение лекарственных препаратов: ü слабокислотного характера: ü слабоосновного характера: 48
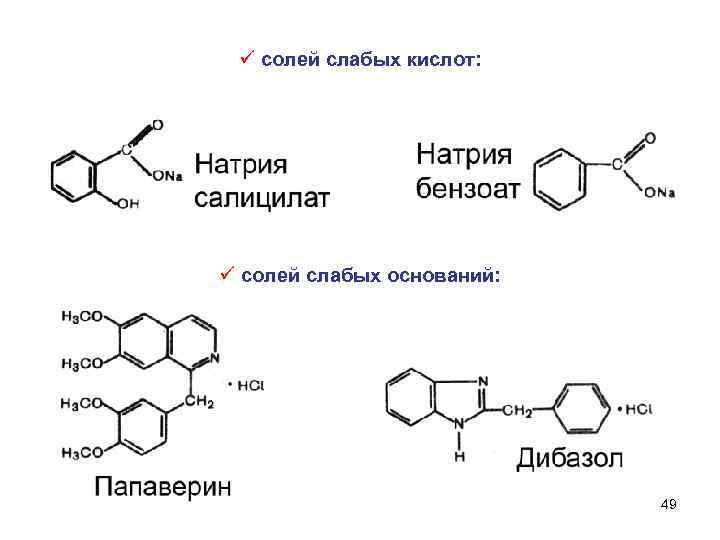
ü солей слабых кислот: ü солей слабых оснований: 49

5. Электролиз в металлургии. (получение алюминия из раствора глинозема в криолите): натрия – из хлорида натрия, магния – из хлорида магния Получение металлов 50 электролизом расплавов солей
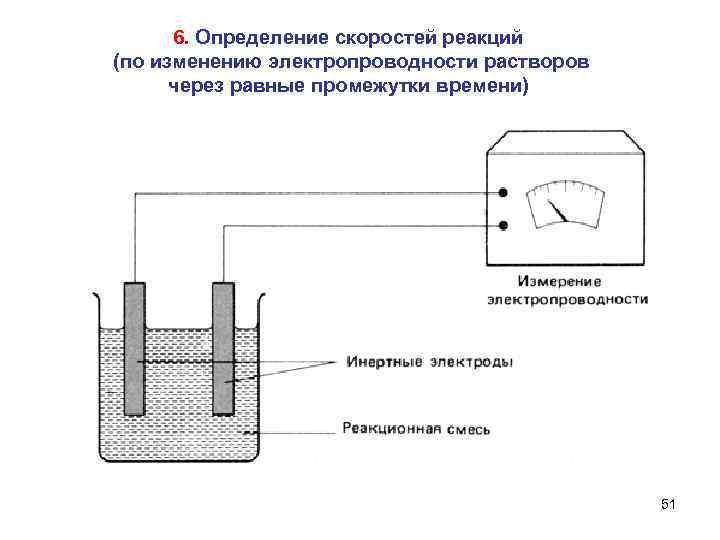
6. Определение скоростей реакций (по изменению электропроводности растворов через равные промежутки времени) 51

7. Определение структурных особенностей некоторых материалов по их электропроводности. Установлено, что ламповая сажа в вазелиновом масле показывает наибольшую структурированность системы при концентрации 10– 12%, температуре около 80°С и отсутствии поверхностно-активных веществ, мешающих формированию структурной сетки. Это имеет производственное значение, поскольку сажа входит в состав многих красок, лаков, каучуковых клеев, резиновых смесей. 52
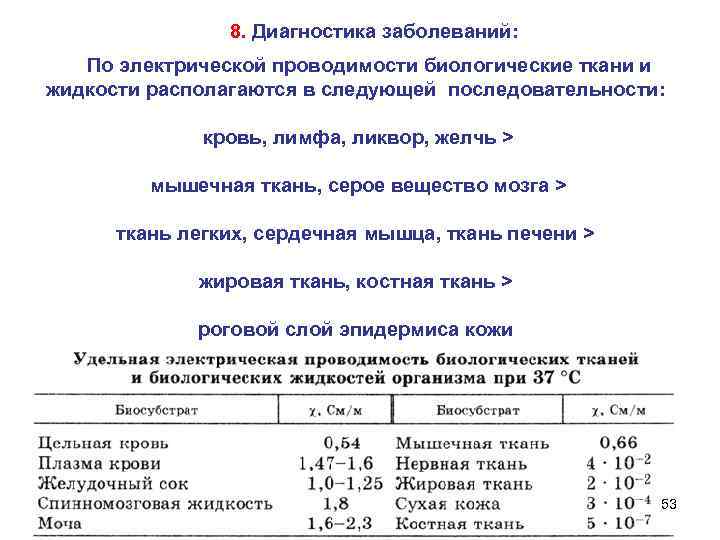
8. Диагностика заболеваний: По электрической проводимости биологические ткани и жидкости располагаются в следующей последовательности: кровь, лимфа, ликвор, желчь > мышечная ткань, серое вещество мозга > ткань легких, сердечная мышца, ткань печени > жировая ткань, костная ткань > роговой слой эпидермиса кожи 53
При заболеваниях почек (нефрит, нефросклероз, ) уменьшается концентрации Na. Cl и увеличивается содержание белка. Электрическая проводимость уменьшается до 0, 9– 1, 4 См/м ( норма-1, 6– 2, 3 ) При диабете повышается содержание сахара (неэлектролит) Электрическая проводимость мочи также понижена до 0, 9– 1, 4 Для желудочного сока удельная электрическая проводимость в норме - 1, 0– 1, 25 См/м свыше 1, 25 См/м - гиперкислотность, 0, 8– 1, 0 - гипокислотность, менее 0, 8 - бескислотность 54
9. Реография - метод изучения кровообращения в печени, сердце, почках, кровотока в сосудах на основе кондуктометрических измерений Электрическая проводимость цельной крови меньше, чем других клеточных жидкостей, поэтому при наполнении сосудов кровью их электрическое сопротивление повышается. 55
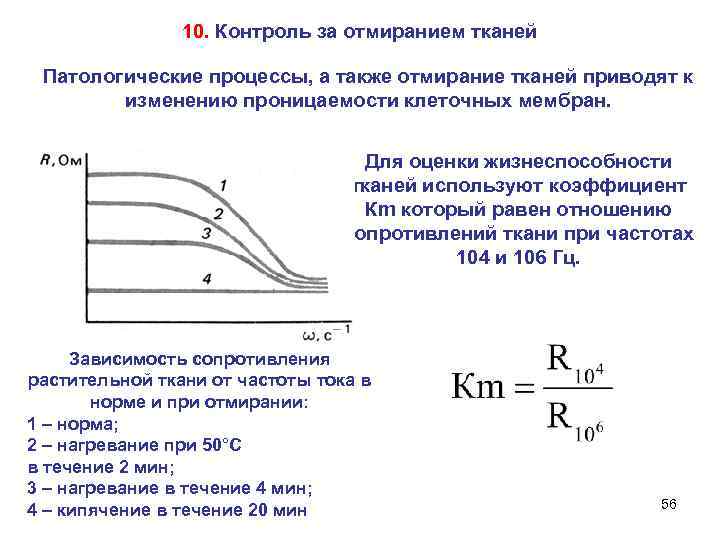
10. Контроль за отмиранием тканей Патологические процессы, а также отмирание тканей приводят к изменению проницаемости клеточных мембран. Для оценки жизнеспособности тканей используют коэффициент Кm который равен отношению сопротивлений ткани при частотах 104 и 106 Гц. Зависимость сопротивления растительной ткани от частоты тока в норме и при отмирании: 1 – норма; 2 – нагревание при 50°С в течение 2 мин; 3 – нагревание в течение 4 мин; 56 4 – кипячение в течение 20 мин

При гибели клеток и тканей избирательная проницаемость мембран исчезает, состав внутриклеточного и внеклеточного содержимого становится одинаковым, Кm становится равным единице Н. Ге И. Репин «Петр I допрашивает царевича «Иван Грозный и сын его Иван» (1885) Алексея в Петергофе» (1871) 57
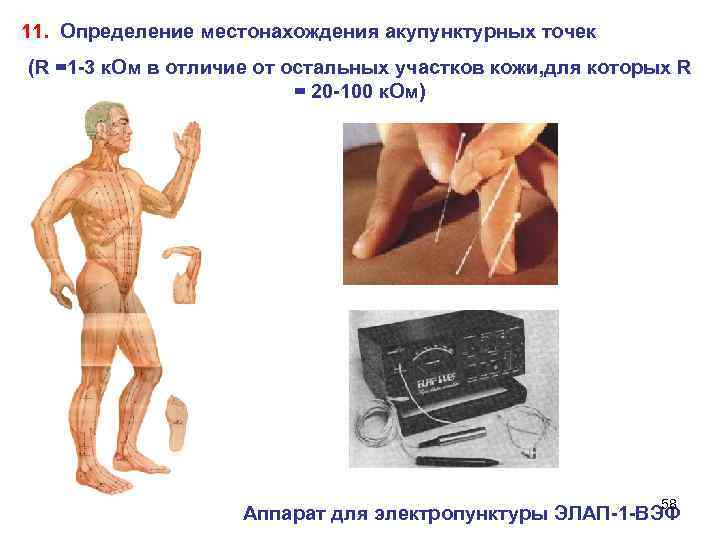
11. Определение местонахождения акупунктурных точек (R =1 -3 к. Ом в отличие от остальных участков кожи, для которых R = 20 -100 к. Ом) 58 Аппарат для электропунктуры ЭЛАП-1 -ВЭФ

12. Электрофоретическое введение лекарственных препаратов Ионофорез, электростимуляция, диатермия, ультравысокочастотная терапия основаны на электрической проводимости большинства тканей и сред организма. При ионофорезе лекарственные вещества вводятся в организм через неповрежденную кожу, сквозь поры потовых желез с помощью постоянного тока. В местах приложения электродов образуются кожные депо ионов, откуда лекарственный препарат постепенно перемещается к очагу поражения. В зависимости от заряда ионов лекарственных препаратов они 59 вводятся с положительного или отрицательного электродов.

Спасибо за внимание! 60
Лекция Электропроводность. Кондуктометрия.ppt