Органика, 6-1 лекция.ppt
- Количество слайдов: 100

Кафедра общей и медицинской химии Лекция 7 -I Углеводы. Моно- и дисахариды Хроматографические методы исследования. 1

Углево ды — органические вещества, содержащие карбонильную группу и несколько гидроксильных групп. Они входят в состав клеток и тканей всех живых и растительных организмов. Название углеводов сложилось исторически, для многих углеводов (УВ) О : H как в воде и общая формула – Сn(H 2 O)n. Растениями углеводы образуются в процессе фотосинтеза из CO 2 и Н 2 О: 6 CO 2 + 6 Н 2 О C 6 H 12 O 6 По способности к гидролизу УВ делят на простые и сложные. УВ сложные простые (гидролизуются) (не гидролизуются) моносахариды олигосахариды Полисахариды n ≤ 10 n > 10 2
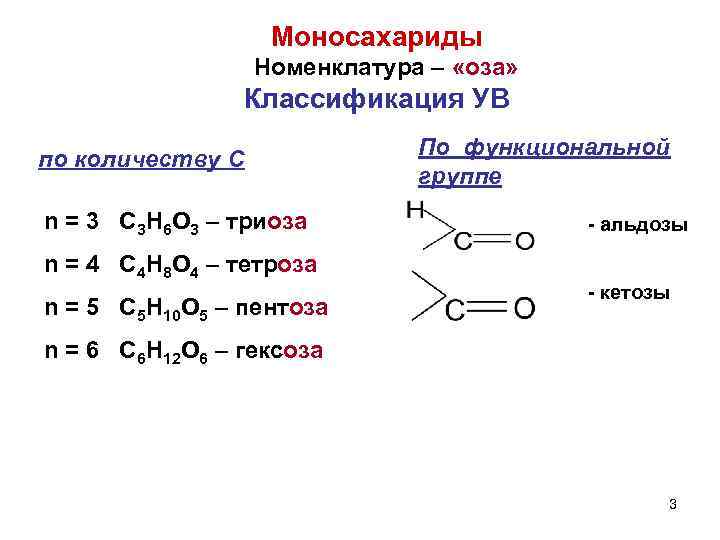
Моносахариды Номенклатура – «оза» Классификация УВ по количеству С По функциональной группе n = 3 C 3 H 6 O 3 – триоза - альдозы n = 4 C 4 H 8 O 4 – тетроза - кетозы n = 5 C 5 H 10 O 5 – пентоза n = 6 C 6 H 12 O 6 – гексоза 3

Стереоизомерия УВ Первый член гомологичного ряда УВ – триоза C 3 H 6 O 3. - глицериновый альдегид 2, 3–дигидроксипропаналь (альдоза) и его структурный изомер 1, 2 –дигидроксипропанон (кетоза) 4
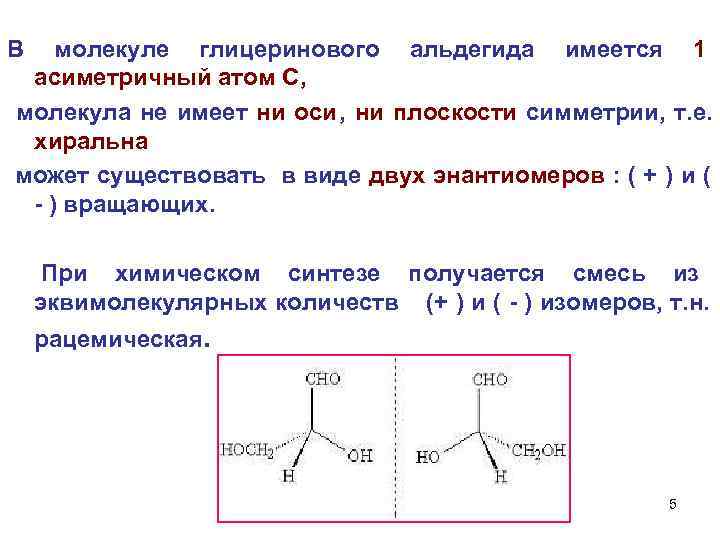
В молекуле глицеринового альдегида имеется 1 асиметричный атом С, молекула не имеет ни оси, ни плоскости симметрии, т. е. хиральна может существовать в виде двух энантиомеров : ( + ) и ( - ) вращающих. При химическом синтезе получается смесь из эквимолекулярных количеств (+ ) и ( - ) изомеров, т. н. рацемическая. 5

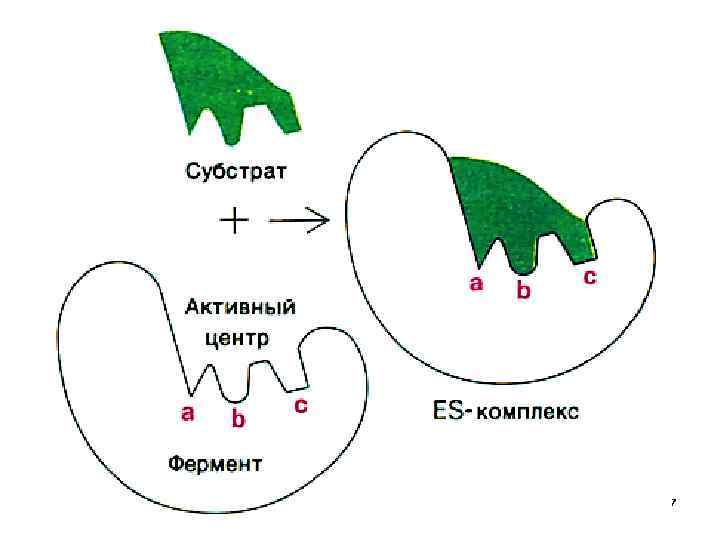
• Реакции, протекающие в живом организме приводят к одному энантиомеру, т. е. стереоселективны. • Необходимо знать конфигурацию атомов в этих энантиомерах, ведь биохимические реакции – ферментативны , а конфигурация фермента должна совпадать с конфигурацией Sb , т. е. они должны подходить друг к другу, как ключ к замку 6
7
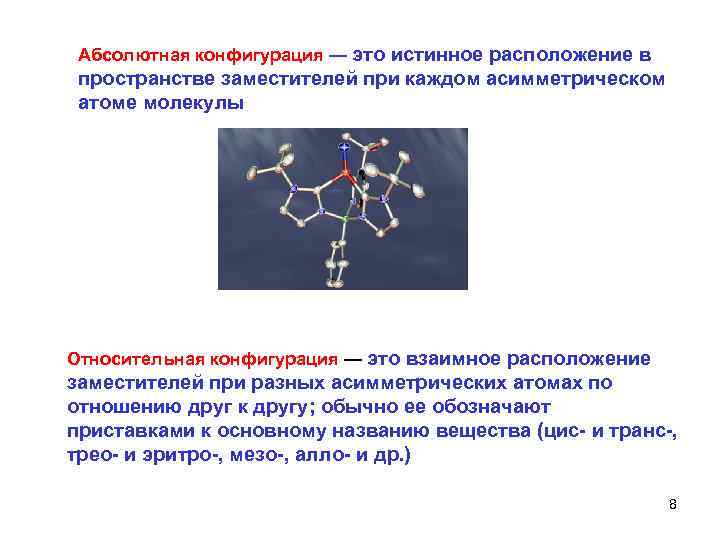
Абсолютная конфигурация — это истинное расположение в пространстве заместителей при каждом асимметрическом атоме молекулы Относительная конфигурация — это взаимное расположение заместителей при разных асимметрических атомах по отношению друг к другу; обычно ее обозначают приставками к основному названию вещества (цис- и транс-, трео- и эритро-, мезо-, алло- и др. ) 8
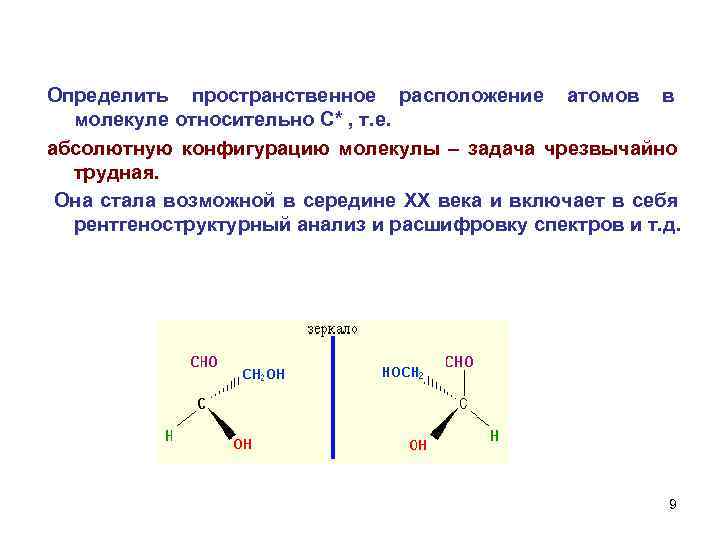
Определить пространственное расположение атомов в молекуле относительно С* , т. е. абсолютную конфигурацию молекулы – задача чрезвычайно трудная. Она стала возможной в середине ХХ века и включает в себя рентгеноструктурный анализ и расшифровку спектров и т. д. 9

Если абсолютную конфигурацию молекулы узнать трудно, то можно определить относительную. Химики в начале ХХ века ввели стереохимические ряды, условно обозначаемые как D и L, 1)выбрали конфигурационный стандарт 2) стали определять относительную конфигурацию изучаемого стереоизомера, сравнивая его со стандартом, 3) относить соединения к D и L стереохимическим рядам. За конфигурационный эталон в 1906 году Розанов А. принял глицериновый альдегид. 10
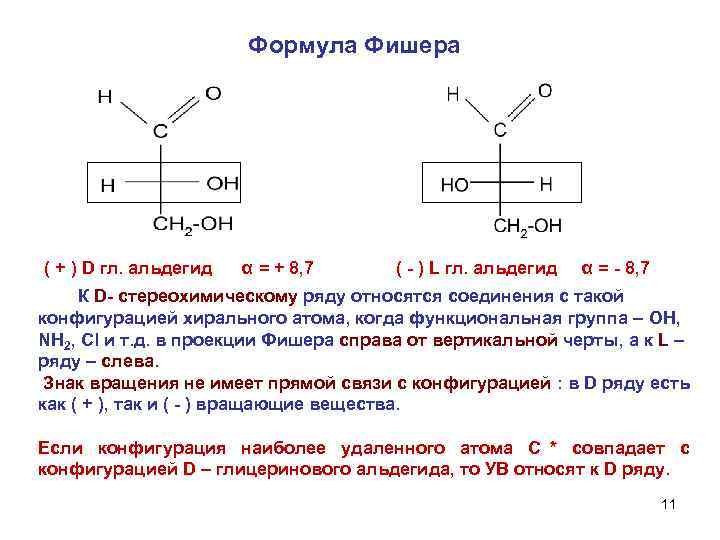
Формула Фишера ( + ) D гл. альдегид α = + 8, 7 ( - ) L гл. альдегид α = - 8, 7 К D- стереохимическому ряду относятся соединения с такой конфигурацией хирального атома, когда функциональная группа – OH, NH 2, Cl и т. д. в проекции Фишера справа от вертикальной черты, а к L – ряду – слева. Знак вращения не имеет прямой связи с конфигурацией : в D ряду есть как ( + ), так и ( - ) вращающие вещества. Если конфигурация наиболее удаленного атома С * совпадает с конфигурацией D – глицеринового альдегида, то УВ относят к D ряду. 11

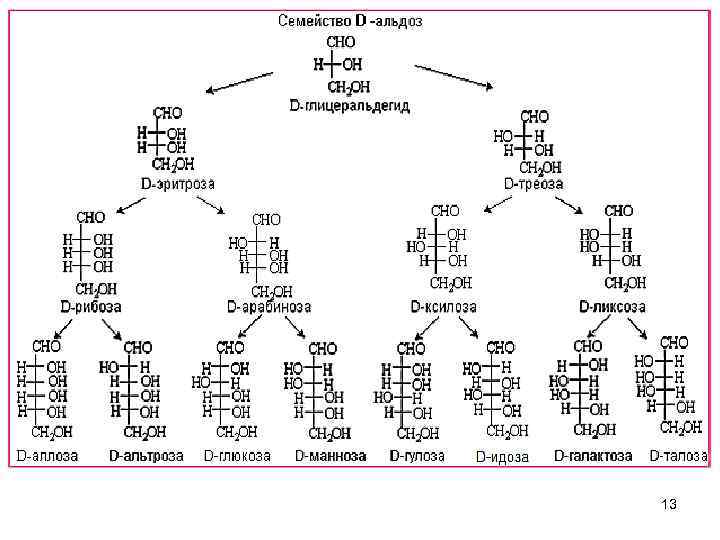
Для изображения строения мнсх. используют проекционные формулы Фишера. Фишер Эмиль Герман (1852 - 1919), немецкий химик-органик, создатель научной школы, основоположник химии природных соединений. 1. Исследовал строение и синтезировал ряд производных пурина: кофеин, гуанин, аденин и др. 2. Ввел номенклатуру, создал рациональную классификацию и осуществил синтез многих углеводов. 3. Открыл специфичность действия ферментов. Основополагающие исследования по химии белков. Нобелевская премия (1902). 12
13
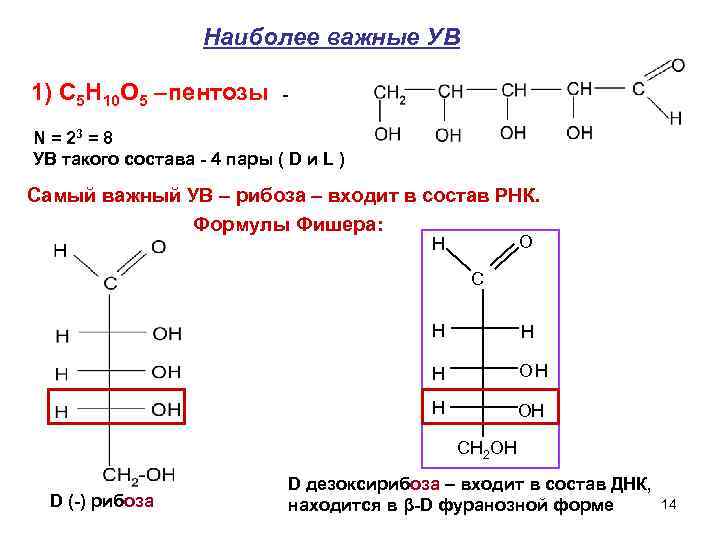
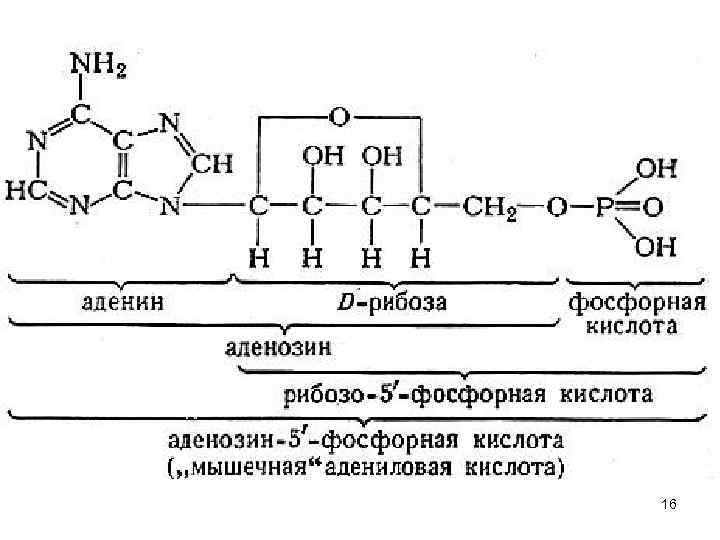
Наиболее важные УВ 1) C 5 H 10 O 5 –пентозы - N = 23 = 8 УВ такого состава - 4 пары ( D и L ) Самый важный УВ – рибоза – входит в состав РНК. Формулы Фишера: H O C H H OH H ОH СН 2 ОН D дезоксирибоза – входит в состав ДНК, D (-) рибоза находится в β-D фуранозной форме 14
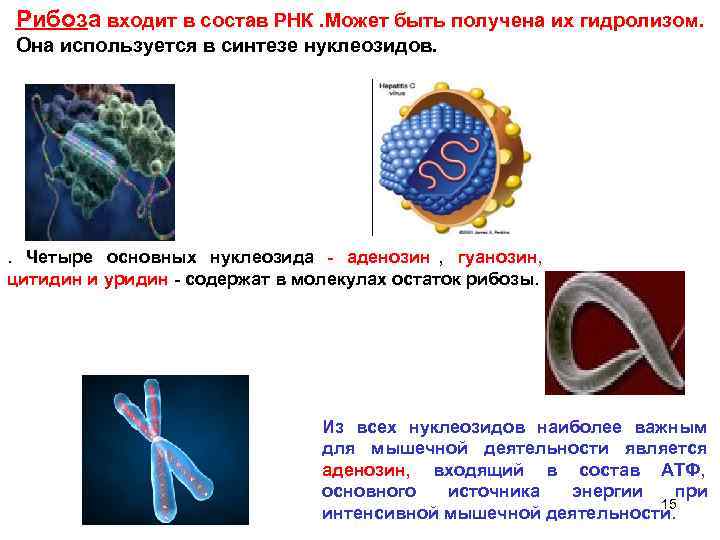
Рибоза входит в состав РНК. Может быть получена их гидролизом. Она используется в синтезе нуклеозидов. . Четыре основных нуклеозида - аденозин , гуанозин, цитидин и уридин - содержат в молекулах остаток рибозы. Из всех нуклеозидов наиболее важным для мышечной деятельности является аденозин, входящий в состав АТФ, основного источника энергии при 15 интенсивной мышечной деятельности.
16
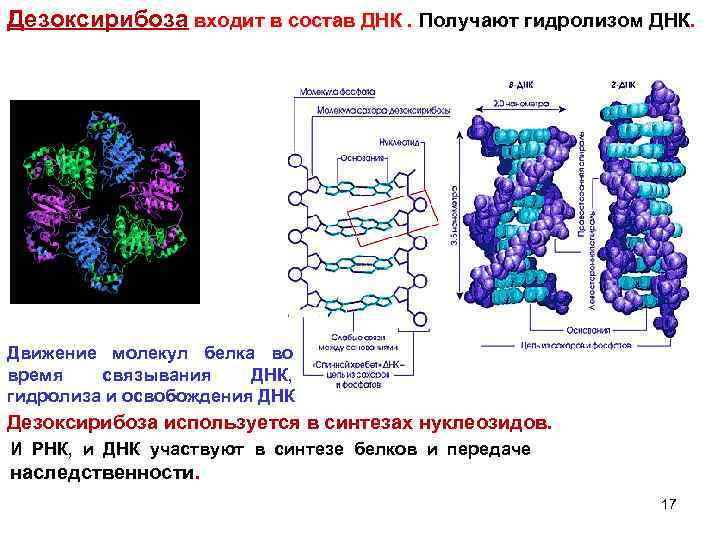
Дезоксирибоза входит в состав ДНК. Получают гидролизом ДНК. Движение молекул белка во время связывания ДНК, гидролиза и освобождения ДНК Дезоксирибоза используется в синтезах нуклеозидов. И РНК, и ДНК участвуют в синтезе белков и передаче наследственности. 17
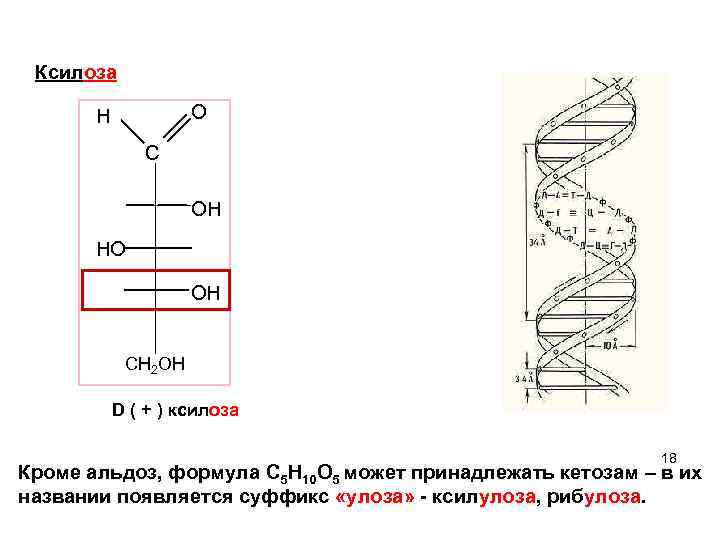
Ксилоза H O C ОH НO OН СН 2 ОН D ( + ) ксилоза 18 Кроме альдоз, формула C 5 H 10 O 5 может принадлежать кетозам – в их названии появляется суффикс «улоза» - ксилулоза, рибулоза. 18
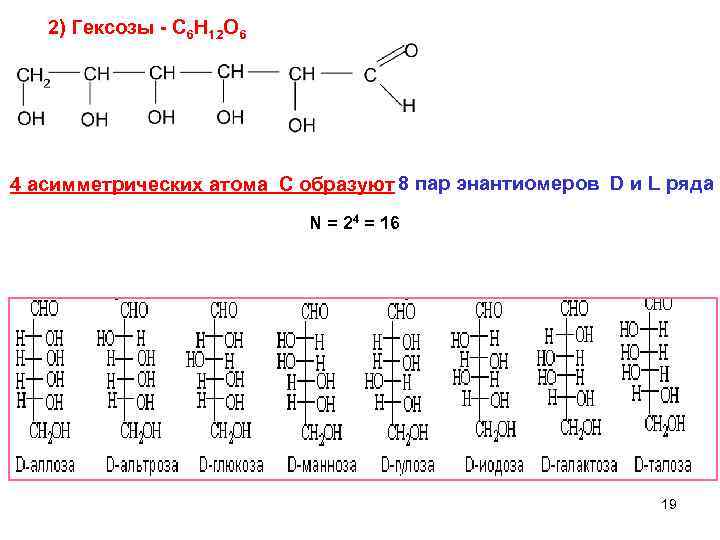
2) Гексозы - C 6 H 12 O 6 4 асимметрических атома С образуют 8 пар энантиомеров D и L ряда N = 24 = 16 19
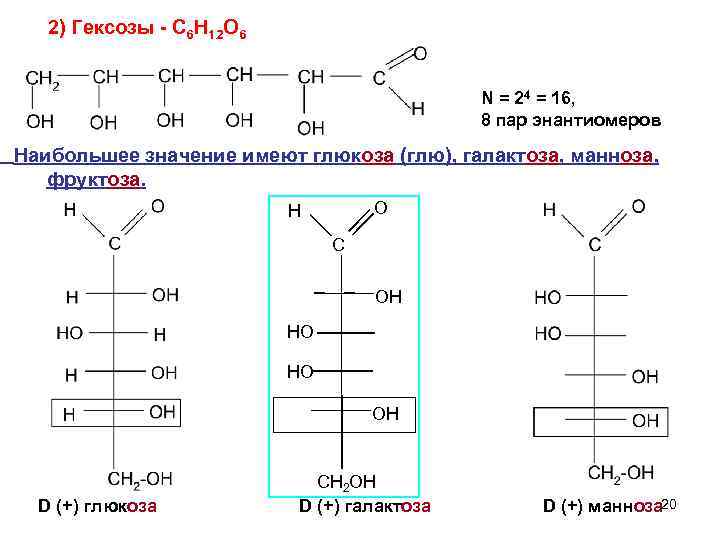
2) Гексозы - C 6 H 12 O 6 N = 24 = 16, 8 пар энантиомеров Наибольшее значение имеют глюкоза (глю), галактоза, манноза, фруктоза. H O C OН HО НO OН СН 2 ОН D (+) глюкоза D (+) галактоза D (+) манноза 20

Глюкоза - самый распространенный моносахарид В свободном виде содержится во фруктовых соках, в качестве составной части входит в молекулы дисахаридов (сахарозы, мальтозы, лактозы, целлобиозы и полисахаридов (крахмал, гликогена, целлюлозы, декстринов 21

Глюкоза Используют глюкозу Ø в пищевой промышленности, Øмедицине , для синтеза глюконовой и аскорбиновой кислот, Ø в качестве восстановителя в текстильной промышленности, Ø для получения этилового спирта. 22

Эпимеры –диастереомеры, которые различаются конфигурацией одного атома. Фруктоза – структурный изомер глюкозы, фруктовый сахар содержится в мёде, фруктах D (-) фру 23

Фруктоза Ф руктоза фруктовый или плодовый, сахар, левулёза, β фруктофураноза, бесцветные кристаллы сладкого вкуса (слаще сахарозы в 1, 5 раза и глюкозы в 3 раза), растворимы в воде. Встречается в свободном виде во многих фруктах и плодах: в яблоках, помидорах, пчелином мёде (около 50% ), входит в состав олиго- и полисахаридов. 24
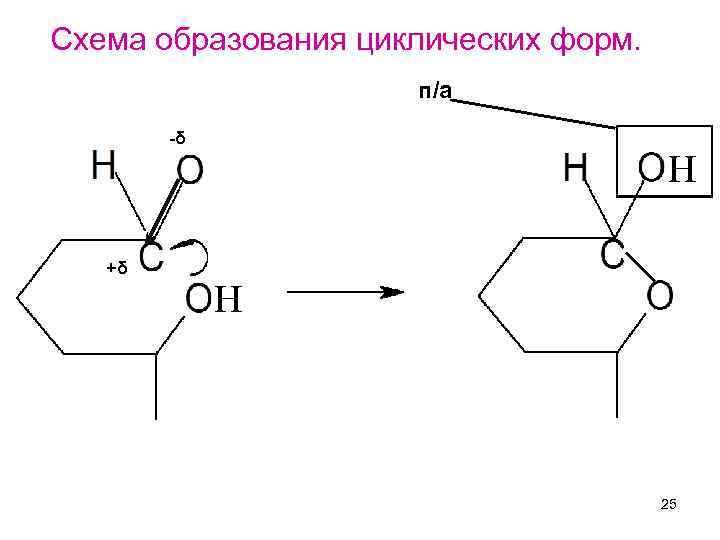
Схема образования циклических форм. п/а -δ Н +δ Н 25
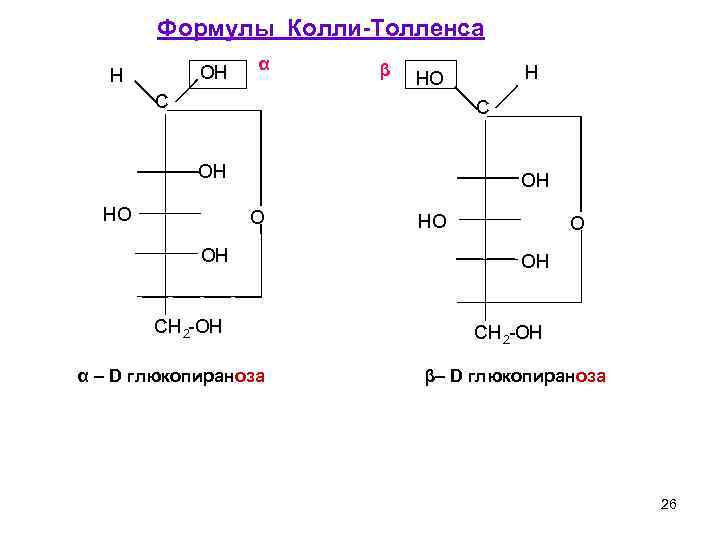
Формулы Колли-Толленса OH α β H HO H C OH HO O OH CH 2 -OH α – D глюкопираноза β– D глюкопираноза 26
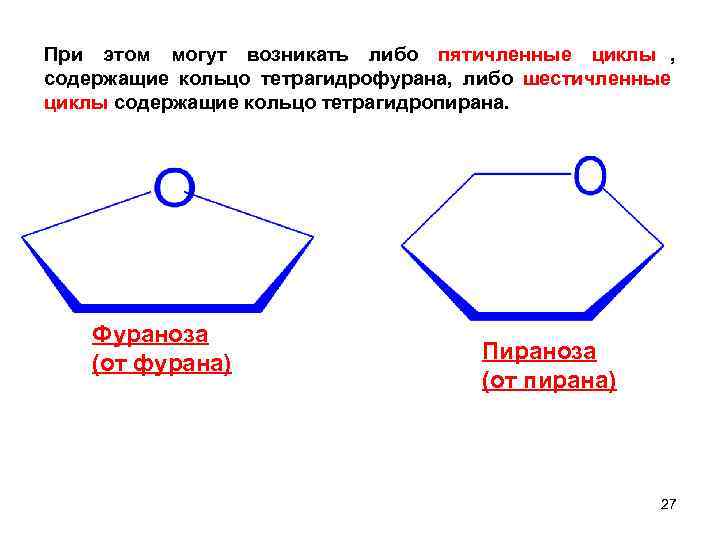
При этом могут возникать либо пятичленные циклы , содержащие кольцо тетрагидрофурана, либо шестичленные циклы содержащие кольцо тетрагидропирана. Фураноза (от фурана) Пираноза (от пирана) 27
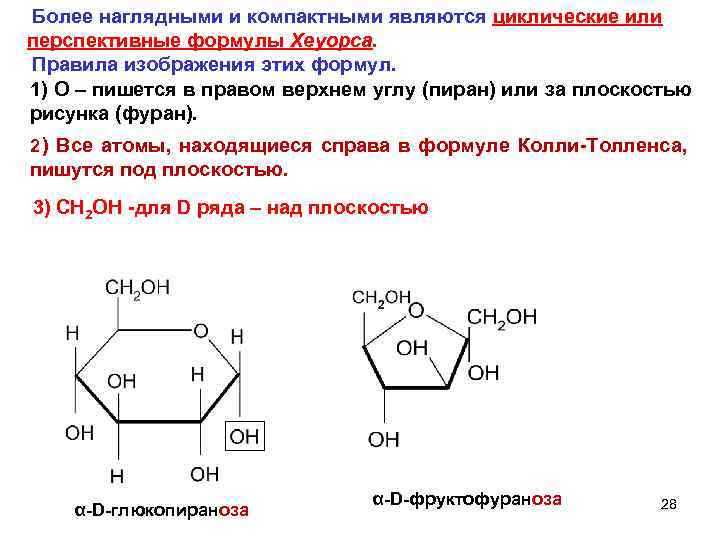
Более наглядными и компактными являются циклические или перспективные формулы Хеуорса. Правила изображения этих формул. 1) О – пишется в правом верхнем углу (пиран) или за плоскостью рисунка (фуран). 2 ) Все атомы, находящиеся справа в формуле Колли-Толленса, пишутся под плоскостью. 3) CH 2 OH -для D ряда – над плоскостью α-D-фруктофураноза 28 α-D-глюкопираноза

Таутомерия. Мутаротация Доказательством существования циклической формы может быть явление мутаротации. твердом состоянии моносахариды имеют циклическое В строение. При растворении моносахаридов первоначальное значение [α] меняется, со временем достигнув определенного значения, которое остается постоянным. Мутаротация – изменение удельного вращения растворов УВ во времени. Сахариметр-поляриметр СУ-5 предназначен для измерения концентрации сахарозы в растворах по углу вращения плоскости поляризации 29

Таутомерия. Мутаротация При растворении моносахарид из одной циклической формы может перейти в другую, но только через открытую. β-D- глюкопираноза D – глю α-D- глюкопираноза α = + 19° равнов. α = 52. 5° α = + 112° Автоматический цифровой поляриметр Сосуществование в динамическом равновесии двух и более изомерных форм называется таутомерией. Таутомерия УВ - окси-оксо, цикло-оксо, или кольчато- цепная. 30
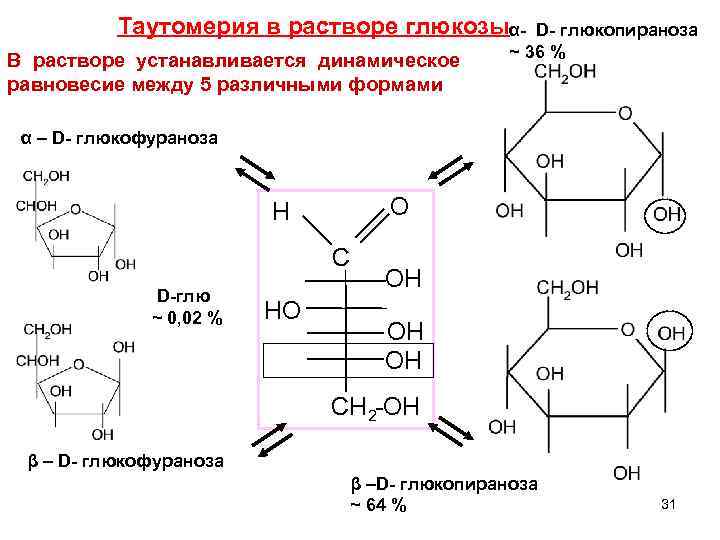
Таутомерия в растворе глюкозыα- D- глюкопираноза ~ 36 % В растворе устанавливается динамическое равновесие между 5 различными формами α – D- глюкофураноза H O C OH D-глю ~ 0, 02 % HO OH CH 2 -OH β – D- глюкофураноза β –D- глюкопираноза ~ 64 % 31
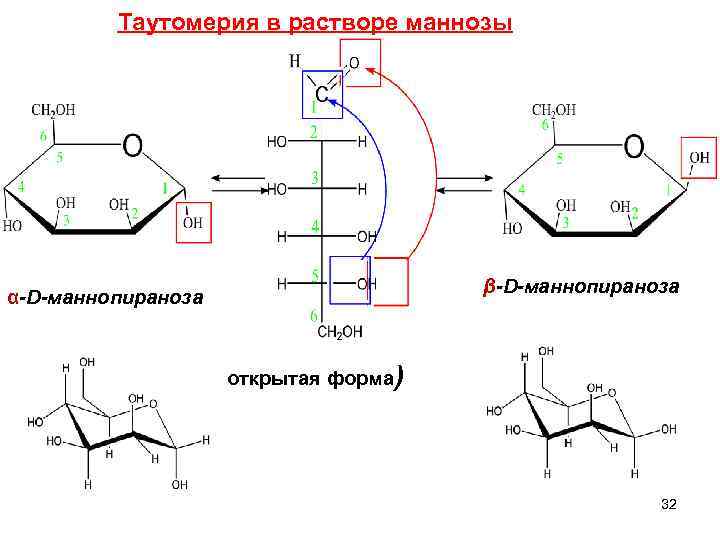
Таутомерия в растворе маннозы β-D-маннопираноза α-D-маннопираноза открытая форма) 32

Манноза – компонент многих полисахаридов и смешанных биополимеров растительного, животного и бактериального происхождения, имеет сладкий вкус. В природе встречается только D- форма. Существует в виде двух аномеров: α- и β- формы. В свободном виде обнаружена в плодах многих цитрусовых, анакардиевых и коринокарповых 33

Манноза Превращения маннозы в организме происходят с помощью активированной формы маннозы – гаунозиндифосфатманнозы (ГДФМ), которая служит донором остатка маннозы при биосинтезе маннанов и других биополимеров. 34
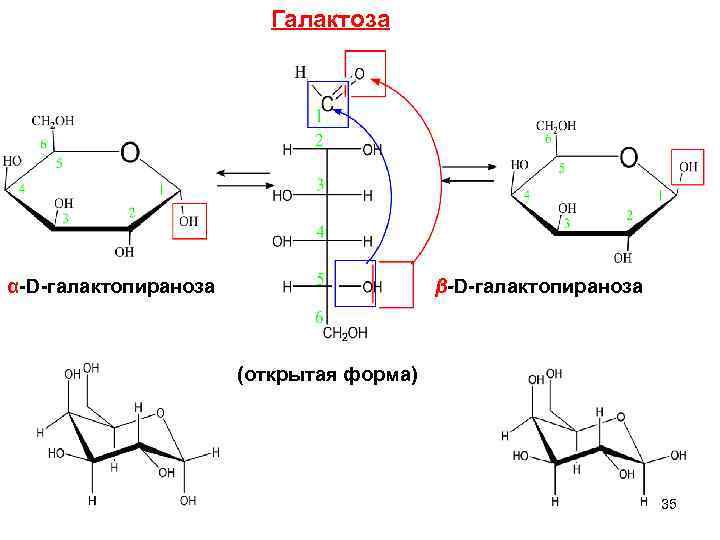
Галактоза α-D-галактопираноза β-D-галактопираноза (открытая форма) 35

Галактоза Встречается в природе в свободном виде , в виде г ликозидов , дисахаридов (лактозы), полисахаридов ( агар-агара, ). Галактоза входит в состав стероидных алкалоидов, выделенных из растений семейства пасленовых, например саланина содержащегося в картофеле. Агар-агар 36
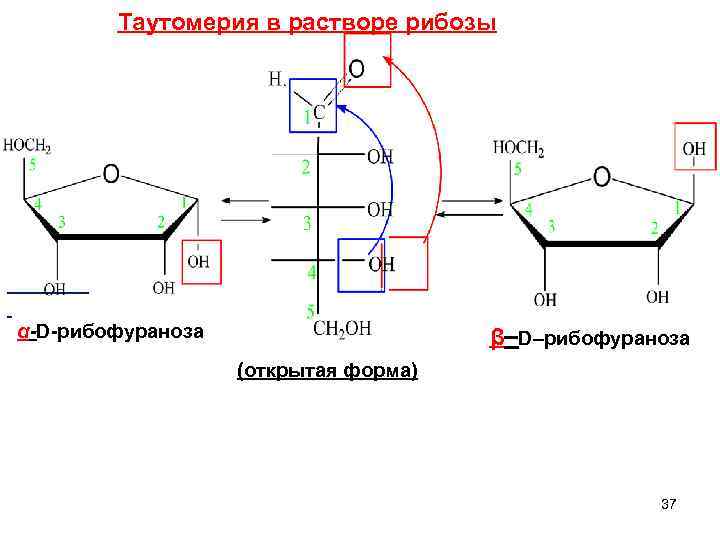
Таутомерия в растворе рибозы α-D-рибофураноза β–D–рибофураноза (открытая форма) 37
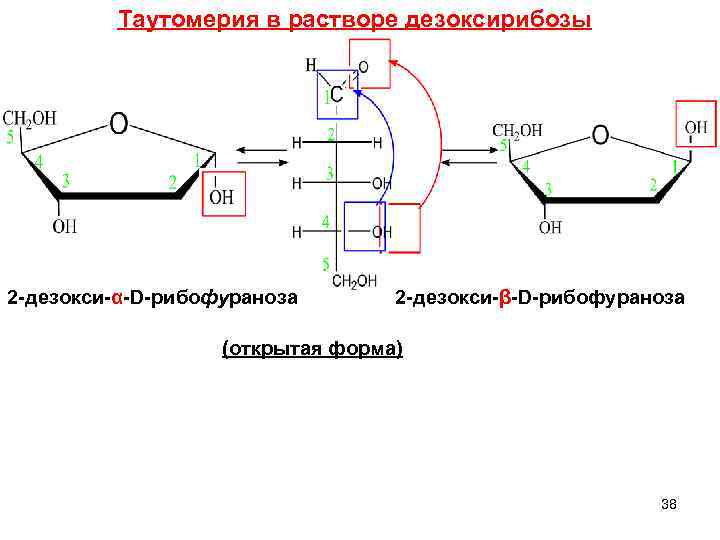
Таутомерия в растворе дезоксирибозы 2 -дезокси-α-D-рибофураноза 2 -дезокси-β-D-рибофураноза (открытая форма) 38
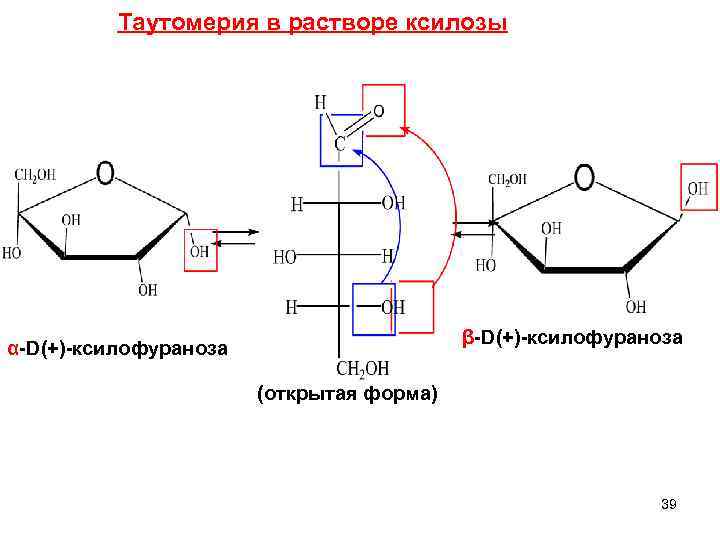
Таутомерия в растворе ксилозы β-D(+)-ксилофураноза α-D(+)-ксилофураноза (открытая форма) 39
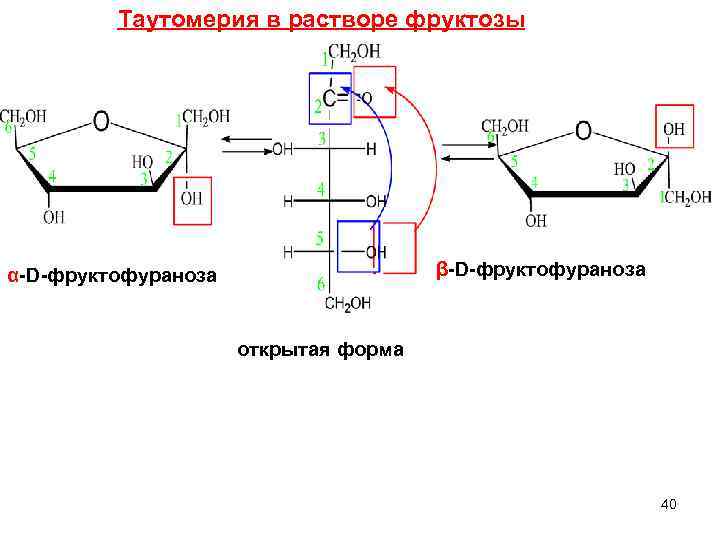
Таутомерия в растворе фруктозы α-D-фруктофураноза β-D-фруктофураноза открытая форма 40

Эпимеризация углеводов ЭПИМЕРИЗАЦИЯ - изменение конфигурации одного из хиральных центров молекулы на противоположную Эпимеры –диастереомеры, отличающиеся конфигурацией только одного асимметрического атома С. В организме эпимеризация происходит ферментативно, in vitro- в щелочной среде. В слабощелочном растворе D-глюкоза находится в равновесии с кетогексозой, D- фруктозой , и альдогексозой, D- маннозой Глюкоза и манноза различаются конфигурацией при С-2 Связана с открытой формой УВ. Причина – в кислотном характере Н при α. С атоме. Dфру Dглю Dман 41
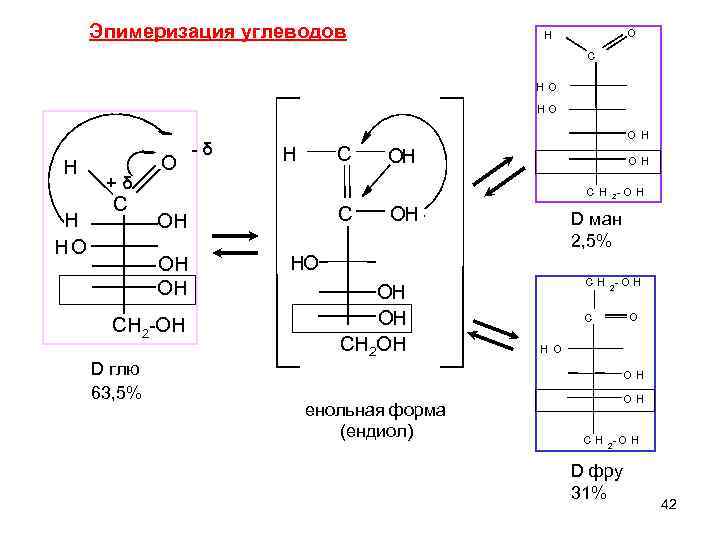
Эпимеризация углеводов H O C H O HO O H - δ H C OH H O O H + δ C H 2 -O H C OH H OH D ман HO 2, 5% OH HO C H 2 - O H OH CH 2 -OH C O CH 2 OH H O D глю OH 63, 5% OH енольная форма (ендиол) C H 2 - O H D фру 31% 42
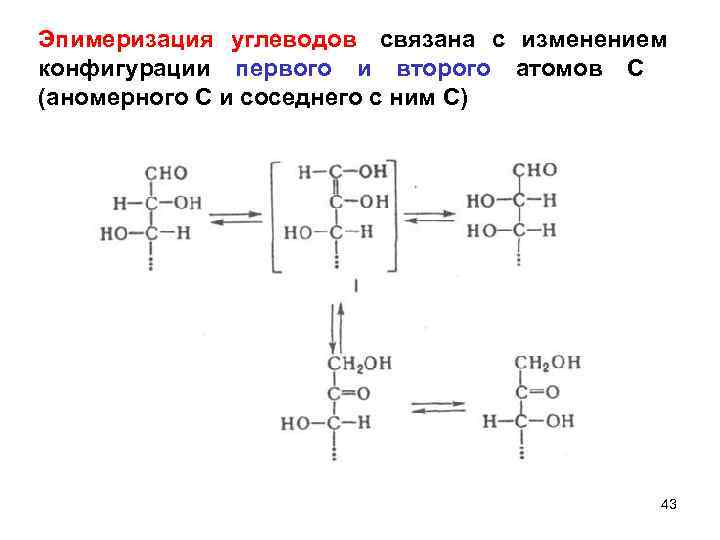
Эпимеризация углеводов связана с изменением конфигурации первого и второго атомов С (аномерного С и соседнего с ним С) 43

Химические свойства УВ Общие реакции для всех углеводордов Ø на ОН- спирт Ø на п/а ОН Ø на > C = O Ø ОВР Специфические реакции (различают пентозы и гексозы) Ø брожение Ø действ. кт. конц. Ø реакция Селиванова 44
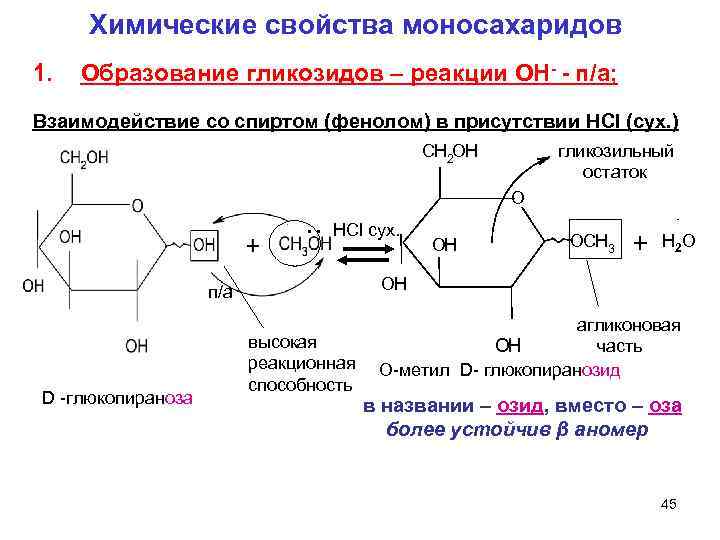
Химические свойства моносахаридов 1. Образование гликозидов – реакции ОН- - п/а; Взаимодействие со спиртом (фенолом) в присутствии HCl (сух. ) CH 2 OH гликозильный остаток O . . HCl сух. OH OCH 3 + Н 2 О п/а OH агликоновая высокая OH часть реакционная О-метил D- глюкопиранозид способность D -глюкопираноза в названии – озид, вместо – оза более устойчив β аномер 45
Особенности гликозидов 1) Легко гидролизуются в кислой среде, устойчивы в щелочной, при гидролизе образуются исходные продукты – мнсх + спирт, фенол. 2) Не могут иметь открытой формы, т. к. нет ОН п/а, а поэтому - не превращаются в другой аномер, следствием этого является отсутствие мутаротации. O- и N- Гликозиды Связь между агликоном и остатком монозы ( гликозидная связь) может осуществляться через атомы кислорода, азота и серы. В зависимости от этого различают O-, N-, S-гликозиды: 46
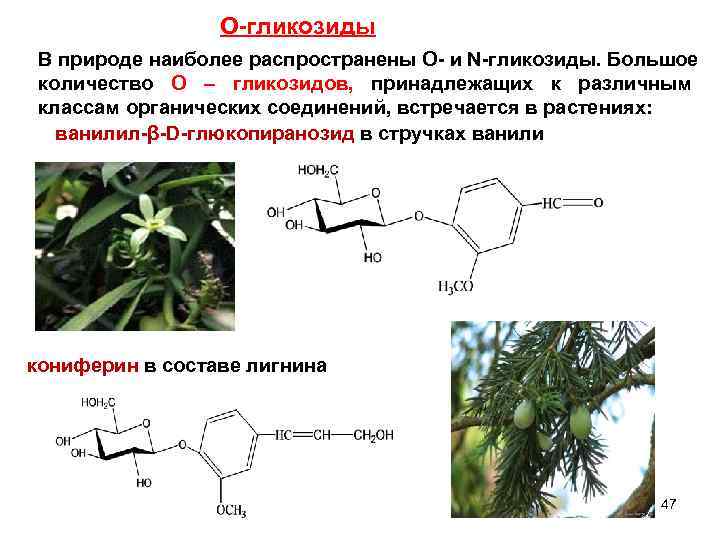
О-гликозиды В природе наиболее распространены O- и N-гликозиды. Большое количество О – гликозидов, принадлежащих к различным классам органических соединений, встречается в растениях: ванилил-β-D-глюкопиранозид в стручках ванили кониферин в составе лигнина 47
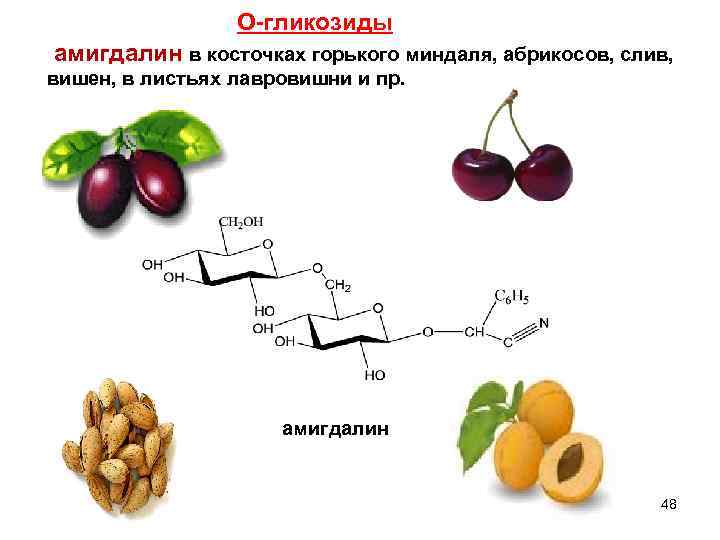
О-гликозиды амигдалин в косточках горького миндаля, абрикосов, слив, вишен, в листьях лавровишни и пр. амигдалин 48

О-гликозиды Витамины К, Р – это О - гликозиды , некоторые лекарственные препараты (стрептомицин), антибиотики, сердечные гликозиды, извлекаемые из ландыша наперстянки. 49
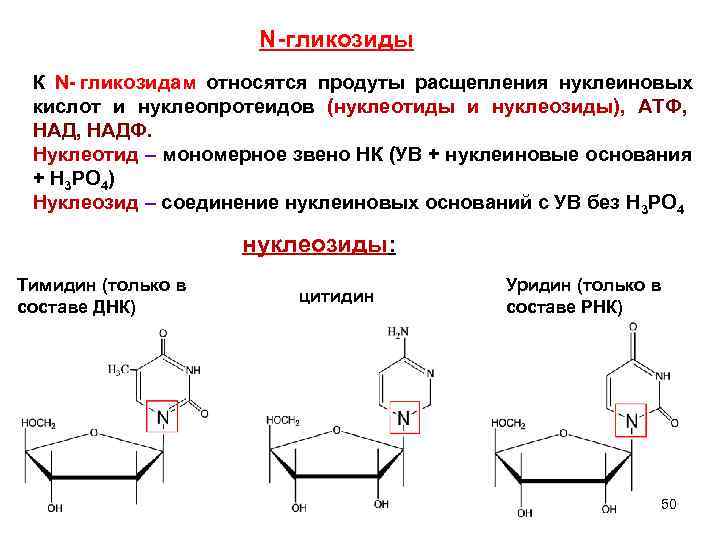
N-гликозиды К N- гликозидам относятся продуты расщепления нуклеиновых кислот и нуклеопротеидов (нуклеотиды и нуклеозиды), АТФ, НАД, НАДФ. Нуклеотид – мономерное звено НК (УВ + нуклеиновые основания + H 3 PO 4) Нуклеозид – соединение нуклеиновых оснований с УВ без H 3 PO 4 нуклеозиды: Тимидин (только в Уридин (только в цитидин составе ДНК) составе РНК) 50
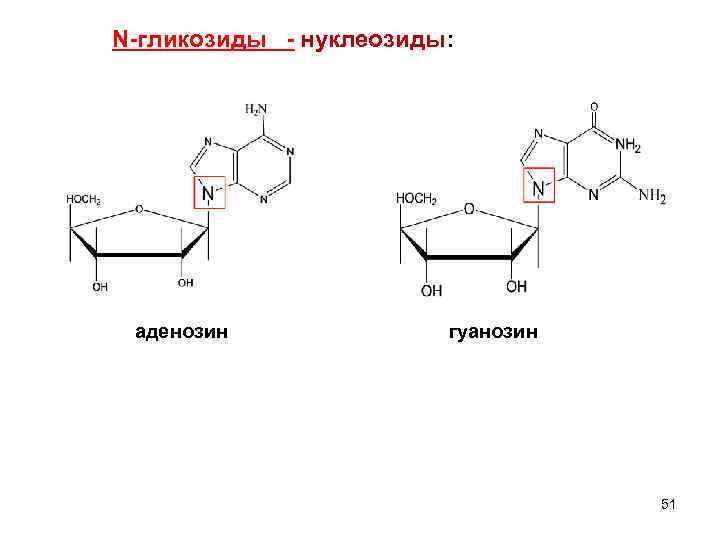
N-гликозиды - нуклеозиды: аденозин гуанозин 51
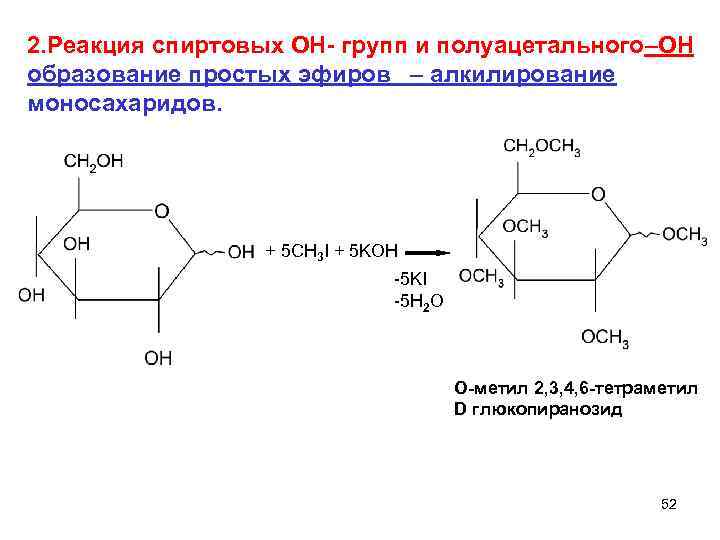
2. Реакция спиртовых ОН- групп и полуацетального–ОН образование простых эфиров – алкилирование моносахаридов. + 5 CH 3 I + 5 KOH -5 KI -5 H 2 O O-метил 2, 3, 4, 6 -тетраметил D глюкопиранозид 52
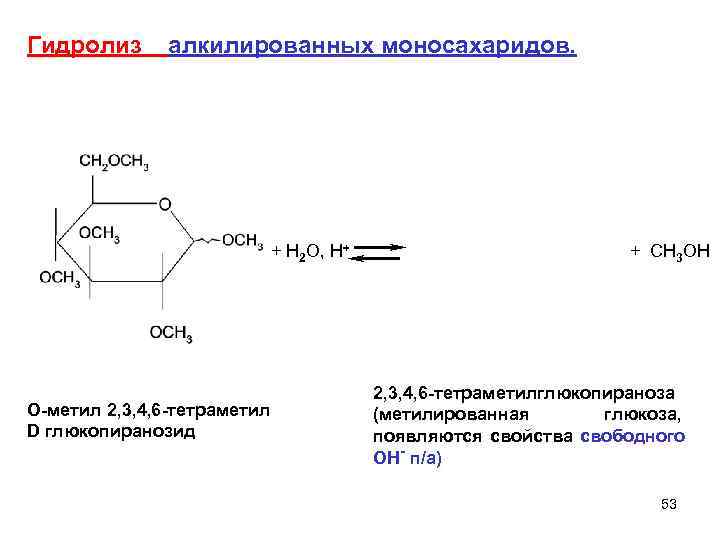
Гидролиз алкилированных моносахаридов. + H 2 O, H+ + CH 3 OH 2, 3, 4, 6 -тетраметилглюкопираноза O-метил 2, 3, 4, 6 -тетраметил (метилированная глюкоза, D глюкопиранозид появляются свойства свободного ОН- п/а) 53

3 . Образование сложных эфиров – реакции этерификации или ацилирования моносахаридов. Введение RCO может происходить при помощи RCOCI, (RCO)2 О, RCOOH. Обычно используют ангидриды карбоновых кислот, образуются сложные эфиры H+ + 5 (CH 3 CO)2 O CH 3 CO Ac -5 CH 3 COOH D гал 1, 2, 3, 4, 6 -пентаацетил D галактопираноза (сложный эфир) 54
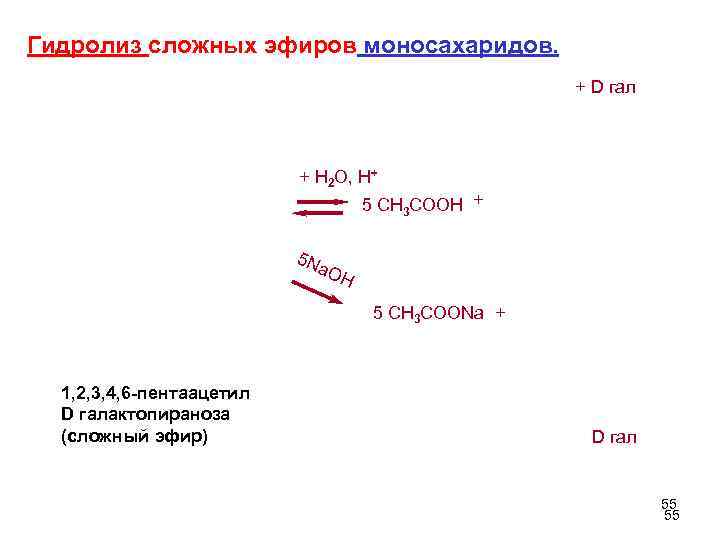
Гидролиз сложных эфиров моносахаридов. + D гал + H 2 O, H+ 5 CH 3 COOH + 5 N a. O H 5 CH 3 COONa + 1, 2, 3, 4, 6 -пентаацетил D галактопираноза (сложный эфир) D гал 55

3. Образование сложных эфиров- фосфатов Большое значение имеют эфиры H 3 PO 4 – фосфаты. Это - наиболее метаболически активные формы моносахаридов , содержатся во всех растительных и животных организмах. Фосфаты D глюкозы и D фруктозы). Фосфаты содержатся во всех растительных и животных организмах 56
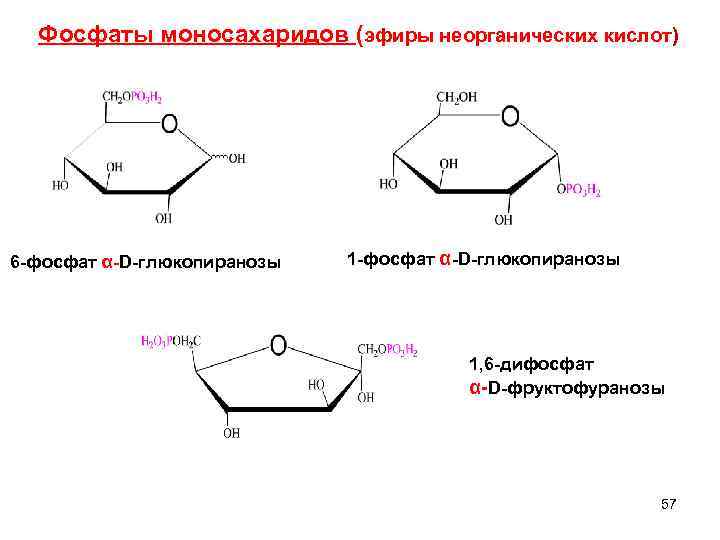
Фосфаты моносахаридов (эфиры неорганических кислот) 6 -фосфат α-D-глюкопиранозы 1 -фосфат α-D-глюкопиранозы 1, 6 -дифосфат α-D-фруктофуранозы 57
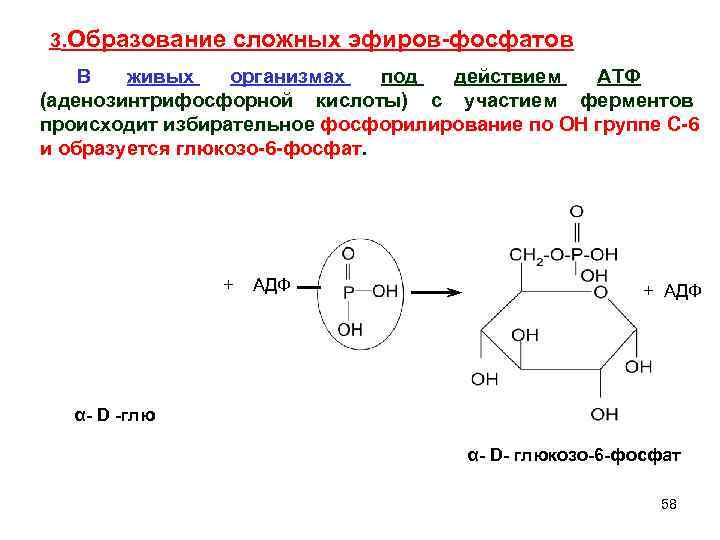
3. Образование сложных эфиров-фосфатов В живых организмах под действием АТФ (аденозинтрифосфорной кислоты) с участием ферментов происходит избирательное фосфорилирование по ОН группе С-6 и образуется глюкозо-6 -фосфат. + АДФ + АДФ α- D -глю α- D- глюкозо-6 -фосфат 58
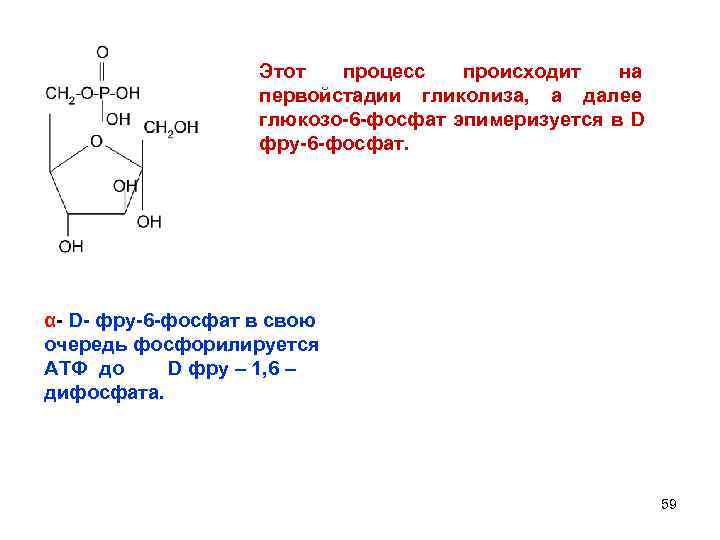
Этот процесс происходит на первойстадии гликолиза, а далее глюкозо-6 -фосфат эпимеризуется в D фру-6 -фосфат. α- D- фру-6 -фосфат в свою очередь фосфорилируется АТФ до D фру – 1, 6 – дифосфата. 59
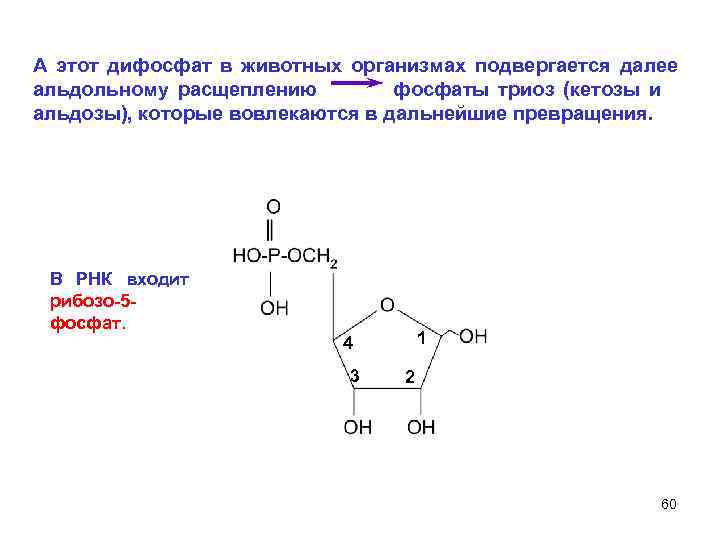
А этот дифосфат в животных организмах подвергается далее альдольному расщеплению фосфаты триоз (кетозы и альдозы), которые вовлекаются в дальнейшие превращения. В РНК входит рибозо-5 - фосфат. 4 1 3 2 60

Кроме того, Фруктоза-1, 6 -дифосфат, фруктозо-6 -фосфат Øпромежуточные соединения в темновой фазе фотосинтеза (цикл Кельвина), Øучастники спиртового брожения и Ø биосинтеза углеводов. 61
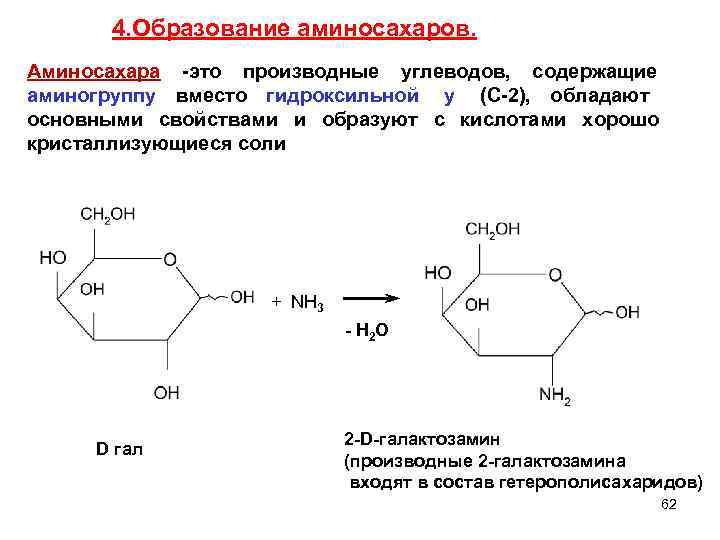
4. Образование аминосахаров. Аминосахара -это производные углеводов, содержащие аминогруппу вместо гидроксильной у (С-2), обладают основными свойствами и образуют с кислотами хорошо кристаллизующиеся соли + NH 3 - Н 2 О 2 -D-галактозамин D гал (производные 2 -галактозамина входят в состав гетерополисахаридов) 62
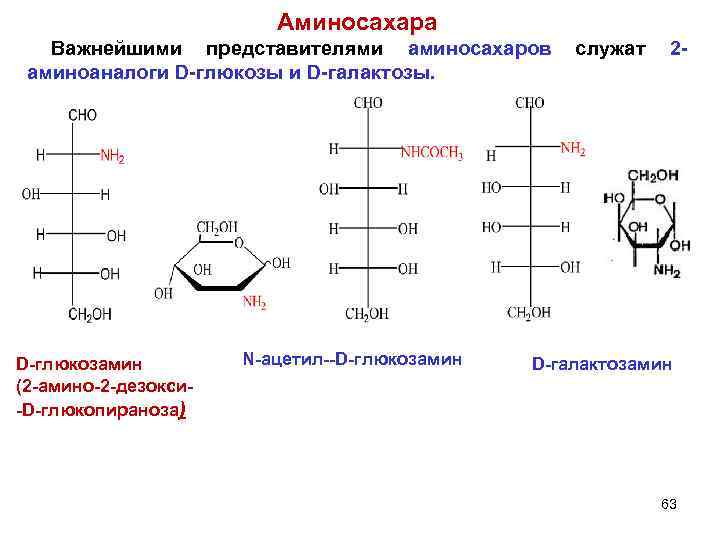
Аминосахара Важнейшими представителями аминосахаров служат 2 - аминоаналоги D-глюкозы и D-галактозы. D-глюкозамин N-ацетил--D-глюкозамин D-галактозамин (2 -амино-2 -дезокси- -D-глюкопираноза) 63
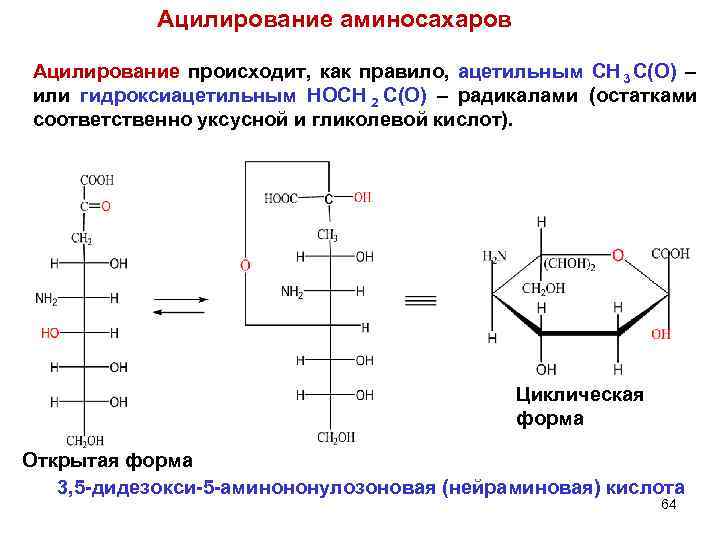
Ацилирование аминосахаров Ацилирование происходит, как правило, ацетильным CH 3 C(O) – или гидроксиацетильным HOCH 2 C(O) – радикалами (остатками соответственно уксусной и гликолевой кислот). Циклическая форма Открытая форма 3, 5 -дидезокси-5 -аминононулозоновая (нейраминовая) кислота 64
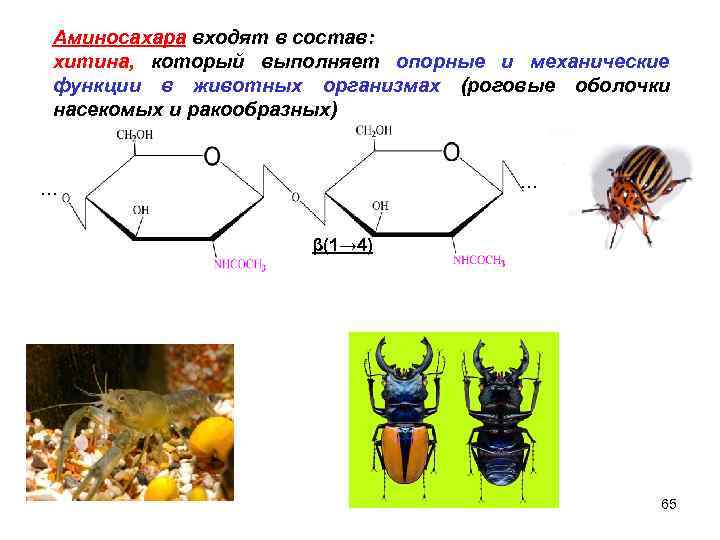
Аминосахара входят в состав: хитина, который выполняет опорные и механические функции в животных организмах (роговые оболочки насекомых и ракообразных) … β(1→ 4) 65
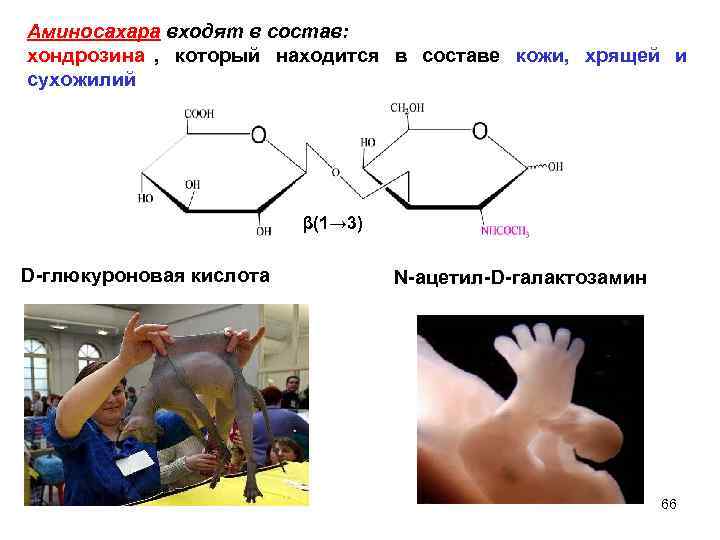
Аминосахара входят в состав: хондрозина , который находится в составе кожи, хрящей и сухожилий β(1→ 3) D-глюкуроновая кислота N-ацетил-D-галактозамин 66
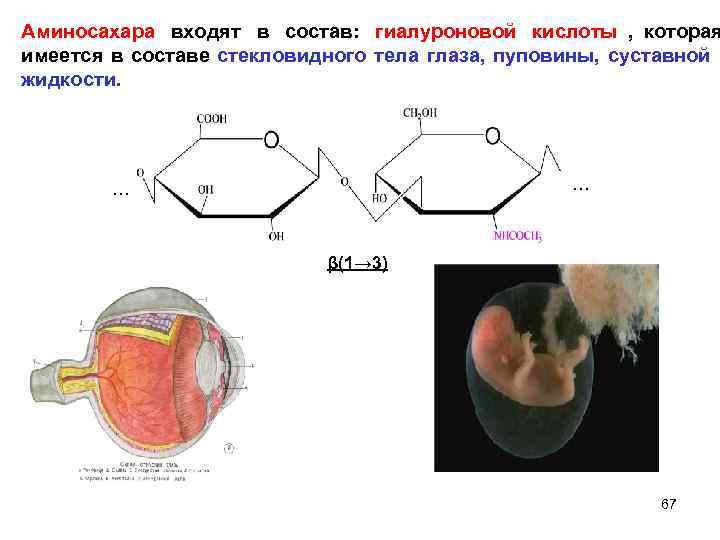
Аминосахара входят в состав: гиалуроновой кислоты , которая имеется в составе стекловидного тела глаза, пуповины, суставной жидкости. … β(1→ 3) 67
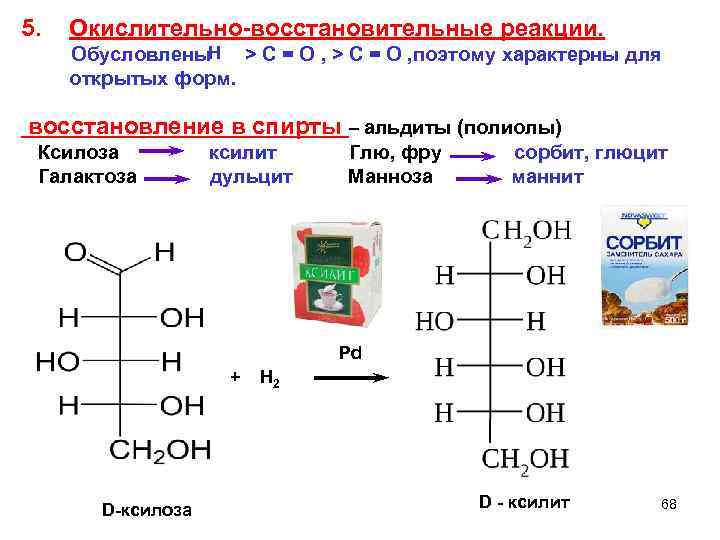
5. Окислительно-восстановительные реакции. Н Обусловлены > C = O , поэтому характерны для открытых форм. восстановление в спирты – альдиты (полиолы) Ксилоза ксилит Глю, фру сорбит, глюцит Галактоза дульцит Манноза маннит Pd + Н 2 D-ксилоза D - ксилит 68
Окисление моносахаридов Реакции окисления используют в структурных исследованиях и биохимических анализах для обнаружения моносахаридов, в частности глюкозы, в биологических жидкостях (моча , кровь). В зависимости от условий окисления образуются различные продукты. 69
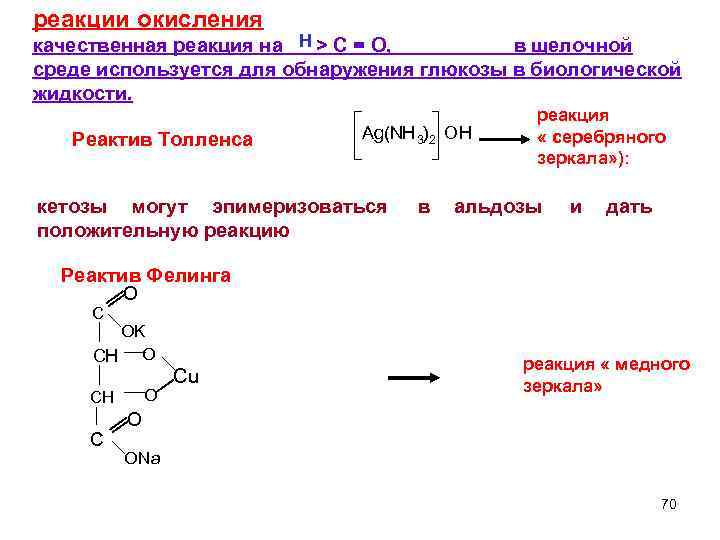
реакции окисления Н качественная реакция на > C = O, в щелочной среде используется для обнаружения глюкозы в биологической жидкости. реакция Ag(NH 3) 2 OH « серебряного Реактив Толленса зеркала» ): кетозы могут эпимеризоваться в альдозы и дать положительную реакцию Реактив Фелинга O C OK CH O реакция « медного Cu зеркала» CH O O C ONa 70

Окисление в щелочной среде (качественная реакция на альдозу) реактивом Толленса (реакция « серебряного зеркала» ): Ag(NH 3)2 OH Продукты окисления (глюконовая кислота) D-Глюкоза 71
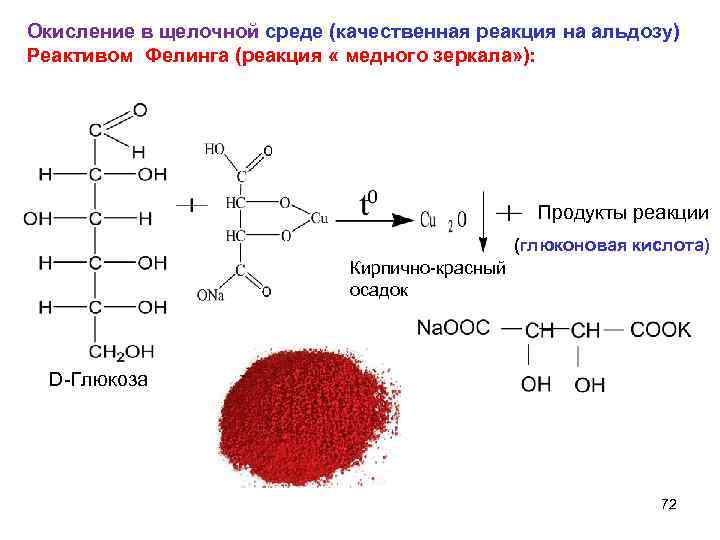
Окисление в щелочной среде (качественная реакция на альдозу) Реактивом Фелинга (реакция « медного зеркала» ): Продукты реакции (глюконовая кислота) Кирпично-красный осадок D-Глюкоза 72
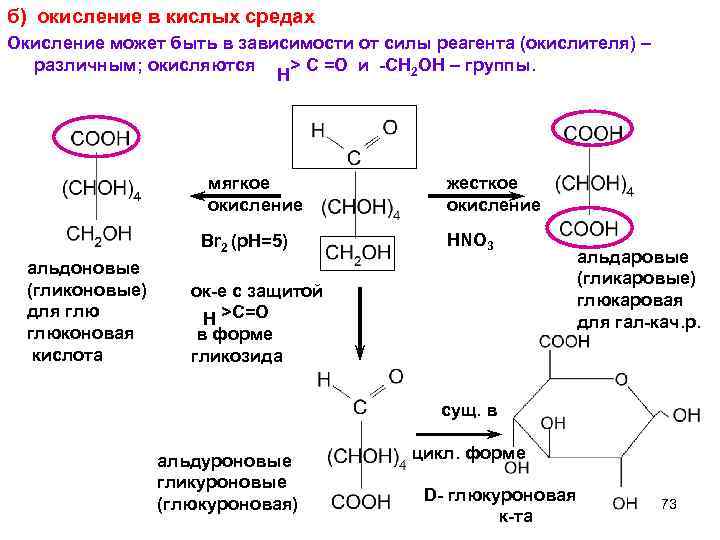
б) окисление в кислых средах Окисление может быть в зависимости от силы реагента (окислителя) – различным; окисляются > C =O и -СН 2 ОН – группы. Н мягкое жесткое окисление Br 2 (p. H=5) HNO 3 альдаровые альдоновые (гликаровые) (гликоновые) ок-е с защитой глюкаровая для глю >C=O Н для гал-кач. р. глюконовая в форме кислота гликозида сущ. в альдуроновые цикл. форме гликуроновые D- глюкуроновая (глюкуроновая) 73 к-та
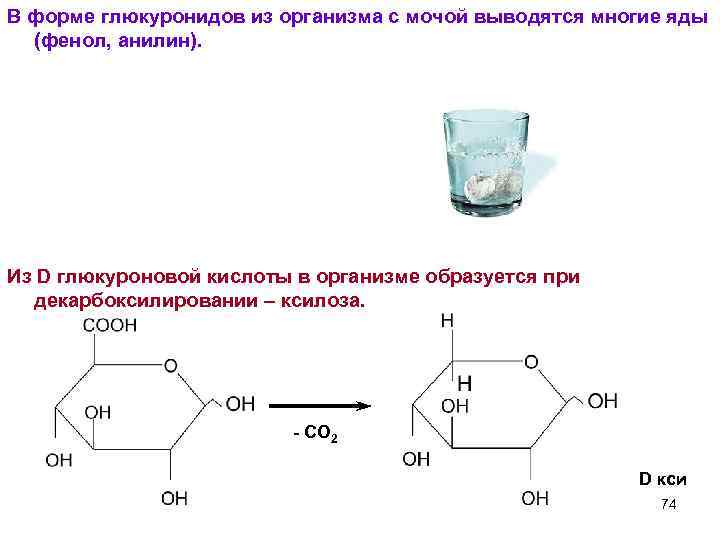
В форме глюкуронидов из организма с мочой выводятся многие яды (фенол, анилин). Из D глюкуроновой кислоты в организме образуется при декарбоксилировании – ксилоза. - СО 2 D кси 74
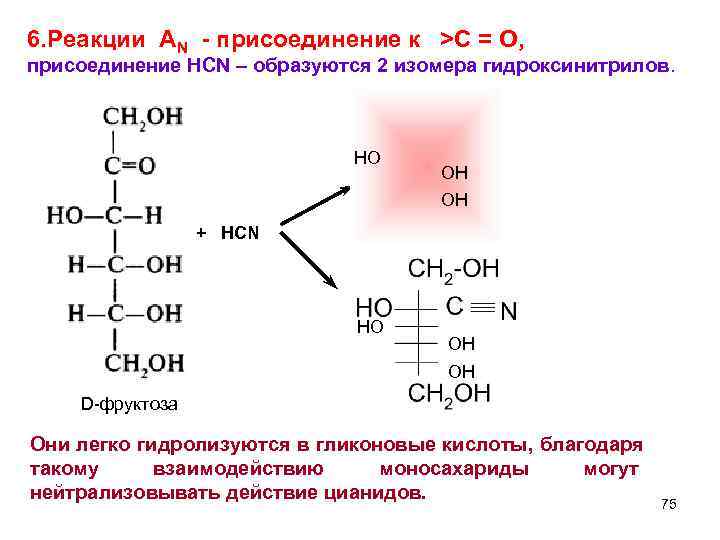
6. Реакции AN - присоединение к >C = O, присоединение HCN – образуются 2 изомера гидроксинитрилов. HO OH + HCN HO OH D-фруктоза Они легко гидролизуются в гликоновые кислоты, благодаря такому взаимодействию моносахариды могут нейтрализовывать действие цианидов. 75

7. Качественные реакции на Н > C = O (альдегидную группу) Ø образование озазонов при действии С 6 H 5 NH – NH 2 на > C = O Озазоны — окрашенные в желтый или оранжевый цвет кристаллы, хорошо кристаллизуются и имеют четкие температуры плавления 76
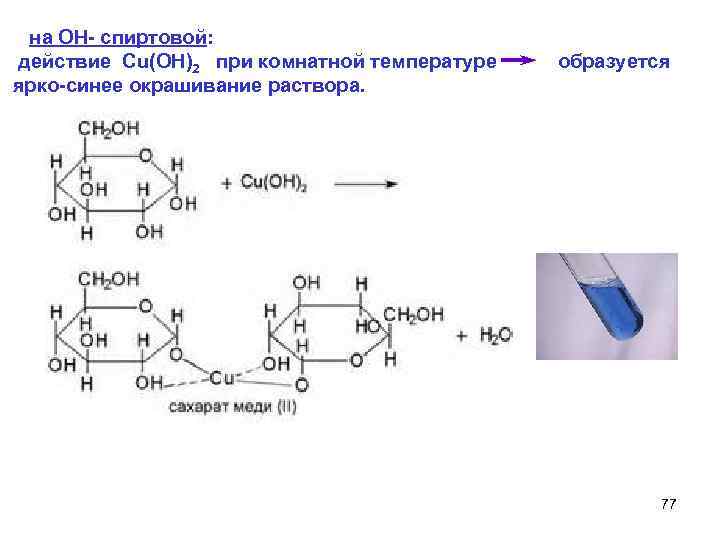
на ОН- спиртовой: действие Cu(OH)2 при комнатной температуре образуется ярко-синее окрашивание раствора. 77
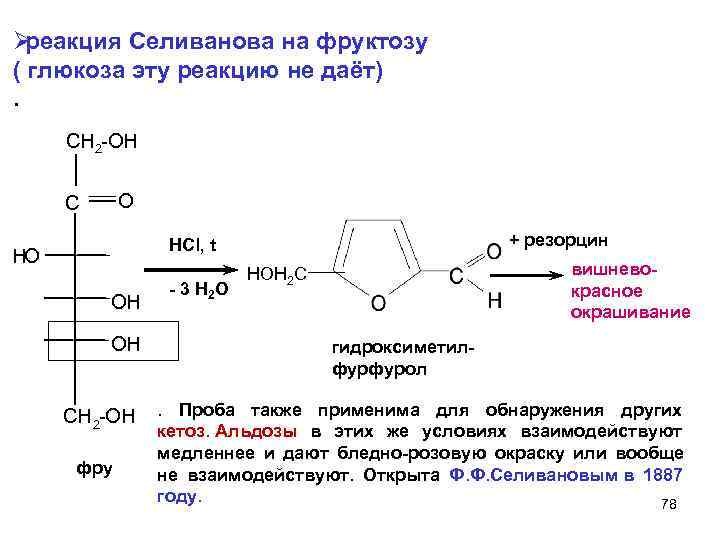
Ø реакция Селиванова на фруктозу ( глюкоза эту реакцию не даёт). CH 2 -OН C O HCl, t + резорцин HO HOH 2 C вишнево- - 3 H 2 O красное OH окрашивание OH гидроксиметил- фурфурол CH 2 -OH . Проба также применима для обнаружения других кетоз. Альдозы в этих же условиях взаимодействуют медленнее и дают бледно-розовую окраску или вообще фру не взаимодействуют. Открыта Ф. Ф. Селивановым в 1887 году. 78

Дисахариды 79
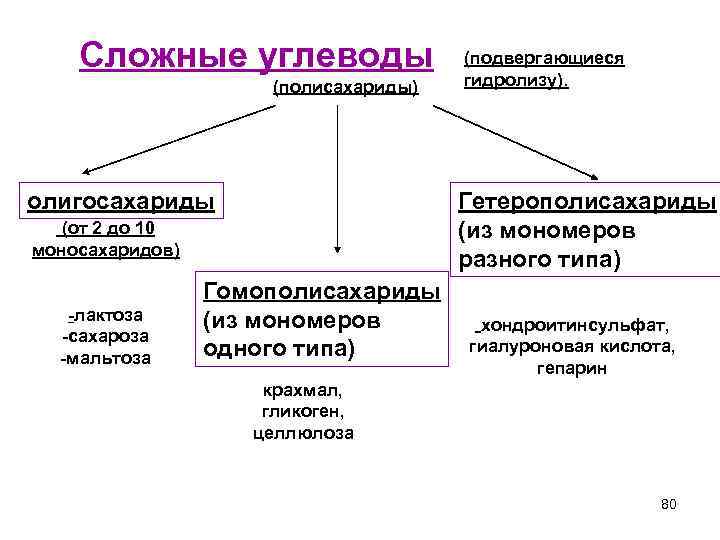
Сложные углеводы (подвергающиеся (полисахариды) гидролизу). олигосахариды Гетерополисахариды (от 2 до 10 (из мономеров моносахаридов) разного типа) Гомополисахариды -лактоза (из мономеров хондроитинсульфат, -сахароза -мальтоза одного типа) гиалуроновая кислота, гепарин крахмал, гликоген, целлюлоза 80
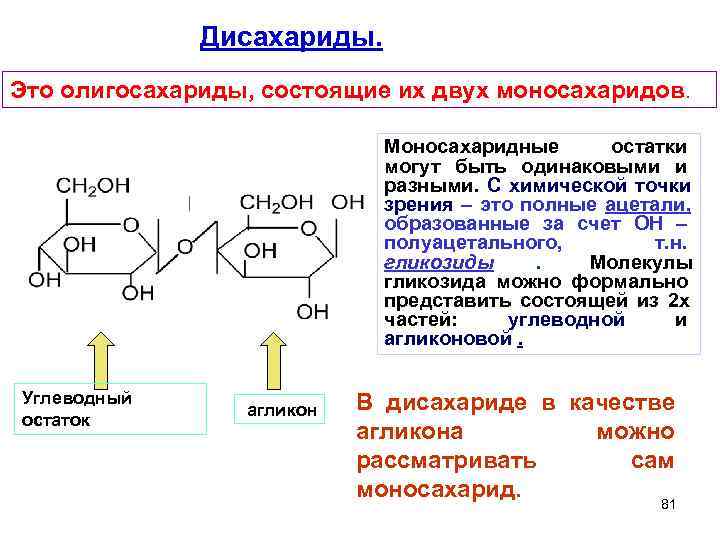
Дисахариды. Это олигосахариды, состоящие их двух моносахаридов. Моносахаридные остатки могут быть одинаковыми и разными. С химической точки зрения – это полные ацетали, образованные за счет ОН – полуацетального, т. н. гликозиды . Молекулы гликозида можно формально представить состоящей из 2 х частей: углеводной и агликоновой. Углеводный В дисахариде в качестве агликон остаток агликона можно рассматривать сам моносахарид. 81
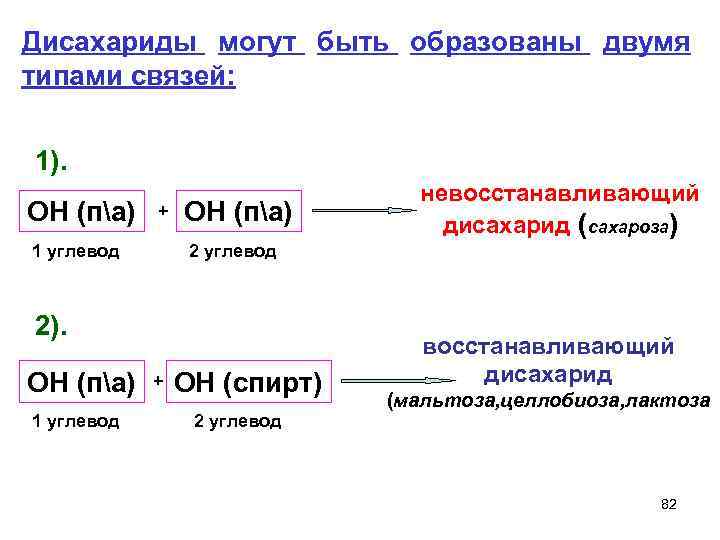
Дисахариды могут быть образованы двумя типами связей: 1). невосстанавливающий ОН (па) + ОН (па) дисахарид (сахароза) 1 углевод 2 углевод 2). восстанавливающий ОН (па) + ОН (спирт) дисахарид (мальтоза, целлобиоза, лактоза 1 углевод 2 углевод 82
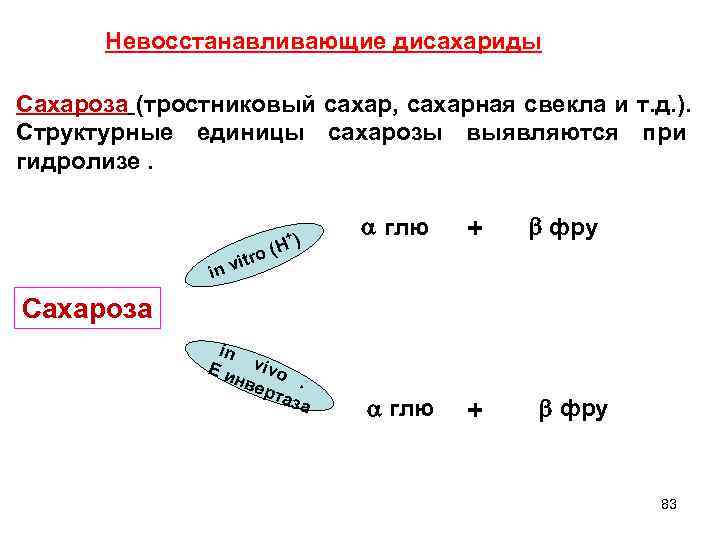
Невосстанавливающие дисахариды Сахароза (тростниковый сахар, сахарная свекла и т. д. ). Структурные единицы сахарозы выявляются при гидролизе. +) глю + фру ro (H in vit Сахароза in E vivo инв ерт . аза глю + фру 83
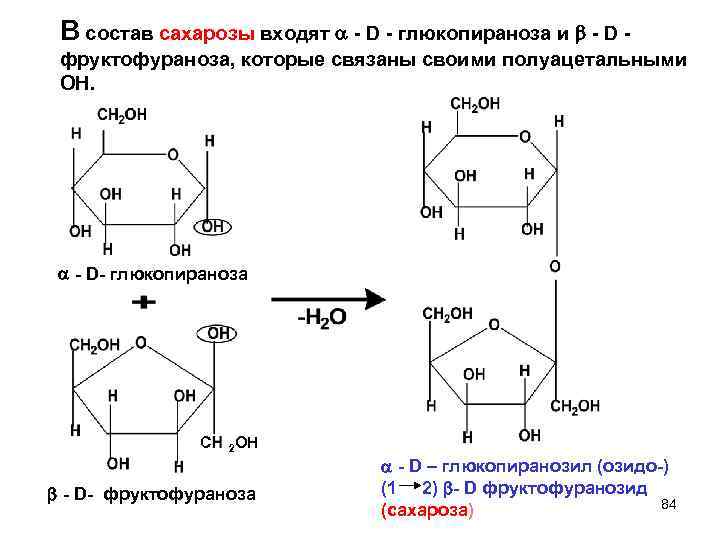
В состав сахарозы входят - D - глюкопираноза и - D - фруктофураноза, которые связаны своими полуацетальными ОН. - D- глюкопираноза С 2 ОН - D – глюкопиранозил (озидо-) - D- фруктофураноза (1 2) - D фруктофуранозид (сахароза) 84

В названии невосстанавливающих дисахаридов отражено отсутствие полуацетальных ОН, суффикс оза заменен на озил (или озидо) для I углевода и озид для II. Сахароза – это озидо – озид. Правомерны оба названия: - D - фруктофуранозил - (2 1) - - D - глюкопиранозид. - D - глюкопиранозил - (1 2) - - D – фруктофуранозид. 85

Свойства сахарозы. В невосстанавливающем дисахариде нет свободного ОН – полуацетального, поэтому свойства, связанные с ним, отсутствуют: 1). Мутаротация 2). Восстанавливающие способности. Не реагирует с реактивом Толленса (Ag (NH 3)2 OH) с реактивом Фелинга, так как нет открытой формы, содержащей альдегидной группы 3). Отсутствуют реакции AN, например с HCN, с фенилгидразином C 6 Н 5 -NH-NH 2. 86
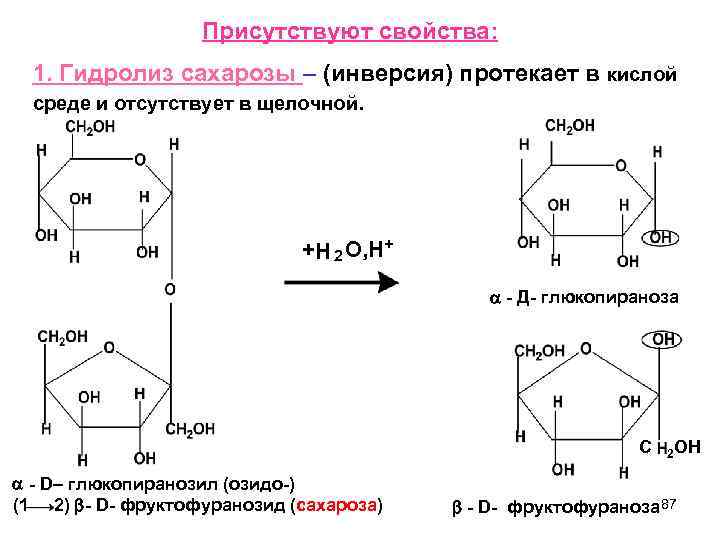
Присутствуют свойства: 1. Гидролиз сахарозы – (инверсия) протекает в кислой среде и отсутствует в щелочной. +H 2 O, H+ - Д- глюкопираноза С 2 ОН - D– глюкопиранозил (озидо-) (1 2) - D- фруктофуранозид (сахароза) - D- фруктофураноза 87

При гидролизе сахарозы в кислой среде образуются исходные моносахариды. Гидролиз сахарозы идет очень легко, даже в присутствии слабых кислот. Ход гидролиза можно проследить с помощью поляриметра, измеряя 20 (удельное вращение). Автоматический поляриметр Раствор сахарозы правовращающий (+), а при гидролизе образуется -D- глю (+) и -D- фру (-) – левовращающая. В результате будет преобладать левое вращение. 88

Поэтому процесс гидролиза иногда называется инверсией, а смесь образующихся глю фру – и инвертным сахаром. 89
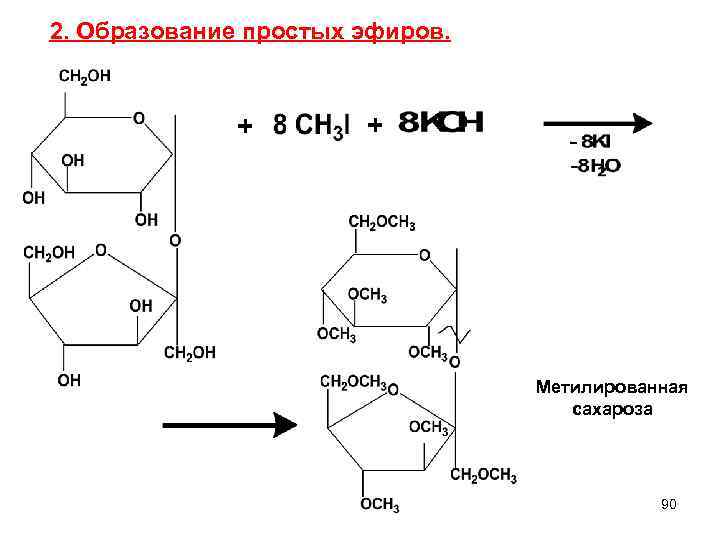
2. Образование простых эфиров. + Метилированная сахароза 90
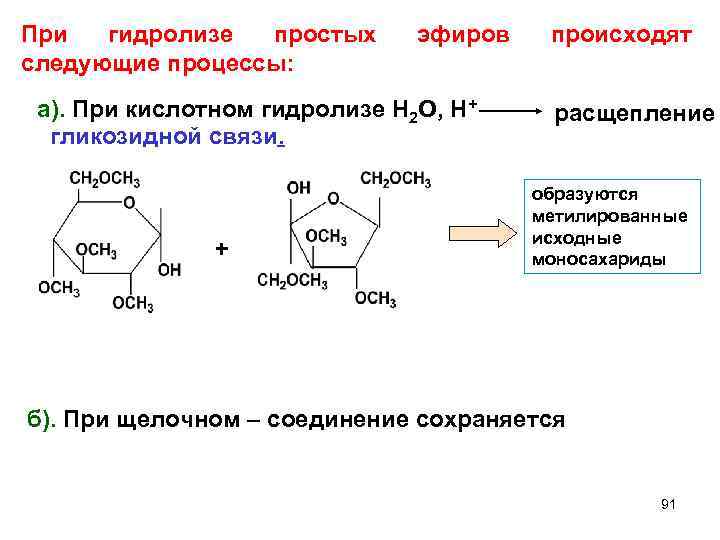
При гидролизе простых эфиров происходят следующие процессы: а). При кислотном гидролизе Н 2 О, Н+ расщепление гликозидной связи. образуются метилированные исходные + моносахариды б). При щелочном – соединение сохраняется 91
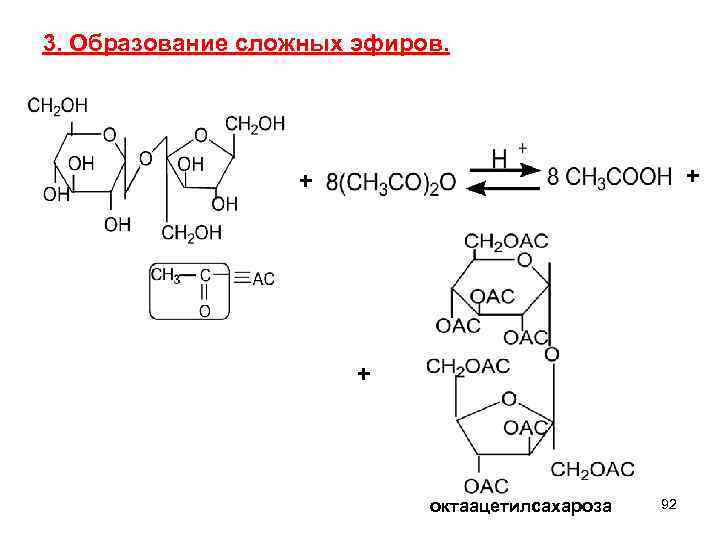
3. Образование сложных эфиров. + октaацетилсахароза 92
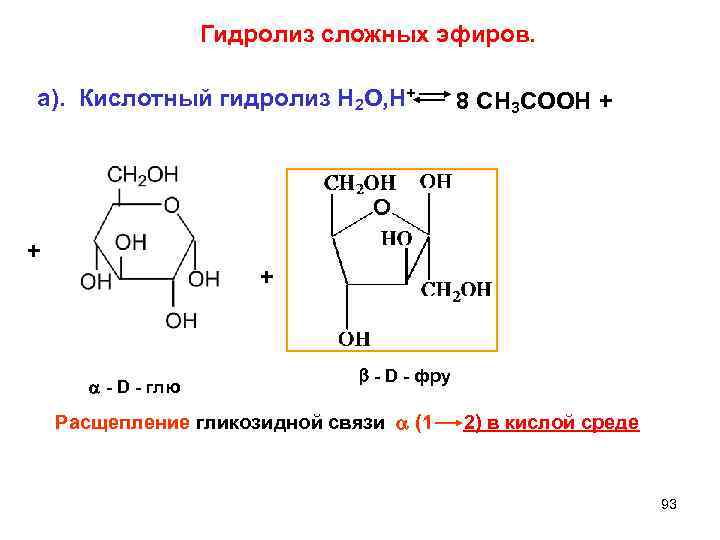
Гидролиз сложных эфиров. а). Кислотный гидролиз Н 2 О, Н+ 8 СН 3 СООН + + - D - фру - D - глю Расщепление гликозидной связи (1 2) в кислой среде 93
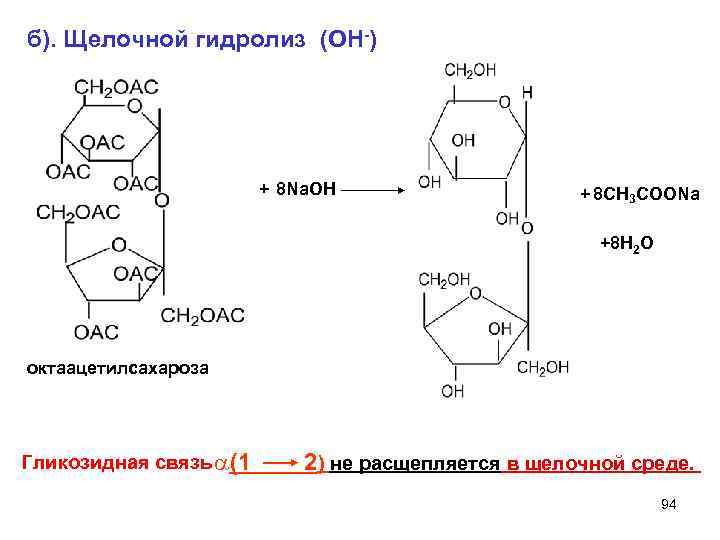
б). Щелочной гидролиз (ОН-) + 8 Na. ОН + 8 СН 3 СООNa +8 H 2 O октaацетилсахароза Гликозидная связь a(1 2) не расщепляется в щелочной среде. 94
![4. Жесткое окисление [O] трикарбоновая кислота – 3 СООН сахароза 95 4. Жесткое окисление [O] трикарбоновая кислота – 3 СООН сахароза 95](https://present5.com/presentation/3/-119053949_441447185.pdf-img/-119053949_441447185.pdf-95.jpg)
4. Жесткое окисление [O] трикарбоновая кислота – 3 СООН сахароза 95

Восстанавливающие дисахариды. образованы ОН(п/а) + ОН (спиртовой) 1 УВ 2 УВ -озил -оза 1). Лактоза. 2). Мальтоза. 3). Целлобиоза. Лактоза - молочный сахар. Образована - D- галактопиранозой и - ( ) - D - глюкопиранозой. 96
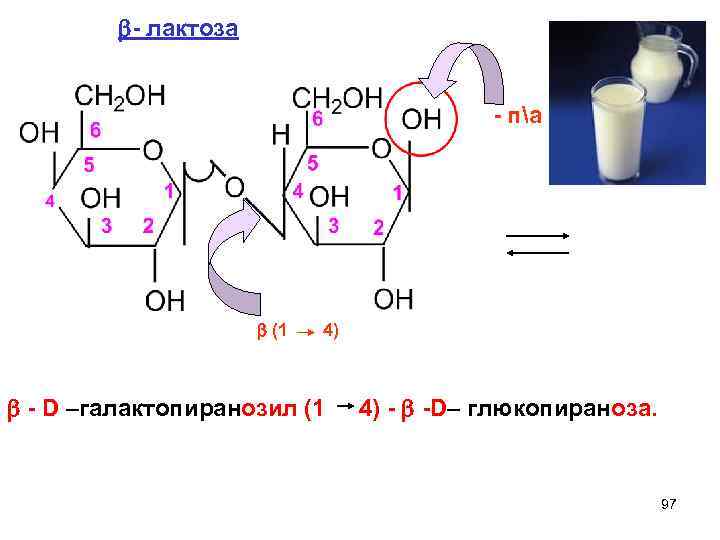
- лактоза - па (1 4) - D –галaктопиранозил (1 4) - -D– глюкопираноза. 97

- лактоза содержится в материнском молоке, является основным углеводом пищи для грудных детей; - лактоза ( - глю) – в коровьем. 98
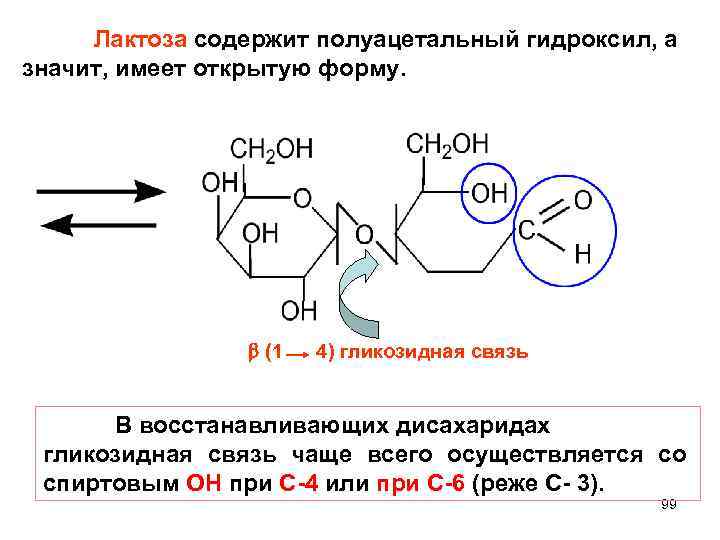
Лактоза содержит полуацетальный гидроксил, а значит, имеет открытую форму. (1 4) гликозидная связь В восстанавливающих дисахаридах гликозидная связь чаще всего осуществляется со спиртовым ОН при С-4 или при С-6 (реже C- 3). 99
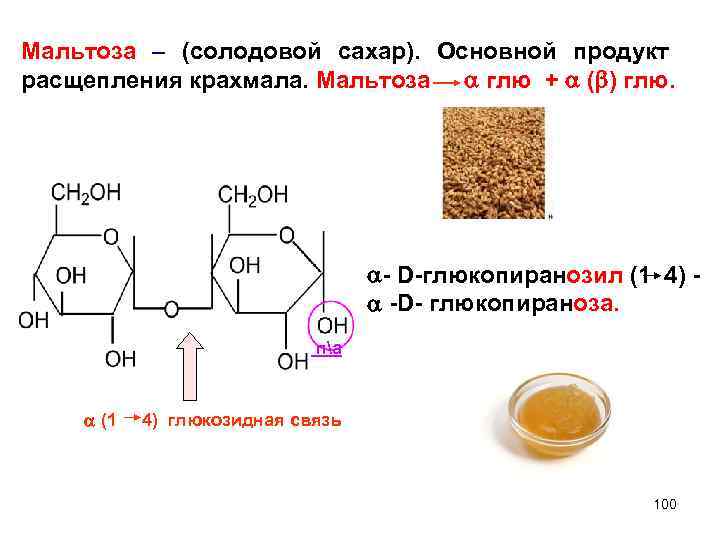
Мальтоза – (солодовой сахар). Основной продукт расщепления крахмала. Мальтоза глю + ( ) глю. - D-глюкопиранозил (1 4) - -D- глюкопираноза. па (1 4) глюкозидная связь 100
Органика, 6-1 лекция.ppt