lect_org_3 (1).ppt
- Количество слайдов: 80

Кафедра общей и медицинской химии Лекция 3 Биологически важные реакции карбонильных соединений. Масс-спектрометрия.
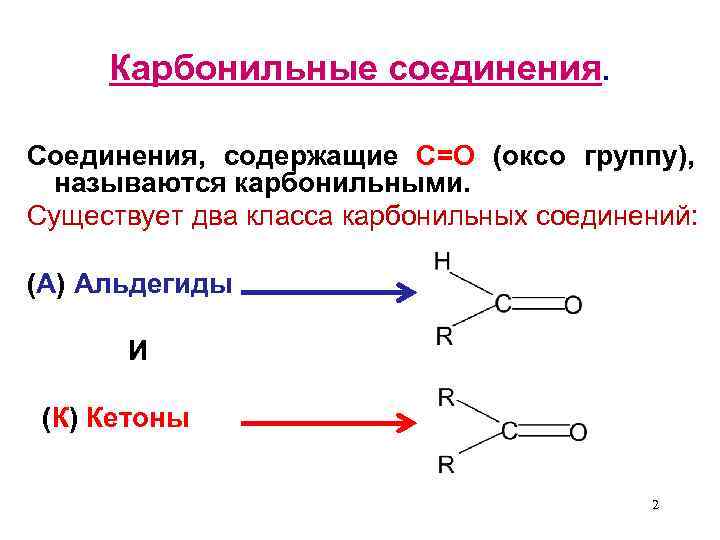
Карбонильные соединения. Соединения, содержащие С=О (оксо группу), называются карбонильными. Существует два класса карбонильных соединений: (А) Альдегиды И (К) Кетоны 2

3

I. Классификация и номенклатура альдегидов (А) По природе R : 1) предельные (Cn. H 2 n. O) Систематическая заместительная номенклатура ИЮПАК: название УВ + АЛЬ метан. АЛЬ Тривиальная номенклатура формальдегид муравьиный альдегид. - этан. АЛЬ - ацетальдегид, уксусный А. - пропан. АЛЬ - пропионовый альдегид - метилуксусный альдегид 4
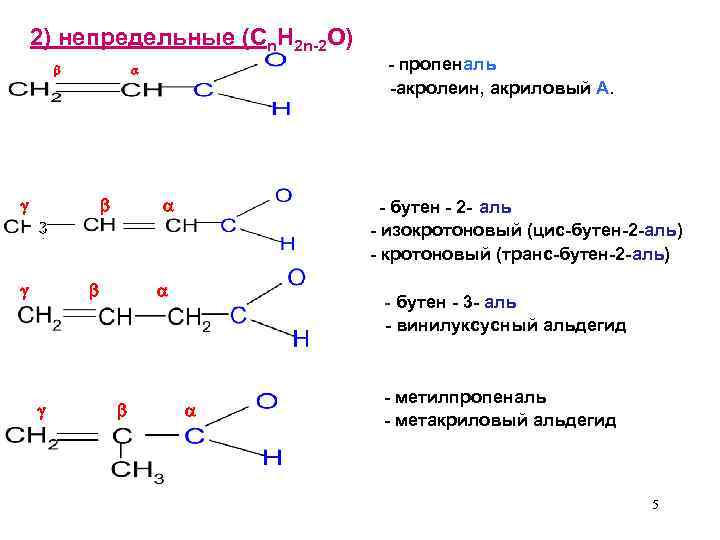
2) непредельные (Cn. H 2 n-2 O) - бутен - 2 - аль - изокротоновый (цис-бутен-2 -аль) - кротоновый (транс-бутен-2 -аль) 3 - пропеналь -акролеин, акриловый А. - бутен - 3 - аль - винилуксусный альдегид - метилпропеналь - метакриловый альдегид 5

3)Ароматические А бензальдегид 4) Алициклические А Циклопентанкарбальдегид 6

7

Кетоны (представители, номенклатура) 1) Алифатические Систематическая заместительная номенклатура (ИЮПАК) Название УВ + ОН пропанон Радикало-функциональная номенклатура - диметилкетон Тривиальная номенклатура -ацетон 2) Ароматические -дифенилкетон - бензофенон 8

3) Смешанные - метилфенилкетон - ацетофенон 4) Циклические - циклопентанон 9

II. Электронное строение и природа химической связи >C=O группы 1. Гибридизация атомных орбиталей С “С” в >C=O находится в sp 2 – гибридизации, 3 , 1 -связи, плоская геометрия. Благодаря такому электронному строению оксогруппы для карбонильных соединений возможны реакции присоединения А 10

2. Полярность и поляризуемость связи С–О 1) Из–за большой электроотрицательности атома О (ЭОо>ЭОс) связь сильно поляризована С О. 2) - связь легко поляризуется. 3) Образуется электрофильный центр на атоме С. 4) К электрофильному центру С происходит присоединение нулеофила. Для карбонильных соединений характерны реакции нуклеофильного присоединения ( АN) Nu - центр +δ >С -δ О >С О- Nu ε - центр Nu атака 11

3. Особые свойства Н при С атоме Водород при С атоме обладает кислотными свойствами (из-за –I эффекта СO-группы), которые он проявляет при соответствующих условиях. Кислотный характер H обуславливает протекание следующих реакций: 1) альдольной конденсации 2) кето – енольной таутомерии +δ 2 СН +δ 1 С -δ О Н Н 12

Для альдегидов и кетонов характерны следующие реакции: I. A N II. ОВР III. Реакции в R Схема реакции нуклеофильного замещения AN. sp 2 sp 3 13

Для увеличения заряда +δ на электрофильном центре С и облегчения протекания реакций АN используется кислотный катализатор. Cхема кислотного катализа. Многие реакции нуклеофильного замещения протекают в кислой среде. 14

Закономерности реакционной способности А и К в реакциях AN. 1) Альдегиды легче вступают в реакции AN, из-за большего положительного заряда ( + ) на С атоме (электрофильном центре) π-π сопряжение формальдегид ацетон ацетофенон, метилфенилкетон Наиболее реакционноспособное соединение - формальдегид 15

2) Введение ЭА заместителя увеличивает активность в реакциях нуклеофильного присоединения AN. +δ 2 хлораль этаналь 3) Большие заместители затрудняют доступ Nu к С+ (стерический фактор) 16

Химические свойства карбонильных соединений. I. Реакции AN 1) Присоединение HCN– образование - гидроксинитрилов (циангидринов) Вступают в реакцию альдегиды и кетоны – А, К. Реагент: - HCN (условие- следы КОН или KCN в Н+ среде) 2 - гидроксипропанонитрил 17
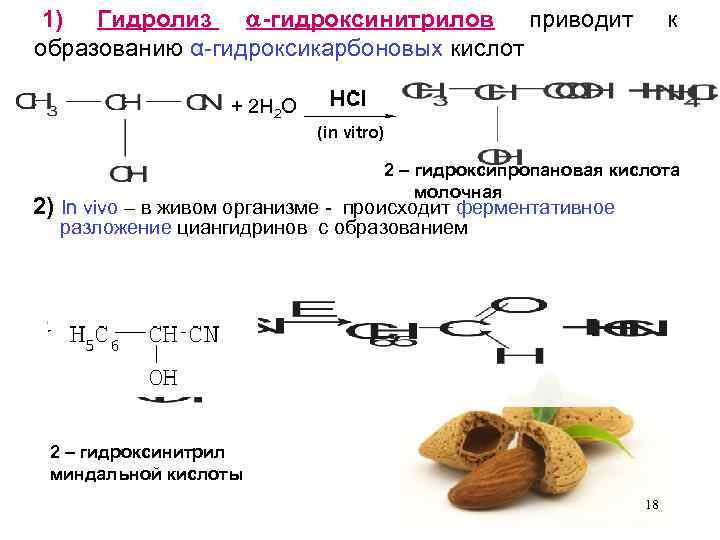
1) Гидролиз -гидроксинитрилов приводит образованию α-гидроксикарбоновых кислот к + 2 H 2 O 2 – гидроксипропановая кислота молочная 2) In vivo – в живом организме - происходит ферментативное разложение циангидринов с образованием 2 – гидроксинитрил миндальной кислоты 18

!Значение реакции присоединения HCN 1) Используется при синтезе аминов и карбоновых кислот (образуются соединения с большей длиной углеродной цепи) H RCN RCH 2 NH 2 восстановление RCN н 2 о гидролиз RCOOH 2) Применяется для получения - гидрокси- и - аминокислот. 19

2) Присоединение спиртов – образование полуацеталей и ацеталей ( реакции - в основном для А) а) реагент – ROH (CH 3 OH, С 2 H 5 OH и т. д. ) условие – HCl сухой – обратимость процесса HCl, сух АN полуацеталь этилового спирта и ацетальдегида диэтилацетальдегид 20

Роль катализатора в реакции AN - увеличение заряд + на С, в SN - создание хорошо уходящей группы Н 2 О. Механизм 21

Гидролиз ацеталей и полуацеталей происходит только в кислой среде –образуются исходные вещества -альдегид и спирт в щелочной среде- ацетали и полуацетали устойчивы) этаналь спирт 22

Присоединение многоатомного спирта – образуется циклический ацеталь: этиленгликоль циклический ацеталь этиленгликоля и ацетальдегида 23
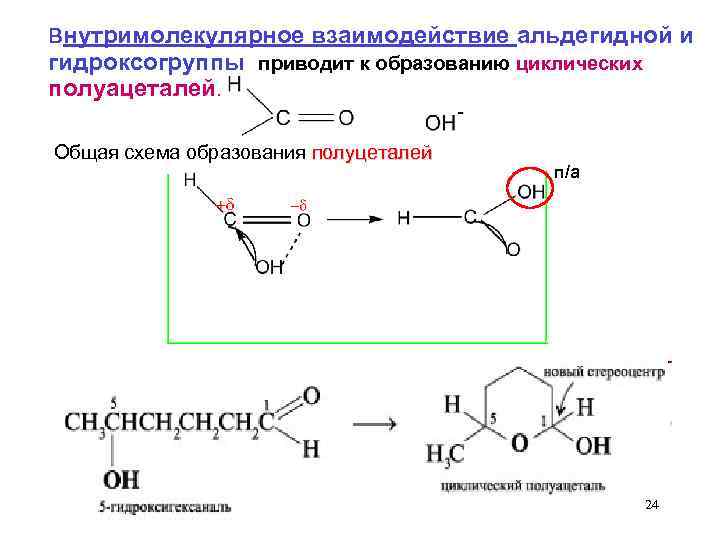
внутримолекулярное взаимодействие альдегидной и гидроксогруппы приводит к образованию циклических полуацеталей. Общая схема образования полуцеталей п/а 24

5 – гидроксипентаналь Пятичленный цикл -фуранозный - шестичленный цикл - пиранозный 25

Значение реакции ацетализации 1). Реакция лежит в основе получения природных полисахаридов (полиацеталей) – целлюлозы, крахмала и т. д. (гетерополисахаридов – хондроитинсульфатов). 26

Значение реакции ацетализации 2). Образование ацеталей происходит при выделении из организма чужеродного соединения – например фенола (может содержаться в составе лекарственных препаратов - парацетомола) глюкуроновой кислотой Фенилглюкуронид (ацеталь) 3). Используется в органическом синтезе для временной защиты альдегидной группы Кетоны - образуют кетали, реакция протекает хуже, затруднена. 27

3) Присоединение H- гидридов металлов (гидрид – ионов). В результате образуются спирты. Альдегиды восстанавливаются в первичные , а кетоны - во вторичные спирты. Реагенты: Na. Al. H 4 , Li. H гидролиз + Li+H- АN H 2 O, H+ - Li + пропанол -2 28

Восстановление в организме А и К • В организме восстановление(гидрирование) альдегидов и кетонов до спиртов осуществляется ферментативно под действием восстановленных форм коферментов (НАДН) или ФАД(2 Н). (никотинамидадениндинуклеотид) восстановленная форма 29

4) Взаимодействие с аминами и их производными (NH 2 X) - образуются имины- (основания Шиффа). Ø В реакцию вступают и альдегиды и кетоны, процесс протекает в два этапа: -нуклеофильное присоединение NH 2 X-первичных аминов или аммиака NH 3 -отщепление Н 2 О классифицируется как отщепления) реакция AN –E (присоединения- + C 2 H 5 NH 2 AN –E - H 2 O Рассматриваются 2 механизма этой реакции : 1) с Н+ катализатором; 2) через образование биполярного иона ю этилимин ацетона 30

Механизм через образование биполярного иона. . . + C 2 H 5 - NH 2 AN + биполярный ион E - H 2 O карбиноламин этилимин ацетальдегида 31

Ø Гидролиз: основания Шиффа и подобные соединения легко гидролизуются в кислой (Н+ ) среде: H+ + H 2 O + NH 2 – C 2 H 5 Образуются исходные вещества: карбонильное соединение и амин. 32

ØВзаимодействие альдегидов и кетонов с аммиаком. • Реакция осложняется циклизацией продуктов присоединения первоначальных метаналь Гексаметилентетрамин-уротропин 33

Уротропин - лекарственный препарат, дезинфецирующее средство, использующееся при воспалении мочевых путей (А. М. Бутлеров 1859 г). • Из уротропина в кислой среде (гидролиз) образуются формальдегид и аммиак. которые обладают антимикробными свойствами. • Особенно сильное антимикробное действие уротропин оказывает в кислой среде мочевыводящих путей почек. 34

Ø Роль иминов в биохимических процессах. § Имины -промежуточные соединения при получении аминов из альдегидов и кетонов восстановительным аминированием. • § В организме восстановительное аминирование осуществляется в ходе синтеза α-аминокислот 35

Процесс образования - аминокислот из - оксокислот называется переаминированием или трансаминированием. ü Он протекает через стадию получения иминов. ü В процессе трансаминирования участвует кофермент пиридоксальфосфат. 2 метил – 3 гидрокси, 5 гидрокси – пиридин – 4 карбальдегидфосфат Пиридоксальфосфат выполняет функцию переносчика аминогруппы т. е. временно хранит NH 2 -группу, являясь «камерой хранения» ) 36

Химические превращения α-аминокислот в организме с участием пиридоксальфосфата. пиридоксальфосфат α-аминокислота альдимин 37

ØАналитические реакции иминов • Используя производные NH 3 и аминов, можно выделить А и К из реакционной смеси и идентифицировать их по температурам плавления. • Оксимы - продукты реакции А и К с гидроксиламином NH 2 OH, механизм реакции AN - E 38

Примеры получения некоторых оксимов 39

• Гидразоны - продукты взаимодействия • NH 2 -NH 2 с альдегидами и кетонами. гидразина 40

• Фенилгидразоны - продукты взаимодействия А и К с фенилгидразином NH 2 -NH-C 6 H 5 41
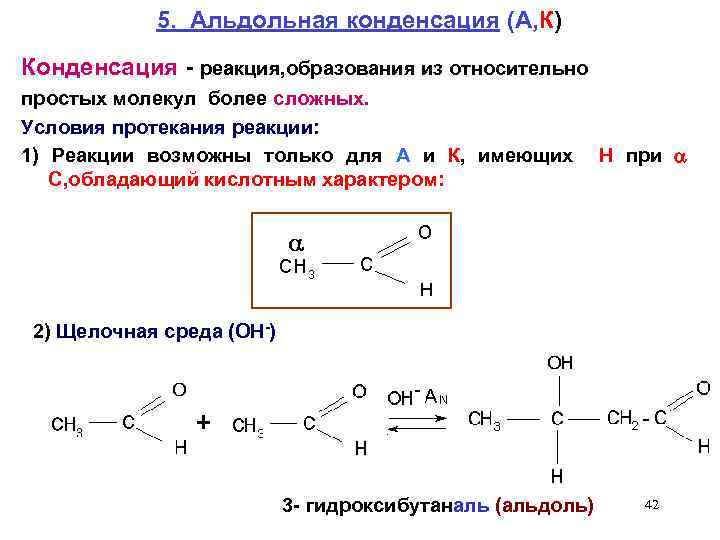
5. Альдольная конденсация (А, К) Конденсация - реакция, образования из относительно простых молекул более сложных. Условия протекания реакции: 1) Реакции возможны только для А и К, имеющих С, обладающий кислотным характером: Н при 2) Щелочная среда (ОН-) 3 - гидроксибутаналь (альдоль) 42

Механизм реакции альдольной конденсации AN а) Образование нуклеофильной частицы (Nu) из 1 -ой молекулы альдегида карбанион - Nu 43

б) Присоединение образовавшегося Nu ко второй молекуле карбонильного соединения – образование альдоля + H 2 O - OH - возврат катализатора 3 - гидроксибутаналь альдоль 44

Кротоновая конденсация Если реакцию конденсации проводить в более жестких условиях (при нагревании и в кислой среде), то альдоль дегидратируется с образованием кротонового альдегида trans бутен – 2 –аль, кротоновый альдегид 45

Значение реакции альдольной конденсации (присоединения). Реакции альдольного присоединения обратимы. В организме происходят два процесса: альдольная конденсация и альдольное расщепление. 1) В углеводном обмене, например, образуется нейраминовая кислота (С 9) из С 3 и С 6. ( в свободном состоянии содержится в спинномозговой жидкости). Ее производные - сиаловые кислоты: компоненты специфических веществ крови и тканей входят в состав ганглиозидов мозга, участвующих в проведении нервных импульсов 46

Образование нейраминовой кислоты-реакция альдольного присоединения 47
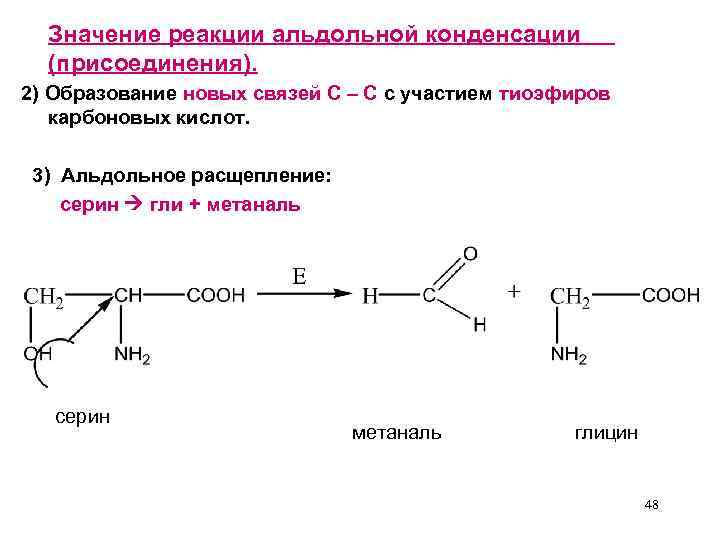
Значение реакции альдольной конденсации (присоединения). 2) Образование новых связей С – С с участием тиоэфиров карбоновых кислот. 3) Альдольное расщепление: серин гли + метаналь серин метаналь глицин 48

6. Присоединение Н 2 О - гидратация , Механизм реакции- AN Процесс гидратации - обратимый. Чем больше положительный заряд на атоме С, тем активнее присоединяется вода. Полностью гидратирован трихлоруксусный альдегид (-I эффект трех атомов CI приводит к образованию большого на С ), Ацетальдегид- гидратирован только наполовину, ацетон практически не образует гидратов. хлораль-гидрат 49

Хлоральгидрат применяется в медицине как успокаивающее и снотворное средство. В основе его фармакологического эффекта лежит наркотическое действие на организм альдегидной группы. 50

7. Взаимодействие с Na. HSO 3 - качественная реакция на >С=О группу. белый осадок 51

II. Кето-енольная таутомерия. Таутомерия - сосуществование в динамическом равновесии двух и более изомерных форм. Кето – енольная таутомериячастный случай прототропной Т. Между кетонной и енольной формой осуществляется перенос протона. Атом Н при α атоме С обладает слабыми кислотным характером Карбанион енолят- ион енол 52

III. Окисление альдегидов 1). Альдегиды легко окисляются до карбоновых кислот большинством окислителей KMn. O 4, K 2 Cr 2 O 7, и т. д. (даже кислородом воздуха). 53

2). Окисление альдегидов реактивом Толенса и реактивом Фелинга– качественная реакция на альдегидную группу. Ag Р-в Толленса + + + H 2 O реакция серебряного зеркала Cu 2 O + H 2 O + + Р-в Фелинга Щелочной раствор тартратного комплекса меди оранжевый цвет 54 реакция медного зеркала

3) Окислительно-восстановительная реакция альдегидов – реакция Канниццаро-Тищенко (диспропорционирования) Ø Характерна для альдегидов, у которых нет Н при С: . формальдегид Ø бензальдегид триметилуксусный альдегид Реакция протекает в ОН- - щелочной среде Реакция диспропорционирования для метаналя в. I ок I в II 55

Реакция окисления – восстановления ( Канниццаро-Тищенко) для бензальдегида в. I бензальдегид ок II ок I бензоат калия в II Фенилкарбинол, бензиловый спирт 56

V Реакции карбонильных соединений в радикале. 1. Для предельных альдегидов и кетонов характерны реакции радикального замещения SR : Cl 2, Br 2, h или Р красный. Замещение происходит всегда в -С атоме. + Br 2 2 -бромпропаналь - галогензамещенные альдегиды и кетоны оказывают сильное раздражающее действие на слизистые оболочки носа и глаз, то есть являются лакриматорами (от лат. Lacrima - слеза) 57

2. Для непредельных альдегидов и кетонов характерны реакции электрофильного присоединения – AЕ в радикале, присоединение к , атомам С происходит против правила Марковникова 3 -бромпропаналь Акролеин - сильный лакриматор, очень токсичен. акролеин Используется для синтеза глицерина, пиридина, аминокислот, лекарственны х препаратов и ряда других веществ. 58

3) Для ароматических альдегидов и кетонов характерны реакции электрофильного замещения - SЕ ( катализатор Al. Cl 3 AIBr 3) – замещение происходит в мета – положении в бензольном кольце. AIBr 3 3 -бромбензальдегид Бензальдегид применяется для синтеза душистых веществ, в парфюмернокосметических композициях, как растворитель и т. д. 59

Галоформная реакция – качественная реакция на фрагмент Используется для определения ацетона и ацетоновых тел в клиническом анализе при сахарном диабете. иодоформ 60

Механизм галоформной реакции +δ Na+ +δ Желтый цвет 61

Физико-химические методы исследования и идентификации карбонильных соединений Инфракрасная спектроскопия • Карбонильные соединения содержат характеристическую группу С=О. Полосы валентных колебаний лежат в области 1740 -1660 см-1. Они интенсивные , а потому легко узнаваемы. • Определение структуры соединений по ИК-спектру без привлечения других данных возможно только для относительно простых молекул. • С помощью ИК-спектров устанавливается наличие отдельных элементов структуры 62

ИК-спектр циклогексанона 63

ИК-спектр бутаналя 64

ИК-спектр бензальдегида 65

Электронная спектроскопия • Группа С=О алифатических альдегидов и кетонов может поглощать ультрафиолетовое излучение двумя способами. В результате в УФ - спектре появляются две полосы: • Одна - около 190 нм ( если карбонильное соединение растворено в гексане). Переход электрона разрешен по симметрии. • Вторая - очень низкой интенсивности в диапазоне 270290 нм. Переход электрона запрещен по симметрии. Положение этой полосы зависит от растворителя и заместителя у αС атома. 66

Электронная спектроскопия УФ –спектр ацетона 67

УФ-спектр бензальдегида Для ароматических альдегидов слабая полоса смещена в более длинноволновую область 320 -350 нм, что связано с сопряжением С=О группы и бензольного кольца (π-πсопряжение) 68

Масс-спектроскопия • При ионизации предельного альдегида в массспектрометре наиболее энергетически выгодным является отрыв одного из электронов свободной электронной пары кислорода. • Молекулярный ион, катион-радикал , возникающий при электронном ударе можно изобразить следующим уравнением: 69

Масс-спектр метилбутаналя Каждый пик соответствует определенному молекулярному катиону, образующемуся при ионизации. 70

Спектроскопия ядерного магнитного резонанса ЯМР • Спектроскопия ядерного магнитного резонанса основана на магнитных свойствах ядер, имеющих спиновое квантовое число I , отличное от 0. • Ядра, в которых имеется нечетное число протонов или нейтронов обладают магнитным моментом: 1 Н, 13 С(изотоп природного 12 С) и др. • При помещении вещества в сильное магнитное поле такие ядра ориентируются вдоль силовых линий поля с небольшим преобладанием. • Поглощение энергии поля регистрируется в виде резонансного пика. 71

ЯМР – 1 Н спектр нитробензальдегида 72
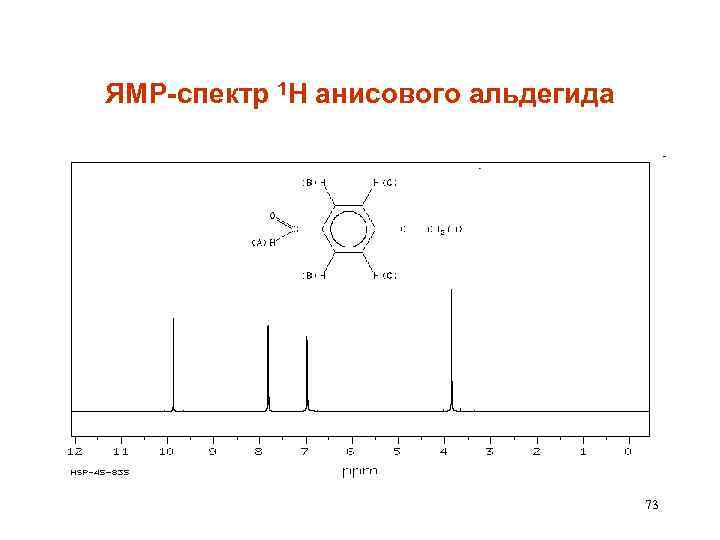
ЯМР-спектр 1 Н анисового альдегида 73

Биологическое значение. 74

Карбонильные соединения – активные участники метаболизма 1. Кетокислоты • • участвуют в метаболизме углеводов(ПВК) и в процессах окисления липидов. Малоновый альдегид - пропандиаль - важнейший продукт перекисного окисления липидов, его определение в биосредах практикуется в биохимическом анализе. 75

2. Убихиноны Участвуют в окислительно-восстановительных процессах пара-хинон циклогексадиен - 2, 5 – дион 1, 4 2 - метилнафтохинон - 1, 4 Витамин К 4 – отвечает за свертываемость крови. 76

3. Пиридоксальфосфат – участник реакций трансаминирования (переаминирования), декарбоксилирования, важнейших химических реакций аминокислот. 4. Углеводы – участники гликолиза. 5. Многие стероидные гормоны содержат кетонную группировку, например, тестостерон и прогестерон – половые гормоны. 77

Карбонильные соединения как лекарственные средства (некоторые примеры) 1. Производные бутиферона обладают успокаивающим действием (нейролептики). 78

2) Фурфурол - в синтезе фурацилина (лечение больного горла) 3) Камфора – является кетоном терпенового ряда. Она с давних времен используется как средство, стимулирующее сердечную деятельность. 79

СПАСИБО ЗА ВНИМАНИЕ! 80
lect_org_3 (1).ppt