Кафедра физической химии















Химическое равновесие и его смещение.ppt
- Количество слайдов: 16
 Кафедра физической химии Дисциплина «Химия» Лекция № 8 Химическое равновесие и его смещение Рягин Сергей Николаевич, д. п. н. , профессор кафедры физической химии, Почетный работник образования РФ
Кафедра физической химии Дисциплина «Химия» Лекция № 8 Химическое равновесие и его смещение Рягин Сергей Николаевич, д. п. н. , профессор кафедры физической химии, Почетный работник образования РФ
 n Различают обратимые и необратимые химические реакции. n Необратимые химические реакции, или односторонние - реакции протекающие самопроизвольно только (или преимущественно) в одном направлении, которое в уравнениях указывают стрелкой (→) вместо знака равенства (=). n При этом происходит практически полное превращение взятых в стехиометрическом соотношении исходных веществ и теоретический выход продуктов составляет 100 %. О таких реакциях говорят, что они идут до конца, т. е. до полного исчезновения реагентов. а. А + в. В → с. С + d. D реагенты продукты D В С q, pΔV А реагенты продукты
n Различают обратимые и необратимые химические реакции. n Необратимые химические реакции, или односторонние - реакции протекающие самопроизвольно только (или преимущественно) в одном направлении, которое в уравнениях указывают стрелкой (→) вместо знака равенства (=). n При этом происходит практически полное превращение взятых в стехиометрическом соотношении исходных веществ и теоретический выход продуктов составляет 100 %. О таких реакциях говорят, что они идут до конца, т. е. до полного исчезновения реагентов. а. А + в. В → с. С + d. D реагенты продукты D В С q, pΔV А реагенты продукты
 Признаки необратимости химических реакций. 1. Образование устойчивого (одного или нескольких) продукта в условиях проведения реакции: а) соединения удаляющегося из сферы реакции, — малорастворимого вещества, выпадающего в осадок, и (или) газа, улетучивающегося из реакционной смеси: Ва. С 12 + K 2 SO 4 → Ba. SO 4 ↓ + 2 КСl ; Na 2 CO 3+ 2 HCl → 2 Na. Cl + CO 2 ↑+ H 2 O б) прочного комплекса и (или) малодиссоциирующего вещества — слабых электролитов. Cu. Br 2 +4 NH 3 → [Cu(NH 3)4]Br 2 ; HC 1 + KOH → KC 1 + H 2 O 2. Экзотермический характер (экзотермичность) реакции (∆Н < 0), сопровождающейся образованием большего числа молей продуктов, чем исходных веществ, т. е. протекающей с увеличением энтропии (∆S > 0). Согласно этому признаку, реакции, в результате которых сложные вещества экзотермически превращаются в более простые, например: 2 KMn. O 4 → K 2 Mn. O 4 + Mn. O 2 + O 2↑ ; 2 С 6 Н 6 + 15 О 2 → 12 СО 2↑ + 6 H 2 O 2 КСl. O 3→ 2 КС 1 + 3 О 2↑ относят к истинно, или совершенно, необратимым процессам независимо от условий, так как непосредственно из продуктов таких реакций в обычных условиях реагенты нельзя получить никаким известным способом.
Признаки необратимости химических реакций. 1. Образование устойчивого (одного или нескольких) продукта в условиях проведения реакции: а) соединения удаляющегося из сферы реакции, — малорастворимого вещества, выпадающего в осадок, и (или) газа, улетучивающегося из реакционной смеси: Ва. С 12 + K 2 SO 4 → Ba. SO 4 ↓ + 2 КСl ; Na 2 CO 3+ 2 HCl → 2 Na. Cl + CO 2 ↑+ H 2 O б) прочного комплекса и (или) малодиссоциирующего вещества — слабых электролитов. Cu. Br 2 +4 NH 3 → [Cu(NH 3)4]Br 2 ; HC 1 + KOH → KC 1 + H 2 O 2. Экзотермический характер (экзотермичность) реакции (∆Н < 0), сопровождающейся образованием большего числа молей продуктов, чем исходных веществ, т. е. протекающей с увеличением энтропии (∆S > 0). Согласно этому признаку, реакции, в результате которых сложные вещества экзотермически превращаются в более простые, например: 2 KMn. O 4 → K 2 Mn. O 4 + Mn. O 2 + O 2↑ ; 2 С 6 Н 6 + 15 О 2 → 12 СО 2↑ + 6 H 2 O 2 КСl. O 3→ 2 КС 1 + 3 О 2↑ относят к истинно, или совершенно, необратимым процессам независимо от условий, так как непосредственно из продуктов таких реакций в обычных условиях реагенты нельзя получить никаким известным способом.
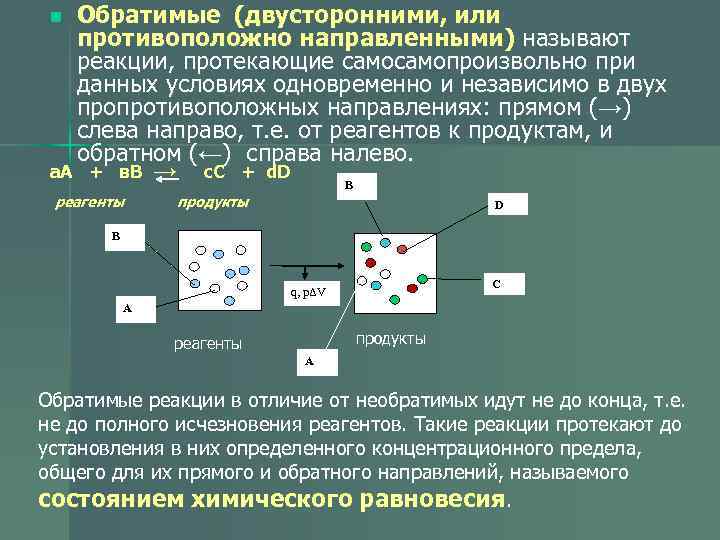
 n Обратимые (двусторонними, или противоположно направленными) называют реакции, протекающие самопроизвольно при данных условиях одновременно и независимо в двух пропротивоположных направлениях: прямом (→) слева направо, т. е. от реагентов к продуктам, и обратном (←) справа налево. а. А + в. В → с. С + d. D В реагенты продукты D В С q, pΔV А реагенты продукты А Обратимые реакции в отличие от необратимых идут не до конца, т. е. не до полного исчезновения реагентов. Такие реакции протекают до установления в них определенного концентрационного предела, общего для их прямого и обратного направлений, называемого состоянием химического равновесия.
n Обратимые (двусторонними, или противоположно направленными) называют реакции, протекающие самопроизвольно при данных условиях одновременно и независимо в двух пропротивоположных направлениях: прямом (→) слева направо, т. е. от реагентов к продуктам, и обратном (←) справа налево. а. А + в. В → с. С + d. D В реагенты продукты D В С q, pΔV А реагенты продукты А Обратимые реакции в отличие от необратимых идут не до конца, т. е. не до полного исчезновения реагентов. Такие реакции протекают до установления в них определенного концентрационного предела, общего для их прямого и обратного направлений, называемого состоянием химического равновесия.
 Химическое равновесие характеризуется следующими особенностями (признаками): n термодинамической устойчивостью — постоянством (неизменностью) во времени состояния (равновесного состава) системы в отсутствие (или при неизменности) внешних воздействий. (∆G=0); n подвижностью — способностью положения равновесия легко смещаться в ту или иную сторону при наличии внешних воздействий, сколь малы бы они ни были; n возможностью достижения системой равновесного состояния с двух сторон — как со стороны реагентов (в результате самопроизвольного процесса), так и со стороны продуктов; n динамическим характером (динамичностью), означающим непрерывное протекание с одинаковой скоростью как прямой, так и обратной реакций.
Химическое равновесие характеризуется следующими особенностями (признаками): n термодинамической устойчивостью — постоянством (неизменностью) во времени состояния (равновесного состава) системы в отсутствие (или при неизменности) внешних воздействий. (∆G=0); n подвижностью — способностью положения равновесия легко смещаться в ту или иную сторону при наличии внешних воздействий, сколь малы бы они ни были; n возможностью достижения системой равновесного состояния с двух сторон — как со стороны реагентов (в результате самопроизвольного процесса), так и со стороны продуктов; n динамическим характером (динамичностью), означающим непрерывное протекание с одинаковой скоростью как прямой, так и обратной реакций.
 Количественно химическое равновесие характеризуют: 1) равновесным составом реакционной смеси. Его обычно выражают через: n равновесные мольные доли веществ- участников равновесия, являющиеся безразмерными величинами; n равновесные концентрации веществ. Для их обозначения обычно используют квадратные скобки с указанием внутри формулы соответствующего вещества, например [А], [В], [С], [D]. В отличие от равновесных, неравновесные — текущие (концентрации в каждый момент времени до наступления состояния равновесия), а также начальные молярные концентрации веществ обозначают через С и Со соответственно с индексом в виде формулы вещества: Со. А, CА и т. д. n парциальными давлениями газообразных веществ рi, если реакция газофазная.
Количественно химическое равновесие характеризуют: 1) равновесным составом реакционной смеси. Его обычно выражают через: n равновесные мольные доли веществ- участников равновесия, являющиеся безразмерными величинами; n равновесные концентрации веществ. Для их обозначения обычно используют квадратные скобки с указанием внутри формулы соответствующего вещества, например [А], [В], [С], [D]. В отличие от равновесных, неравновесные — текущие (концентрации в каждый момент времени до наступления состояния равновесия), а также начальные молярные концентрации веществ обозначают через С и Со соответственно с индексом в виде формулы вещества: Со. А, CА и т. д. n парциальными давлениями газообразных веществ рi, если реакция газофазная.
 2) Равновесный выход продукта (η) есть отношение количества вещества (числа молей) продукта в состоянии равновесия к его стехиометрическому количеству, рассчитанному при условии необратимого протекания реакции, либо отношение соответствующих концентраций. и
2) Равновесный выход продукта (η) есть отношение количества вещества (числа молей) продукта в состоянии равновесия к его стехиометрическому количеству, рассчитанному при условии необратимого протекания реакции, либо отношение соответствующих концентраций. и
 3) Степенью превращения реагента α — отношением количества вещества превратившегося реагента к его начальному количеству, либо отношением соответствующих концентраций:
3) Степенью превращения реагента α — отношением количества вещества превратившегося реагента к его начальному количеству, либо отношением соответствующих концентраций:
 4) Одна из важнейших количественных характеристик химического равновесия — константа равновесия – К равн, позволяющая судить о полноте протекания реакции. n Она изменяются в пределах 0 < Kpавн < ∞ и никогда не равны нулю (исходные вещества не взаимодействуют) и бесконечности (исходные вещества практически полностью превращаются в продукты). n Если Кравн > 1, то в равновесной реакционной смеси преобладают продукты: их относительное содержание в ней выше, чем исходных веществ, т. е. положение равновесия смещено вправо (→). n При Кравн < 1 в равновесной реакционной смеси преобладают исходные вещества: их относительное содержание в ней выше, чем продуктов, т. е. положение равновесия смещено влево (←).
4) Одна из важнейших количественных характеристик химического равновесия — константа равновесия – К равн, позволяющая судить о полноте протекания реакции. n Она изменяются в пределах 0 < Kpавн < ∞ и никогда не равны нулю (исходные вещества не взаимодействуют) и бесконечности (исходные вещества практически полностью превращаются в продукты). n Если Кравн > 1, то в равновесной реакционной смеси преобладают продукты: их относительное содержание в ней выше, чем исходных веществ, т. е. положение равновесия смещено вправо (→). n При Кравн < 1 в равновесной реакционной смеси преобладают исходные вещества: их относительное содержание в ней выше, чем продуктов, т. е. положение равновесия смещено влево (←).
 n Для гомогенных химических равновесий, устанавливающихся в идеальных жидких и газообразных (газовых смесях) растворах, константу равновесия можно выразить, на основе закона действующих масс Гульдберга—Вааге, через равновесные молярные концентрации и равновесные молярные доли, а для равновесий в газовых смесях — через равновесные парциальные давления: , Δn г – изменение числа молей газообразных веществ в течение реакции.
n Для гомогенных химических равновесий, устанавливающихся в идеальных жидких и газообразных (газовых смесях) растворах, константу равновесия можно выразить, на основе закона действующих масс Гульдберга—Вааге, через равновесные молярные концентрации и равновесные молярные доли, а для равновесий в газовых смесях — через равновесные парциальные давления: , Δn г – изменение числа молей газообразных веществ в течение реакции.
 Связь константы равновесия с кинетическими параметрами n Для простых гомогенных реакций константа равновесия может быть выведено из основного закона химической кинетики (закон действующих масс Гульдберга-Вааге), согласно которому скорость химической реакции прямо пропорциональна концентрации реагентов, возведенные в степени равные стехиометрическим коэффициентам в уравнении: В момент равновесия: Таким образом, константа равновесия есть отношение констант скорости прямой и обратной реакции. Отсюда вытекает физический смысл константы равновесия: она показывает, во сколько раз скорость прямой реакции больше скорости обратной при данных условиях.
Связь константы равновесия с кинетическими параметрами n Для простых гомогенных реакций константа равновесия может быть выведено из основного закона химической кинетики (закон действующих масс Гульдберга-Вааге), согласно которому скорость химической реакции прямо пропорциональна концентрации реагентов, возведенные в степени равные стехиометрическим коэффициентам в уравнении: В момент равновесия: Таким образом, константа равновесия есть отношение констант скорости прямой и обратной реакции. Отсюда вытекает физический смысл константы равновесия: она показывает, во сколько раз скорость прямой реакции больше скорости обратной при данных условиях.
 Связь константы равновесия с термодинамическими параметрами Связь между константами равновесия и термодинамическими характеристиками системы устанавливается уравнениями: 1) Уравнение изотермы химической реакции Вант– Гоффа, показывающие взаимосвязь изменения энергии Гиббса и константы химического равновесия. 2) Уравнение изобары химической реакции Вант– Гоффа, показывающие взаимосвязь изменения константы равновесия от теплового эффекта реакции.
Связь константы равновесия с термодинамическими параметрами Связь между константами равновесия и термодинамическими характеристиками системы устанавливается уравнениями: 1) Уравнение изотермы химической реакции Вант– Гоффа, показывающие взаимосвязь изменения энергии Гиббса и константы химического равновесия. 2) Уравнение изобары химической реакции Вант– Гоффа, показывающие взаимосвязь изменения константы равновесия от теплового эффекта реакции.
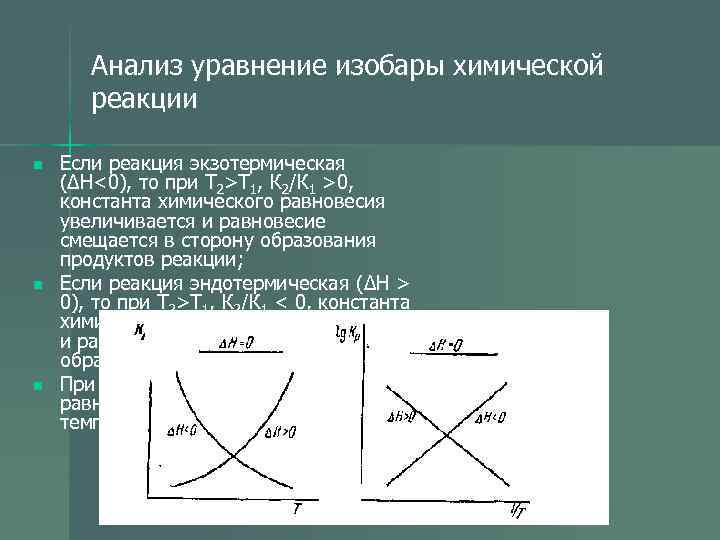
 Анализ уравнение изобары химической реакции n Если реакция экзотермическая (ΔН<0), то при Т 2>Т 1, К 2/К 1 >0, константа химического равновесия увеличивается и равновесие смещается в сторону образования продуктов реакции; n Если реакция эндотермическая (ΔН > 0), то при Т 2>Т 1, К 2/К 1 < 0, константа химического равновесия уменьшается и равновесие смещается в сторону образования исходных веществ; n При ΔН = 0 константа химического равновесия не зависит от температуры
Анализ уравнение изобары химической реакции n Если реакция экзотермическая (ΔН<0), то при Т 2>Т 1, К 2/К 1 >0, константа химического равновесия увеличивается и равновесие смещается в сторону образования продуктов реакции; n Если реакция эндотермическая (ΔН > 0), то при Т 2>Т 1, К 2/К 1 < 0, константа химического равновесия уменьшается и равновесие смещается в сторону образования исходных веществ; n При ΔН = 0 константа химического равновесия не зависит от температуры
 n Изменение состояния равновесия в результате изменения внешних условий называют смещением или сдвигом положения равновесия. n Правило смещения положения равновесия, или принципом Ле Шателье: если на систему, находящуюся в состоянии истинного химического равновесия, оказывать внешнее воздействие путем изменения какого- либо из условий (С, Т, Робщ) определяющих положение равновесия, то в системе происходит изменение равновесного состава и смещение положения равновесия в направлении того процесса, протекание которого ослабляет эффект (влияние) этого воздействия.
n Изменение состояния равновесия в результате изменения внешних условий называют смещением или сдвигом положения равновесия. n Правило смещения положения равновесия, или принципом Ле Шателье: если на систему, находящуюся в состоянии истинного химического равновесия, оказывать внешнее воздействие путем изменения какого- либо из условий (С, Т, Робщ) определяющих положение равновесия, то в системе происходит изменение равновесного состава и смещение положения равновесия в направлении того процесса, протекание которого ослабляет эффект (влияние) этого воздействия.
 n 1. Влияние концентрации: при повышении концентрации реагента или продукта равновесие смещается в сторону его расходования и наоборот. Изменение в равновесной системе концентрации любого из компонентов или концентраций всех компонентов не влияет на константу равновесия. n 2. Влияние температуры: при повышении температуры равновесие смещается в сторону эндотермической реакции, при понижении – экзотермической реакции. n 3. Влияние давления: при повышении давления равновесие смещается в строну уменьшения объема и наоборот. n 4. Катализатор на смещение равновесия не влияет.
n 1. Влияние концентрации: при повышении концентрации реагента или продукта равновесие смещается в сторону его расходования и наоборот. Изменение в равновесной системе концентрации любого из компонентов или концентраций всех компонентов не влияет на константу равновесия. n 2. Влияние температуры: при повышении температуры равновесие смещается в сторону эндотермической реакции, при понижении – экзотермической реакции. n 3. Влияние давления: при повышении давления равновесие смещается в строну уменьшения объема и наоборот. n 4. Катализатор на смещение равновесия не влияет.
 Н 2 + I 2 2 Н I+Q n С (Н 2) или С (I 2) n С (НI) n Т n Р - не влияет n Катализатор – не влияет
Н 2 + I 2 2 Н I+Q n С (Н 2) или С (I 2) n С (НI) n Т n Р - не влияет n Катализатор – не влияет

