lektsia__1_Vvedenie_v_biokhimiyu_Belki_16-17.ppt
- Количество слайдов: 155

Кафедра биохимии Поздравляет Вас с началом нового (2016 -2017) учебного года Желаем больших успехов в учебе и личной жизни


Борис Иванович Ильин-Какуев – первый заведующий кафедрой биохимии

Профессор П. А. Верболович Второй зав. Кафедрой

Профессор Полосухина Татьяна Яковлевна

Третьим заведующим кафедрой стала профессор Светлана Михайловна Плешкова. Выпускница нашего университета, в те времена института


На сегодняшний день заведующим кафедрой стал профессор Шарипов Камалидин Орынбаевич


Лектор – доцент Ерджанова Сара Саид-Алиевна

Лекция № 1 Тема: Введение в биохимию. Понятие о строении и функциях белков. Классификация белков. Сложные белки: ГП, ХП, НП

Цель: Ознакомить студентов с наукой биохимией значением ее для врачей. Дать понятие о строении белков и их функциях. Рассмотреть строение и роль сложных белков: гликопротеинов, хромопротеинов и нуклеопротеинов

План лекции 1. Введение в биохимию 2. Понятие о строении и функциях белков 3. Сложные белки: гликопротеины, хромопротеины, нуклеопротеины – строение, роль, представители

Введение в биохимию Что такое биохимия? Итак, существует множество определений этого термина:

Биохимия (биологическая, или физиологическая химия) по Википедии это: – наука о химическом составе живых клеток и организмов и о химических процессах, лежащих в основе их жизнедеятельности. Биохимия по энциклопедии Кольера это: – наука, которая описывает на языке химии строение и функции живых организмов. Биохимия по энциклопедии Брокгауза и Ефрона это: – греч. , учение о химических процессах в живых существах. Биохимия (биол. химия) по Xu. Mu. K. ru: – изучает хим. состав и структуру в-в, содержащихся в живых организмах, пути и способы регуляции их метаболизма, а также энергетич. обеспечение процессов, происходящих в клетке и организме.

Однако все эти определения не дают ответ на вечный вопрос моих студентов: Зачем врачу нужна биологическая химия?

Отступая от прямого ответа на поставленный вопрос, обращу внимание читателя на ту лавину знаний, которая обрушивается на студента-медика в первые три года пребывания в медицинском университете. Часть этих знаний как бы не имеет отношения к медицине – латинский язык, химия, физика, гуманитарные дисциплины, но их задача – сформировать представление о целостности нашего мира, о его единстве и неразрывности явлений.

Еще одна группа наук – медицинские науки, это анатомия, гистология, физиология и биохимия человека, патоанатомия и патофизиология, фармакология. Их значение можно сравнить с древним представлением об устройстве мира. Анатомия, гистология, цитология – океан, без которого все остальное не имеет значения. Биохимия, физиология и патофизиология – три кита в этом океане. Они сообщают будущему врачу о принципах функционирования организма, о химических процессах в живой материи. Их задача – проложить мосты в клинические дисциплины, дать врачу возможность понять суть процесса, вызывающего болезнь.

Все клинические дисциплины базируются на этих трех китах – биохимии, физиологии и патофизиологии. Убираем китов – и остаются только больное место и ничем необоснованные гадания о типе болезни, ее причинах и способах лечения.

Введение в биохимию Биохимия – это наука, изучающая химический состав живых организмов и химические процессы, которым подвергаются внутренние метаболиты. Открытия в области энзимологии, молекулярной генетики, биоэнергетики выдвинули биохимию в ряд фундаментальных дисциплин и сделали мощным оружием в решении многих проблем биологии, медицины, животноводства и растениеводства.
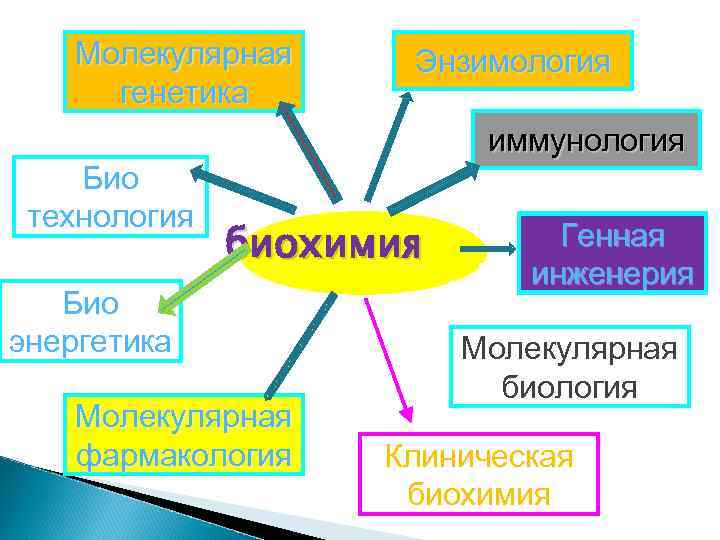
Молекулярная генетика Энзимология иммунология Био технология биохимия Био энергетика Молекулярная фармакология Генная инженерия Молекулярная биология Клиническая биохимия

Биохимия дает врачу сведения, благодаря которым можно разбираться в химизме процессов, протекающих в больном и здоровом организме, использовать показатели метаболитов и ферментов для диагностики и контроля. Она позволяет управлять этими процессами, рационально использовать терапию.

БЕЛКИ Белки (протеины) – высокомолекулярные биополимеры, состоящие из остатков α -аминокислот
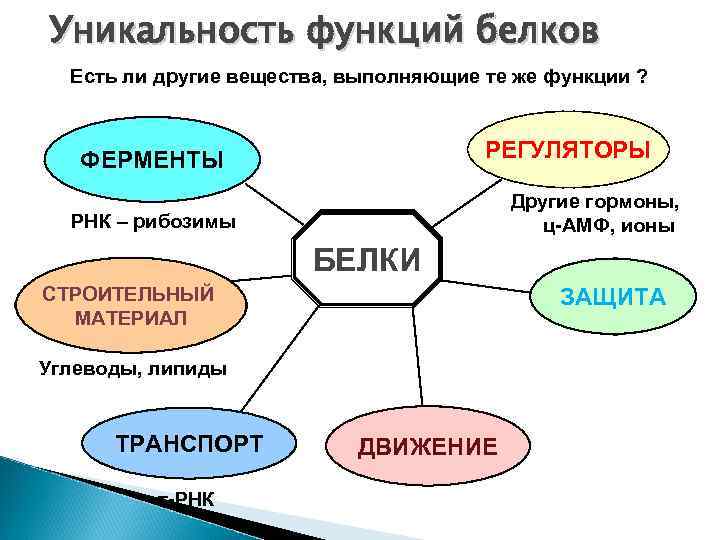
Уникальность функций белков Есть ли другие вещества, выполняющие те же функции ? РЕГУЛЯТОРЫ ФЕРМЕНТЫ Другие гормоны, ц-АМФ, ионы РНК – рибозимы БЕЛКИ СТРОИТЕЛЬНЫЙ МАТЕРИАЛ ЗАЩИТА Углеводы, липиды ТРАНСПОРТ т-РНК ДВИЖЕНИЕ

Белки выполняют все функции, кроме одной – ИНФОРМАЦИОННОЙ не способны к самовоспроизведению

Строение и функции белков Название происходит от греческого слова protos – первый, важнейший. В природе имеется около 1010 - 1012 различных белков, обеспечивающих существование 106 живых существ. .

Многообразие белков

С белками связаны все признаки, отличающие живое от неживого: воспроизводимость себе подобных, сократимость, обмен веществ, высокий уровень структурной организации, способность преобразовывать и использовать энергию, ускорять химические реакции.

Белки
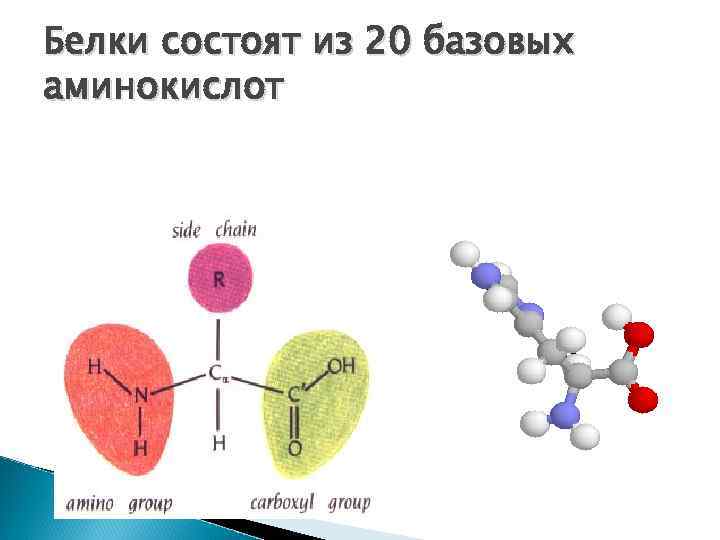
Белки состоят из 20 базовых аминокислот
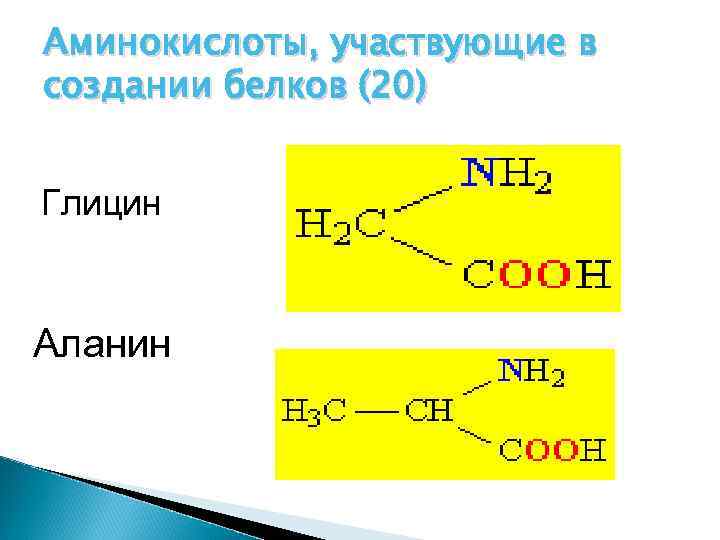
Аминокислоты, участвующие в создании белков (20) Глицин Аланин
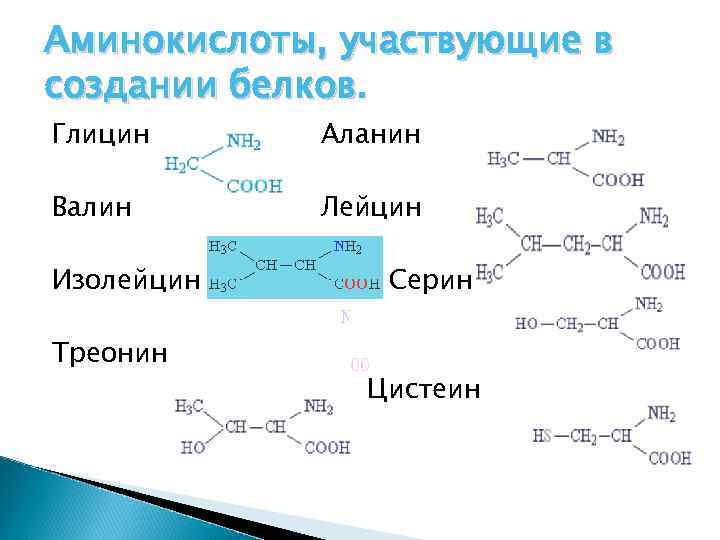
Аминокислоты, участвующие в создании белков. Глицин Аланин Валин Лейцин Изолейцин Треонин Серин Цистеин

МЕТИОНИН ЛИЗИН АРГИНИН АСПАРАГИНОВАЯ КИСЛОТА ГЛУТАМИНОВАЯ КИСЛОТА

Функции белков

Структурная (опорная, пластическая) белки определяют структуру тела растений, микроорганизмов, животных, входят в состав клеточных и субклеточных мембран. Широко известны такие структурные белки как коллаген и эластин соединительной ткани, оссеин костей, кератин волос и ногтей, обеспечивающие прочность и структуру тканей.

Каталитическая – белки обладают свойствами биокатализаторов (ферментов), ускоряя течение химических процессов в организме.

Транспортная – белки переносят с кровью и другими биологическими жидкостями транспорту через мембраны

Защитная – обеспечивают иммунологические реакции. А) защита организма при ранении путем свертывания крови. Б) связывание токсических эндогенных и экзогенных веществ В) антитела. Г) интерфероны – блокируют синтез вирусных белков

Регуляторная –гормоны, ферменты, БАВ, пептиды -являются белками.

Сократительная – способность к передвижению в пространстве, работа сердца, дыхание, перистальтика кишечника, сужение и расширение сосудов обеспечиваются благодаря сократительным белкам мышечной ткани. Сократительная функция присуща и белкам цитоскелета, благодаря которым обеспечиваются важнейшие процессы жизнедеятельности клеток.

Электротрансформирующая функция заключается в превращении электрической и осмотической энергии в энергию макроэргов. 10 -20% энергопотребления у человека, обеспечивается за счет окисления аминокислот

Белки участвуют в процессе передачи генетической информации.

Классификация белков

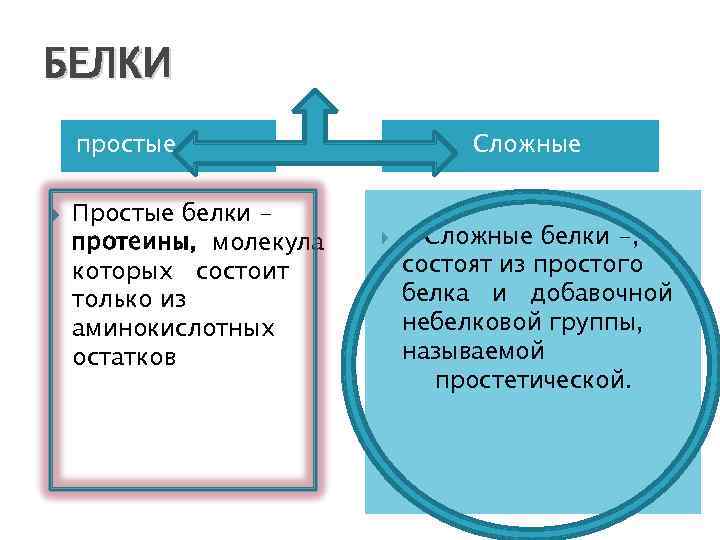
БЕЛКИ простые Простые белки протеины, молекула которых состоит только из аминокислотных остатков Сложные белки -, состоят из простого белка и добавочной небелковой группы, называемой простетической.
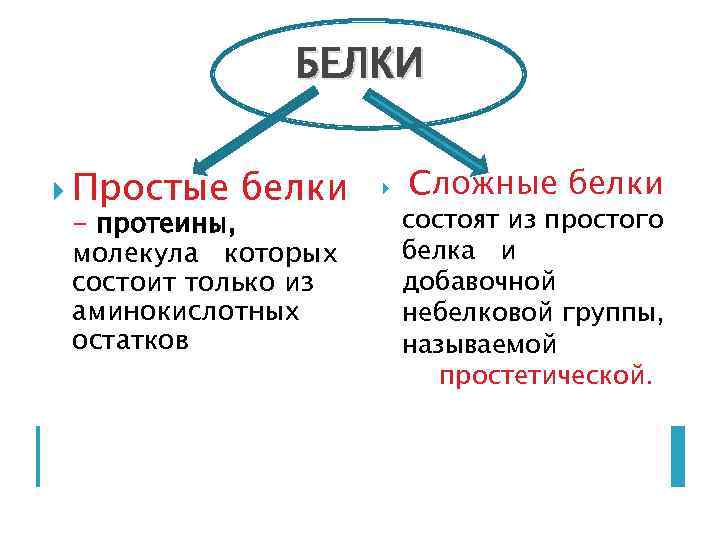
БЕЛКИ Простые белки - протеины, молекула которых состоит только из аминокислотных остатков Сложные белки состоят из простого белка и добавочной небелковой группы, называемой простетической.
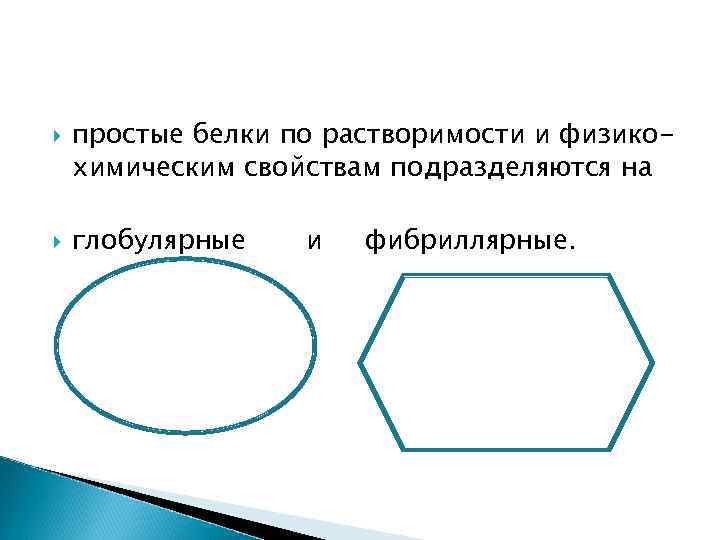
простые белки по растворимости и физикохимическим свойствам подразделяются на глобулярные и фибриллярные.

Глобулярные имеют шарообразную форму молекулы. Фибриллярные белки характеризуются волокнистой структурой, делятся на растворимые и нерастворимые. К первой подгруппе относятся миозин, актин, фибриноген, ко второй – склеропротеины (протеиноиды – кератины, эластины, коллагены).

Простые белка 1. Протеины ◦ Альбумины ◦ Глобулины Протамины Гистоны ◦ Склеропротеины

Сложные белки протеиды, состоящие из простого белка и добавочной небелковой группы, называемой простетической.

Сложные белки Ø Фосфопротеины Ø Металлопротеины Ø Липопротеины Хромопротеины Гликопротеины Нуклеопротеины

фосфопротеины ФП это сложные белки, обособленной простетической группы не имеют. Ее роль выполняют остатки фосфорной кислоты, связанные сложноэфирными связями с гидроксильными группами оксиаминокислот: сер, тре, тир. К одному остатку аминокислоты может присоединиться несколько фрагментов фосфорной кислоты
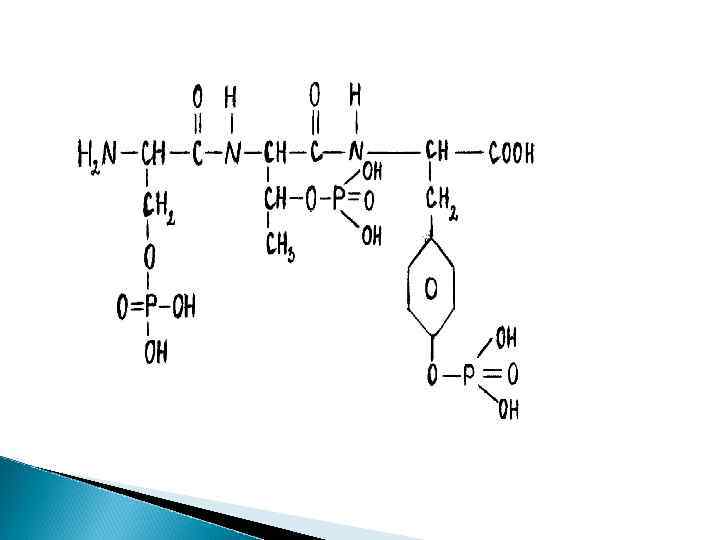

ФП – это полноценные белки с большой молекулярной массой при нагревании не свертываются (термостабильны), в воде не растворимы, но хорошо растворимы в разбавленных растворах солей и щелочей. Имеют кислый характер (ИЭТ ~ 4, 7) из-за остатков фосфорной кислоты, поэтому осаждаются кислотами.

Значение ФП они служат пластическим материалом (источники незаменимых аминокислот и фосфора), играют важную роль в росте организма, поэтому особенно нужны детям.

Представители казеин молока (Р ~ 1%), вителлин и фосвитин – ФП яичного желтка (Р ~ 10%), ихтуллин – в икре рыб (фосфора более 10%). Казеин (от лат caseus – сыр) – основной белок молока, составляет около 80% от белков коровьего молока. Энамелины, фосвитины, обнаруживаются в эмали зуба

Металлопротеины это сложные белки, содержащие в молекуле металлы, но в отличие от ХП здесь металлы свободны и выполняют роль простетической группы. Связь между белком и ионами металлов может быть прочной и непрочной у различных МП. ,

Представители ) ферритин, содержат 20% трехвалентного (окисленного) железа и выполняют роль депо железа в организме. Белок откладывается в печени и селезенке;

Представители МП б) трансферрин, содержит около 0, 13% железа и выполняет роль переносчика железа (главным образом в составе бетаглобулинов), которое в молекуле связано непрочно с ОН-группой тирозина;

Представители МП В)гемосидерин Роль этого белка изучена не достаточно. Это водонерастворимый комплекс, содержащий также УГВ и нуклеотиды. Содержится в РЭС печени и селезенки;

церулоплазмин г). Роль этого белка в транспорте меди, также обладает ферментативной активностью. церулоплазмин иначе называется феррооксидазой. В составе находится 6 -8 атомов двухвалентной меди.

глутатионпероксидаза содержит селен; митохондриальная супероксиддисмутаза содержит марганец, а цитозольная форма этого фермента содержит медь или цинк

железосерные белки выполняют роль дополнительных компонентов в процессе окисления;

б)металлотионеины находятся в печени, почках и кишечнике. Выполняют роль антитоксическую (обезвреживание тяжелых металлов).

К МП относят ряд ферментов, Например, карбоангидраза и карбоксипептидаза содержат цинк; купрум-фермент и цитохромоксидаза содержат медь

К МП относят также ряд ферментов, для которых металл является «мостиком» между белковой и небелковой частями, или непосредственно участвует в выполнении каталитической функции.

карбоангидраза содержит цинк, для активности фосфотрансфераз и киназ необходимы ионы магния и марганца, тирозиназа и ЦХО содержат медь.

Липопротеины (ЛП) это сложные комплексы, включающие в себя большие количества непрочно связанных между собой молекул различных представителей липидов (ФЛ, ХСН, ТАГ, СЖК, СФЛ).
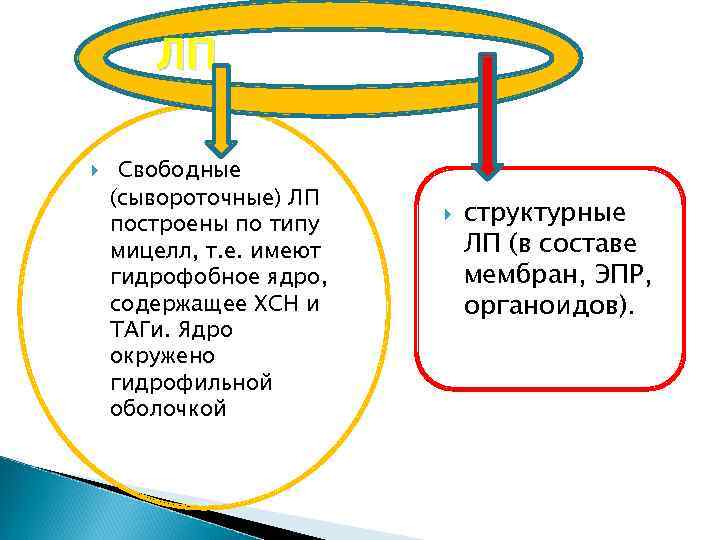
ЛП Свободные (сывороточные) ЛП построены по типу мицелл, т. е. имеют гидрофобное ядро, содержащее ХСН и ТАГи. Ядро окружено гидрофильной оболочкой структурные ЛП (в составе мембран, ЭПР, органоидов).

Свободные ЛП Ядро окружено гидрофильной оболочкой из белков и ФЛ. Хиломикроны (ХМ) Различают ЛПОНП пребета-ЛП ЛПНП , бета-ЛП ЛПВП, альфа-ЛП которые отличаются разным содержанием липидов и белка. ЛП – это транспортная форма липидов.

Белки – 2% ТАГ-80% ФЛ – 7% ХСН -7 -8% ХМ

Гликопротеиды (ГП) Гликопротеиды получили название от слова «glucos» - сладкий, т. к. было установлено, что они содержат углеводы. Простетическая группа представлена различными углеводами и их производными, связь ее с белком ковалентная, углеводпептидная.

Все гликопротеиды обладают высокой молекулярной массой (до нескольких млн. Д), Обладают кислыми свойствами, растворимы в воде, слабых растворах нейтральных солей и щелочей, осаждаются кислотами и обладают высокой вязкостью.

ГП термостабильны, т. к. углеводы, входящие в их состав, значительно повышают устойчивость молекул к различным химическим веществам и нагреванию, защищают их от действия протеаз, определяя тем самым биологическую роль гликопротеидов. Углеводы придают белкам большую специфичность, за счет этих групп макромолекулы гликопротеида могут распознавать другие структуры.

Гликопротеиды в большом количестве содержатся в межклеточном веществе соединительной ткани, плазме крови, слюне и других секретах, в составе цитоплазматических и различных внутриклеточных мембран, в цитозоле.

Значение ГП Они транспортируют гидрофобные вещества и ионы металлов; входя в состав рецепторов мембран, обеспечивают специфичность контактов клетки, влияют на дифференцировку тканей, участвуют в иммунологических реакциях, выполняют защитную роль, покрывая слизистые оболочки.
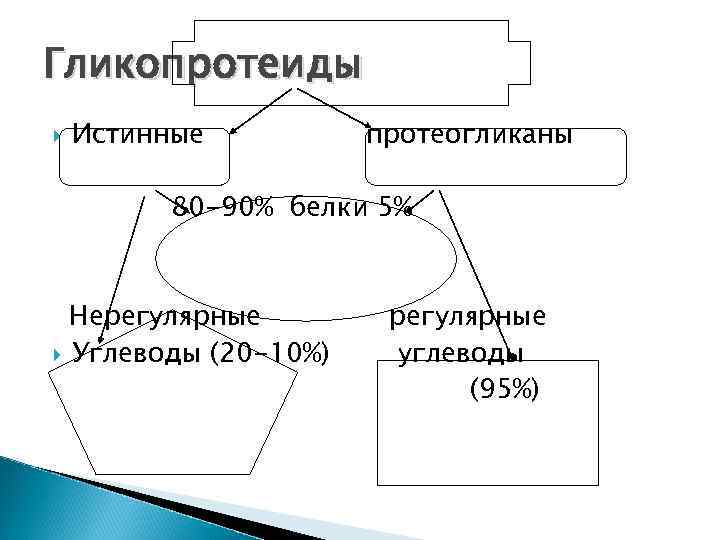
Гликопротеиды Истинные протеогликаны 80 -90% белки 5% Нерегулярные Углеводы (20 -10%) регулярные углеводы (95%)

В состав простетической группы истинных гликопротеидов входят различные моносахариды и их аминопроизводные, нейраминовые или сиаловые кислоты в различных сочетаниях и соотношениях, т. е. простетическая часть истинных гликопротеидов не имеет регулярного строения

Представители истинных ГП иммуноглобулины, муцины, сиалопротеиды, гормоны тиреотропин, фолликулостимулирующий гормон, лютеинизирующий гормон; белки, обуславливающие групповую специфичность крови; протромбин, холинэстераза, транскортин, церулоплазмин, гаптоглобин и т. п.

протеогликаны Протеогликаны содержат небольшую (25%) белковую часть и простетическую группу, представленную гликозамингликанами (ГАГами). ГАГи имеют регулярное строение, т. е. состоят из чередующихся дисахаридов, в состав которых включены уроновые кислоты и ацетилгексозамины

Различают 6 видов ГАГов - гиалуроновая кислота, хондроитинсульфаты А, В, С, кератансульфаты и гепарин, отличающиеся друг от друга природой уроновых кислот, гексозаминов, степенью сульфатирования, типом химической связи, соединяющей между собой мономеры, молекулярной массой, свойствами.
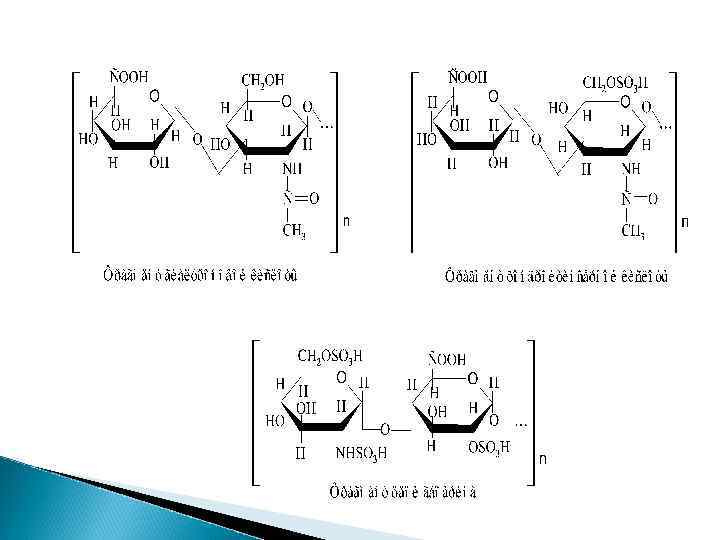

Химический состав ГАГов гиалуроновая кислота (глюкуроновая + ацетилглюкозамин) хондроитинсульфат (глюкуроновая к-та + ацетилгалактозамин) Гепарин (глюкуроновая к-та +глюкозаминсульфат)

Гиалуроновая кислота Основная роль в связывании воды. Активирует митоз Участвует в регуляции проницаемости тканей, являясь главным веществом рыхлой соединительной ткани. обладает цементирующим свойством, соединяя между собой эндотелиальные клетки. обнаружена в стекловидном теле. Содержится в большом количестве в пупочном канатике, препятствуя распространению патогенного агента в суставной жидкости, выполняет роль смазки, уменьшая трение между суставными поверхностями.

гепарин Гепарин вырабатывается тучными клетками - обязательными компонентами соединительной ткани. В отличие от других гликозамингликанов, которые являются исключительно внеклеточными соединениями, гепарин является внутриклеточным соединением в составе тучных клеток артерий, печени, легких и кожи.

Значение гепарина (антикоагулянт) активатор липазы и липопротеидлипазы, тем самым оказывая просветляющее и антиатерогенное действие. Гепарин уменьшает метаболизм клеток, благодаря изменению электрического потенциала клеточной поверхности, что ведет к торможению роста и блокаде фагоцитоза. На этом основано антитоксическое действие гепарина.

Гепарин инактивирует ряд ферментов, в т. ч. активность лизосомальных ферментов; обладает антигиалуронидазным эффектом, снижает проницаемость основного вещества капилляров, освобождает ткани от излишков гистамина. Все это в совокупности обуславливает его противовоспалительное действие. Ингибирует митоз

Хондроитинсерная кислота Участвует в фибриллогенезе и оссификации Является наиболее распространенным ГАГом в организме человека. Ингибирует митоз

Хондроитинсерная кислота Обнаруживается в хрящах, костях, сердечных клапанах. Обуславливает прочность и упругость соединительной ткани Образует агрегаты протеогликанов.

хромопротеины ХП – это сложные белки, у которых небелковой частью являются окрашенные соединения, (металлы или витамины) принадлежащие к различным классам органических веществ (chroma-краска) Железо придает красную окраску Медь – голубовато-зеленую Магний – зеленую
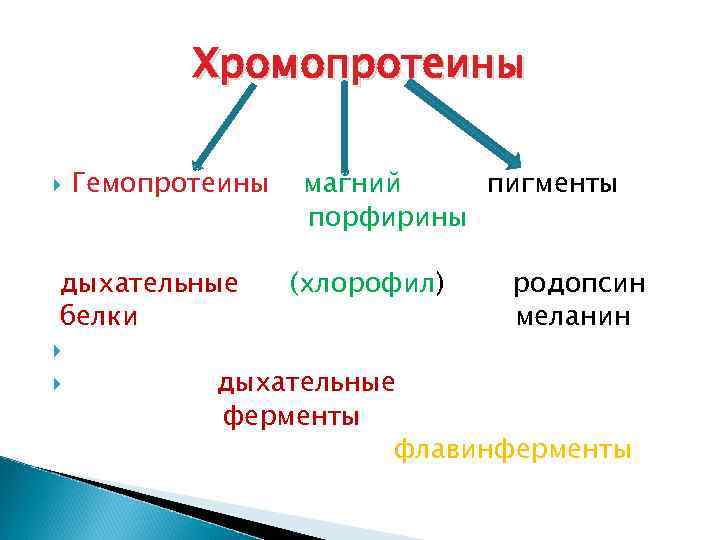
Хромопротеины Гемопротеины дыхательные белки магний пигменты порфирины (хлорофил) родопсин меланин дыхательные ферменты флавинферменты
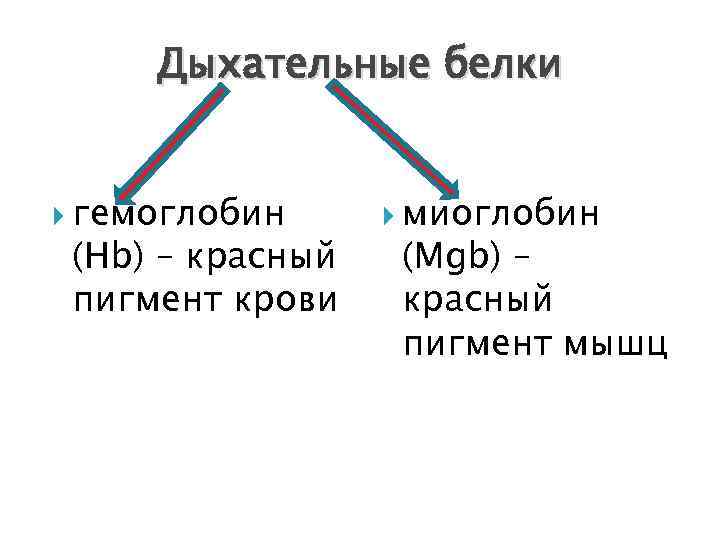
Дыхательные белки гемоглобин (Нb) – красный пигмент крови миоглобин (Мgb) – красный пигмент мышц

гемоглобин Дыхательный белок, красный пигмент крови, содержится в эритроцитах. Состоит из простого белка типа гистонов – глобина и 4 -х гемов.

глобин Состоит из 4 -х полипептидных цепей Двух альфа-цепей (141 остаток АК) Двух бета-цепей (146 остатков АК Молекулярная масса 70 000 Д Обладает видовой специфичностью Гемы гемоглобинов всех животных одинаковы

Гем гемоглобина 1, 3, 5, 8 -тетраметил 2, 4 -дивинил, 6, 7 - дипропионовокислый железопорфин
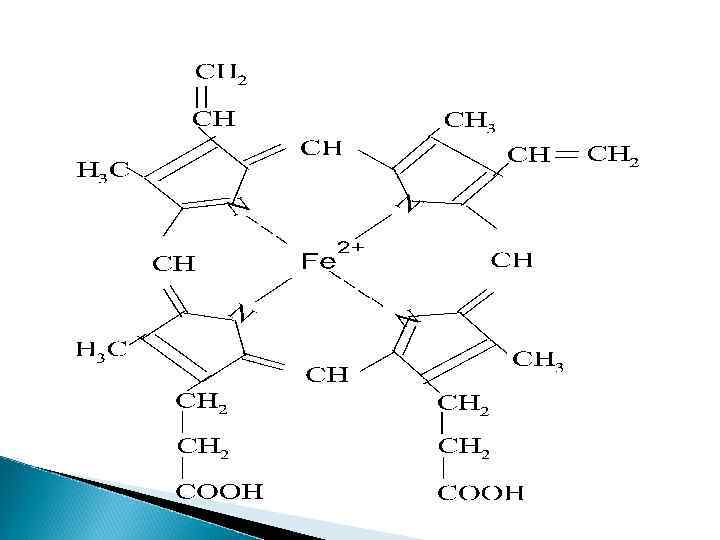
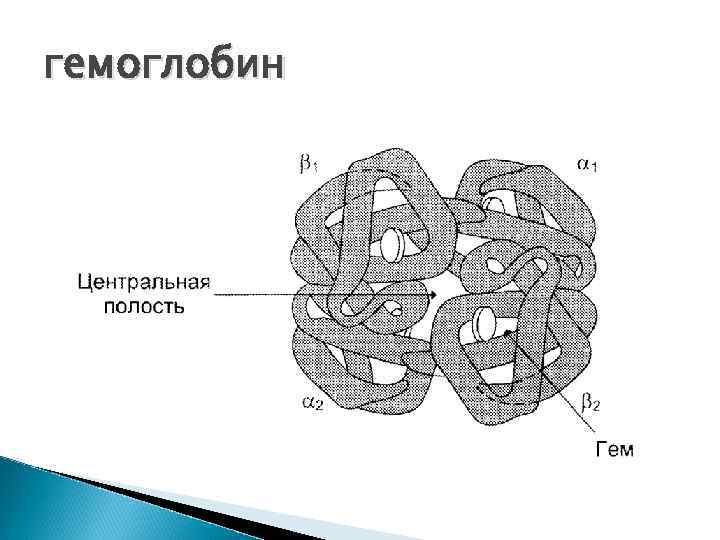
гемоглобин
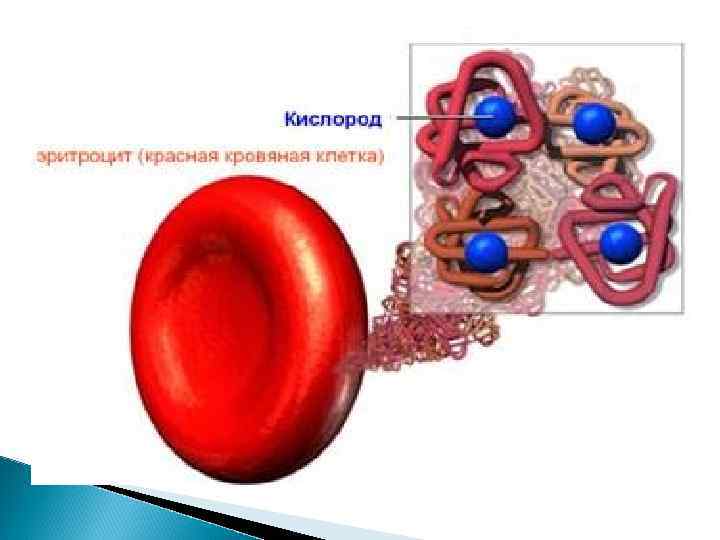

В 1957 году биохимики Д. Кендрью и М. Перутц получили Нобелевскую премию за расшифровку строения молекулы гемоглобина.

Значение гемоглобина 1. перенос кислорода от легких к тканям 2. перенос углекислого газа от тканей к легким

Нуклеопротеины – это сложные белки

Нуклеопротеины Белки Альбумины, Глобулины, гистоны, протамины Простетическая группа – нуклеиновые кислот ДНК и РНК


Белки выполняют все функции, кроме одной – ИНФОРМАЦИОННОЙ не способны к самовоспроизведению

Эту функцию выполняет ДНК главная и единственная ее функция

ДНК – самая большая молекула в клетке. Она намного больше белков и РНК Каждая хромосома = одна молекула ДНК 23 хромосомы человека = 23 молекулы ДНК ≈ 1 метр Самые длинные из них ≈ 8 см ДНК – это молекула-текст. В последовательности ее нуклеотидов записана вся наследственная программа организма
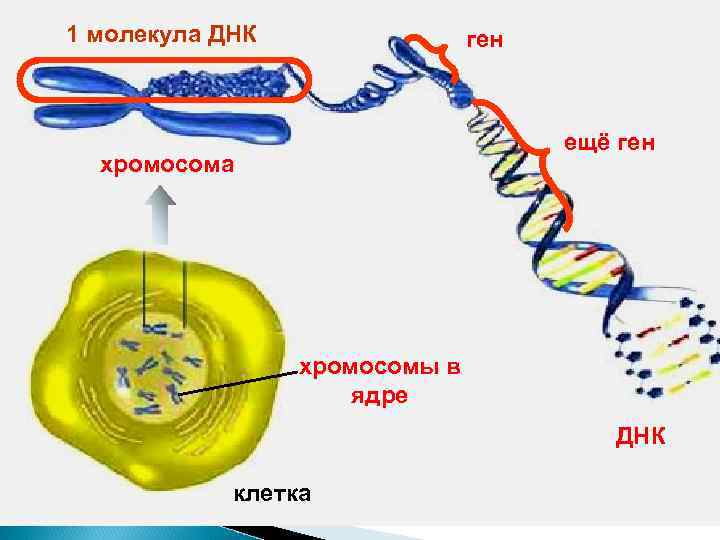
1 молекула ДНК ген ещё ген хромосома хромосомы в ядре ДНК клетка

1953 Открыта структура ДНК Дата рождения молекулярной биологии Джеймс Уотсон Фрэнсис Крик

James Dewey Watson Francis Harry Compton Crick


Рентгеноструктурный портрет ДНК – знаменитое фото 51 Розалинд Франклин 1920 - 1958

Молекулы ДНК и РНК можно увидеть в электронный микроскоп ДНК бактериальных плазмид
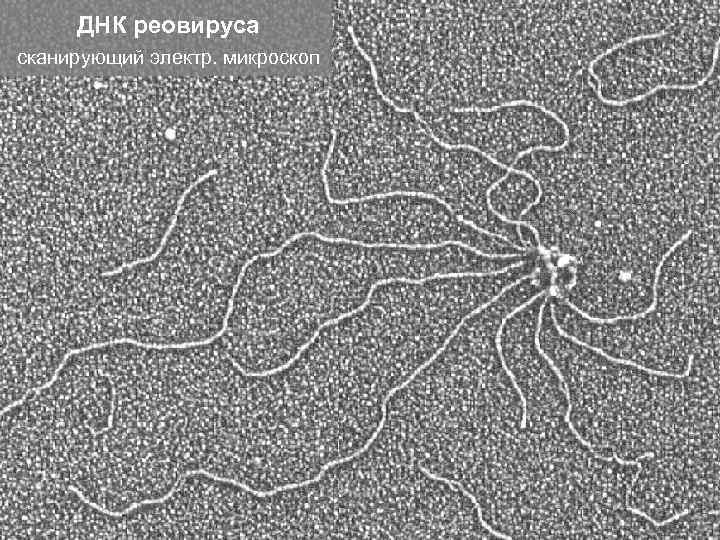
ДНК реовируса сканирующий электр. микроскоп
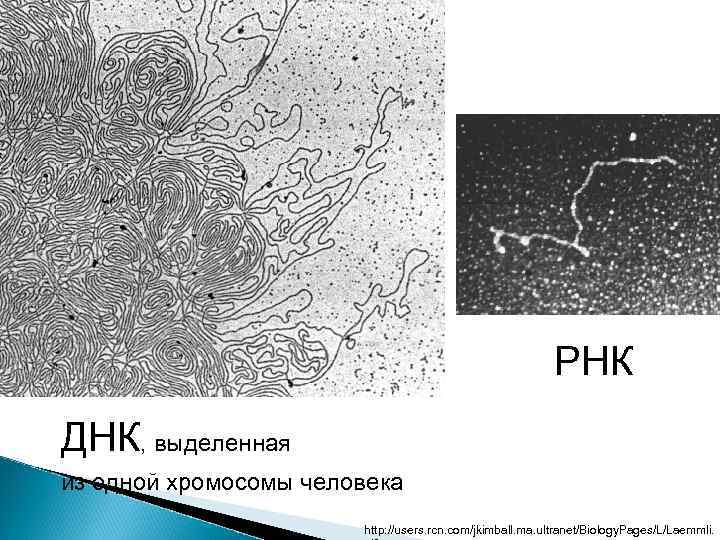
РНК ДНК, выделенная из одной хромосомы человека http: //users. rcn. com/jkimball. ma. ultranet/Biology. Pages/L/Laemmli.
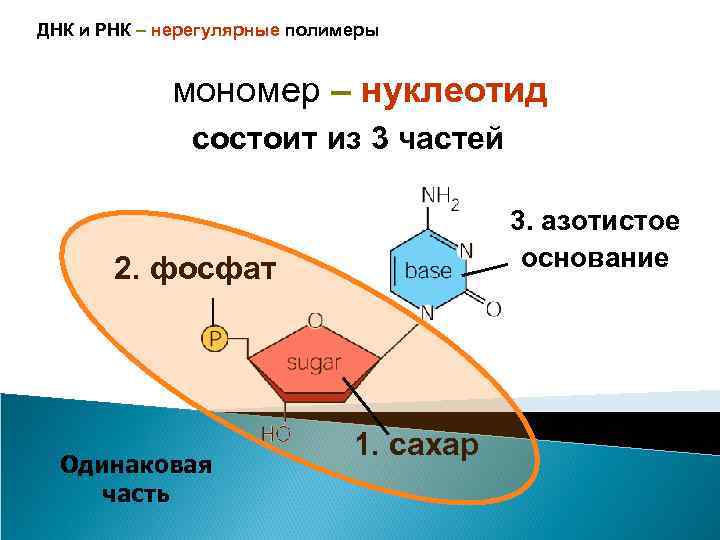
ДНК и РНК – нерегулярные полимеры мономер – нуклеотид состоит из 3 частей 3. азотистое основание 2. фосфат Одинаковая часть 1. сахар
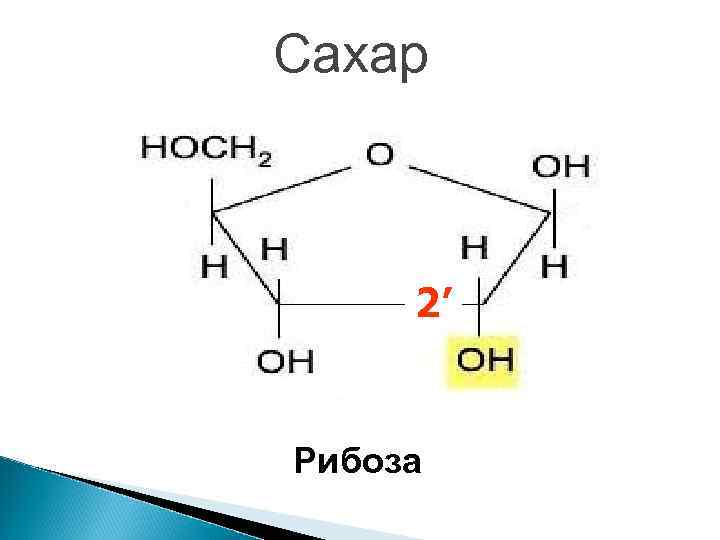
Сахар 2’ Рибоза
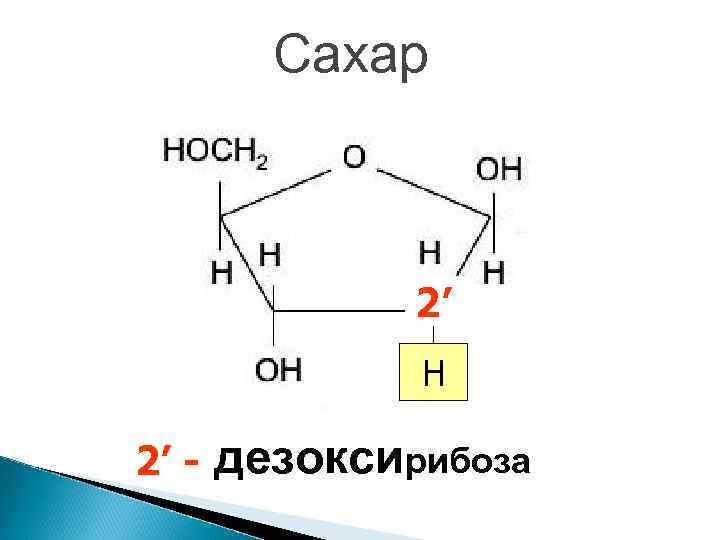
Сахар 2’ H 2’ - дезоксирибоза
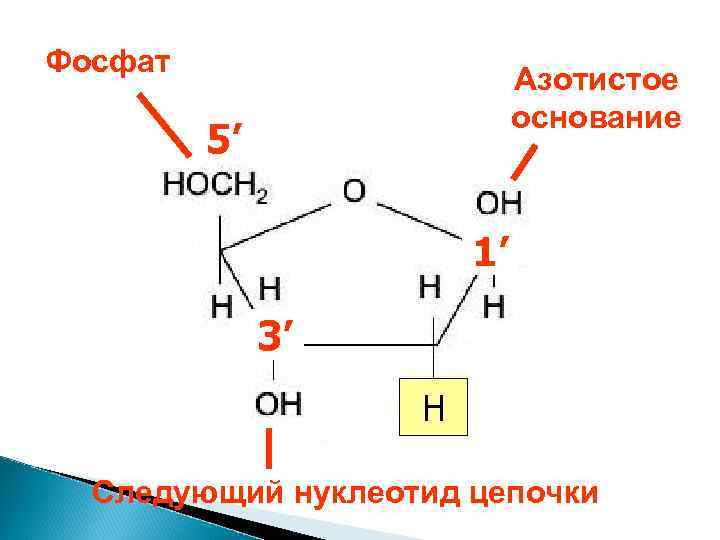
Фосфат Азотистое основание 5’ 1’ 3’ H Следующий нуклеотид цепочки
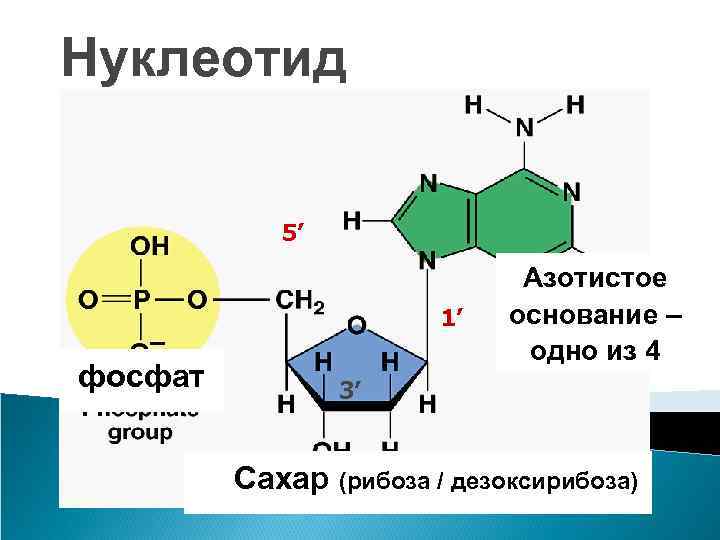
Нуклеотид 5’ 1’ фосфат Азотистое основание – одно из 4 3’ Сахар (рибоза / дезоксирибоза)
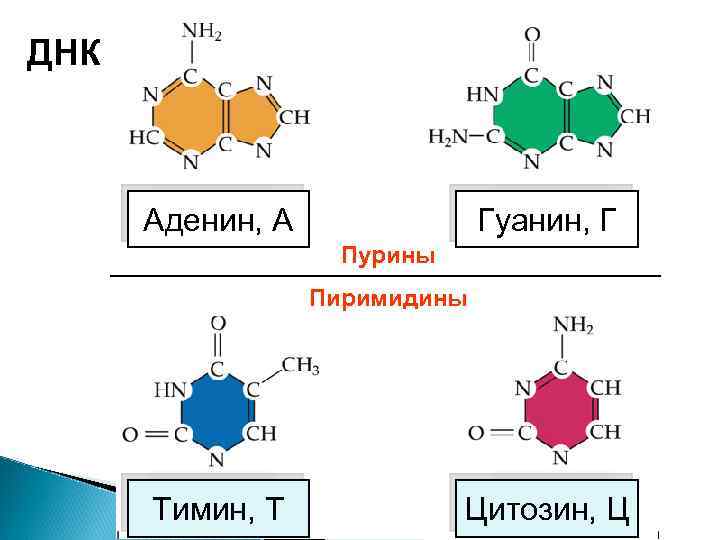
ДНК Аденин, А Гуанин, Г Пурины Пиримидины Тимин, Т Цитозин, Ц
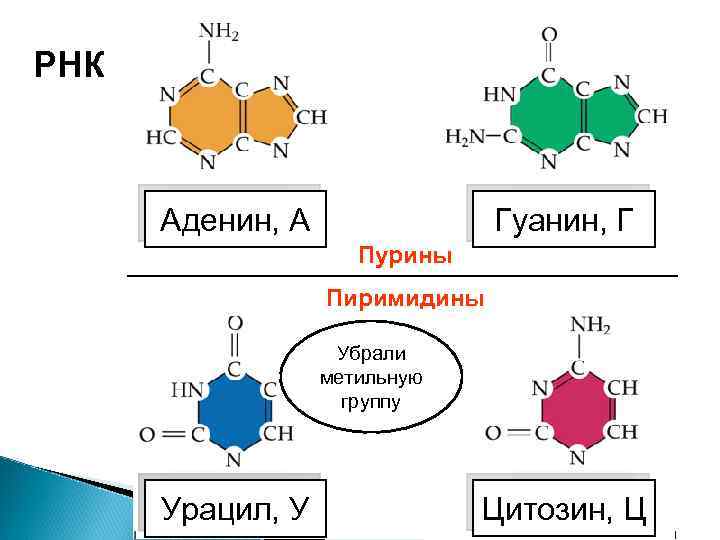
РНК ДНК Аденин, А Гуанин, Г Пурины Пиримидины Убрали метильную группу Тимин, У Урацил, Т Цитозин, Ц
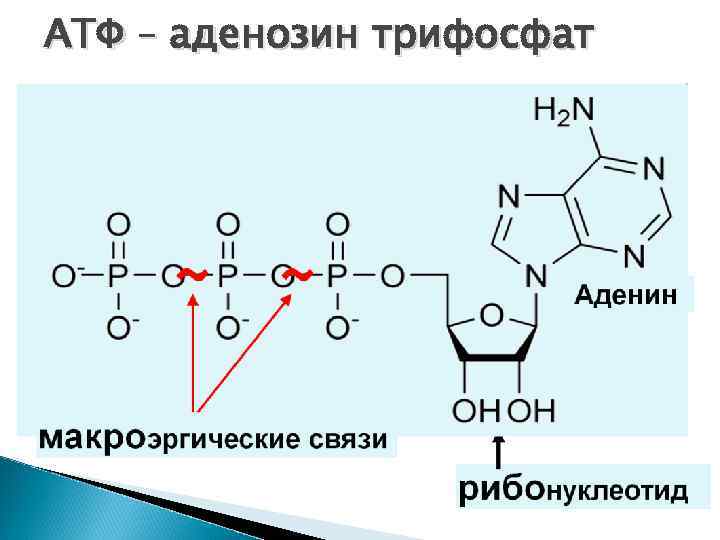
АТФ – аденозин трифосфат
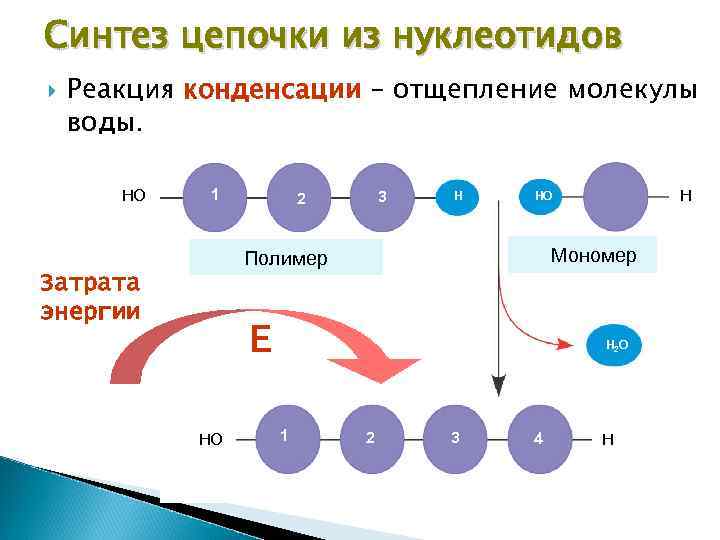
Синтез цепочки из нуклеотидов Реакция конденсации – отщепление молекулы воды. HO 1 3 2 H Мономер Полимер Затрата энергии Е HO H 2 O 1 2 3 4 H
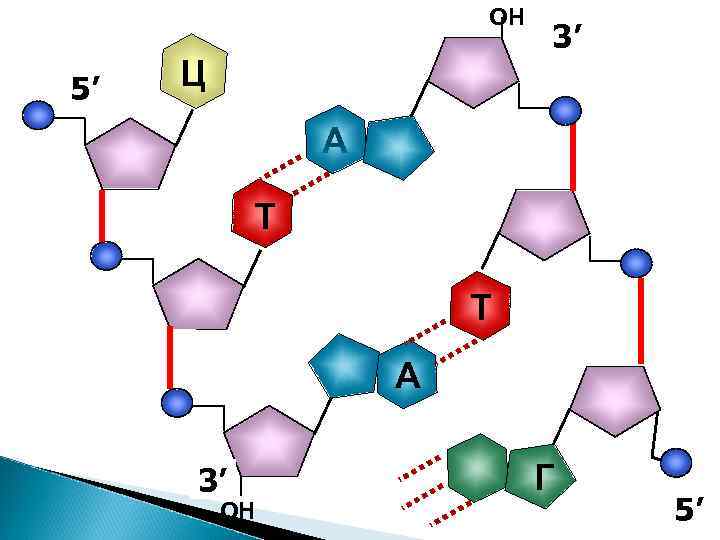
Ц 5’ 3’ ОН Т
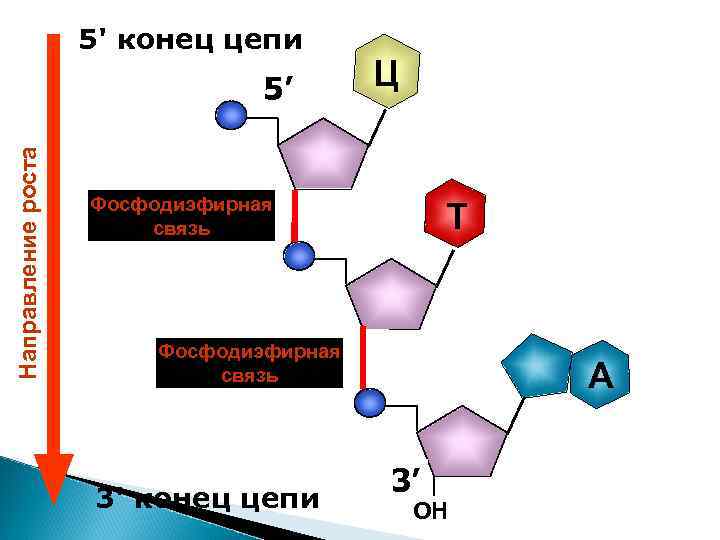
5' конец цепи Ц Направление роста 5’ Фосфодиэфирная связь Т 3’ Фосфодиэфирная ОН связь 3' конец цепи 5’ 3’ ОН A

Растущий конец – всегда 3´ для всех нуклеиновых кислот – ДНК и РНК

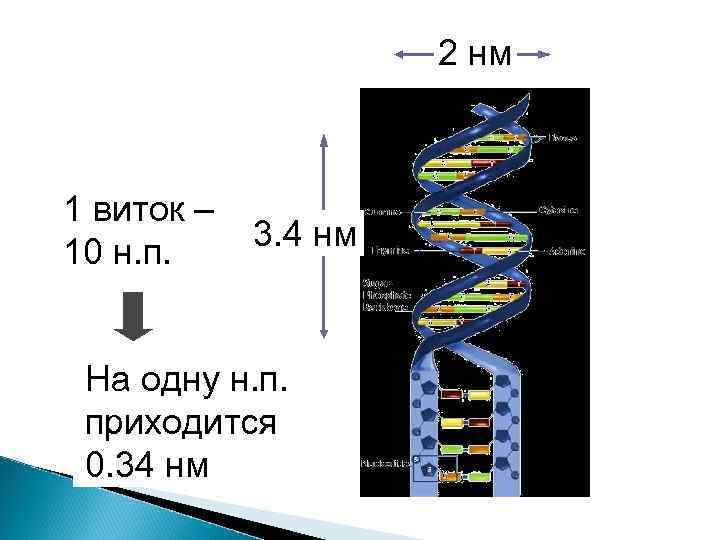
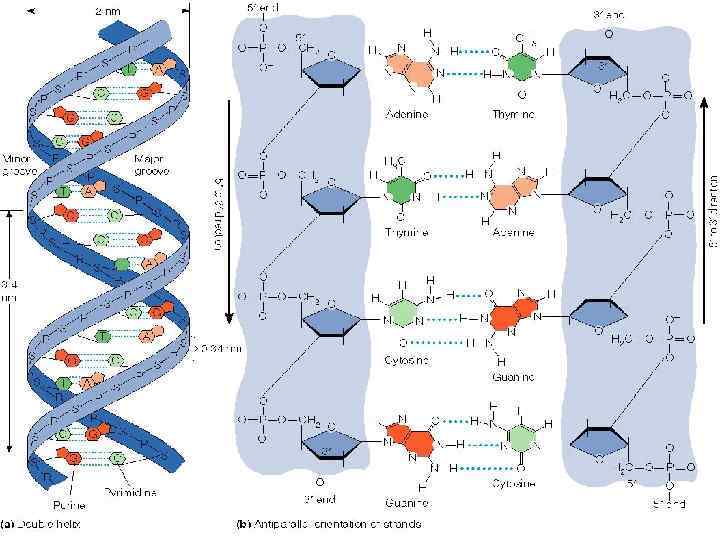
Строение ДНК

1950 Правила Чаргаффа Эрвин Чаргафф
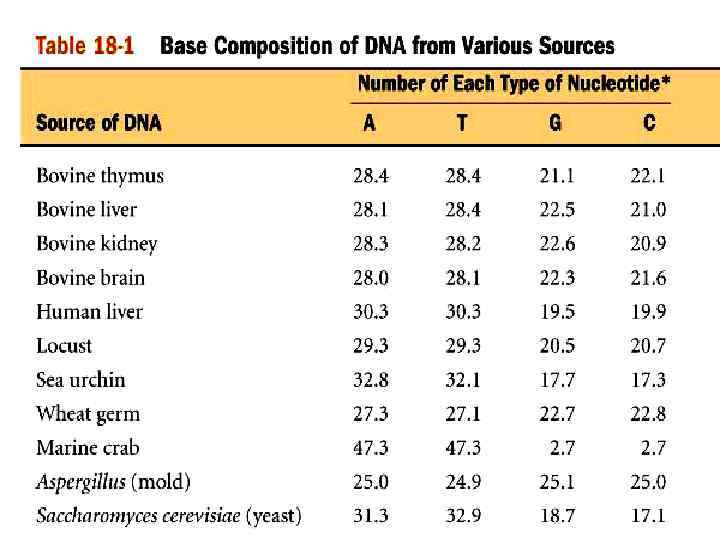
![Правила Чаргаффа [ А ] + [ Г ] = [ Т ] + Правила Чаргаффа [ А ] + [ Г ] = [ Т ] +](https://present5.com/presentation/324096826_438411458/image-131.jpg)
Правила Чаргаффа [ А ] + [ Г ] = [ Т ] + [ Ц ] = 50%

Объяснение правилам Чаргаффа дали Уотсон и Крик ДНК – это 2 цепочки, соединенные по принципу комплементарности
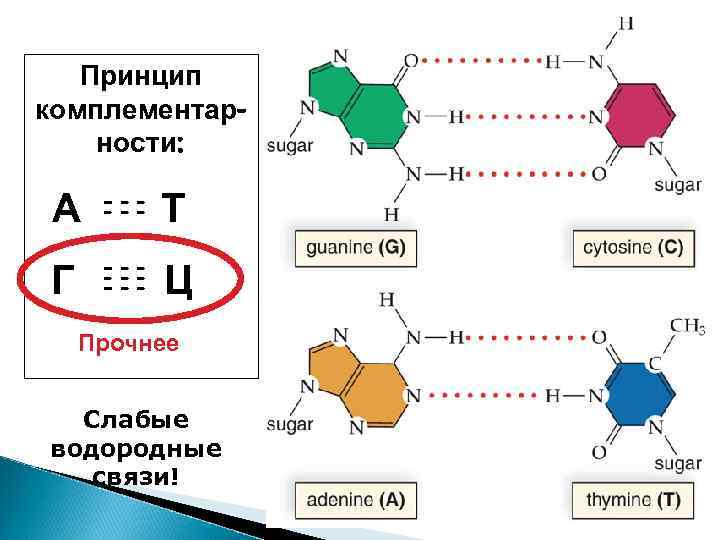
Принцип комплементарности: А ----- Т Г ------- Ц Прочнее Слабые водородные связи!
НО Ц 5’ 3’ A Т Т 3’ ОН 5’ 3’ ОН A Г 5’
2 нм 1 виток – 10 н. п. 3. 4 нм На одну н. п. приходится 0. 34 нм
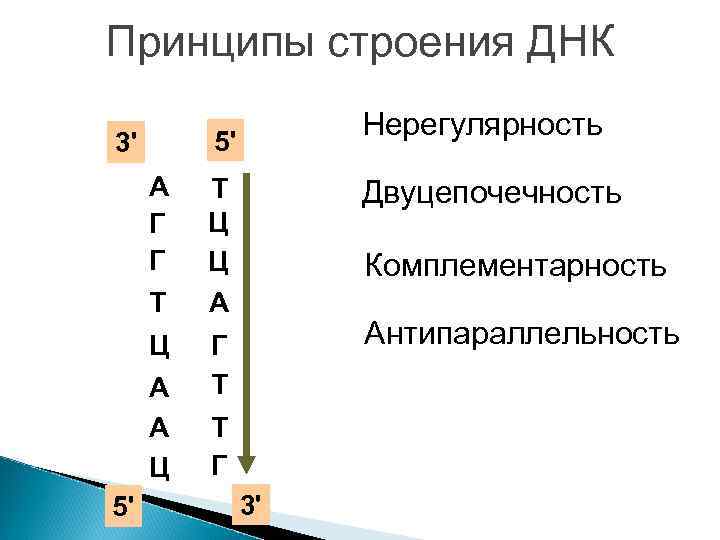
Принципы строения ДНК 5' 3' А Г Г Т Ц А А Ц 5' Нерегулярность Т Ц Ц А Двуцепочечность Комплементарность Антипараллельность Г Т Т Г 3'

Строение РНК

Отличия РНК от ДНК 1. Одноцепочечные молекулы 2. Сахар – рибоза вместо дезоксирибозы 3. 4. У вместо Т Намного меньше – сравнимы по размеру с белками.

Виды РНК 1. и-РНК = м-РНК информационная, матричная до 10 тысяч нуклеотидов линейная 2. т- РНК транспортная около 100 нуклеотидов 3. как и белки, р-РНК рибосомальная имеют 2 -3 тысячи нуклеотидов 3 -мерную конформацию
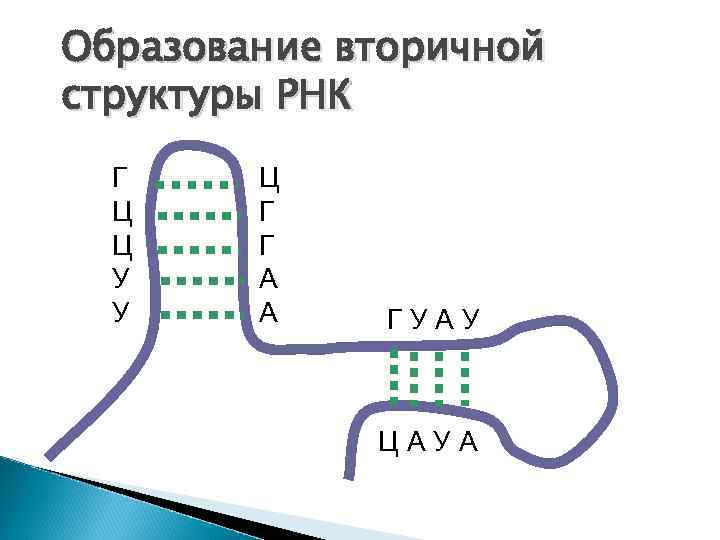
Образование вторичной структуры РНК Г Ц Ц У У Ц Г Г А А ГУАУ ЦАУА
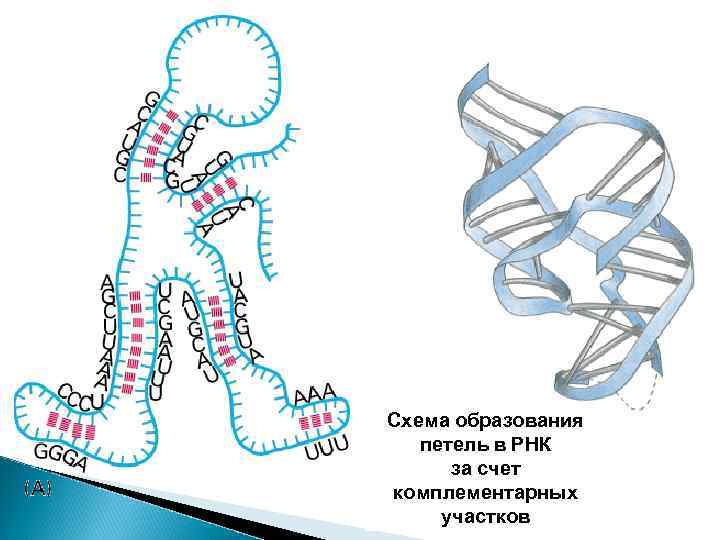
Схема образования петель в РНК за счет комплементарных участков
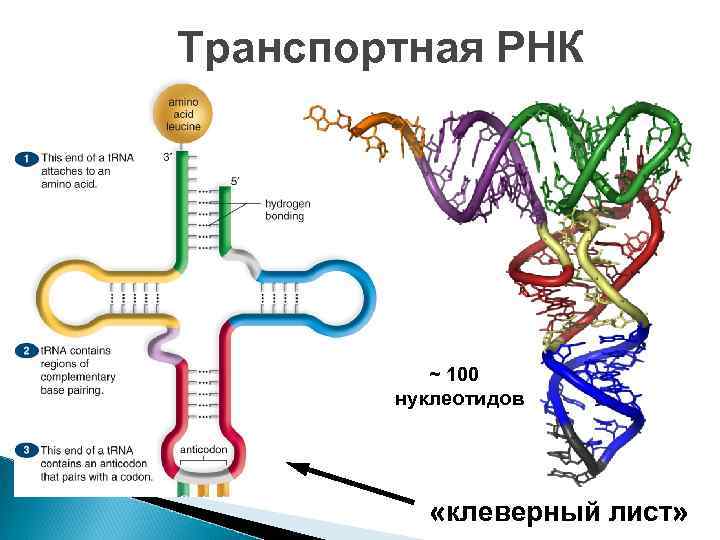
Транспортная РНК ~ 100 нуклеотидов «клеверный лист»
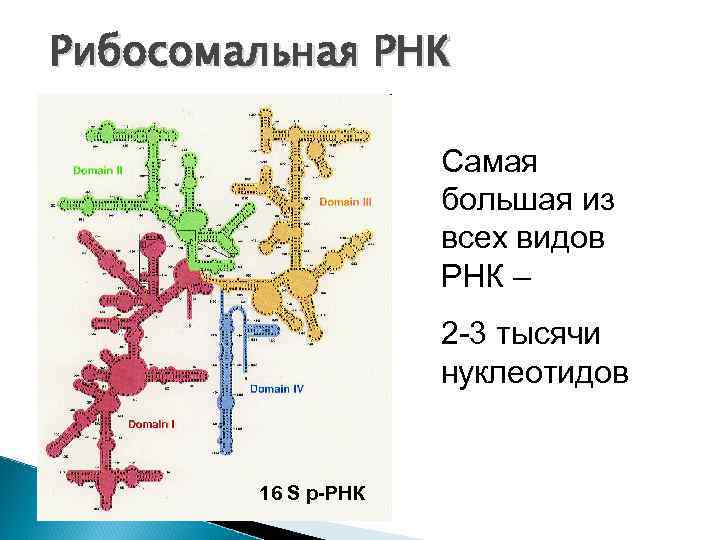
Рибосомальная РНК Самая большая из всех видов РНК – 2 -3 тысячи нуклеотидов 16 S р-РНК
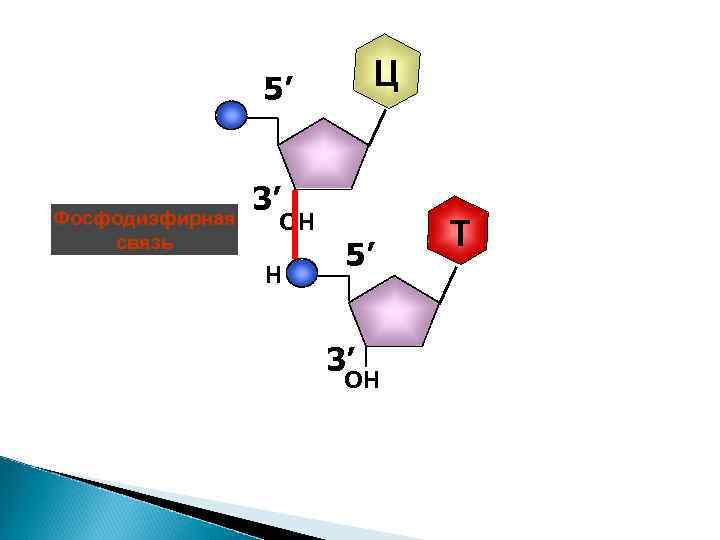
Ц 5’ Фосфодиэфирная связь 3’ ОН Н 5’ 3’ ОН Т
Ц 5’ 3’ ОН Т

Функции РНК в порядке их открытия 1. Информационная: 1950 -e реализация информации Все виды РНК – посредники в передаче информации от ДНК к белку ДНК РНК белок Место встречи всех трех РНК – рибосома ?

Функции РНК в порядке их открытия 1. Информационная: хранение информации (у части вирусов) Примерно 80% вирусов человека и животных использует для записи информации РНК У них она выполняет ту же роль, что ДНК у всех остальных организмов

Функции РНК в порядке их открытия Каталитическая 1982 Рибозимы – РНК-ферменты Не все РНК, а лишь некоторые: 2. р-РНК рибосом, РНК некоторых вирусов РНК в составе сплайсосомы

Функции РНК в порядке их открытия 3. Регуляторная 1990 -е Малые РНК регулируют работу генов в ядре и синтез белка в цитоплазме Аналогична функции ДНКсвязывающих белков

РНК сочетает свойства ДНК – принцип комплементарности, позволяющий матричное копирование молекулы Белков – трехмерную структуру, позволяющую выполнять самые разные функции (катализ, регуляцию, транспорт)
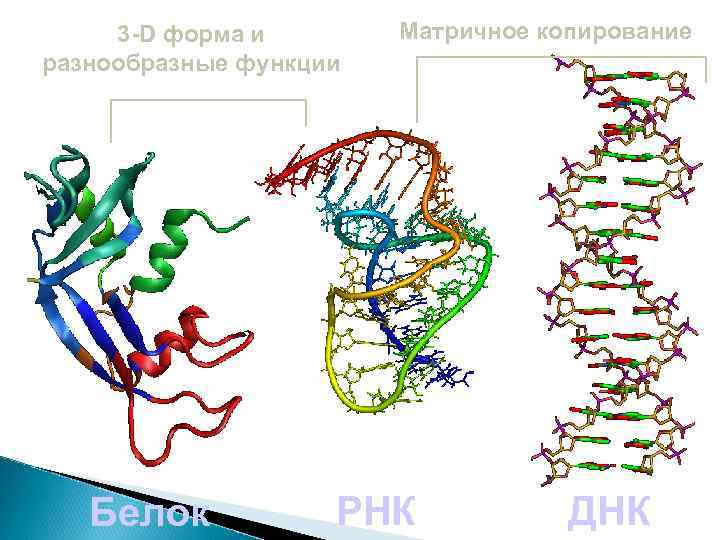
3 -D форма и разнообразные функции Белок Матричное копирование РНК ДНК

ИЛЛЮСТРАТИВНЫЙ МАТЕРИАЛ: Презентация (слайды) ◦ ◦ - - связь биохимии с другими науками; классификация белков; классификация сложных белков;

литература Основная: 1. Северин Е. С. «Биохимия» , М ГЭОТАР-МЕДИА, 2013 2. Сеитов З. С. «Биохимия» , Алматы, 2012 3, Harper’s Illusstated Biochemistry, 29 e, 2012 1. 2. 3. 4. дополнительная : Николаев А. Я. «Биологическая химия» , М. , 2007 Т. Т. Березов, Б. Ф. Коровкин «Биологическая химия» , 2002 г. Плешкова С. М. и др. «Учебное пособие для самостоятельного изучения биохимии» Часть 1 !Белки, ферменты, энергетический обмен, витамины!, Алматы, 2009 г Марри. , Греннер Д. , Мейес П. , Родуэлл В «Биохимия человека» В 2 -х томах перевод с англ. : Мир, 1993 – 384 с

КОНТРОЛЬНЫЕ ВОПРОСЫ Дайте определение биохимии как науки Ø 2. Понятие о сложных белках Ø 3. Назовите представителей истинных гликопротеинов Ø 4. Перечислите гликозамингликаны Ø 5. Назовите дыхательные белки Ø 6. Из чего состоят мононуклеотиды? Ø 1.
lektsia__1_Vvedenie_v_biokhimiyu_Belki_16-17.ppt