БОХ лекц.моносах..ppt
- Количество слайдов: 63

Кафедра биоорганической химии БГМУ Тема лекции 7: Моносахариды. Строение, таутомерные формы, реакционная способность, биологическое значение

УГЛЕВОДЫ l Углеводы – гетерофункциональные соединения являющиеся альдегидоили кетономногоатомными спиртами и их производными l Углеводы являются продуктами фотосинтеза и образуются в растениях из углекислого газа и воды под действием квантов солнечной энергии с участием хлорофилла


Функции углеводов l Являются субстратами для получения АТФ; l Являются запасным энергетическим материалом (крахмал, гликоген и др. ); l Выполняют структурную функцию (клетчатка); l Являются метаболитами и биорегуляторами; l Участвуют в межклеточном взаимодействии в функционировании иммунной системы и др.

Классификация углеводов По отношению к кислотному гидролизу и свойствам l моносахариды Сn. H 2 n. On n=3 -10 l олигосахариды (С 6 H 10 O 5)n n<10 l полисахариды (С 6 H 10 O 5)n n>10 l

МОНОСАХАРИДЫ циклические полуацетали альдегидоили кетономногоатомных спиртов, существующие в растворе в равновесии со своими таутомерными ациклическими формами

Классификация моносахаридов По функц. группам l Альдозы l Кетозы По числу атомов С l Триозы l Тетрозы l D- l Пентозы l L- l Гексозы

Классификация моносахаридов Таутомерные полуацетальные формы: а) по характеру цикла -пиранозы -фуранозы б) по конфигурации аномерного центра -α-формы
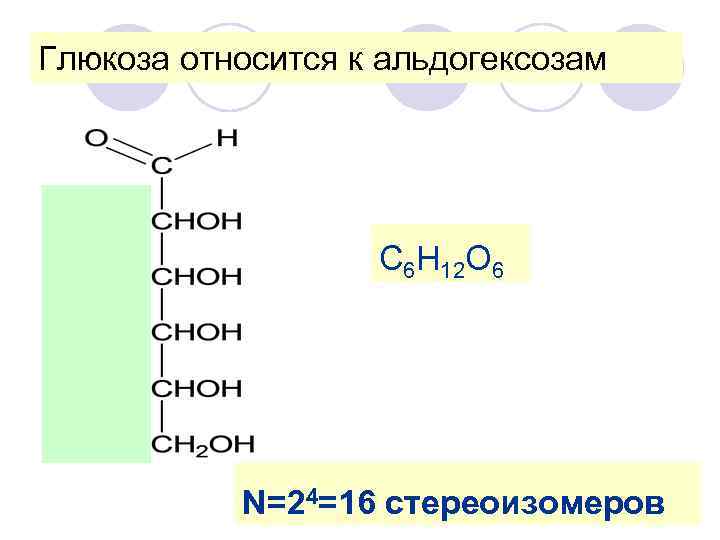
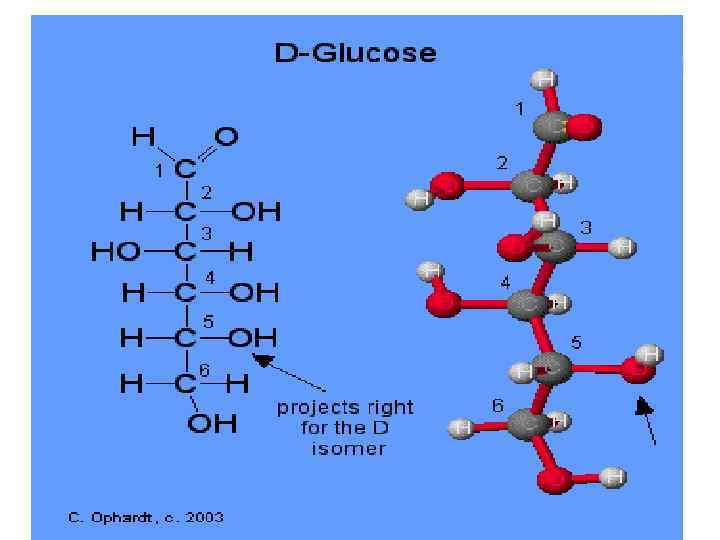
Глюкоза относится к альдогексозам С 6 H 12 O 6 N=24=16 стереоизомеров
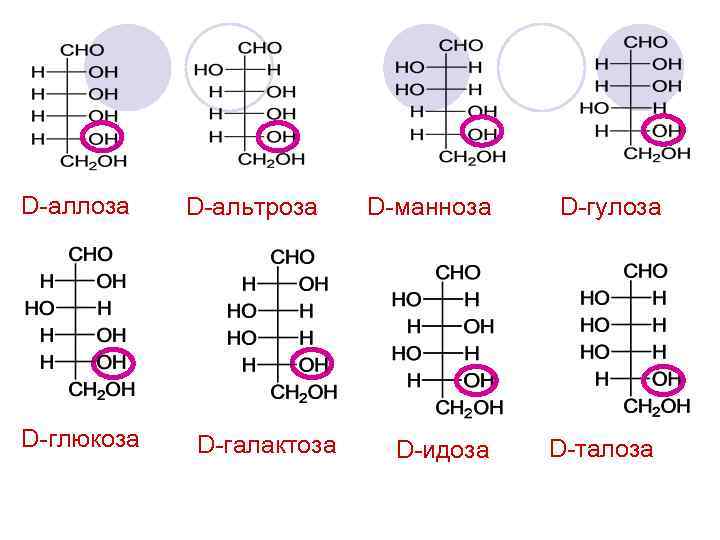
D-аллоза D-глюкоза D-альтроза D-галактоза D-манноза D-гулоза D-идоза D-талоза
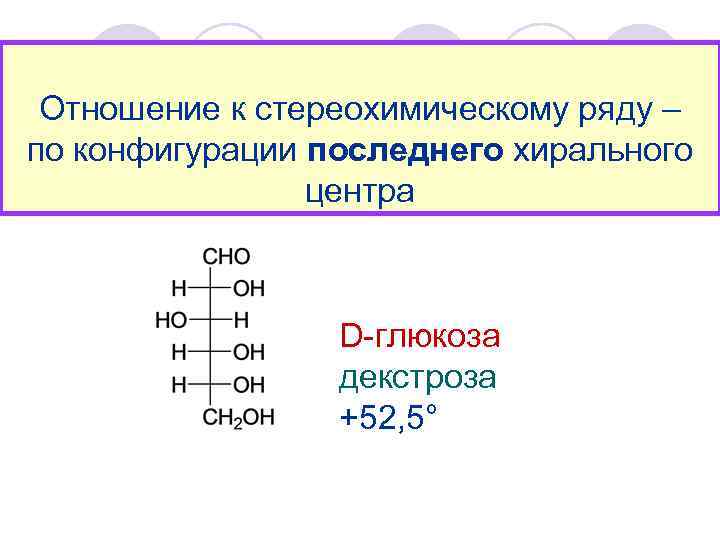
Отношение к стереохимическому ряду – по конфигурации последнего хирального центра D-глюкоза декстроза +52, 5°
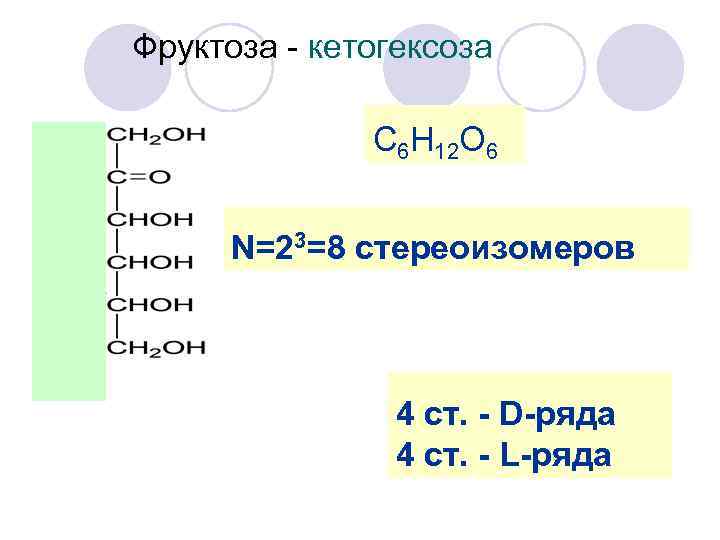
Фруктоза - кетогексоза С 6 H 12 O 6 N=23=8 стереоизомеров 4 ст. - D-ряда 4 ст. - L-ряда
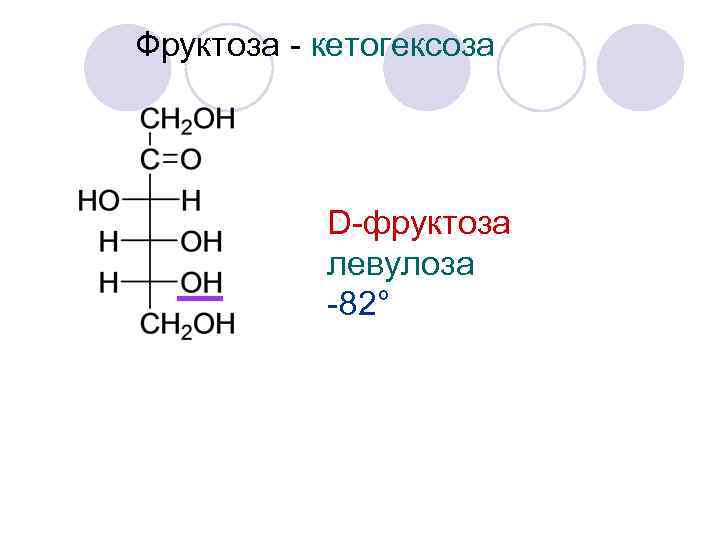
Фруктоза - кетогексоза D-фруктоза левулоза -82°
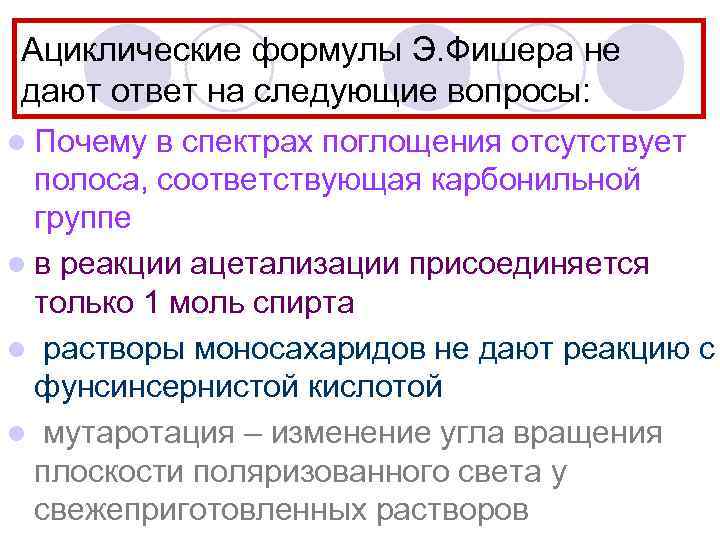
Ациклические формулы Э. Фишера не дают ответ на следующие вопросы: l Почему в спектрах поглощения отсутствует полоса, соответствующая карбонильной группе l в реакции ацетализации присоединяется только 1 моль спирта l растворы моносахаридов не дают реакцию с фунсинсернистой кислотой l мутаротация – изменение угла вращения плоскости поляризованного света у свежеприготовленных растворов
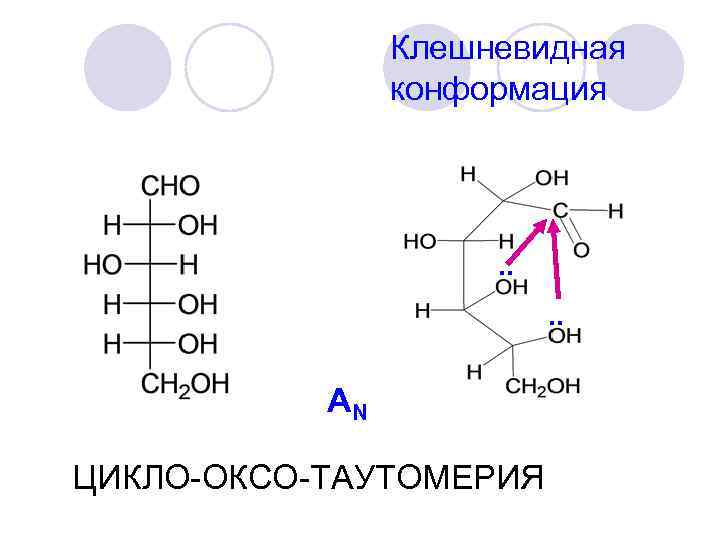
Клешневидная конформация . . AN ЦИКЛО-ОКСО-ТАУТОМЕРИЯ
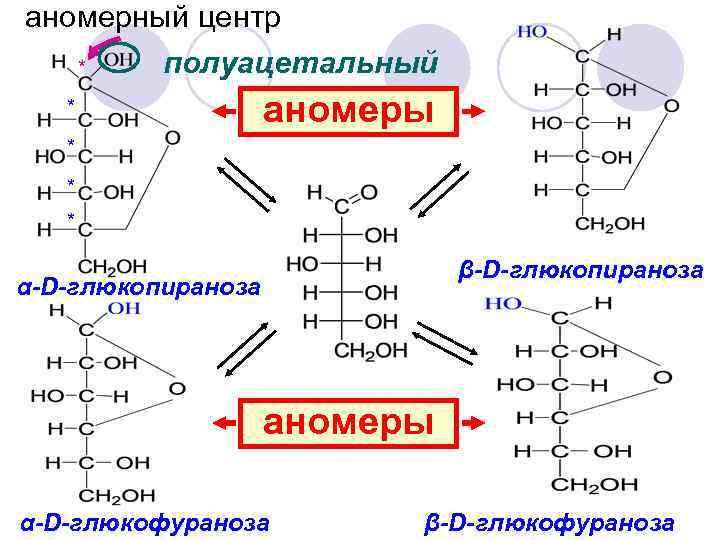
аномерный центр полуацетальный * * аномеры * * * β-D-глюкопираноза α-D-глюкопираноза аномеры α-D-глюкофураноза β-D-глюкофураноза

Аномеры являются диастереомерами В растворе глюкозы – 0. 01% ациклической формы 99. 9% циклические lв спектрах поглощения отсутствует полоса, соответствующая карбонильной группе l растворы моносахаридов не дают реакцию с фуксинсернистой кислотой

МУТАРОТАЦИЯ l Меняющийся угол вращения плоскости поляризованного света у свежеприготовленных растворов моносахаридов в течение определенного времени (1, 5 – 2 часа)

Мутаротация В растворе преобладают пиранозные формы α-D-глюкопираноза +112, 5 β-D-глюкопираноза +19, 5 Равновесия устанавливается через 1, 5 -2 ч. +52, 5 2/3 β-D-глюкопираноза ⇄1/3 α-Dглюкопираноза Переход осуществляется только через открытую форму
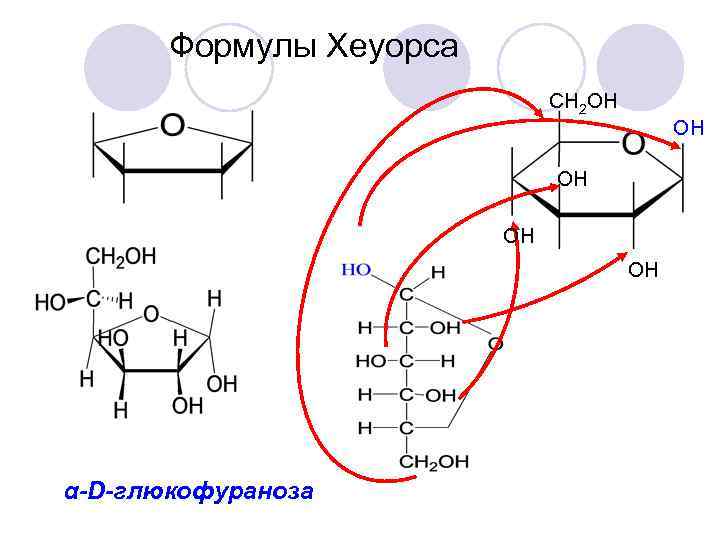
Формулы Хеуорса СН 2 ОН ОН ОН α-D-глюкофураноза
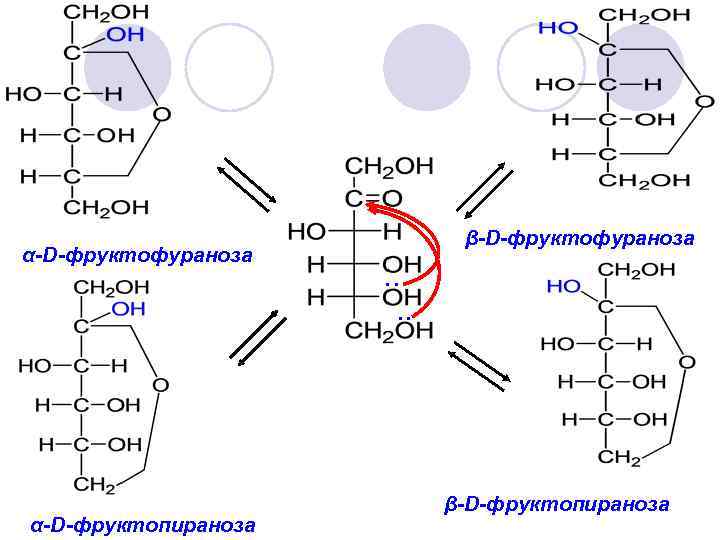
α-D-фруктофураноза α-D-фруктопираноза β-D-фруктофураноза . . β-D-фруктопираноза
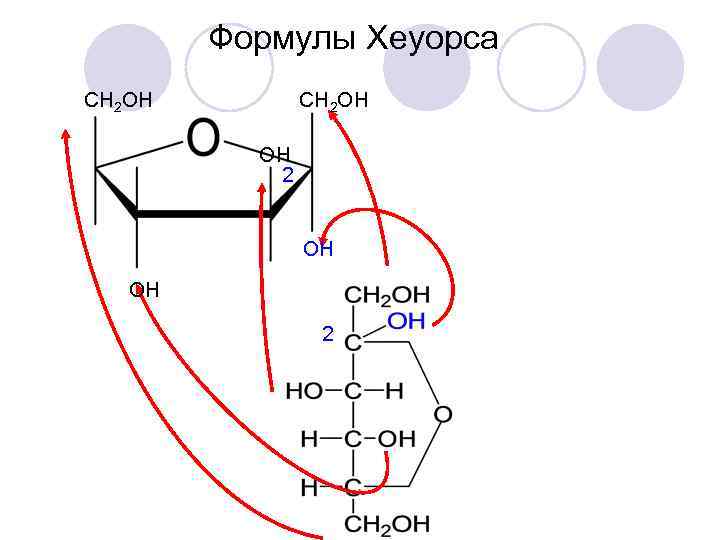
Формулы Хеуорса СН 2 ОН ОН 2
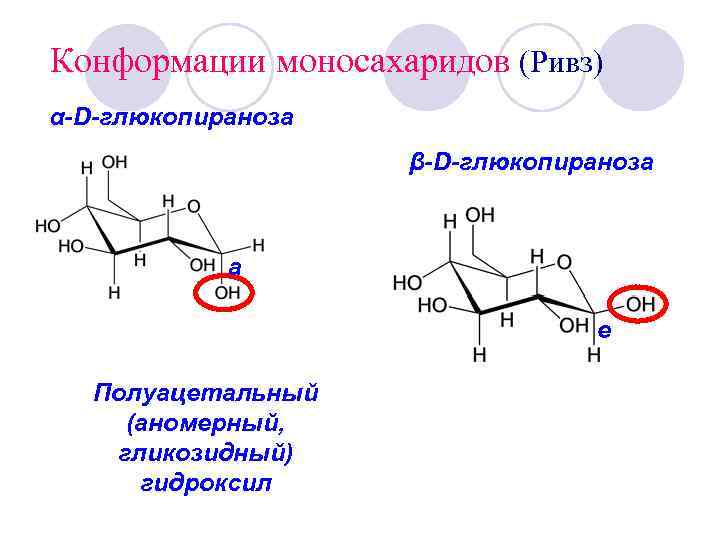
Конформации моносахаридов (Ривз) α-D-глюкопираноза β-D-глюкопираноза а е Полуацетальный (аномерный, гликозидный) гидроксил
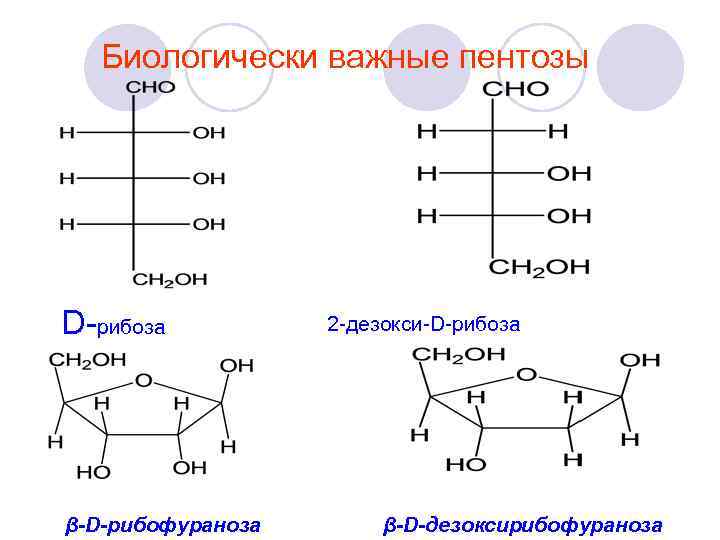
Биологически важные пентозы D-рибоза β-D-рибофураноза 2 -дезокси-D-рибоза β-D-дезоксирибофураноза
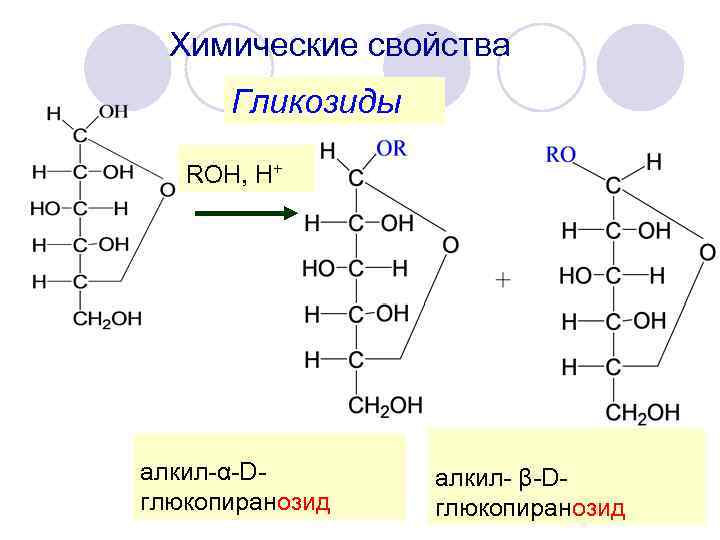
Химические свойства Гликозиды ROH, Н+ алкил-α-Dглюкопиранозид алкил- β-Dглюкопиранозид

гликозиды - ацетали гликозиды гидролизуются только в кислой среде гликозиды не мутаротируют Состоят из углеводной части и агликона

Различают пиранозиды фуранозиды О-гликозиды N-гликозиды S-гликозиды

Сердечные гликозиды l Это О-гликозиды растительного происхождения, у которых роль агликона выполняют соединения стерановой структуры. Они обладают способностью усиливать сократительную способность сердечной мышцы и используются для лечения сердечной недостаточности. Содержатся в наперстянке, ландыше, горицвете и др.
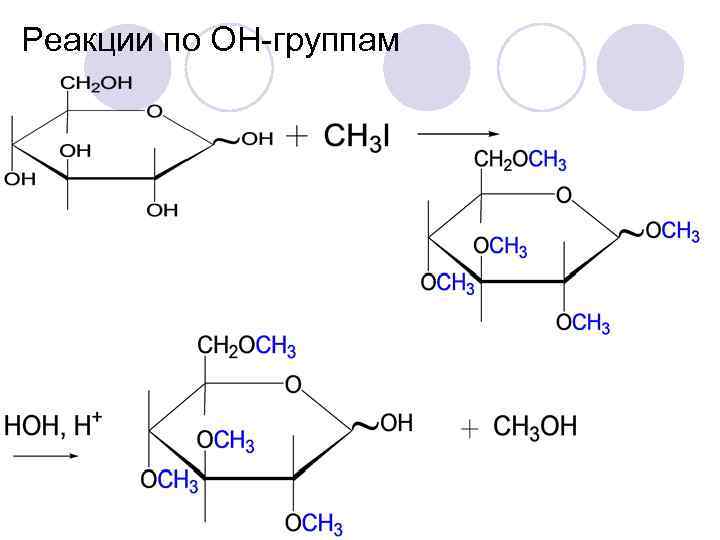
Реакции по ОН-группам
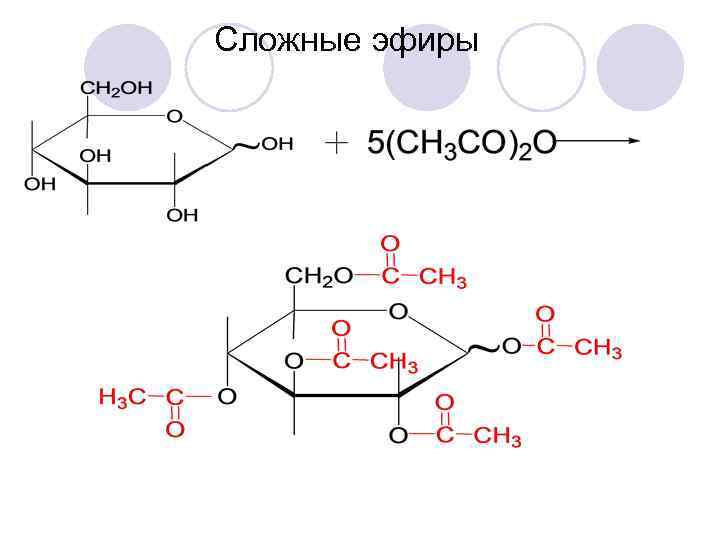
Сложные эфиры
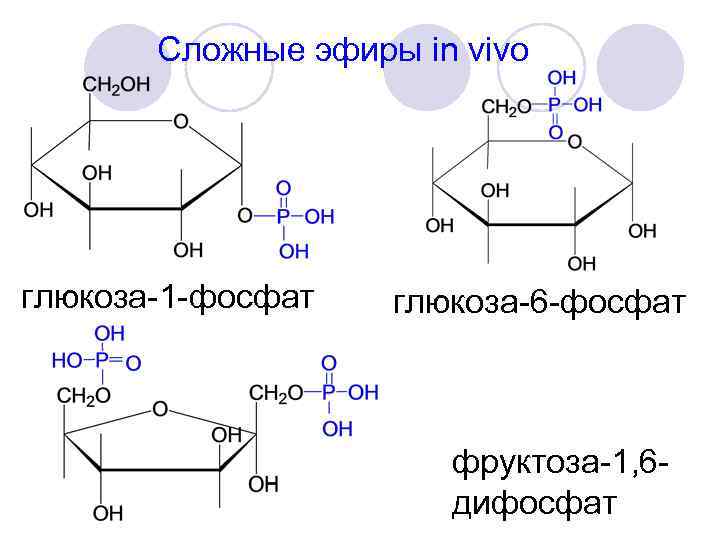
Сложные эфиры in vivo глюкоза-1 -фосфат глюкоза-6 -фосфат фруктоза-1, 6 дифосфат
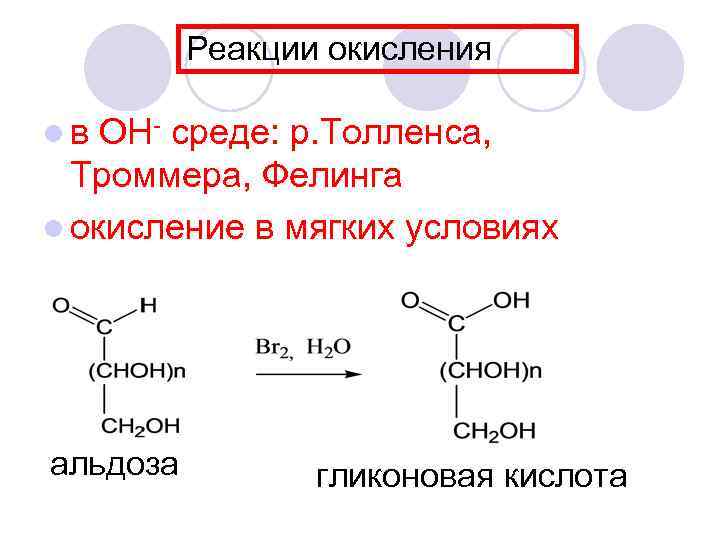
Реакции окисления lв ОН- среде: р. Толленса, Троммера, Фелинга l окисление в мягких условиях альдоза гликоновая кислота
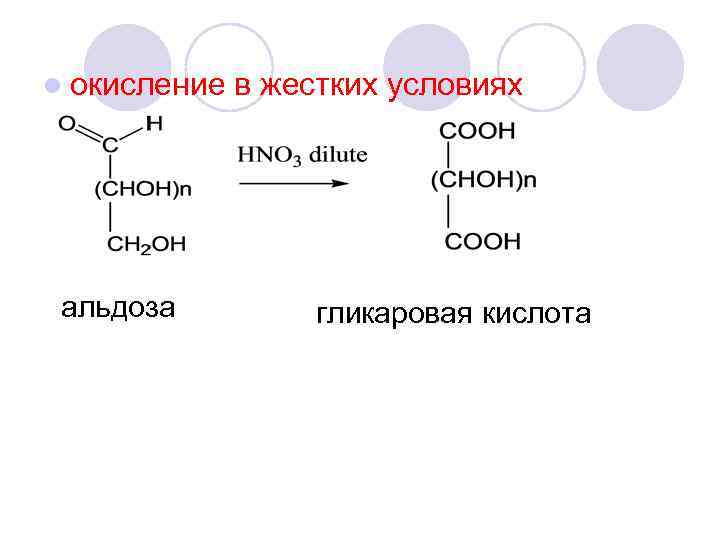
l окисление альдоза в жестких условиях гликаровая кислота
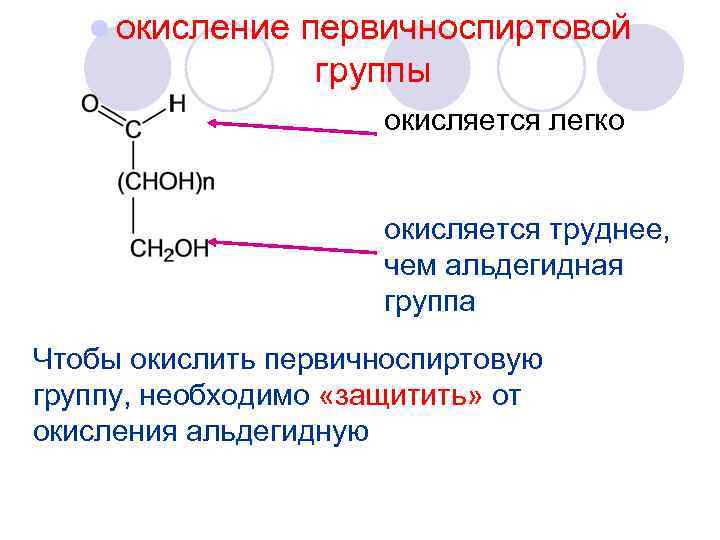
l окисление первичноспиртовой группы окисляется легко окисляется труднее, чем альдегидная группа Чтобы окислить первичноспиртовую группу, необходимо «защитить» от окисления альдегидную
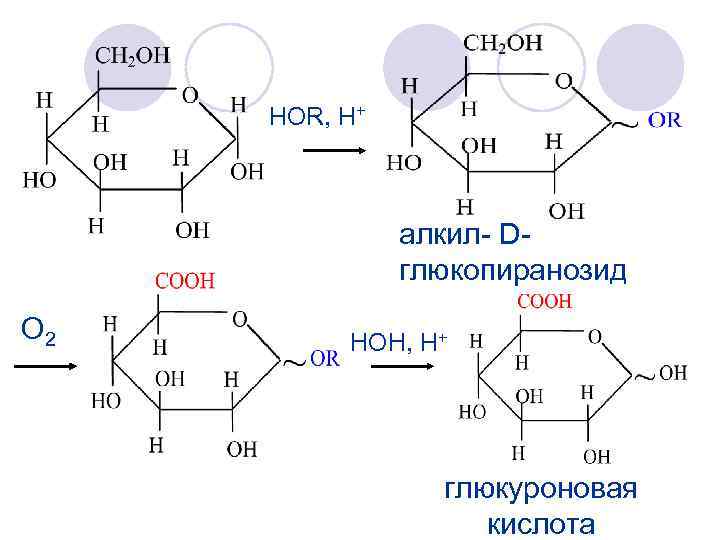
HOR, H+ алкил- Dглюкопиранозид O 2 НОН, H+ глюкуроновая кислота
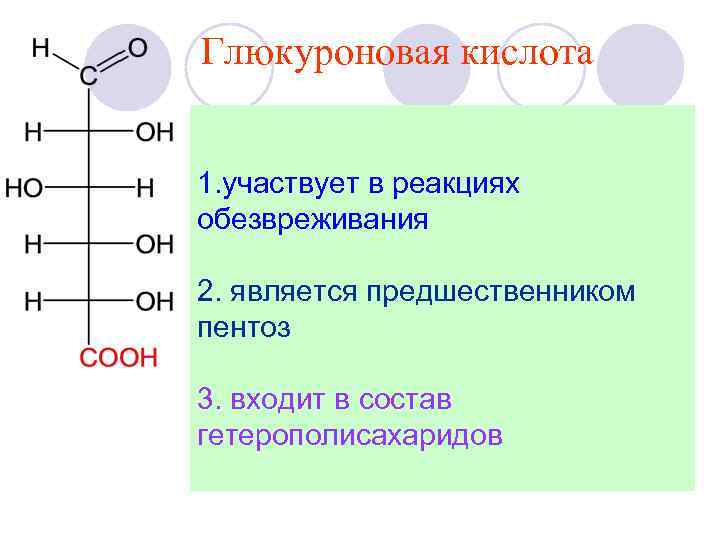
Глюкуроновая кислота 1. участвует в реакциях обезвреживания 2. является предшественником пентоз 3. входит в состав гетерополисахаридов
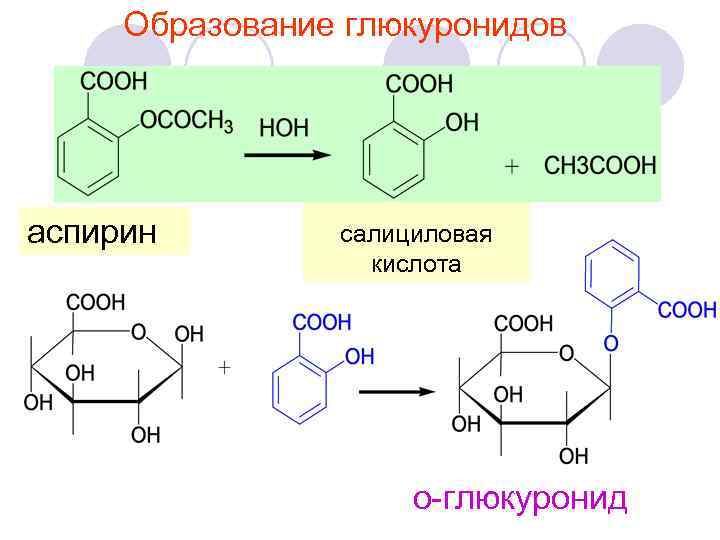
Образование глюкуронидов аспирин салициловая кислота о-глюкуронид
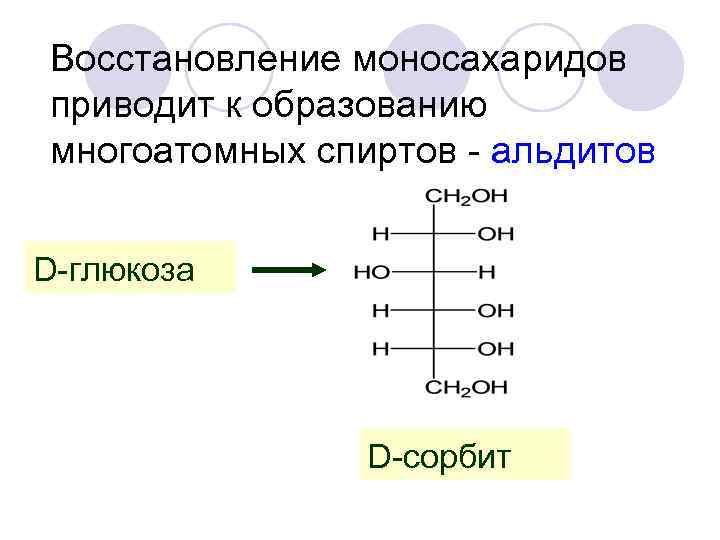
Восстановление моносахаридов приводит к образованию многоатомных спиртов - альдитов D-глюкоза D-сорбит
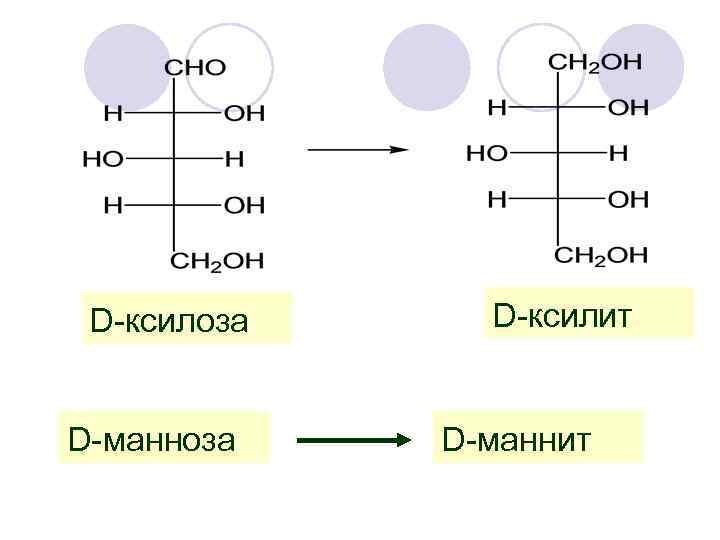
D-ксилоза D-манноза D-ксилит D-маннит

Эпимеры l Это стереоизомеры, отличающиеся конфигурацией только 1 хирального центра (кроме аномерного и и последнего хирального)

D-манноза эпимеры по С-2 D-глюкоза D-галактоза эпимеры по С-4
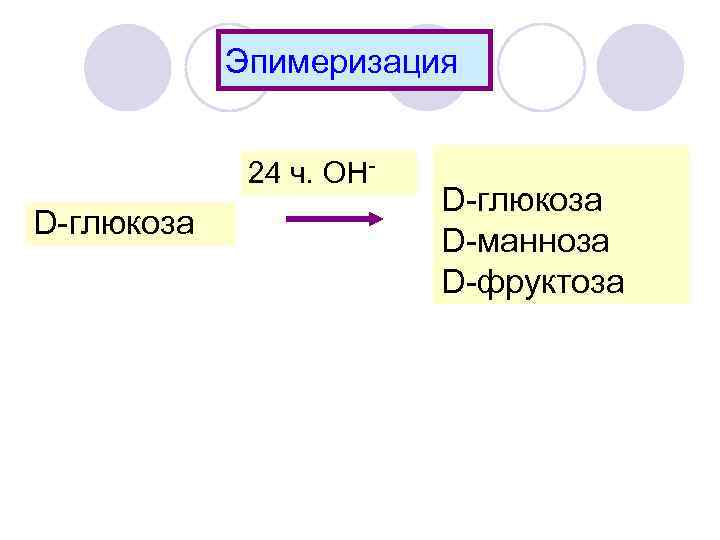
Эпимеризация 24 ч. ОН- D-глюкоза D-манноза D-фруктоза
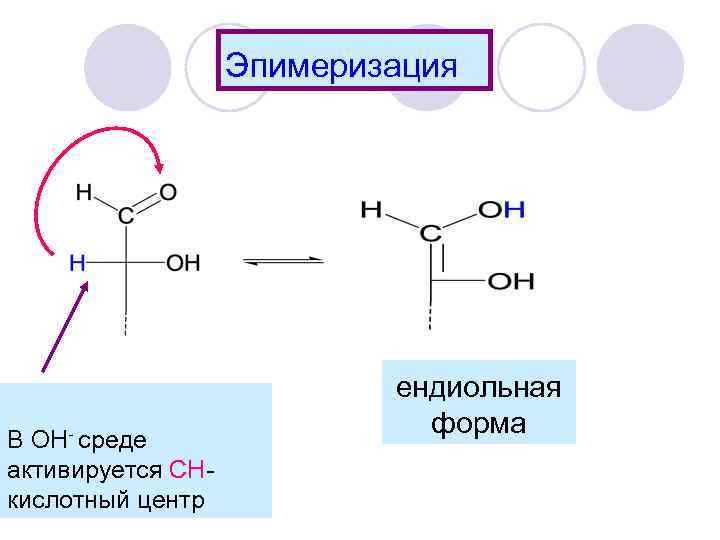
Эпимеризация В ОН- среде активируется СНкислотный центр ендиольная форма
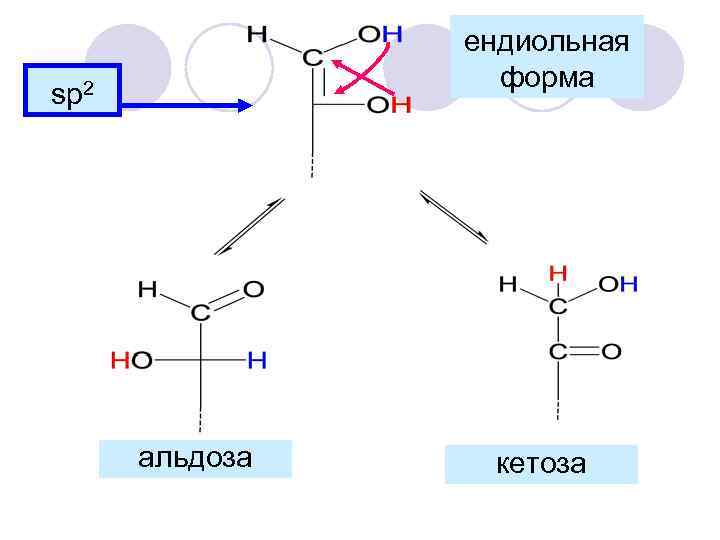
ендиольная форма sp 2 альдоза кетоза
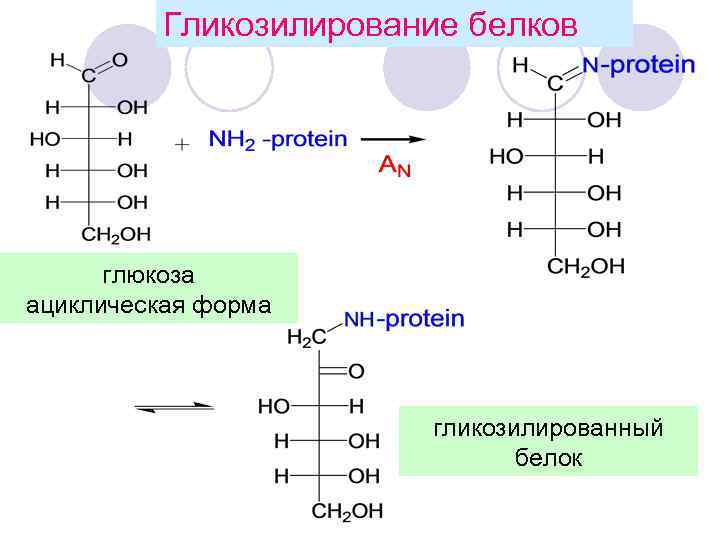
Гликозилирование белков глюкоза ациклическая форма гликозилированный белок

Реакции брожения l Брожение – процесс анаэробного расщепления органических веществ, происходящий под влиянием ферментов микроорганизмов l Спиртовое брожение (дрожжи) глюкоза → ПВК → С 2 Н 5 ОН + СО 2

Спирт медицинский (ректификат) l В результате спиртового брожения образуется брага, содержащая 16 -18% этанола. Ее подвергают перегонке или вымораживанию и получают спирт-сырец, который содержит сивушные масла и другие примеси. Его подвергают фракционной перегонке. Фракция, кипящая при 85, 5° и содержащая 96% этанола (4% вода), и является спиртом - ректификатом
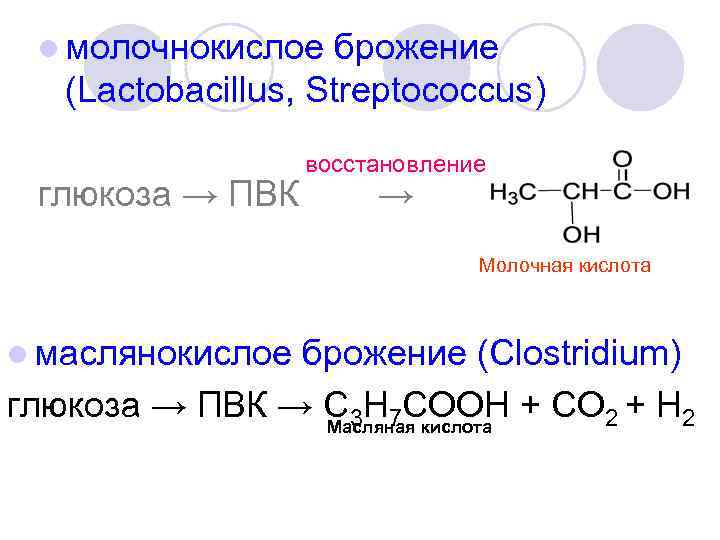
l молочнокислое брожение (Lactobacillus, Streptococcus) глюкоза → ПВК восстановление → Молочная кислота l маслянокислое брожение (Clostridium) глюкоза → ПВК → С 3 Н 7 COОН + СО 2 + H 2 Масляная кислота
![l лимоннокислое брожение (Aspergillus) глюкоза + [O]→ + HOH l лимоннокислое брожение (Aspergillus) глюкоза + [O]→ + HOH](https://present5.com/presentation/17146331_106332180/image-52.jpg)
l лимоннокислое брожение (Aspergillus) глюкоза + [O]→ + HOH
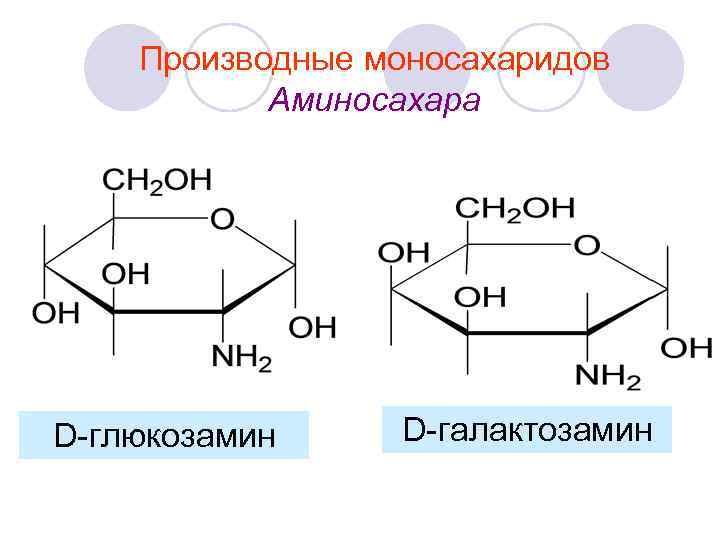
Производные моносахаридов Аминосахара D-глюкозамин D-галактозамин
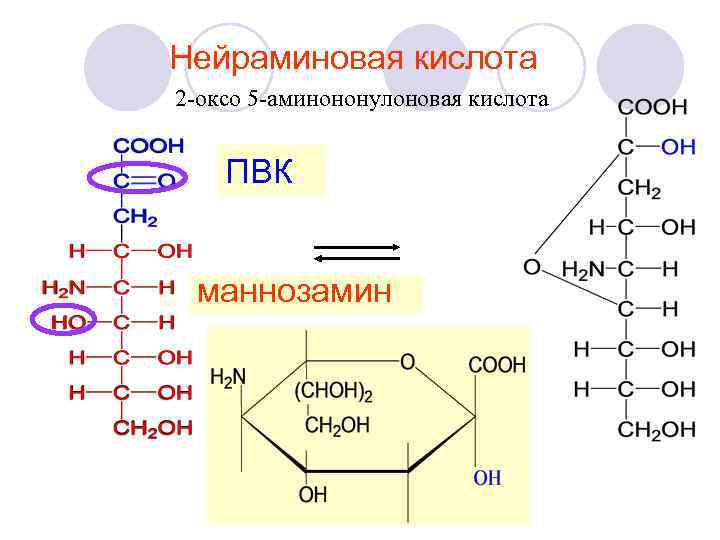
Нейраминовая кислота 2 -оксо 5 -аминононулоновая кислота ПВК маннозамин
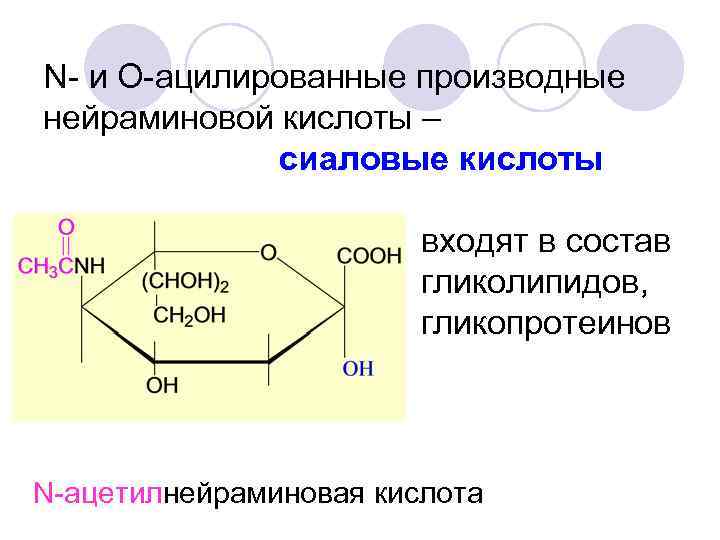
N- и O-ацилированные производные нейраминовой кислоты – сиаловые кислоты входят в состав гликолипидов, гликопротеинов N-ацетилнейраминовая кислота
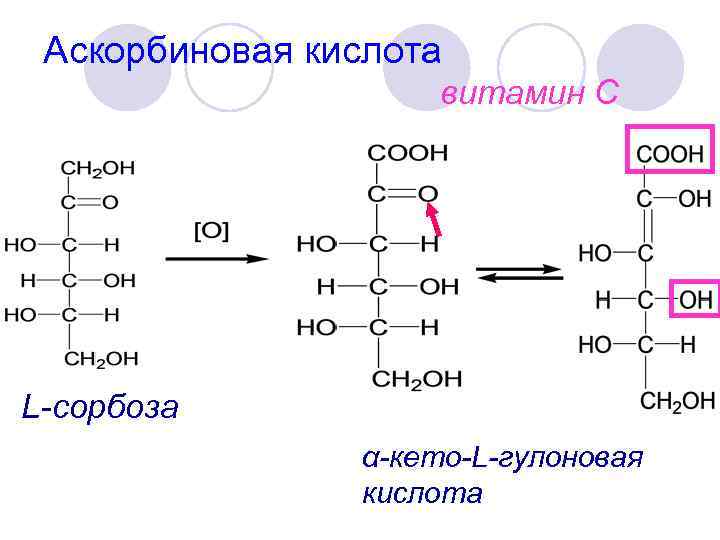
Аскорбиновая кислота витамин С L-сорбоза α-кето-L-гулоновая кислота
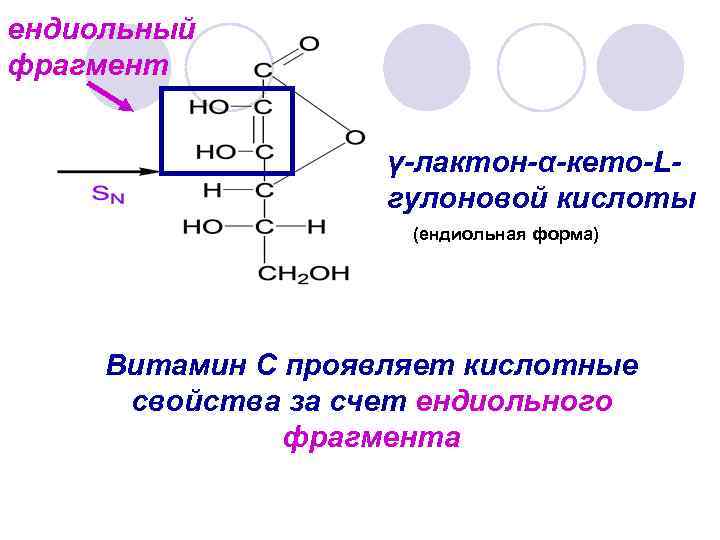
ендиольный фрагмент γ-лактон-α-кето-Lгулоновой кислоты (ендиольная форма) Витамин С проявляет кислотные свойства за счет ендиольного фрагмента
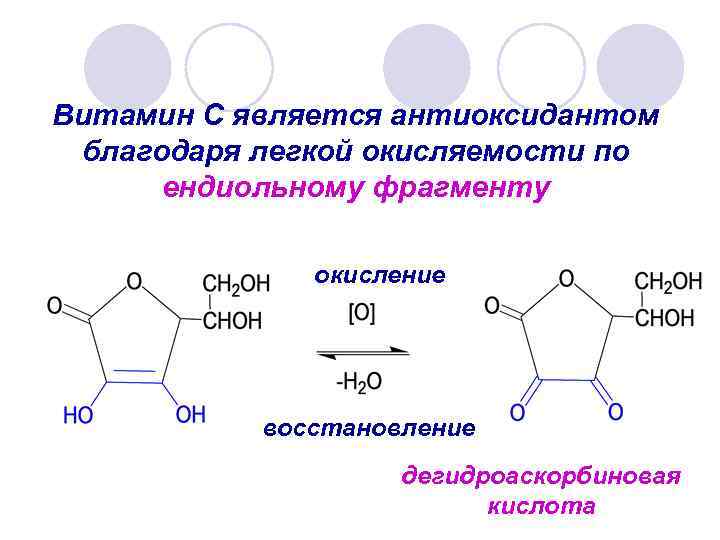
Витамин С является антиоксидантом благодаря легкой окисляемости по ендиольному фрагменту окисление восстановление дегидроаскорбиновая кислота





БОХ лекц.моносах..ppt