белки.ppt
- Количество слайдов: 101

Кафедра биоорганической химии БГМУ Тема лекции 10: ПЕПТИДЫ, БЕЛКИ. УРОВНИ ОРГАНИЗАЦИИ БЕЛКОВЫХ МОЛЕКУЛ 1 Мемориал Л. Полинга в Колд Спринг Харбор

Пептиды и белки представляют собой соединения, построенные из остатков -аминокислот, соединенных пептидной (амидной связью) Пептиды имеют в своей структуре до 70 аминокислотных остатков 2
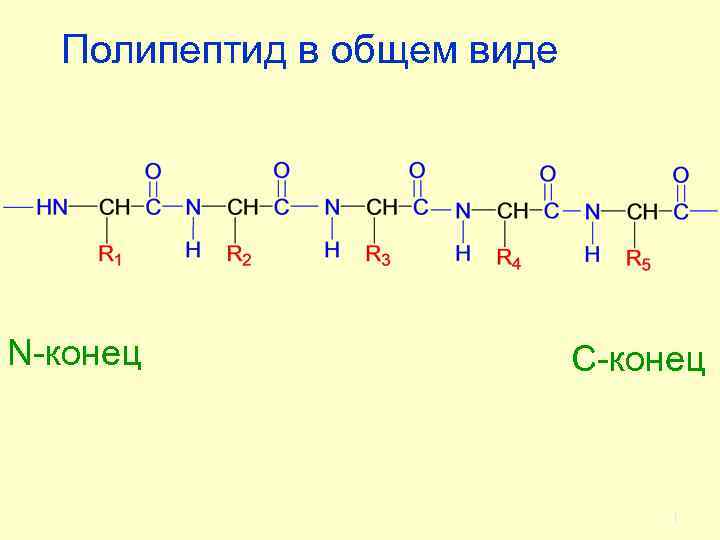
Полипептид в общем виде N-конец С-конец 3

аланилсерилтирозин Ala-Ser-Tyr 4

НАЗВАНИЯ НЕКОТОРЫХ АМИНОКИСЛОТНЫХ ОСТАТКОВ Glu-глутамил Gln-глутаминил Asp-аспартил Asn-аспарагинил 5
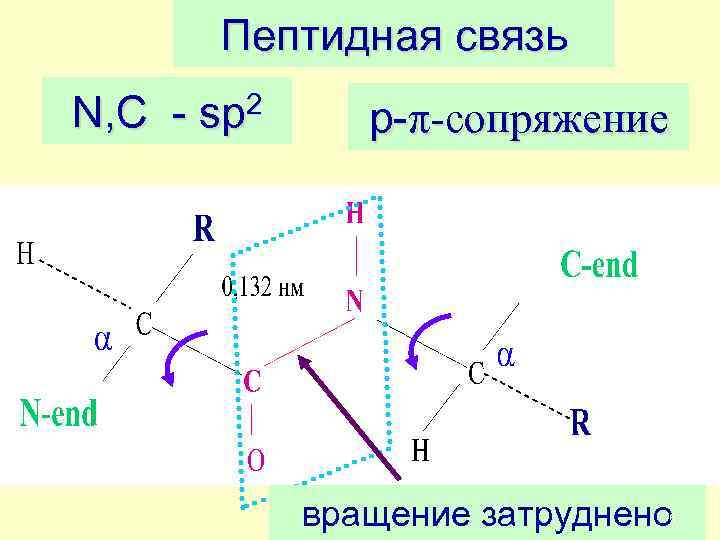
Пептидная связь N, C - sp 2 p-π-сопряжение вращение затруднено 6

ü В пептидной группе –CONHатомы C, O, N в sp 2 –гибридизации и лежат в одной плоскости ü Неподеленная пара электронов атома N вступает в сопряжение с πэлектронами двойной связи С=О (p-πсопряжение) ü Связь C–N становится короче , 0, 132 нм против 0, 147 нм; а связь С=О удлиняется до 0, 124 нм против 0, 121 нм 7

ü Электронное строение предопределяет жесткую плоскостную структуру пептидной группы. Барьер вращения равен 53 -84 к. Дж/моль. ü α-Атомы углерода находятся в транс-положении üВ полипептидной цепи плоскости пептидных групп расположены под углом друг к другу и соединены между собой α-атомами углерода 8

0, 38 нм 0, 28 нм R C =0, 15 нм 9

Вытянутая полипептидная цепь 10

Кислотно-основные свойства пептидов u Кислые пептиды: альбумин, пепсин, казеин 11
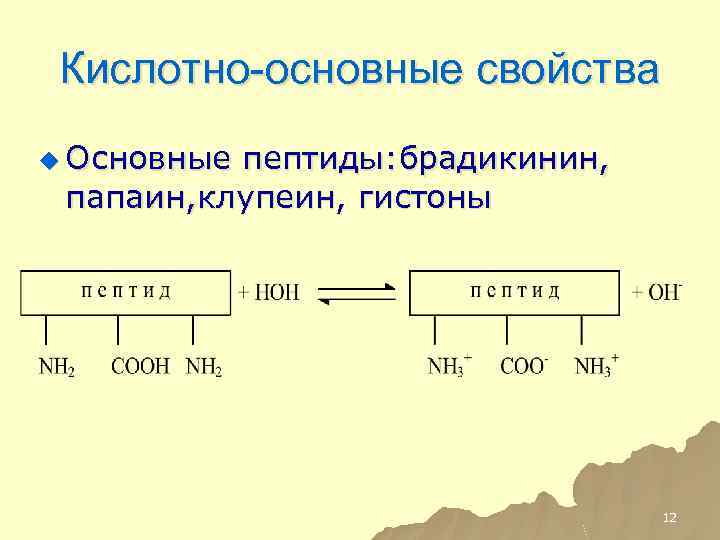
Кислотно-основные свойства u Основные пептиды: брадикинин, папаин, клупеин, гистоны 12

Кислотно-основные свойства u Нейтральные пептиды и белки: гемоглобин 13

Классификация и номенклатура пептидов Олигопептиды До 10 АК остатков Полипептиды От 10 до 70 АК остатков Перечисляют названия АК-остатков, начиная с N-конца, с добавлением суффикса – ил. Для С-концевой АК сохраняется ее полное название 14

Биологическая и медицинская значимость пептидов u Пептиды в организме выполняют важные и разнообразные функции: являются участниками процессов обмена, биорегуляторами (гормонами, нейромедиаторами), медиаторами иммунной системы и, кроме того, используются в виде лекарственных средств 15

Классический синтез пептидов в растворе Стратегия синтеза: 1. Защита NH 2 -группы 1 -й АМК 2. Активация СООН-группы 1 -й АМК 3. Защита СООН-группы 2 -й АМК 16

Защищающие группы u u u u Должны: Полностью блокировать соответствующую группировку; Быть устойчивыми в ходе удаления других защитных групп; Не вызывать побочных реакции и рацемизации; Защищенные производные должны хорошо идентифицироваться и выделяться; Не должны вызывать осложнений с растворением и выделением пептидов; При их удалении не должна разрушаться пептидная связь. 17

Классический синтез дипептида ала-вал 18

продолжение синтеза 19

Твердофазный синтез пептидов (Меррифилд) 20

Основные функции пептидов 1. регуляторная (рилизинг-факторы или либерины, нейромедиаторы); 2. гормональная (окситоцин, вазопрессин, брадикинин, гастрин и др. ); 3. антибиотическая (грамицидин А, В, С, S; актиномицин D, валиномицин и др. ); 4. антиоксидантная (глутатион и др. ); 5. функция витаминов (фолиевая кислота); 6. пептидные алкалоиды (эрготамин и др. ); 7. токсины (фаллоидин, амантидин и др. ). 21

Строение окситоцина Синт в гипотал, в гипофиз: сокр муск матки, стим лактацию 1953 г. Винсент Дю Виньо (первый синтез) 22

Строение пенициллина Остаток цистеина Остаток D-валина 23

Фаллоидин из бледной поганки 24

Аспартам Е 951, в 200 раз слаще сахарозы 25
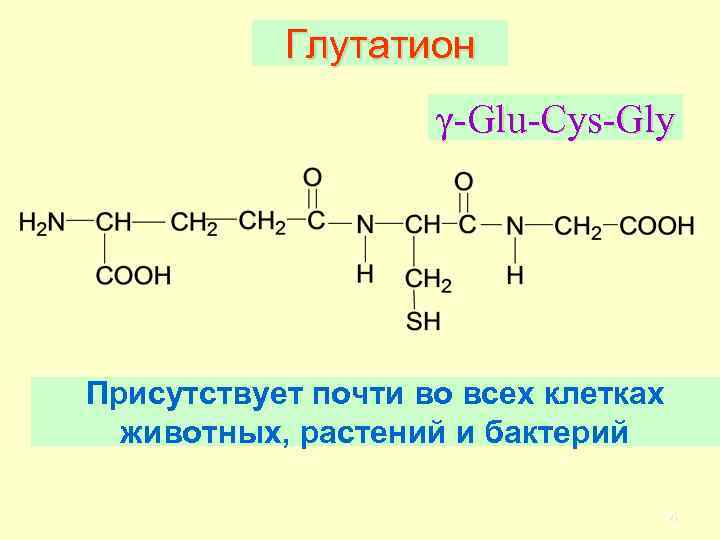
Глутатион γ-Glu-Cys-Gly Присутствует почти во всех клетках животных, растений и бактерий 26
![глутатион восстановленный глутатион окисленный -2 [Н] +2 [Н] глутатион является антиоксидантом 27 глутатион восстановленный глутатион окисленный -2 [Н] +2 [Н] глутатион является антиоксидантом 27](https://present5.com/presentation/17146331_106331770/image-27.jpg)
глутатион восстановленный глутатион окисленный -2 [Н] +2 [Н] глутатион является антиоксидантом 27

Нейропептиды u Энкефалины TYR-GLY-PHE-MET TYR-GLY-PHE-LEY u Эндорфины 16 -31 амк Мишень – опиатный рецептор 28

29

Инсулин u Фредерик Сенджер 1958 г. Препроинсулин-109 а. о. , сигнальный пептид - 23 ао. , вставочный пептид- 35 а. о. , инсулин – 51 а. о. (А-21 а. о. , В-30 а. о. ) 30

Препроинсулин 31

32

ВИДЫ ИНСУЛИНА u Животного происхождения u Модифицированный животный u Синтетический u Генно-инженерный человека 33

Белки содержат > 70 остатков АМК u Способны формировать и удерживать определенную пространственную структуру, т. е. молекулы белков имеют высокие уровни организации u Обладают разнообразием и высокой специфичностью, поскольку построены из 20 разных L-АМК u 34

Силы и взаимодействия в структуре белков 35

Значение энергий связей и взаимодействий в белках Пептидная (ковалентная амидная)-350400 к. Дж/моль u Дисульфидная (ковалентная)- 293 к. Дж/моль u u Электростатическое взаимодействие (ионная, солевая связь)- 35 -40 к. Дж/моль Водородная связь- 5 -6(полярн. окр), 16, 7 к. Дж/моль(непол. ) к. Дж/моль Гидрофобное взаим. -6 -6, 5 к. Дж/моль 36

Уровни организации белковых молекул u Датским биохимиком Линдерштремом-Лангом было предложено рассматривать 3 уровня организации молекулы белка u Для некоторых белков существует и четвертичная структура 37

38

Первичная структура белка – последовательность аминокислотных остатков, связанных пептидными связями неразветвленное строение 39

Вторичная структура – локальная конформация определенного участка полипептидной цепи, возникающая в результате ее скручивания, складывания или иной организации за счет вращения по -связям -углеродных атомов полипептидной цепи Л. Полинг и Р. Кори (1950) показали, что для полипептидной цепи одной из наиболее выгодных конформаций является расположение в пространстве в виде правозакрученной спирали ( -спираль) 40

АЛЬФА-СПИРАЛЬ 41

α-Спиральная конформация полипептидной цепи На один виток - 3, 6 остатка АМК шаг спирали - 0, 54 нм Диаметр - 0, 5 нм -Спираль стабилизируется водородными связями между карбонильным атомом кислорода и атомом водорода NH-группы каждого пятого аминокислотного остатков 42

Водородные связи направлены почти параллельно оси α-спирали и удерживают цепь в закрученном состоянии 43

β-Структура (складчатый лист) Представляет собой вытянутые зигзагообразные полипептидные цепи, связанные водородными связями 44

Конформация β-складчатого листа 45

-Поворот формируется в участке полипептидной цепи, где она меняет направление на 180. Pro Gly -Поворот включает 4 АМК остатка и стабилизируется водородными связями. 46

Третичная структура – взаимное расположение в пространстве частей всей полипептидной цепи, обусловленное взаимодействием элементов вторичной структуры как близлежащих, так и отдаленных АМК-остатков 47

В формировании третичной структуры белков участвуют типы связей: • ковалентные дисульфидные • нековалентные водородные ионные гидрофобное взаимодействие 48

ФОЛДИНГ «расплавленная глобула» 49

Фолдинг – физико-химический процесс формирования (пространственной укладки) полипептидной цепи, в ходе которого происходит образование нативной (с минимальной энергией) пространственной конформации (Парадокс Левинталя) контролируется и регулируется внутриклеточными механизмами, в реализации которых участвуют шапероны и шаперонины 50

Шапероны (белки теплового шока) Функции: • предотвращение образования агрегатов белков • транспорт белков во внутриклеточные компартаменты • восстановление поврежденных белков 51

Механизм: связывание гидрофобных фрагментов полипептидных цепей 52

53

54

Домены –области в третичной структуре белка, которым свойственна определенная автономия структурной организации 14 -16 к. Да uструктурные uфункциональные 55

Домены домены 56

ТРЕТИЧНАЯ СТРУКТУРА 57

Классы белков по третичной структуре 58

Четвертичная структура u Способ укладки в пространстве отдельных полипептидных цепей с третичной структурой (протомеров), приводящий к формированию единого в структурном и функциональном отношениях макромолекулярного образования (мультимера) 59

Гемоглобин α 1α 2 141 АМК β 1 β 2 146 АМК Каждый протомер – сложный белок, так как содержит гем 60

Третичная структура миоглобина 61
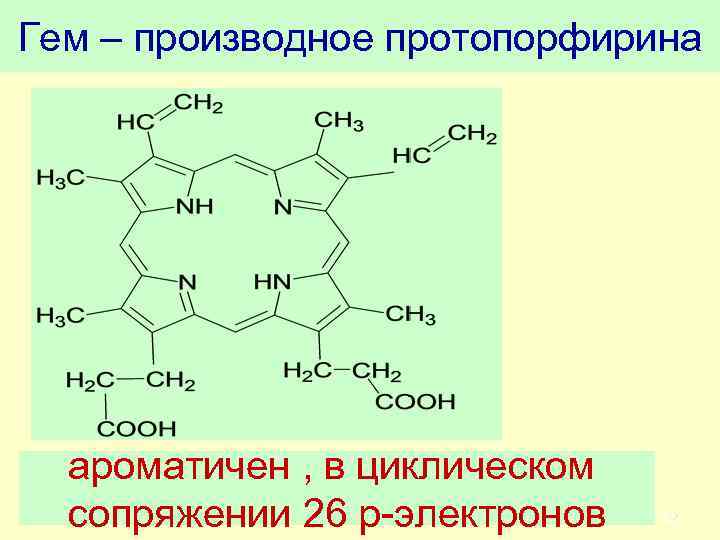
Гем – производное протопорфирина ароматичен , в циклическом сопряжении 26 р-электронов 62

63
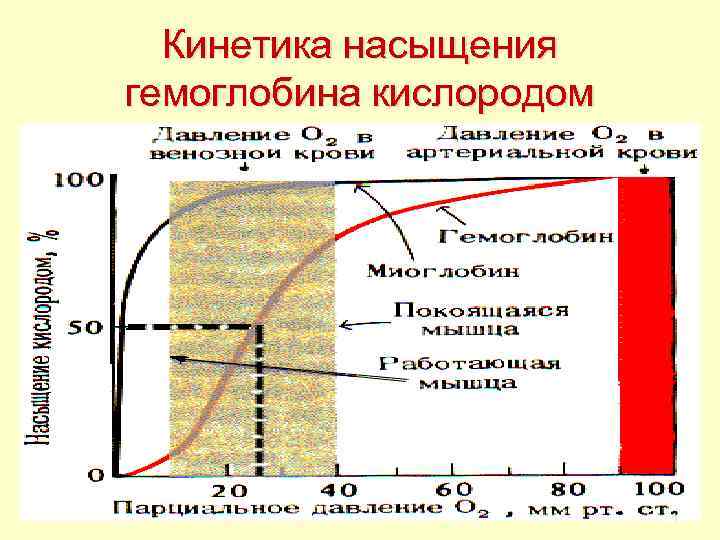
Кинетика насыщения гемоглобина кислородом 64

Денатурация u Процесс нарушения более высоких уровней организации белковой молекулы при сохранении первичной структуры, приводящий к потере биологической и физиологической активности белка 65

Факторы вызывающие денатурацию u физические факторы: t°, р, излучения, встряхивание u химические: мочевина, этанол, фенол, меркаптоэтанол, додецилсульфат Nа, альдегиды u обратимая u необратимая 66

Денатурация белка Ренатурация белка 67

Рибонуклеаза – фермент, гидролизующий РНК S SН мочевина S + + SН HO-CH 2 -SH HO-CH 2 -CH 2 -S денатурация 68

отмывание реагентов SН SН окисление S S Восстановление структуры фермента, его функциональной активности 69

Классификация белков u По составу СЛОЖНЫЕ Металлопротеины Гемопротеины Фосфопротеины Гликопротеины Протеогликаны Липопротеины Нуклеопротеины u простые u сложные 70

u По форме u глобулярные u фибриллярные Глобулярные l/r≤ 10 l r Фибриллярные l/r>10 71

u по растворимости u альбумины растворимы в воде, солевых растворах u глобулины слаборастворимы в воде, но хорошо растворимы в солевых растворах u проламины растворимы в этаноле u гистоны растворах растворимы в солевых u склеропротеины нерастворимы в воде и солевых растворах 72

Функции белков Каталитическая функция Транспортная функция. Защитная функция Сократительная функция Структурная функция Гормональная функция Резервная функция Рецепторная и др. 73

Структурная (пластическая) 74
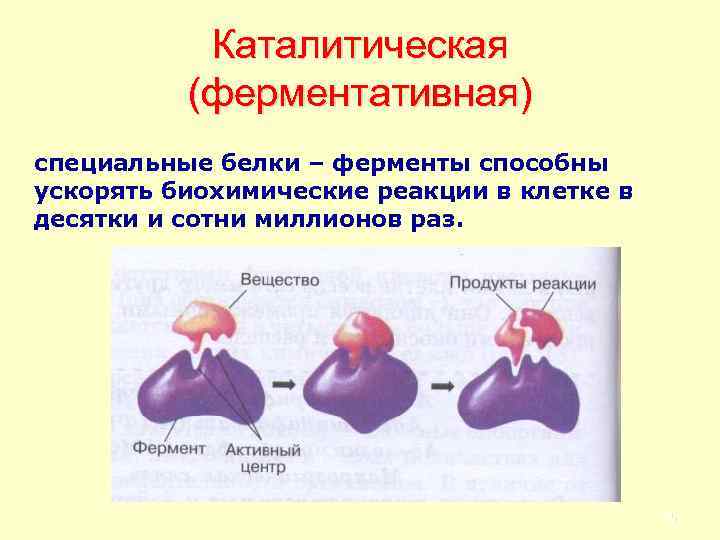
Каталитическая (ферментативная) специальные белки – ферменты способны ускорять биохимические реакции в клетке в десятки и сотни миллионов раз. 75

Двигательная функция Двигательную функцию выполняют сократительные белки 76

Транспортная функция клетка 02 Лёгкие 77

Защитная функция белки предохраняют организм от вторжения чужеродных белков и микроорганизмов и от повреждения 78

Регуляторная функция присуща белкам – гормонам. Они поддерживают постоянные концентрации веществ в крови и клетках, участвуют в росте 79

Сигнальная функция Белкам присуща также сигнальная функция. В мембранах клетки встроены белки, способные изменять свою третичную структуру в ответ на действие факторов внешней среды. 80
Энергетическая функция При расщеплении выделяется 17. 6 к. Дж энергии Белок 81

82

83

84

85

Альфа - спираль 86

SN N-конец С-конец 87

Ионное 88

СИЛЫ И ВЗАИМОДЕЙСТВИЯ 89

Ионное (электростатическое) взаимодействие Есв. ~ 42 к. Дж/моль 90

91

Третичная структура белка 92

Weak bonds and Structure 93

2 1 Четвертичная структура гемоглобина 94

Fe 2+ Координационное число Fe - 6 95

96

97

Строение пептида 98

99

Третичная структура αсубъединицы гемоглобина 100

Функции белка в организме 101
белки.ppt