 К и с л о р о д
К и с л о р о д
 Кислород Основные вопросы, рассматриваемые в лекции "Кислород является центром, вокруг которого вращается вся химия". Берцелиус þ þ Особая роль элемента О в химии Характеристики кислородного атома Степени окисления кислорода в соединениях Распространенность и природные соединения кислорода þ Строение молекулы дикислорода с точки зрения метода молекулярных орбиталей. þ Свойства простых веществ: дикислорода и озона þ Соединения кислорода: w оксиды, как важнейший класс неорганических соединений w пероксиды, супероксиды, озониды. Окислительные свойства
Кислород Основные вопросы, рассматриваемые в лекции "Кислород является центром, вокруг которого вращается вся химия". Берцелиус þ þ Особая роль элемента О в химии Характеристики кислородного атома Степени окисления кислорода в соединениях Распространенность и природные соединения кислорода þ Строение молекулы дикислорода с точки зрения метода молекулярных орбиталей. þ Свойства простых веществ: дикислорода и озона þ Соединения кислорода: w оксиды, как важнейший класс неорганических соединений w пероксиды, супероксиды, озониды. Окислительные свойства
 Особое место О среди других химических элементов § Большая часть неорганической химии посвящена кислородсодержащим соединениям элементов. § Кислород образует соединения почти со всеми другими элементами, кроме Не, Nе, Ar, Kr. § Высшие оксиды часто рассматривают, как характеристические соединения элементов. § Кислород – самый распространенный на Земле элемент. § Кислород, как простое вещество, играет особую роль в производстве энергии
Особое место О среди других химических элементов § Большая часть неорганической химии посвящена кислородсодержащим соединениям элементов. § Кислород образует соединения почти со всеми другими элементами, кроме Не, Nе, Ar, Kr. § Высшие оксиды часто рассматривают, как характеристические соединения элементов. § Кислород – самый распространенный на Земле элемент. § Кислород, как простое вещество, играет особую роль в производстве энергии
 Распространенность кислорода и его природные соединения • Наружный слой Земли, называемый Земной корой, образован соединениями кислорода с другими элементами, главным образом с кремнием и алюминием. • Многие элементы в природе находятся в виде кислородсодержащих соединений, в том числе и важнейшие металлы – железо и алюминий • Масса атомов кислорода составляет почти 50% всей массы Земной коры. • На долю кислорода приходится 89% массы мирового океана. • В атмосфере кислород содержится в виде двухатомных молекул О 2. • Массовый % кислорода в воздухе равен 23.
Распространенность кислорода и его природные соединения • Наружный слой Земли, называемый Земной корой, образован соединениями кислорода с другими элементами, главным образом с кремнием и алюминием. • Многие элементы в природе находятся в виде кислородсодержащих соединений, в том числе и важнейшие металлы – железо и алюминий • Масса атомов кислорода составляет почти 50% всей массы Земной коры. • На долю кислорода приходится 89% массы мирового океана. • В атмосфере кислород содержится в виде двухатомных молекул О 2. • Массовый % кислорода в воздухе равен 23.
 8 O кислород 2 s 22 p 4 Характеристики атома и характерные степени окисления 15, 999 2 s O 2 p • Кислород – это p-элемент 6 А-подгруппы. • Электронная формула атома О: 1 s 22 p 4. • Атому кислорода не хватает всего двух электронов для создания устойчивой восьмиэлектронной оболочки. • У кислородного атома всего два электронных слоя, и поэтому маленький орбитальный радиус. • Эти особенности электронного строения делают кислород очень электроотрицательным элементом. • Электроотрицательность кислорода равна 3, 4.
8 O кислород 2 s 22 p 4 Характеристики атома и характерные степени окисления 15, 999 2 s O 2 p • Кислород – это p-элемент 6 А-подгруппы. • Электронная формула атома О: 1 s 22 p 4. • Атому кислорода не хватает всего двух электронов для создания устойчивой восьмиэлектронной оболочки. • У кислородного атома всего два электронных слоя, и поэтому маленький орбитальный радиус. • Эти особенности электронного строения делают кислород очень электроотрицательным элементом. • Электроотрицательность кислорода равна 3, 4.
 8 O кислород Степени окисления кислорода 2 s 22 p 4 15, 999 • 2 s O 2 p Наиболее устойчивой и самой распространенной степенью окисления кислорода является (– 2) • кроме того, кислород проявляет степени окисления: -1, +1, +2 • Положительные степени окисления проявляются только в соединениях с фтором: OF, OF 2
8 O кислород Степени окисления кислорода 2 s 22 p 4 15, 999 • 2 s O 2 p Наиболее устойчивой и самой распространенной степенью окисления кислорода является (– 2) • кроме того, кислород проявляет степени окисления: -1, +1, +2 • Положительные степени окисления проявляются только в соединениях с фтором: OF, OF 2
 Простое вещество • Известны две модификации простого вещества: • дикислород О 2, который мы называем просто "кислород", и • озон О 3. • Кислород находится в воздухе в виде молекул О 2. Мольная доля молекул О 2 в воздухе составляет 21 %. • Озон образуется за счет поглощения молекулами кислорода ультрафиолетового излучения Солнца по эндотермической реакции: 3 О 2(г. ) = 2 О 3(г. ); Hо = 284 к. Дж/моль
Простое вещество • Известны две модификации простого вещества: • дикислород О 2, который мы называем просто "кислород", и • озон О 3. • Кислород находится в воздухе в виде молекул О 2. Мольная доля молекул О 2 в воздухе составляет 21 %. • Озон образуется за счет поглощения молекулами кислорода ультрафиолетового излучения Солнца по эндотермической реакции: 3 О 2(г. ) = 2 О 3(г. ); Hо = 284 к. Дж/моль
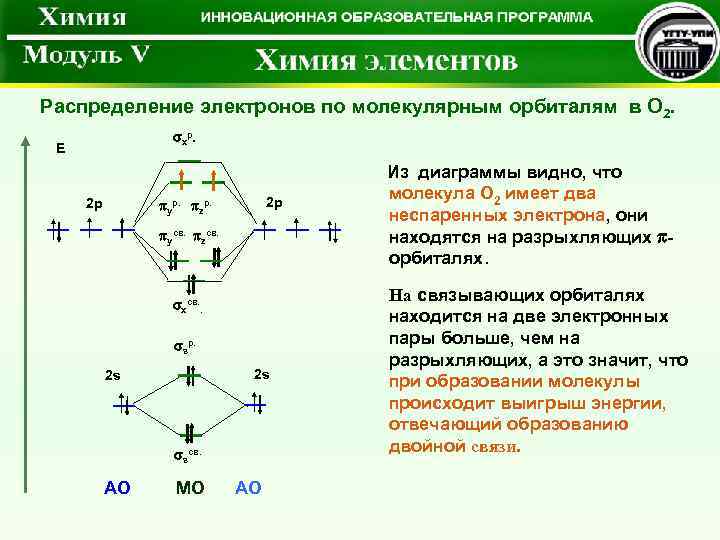 Распределение электронов по молекулярным орбиталям в O 2. хр. Е 2 p 2 p yр. zр. yсв. zсв. xсв. . sр. 2 s sсв. АО МО АО Из диаграммы видно, что молекула О 2 имеет два неспаренных электрона, они находятся на разрыхляющих орбиталях. На связывающих орбиталях находится на две электронных пары больше, чем на разрыхляющих, а это значит, что при образовании молекулы происходит выигрыш энергии, отвечающий образованию двойной связи.
Распределение электронов по молекулярным орбиталям в O 2. хр. Е 2 p 2 p yр. zр. yсв. zсв. xсв. . sр. 2 s sсв. АО МО АО Из диаграммы видно, что молекула О 2 имеет два неспаренных электрона, они находятся на разрыхляющих орбиталях. На связывающих орбиталях находится на две электронных пары больше, чем на разрыхляющих, а это значит, что при образовании молекулы происходит выигрыш энергии, отвечающий образованию двойной связи.
 Простые вещества кислорода O 2 и O 3 • Дикислород О 2 – бесцветный газ без запаха и вкуса, в воде растворяется в ограниченном количестве (~ 0, 001 моль/л). • Кислород в промышленности получают фракционной перегонкой жидкого воздуха. Температура кипения О 2 равна – 183 о. С, а температура кипения азота равна – 196 о. С. Таким образом, из сжиженного воздуха первым в газ переходит азот. • В мире ежегодно получают ~ 80 млн. т кислорода • Озон О 3 – светло-синий газ с характерным запахом. В переводе с греческого озон означает "пахнущий". В небольших количествах озон образуется в электрических разрядах при грозе, и именно он придает воздуху после грозы приятную свежесть
Простые вещества кислорода O 2 и O 3 • Дикислород О 2 – бесцветный газ без запаха и вкуса, в воде растворяется в ограниченном количестве (~ 0, 001 моль/л). • Кислород в промышленности получают фракционной перегонкой жидкого воздуха. Температура кипения О 2 равна – 183 о. С, а температура кипения азота равна – 196 о. С. Таким образом, из сжиженного воздуха первым в газ переходит азот. • В мире ежегодно получают ~ 80 млн. т кислорода • Озон О 3 – светло-синий газ с характерным запахом. В переводе с греческого озон означает "пахнущий". В небольших количествах озон образуется в электрических разрядах при грозе, и именно он придает воздуху после грозы приятную свежесть
 Химические свойства простых веществ • О 2 и О 3 являются сильными окислителями. • Озон более сильный окислитель, чем кислород. • Кислород окисляет очень большое количество самых разнообразных органических и неорганических соединений и подавляющее большинство простых веществ, кроме галогенов, азота, благородных газов и благородных металлов. • Большинство реакций окисления веществ кислородом сопровождается выделением тепла. Реакции окисления природного газа, нефти, угля используются для получения энергии.
Химические свойства простых веществ • О 2 и О 3 являются сильными окислителями. • Озон более сильный окислитель, чем кислород. • Кислород окисляет очень большое количество самых разнообразных органических и неорганических соединений и подавляющее большинство простых веществ, кроме галогенов, азота, благородных газов и благородных металлов. • Большинство реакций окисления веществ кислородом сопровождается выделением тепла. Реакции окисления природного газа, нефти, угля используются для получения энергии.
 Химические свойства простых веществ Для реакций, протекающих в водных растворах, окислительная способность веществ оценивается величинами электродных потенциалов Е. Восстановление О 2 происходит в соответствии со следующей полуреакцией: O 2 + 4 e– + 4 H+ = 2 H 2 O; • Ео = 1, 23 В Стандартный электродный потенциал О 2 указывает на его высокие окислительные свойства. • Для озона Ео положительнее, озон является очень сильным окислителем. O 3 + 2 e– + 2 H+ = O 2 + H 2 O; • Ео = 2, 07 В Хотя кислород – сильный окислитель, тем не менее, при обычных температурах реакции с его участием часто проходят медленно. В значительной мере это обусловлено высокой энергией связи в молекуле О 2
Химические свойства простых веществ Для реакций, протекающих в водных растворах, окислительная способность веществ оценивается величинами электродных потенциалов Е. Восстановление О 2 происходит в соответствии со следующей полуреакцией: O 2 + 4 e– + 4 H+ = 2 H 2 O; • Ео = 1, 23 В Стандартный электродный потенциал О 2 указывает на его высокие окислительные свойства. • Для озона Ео положительнее, озон является очень сильным окислителем. O 3 + 2 e– + 2 H+ = O 2 + H 2 O; • Ео = 2, 07 В Хотя кислород – сильный окислитель, тем не менее, при обычных температурах реакции с его участием часто проходят медленно. В значительной мере это обусловлено высокой энергией связи в молекуле О 2
 Соединения кислорода • • Кислородные соединения многочисленны и разнообразны. • От нормальных оксидов следует отличать бинарные соединения элементов с кислородом, такие как пероксиды, супероксиды и озониды В них О проявляет степени окисления: (-1, -1/2, -1/3). Эти соединения содержат следующие группы атомов: Пероксиды – (–O–O–) или O 22– Супероксиды – О 2– Озониды – О 3 – Примеры: пероксид натрия. Na 2 O 2 , супероксид калия KO 2, озонид калия KO 3. Пероксиды, супероксиды и озониды - очень сильные окислители. • • Наиболее важным классом бинарных кислородных соединений являются оксиды. В оксидах О находится в степени окисления (– 2)
Соединения кислорода • • Кислородные соединения многочисленны и разнообразны. • От нормальных оксидов следует отличать бинарные соединения элементов с кислородом, такие как пероксиды, супероксиды и озониды В них О проявляет степени окисления: (-1, -1/2, -1/3). Эти соединения содержат следующие группы атомов: Пероксиды – (–O–O–) или O 22– Супероксиды – О 2– Озониды – О 3 – Примеры: пероксид натрия. Na 2 O 2 , супероксид калия KO 2, озонид калия KO 3. Пероксиды, супероксиды и озониды - очень сильные окислители. • • Наиболее важным классом бинарных кислородных соединений являются оксиды. В оксидах О находится в степени окисления (– 2)
 Пероксид водорода • Пероксид водорода H 2 O 2 – сиропообразная голубоватая жидкость. • H 2 O 2 проявляет свойства очень слабой кислоты. H 2 O 2 H + + HO 2– ; • р. К = 11, 65 Пероксид водорода при комнатной температуре самопроизвольно разлагается. 2 H 2 O 2 = 2 H 2 O + O 2 • Реакция разложения H 2 O 2 является реакцией диспропорционирования. H 2 O 2 + 2 e– + 2 H+ = 2 H 2 O; Eо = +1, 77 В. H 2 O 2 = O 2 + 2 e– + 2 H+; Eо = + 0, 68 В. • H 2 O 2 может выступать в роли окислителя и в роли восстановителя. • Более ярко выражены окислительные свойства, особенно в щелочной среде. Восстановительные свойства Н 2 О 2 проявляет только по отношению к сильным окислителям в кислой среде.
Пероксид водорода • Пероксид водорода H 2 O 2 – сиропообразная голубоватая жидкость. • H 2 O 2 проявляет свойства очень слабой кислоты. H 2 O 2 H + + HO 2– ; • р. К = 11, 65 Пероксид водорода при комнатной температуре самопроизвольно разлагается. 2 H 2 O 2 = 2 H 2 O + O 2 • Реакция разложения H 2 O 2 является реакцией диспропорционирования. H 2 O 2 + 2 e– + 2 H+ = 2 H 2 O; Eо = +1, 77 В. H 2 O 2 = O 2 + 2 e– + 2 H+; Eо = + 0, 68 В. • H 2 O 2 может выступать в роли окислителя и в роли восстановителя. • Более ярко выражены окислительные свойства, особенно в щелочной среде. Восстановительные свойства Н 2 О 2 проявляет только по отношению к сильным окислителям в кислой среде.
 Заключение § Кислород – самый распространенный на Земле элемент. § Кислород образует соединения почти со всеми другими элементами, кроме Не, Nе, Ar, Kr. Большая часть неорганической химии посвящена кислородсодержащим соединениям элементов. § Кислород – очень электроотрицательный элемент. Электроотрицательность кислорода равна 3, 4. • Наиболее устойчивой и самой распространенной степенью окисления кислорода является (– 2), • кроме того, кислород проявляет степени окисления: -1, +2 • Положительные степени окисления проявляются только в соединениях с фтором: OF, OF 2 • О 2 и О 3 являются сильными окислителями. Озон более сильный окислитель, чем кислород. • Пероксиды, супероксиды и озониды - очень сильные окислители.
Заключение § Кислород – самый распространенный на Земле элемент. § Кислород образует соединения почти со всеми другими элементами, кроме Не, Nе, Ar, Kr. Большая часть неорганической химии посвящена кислородсодержащим соединениям элементов. § Кислород – очень электроотрицательный элемент. Электроотрицательность кислорода равна 3, 4. • Наиболее устойчивой и самой распространенной степенью окисления кислорода является (– 2), • кроме того, кислород проявляет степени окисления: -1, +2 • Положительные степени окисления проявляются только в соединениях с фтором: OF, OF 2 • О 2 и О 3 являются сильными окислителями. Озон более сильный окислитель, чем кислород. • Пероксиды, супероксиды и озониды - очень сильные окислители.
 Рекомендуемая учебная литература § Степин Б. Д. , Цветков А. А. Неорганическая химия: Учебник для вузов / Б. Д. Степин, А. А. Цветков. – М. : Высш. шк. , 1994. - 608 с. : ил. § Карапетьянц М. Х. Общая и неорганическая химия: Учебник для студентов вузов / М. Х. Карапетьянц, С. И. Дракин. - 4 -е изд. , стер. - М. : Химия, 2000. - 592 с. : ил. § Угай Я. А. Общая и неорганическая химия: Учебник для студентов вузов, обучающихся по направлению и специальности "Химия" / Я. А. Угай. - 3 -е изд. , испр. - М. : Высш. шк. , 2007. - 527 с. : ил. § Никольский А. Б. , Суворов А. В. Химия. Учебник для вузов / А. Б. Никольский, А. В. Суворов. – СПб: Химиздат, 2001. - 512 с. : ил.
Рекомендуемая учебная литература § Степин Б. Д. , Цветков А. А. Неорганическая химия: Учебник для вузов / Б. Д. Степин, А. А. Цветков. – М. : Высш. шк. , 1994. - 608 с. : ил. § Карапетьянц М. Х. Общая и неорганическая химия: Учебник для студентов вузов / М. Х. Карапетьянц, С. И. Дракин. - 4 -е изд. , стер. - М. : Химия, 2000. - 592 с. : ил. § Угай Я. А. Общая и неорганическая химия: Учебник для студентов вузов, обучающихся по направлению и специальности "Химия" / Я. А. Угай. - 3 -е изд. , испр. - М. : Высш. шк. , 2007. - 527 с. : ил. § Никольский А. Б. , Суворов А. В. Химия. Учебник для вузов / А. Б. Никольский, А. В. Суворов. – СПб: Химиздат, 2001. - 512 с. : ил.


