atommendel-120223032129-phpapp02.ppt
- Количество слайдов: 16
 Көпэлектронды атом
Көпэлектронды атом
 Макс Планк
Макс Планк
 Көп электронды атомдарды қарастырайық. Мұндай жүйеде әсерлесуді сипаттау үшін екінші электростатикалық жақындасуды қарастыру керек. Бұл жақындасуда потенциялдық энергия операторы мына түрде болады: (СГС жүйесінде) - N электронннан ядроға дейінгі арақашықтық, - n және m электрондар арасындағы арақашықтық (1) Формуладағы бірінші мүше электрондардың ядроға тартылуын сипаттайды. Ал (1) формуладағы 2 мүше электрондардың өзара электростатикалық тебілуін сипаттайды.
Көп электронды атомдарды қарастырайық. Мұндай жүйеде әсерлесуді сипаттау үшін екінші электростатикалық жақындасуды қарастыру керек. Бұл жақындасуда потенциялдық энергия операторы мына түрде болады: (СГС жүйесінде) - N электронннан ядроға дейінгі арақашықтық, - n және m электрондар арасындағы арақашықтық (1) Формуладағы бірінші мүше электрондардың ядроға тартылуын сипаттайды. Ал (1) формуладағы 2 мүше электрондардың өзара электростатикалық тебілуін сипаттайды.
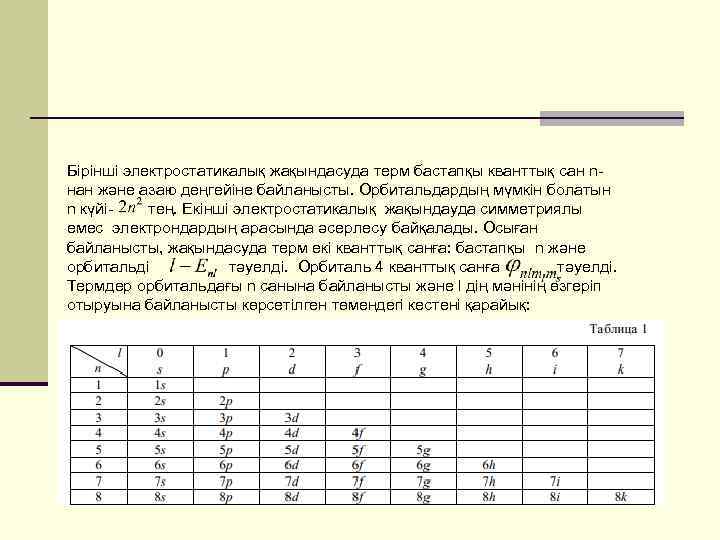 Бірінші электростатикалық жақындасуда терм бастапқы кванттық сан nнан және азаю деңгейіне байланысты. Орбитальдардың мүмкін болатын n күйітең. Екінші электростатикалық жақындауда симметриялы емес электрондардың арасында әсерлесу байқалады. Осыған байланысты, жақындасуда терм екі кванттық санға: бастапқы n және орбитальді тәуелді. Орбиталь 4 кванттық санға тәуелді. Термдер орбитальдағы n санына байланысты және l дің мәнінің өзгеріп отыруына байланысты көрсетілген төмендегі кестені қарайық:
Бірінші электростатикалық жақындасуда терм бастапқы кванттық сан nнан және азаю деңгейіне байланысты. Орбитальдардың мүмкін болатын n күйітең. Екінші электростатикалық жақындауда симметриялы емес электрондардың арасында әсерлесу байқалады. Осыған байланысты, жақындасуда терм екі кванттық санға: бастапқы n және орбитальді тәуелді. Орбиталь 4 кванттық санға тәуелді. Термдер орбитальдағы n санына байланысты және l дің мәнінің өзгеріп отыруына байланысты көрсетілген төмендегі кестені қарайық:
 Терм энергиясының кванттық сандардан тәуелділігі келесі ережелер бойынша анықталады: - (n+l) өсуіне байланысты өседі, егер (n+l) бірдей болса, онда термнің энергиясы n –ге көп болады. Атомдық құрылымдық бірлігін қарастырайық: • Атомның негізгі құрылымдық бірлігі ретінде орбиталь болып табылады. Ол барлық кванттық сан мәнімен сипатталады. • Бірдей мәнді электрондар ұяшықтарын құрайды. • Бірдей мәнді n, l электрондар деңгейшелер деп аталады • Басты кванттық сан n бірдей мәнді электрондар деңгейлерді құрады. Әртүрлі атомдар деңгейлері 3 кестеде көрсетілген символдармен (K , L, M, N, O) белгіленеді.
Терм энергиясының кванттық сандардан тәуелділігі келесі ережелер бойынша анықталады: - (n+l) өсуіне байланысты өседі, егер (n+l) бірдей болса, онда термнің энергиясы n –ге көп болады. Атомдық құрылымдық бірлігін қарастырайық: • Атомның негізгі құрылымдық бірлігі ретінде орбиталь болып табылады. Ол барлық кванттық сан мәнімен сипатталады. • Бірдей мәнді электрондар ұяшықтарын құрайды. • Бірдей мәнді n, l электрондар деңгейшелер деп аталады • Басты кванттық сан n бірдей мәнді электрондар деңгейлерді құрады. Әртүрлі атомдар деңгейлері 3 кестеде көрсетілген символдармен (K , L, M, N, O) белгіленеді.
 Көпэлектронды атомдарда электрондар еркін қашықтықта орналаса алмайды – яғни еркін орбитальдарды толтыра алмайды. Себебі, көпэлектронды атомдарда электрондардың күйін анықтайтын, кванттық сандарға шектеу қоятын арнайы ережелер бар. Көпэлектронды атомдардың орбитальдарды электрондармен толтыру ережелерін қарастырайық: Ø Энергияның минимум принципі. Негізгі жағдайда көпэлектрондардың электрондары өте аз энергия күйінде болуға тырысады. Паули принципі. Бір кванттық жағдайда тек қана бір электрон бола алады. Көп электронды атомға қатысты бұл, бір орбитальында бір электроннан артық электрон болмайды. Яғни, атомда барлық төрт квант саны бірдей болған екі немесе одан көп электрондар болуы мүмкін емес. Ø Хунда ережесі. Толтырылған деңгейшелердің спині әдетте максимальды болып келеді. Яғни , бастапқы жағдайда кванттық сандардың әртүрлі мәнімен күйлер толтырылады, бұл кезде спин проекциясы бірмәнді болады ; кванттық саны бойынша 2 l + 1 күйі спин проекциясы бірдей электрондармен толтырылған соң , олар енді проекциясы теріс таңбалы электрондармен толтырыла бастайды. Енді Паули принципі бойынша атом құрылымының бірлігін қарастырайық: 1. Орбиталь барлық 4 кванттық сандардың белгілі бір мәндерімен сипатталады. Сонымен қоса , орбитальда тек қана бір электрон орналасады. 2. Ұяшықтар спиндері қарама- қарсы екі электроннан тұрады.
Көпэлектронды атомдарда электрондар еркін қашықтықта орналаса алмайды – яғни еркін орбитальдарды толтыра алмайды. Себебі, көпэлектронды атомдарда электрондардың күйін анықтайтын, кванттық сандарға шектеу қоятын арнайы ережелер бар. Көпэлектронды атомдардың орбитальдарды электрондармен толтыру ережелерін қарастырайық: Ø Энергияның минимум принципі. Негізгі жағдайда көпэлектрондардың электрондары өте аз энергия күйінде болуға тырысады. Паули принципі. Бір кванттық жағдайда тек қана бір электрон бола алады. Көп электронды атомға қатысты бұл, бір орбитальында бір электроннан артық электрон болмайды. Яғни, атомда барлық төрт квант саны бірдей болған екі немесе одан көп электрондар болуы мүмкін емес. Ø Хунда ережесі. Толтырылған деңгейшелердің спині әдетте максимальды болып келеді. Яғни , бастапқы жағдайда кванттық сандардың әртүрлі мәнімен күйлер толтырылады, бұл кезде спин проекциясы бірмәнді болады ; кванттық саны бойынша 2 l + 1 күйі спин проекциясы бірдей электрондармен толтырылған соң , олар енді проекциясы теріс таңбалы электрондармен толтырыла бастайды. Енді Паули принципі бойынша атом құрылымының бірлігін қарастырайық: 1. Орбиталь барлық 4 кванттық сандардың белгілі бір мәндерімен сипатталады. Сонымен қоса , орбитальда тек қана бір электрон орналасады. 2. Ұяшықтар спиндері қарама- қарсы екі электроннан тұрады.
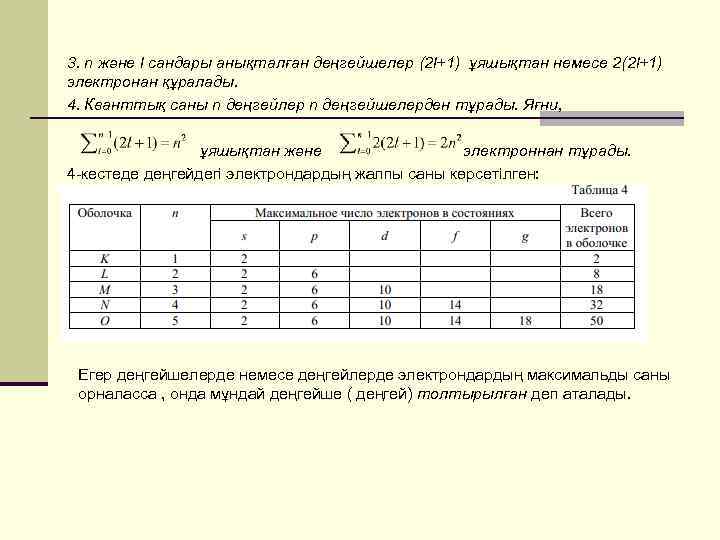 3. n және l сандары анықталған деңгейшелер (2 l+1) ұяшықтан немесе 2(2 l+1) электронан құралады. 4. Кванттық саны n деңгейлер n деңгейшелерден тұрады. Яғни, ұяшықтан және электроннан тұрады. 4 -кестеде деңгейдегі электрондардың жалпы саны көрсетілген: Егер деңгейшелерде немесе деңгейлерде электрондардың максимальды саны орналасса , онда мұндай деңгейше ( деңгей) толтырылған деп аталады.
3. n және l сандары анықталған деңгейшелер (2 l+1) ұяшықтан немесе 2(2 l+1) электронан құралады. 4. Кванттық саны n деңгейлер n деңгейшелерден тұрады. Яғни, ұяшықтан және электроннан тұрады. 4 -кестеде деңгейдегі электрондардың жалпы саны көрсетілген: Егер деңгейшелерде немесе деңгейлерде электрондардың максимальды саны орналасса , онда мұндай деңгейше ( деңгей) толтырылған деп аталады.
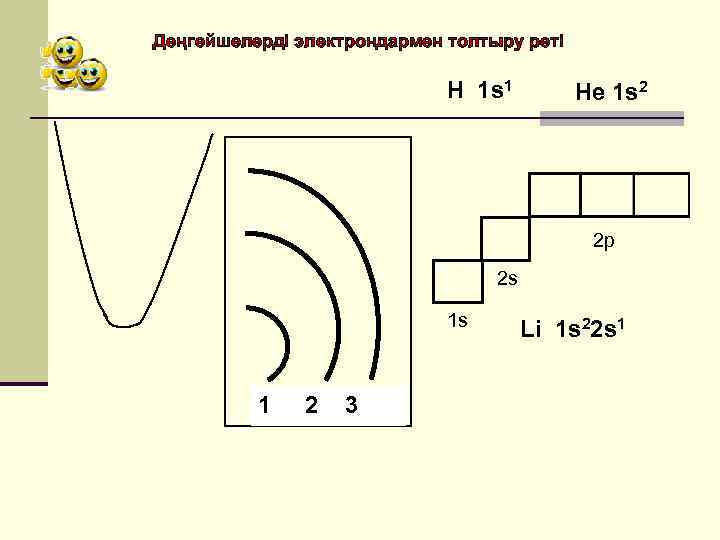 Деңгейшелерді электрондармен толтыру реті Н 1 s 1 Не 1 s 2 2 р 2 s 1 s 1 2 3 Li 1 s 22 s 1
Деңгейшелерді электрондармен толтыру реті Н 1 s 1 Не 1 s 2 2 р 2 s 1 s 1 2 3 Li 1 s 22 s 1
 Элементтердің Д. И. Менделеев периодтық жүйесі Элементтердің химиялық қасиеттері сыртқы электрондармен анықталады. Кезекті деңгейлердің толтырылуы алдыңғы толтырылған дейгейлердің реті бойынша қайталанады, сонымен қоса элементтердің химиялық қасиеттері деңгей бойынша периодты түрде өзгеріп отырады. Деңгейлер сілті металлдардан басталып асыл газдардан аяқталады. 4 кесте бойынша деңгейлерді толтыру да элементтердің сандары 2, 8, 18, 32, 50 болу керек Сонда идеалды периодты схема пайда болады. Бірақ , Менделеевтің периодты жүйесінде кезекті периодтарындағы элементтердің саны 2, 8, 18 тең. Яғни , элементтердің реалды жүйесі деңгейлерді толтырудың идеалды схемасынан ерекшеленеді.
Элементтердің Д. И. Менделеев периодтық жүйесі Элементтердің химиялық қасиеттері сыртқы электрондармен анықталады. Кезекті деңгейлердің толтырылуы алдыңғы толтырылған дейгейлердің реті бойынша қайталанады, сонымен қоса элементтердің химиялық қасиеттері деңгей бойынша периодты түрде өзгеріп отырады. Деңгейлер сілті металлдардан басталып асыл газдардан аяқталады. 4 кесте бойынша деңгейлерді толтыру да элементтердің сандары 2, 8, 18, 32, 50 болу керек Сонда идеалды периодты схема пайда болады. Бірақ , Менделеевтің периодты жүйесінде кезекті периодтарындағы элементтердің саны 2, 8, 18 тең. Яғни , элементтердің реалды жүйесі деңгейлерді толтырудың идеалды схемасынан ерекшеленеді.
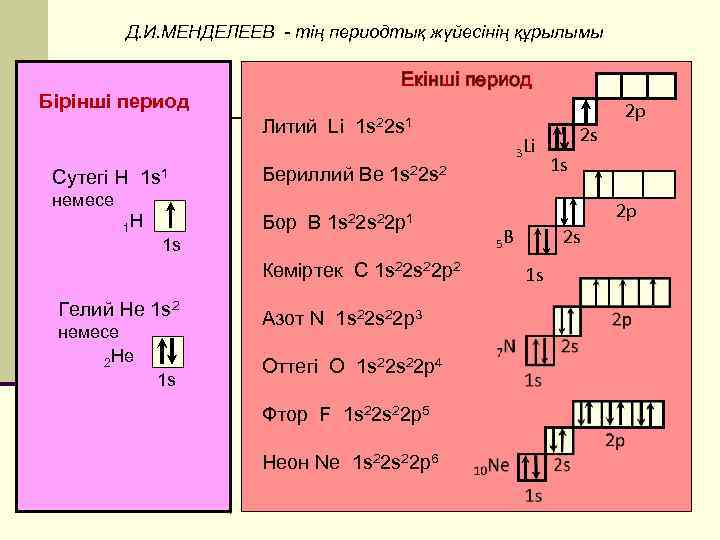 Д. И. МЕНДЕЛЕЕВ - тің периодтық жүйесінің құрылымы Екінші период Бірінші период Литий Li Сутегі Н 1 s 1 1 s 22 s 1 3 Li Бериллий Ве 1 s 22 s 2 2 s 1 s немесе 1 Н Бор В 1 s 22 р1 1 s Көміртек С 1 s 22 р2 Гелий Не 1 s 2 немесе 2 Не 1 s Азот N 1 s 22 р3 Оттегі О 1 s 22 р4 Фтор F 1 s 22 р5 Неон Nе 1 s 22 р6 2 р 2 р 2 s 5 В 1 s
Д. И. МЕНДЕЛЕЕВ - тің периодтық жүйесінің құрылымы Екінші период Бірінші период Литий Li Сутегі Н 1 s 1 1 s 22 s 1 3 Li Бериллий Ве 1 s 22 s 2 2 s 1 s немесе 1 Н Бор В 1 s 22 р1 1 s Көміртек С 1 s 22 р2 Гелий Не 1 s 2 немесе 2 Не 1 s Азот N 1 s 22 р3 Оттегі О 1 s 22 р4 Фтор F 1 s 22 р5 Неон Nе 1 s 22 р6 2 р 2 р 2 s 5 В 1 s
 Элементтердің периодтық жүйесі (тарихы) 18 ғасырдың аяғы мен 19 ғасырдың басында химиктер элементтердің химиялық және физикалық қасиеттеріне, тығыздығына , элементтің күйіне , тығыздығына , электрөткізгіштігіне байланысты жүйе құруға тырысты. «Атомдық салмағы» бойынша классификациясы Праут гипотезасы. 1805 жылы Дж. Дальтон сутегінің бірлік атомдық массасын ескере отырып, бірнеше элементтің атомдық массасын анықтады, ал Й. Берцелиус 1815 жылы атомдық массаның өлшемін нақтылады. Ғалымдар элементтердің атомдық массаларының арасында қарапайым байланысты орнатқысы келді. У. Праут 1815 жылы барлық элементтердің атомдық массалары сутектің атомдық массаларымен қарапайым қысқаша қатынасымен байланысын болжады. Триады Доберейнера. И. Доберейнер 1816 -1829 жылы Cl, Br, I және Ca, Sr, Ba сияқты ұқсас элементтердің триадын бойынша атомдық масса және кейбір физикалық қасиеттердің көлемі арифметикалық прогресс бойынша, яғни әрбір екінші элемент үшін олардың қасиетін болжауға болады
Элементтердің периодтық жүйесі (тарихы) 18 ғасырдың аяғы мен 19 ғасырдың басында химиктер элементтердің химиялық және физикалық қасиеттеріне, тығыздығына , элементтің күйіне , тығыздығына , электрөткізгіштігіне байланысты жүйе құруға тырысты. «Атомдық салмағы» бойынша классификациясы Праут гипотезасы. 1805 жылы Дж. Дальтон сутегінің бірлік атомдық массасын ескере отырып, бірнеше элементтің атомдық массасын анықтады, ал Й. Берцелиус 1815 жылы атомдық массаның өлшемін нақтылады. Ғалымдар элементтердің атомдық массаларының арасында қарапайым байланысты орнатқысы келді. У. Праут 1815 жылы барлық элементтердің атомдық массалары сутектің атомдық массаларымен қарапайым қысқаша қатынасымен байланысын болжады. Триады Доберейнера. И. Доберейнер 1816 -1829 жылы Cl, Br, I және Ca, Sr, Ba сияқты ұқсас элементтердің триадын бойынша атомдық масса және кейбір физикалық қасиеттердің көлемі арифметикалық прогресс бойынша, яғни әрбір екінші элемент үшін олардың қасиетін болжауға болады
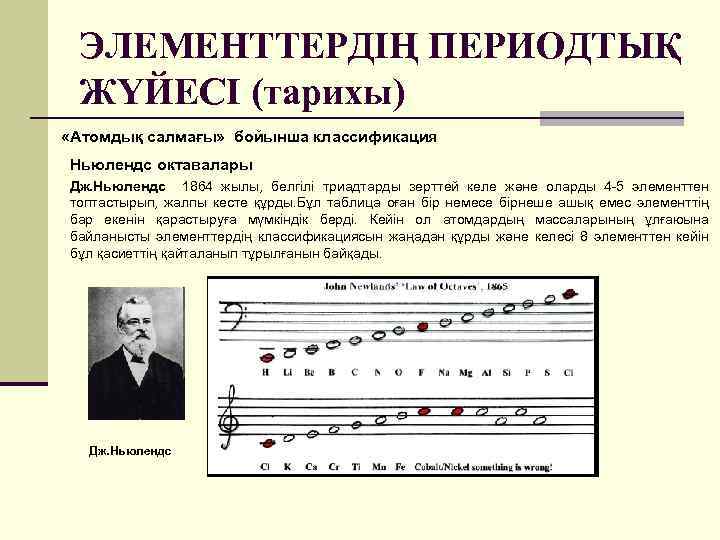 ЭЛЕМЕНТТЕРДІҢ ПЕРИОДТЫҚ ЖҮЙЕСІ (тарихы) «Атомдық салмағы» бойынша классификация Ньюлендс октавалары Дж. Ньюлендс 1864 жылы, белгілі триадтарды зерттей келе және оларды 4 -5 элементтен топтастырып, жалпы кесте құрды. Бұл таблица оған бір немесе бірнеше ашық емес элементтің бар екенін қарастыруға мүмкіндік берді. Кейін ол атомдардың массаларының ұлғаюына байланысты элементтердің классификациясын жаңадан құрды және келесі 8 элементтен кейін бұл қасиеттің қайталанып тұрылғанын байқады. Дж. Ньюлендс
ЭЛЕМЕНТТЕРДІҢ ПЕРИОДТЫҚ ЖҮЙЕСІ (тарихы) «Атомдық салмағы» бойынша классификация Ньюлендс октавалары Дж. Ньюлендс 1864 жылы, белгілі триадтарды зерттей келе және оларды 4 -5 элементтен топтастырып, жалпы кесте құрды. Бұл таблица оған бір немесе бірнеше ашық емес элементтің бар екенін қарастыруға мүмкіндік берді. Кейін ол атомдардың массаларының ұлғаюына байланысты элементтердің классификациясын жаңадан құрды және келесі 8 элементтен кейін бұл қасиеттің қайталанып тұрылғанын байқады. Дж. Ньюлендс
 ЭЛЕМЕНТТЕРДІҢ ПЕРИОДТЫҚ ЖҮЙЕСІ (тарихы) «Атомдық салмағы» бойынша классификация Ньюлендс октавалары Ұқсас элементтер , ереже бойынша, горизонталь бағыт бойынша бір қатарға орналасады. Дж. Ньюлендс
ЭЛЕМЕНТТЕРДІҢ ПЕРИОДТЫҚ ЖҮЙЕСІ (тарихы) «Атомдық салмағы» бойынша классификация Ньюлендс октавалары Ұқсас элементтер , ереже бойынша, горизонталь бағыт бойынша бір қатарға орналасады. Дж. Ньюлендс
 ЭЛЕМЕНТТЕРДІҢ ПЕРИОДТЫҚ ЖҮЙЕСІ (тарихы) «Атомдық салмағы» бойынша классификация Менделеевтің бастапқы нұсқасы 1869 жылы ұсынылды. Дмитрий Иванович периодтық жүйені химиялық қасиеттері бойынша өзгерту керектігін жөн көрген бірінші ғалым емес. Бірақ ол бірінші болып периодтық заңды ретке келтіріп оны практикада қолданды: ашылмаған элементтердің бар екенін және атомдық салмақтың кейбір элементтерде қате екенін айтты. Д. И. Менделеев
ЭЛЕМЕНТТЕРДІҢ ПЕРИОДТЫҚ ЖҮЙЕСІ (тарихы) «Атомдық салмағы» бойынша классификация Менделеевтің бастапқы нұсқасы 1869 жылы ұсынылды. Дмитрий Иванович периодтық жүйені химиялық қасиеттері бойынша өзгерту керектігін жөн көрген бірінші ғалым емес. Бірақ ол бірінші болып периодтық заңды ретке келтіріп оны практикада қолданды: ашылмаған элементтердің бар екенін және атомдық салмақтың кейбір элементтерде қате екенін айтты. Д. И. Менделеев
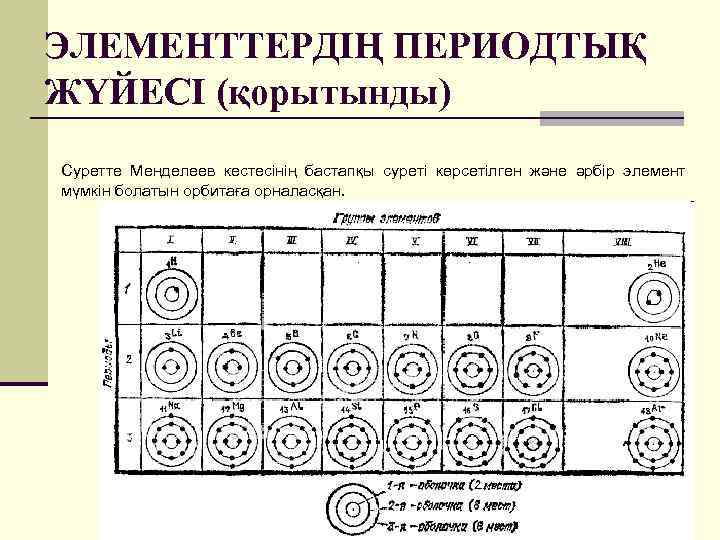 ЭЛЕМЕНТТЕРДІҢ ПЕРИОДТЫҚ ЖҮЙЕСІ (қорытынды) Суретте Менделеев кестесінің бастапқы суреті көрсетілген және әрбір элемент мүмкін болатын орбитаға орналасқан.
ЭЛЕМЕНТТЕРДІҢ ПЕРИОДТЫҚ ЖҮЙЕСІ (қорытынды) Суретте Менделеев кестесінің бастапқы суреті көрсетілген және әрбір элемент мүмкін болатын орбитаға орналасқан.


