
КӨМІРТЕКТІ НАНОБӨЛШЕК ЕРДІҢ ЖІКТЕЛУІ 1
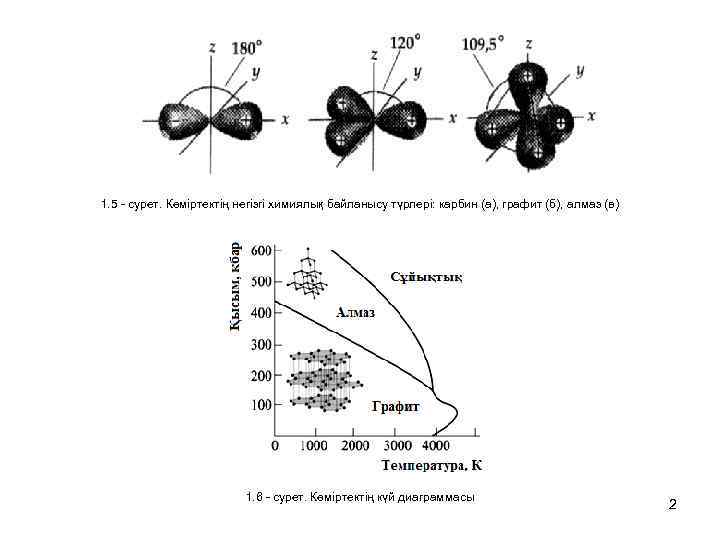
1. 5 - сурет. Көміртектің негізгі химиялық байланысу түрлері: карбин (а), графит (б), алмаз (в) 1. 6 - сурет. Көміртектің күй диаграммасы 2

1. 1 - кесте. Көміртекті материалдардың қасиеттері Модификация Гибридизация Байланыстың ұзындығы, Тығыздығы, г/см 3 Кристалды торлар L (нм) Алмаз sp 3 0, 148 3, 515 Куб тәрізді Графит sp 2 0, 142 (0, 335) 1, 848 Гексагональді Фуллерен sp 2 0, 144 / 0, 139 1, 651 Фуллеренді құрылымдар: молекулярлы ГЦК, ромб тәрізді, гексагональді Карбин sp α: 0, 125/0, 149 1, 917 Гексагональді β: 0, 138 3
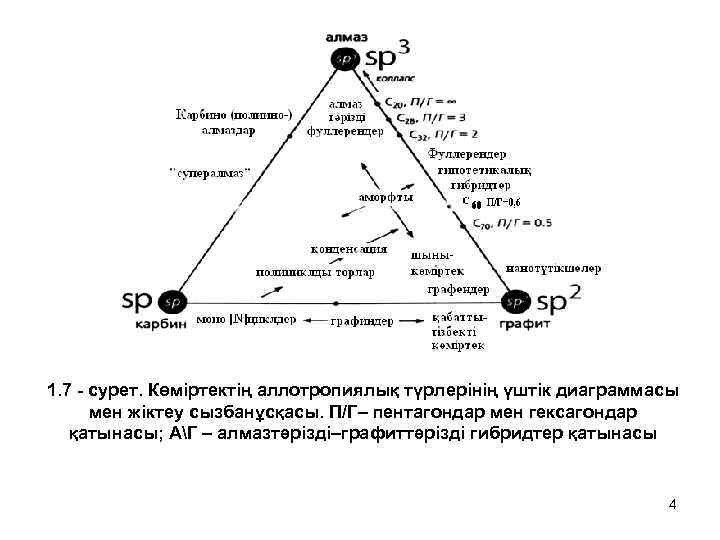
1. 7 - сурет. Көміртектің аллотропиялық түрлерінің үштік диаграммасы мен жіктеу сызбанұсқасы. П/Г– пентагондар мен гексагондар қатынасы; АГ – алмазтәрізді–графиттәрізді гибридтер қатынасы 4
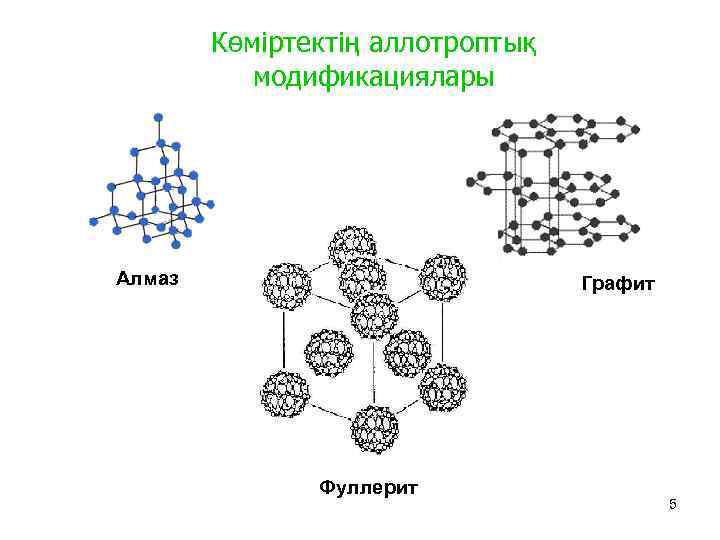
Көміртектің аллотроптық модификациялары Алмаз Графит Фуллерит 5
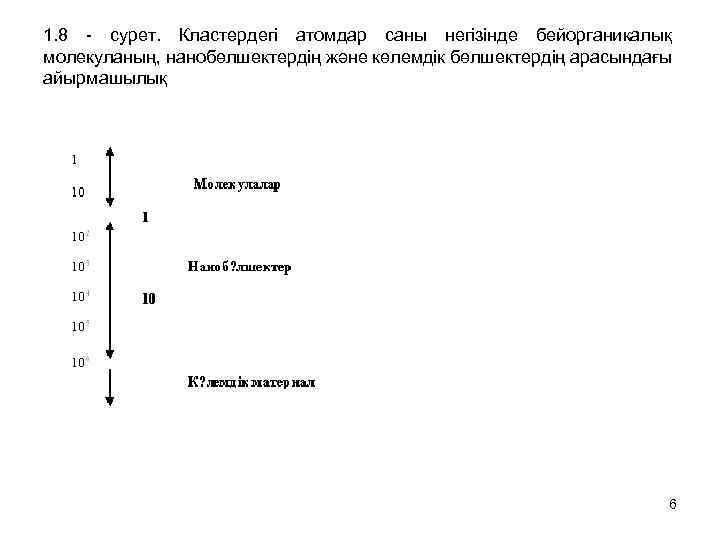
1. 8 - сурет. Кластердегі атомдар саны негізінде бейорганикалық молекуланың, нанобөлшектердің және көлемдік бөлшектердің арасындағы айырмашылық 6

1. 9 - сурет. Дисперсті фаза өлшемі бойынша дисперсті материалдардың жіктелуі 7

ФУЛЛЕРЕНДЕР ҚҰРЫЛЫCЫ ЖӘНЕ НОМЕНКЛАТУРАСЫ 8
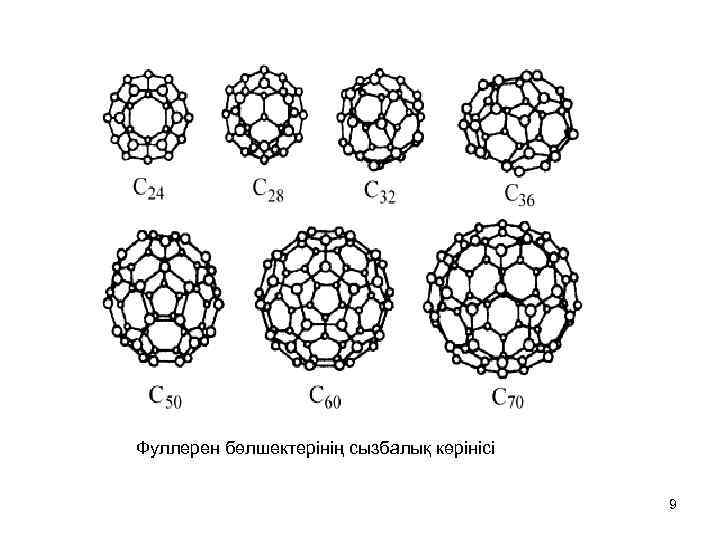
Фуллерен бөлшектерінің сызбалық көрінісі 9
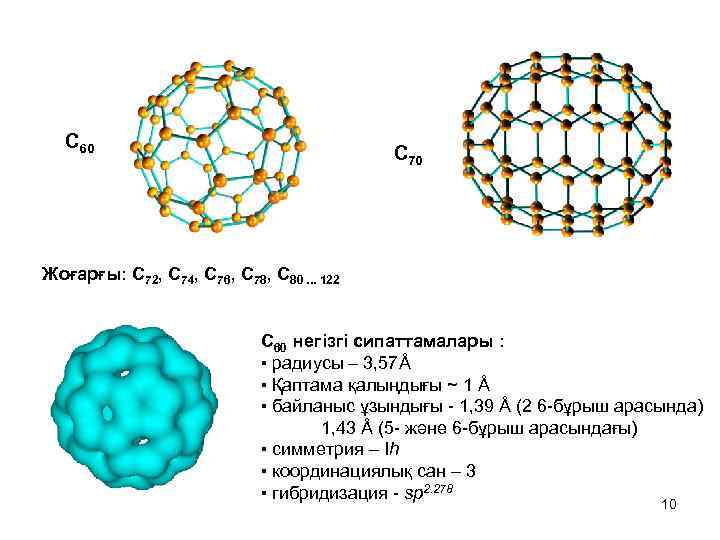
C 60 C 70 Жоғарғы: С 72, С 74, С 76, С 78, С 80. . . 122 С 60 негізгі сипаттамалары : ▪ радиусы – 3, 57Å ▪ Қаптама қалыңдығы ~ 1 Å ▪ байланыс ұзындығы - 1, 39 Å (2 6 -бұрыш арасында) 1, 43 Å (5 - және 6 -бұрыш арасындағы) ▪ симметрия – Ih ▪ координациялық сан – 3 ▪ гибридизация - sp 2. 278 10
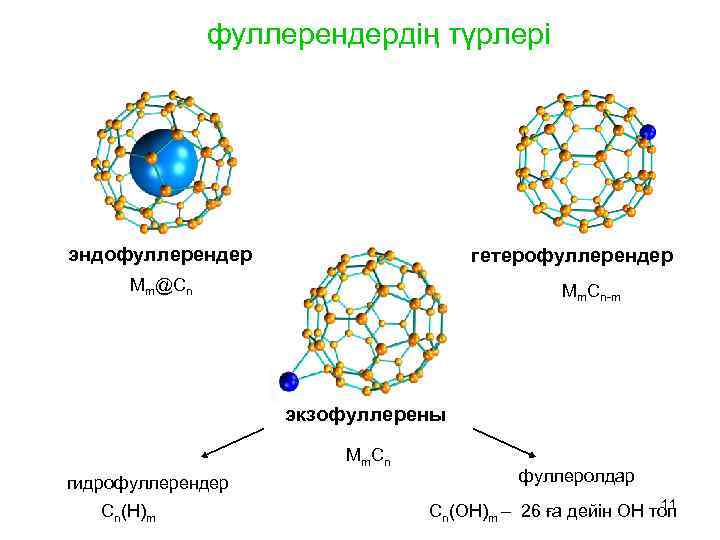
фуллерендердің түрлері эндофуллерендер гетерофуллерендер Мm@Cn Мm. Cn-m экзофуллерены Мm. Cn гидрофуллерендер Cn(Н)m фуллеролдар 11 Cn(ОН)m – 26 ға дейін ОН топ

Гиперфуллерендер (гигант фуллерендер, сарымсақ тәрізді құрылымдар) бір-біріне кидірілген дөңгелек формалар түрінде кездеседі. Есептеулер нәтижесінде ең тұрақты көміртек құрылымдары кластердегі атом саны 106 -107 болған кезде түзілетіні анықталған. Фуллерендердің ең кішісі С 60, келесісі болады, мысалы, С 60@С 240@С 540@С 960@С 1500. Мұндай түзілімдердегі радиустар айырымы графиттегі қабатаралық қашықтықтармен шамалас болады (1. 32 - сурет). 240, 540, 960, 1500 атомдардан құралған гигант фуллерендер икосаэдрлік симметриялы болады. Сарымсақтәрізді құрылымдар аморфты көміртекке, көміртектің полиэдрлік графиттелген бөлшектеріне немесе КҚКНТ-ге электрондар ағынымен қарқынды әсер ету арқылы түзілуі мүмкін. Сарымсақтәрізді құрылымның сызбанұсқалық кескіні (r 2 - r 1 = r 3 - r 2 = … = rn - rn-1 ≈ 0, 335 нм) 12
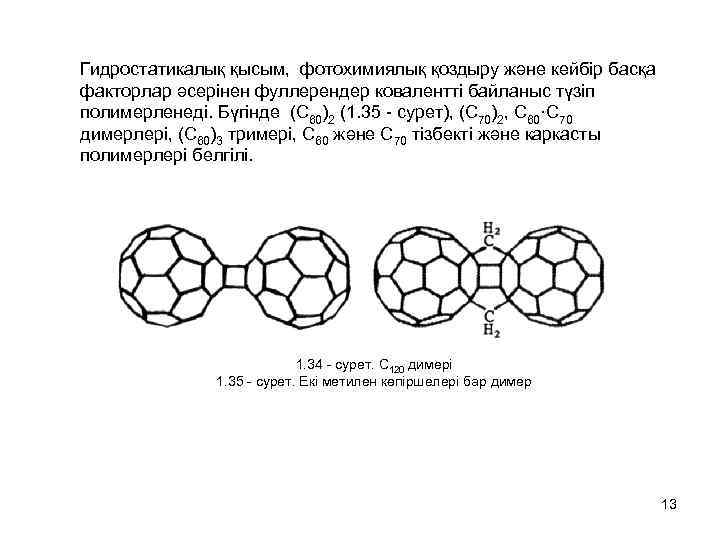
Гидростатикалық қысым, фотохимиялық қоздыру және кейбір басқа факторлар әсерінен фуллерендер ковалентті байланыс түзіп полимерленеді. Бүгінде (С 60)2 (1. 35 - сурет), (С 70)2, С 60·С 70 димерлері, (С 60)3 тримері, С 60 және С 70 тізбекті және каркасты полимерлері белгілі. 1. 34 - сурет. С 120 димері 1. 35 - сурет. Екі метилен көпіршелері бар димер 13

Фуллерендердің қасиеттері 14

С 60 фуллереннің кейбір сипаттамалары • Иондану потенциалы – 7, 61 э. В • Баланыс энергиясы – 7 э. В, • 12 электрон қабылдап бір электрон бере алады, яғни заряды С 60 +1 ден -12 ге дейін өзгеруі мүмкін 15
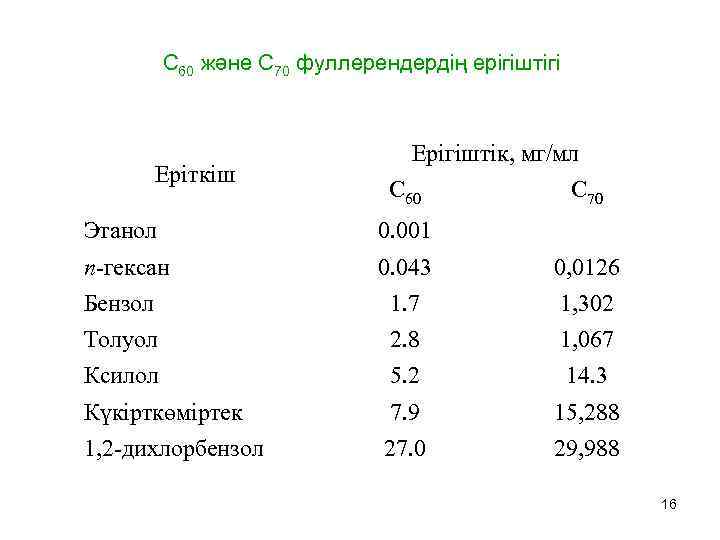
С 60 және С 70 фуллерендердің ерігіштігі Еріткіш Ерігіштік, мг/мл С 60 С 70 Этанол 0. 001 n-гексан 0. 043 0, 0126 Бензол 1. 7 1, 302 Толуол 2. 8 1, 067 Ксилол 5. 2 14. 3 Күкірткөміртек 7. 9 15, 288 1, 2 -дихлорбензол 27. 0 29, 988 16
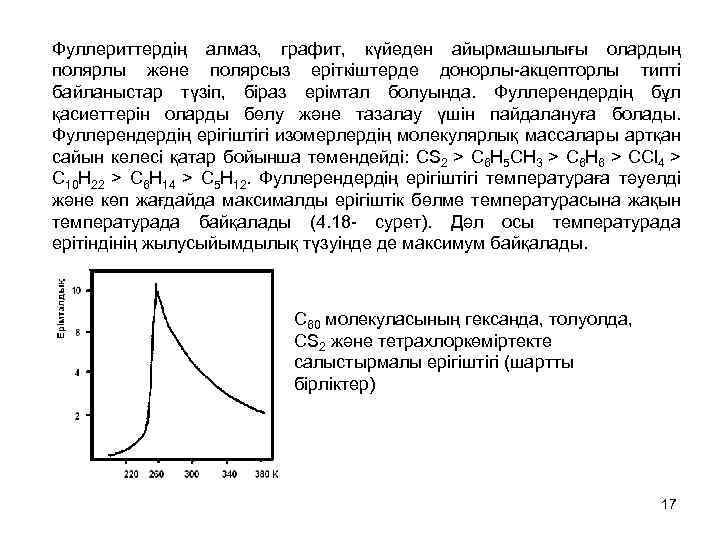
Фуллериттердің алмаз, графит, күйеден айырмашылығы олардың полярлы және полярсыз еріткіштерде донорлы-акцепторлы типті байланыстар түзіп, біраз ерімтал болуында. Фуллерендердің бұл қасиеттерін оларды бөлу және тазалау үшін пайдалануға болады. Фуллерендердің ерігіштігі изомерлердің молекулярлық массалары артқан сайын келесі қатар бойынша төмендейді: CS 2 > C 6 H 5 CH 3 > C 6 H 6 > CCl 4 > C 10 H 22 > C 6 H 14 > C 5 H 12. Фуллерендердің ерігіштігі температураға тәуелді және көп жағдайда максималды ерігіштік бөлме температурасына жақын температурада байқалады (4. 18 - сурет). Дәл осы температурада ерітіндінің жылусыйымдылық түзуінде де максимум байқалады. C 60 молекуласының гександа, толуолда, CS 2 және тетрахлоркөміртекте салыстырмалы ерігіштігі (шартты бірліктер) 17

• C 70 молекуласының ерігіштігі C 60 молекуласынан ерекшеленеді: оның бензолда және басқа ерігіштігінде максимум болмайды. • Фуллерендер ерітінділеріне сольватохромия тән – еріткіштердің сольваттаушы қасиеттері өзгеруі нәтижесінде ерітіндінің түсінің немесе жұтылу спектрлерінің өзгеруі. Бұл құбылысты сонымен бірге концентрацияның өзгеруімен фуллерендердің өлшемдері өзгеруімен де түсіндіруге болады. • Ерітінділерден кристалданған кезде көп жағдайда торлардың түйіндерінде еріткіш молекулалары болады. Болжамдар бойынша көбінесе С 60·Х түзіледі, мұндағы X=C 6 H 6, C 6 H 5 CH 3, CS 2. Мұндай қосылыстарды ван-дер-ваальс күштерімен түзілетін клатраттарға, молекулярлы комплекстерге немесе сольваттарға жатқызуға болады. Клатраттардағы симметрия фуллерендермен салыстырғанда аздау болады да, С 60 молекулалардың айналуы төмен болады. 18
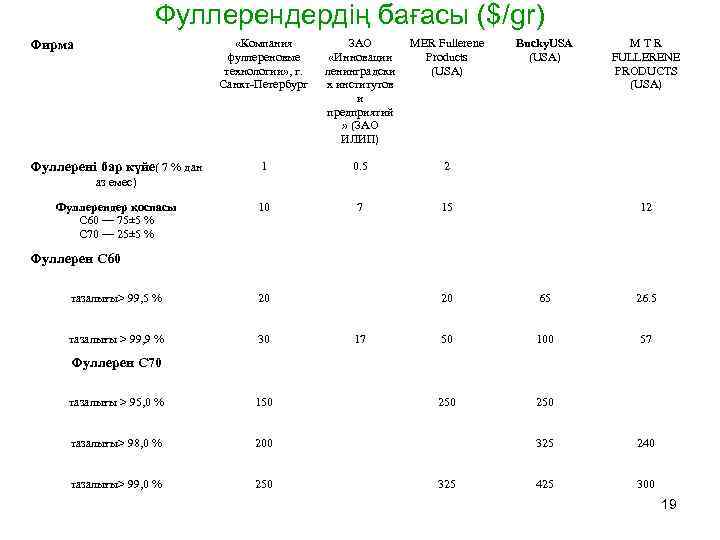
Фуллерендердің бағасы ($/gr) «Компания фуллереновые технологии» , г. Санкт-Петербург Фирма Фуллерені бар күйе( 7 % дан ЗАО «Инновации ленинградски х институтов и предприятий » (ЗАО ИЛИП) MER Fullerene Products (USA) 1 0. 5 2 10 7 Bucky. USA (USA) 15 MTR FULLERENE PRODUCTS (USA) аз емес) Фуллерендер қоспасы С 60 — 75± 5 % С 70 — 25± 5 % 12 Фуллерен С 60 тазалығы> 99, 5 % 20 тазалығы > 99, 9 % 30 20 17 65 26. 5 50 100 57 250 Фуллерен С 70 тазалығы > 95, 0 % 150 тазалығы> 98, 0 % 200 тазалығы> 99, 0 % 250 325 240 425 300 19

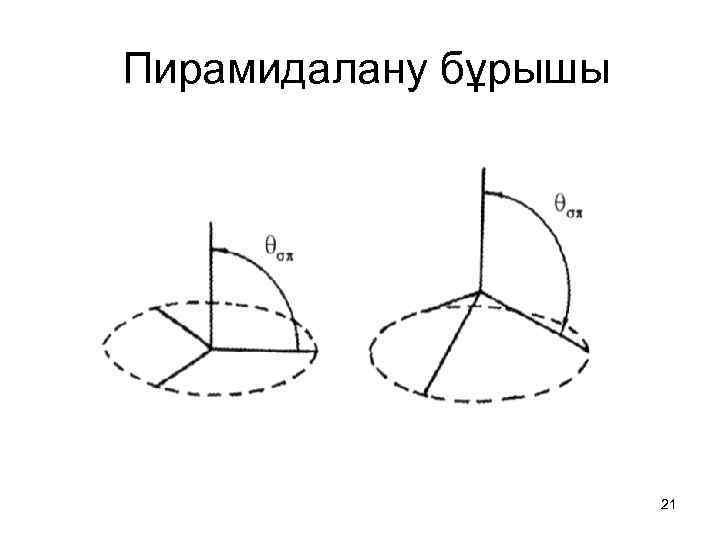
Фуллерендердің химиялық қасиеттері Фуллерендер қатарындағы материалдар дөңгеленген құрылысына байланысты химиялық қасиеттері бойынша өзге көміртекті материалдардың қасиеттерінен біраз ерекшеленеді. Майысқан көміртек жазықтықтарының реакциялық қабілеттілігі пирамидалану бұрышына байланысты өзгеріп отырады (4. 8 - сурет). Пирамидалану бұрышы σ- (р) және π- (sp 2) байланыстар бағытының айырымымен анықталады. Пирамидалану бұрышы келесі (4. 1) формула бойынша анықталады: (4. 1) мұндағы θσπ- σ- және π- байланыстар бағыттары арасындағы бұрыш. 20
Пирамидалану бұрышы 21

• Графиттегі қатпарлы құрылымда жазық графен жазықтықтары арасындағы бұрыш нөлге тең ( ), ал алмаздың тетрагональді құрылымындағы пирамидалану бұрышы үлкен мәнге ие ( ). Фуллеренде байланыстар гибридтелген (С 60 молекуласында тең) және sp 2 және sp 3 гибридтелу күйлері арасындағы сипатта болады. Дәл осы гибридтелу фуллерендердің жоғары реакциялық қабілеттілігін анықтайды. Мысалы, Н атомдары мен СН 3 радикалдардың майысқан көміртек торларымен әрекеттесу энтальпиясы пирамидалану бұрышына байланысты болады және бұл бұрыш өзгергенде 1 э. В өзгереді. Бұл реакциялар фуллерендердің сыртқы қабатында ғана жүреді. 22
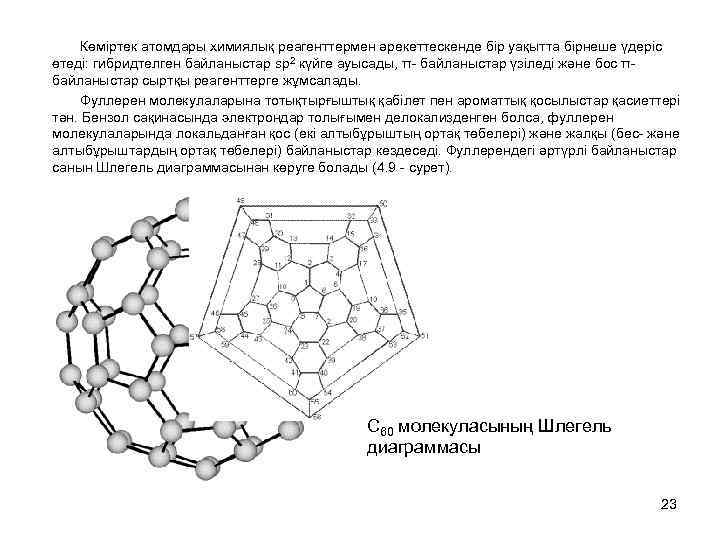
Көміртек атомдары химиялық реагенттермен әрекеттескенде бір уақытта бірнеше үдеріс өтеді: гибридтелген байланыстар sp 2 күйге ауысады, π- байланыстар үзіледі және бос π- байланыстар сыртқы реагенттерге жұмсалады. Фуллерен молекулаларына тотықтырғыштық қабілет пен ароматтық қосылыстар қасиеттері тән. Бензол сақинасында электрондар толығымен делокализденген болса, фуллерен молекулаларында локальданған қос (екі алтыбұрыштың ортақ төбелері) және жалқы (бес- және алтыбұрыштардың ортақ төбелері) байланыстар кездеседі. Фуллерендегі әртүрлі байланыстар санын Шлегель диаграммасынан көруге болады (4. 9 - сурет). C 60 молекуласының Шлегель диаграммасы 23

• • • C 60 фуллерендердің химиялық реакцияларын бірнеше топқа жіктеуге болады: тотықсыздану, нуклеофильді қосылу, циклоқосылу, галогендеу, фуллерендерді кластерлермен түрлендіру, гидрлеу, радикалдарды жалғау, ауыспалы металдармен комплексті қосылыс түзу, тотығу және электрофильді реагенттермен әрекеттесу. Бұл қатарға фуллерендердің полимерленуі, сақиналардың ашылуы, жоғары фуллерендердің химиялық реакциялары, гетерофуллерендерді алу және олардың қасиеттері, эндофуллерендердің реакциялары сияқты реакцияларды қосуға болады. 24

Тотықсыздану. Фуллерен молекуласы 12 электронға дейін қосып алып, аниондарын түзуге қабілетті. Тотықсыздану электрон донорлармен әрекеттескенде (сілтілік және сілтілікжер металдар, ауыспалы металдардың комплексті қосылыстары), сонымен бірге электрохимиялық әдіспен және фотохимиялық әдіспен жүзеге асырылады. Фуллерендердің тотықсыздандырғыштары ретінде көптеген органикалық қосылыстар қолданылады. Ерітінділерде тотықсыздандыру барысында , , және тұздары алынған. Фуллерендердің металдармен қосылыстарын фуллеридтер деп атайды. Бүгінде фуллерендердің сілтілік металдармен MC 60, M 3 C 60, жоғары қысымда толық қайта топтасу нәтижесінде түзілетін M 4 C 60 пен M 6 C 60 қосылыстары алынған. Нуклеофильді қосылу реакциялары. Мұндай реакцияларға бірнеше топтардың жалғану реакцияларын жатқызуға болады: көміртекқұрамды нуклеофильдердің (гидроалкилдеу, гидроарилдеу, циклопропандау, цианидтердің жалғану реакциялары), аминдердің, гидроксидтердің фосфорқұрамды нуклеофильдердің қосылуы. Нуклеофильді қосылу кезінде 1, 2 - қосылу реакциялары жүзеге асады. Көп тараған нуклеофильді қосылу реакцияларына циклопропандау реакцияларын жатқызуға болады және бұл реакция Бингель реакциясы деп аталады. 25
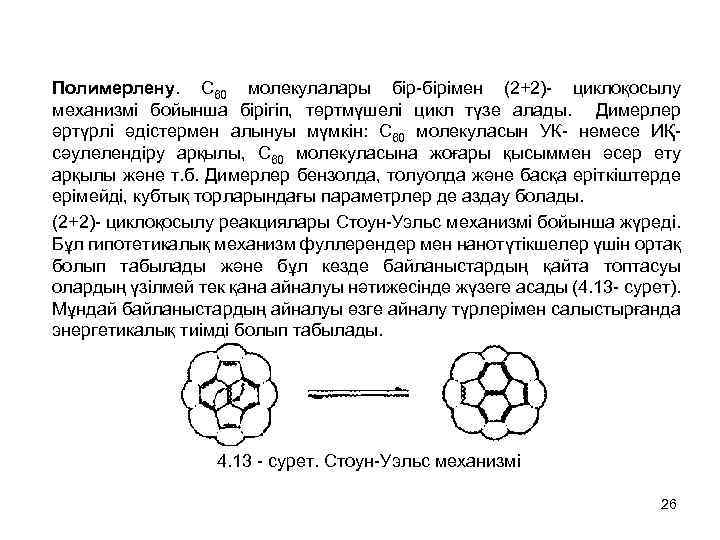
Полимерлену. C 60 молекулалары бір-бірімен (2+2)- циклоқосылу механизмі бойынша бірігіп, төртмүшелі цикл түзе алады. Димерлер әртүрлі әдістермен алынуы мүмкін: C 60 молекуласын УК- немесе ИҚ- сәулелендіру арқылы, C 60 молекуласына жоғары қысыммен әсер ету арқылы және т. б. Димерлер бензолда, толуолда және басқа еріткіштерде ерімейді, кубтық торларындағы параметрлер де аздау болады. (2+2)- циклоқосылу реакциялары Стоун-Уэльс механизмі бойынша жүреді. Бұл гипотетикалық механизм фуллерендер мен нанотүтікшелер үшін ортақ болып табылады және бұл кезде байланыстардың қайта топтасуы олардың үзілмей тек қана айналуы нәтижесінде жүзеге асады (4. 13 - сурет). Мұндай байланыстардың айналуы өзге айналу түрлерімен салыстырғанда энергетикалық тиімді болып табылады. 4. 13 - сурет. Стоун-Уэльс механизмі 26
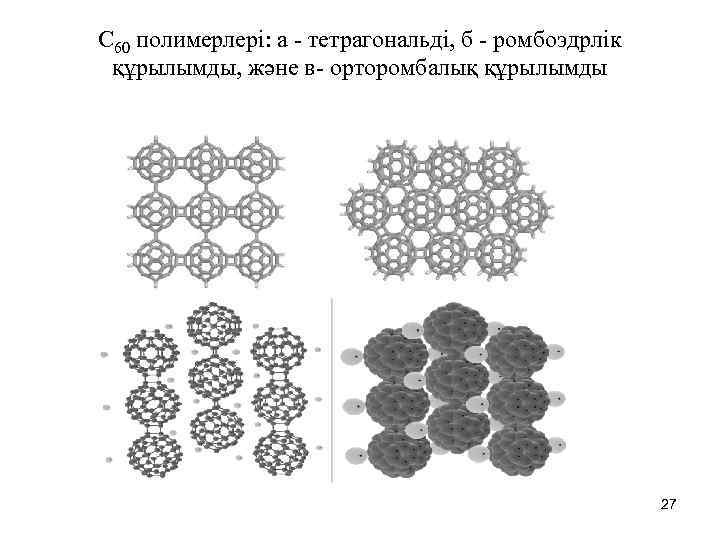
C 60 полимерлері: а - тетрагональді, б - ромбоэдрлік құрылымды, және в- орторомбалық құрылымды 27

Галогендеу. C 60 фуллерендер фтормен әрекеттесіп түссіз немесе сары түсті C 60 Fn құрамды өнімдер жиынын түзеді. Сұйытылған фтор мен C 60 фуллерендер бөлме температурасынан бастап-ақ әрекеттесе бастайды, ал тереңірек фторлау жүргізу үшін температураны 200 -300 ºС дейін арттыру қажет. Фтормен ең қаныққан үлгілер C 60 F 48 формуласына сәйкес келеді және ол 335 ºС температурада алынған. Фуллерендердің фторидтері тұрақтылығы және шығымы әртүрлі изомерлер түзе алады. Мысалы, дифторид C 60 F 2 екі тұрақтылығы жоғары формалар түзеді: 1, 4 - изомер және 1, 2 - изомер. Фторланған фуллерендер ішінде көп бөлігі фтормен сақина түзіп байланысқан C 60 F 16, C 60 F 18, C 60 F 20 тұрақты изомерлерінің құрылымдары қызықты болып келеді. Бұл кезде молекула күшті полярлы болады. Мысалы, C 60 F 18 молекуласының құрылысы 4. 15 - суретте келтірілген. C 60 F 36, C 60 F 48 молекулаларының құрылыстары бұдан да күрделі болып келеді. 28
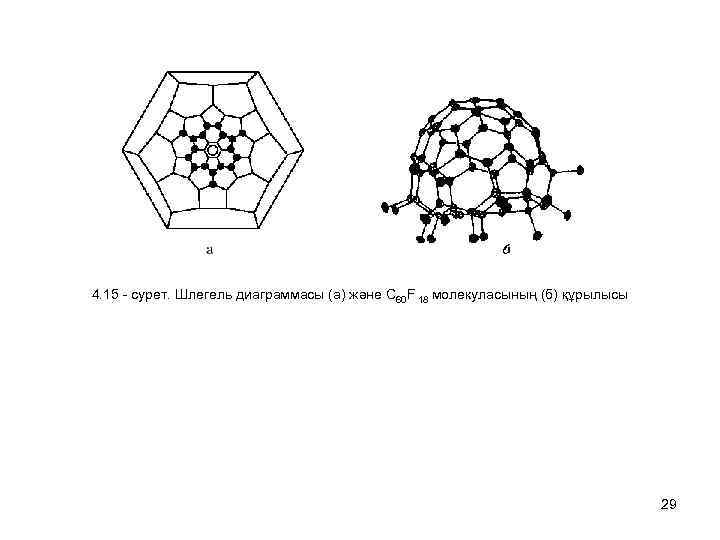
4. 15 - сурет. Шлегель диаграммасы (а) және C 60 F 18 молекуласының (б) құрылысы 29
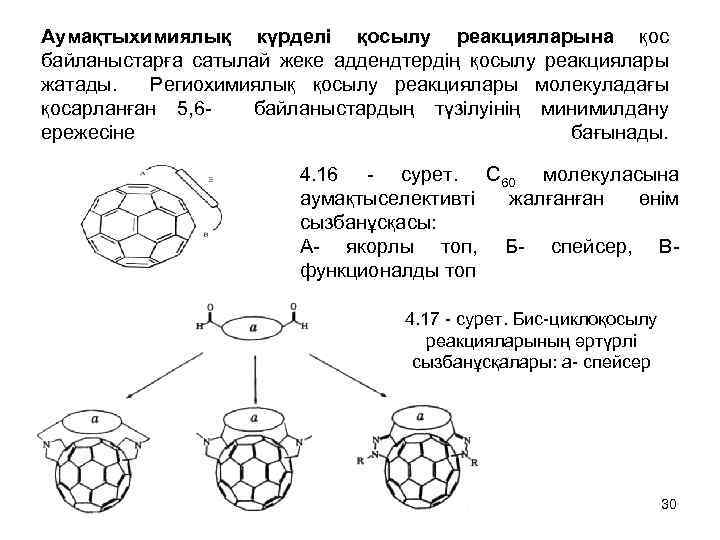
Аумақтыхимиялық күрделі қосылу реакцияларына қос байланыстарға сатылай жеке аддендтердің қосылу реакциялары жатады. Региохимиялық қосылу реакциялары молекуладағы қосарланған 5, 6 - байланыстардың түзілуінің минимилдану ережесіне бағынады. 4. 16 - сурет. C 60 молекуласына аумақтыселективті жалғанған өнім сызбанұсқасы: А- якорлы топ, Б- спейсер, В- функционалды топ 4. 17 - сурет. Бис-циклоқосылу реакцияларының әртүрлі сызбанұсқалары: а- спейсер 30

Гидрлеу. Фуллерендердің тұрақты гидридтері мен галогенидтерінің құрамында сутек атомының саны жұп болады. Қысым астында гидрлеу C 60 H 2 -C 60 H 18 және С 70 H 4 -C 70 H 30 молекулаларының түзілуіне алып келеді. Бүгінгі таңдағы синтезделген ең жоғарғы гидрид - С 60 H 44. Фуллерендерге гидроксотоптарды жалғау реакциялары- радикалдарды жалғау реакциялары ішіндегі негізгісі болып табылады. Полигидроксильденген фуллерендерді фуллеролдар (фуллеренолдар) деп атайды. Мұндай фуллеролдарды синтездеудің қарапайым әдістері құрамында кем дегенде 12 ОН топтары бар молекулалар синтездеуге мүмкіндік береді. Фуллеролдардың ішінде суда ерімталдары да кездеседі, мысалы, C 60(ОH)24. Фуллеролдар медицинада жұлдызды формалы полимерлердің сфералық ядролары ретінде немесе бос радикалдарды ұстағыш ретінде қолданылады. 31

Фуллерендердің тотығуы және электрофильді реагенттермен реакциялары – 200 ºC температурадан жоғары қыздырғанда немесе УК– сәулелендіргенде фуллерендер оттегімен СО 2 түзе тотығады. Озонолиздеу кезінде фуллерендер құрамында 5 оттегі атомы бар өнімдер түзе тотығады. Фуллерендерді тікелей немесе жанама тотықтыру арқылы C 60 On (n=1, 5, 9), С 70 On және димерлі C 120 O синтезделген. Фуллерендер ауада 200 -250 ºС бастап баяу тотыға бастайды, бұл кезде кристалдық құрылым бұзылып, атомдар қатынасы С: О=5: 1 болатындай оттекті қосылыс түзіледі. Тотығу жарықта қараңғыдағымен салыстырғанда жылдамырақ өтеді. Фуллерендер күшті тотықтырғыштармен және қышқылдармен реакцияласады. Фуллерендердің тотығуы нәтижесінде және катиондары түзілетіні анықталған. 32

• Эндоэдрлік фуллерендер (эндофуллерендер) Mn@Cm немесе i. Mn. Cm белгілеулері арқылы беріледі. Мысалы, i. La. C 82 (La@C 82), i. Sc 2 C 84 (Sc 2@C 84) және i. Sc 3 C 86 (Sc 3@C 86). ИЮПАК номенклатурасы бойынша оларды фуллерен-инкар-лантан және фуллерен-инкар-скандий деп атайды. Бір химиялық элемент бірнеше эндофуллерен түзе алатыны анықталған. Мысалы, Ln@Cn қосылысының n= 74, 82, 84, 88, 90, 92 немесе 94 болатын эндофуллерендері белгілі. Фуллерендердің эндоэдрлік қосылыстары ұшқыш болып келеді. Бұл қосылыстардың химиялық қасиеттері қарапайым фуллерендерден өзгеше болып келеді. Мұндай ерекшелік капсула . ішіне енгізілген атомның валенттік электрондарының фуллерен қаптамасына берілуіне байланысты болады. Осының нәтижесінде фуллерендерде күшті тотықсыздандырғыштық қасиет пайда болады да, жеңіл электронға ынтықты аддукт түзеді. 33