ІЗОГІПСИЧНІ ПЕРЕТВОРЕННЯ ФУНКЦІОНАЛЬНИХ ГРУП РЕАКЦІЇ ЗАМІЩЕННЯ ТА





zanyattya01.pptx
- Размер: 704.6 Кб
- Автор: Саня Трибрат
- Количество слайдов: 19
Описание презентации ІЗОГІПСИЧНІ ПЕРЕТВОРЕННЯ ФУНКЦІОНАЛЬНИХ ГРУП РЕАКЦІЇ ЗАМІЩЕННЯ ТА по слайдам
 ІЗОГІПСИЧНІ ПЕРЕТВОРЕННЯ ФУНКЦІОНАЛЬНИХ ГРУП РЕАКЦІЇ ЗАМІЩЕННЯ ТА ЕЛІМІНУВАННЯ Сучасні методи органічного синтезу
ІЗОГІПСИЧНІ ПЕРЕТВОРЕННЯ ФУНКЦІОНАЛЬНИХ ГРУП РЕАКЦІЇ ЗАМІЩЕННЯ ТА ЕЛІМІНУВАННЯ Сучасні методи органічного синтезу
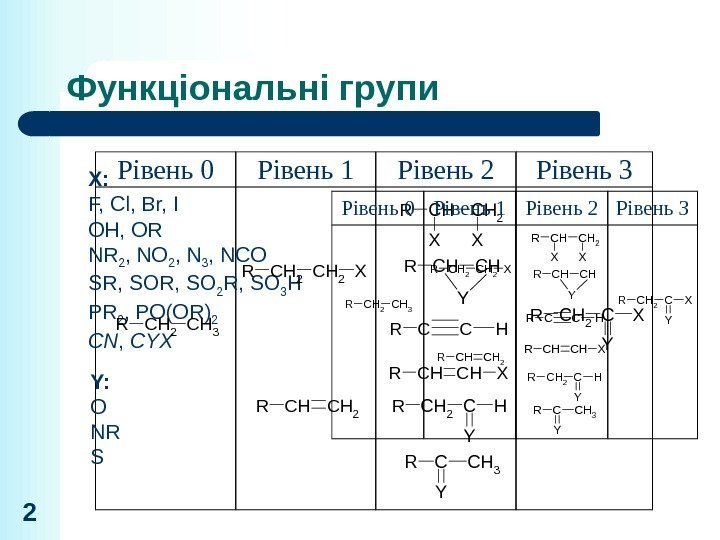
 Функціональні групи Рівень 0 Рівень 1 Рівень 2 Рівень 3 X: F, Cl, Br, I OH, OR NR 2 , NO 2 , N 3 , NCO SR, SO 2 R, SO 3 H PR 2 , PO(OR) 2 CN , CYX Y: O NR SCH 2 CH 3 R CH 2 RX CHCH 2 X R X CHCHR Y C C HR C H XR CH 2 C Y XR CHCH 2 RCH 2 C Y HR C C H 3 R Y 2 Рівень 0 Рівень 1 Рівень 2 Рівень 3 CH 2 CH 3 R CH 2 RX CHCH 2 X R X CHCHR Y CCHR CHCHXR CH 2 C Y XR CHCH 2 R C H 2 C Y HR CCH 3 R Y
Функціональні групи Рівень 0 Рівень 1 Рівень 2 Рівень 3 X: F, Cl, Br, I OH, OR NR 2 , NO 2 , N 3 , NCO SR, SO 2 R, SO 3 H PR 2 , PO(OR) 2 CN , CYX Y: O NR SCH 2 CH 3 R CH 2 RX CHCH 2 X R X CHCHR Y C C HR C H XR CH 2 C Y XR CHCH 2 RCH 2 C Y HR C C H 3 R Y 2 Рівень 0 Рівень 1 Рівень 2 Рівень 3 CH 2 CH 3 R CH 2 RX CHCH 2 X R X CHCHR Y CCHR CHCHXR CH 2 C Y XR CHCH 2 R C H 2 C Y HR CCH 3 R Y
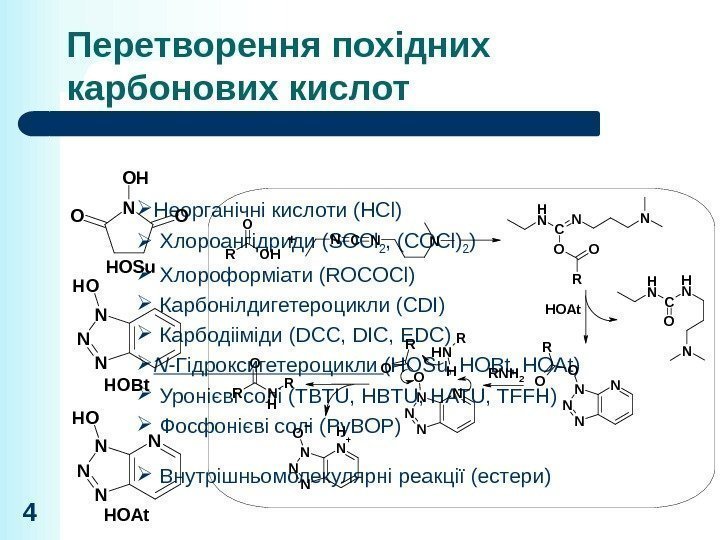
 Перетворення похідних карбонових кислот Активація карбонових кислот Неорганічні кислоти (HCl) Хлороангідриди (SOCl 2 , (COCl) 2 ) Хлороформіати (ROCOCl) Карбонілдигетероцикли (CDI) Карбодііміди (DCC, DIC, EDC) N -Гідроксигетероцикли (HOSu, HOBt, HOAt) Уронієві солі (TBTU, HATU, TFFH) Фосфонієві солі (Py. BOP) Внутрішньомолекулярні реакції (естери) N C N DCCNCN DIC NCNN EDC (EDCI, EDAC)
Перетворення похідних карбонових кислот Активація карбонових кислот Неорганічні кислоти (HCl) Хлороангідриди (SOCl 2 , (COCl) 2 ) Хлороформіати (ROCOCl) Карбонілдигетероцикли (CDI) Карбодііміди (DCC, DIC, EDC) N -Гідроксигетероцикли (HOSu, HOBt, HOAt) Уронієві солі (TBTU, HATU, TFFH) Фосфонієві солі (Py. BOP) Внутрішньомолекулярні реакції (естери) N C N DCCNCN DIC NCNN EDC (EDCI, EDAC)
 Перетворення похідних карбонових кислот Неорганічні кислоти (HCl) Хлороангідриди (SOCl 2 , (COCl) 2 ) Хлороформіати (ROCOCl) Карбонілдигетероцикли (CDI) Карбодііміди (DCC, DIC, EDC) N -Гідроксигетероцикли (HOSu, HOBt, HOAt) Уронієві солі (TBTU, HATU, TFFH) Фосфонієві солі (Py. BOP) Внутрішньомолекулярні реакції (естери)HOSu NOO OHHOBt. NN N OH HOAt N N N OH N HOAt NN N O NR OR O HO + N C N N RO C N N NH O O C NH NH N RNH 2 R N HO R NN N O NH + NN N O NR O NH R H
Перетворення похідних карбонових кислот Неорганічні кислоти (HCl) Хлороангідриди (SOCl 2 , (COCl) 2 ) Хлороформіати (ROCOCl) Карбонілдигетероцикли (CDI) Карбодііміди (DCC, DIC, EDC) N -Гідроксигетероцикли (HOSu, HOBt, HOAt) Уронієві солі (TBTU, HATU, TFFH) Фосфонієві солі (Py. BOP) Внутрішньомолекулярні реакції (естери)HOSu NOO OHHOBt. NN N OH HOAt N N N OH N HOAt NN N O NR OR O HO + N C N N RO C N N NH O O C NH NH N RNH 2 R N HO R NN N O NH + NN N O NR O NH R H
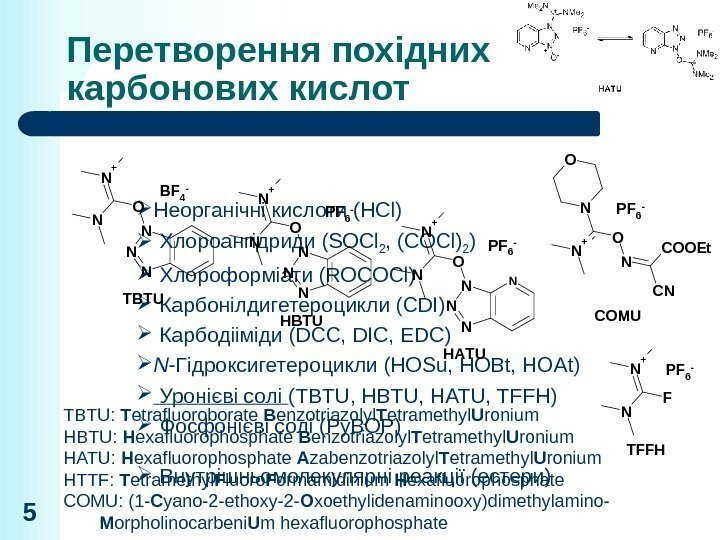
 Перетворення похідних карбонових кислот Неорганічні кислоти (HCl) Хлороангідриди (SOCl 2 , (COCl) 2 ) Хлороформіати (ROCOCl) Карбонілдигетероцикли (CDI) Карбодііміди (DCC, DIC, EDC) N -Гідроксигетероцикли (HOSu, HOBt, HOAt) Уронієві солі (TBTU, HATU, TFFH) Фосфонієві солі (Py. BOP) Внутрішньомолекулярні реакції (естери) 5 TBTU: T etrafluoroborate B enzotriazolyl T etramethyl U ronium HBTU: H exafluorophosphate B enzotriazolyl T etramethyl U ronium HATU: H exafluorophosphate A zabenzotriazolyl T etramethyl U ronium HTTF: T etramethyl F luoro F ormamidinium H exafluorophosphate COMU: (1 — C yano-2 -ethoxy-2 — O xoethylidenaminooxy)dimethylamino- M orpholinocarbeni U m hexafluorophosphate. N N N ON+ N TBTU BF 4 — N N N O N + N HBTU PF 6 — N N N O N N+ N HATU PF 6 — TFFH F N + N PF 6 — N + O N CN COOEt COMU PF 6 —
Перетворення похідних карбонових кислот Неорганічні кислоти (HCl) Хлороангідриди (SOCl 2 , (COCl) 2 ) Хлороформіати (ROCOCl) Карбонілдигетероцикли (CDI) Карбодііміди (DCC, DIC, EDC) N -Гідроксигетероцикли (HOSu, HOBt, HOAt) Уронієві солі (TBTU, HATU, TFFH) Фосфонієві солі (Py. BOP) Внутрішньомолекулярні реакції (естери) 5 TBTU: T etrafluoroborate B enzotriazolyl T etramethyl U ronium HBTU: H exafluorophosphate B enzotriazolyl T etramethyl U ronium HATU: H exafluorophosphate A zabenzotriazolyl T etramethyl U ronium HTTF: T etramethyl F luoro F ormamidinium H exafluorophosphate COMU: (1 — C yano-2 -ethoxy-2 — O xoethylidenaminooxy)dimethylamino- M orpholinocarbeni U m hexafluorophosphate. N N N ON+ N TBTU BF 4 — N N N O N + N HBTU PF 6 — N N N O N N+ N HATU PF 6 — TFFH F N + N PF 6 — N + O N CN COOEt COMU PF 6 —
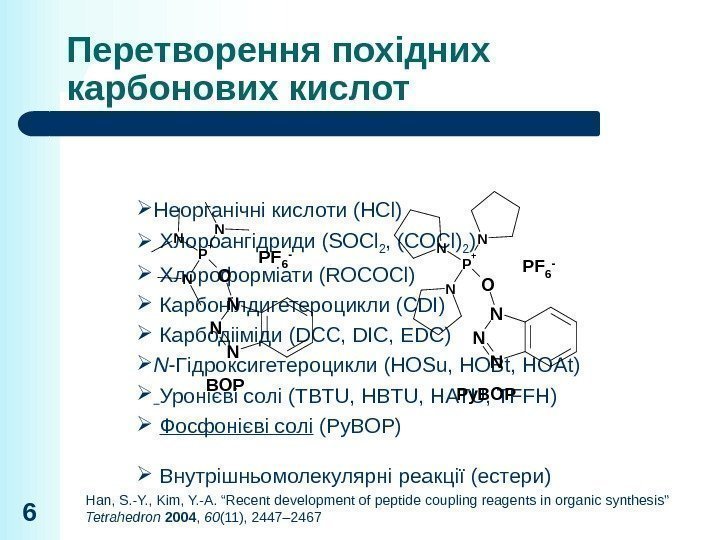
 Перетворення похідних карбонових кислот 6 Неорганічні кислоти (HCl) Хлороангідриди (SOCl 2 , (COCl) 2 ) Хлороформіати (ROCOCl) Карбонілдигетероцикли (CDI) Карбодііміди (DCC, DIC, EDC) N -Гідроксигетероцикли (HOSu, HOBt, HOAt) Уронієві солі (TBTU, HATU, TFFH) Фосфонієві солі (Py. BOP) Внутрішньомолекулярні реакції (естери)N N N O P + NN N BOP PF 6 — N N N OP + N N N Py. BOP PF 6 — Han, S. -Y. , Kim, Y. -A. “Recent development of peptide coupling reagents in organic synthesis” Tetrahedron 2004 , 60 (11), 2447–
Перетворення похідних карбонових кислот 6 Неорганічні кислоти (HCl) Хлороангідриди (SOCl 2 , (COCl) 2 ) Хлороформіати (ROCOCl) Карбонілдигетероцикли (CDI) Карбодііміди (DCC, DIC, EDC) N -Гідроксигетероцикли (HOSu, HOBt, HOAt) Уронієві солі (TBTU, HATU, TFFH) Фосфонієві солі (Py. BOP) Внутрішньомолекулярні реакції (естери)N N N O P + NN N BOP PF 6 — N N N OP + N N N Py. BOP PF 6 — Han, S. -Y. , Kim, Y. -A. “Recent development of peptide coupling reagents in organic synthesis” Tetrahedron 2004 , 60 (11), 2447–
 Перетворення функціональних груп (рівень 2) Рівень 0 Рівень 1 Рівень 2 Рівень 3 7 CH 2 CH 3 R CH 2 RX CHCH 2 X R X CHCHR Y CCHR CH 2 C Y XR C H 2 R CH 2 C Y HR C C H 3 R Y CHCHRX
Перетворення функціональних груп (рівень 2) Рівень 0 Рівень 1 Рівень 2 Рівень 3 7 CH 2 CH 3 R CH 2 RX CHCH 2 X R X CHCHR Y CCHR CH 2 C Y XR C H 2 R CH 2 C Y HR C C H 3 R Y CHCHRX
 Перетворення функціональних груп (рівень 1) 8 X: F, Cl, Br, I OH, OR NR 2 , NO 2 , N 3 , NCO SR, SO 2 R, SO 3 H PR 2 , PO(OR) 2 CN , CYX Y: O NR S Рівень 0 Рівень 1 Рівень 2 Рівень 3 CH 2 CH 3 R CH 2 RX CHCH 2 X R X CHCHR Y CCHR CHCHXR CH 2 C Y XR CHCH 2 R C H 2 C Y HR CCH 3 R Y
Перетворення функціональних груп (рівень 1) 8 X: F, Cl, Br, I OH, OR NR 2 , NO 2 , N 3 , NCO SR, SO 2 R, SO 3 H PR 2 , PO(OR) 2 CN , CYX Y: O NR S Рівень 0 Рівень 1 Рівень 2 Рівень 3 CH 2 CH 3 R CH 2 RX CHCH 2 X R X CHCHR Y CCHR CHCHXR CH 2 C Y XR CHCH 2 R C H 2 C Y HR CCH 3 R Y
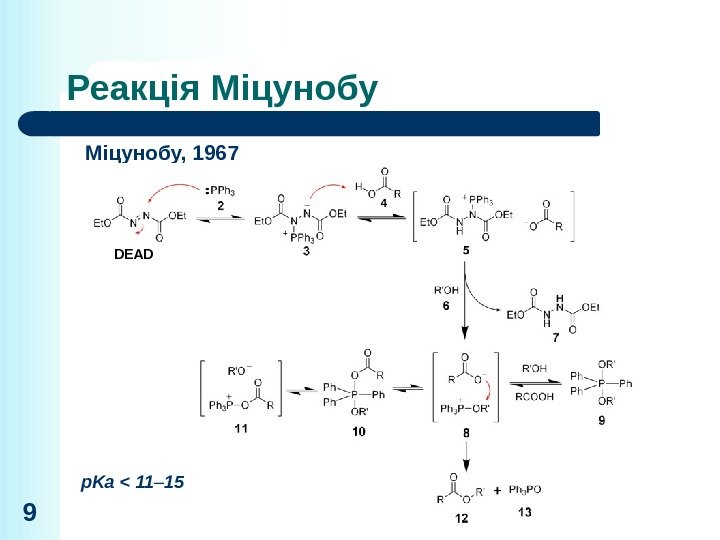
 Реакція Міцунобу 9 Міцунобу, 1967 DEAD + p. Ka < 11 –
Реакція Міцунобу 9 Міцунобу, 1967 DEAD + p. Ka < 11 –
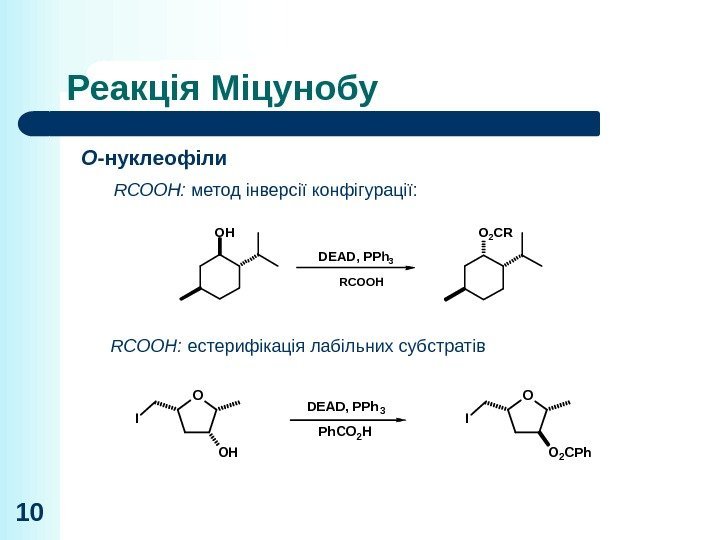
 Реакція Міцунобу 10 O OHI DEAD, PPh 3 Ph. CO 2 H O O 2 CPh. I Ts. O OH OC 1 6 H 3 3 DEAD, PPh 3 Ph. CO 2 H, T HF, 18 h Ts. O O 2 CPh OC 1 6 H 3 3 55%RCOOH: метод інверсії конфігурації: O -нуклеофіли RCOOH: естерифікація лабільних субстратів. OH DEAD, PPh 3 O 2 CR OH O R’ R’H 2 COH O Ph. HRCOOH
Реакція Міцунобу 10 O OHI DEAD, PPh 3 Ph. CO 2 H O O 2 CPh. I Ts. O OH OC 1 6 H 3 3 DEAD, PPh 3 Ph. CO 2 H, T HF, 18 h Ts. O O 2 CPh OC 1 6 H 3 3 55%RCOOH: метод інверсії конфігурації: O -нуклеофіли RCOOH: естерифікація лабільних субстратів. OH DEAD, PPh 3 O 2 CR OH O R’ R’H 2 COH O Ph. HRCOOH
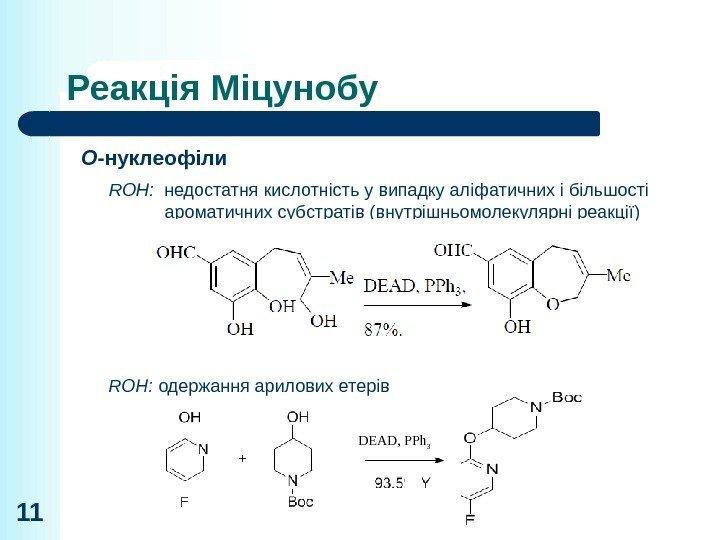
 Реакція Міцунобу 11 O -нуклеофіли ROH: недостатня кислотність у випадку аліфатичних і більшості ароматичних субстратів (внутрішньомолекулярні реакції) DEAD, PPh 3 ROH: одержання арилових етерів
Реакція Міцунобу 11 O -нуклеофіли ROH: недостатня кислотність у випадку аліфатичних і більшості ароматичних субстратів (внутрішньомолекулярні реакції) DEAD, PPh 3 ROH: одержання арилових етерів
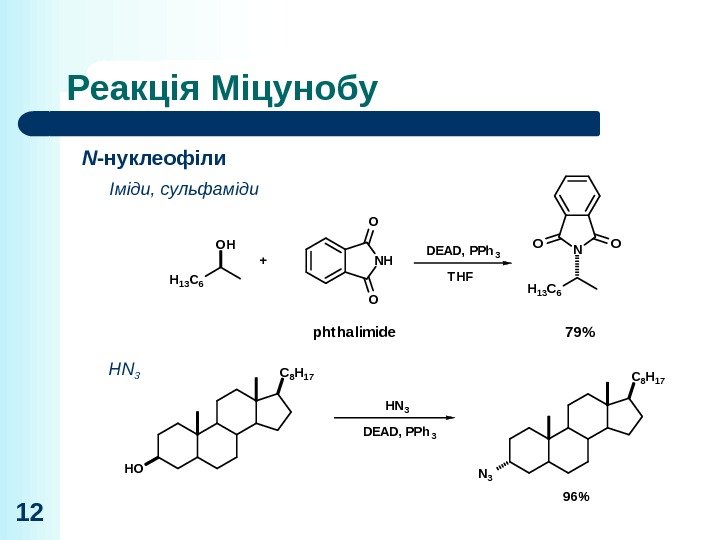
 Реакція Міцунобу 12 N -нуклеофіли Іміди, сульфаміди HN 3 DEAD, PPh 3 T HFOH + O O NH pht halimide OO N 79% N 2 H 4 Et OH NH 2 4 9%H 1 3 C 6 C 8 H 1 7 HO HN 3 DEAD, PPh 3 C 8 H 1 7 N 3 96%DEAD, PPh 3 T HFOH + O O NH pht halimide OO N 79 % N 2 H 4 Et OH NH 2 4 9%H 1 3 C 6 C 8 H 1 7 HO HN 3 DEAD, PPh 3 C 8 H 1 7 N 3 96%
Реакція Міцунобу 12 N -нуклеофіли Іміди, сульфаміди HN 3 DEAD, PPh 3 T HFOH + O O NH pht halimide OO N 79% N 2 H 4 Et OH NH 2 4 9%H 1 3 C 6 C 8 H 1 7 HO HN 3 DEAD, PPh 3 C 8 H 1 7 N 3 96%DEAD, PPh 3 T HFOH + O O NH pht halimide OO N 79 % N 2 H 4 Et OH NH 2 4 9%H 1 3 C 6 C 8 H 1 7 HO HN 3 DEAD, PPh 3 C 8 H 1 7 N 3 96%
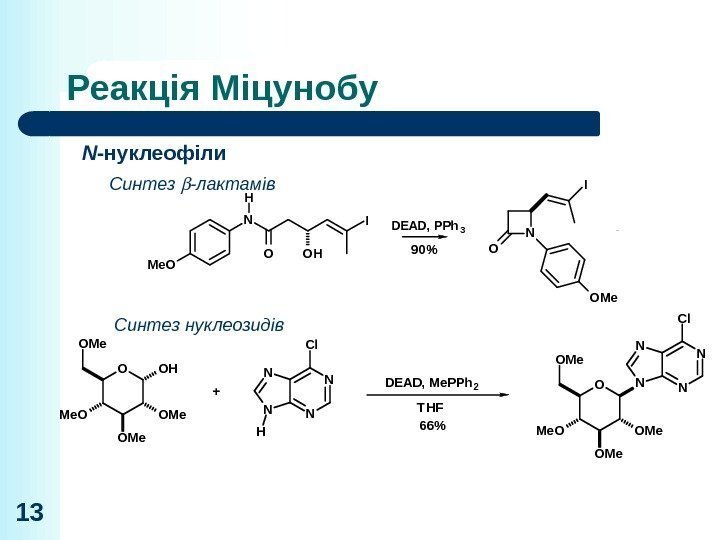
 Реакція Міцунобу 13 N -нуклеофіли Синтез -лактамів Синтез нуклеозидів O O O HO OHO HN COMe. O O OH IH N DEAD, PPh 3 90% O N OMe. I CAN Me. CN, H 2 O O N I H 1. t -Bu. Me 2 Si. Cl, Et 3 N 70% 3 st eps 2. LDA, Me. I O N I Si. Me 2 Bu t Lankicidin C OOH OMe OMe Me. O OMe DEAD, Me. PPh 2 T HF N H NN N Cl +O OMe OMe Me. O OMe N NN N Cl 66%
Реакція Міцунобу 13 N -нуклеофіли Синтез -лактамів Синтез нуклеозидів O O O HO OHO HN COMe. O O OH IH N DEAD, PPh 3 90% O N OMe. I CAN Me. CN, H 2 O O N I H 1. t -Bu. Me 2 Si. Cl, Et 3 N 70% 3 st eps 2. LDA, Me. I O N I Si. Me 2 Bu t Lankicidin C OOH OMe OMe Me. O OMe DEAD, Me. PPh 2 T HF N H NN N Cl +O OMe OMe Me. O OMe N NN N Cl 66%
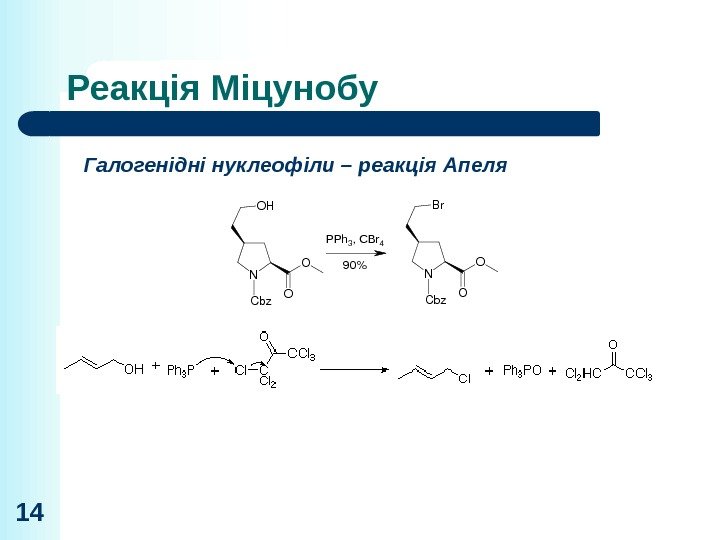
 14 Галогенідні нуклеофіли – реакція Апеля. N O O Br Cbz N O O OH Cbz 90% PPh 3, CBr 4 Реакція Міцунобу
14 Галогенідні нуклеофіли – реакція Апеля. N O O Br Cbz N O O OH Cbz 90% PPh 3, CBr 4 Реакція Міцунобу
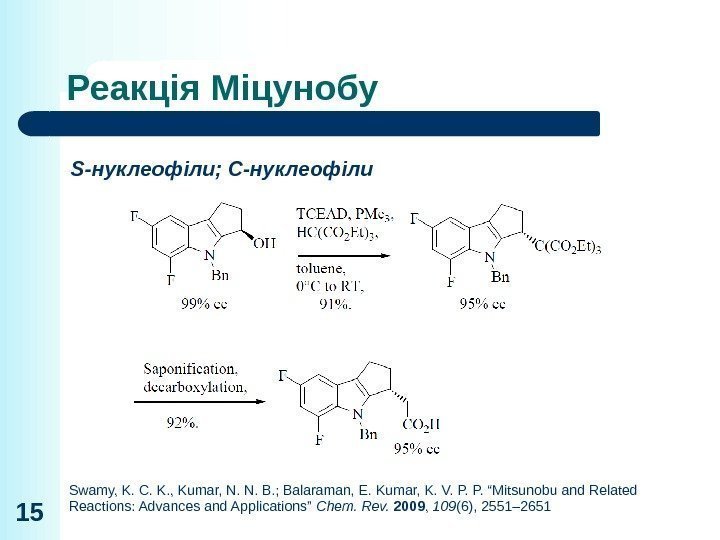
 15 S-нуклеофіли; С-нуклеофіли Swamy, K. C. K. , Kumar, N. N. B. ; Balaraman, E. Kumar, K. V. P. P. “Mitsunobu and Related Reactions: Advances and Applications” Chem. Rev. 2009 , 109 (6), 2551– 2651 Реакція Міцунобу
15 S-нуклеофіли; С-нуклеофіли Swamy, K. C. K. , Kumar, N. N. B. ; Balaraman, E. Kumar, K. V. P. P. “Mitsunobu and Related Reactions: Advances and Applications” Chem. Rev. 2009 , 109 (6), 2551– 2651 Реакція Міцунобу
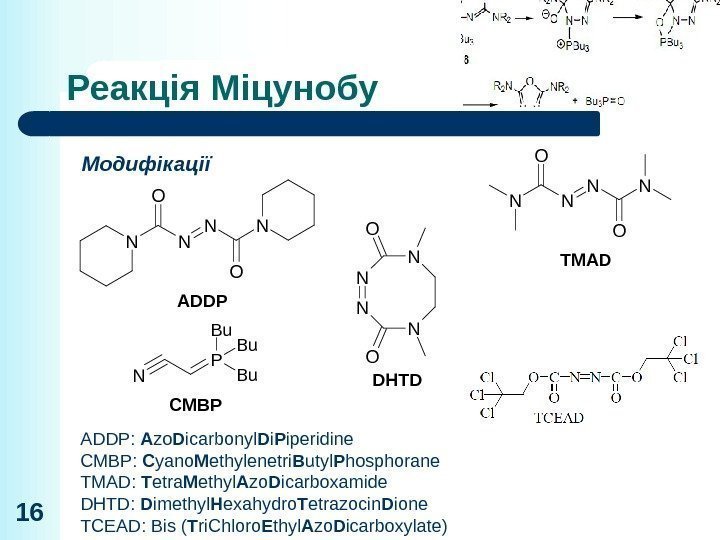
 Реакція Міцунобу 16 Модифікації ADDPN N N O O N ADDP: A zo D icarbonyl D i P iperidine CMBP: C yano M ethylenetri B utyl P hosphorane TMAD: T etra M ethyl A zo D icarboxamide DHTD: D imethyl H exahydro T etrazocin D ione TCEAD: Bis ( T ri. Chloro E thyl A zo D icarboxylate) CMBP N P Bu Bu Bu TMAD N N N O O N DHTD N N O O
Реакція Міцунобу 16 Модифікації ADDPN N N O O N ADDP: A zo D icarbonyl D i P iperidine CMBP: C yano M ethylenetri B utyl P hosphorane TMAD: T etra M ethyl A zo D icarboxamide DHTD: D imethyl H exahydro T etrazocin D ione TCEAD: Bis ( T ri. Chloro E thyl A zo D icarboxylate) CMBP N P Bu Bu Bu TMAD N N N O O N DHTD N N O O
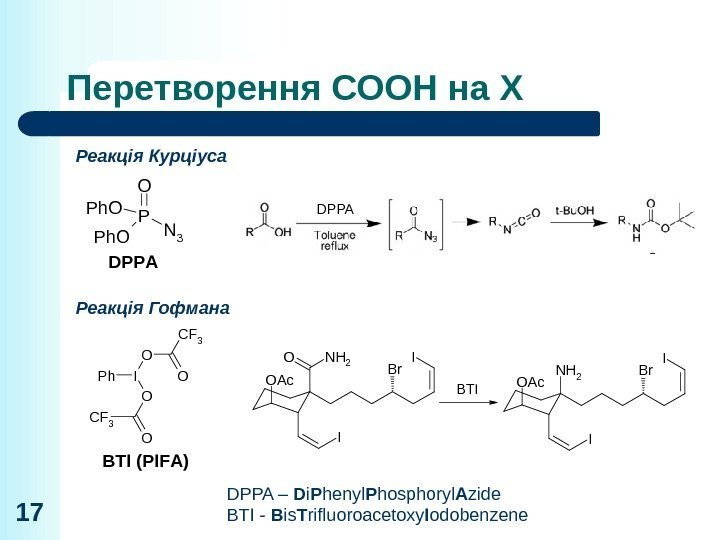
 Перетворення СООН на Х 17 Реакція Курціуса Реакція Гофмана DPPA – D i P henyl P hosphoryl A zide BTI — B is T rifluoroacetoxy I odobenzene DPPA P N 3 O P h O DPPAOAc NH 2 OI Br I BTIOAc NH 2 I Br I BTI (PIFA) I OO C F 3 O OC F 3 P h
Перетворення СООН на Х 17 Реакція Курціуса Реакція Гофмана DPPA – D i P henyl P hosphoryl A zide BTI — B is T rifluoroacetoxy I odobenzene DPPA P N 3 O P h O DPPAOAc NH 2 OI Br I BTIOAc NH 2 I Br I BTI (PIFA) I OO C F 3 O OC F 3 P h
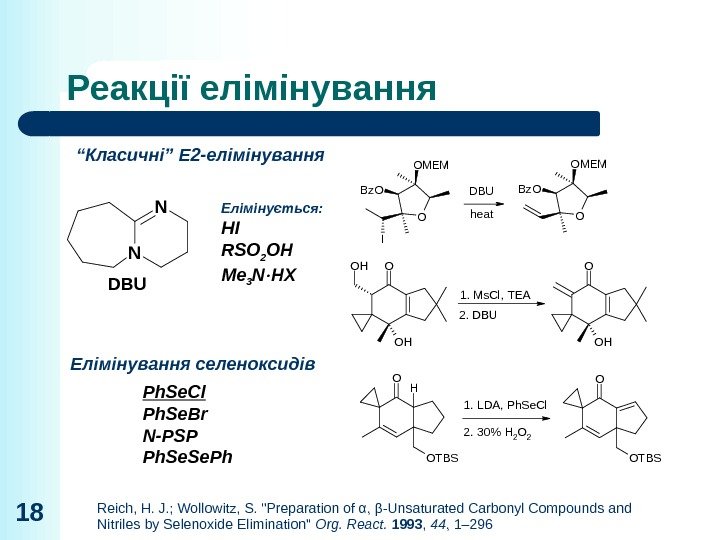
 Реакції елімінування 18 DBU N NO OMEM I Bz. O DBU O OMEM Bz. O heat 2. DBU 1. Ms. Cl, TEA OH OH O Елімінування селеноксидів “ Класичні” E 2 -елімінування Елімінується: HI RSO 2 OH Me 3 N HX OTBS HO 1. LDA, Ph. Se. Cl 2. 30% H 2 O 2 OTBS OPh. Se. Cl Ph. Se. Br N-PSP Ph. Se. Ph Reich, H. J. ; Wollowitz, S. «Preparation of α, β-Unsaturated Carbonyl Compounds and Nitriles by Selenoxide Elimination» Org. React. 1993 , 44 , 1–
Реакції елімінування 18 DBU N NO OMEM I Bz. O DBU O OMEM Bz. O heat 2. DBU 1. Ms. Cl, TEA OH OH O Елімінування селеноксидів “ Класичні” E 2 -елімінування Елімінується: HI RSO 2 OH Me 3 N HX OTBS HO 1. LDA, Ph. Se. Cl 2. 30% H 2 O 2 OTBS OPh. Se. Cl Ph. Se. Br N-PSP Ph. Se. Ph Reich, H. J. ; Wollowitz, S. «Preparation of α, β-Unsaturated Carbonyl Compounds and Nitriles by Selenoxide Elimination» Org. React. 1993 , 44 , 1–
 Реакції елімінування 19 Піролітичне син-елімінування Елімінування за Коупом ( N -оксиди) Елімінування за Чугаєвим (ксантати) Дегідратація за участі реагента Бургеса. Burgess’ reagent N +S O O NO O 1. Me. OH 2. TEACl S O O N O Вторинні спирти Третинні спирти Первинні аміди Формаміди Khapli, S. ; Dey, S. ; Mal, D. «Burgess reagent in organic synthesis» J. Indian Inst. Sci. 2001 , 81 , 461– 476.
Реакції елімінування 19 Піролітичне син-елімінування Елімінування за Коупом ( N -оксиди) Елімінування за Чугаєвим (ксантати) Дегідратація за участі реагента Бургеса. Burgess’ reagent N +S O O NO O 1. Me. OH 2. TEACl S O O N O Вторинні спирти Третинні спирти Первинні аміди Формаміди Khapli, S. ; Dey, S. ; Mal, D. «Burgess reagent in organic synthesis» J. Indian Inst. Sci. 2001 , 81 , 461– 476.
