Заняття1.ppt
- Количество слайдов: 18
 ІЗОГІПСИЧНІ ПЕРЕТВОРЕННЯ ФУНКЦІОНАЛЬНИХ ГРУП РЕАКЦІЇ ЗАМІЩЕННЯ ТА ЕЛІМІНУВАННЯ Сучасні методи органічного синтезу
ІЗОГІПСИЧНІ ПЕРЕТВОРЕННЯ ФУНКЦІОНАЛЬНИХ ГРУП РЕАКЦІЇ ЗАМІЩЕННЯ ТА ЕЛІМІНУВАННЯ Сучасні методи органічного синтезу
 Функціональні групи Рівень 1 Рівень 2 Рівень 3 X: Рівень 0 F, Cl, Br, I Рівень 0 Рівень 1 Рівень 2 Рівень 3 OH, OR NR 2, NO 2, N 3, NCO SR, SO 2 R, SO 3 H PR 2, PO(OR)2 CN, CYX Y: O NR S 2
Функціональні групи Рівень 1 Рівень 2 Рівень 3 X: Рівень 0 F, Cl, Br, I Рівень 0 Рівень 1 Рівень 2 Рівень 3 OH, OR NR 2, NO 2, N 3, NCO SR, SO 2 R, SO 3 H PR 2, PO(OR)2 CN, CYX Y: O NR S 2
 Перетворення похідних карбонових кислот Активація карбонових кислот ØНеорганічні кислоти (HCl) Ø Хлороангідриди (SOCl 2, (COCl)2) Ø Хлороформіати (ROCOCl) Ø Карбонілдигетероцикли (CDI) Ø Карбодііміди (DCC, DIC, EDC) ØN-Гідроксигетероцикли (HOSu, HOBt, HOAt) Ø Уронієві солі (TBTU, HATU, TFFH) Ø Фосфонієві солі (Py. BOP) Ø Внутрішньомолекулярні реакції (естери) 3
Перетворення похідних карбонових кислот Активація карбонових кислот ØНеорганічні кислоти (HCl) Ø Хлороангідриди (SOCl 2, (COCl)2) Ø Хлороформіати (ROCOCl) Ø Карбонілдигетероцикли (CDI) Ø Карбодііміди (DCC, DIC, EDC) ØN-Гідроксигетероцикли (HOSu, HOBt, HOAt) Ø Уронієві солі (TBTU, HATU, TFFH) Ø Фосфонієві солі (Py. BOP) Ø Внутрішньомолекулярні реакції (естери) 3
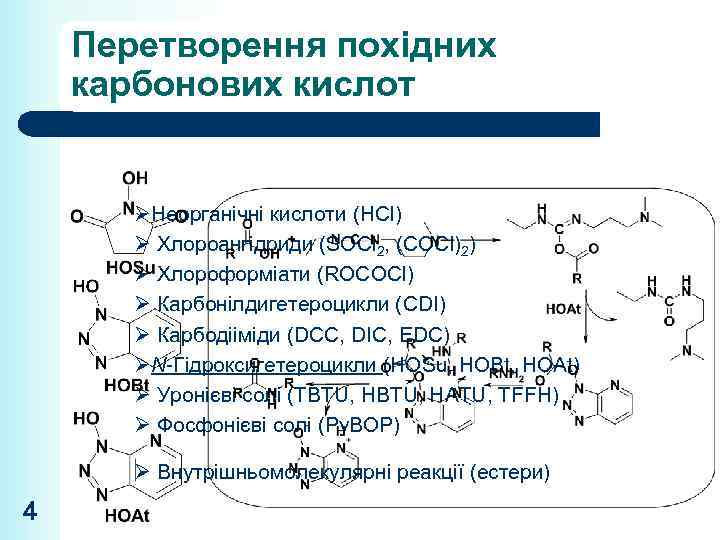 Перетворення похідних карбонових кислот ØНеорганічні кислоти (HCl) Ø Хлороангідриди (SOCl 2, (COCl)2) Ø Хлороформіати (ROCOCl) Ø Карбонілдигетероцикли (CDI) Ø Карбодііміди (DCC, DIC, EDC) ØN-Гідроксигетероцикли (HOSu, HOBt, HOAt) Ø Уронієві солі (TBTU, HATU, TFFH) Ø Фосфонієві солі (Py. BOP) Ø Внутрішньомолекулярні реакції (естери) 4
Перетворення похідних карбонових кислот ØНеорганічні кислоти (HCl) Ø Хлороангідриди (SOCl 2, (COCl)2) Ø Хлороформіати (ROCOCl) Ø Карбонілдигетероцикли (CDI) Ø Карбодііміди (DCC, DIC, EDC) ØN-Гідроксигетероцикли (HOSu, HOBt, HOAt) Ø Уронієві солі (TBTU, HATU, TFFH) Ø Фосфонієві солі (Py. BOP) Ø Внутрішньомолекулярні реакції (естери) 4
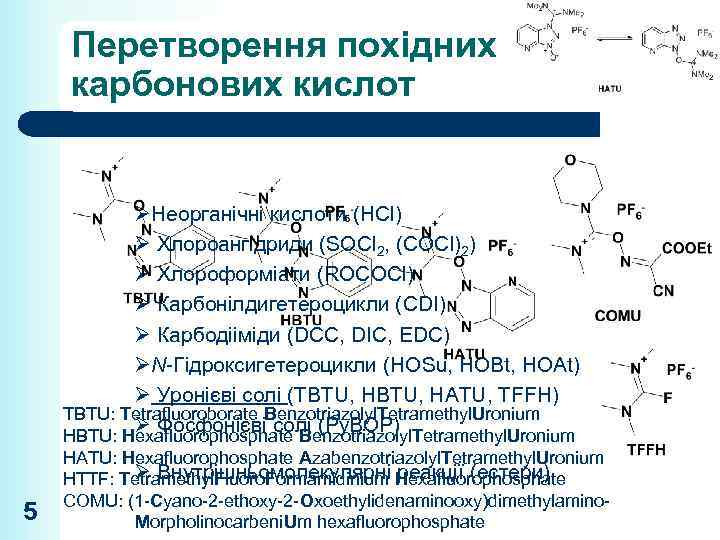 Перетворення похідних карбонових кислот ØНеорганічні кислоти (HCl) Ø Хлороангідриди (SOCl 2, (COCl)2) Ø Хлороформіати (ROCOCl) Ø Карбонілдигетероцикли (CDI) Ø Карбодііміди (DCC, DIC, EDC) ØN-Гідроксигетероцикли (HOSu, HOBt, HOAt) Ø Уронієві солі (TBTU, HATU, TFFH) TBTU: Tetrafluoroborate Benzotriazolyl. Tetramethyl. Uronium Ø Фосфонієві солі (Py. BOP) HBTU: Hexafluorophosphate Benzotriazolyl. Tetramethyl. Uronium 5 HATU: Hexafluorophosphate Azabenzotriazolyl. Tetramethyl. Uronium Ø Внутрішньомолекулярні реакції (естери) HTTF: Tetramethyl. Fluoro. Formamidinium Hexafluorophosphate COMU: (1 -Cyano-2 -ethoxy-2 -Oxoethylidenaminooxy)dimethylamino. Morpholinocarbeni. Um hexafluorophosphate
Перетворення похідних карбонових кислот ØНеорганічні кислоти (HCl) Ø Хлороангідриди (SOCl 2, (COCl)2) Ø Хлороформіати (ROCOCl) Ø Карбонілдигетероцикли (CDI) Ø Карбодііміди (DCC, DIC, EDC) ØN-Гідроксигетероцикли (HOSu, HOBt, HOAt) Ø Уронієві солі (TBTU, HATU, TFFH) TBTU: Tetrafluoroborate Benzotriazolyl. Tetramethyl. Uronium Ø Фосфонієві солі (Py. BOP) HBTU: Hexafluorophosphate Benzotriazolyl. Tetramethyl. Uronium 5 HATU: Hexafluorophosphate Azabenzotriazolyl. Tetramethyl. Uronium Ø Внутрішньомолекулярні реакції (естери) HTTF: Tetramethyl. Fluoro. Formamidinium Hexafluorophosphate COMU: (1 -Cyano-2 -ethoxy-2 -Oxoethylidenaminooxy)dimethylamino. Morpholinocarbeni. Um hexafluorophosphate
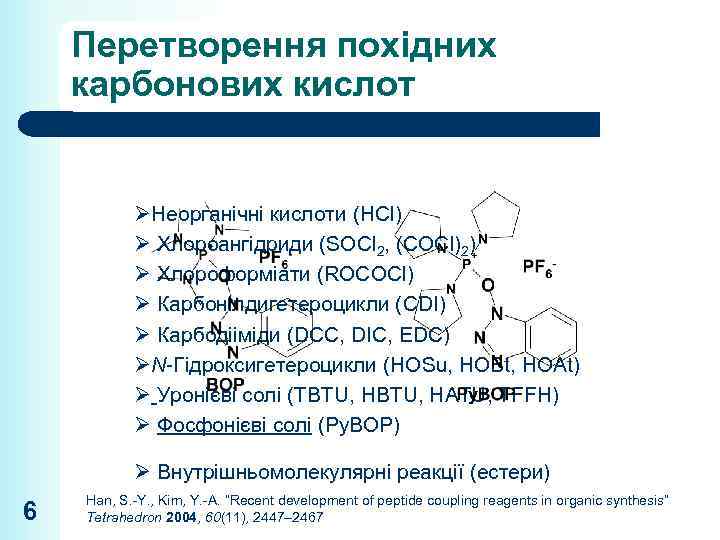 Перетворення похідних карбонових кислот ØНеорганічні кислоти (HCl) Ø Хлороангідриди (SOCl 2, (COCl)2) Ø Хлороформіати (ROCOCl) Ø Карбонілдигетероцикли (CDI) Ø Карбодііміди (DCC, DIC, EDC) ØN-Гідроксигетероцикли (HOSu, HOBt, HOAt) Ø Уронієві солі (TBTU, HATU, TFFH) Ø Фосфонієві солі (Py. BOP) Ø Внутрішньомолекулярні реакції (естери) 6 Han, S. -Y. , Kim, Y. -A. “Recent development of peptide coupling reagents in organic synthesis” Tetrahedron 2004, 60(11), 2447– 2467
Перетворення похідних карбонових кислот ØНеорганічні кислоти (HCl) Ø Хлороангідриди (SOCl 2, (COCl)2) Ø Хлороформіати (ROCOCl) Ø Карбонілдигетероцикли (CDI) Ø Карбодііміди (DCC, DIC, EDC) ØN-Гідроксигетероцикли (HOSu, HOBt, HOAt) Ø Уронієві солі (TBTU, HATU, TFFH) Ø Фосфонієві солі (Py. BOP) Ø Внутрішньомолекулярні реакції (естери) 6 Han, S. -Y. , Kim, Y. -A. “Recent development of peptide coupling reagents in organic synthesis” Tetrahedron 2004, 60(11), 2447– 2467
 Перетворення функціональних груп (рівень 2) Рівень 0 7 Рівень 1 Рівень 2 Рівень 3
Перетворення функціональних груп (рівень 2) Рівень 0 7 Рівень 1 Рівень 2 Рівень 3
 Перетворення функціональних груп (рівень 1) X: F, Cl, Br, I OH, OR NR 2, NO 2, N 3, NCO SR, SO 2 R, SO 3 H PR 2, PO(OR)2 CN, CYX Y: O NR S 8 Рівень 0 Рівень 1 Рівень 2 Рівень 3
Перетворення функціональних груп (рівень 1) X: F, Cl, Br, I OH, OR NR 2, NO 2, N 3, NCO SR, SO 2 R, SO 3 H PR 2, PO(OR)2 CN, CYX Y: O NR S 8 Рівень 0 Рівень 1 Рівень 2 Рівень 3
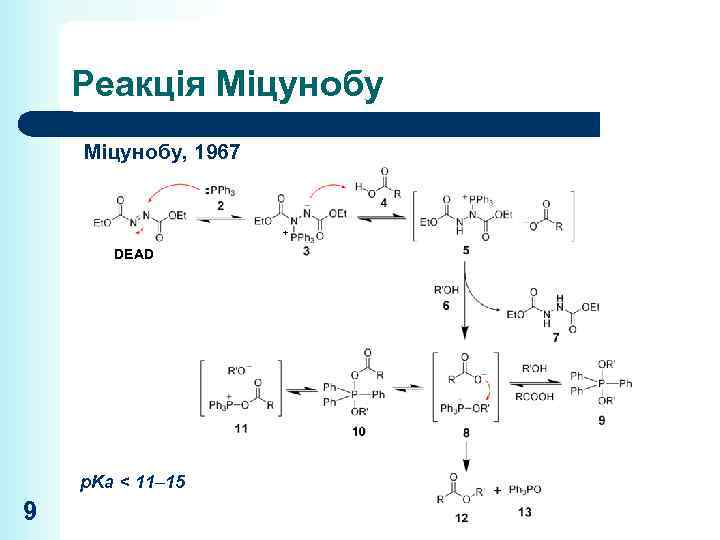 Реакція Міцунобу, 1967 + DEAD p. Ka < 11– 15 9
Реакція Міцунобу, 1967 + DEAD p. Ka < 11– 15 9
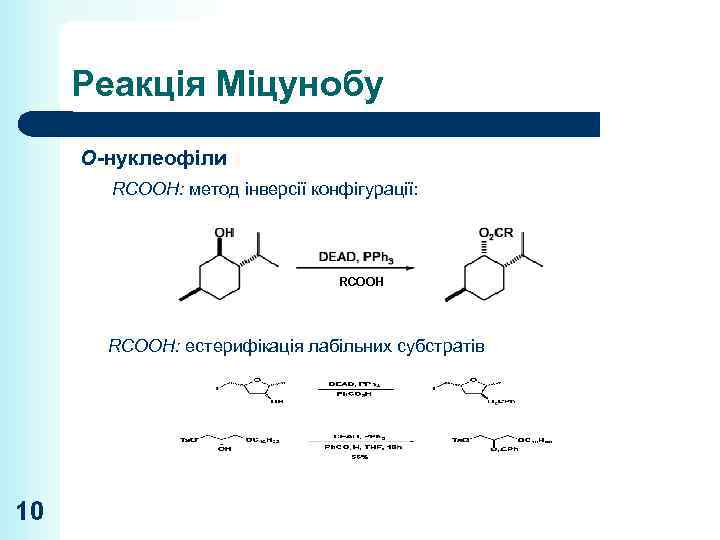 Реакція Міцунобу O-нуклеофіли RCOOH: метод інверсії конфігурації: RCOOH: естерифікація лабільних субстратів 10
Реакція Міцунобу O-нуклеофіли RCOOH: метод інверсії конфігурації: RCOOH: естерифікація лабільних субстратів 10
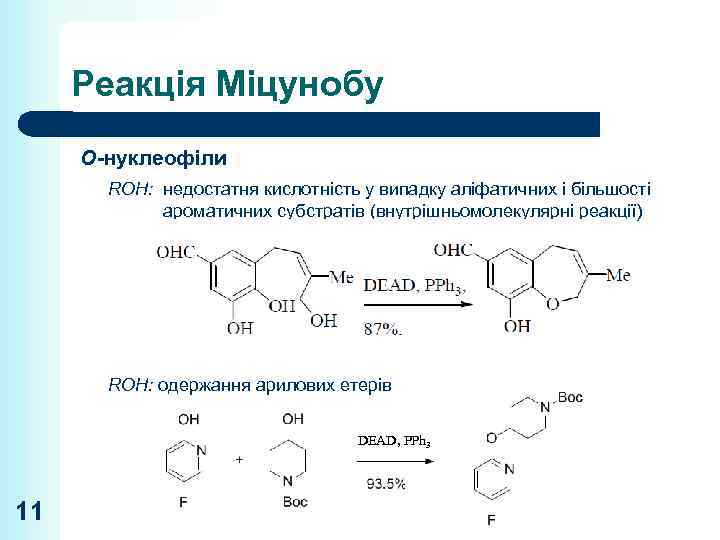 Реакція Міцунобу O-нуклеофіли ROH: недостатня кислотність у випадку аліфатичних і більшості ароматичних субстратів (внутрішньомолекулярні реакції) ROH: одержання арилових етерів DEAD, PPh 3 11
Реакція Міцунобу O-нуклеофіли ROH: недостатня кислотність у випадку аліфатичних і більшості ароматичних субстратів (внутрішньомолекулярні реакції) ROH: одержання арилових етерів DEAD, PPh 3 11
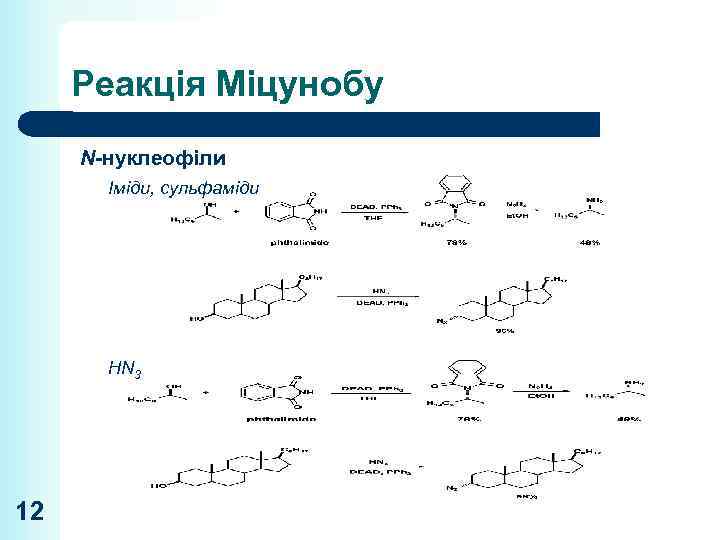 Реакція Міцунобу N-нуклеофіли Іміди, сульфаміди HN 3 12
Реакція Міцунобу N-нуклеофіли Іміди, сульфаміди HN 3 12
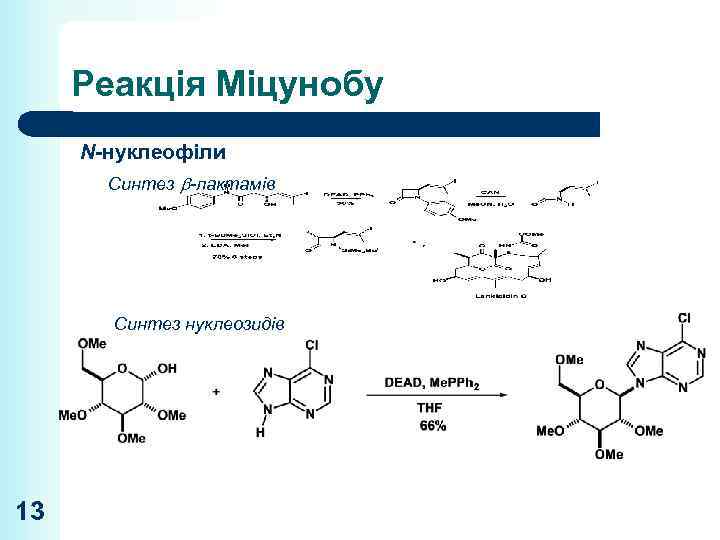 Реакція Міцунобу N-нуклеофіли Синтез -лактамів Синтез нуклеозидів 13
Реакція Міцунобу N-нуклеофіли Синтез -лактамів Синтез нуклеозидів 13
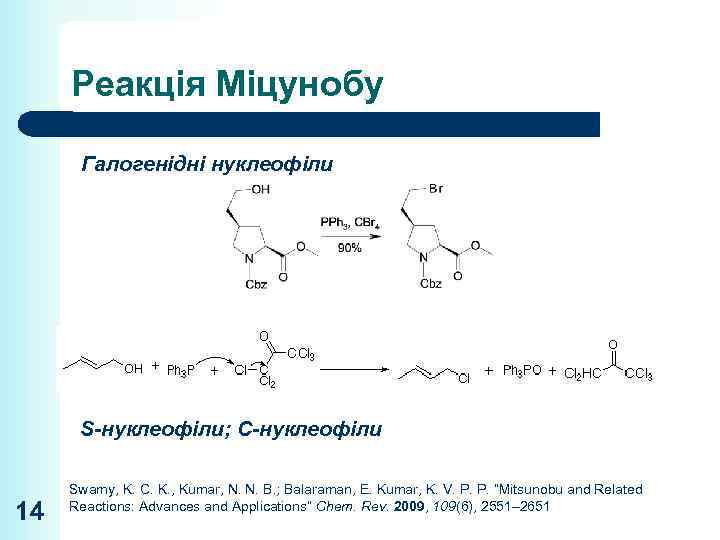 Реакція Міцунобу Галогенідні нуклеофіли S-нуклеофіли; С-нуклеофіли 14 Swamy, K. C. K. , Kumar, N. N. B. ; Balaraman, E. Kumar, K. V. P. P. “Mitsunobu and Related Reactions: Advances and Applications” Chem. Rev. 2009, 109(6), 2551– 2651
Реакція Міцунобу Галогенідні нуклеофіли S-нуклеофіли; С-нуклеофіли 14 Swamy, K. C. K. , Kumar, N. N. B. ; Balaraman, E. Kumar, K. V. P. P. “Mitsunobu and Related Reactions: Advances and Applications” Chem. Rev. 2009, 109(6), 2551– 2651
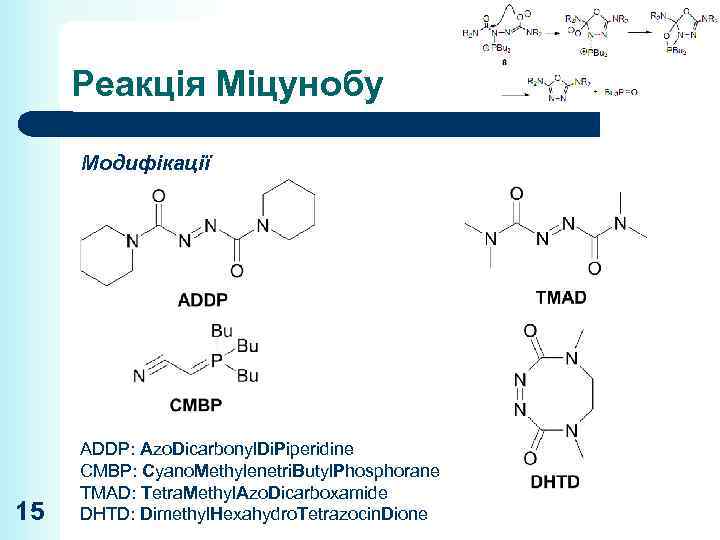 Реакція Міцунобу Модифікації 15 ADDP: Azo. Dicarbonyl. Di. Piperidine CMBP: Cyano. Methylenetri. Butyl. Phosphorane TMAD: Tetra. Methyl. Azo. Dicarboxamide DHTD: Dimethyl. Hexahydro. Tetrazocin. Dione
Реакція Міцунобу Модифікації 15 ADDP: Azo. Dicarbonyl. Di. Piperidine CMBP: Cyano. Methylenetri. Butyl. Phosphorane TMAD: Tetra. Methyl. Azo. Dicarboxamide DHTD: Dimethyl. Hexahydro. Tetrazocin. Dione
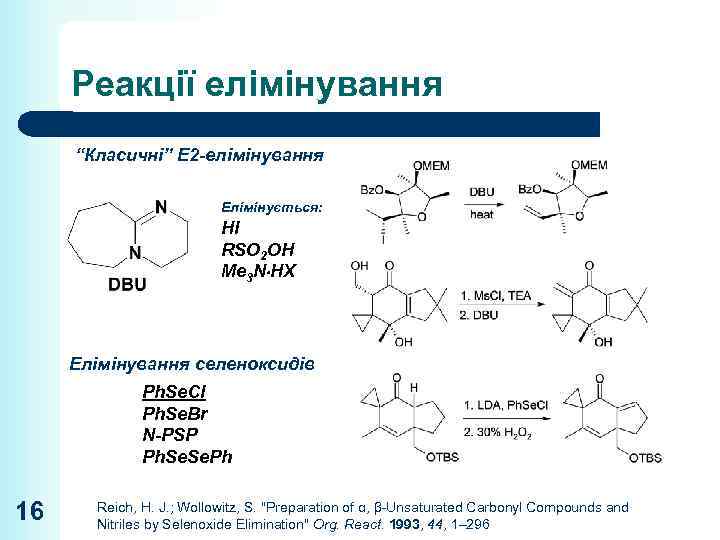 Реакції елімінування “Класичні” E 2 -елімінування Елімінується: HI RSO 2 OH Me 3 N HX Елімінування селеноксидів Ph. Se. Cl Ph. Se. Br N-PSP Ph. Se. Ph 16 Reich, H. J. ; Wollowitz, S. "Preparation of α, β-Unsaturated Carbonyl Compounds and Nitriles by Selenoxide Elimination" Org. React. 1993, 44, 1– 296
Реакції елімінування “Класичні” E 2 -елімінування Елімінується: HI RSO 2 OH Me 3 N HX Елімінування селеноксидів Ph. Se. Cl Ph. Se. Br N-PSP Ph. Se. Ph 16 Reich, H. J. ; Wollowitz, S. "Preparation of α, β-Unsaturated Carbonyl Compounds and Nitriles by Selenoxide Elimination" Org. React. 1993, 44, 1– 296
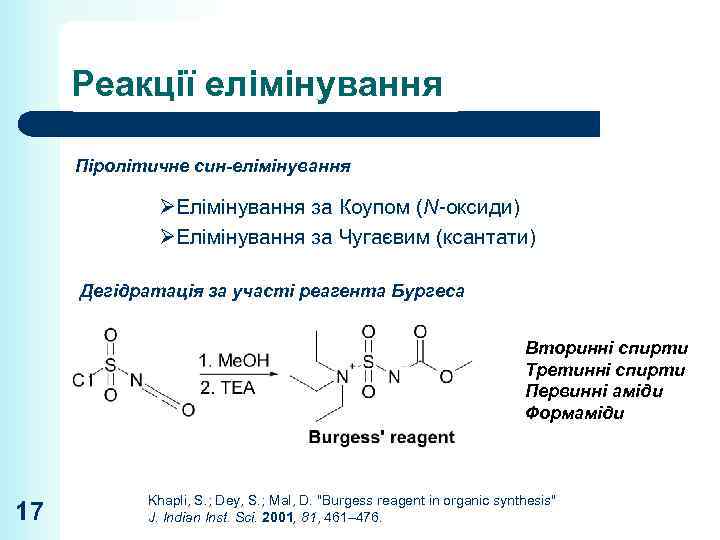 Реакції елімінування Піролітичне син-елімінування ØЕлімінування за Коупом (N-оксиди) ØЕлімінування за Чугаєвим (ксантати) Дегідратація за участі реагента Бургеса Вторинні спирти Третинні спирти Первинні аміди Формаміди 17 Khapli, S. ; Dey, S. ; Mal, D. "Burgess reagent in organic synthesis" J. Indian Inst. Sci. 2001, 81, 461– 476.
Реакції елімінування Піролітичне син-елімінування ØЕлімінування за Коупом (N-оксиди) ØЕлімінування за Чугаєвим (ксантати) Дегідратація за участі реагента Бургеса Вторинні спирти Третинні спирти Первинні аміди Формаміди 17 Khapli, S. ; Dey, S. ; Mal, D. "Burgess reagent in organic synthesis" J. Indian Inst. Sci. 2001, 81, 461– 476.
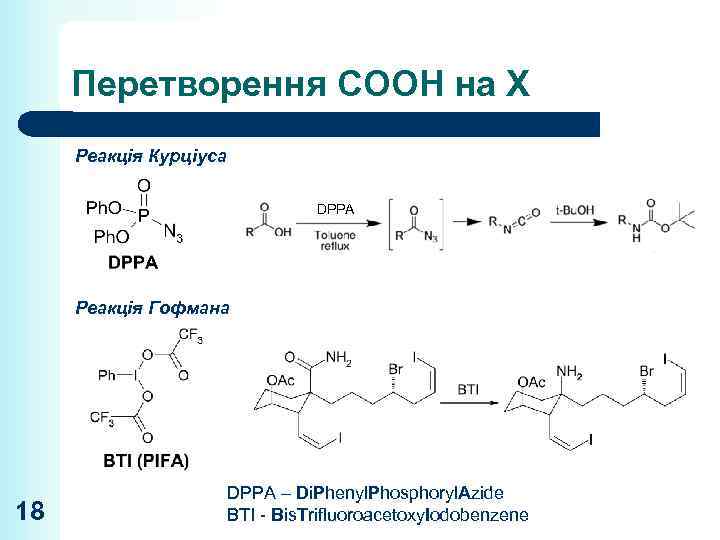 Перетворення СООН на Х Реакція Курціуса DPPA Реакція Гофмана 18 DPPA – Di. Phenyl. Phosphoryl. Azide BTI - Bis. Trifluoroacetoxy. Iodobenzene
Перетворення СООН на Х Реакція Курціуса DPPA Реакція Гофмана 18 DPPA – Di. Phenyl. Phosphoryl. Azide BTI - Bis. Trifluoroacetoxy. Iodobenzene


