tverdye_rastvory-1-2011.ppt
- Количество слайдов: 41

Избранные главы неорганического материаловедения Лекция 9 Твердые растворы -1 Закономерности взаимной растворимости твердых фаз.

Твердые растворы – фазы переменного состава, имеющие кристаллическую решетку фазы – «растворителя» .

L β α TА ’ α TB ’ Система без растворимости в твердом состоянии Система с ограниченными ( ά и β) и непрерывным (α) твердыми растворами

Твердые растворы: А. Замещения - изовалентное замещение - алиовалентное (гетеровалентное) замещение. Твердые растворы вычитания. Б. Внедрения

Твердые растворы замещения. а 1 А x A 1 -x. Bx A а x A 1 -x. Bx B В

Элементарная ячейка молекулярного ОЦК-кристалла.

Кристаллический полимер. Твердый раствор.

Твердые растворы замещения. 2 Твердые растворы замещения образуются, если: 1. Для ковалентных веществ: Компоненты имеют сходное электронное строение Для ионных веществ: Компоненты имеют одинаковый заряд ионов или есть возможность компенсации различия зарядов. 2. Атомные (ионные) радиусы близки (для сложных веществ: близкие параметры эл. ячеек).
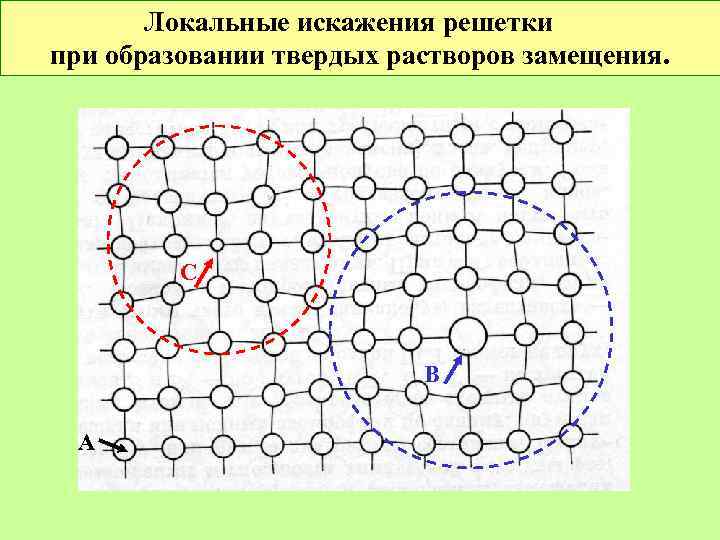
Локальные искажения решетки при образовании твердых растворов замещения. С В А

Соотношение между термодинамическими функциями смешения и типами диаграмм состояния. ΔGсм = Gтв. р-ра – х. АGА - (1 - х. А)GВ ΔGсм = ΔНсм – ТΔSсм
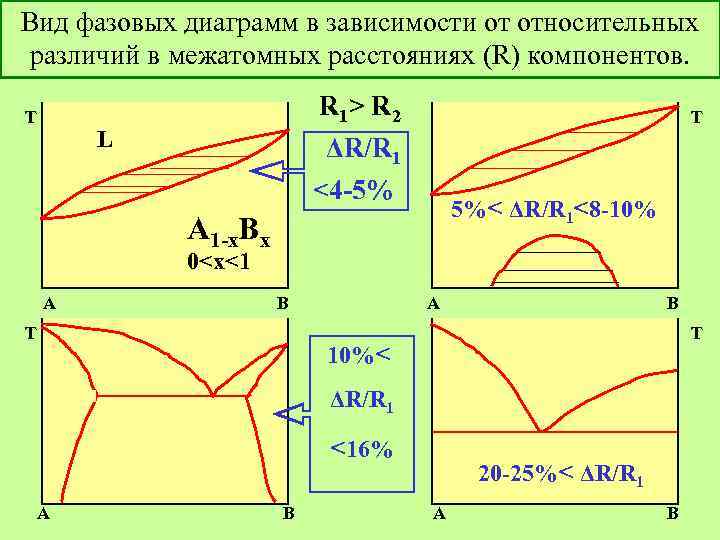
Вид фазовых диаграмм в зависимости от относительных различий в межатомных расстояниях (R) компонентов. T R 1> R 2 L T ΔR/R 1 <4 -5% 5%< ΔR/R 1<8 -10% A 1 -x. Bx 0<x<1 A B T 10%< ΔR/R 1 <16% A B 20 -25%< ΔR/R 1 A B

Фазовые диаграммы систем Sc 2 O 3 – Ln 2 O 3 Sc 2 O 3 Yb 2 O 3 Sc 2 O 3 ΔR/R 1: 5, 29% Sc R 3+, Å | 0, 75 Ho 2 O 3 Sc 2 O 3 6, 52% Dy 2 O 3 7, 32% Sc 2 O 3 La 2 O 3 11, 88% |Lu Yb Tm Er Ho Dy Tb Gd Eu Sm Nd Pr Ce La 0, 87 0, 90 | 0, 92 1, 04

Фазовые диаграммы систем La 2 O 3 – Ln 2 O 3 ΔR/R 1: 2, 46 % 6, 97 % La| Ce |Pr |Nd |Sm |Eu |Gd |Tb |Dy |Ho |Er |Tm |Yb |Lu | R 3+, Å |1, 04 0, 98 0, 87

Твердые растворы замещения. Растворимость компонента с меньшим размером атома (иона) в матрице компонента с бóльшим ионным (атомным) радиусом всегда больше, чем наоборот. r(Al+3) = 0, 50Å r(Ga+3) = 0, 62Å

При одинаковой разнице размеров замещающего и замещаемого ионов взаимная растворимость больше в случае большего размера ионов противоположного заряда и более сложных структур.

990 о Т, о. С 800 о 772 о 856 о Т, о. С 720 о 5% 500 о KF Na. F 754 о Na. Cl 718 о KCl Т, о. С 688 о 677 о Т, о. С 240 о 395 о Na. Br KBr Na. J KJ

990 о 854 о Т, о. С 632 о 5% Na. F Li. F Увеличение взаимной растворимости при усложнении структуры Na 2 Si. O 3 Li 2 Si. O 3

Растворимость возможна только при соответствии электронной структуры растворяемого иона типу координационного окружения в матрице «растворителя» .

Растворимость в системе Li 2 O –Al 2 O 3 –Cr 2 O 3 Al 2 O 3 Li. Al 5 O 8 Li. Al. O 2 Li 2 O Li. Cr. O 2 Cr 2 O 3

Растворимость в системе Li 2 O –Al 2 O 3 –Cr 2 O 3 Al 2 O 3 Li. Al 5 O 8 Неорганиченная взаимная растворимость двух фаз коррундового типа : Al+3 и Cr+3 занимают октаэдрические позиции. Li. Al. O 2 Cr+3 : 3 d 3 Li 2 O Li. Cr. O 2 Cr 2 O 3 Al+3 : 3 p 0

Li 0, 5 Al 2, 5 O 4 = Растворимость в системе Li 2 O –Al 2 O 3 –Cr 2 O 3 = [Li 0, 5 Al 1, 0]тетр[Al 1, 5]окт. O 4 Замещение Al+3 на Cr+3 ограничено 60% : Cr+3 может занимать только октаэдрические позиции. Al 2 O 3 1, 5/2, 5 =0, 6 Li. Al 5 O 8 Li. Al. O 2 60% Cr+3 : 3 d 3 Li 2 O Li. Cr. O 2 Cr 2 O 3 Al+3 : 3 p 0

Односторонняя растворимость в системе Li. Al. O 2 – Li. Cr. O 2 Замещение в Li. Al. O 2 не происходит, т. к. все Al+3 в тетрагональных узлах. Замещение Cr+3 на Al+3 ограничено 60% : оба катиона в октаэдрических позициях. Al 2 O 3 60% Li. Al. O 2 Li 2 O Li. Cr. O 2 Cr 2 O 3

Электронные факторы, влияющие на взаимную растворимость твердых фаз

Электронные факторы, определяющие взаимную растворимость твердых фаз. ΔНсм ионных соединений > >ΔНсм ковалентных соединений 26 мол. % Mg. S Mg. O о. С Ca. O 1. Взаимная растворимость ионных соединений меньше, чем взаимная растворимость подобных ковалентных соединений. 19 мол. % Ca. S о. С

2. Увеличение разницы электроотрицательностей (Δχ) приводит к уменьшению взаимной растворимости Примеры: Са 2+ и Cd 2+ (Δχ = 0, 6) (Δri = 0, 14 A; КЧ=6) Na+ и Cu+ (Δri = 0, 25 A ; КЧ=6) K+ и Ag+ (Δχ = 0, 90) (Δχ = 1, 10) (Δri = 0, 18 A ; КЧ=6) Твердые растворы солей этих пар катионов практически не образуются, несмотря на их близкие ионные радиусы

T>1000 o. C

Z x. Z A = 6 Δri/ ri = 0, 04 Z x. Z A = 4 Δri/ ri = 0, 07 Z x. Z A = 8 Δri/ ri = 0, 05

Mo. O 2 –WO 2: при 750 о. С непрерывный твердый раствор. Z x. Z A = 8 Δri/ ri = 0, 015 Zx. ZA = 12 Δri/ ri = 0, 01 Mo. O 3 WO 3

Правило Вегарда Параметр эл. ячейки а твердого раствора= Σ хjаj j Мольная доля Для бинарного раствора: а твердого раствора= ха. А + (1 -х)а. В

Параметр решетки Твердые растворы. Правило Вегарда. • • • экстраполяция • • Предел растворимости А Состав В

В системе Ge – Si наблюдается полное соответствие правилу Вегарда Ge Si Параметры алмазоподобных решеток: a (Si) = 0, 544 нм a (Ge) = 0, 566 нм


37

а, Å А В А В

Соответствие знака отклонений от правила Вегарда и особенностей фазовых диаграмм бинарных систем. а, Å А а, Å В Отрицательные отклонения говорят о тенденции к расслоению тв. р-ра. А В Положительные отклонения говорят о тенденции к упорядочению тв. р-ра и образованию промежуточных соединений.

Бинарные твердые растворы ГЦК-металлов. Правило Вегарда. Au - Cu Cu - Pd Cu - Ni

Принцип непрерывности При непрерывном изменении параметров, определяющих состояние системы, свойства отдельных фаз ее изменяются непрерывно. Свойства системы в целом изменяются также непрерывно, но при условии, что не возникают новые фазы и не исчезают старые.

Фазовая диаграмма и критические температуры сверхпроводников в системе Pt – Nb T, o. C T, K L Иллюстрация принципа непрерывности

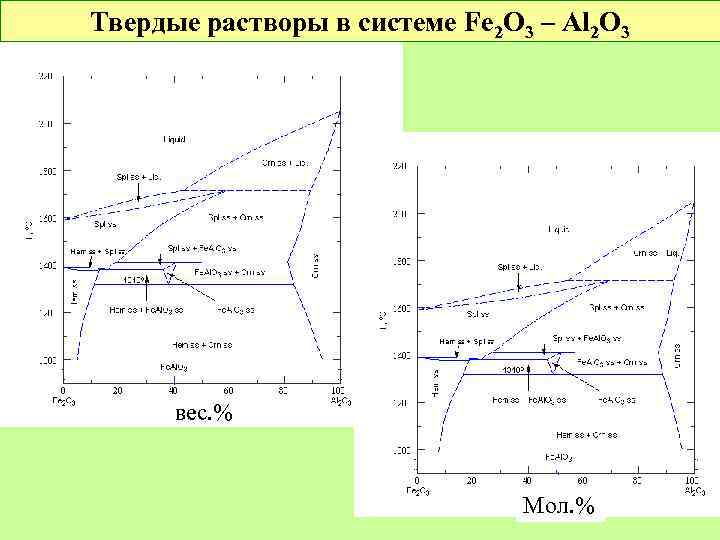
Твердые растворы в системе Fe 2 O 3 – Al 2 O 3 вес. % Мол. %

tverdye_rastvory-1-2011.ppt