Lektsiya_3_ukr_Imunka.pptx
- Количество слайдов: 82
 Івано-Франківський національний медичний університет Кафедра внутрішньої медицини № 1 з курсом клінічної імунології та алергології Тема лекції: “Основи трансплантаційного імунітету. Імунологія репродукції. Протипухлинний імунітет. Аспекти аутоімунних захворювань”. Підготував доцент кафедри, к. мед. н. Камінський В. Я.
Івано-Франківський національний медичний університет Кафедра внутрішньої медицини № 1 з курсом клінічної імунології та алергології Тема лекції: “Основи трансплантаційного імунітету. Імунологія репродукції. Протипухлинний імунітет. Аспекти аутоімунних захворювань”. Підготував доцент кафедри, к. мед. н. Камінський В. Я.
 Визначення Трансплантація – це хірургічне пересадження тканин чи органів від одного організму (донора) до другого організму (реципієнта).
Визначення Трансплантація – це хірургічне пересадження тканин чи органів від одного організму (донора) до другого організму (реципієнта).
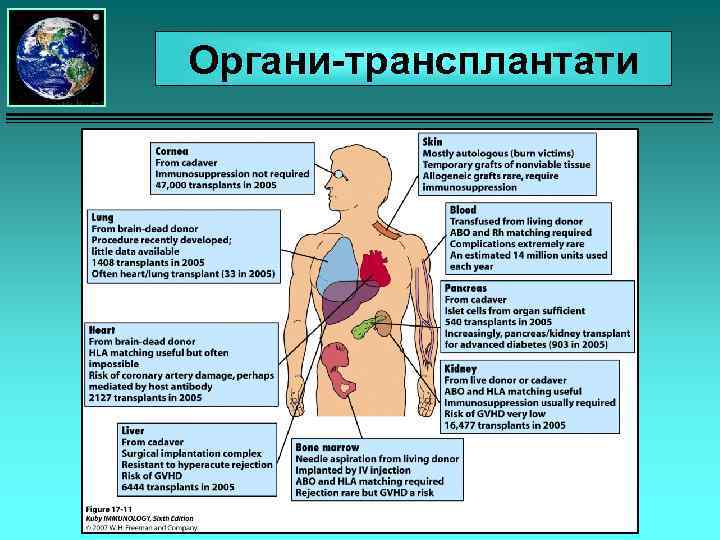 Органи-трансплантати
Органи-трансплантати

 Юрійович Вороний (1895 -1961) У 1933 році в м. Херсоні вперше у світі пересадив нирку людині.
Юрійович Вороний (1895 -1961) У 1933 році в м. Херсоні вперше у світі пересадив нирку людині.
 Історія трансплантації Пітер Медавар (1915 -1987) Британський біолог. Відкрив процес прийняття або відторгнення імунною системою трансплантованих тканин (імунологічну толерантність). Лауреат Нобелівської премії 1960 р.
Історія трансплантації Пітер Медавар (1915 -1987) Британський біолог. Відкрив процес прийняття або відторгнення імунною системою трансплантованих тканин (імунологічну толерантність). Лауреат Нобелівської премії 1960 р.
 План лекції 1. Трансплантаційний імунітет. 2. Імунологія репродукції. 3. Протипухлинний імунітет. 4. Аутоімунні захворювання.
План лекції 1. Трансплантаційний імунітет. 2. Імунологія репродукції. 3. Протипухлинний імунітет. 4. Аутоімунні захворювання.
 Історія трансплантації
Історія трансплантації
 Історія трансплантації
Історія трансплантації
 Історія трансплантації Томас Старзл (народився у 1926 р. ) Американський хірург-трансплантолог. Здійснив першу трансплантацію печінки людині у 1963 році.
Історія трансплантації Томас Старзл (народився у 1926 р. ) Американський хірург-трансплантолог. Здійснив першу трансплантацію печінки людині у 1963 році.
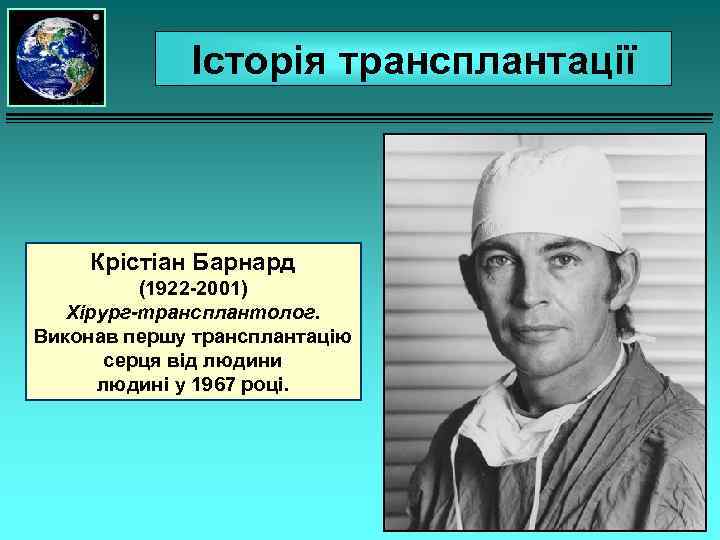 Історія трансплантації Крістіан Барнард (1922 -2001) Хірург-трансплантолог. Виконав першу трансплантацію серця від людини людині у 1967 році.
Історія трансплантації Крістіан Барнард (1922 -2001) Хірург-трансплантолог. Виконав першу трансплантацію серця від людини людині у 1967 році.
 Типи трансплантатів Аутотрансплантат – донор і реципієнт є однією й тією ж особою. Ізотрансплантат (синтрансплантат) – донор і реципієнт є однояйцевими близнюками. Алотрансплантат (гомотрансплантат) – донор і реципієнт належать до одного виду (від людини до людини). Ксенотрансплантат (гетеротрансплантат) – донор і реципієнт належать до різних видів (від тварини до людини).
Типи трансплантатів Аутотрансплантат – донор і реципієнт є однією й тією ж особою. Ізотрансплантат (синтрансплантат) – донор і реципієнт є однояйцевими близнюками. Алотрансплантат (гомотрансплантат) – донор і реципієнт належать до одного виду (від людини до людини). Ксенотрансплантат (гетеротрансплантат) – донор і реципієнт належать до різних видів (від тварини до людини).
 Трансплантація Аутологічні та ізогенні трансплантати приживаються. Алогенні та ксеногенні трансплантати відторгуються. Продовження тривалості функціонування трансплантата: 1) передтрансплантаційна селекція; 2) післятрансплантаційна імуносупресія. Селекція – це відбір максимально подібної в антигенному плані пари “донор -реципієнт”. якнайменше У донора таких повинно бути антигенів гістосумісності, яких немає у реципієнта.
Трансплантація Аутологічні та ізогенні трансплантати приживаються. Алогенні та ксеногенні трансплантати відторгуються. Продовження тривалості функціонування трансплантата: 1) передтрансплантаційна селекція; 2) післятрансплантаційна імуносупресія. Селекція – це відбір максимально подібної в антигенному плані пари “донор -реципієнт”. якнайменше У донора таких повинно бути антигенів гістосумісності, яких немає у реципієнта.
 Етапи селекції А. Оцінка сумісності донор-реципієнт: 1. Сумісність груп крові за с-мою АВ 0 і резус-фактором. 2. HLA-типування. 3. Крос-матч реакція. 4. Реакція змішаних лімфоцитів. Б. Визначення імунного статусу реципієнта (напр. , наявність ауто. АТ при аутоімунних захворюваннях зумовлює відторгнення трансплантата навіть при повній сумісності донора і реципієнта). В. Визначення абсолютних і відносних протипоказань до трансплантації (поліорганна недостатність, іноперабельні онкозахворювання, активні інфекційні процеси).
Етапи селекції А. Оцінка сумісності донор-реципієнт: 1. Сумісність груп крові за с-мою АВ 0 і резус-фактором. 2. HLA-типування. 3. Крос-матч реакція. 4. Реакція змішаних лімфоцитів. Б. Визначення імунного статусу реципієнта (напр. , наявність ауто. АТ при аутоімунних захворюваннях зумовлює відторгнення трансплантата навіть при повній сумісності донора і реципієнта). В. Визначення абсолютних і відносних протипоказань до трансплантації (поліорганна недостатність, іноперабельні онкозахворювання, активні інфекційні процеси).
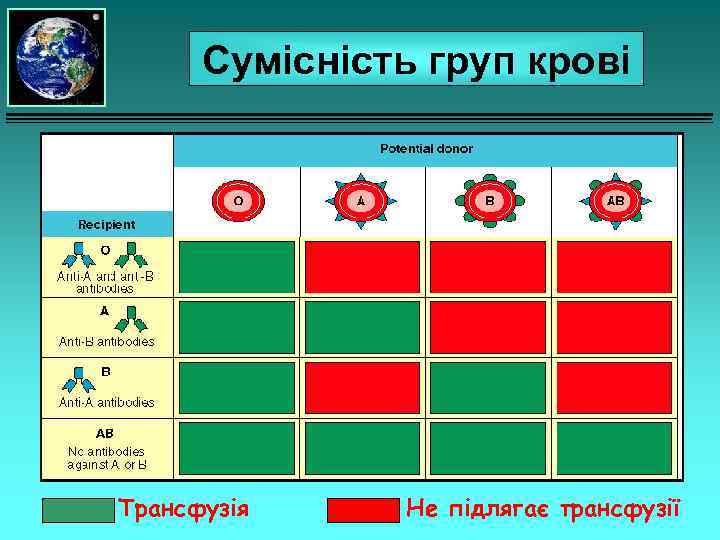 Сумісність груп крові Трансфузія Не підлягає трансфузії
Сумісність груп крові Трансфузія Не підлягає трансфузії
 Антигени гістосумісності (трансплантаційні антигени) – це білки на поверхні клітин органа, які відповідають за сумісність тканин. Найважливіші з них: 1) антигени HLA (людські лейкоцитарні антигени), які є продуктами генів головного комплексу гістосумісності; 2) еритроцитарні антигени (за системою АВ 0 та резус-фактором).
Антигени гістосумісності (трансплантаційні антигени) – це білки на поверхні клітин органа, які відповідають за сумісність тканин. Найважливіші з них: 1) антигени HLA (людські лейкоцитарні антигени), які є продуктами генів головного комплексу гістосумісності; 2) еритроцитарні антигени (за системою АВ 0 та резус-фактором).
 Антигени HLA У людини комплекс генів HLA розташований на короткому плечі 6 -ої хромосоми у певних локусах (ділянках). Гени І класу HLA містяться у трьох локусах: А, В, С. Гени ІІ класу HLA – у локусі D, який складається з трьох сублокусів: DR, DQ і DP. Певні локуси відповідають за синтез відповідних HLA-молекул: локус А – за синтез HLA-А, локус DR – за HLA-DR і т. д. Тобто до антигенів І класу належать молекули HLA-А, HLA-В, HLA-С, а до ІІ класу – HLA-DR, HLA-DQ, HLA-DP.
Антигени HLA У людини комплекс генів HLA розташований на короткому плечі 6 -ої хромосоми у певних локусах (ділянках). Гени І класу HLA містяться у трьох локусах: А, В, С. Гени ІІ класу HLA – у локусі D, який складається з трьох сублокусів: DR, DQ і DP. Певні локуси відповідають за синтез відповідних HLA-молекул: локус А – за синтез HLA-А, локус DR – за HLA-DR і т. д. Тобто до антигенів І класу належать молекули HLA-А, HLA-В, HLA-С, а до ІІ класу – HLA-DR, HLA-DQ, HLA-DP.
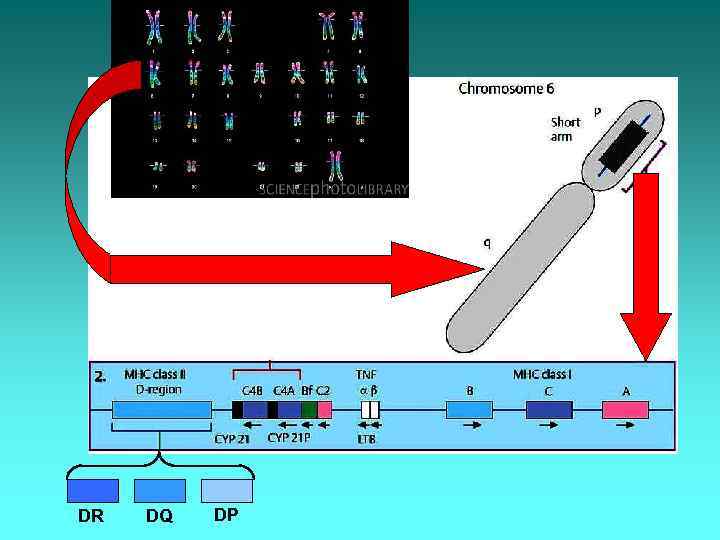 DR DQ DP
DR DQ DP
 Головні антигени HLA Серед усіх цих антигенів головними трансплантаційними антигенами вважаються HLA-А, HLA-В та HLA-DR, оскільки саме вони є найважливішими структурами, які розпізнаються імунною системою відторгненні трансплантата. У кожному локусі можлива наявність значної кількості алелів (варіантів). Тому відповідно будуть синтезуватися певні серологічні типи молекул HLA. господаря при
Головні антигени HLA Серед усіх цих антигенів головними трансплантаційними антигенами вважаються HLA-А, HLA-В та HLA-DR, оскільки саме вони є найважливішими структурами, які розпізнаються імунною системою відторгненні трансплантата. У кожному локусі можлива наявність значної кількості алелів (варіантів). Тому відповідно будуть синтезуватися певні серологічні типи молекул HLA. господаря при
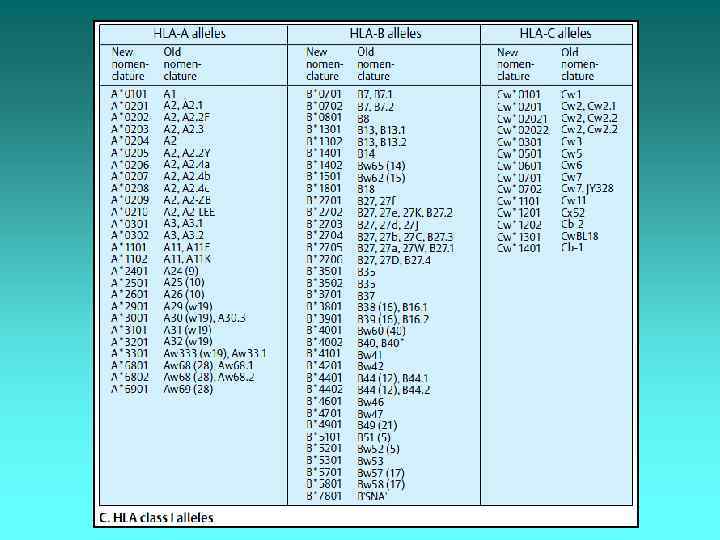
 Співпадіння антигенів HLA Кожна людина має по 6 головних антигенів (напр. , HLA-А 1, HLA-А 2, HLA-В 5, HLA-В 7, HLA-DR 1, HLA-DR 2): три – від батька (HLAА 1, HLA-В 5, HLA-DR 2) і три – від матері (HLA-А 2, HLA-В 7, HLA-DR 1). Для трансплантації потрібне співпадіння хоча б по п’яти із шести головних антигенів HLA. Неспівпадіння по двох антигенах не виключає можливість трансплантації в принципі, але сильно підвищує ймовірність відторгнення трансплантату. Неспівпадіння по трьох і більше антигенах виключає саму можливість трансплантації від даного донора даному реципієнту.
Співпадіння антигенів HLA Кожна людина має по 6 головних антигенів (напр. , HLA-А 1, HLA-А 2, HLA-В 5, HLA-В 7, HLA-DR 1, HLA-DR 2): три – від батька (HLAА 1, HLA-В 5, HLA-DR 2) і три – від матері (HLA-А 2, HLA-В 7, HLA-DR 1). Для трансплантації потрібне співпадіння хоча б по п’яти із шести головних антигенів HLA. Неспівпадіння по двох антигенах не виключає можливість трансплантації в принципі, але сильно підвищує ймовірність відторгнення трансплантату. Неспівпадіння по трьох і більше антигенах виключає саму можливість трансплантації від даного донора даному реципієнту.
 HLA-типування Для ідентифікації сумісності донора і реципієнта по HLA-антигенах проводять типування. Є два способи ідентифікації: 1) серотипування (лімфоцитотоксичний тест – визначення антигенів за допомогою HLA-сироваток, які об’єднані у стандартні набори (панелі)); 2) ДНК-генотипування (ПЛР – визначення не HLA-антигенів, а самих генів у 6 -ій хромосомі; це більш точний метод, але значно дорожчий і трудомісткіший).
HLA-типування Для ідентифікації сумісності донора і реципієнта по HLA-антигенах проводять типування. Є два способи ідентифікації: 1) серотипування (лімфоцитотоксичний тест – визначення антигенів за допомогою HLA-сироваток, які об’єднані у стандартні набори (панелі)); 2) ДНК-генотипування (ПЛР – визначення не HLA-антигенів, а самих генів у 6 -ій хромосомі; це більш точний метод, але значно дорожчий і трудомісткіший).
 Оцінка сумісності донор-реципієнт Крос-матч реакція. Сироватка реципієнта може містити так звані передіснуючі АТ (внаслідок сенсибілізації реципієнта гемотрансфузіями, багатьох вагітностей у жінок і т. д. ). Забирають зразки сироватки у реципієнта і додають лімфоцити донора. При лізисі лімфоцитів – трансплантація не проводиться. Реакція змішаних лімфоцитів. Змішують лімфоцити донора і реципієнта – при їх несумісності відбувається бласттрансформація (перетворення лімфоцитів у бластні клітини).
Оцінка сумісності донор-реципієнт Крос-матч реакція. Сироватка реципієнта може містити так звані передіснуючі АТ (внаслідок сенсибілізації реципієнта гемотрансфузіями, багатьох вагітностей у жінок і т. д. ). Забирають зразки сироватки у реципієнта і додають лімфоцити донора. При лізисі лімфоцитів – трансплантація не проводиться. Реакція змішаних лімфоцитів. Змішують лімфоцити донора і реципієнта – при їх несумісності відбувається бласттрансформація (перетворення лімфоцитів у бластні клітини).
 Типи реакцій відторгнення 1. Надгостре відторгнення. 2. Гостре відторгнення. 3. Хронічне відторгнення.
Типи реакцій відторгнення 1. Надгостре відторгнення. 2. Гостре відторгнення. 3. Хронічне відторгнення.
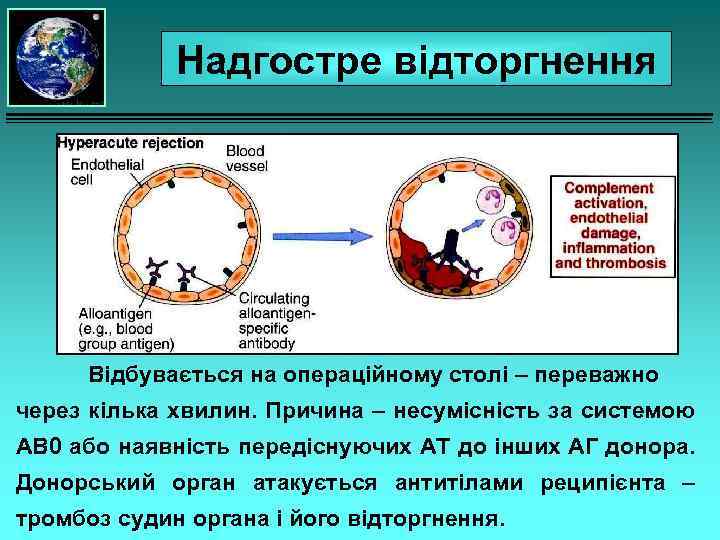 Надгостре відторгнення Відбувається на операційному столі – переважно через кілька хвилин. Причина – несумісність за системою АВ 0 або наявність передіснуючих АТ до інших АГ донора. Донорський орган атакується антитілами реципієнта – тромбоз судин органа і його відторгнення.
Надгостре відторгнення Відбувається на операційному столі – переважно через кілька хвилин. Причина – несумісність за системою АВ 0 або наявність передіснуючих АТ до інших АГ донора. Донорський орган атакується антитілами реципієнта – тромбоз судин органа і його відторгнення.
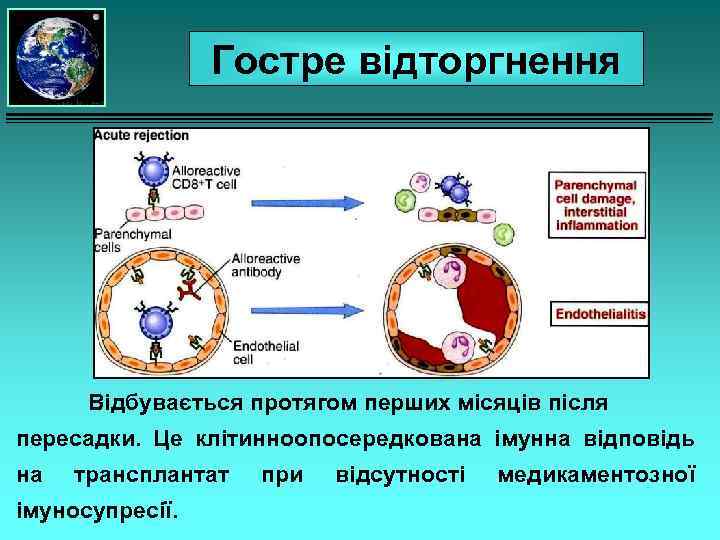 Гостре відторгнення Відбувається протягом перших місяців після пересадки. Це клітинноопосередкована імунна відповідь на трансплантат імуносупресії. при відсутності медикаментозної
Гостре відторгнення Відбувається протягом перших місяців після пересадки. Це клітинноопосередкована імунна відповідь на трансплантат імуносупресії. при відсутності медикаментозної
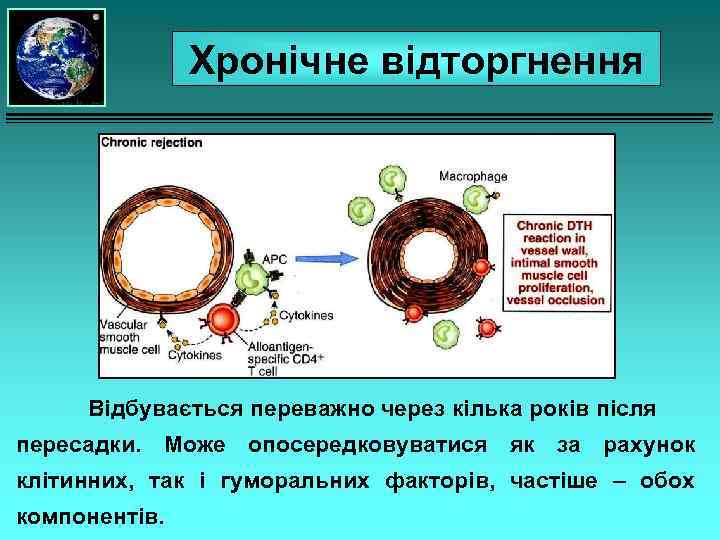 Хронічне відторгнення Відбувається переважно через кілька років після пересадки. Може опосередковуватися як за рахунок клітинних, так і гуморальних факторів, частіше – обох компонентів.
Хронічне відторгнення Відбувається переважно через кілька років після пересадки. Може опосередковуватися як за рахунок клітинних, так і гуморальних факторів, частіше – обох компонентів.
 Посттрансплантаційний моніторинг Необхідний при ало- і ксенотрансплантації. Проводиться контроль ефективності імуносупресивної терапії та прогнозування кризу відторгнення. Найефективніший критерій прогнозу – імунорегуляторний індекс (Тх / Тс). В нормі ІРІ = 1, 5 -3, 5. При ІРІ < 1, 0 зростає ризик розвитку інфекційних ускладнень. При ІРІ > 4, 0 виникає загроза відторгнення трансплантата.
Посттрансплантаційний моніторинг Необхідний при ало- і ксенотрансплантації. Проводиться контроль ефективності імуносупресивної терапії та прогнозування кризу відторгнення. Найефективніший критерій прогнозу – імунорегуляторний індекс (Тх / Тс). В нормі ІРІ = 1, 5 -3, 5. При ІРІ < 1, 0 зростає ризик розвитку інфекційних ускладнень. При ІРІ > 4, 0 виникає загроза відторгнення трансплантата.
 Посттрансплантаційна терапія 1. Постійна імуносупресія (недостатня супресія приводить до ризику відторгнення, надмірна супресія – до розвитку некерованих інфекційних ускладнень і злоякісних пухлин). 2. Профілактика і лікування кризів відторгнення (збільшують дози імунодепресантів, напр. , пульс-терапія). 3. Профілактика і лікування інфекційних процесів (виникають на фоні імуносупресії; застосовують тривалі курси антибіотиків).
Посттрансплантаційна терапія 1. Постійна імуносупресія (недостатня супресія приводить до ризику відторгнення, надмірна супресія – до розвитку некерованих інфекційних ускладнень і злоякісних пухлин). 2. Профілактика і лікування кризів відторгнення (збільшують дози імунодепресантів, напр. , пульс-терапія). 3. Профілактика і лікування інфекційних процесів (виникають на фоні імуносупресії; застосовують тривалі курси антибіотиків).
 Імуносупресивна терапія - глюкокортикоїди - азатіоприн - селективні імунодепресанти (циклоспорин А, такролімус, сіролімус, мікофенолату мофетил) - біологічні препарати (антилімфоцитарна сироватка, антилімфоцитарний імуноглобулін) - моноклональні антитіла (інфліксімаб (анти-TNF-α), муромонаб (анти-CD 3), даклізумаб (анти-CD 25))
Імуносупресивна терапія - глюкокортикоїди - азатіоприн - селективні імунодепресанти (циклоспорин А, такролімус, сіролімус, мікофенолату мофетил) - біологічні препарати (антилімфоцитарна сироватка, антилімфоцитарний імуноглобулін) - моноклональні антитіла (інфліксімаб (анти-TNF-α), муромонаб (анти-CD 3), даклізумаб (анти-CD 25))
 План лекції 1. Трансплантаційний імунітет. 2. Імунологія репродукції. 3. Протипухлинний імунітет. 4. Аутоімунні захворювання.
План лекції 1. Трансплантаційний імунітет. 2. Імунологія репродукції. 3. Протипухлинний імунітет. 4. Аутоімунні захворювання.
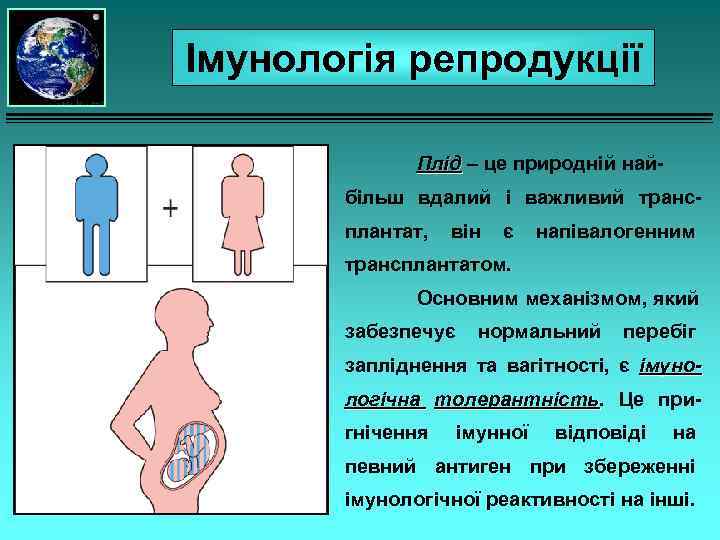 Імунологія репродукції Плід – це природній найбільш вдалий і важливий трансплантат, він є напівалогенним трансплантатом. Основним механізмом, який забезпечує нормальний перебіг запліднення та вагітності, є імунологічна толерантність. Це притолерантність гнічення імунної відповіді на певний антиген при збереженні імунологічної реактивності на інші.
Імунологія репродукції Плід – це природній найбільш вдалий і важливий трансплантат, він є напівалогенним трансплантатом. Основним механізмом, який забезпечує нормальний перебіг запліднення та вагітності, є імунологічна толерантність. Це притолерантність гнічення імунної відповіді на певний антиген при збереженні імунологічної реактивності на інші.
 Імунологічна толерантність Багато механізмів пригнічують імунну відповідь матері на плід: Ø альфа-фетопротеїн; Ø прогестерон; Ø децидуальна оболонка; Ø хоріонічний гонадотропін; Ø плацента; Ø відсутність на трофобласті класичних антигенів HLA класу І та ІІ; Ø зниження функції Т-хелперів-1 і їх продуктів: ІЛ-2, ФНП-α, γ-ІФН; Ø посилення функції Т-хелперів-2 і їх продуктів: ІЛ-4, ІЛ-10; Ø блокувальні антитіла; Ø зростає активність Т-супресорів, тому ІРІ зменшується у 1, 5 -2 рази.
Імунологічна толерантність Багато механізмів пригнічують імунну відповідь матері на плід: Ø альфа-фетопротеїн; Ø прогестерон; Ø децидуальна оболонка; Ø хоріонічний гонадотропін; Ø плацента; Ø відсутність на трофобласті класичних антигенів HLA класу І та ІІ; Ø зниження функції Т-хелперів-1 і їх продуктів: ІЛ-2, ФНП-α, γ-ІФН; Ø посилення функції Т-хелперів-2 і їх продуктів: ІЛ-4, ІЛ-10; Ø блокувальні антитіла; Ø зростає активність Т-супресорів, тому ІРІ зменшується у 1, 5 -2 рази.
 Порушення імунних механізмів Найважливіші фактори, що активують імунну систему вагітної: 1) внутрішньоматкові інфекції (сприяють “перемиканню” імунної системи вагітної з домінування Т-хелперів-2 на Т-хелпери 1; це призводить до імунного конфлікту “мати-плід” і переривання вагітності); 2) медичні аборти в анамнезі (залишають після себе імунозапальні та гормональні зміни, які під час наступної вагітності завдяки механізмам пам’яті відторгують плід). Подібне “перемикання” імунної системи вагітної може викликати вживання нею імунотропних засобів, особливо, імуностимуляторів.
Порушення імунних механізмів Найважливіші фактори, що активують імунну систему вагітної: 1) внутрішньоматкові інфекції (сприяють “перемиканню” імунної системи вагітної з домінування Т-хелперів-2 на Т-хелпери 1; це призводить до імунного конфлікту “мати-плід” і переривання вагітності); 2) медичні аборти в анамнезі (залишають після себе імунозапальні та гормональні зміни, які під час наступної вагітності завдяки механізмам пам’яті відторгують плід). Подібне “перемикання” імунної системи вагітної може викликати вживання нею імунотропних засобів, особливо, імуностимуляторів.
 Імунологія безпліддя Безплідним вважається шлюб, що залишається бездітним після 2 років статевого життя без застосування контрацептивів. Серед причин безпліддя чільне місце займають запальні процеси в геніталіях та їх наслідки (понад 75%). Імунною причиною чоловічого безпліддя може бути наявність антитіл проти власних сперматозоїдів (внаслідок травми, крипторхізму, перенесення паротиту у віці дозрівання і т. д. ). Лікування: імуносупресивна терапія або застосування штучного запліднення. Основні імунні причини жіночого безпліддя: 1) вторинний імунодефіцит; 2) антиоваріальний імунний конфлікт; 3) антиспермальний імунний конфлікт; 4) високий рівень гістосумісності між подружжям.
Імунологія безпліддя Безплідним вважається шлюб, що залишається бездітним після 2 років статевого життя без застосування контрацептивів. Серед причин безпліддя чільне місце займають запальні процеси в геніталіях та їх наслідки (понад 75%). Імунною причиною чоловічого безпліддя може бути наявність антитіл проти власних сперматозоїдів (внаслідок травми, крипторхізму, перенесення паротиту у віці дозрівання і т. д. ). Лікування: імуносупресивна терапія або застосування штучного запліднення. Основні імунні причини жіночого безпліддя: 1) вторинний імунодефіцит; 2) антиоваріальний імунний конфлікт; 3) антиспермальний імунний конфлікт; 4) високий рівень гістосумісності між подружжям.
 Вторинний імунодефіцит ВІД може бути причиною порушення зачаття чи звичного викидня. Напр. , на сперматозоїді є антиген МА-1, а на яйцеклітині – рецептор до нього. При заплідненні в нормі рецептор активується і з ним контактує антиген МА-1. При ВІД не відбувається активації рецептора – не виникає зачаття. Для виявлення ВІД проводять імунологічне обстеження, під час якого дотримуються правил: 1) імунограму не роблять в період менструації; 2) контроль імунограми проводять не раніше, ніж через 2 тижні після клінічного видужання від запальних захворювань; 3) при аналізі імунограми слід передусім звертати увагу на різко виражені зміни показників.
Вторинний імунодефіцит ВІД може бути причиною порушення зачаття чи звичного викидня. Напр. , на сперматозоїді є антиген МА-1, а на яйцеклітині – рецептор до нього. При заплідненні в нормі рецептор активується і з ним контактує антиген МА-1. При ВІД не відбувається активації рецептора – не виникає зачаття. Для виявлення ВІД проводять імунологічне обстеження, під час якого дотримуються правил: 1) імунограму не роблять в період менструації; 2) контроль імунограми проводять не раніше, ніж через 2 тижні після клінічного видужання від запальних захворювань; 3) при аналізі імунограми слід передусім звертати увагу на різко виражені зміни показників.
 Антиспермальний імунний конфлікт В нормі організм жінки забезпечує стан толерантності до сперматозоїдів. Фактори ризику, які сприяють імунізації сперматозоїдами: 1) активація місцевого імунітету при запальних процесах; 2) молекулярна схожість між інфекційними збудниками і сперматозоїдами; 3) патологічні стани шийки матки (ерозії, тріщини, пухлини); 4) зниження імуносупресивних востей сім’яної плазми чоловіка. власти-
Антиспермальний імунний конфлікт В нормі організм жінки забезпечує стан толерантності до сперматозоїдів. Фактори ризику, які сприяють імунізації сперматозоїдами: 1) активація місцевого імунітету при запальних процесах; 2) молекулярна схожість між інфекційними збудниками і сперматозоїдами; 3) патологічні стани шийки матки (ерозії, тріщини, пухлини); 4) зниження імуносупресивних востей сім’яної плазми чоловіка. власти-
 Діагностика антиспермальних антитіл Існують два види тестів (обидва проводять у день овуляції): 1) якісні (посткоїтальний; фракційний посткоїтальний; тест контакту сперми і цервікального слизу); 2) кількісні (мікроаглютинаційний тест Фріберга; спермоіммобі- лізуючий тест Ізоджима). У якісних тестах при контакті сперми і слизу каналу шийки матки вивчають рухливість сперматозоїдів і глибину їх проникнення у слиз. У тесті Фріберга визначають ступінь сенсибілізації жінки до сперматозоїдів у вигляді титрів, які можна порівнювати у динаміці. У тесті Ізоджима визначають відсоток активних та неактивних сперматозоїдів.
Діагностика антиспермальних антитіл Існують два види тестів (обидва проводять у день овуляції): 1) якісні (посткоїтальний; фракційний посткоїтальний; тест контакту сперми і цервікального слизу); 2) кількісні (мікроаглютинаційний тест Фріберга; спермоіммобі- лізуючий тест Ізоджима). У якісних тестах при контакті сперми і слизу каналу шийки матки вивчають рухливість сперматозоїдів і глибину їх проникнення у слиз. У тесті Фріберга визначають ступінь сенсибілізації жінки до сперматозоїдів у вигляді титрів, які можна порівнювати у динаміці. У тесті Ізоджима визначають відсоток активних та неактивних сперматозоїдів.
 Лікування антигаметного імунного конфлікту q Запобігання надходження сперми у піхву – кондомотерапія (застосування презервативів під час статевого акту) протягом 3 -6 міс. q Детоксикація (ентеросорбенти, реосорбілакт та ін. ) q Десенсибілізуючі препарати q Фізіотерапевтичні процедури (лазеротерапія) q Імуносупресивна терапія (при наявності ауто. АТ до сперматозоїдів у чоловіків або до яйцеклітини у жінок).
Лікування антигаметного імунного конфлікту q Запобігання надходження сперми у піхву – кондомотерапія (застосування презервативів під час статевого акту) протягом 3 -6 міс. q Детоксикація (ентеросорбенти, реосорбілакт та ін. ) q Десенсибілізуючі препарати q Фізіотерапевтичні процедури (лазеротерапія) q Імуносупресивна терапія (при наявності ауто. АТ до сперматозоїдів у чоловіків або до яйцеклітини у жінок).
 Значення гістосумісності між подружжям Високий ступінь гістосумісності між подружжям є природнім механізмом, який зменшує ймовірність запліднення. Чим нижчий ступінь гістосумісності, тим більша можливість подружжю бути фертильними. Ступінь гістосумісності подружжя визначають шляхом порівняння їх HLA-фенотипів методом типування. Частіше це проводять за HLA-антигенами І класу, а саме – А та В. Напр. , імунозалежна безплідність виникає при 3 ідентичних HLA-антигенах. Імунний супресорний механізм до плода в організмі жінки “вмикається” після контакту її імунної системи з чужорідними HLAантигенами чоловіка (напр. , у спермі знаходяться лімфоцити чоловіка з наявними на їх поверхні HLA-антигенами). При значній подібності антигенів подружжя у жінки не запускається імуносупресорний механізм до плода, що зменшує її фертильність.
Значення гістосумісності між подружжям Високий ступінь гістосумісності між подружжям є природнім механізмом, який зменшує ймовірність запліднення. Чим нижчий ступінь гістосумісності, тим більша можливість подружжю бути фертильними. Ступінь гістосумісності подружжя визначають шляхом порівняння їх HLA-фенотипів методом типування. Частіше це проводять за HLA-антигенами І класу, а саме – А та В. Напр. , імунозалежна безплідність виникає при 3 ідентичних HLA-антигенах. Імунний супресорний механізм до плода в організмі жінки “вмикається” після контакту її імунної системи з чужорідними HLAантигенами чоловіка (напр. , у спермі знаходяться лімфоцити чоловіка з наявними на їх поверхні HLA-антигенами). При значній подібності антигенів подружжя у жінки не запускається імуносупресорний механізм до плода, що зменшує її фертильність.
 Лікування безпліддя при підвищеній гістосумісності 1. Імунізація дружини пулом лімфоцитів чоловіка (лімфоцити чоловіка вводять жінці в/ш в 10 -15 точок на плечі протягом 2 -3 циклів перед запланованою вагітністю). 2. Пересадження дружині шматка шкіри чоловіка (перед і під час вагітності підшивають шматок шкіри чоловіка на плечі жінки). Мета цих методів – підвищення ступеня розпізнання імунною системою жінки HLA-антигенів чоловіка і формування супресії жінки до плода.
Лікування безпліддя при підвищеній гістосумісності 1. Імунізація дружини пулом лімфоцитів чоловіка (лімфоцити чоловіка вводять жінці в/ш в 10 -15 точок на плечі протягом 2 -3 циклів перед запланованою вагітністю). 2. Пересадження дружині шматка шкіри чоловіка (перед і під час вагітності підшивають шматок шкіри чоловіка на плечі жінки). Мета цих методів – підвищення ступеня розпізнання імунною системою жінки HLA-антигенів чоловіка і формування супресії жінки до плода.
 Несумісність за резус-антигеном Люди, кров яких є резус-позитивною, мають на поверхні еритроцитів протеїн, відомий під назвою D-антиген (Rh. D-антиген). 85% жителів Європи є Rh. D-позитивними і 15% – Rh. Dнегативними. Резус-конфлікт може виникнути між матір’ю й ембріоном, коли мати буде Rh. D-негативною, а плід – Rh. D-позитивним. Під час перших пологів еритроцити плода потрапляють у кров матері й у неї виробляються анти-D-антитіла, які належать до типу Ig. G. Коли ця жінка вагітніє вдруге, і плід знову є Rh. D-позитивним, то анти-D-антитіла з крові матері проходять через плаценту й атакують еритроцити плода. Залежно від кількості анти-Dантитіл можливий мимовільний аборт, народження мертвої дитини або живої з гемолітичною хворобою новонародженого.
Несумісність за резус-антигеном Люди, кров яких є резус-позитивною, мають на поверхні еритроцитів протеїн, відомий під назвою D-антиген (Rh. D-антиген). 85% жителів Європи є Rh. D-позитивними і 15% – Rh. Dнегативними. Резус-конфлікт може виникнути між матір’ю й ембріоном, коли мати буде Rh. D-негативною, а плід – Rh. D-позитивним. Під час перших пологів еритроцити плода потрапляють у кров матері й у неї виробляються анти-D-антитіла, які належать до типу Ig. G. Коли ця жінка вагітніє вдруге, і плід знову є Rh. D-позитивним, то анти-D-антитіла з крові матері проходять через плаценту й атакують еритроцити плода. Залежно від кількості анти-Dантитіл можливий мимовільний аборт, народження мертвої дитини або живої з гемолітичною хворобою новонародженого.
 Профілактика резус-конфлікту Протягом двох днів після перших пологів D-негативній матері вводять людські анти-D-антитіла, поки в неї не утворилися такі ж власні. Введені АТ зв’язуються з еритроцитами Dпозитивного плода, які потрапили в кровотік матері. Таким чином, анти-D-антитіла знищують еритроцити новонародженого, що потім елімінуються. При цьому мати не імунізується D-антигеном і у неї не виробляються власні анти-D-антитіла, що могли би стати причиною гемолітичної хвороби новонародженого під час наступної вагітності.
Профілактика резус-конфлікту Протягом двох днів після перших пологів D-негативній матері вводять людські анти-D-антитіла, поки в неї не утворилися такі ж власні. Введені АТ зв’язуються з еритроцитами Dпозитивного плода, які потрапили в кровотік матері. Таким чином, анти-D-антитіла знищують еритроцити новонародженого, що потім елімінуються. При цьому мати не імунізується D-антигеном і у неї не виробляються власні анти-D-антитіла, що могли би стати причиною гемолітичної хвороби новонародженого під час наступної вагітності.
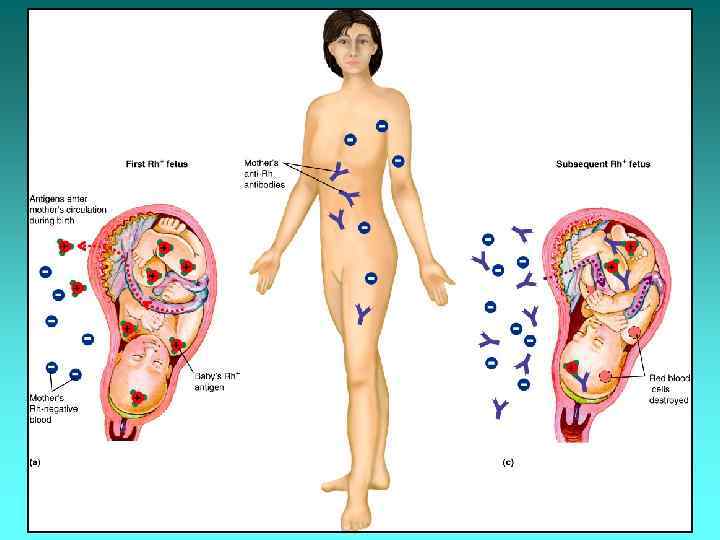
 Конфлікт за системою АВ 0 Після 9 -го тижня вагітності під час формування трофобласта еритроцити плода потрапляють у кровотік матері. У разі несумісності плода і матері за системою АВ 0 у неї виробляються антигрупові антитіла. Вони належать до типу Ig. G, проходять крізь плаценту і викликають гемолітичну хворобу плода. Найчастіше міжгруповий конфлікт спостерігають, коли в матері група крові 0(І), а у плода – А(ІІ). Таке відбувається приблизно у 10% випадків від загальної кількості пологів. Інші види несумісності зустрічаються набагато рідше. У випадку такого конфлікту матері проводять інфузійну терапію, щоб зменшити титр антигрупових антитіл.
Конфлікт за системою АВ 0 Після 9 -го тижня вагітності під час формування трофобласта еритроцити плода потрапляють у кровотік матері. У разі несумісності плода і матері за системою АВ 0 у неї виробляються антигрупові антитіла. Вони належать до типу Ig. G, проходять крізь плаценту і викликають гемолітичну хворобу плода. Найчастіше міжгруповий конфлікт спостерігають, коли в матері група крові 0(І), а у плода – А(ІІ). Таке відбувається приблизно у 10% випадків від загальної кількості пологів. Інші види несумісності зустрічаються набагато рідше. У випадку такого конфлікту матері проводять інфузійну терапію, щоб зменшити титр антигрупових антитіл.
 План лекції 1. Трансплантаційний імунітет. 2. Імунологія репродукції. 3. Протипухлинний імунітет. 4. Аутоімунні захворювання.
План лекції 1. Трансплантаційний імунітет. 2. Імунологія репродукції. 3. Протипухлинний імунітет. 4. Аутоімунні захворювання.
 Імунологія пухлин Пухлина – це патологічний процес, що характеризується нестримним розмноженням клітин без контролю організму. Злоякісні пухлини, на відміну від доброякісних, характеризуються втратою диференціювання, інвазивним ростом і метастатичним поширенням.
Імунологія пухлин Пухлина – це патологічний процес, що характеризується нестримним розмноженням клітин без контролю організму. Злоякісні пухлини, на відміну від доброякісних, характеризуються втратою диференціювання, інвазивним ростом і метастатичним поширенням.
 Типи злоякісних пухлин Карцинома – пухлина ендо- та ектодерми (напр. , шкіри та епітелію органів) – 89, 3% Саркома – пухлина мезодерми (кісток, м’язів) – 1, 9% Лейкемії та лімфоми – пухлини гемопоетичних клітин – 8, 8%
Типи злоякісних пухлин Карцинома – пухлина ендо- та ектодерми (напр. , шкіри та епітелію органів) – 89, 3% Саркома – пухлина мезодерми (кісток, м’язів) – 1, 9% Лейкемії та лімфоми – пухлини гемопоетичних клітин – 8, 8%
 Онкогенез В нормі кожна клітина організму здатна до певної кількості поділів, після чого активується ген апоптозу й виникає генетично запрограмована клітинна смерть. Атипові клітини здатні блокувати апоптоз, що ключовим рушійним фактором онкогенезу. і є
Онкогенез В нормі кожна клітина організму здатна до певної кількості поділів, після чого активується ген апоптозу й виникає генетично запрограмована клітинна смерть. Атипові клітини здатні блокувати апоптоз, що ключовим рушійним фактором онкогенезу. і є
 Фактори взаємодії пухлини й організму Розрізняють чотири групи факторів, що беруть участь у розвитку пухлини: 1. Антибластомні. 2. Імунорезистентності пухлини. 3. Пробластомні, що пригнічують імунітет. 4. Пробластомні, що посилюють ріст пухлини.
Фактори взаємодії пухлини й організму Розрізняють чотири групи факторів, що беруть участь у розвитку пухлини: 1. Антибластомні. 2. Імунорезистентності пухлини. 3. Пробластомні, що пригнічують імунітет. 4. Пробластомні, що посилюють ріст пухлини.
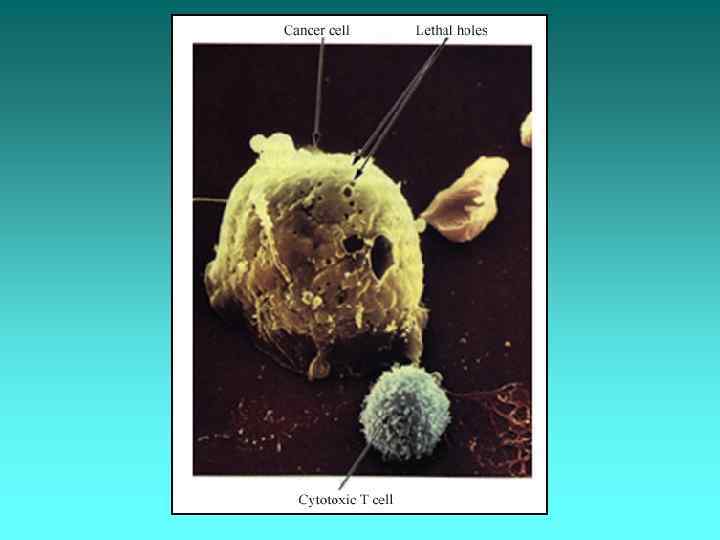
 Антибластомні фактори І. Клітинні: 1) Т-кілери; 2) природні кілери (NK-клітини); 3) макрофаги. ІІ. Гуморальні: 1) специфічні антитіла; 2) ІЛ-1; 3) ІЛ-2; 4) ФНП (фактор некрозу пухлин); 5) інтерферони.
Антибластомні фактори І. Клітинні: 1) Т-кілери; 2) природні кілери (NK-клітини); 3) макрофаги. ІІ. Гуморальні: 1) специфічні антитіла; 2) ІЛ-1; 3) ІЛ-2; 4) ФНП (фактор некрозу пухлин); 5) інтерферони.
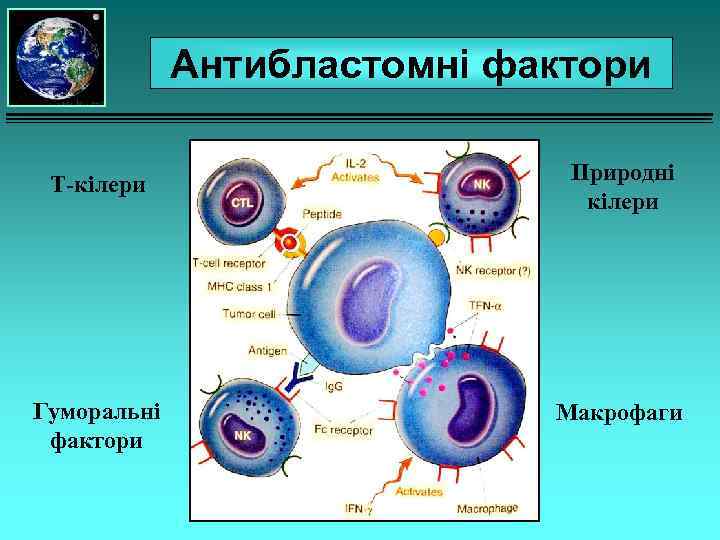 Антибластомні фактори Т-кілери Гуморальні фактори Природні кілери Макрофаги
Антибластомні фактори Т-кілери Гуморальні фактори Природні кілери Макрофаги
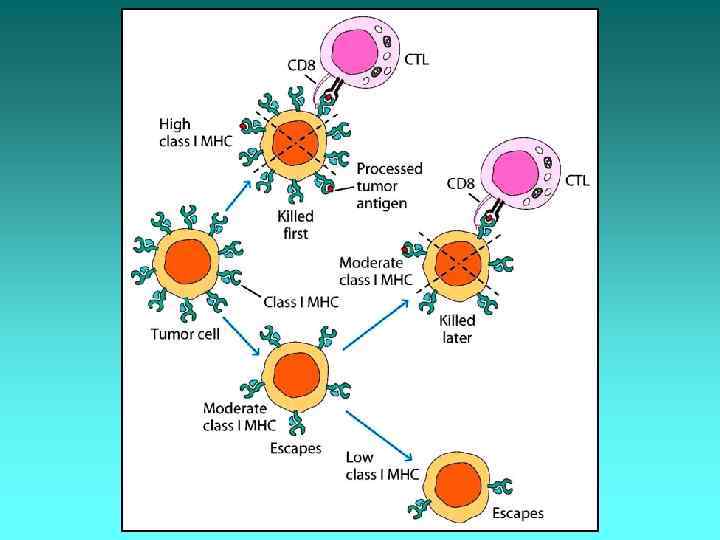
 Фактори імунорезистентності пухлини Фактори, що допомагають пухлині уникати імунного нагляду: 1. Слабка імуногенність пухлинних антигенів. 2. Постійна модифікація антигенів. 3. Селекція імунологічно стійких атипових клітин. 4. Втрата антигенів HLA І класу з поверхні атипової клітини. 5. Швидкий ріст пухлини часто випереджає імунну відповідь. 6. Експресія на атипових клітинах рецепторів до факторів росту. 7. Надмірна активація Т-супресорів.
Фактори імунорезистентності пухлини Фактори, що допомагають пухлині уникати імунного нагляду: 1. Слабка імуногенність пухлинних антигенів. 2. Постійна модифікація антигенів. 3. Селекція імунологічно стійких атипових клітин. 4. Втрата антигенів HLA І класу з поверхні атипової клітини. 5. Швидкий ріст пухлини часто випереджає імунну відповідь. 6. Експресія на атипових клітинах рецепторів до факторів росту. 7. Надмірна активація Т-супресорів.
 Пробластомні фактори, що пригнічують імунітет 1. Імуносупресивні речовини, виділені лімфоцитами і макрофагами (ІЛ-10, Pg. Е 2). 2. Блокуючі антитіла. 3. ЦІК (циркулюючі імунні комплекси). 4. ТФР-β (трансформуючий фактор росту-бета).
Пробластомні фактори, що пригнічують імунітет 1. Імуносупресивні речовини, виділені лімфоцитами і макрофагами (ІЛ-10, Pg. Е 2). 2. Блокуючі антитіла. 3. ЦІК (циркулюючі імунні комплекси). 4. ТФР-β (трансформуючий фактор росту-бета).
 Пробластомні фактори, що посилюють ріст пухлини 1. Фактор росту пухлини, виділений макрофагами. 2. ІЛ-2. 3. ІЛ-6. 4. γ-ІНФ. 5. Порушення функцій Т-кілерів та АПК (антигенпрезентуючих клітин).
Пробластомні фактори, що посилюють ріст пухлини 1. Фактор росту пухлини, виділений макрофагами. 2. ІЛ-2. 3. ІЛ-6. 4. γ-ІНФ. 5. Порушення функцій Т-кілерів та АПК (антигенпрезентуючих клітин).
 Імунодіагностика пухлин І. Оцінка імунного статусу хворого (імунодефіцит виникає до клінічних проявів; імуносупресія не тотальна, а зміна окремих показників). ІІ. Виявлення специфічних антигенів пухлини: 1) ембріональні антигени; 2) тканинноспецифічні антигени, асоційовані з пухлинами.
Імунодіагностика пухлин І. Оцінка імунного статусу хворого (імунодефіцит виникає до клінічних проявів; імуносупресія не тотальна, а зміна окремих показників). ІІ. Виявлення специфічних антигенів пухлини: 1) ембріональні антигени; 2) тканинноспецифічні антигени, асоційовані з пухлинами.
 Ембріональні антигени Вони властиві для ембріонів та для пухлин у дорослих. Не мають специфічної органотропності. - Альфа-фетопротеїн – рак печінки, пухлини яєчка, простати - Раково-ембріональний антиген – рак товстої кишки, підшлункової залози - Хоріонічний гонадотропін – пухлини матки, яйників, яєчок
Ембріональні антигени Вони властиві для ембріонів та для пухлин у дорослих. Не мають специфічної органотропності. - Альфа-фетопротеїн – рак печінки, пухлини яєчка, простати - Раково-ембріональний антиген – рак товстої кишки, підшлункової залози - Хоріонічний гонадотропін – пухлини матки, яйників, яєчок
 Тканинноспецифічні антигени, асоційовані з пухлинами - Простатичний специфічний антиген (PSA) – рак простати - Р-53 – рак сечового міхура - СА-19 -9 – рак підшлункової залози - СА-125 – рак яйників
Тканинноспецифічні антигени, асоційовані з пухлинами - Простатичний специфічний антиген (PSA) – рак простати - Р-53 – рак сечового міхура - СА-19 -9 – рак підшлункової залози - СА-125 – рак яйників
 Методи лікування пухлин ü Хірургія ü Хіміотерапія ü Променева терапія ü Імунотерапія
Методи лікування пухлин ü Хірургія ü Хіміотерапія ü Променева терапія ü Імунотерапія
 Імунотерапія пухлин v Моноклональні антитіла v Біфункціональні моноклональні антитіла v Пухлино-інфільтруючі лімфоцити v Імуностимулюючі фактори v Протипухлинні вакцини
Імунотерапія пухлин v Моноклональні антитіла v Біфункціональні моноклональні антитіла v Пухлино-інфільтруючі лімфоцити v Імуностимулюючі фактори v Протипухлинні вакцини
 Моноклональні антитіла 1) моноклональні АТ: - Рітуксімаб (для л-ня лімфом); - Герцептин (для л-ня раку легень, лімфом); - Цетуксімаб (для л-ня колоректального раку); 2) моноклональні АТ + токсин (цитотоксичний лік): - Мілотарг; - САТ-3888; 3) моноклональні антитіла + радіоізотоп: - Зевалін; - Бексар.
Моноклональні антитіла 1) моноклональні АТ: - Рітуксімаб (для л-ня лімфом); - Герцептин (для л-ня раку легень, лімфом); - Цетуксімаб (для л-ня колоректального раку); 2) моноклональні АТ + токсин (цитотоксичний лік): - Мілотарг; - САТ-3888; 3) моноклональні антитіла + радіоізотоп: - Зевалін; - Бексар.
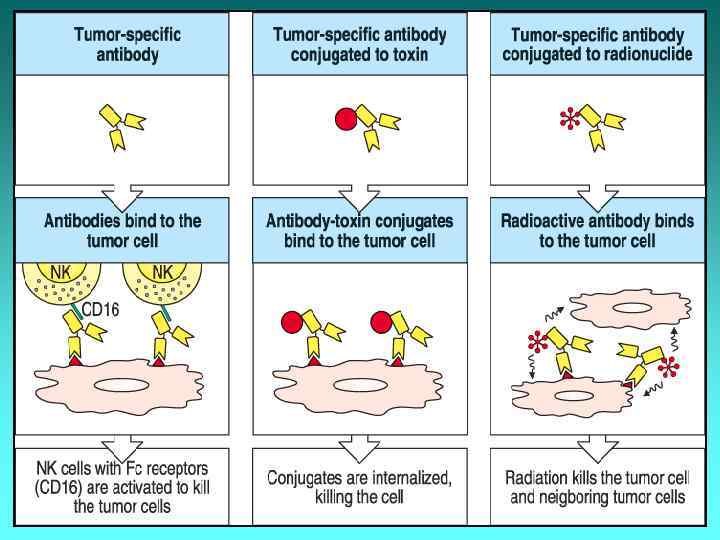
 Біфункціональні моноклональні антитіла Блінатумомаб – синтетичне моноклональне АТ, одна частина якого зв’язується з CD 19 (антигеном на поверхні пухлинних В-лімфоцитів), а друга – із CD 3 (молекулою на Т-лімфоцитах, в т. ч. на Т-кілерах). Після фіксації антитілом атипової клітини і Т-кілера останній стимулюється для знищення Застосовують для л-ня лімфом. пухлинної клітини.
Біфункціональні моноклональні антитіла Блінатумомаб – синтетичне моноклональне АТ, одна частина якого зв’язується з CD 19 (антигеном на поверхні пухлинних В-лімфоцитів), а друга – із CD 3 (молекулою на Т-лімфоцитах, в т. ч. на Т-кілерах). Після фіксації антитілом атипової клітини і Т-кілера останній стимулюється для знищення Застосовують для л-ня лімфом. пухлинної клітини.
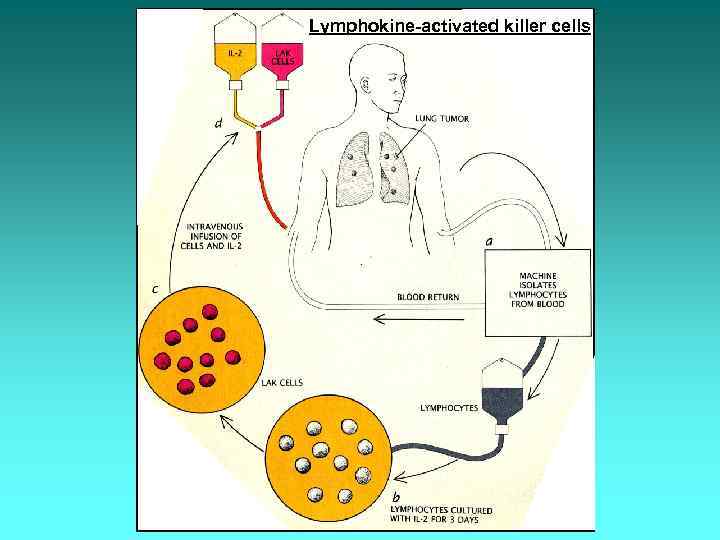
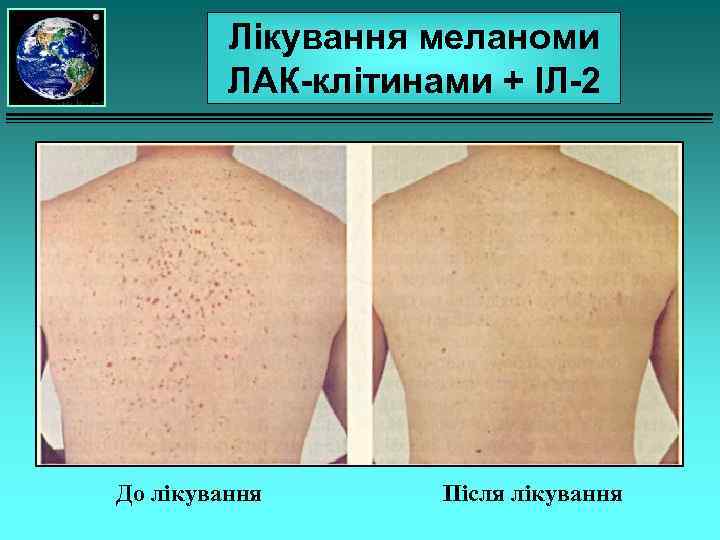
 Пухлиноінфільтруючі лімфоцити Лімфоцити хворого культивують in vitro в присутності його атипових клітин та ІЛ-2 (фактор росту). Ці лімфоцити ще називають ЛАК-клітинами (лімфокінактивовані кілери). Через деякий час ЛАК-клітини вводять пацієнтові, де вони атакують пухлину.
Пухлиноінфільтруючі лімфоцити Лімфоцити хворого культивують in vitro в присутності його атипових клітин та ІЛ-2 (фактор росту). Ці лімфоцити ще називають ЛАК-клітинами (лімфокінактивовані кілери). Через деякий час ЛАК-клітини вводять пацієнтові, де вони атакують пухлину.
 Lymphokine-activated killer cells
Lymphokine-activated killer cells
 Лікування меланоми ЛАК-клітинами + ІЛ-2 До лікування Після лікування
Лікування меланоми ЛАК-клітинами + ІЛ-2 До лікування Після лікування
 Імуностимулюючі фактори • БЦЖ (Bacillus Calmette-Guérin) (бацила Кальметта-Герена) – ослаблена жива коров’яча туберкульозна бацила. П/ш вводять при раку молочної з-зи, меланомі. • Ксеногенний трансплантат (шкірний) – при відторгненні стимулюють клітинні механізми (при меланомі). • Інтерферон-γ – посилює експресію HLA-І класу на атипових клітинах, що робить їх чутливими до Т-кілерів.
Імуностимулюючі фактори • БЦЖ (Bacillus Calmette-Guérin) (бацила Кальметта-Герена) – ослаблена жива коров’яча туберкульозна бацила. П/ш вводять при раку молочної з-зи, меланомі. • Ксеногенний трансплантат (шкірний) – при відторгненні стимулюють клітинні механізми (при меланомі). • Інтерферон-γ – посилює експресію HLA-І класу на атипових клітинах, що робить їх чутливими до Т-кілерів.
 Протипухлинні вакцини 1. Пацієнт-специфічні вакцини. Вакцини виготовлені за допомогою антигенів пухлини конкретного пацієнта. 2. Тумор-специфічні вакцини. Вакцини масово синтезуються для використання будь-яким онкохворим з певною конкретною пухлиною.
Протипухлинні вакцини 1. Пацієнт-специфічні вакцини. Вакцини виготовлені за допомогою антигенів пухлини конкретного пацієнта. 2. Тумор-специфічні вакцини. Вакцини масово синтезуються для використання будь-яким онкохворим з певною конкретною пухлиною.
 План лекції 1. Трансплантаційний імунітет. 2. Імунологія репродукції. 3. Протипухлинний імунітет. 4. Аутоімунні захворювання.
План лекції 1. Трансплантаційний імунітет. 2. Імунологія репродукції. 3. Протипухлинний імунітет. 4. Аутоімунні захворювання.
 Аутоімунні захворювання Це патологічний процес, який характеризується розвитком стійкої імунної відповіді проти власних антигенів і приводить до ураження органів і тканин. Значно частіше зустрічаються у жінок, ніж у чоловіків. Найбільший ризик виникнення – у віці 20 -40 років. Найважливіший етіологічний момент – природжена схильність до дефектів розпізнання антигенів і підтримання аутотолерантності.
Аутоімунні захворювання Це патологічний процес, який характеризується розвитком стійкої імунної відповіді проти власних антигенів і приводить до ураження органів і тканин. Значно частіше зустрічаються у жінок, ніж у чоловіків. Найбільший ризик виникнення – у віці 20 -40 років. Найважливіший етіологічний момент – природжена схильність до дефектів розпізнання антигенів і підтримання аутотолерантності.
 Поділ і характеристика Аутоімунні захворювання поділяють на дві групи: 1. Системні (СЧВ, РА та ін. ). 2. Органоспецифічні (тиреоїдит Хашімото, ЦД І типу, міастенія гравіс, атрофічний гастрит та ін. ). Аутоімунний процес може опосередковуватися як гуморальними (ауто. АТ, ЦІК), так і клітинними (сповільнена гіперчутливість, Т-кілери) механізмами. Більшість аутоімунних захворювань асоційована з антигенами HLA-DR.
Поділ і характеристика Аутоімунні захворювання поділяють на дві групи: 1. Системні (СЧВ, РА та ін. ). 2. Органоспецифічні (тиреоїдит Хашімото, ЦД І типу, міастенія гравіс, атрофічний гастрит та ін. ). Аутоімунний процес може опосередковуватися як гуморальними (ауто. АТ, ЦІК), так і клітинними (сповільнена гіперчутливість, Т-кілери) механізмами. Більшість аутоімунних захворювань асоційована з антигенами HLA-DR.
 Імунологічні ознаки аутоімунних захворювань Ø Підвищений рівень гаммаглобулінів у крові Ø Наявність аутоантитіл Ø Знижений рівень сироваткового комплементу Ø Високий вміст ЦІК Ø Зниження вмісту й активності Т-супресорів Ø Виявлення при біопсії пошкодження тканин і фіксованих у них імунних комплексів
Імунологічні ознаки аутоімунних захворювань Ø Підвищений рівень гаммаглобулінів у крові Ø Наявність аутоантитіл Ø Знижений рівень сироваткового комплементу Ø Високий вміст ЦІК Ø Зниження вмісту й активності Т-супресорів Ø Виявлення при біопсії пошкодження тканин і фіксованих у них імунних комплексів
 Типи аутоантитіл 1. Неспецифічні (універсальні) – характерні для багатьох аутоімунних захворювань (протиядерні, протимітохондріальні, антифосфоліпідні). 2. Тканиноспецифічні – їх вплив обмежений певним типом тканин, хоча не завжди обмежений певним органом (АТ до острівців Лангерганса при ЦД І типу; АТ до ацетилхолінових рецепторів при міастенії). 3. Органоспецифічні – їх дія обмежена органом, але не тканиною (АТ до епітелію жовчних шляхів при первинному біліарному цирозі).
Типи аутоантитіл 1. Неспецифічні (універсальні) – характерні для багатьох аутоімунних захворювань (протиядерні, протимітохондріальні, антифосфоліпідні). 2. Тканиноспецифічні – їх вплив обмежений певним типом тканин, хоча не завжди обмежений певним органом (АТ до острівців Лангерганса при ЦД І типу; АТ до ацетилхолінових рецепторів при міастенії). 3. Органоспецифічні – їх дія обмежена органом, але не тканиною (АТ до епітелію жовчних шляхів при первинному біліарному цирозі).
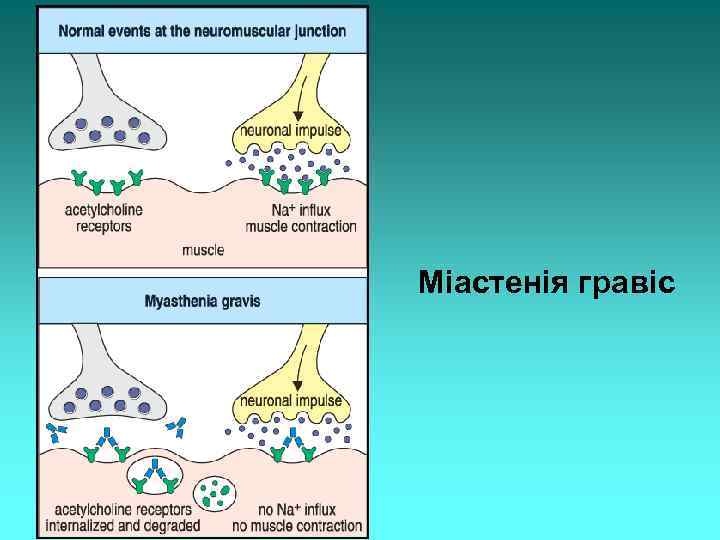 Міастенія гравіс
Міастенія гравіс
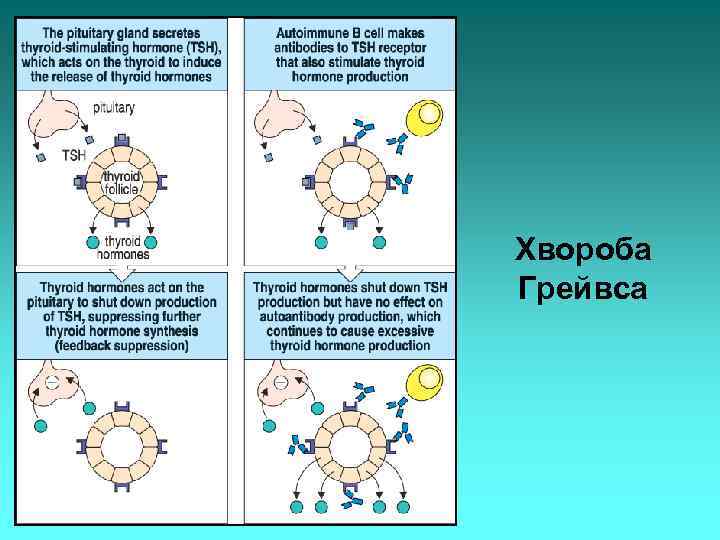 Хвороба Грейвса
Хвороба Грейвса
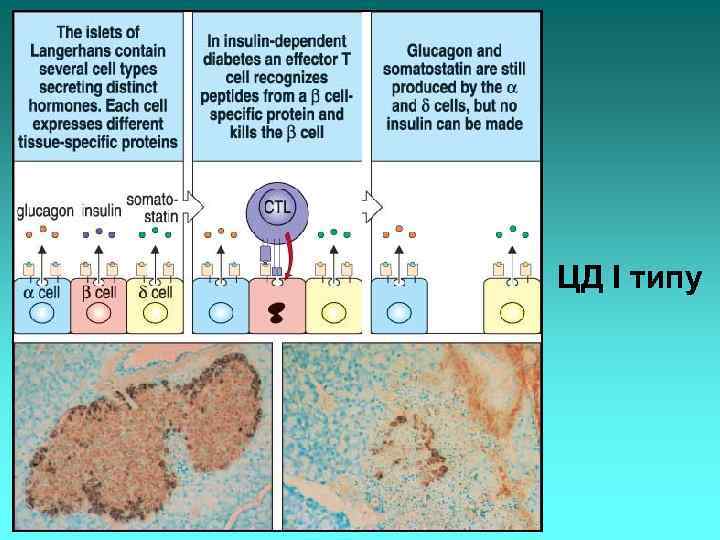 ЦД І типу
ЦД І типу
 Імунологічна привілегія Імунологічно привілегійованими місцями в організмі є мозок, очі, щитоподібна залоза, матка (плід), яєчка. За статистикою саме ці тканини частіше за інші стають об’єктом аутоімунного пошкодження, напр. , симпатична офтальмія (дослівно “запалення другого ока”).
Імунологічна привілегія Імунологічно привілегійованими місцями в організмі є мозок, очі, щитоподібна залоза, матка (плід), яєчка. За статистикою саме ці тканини частіше за інші стають об’єктом аутоімунного пошкодження, напр. , симпатична офтальмія (дослівно “запалення другого ока”).
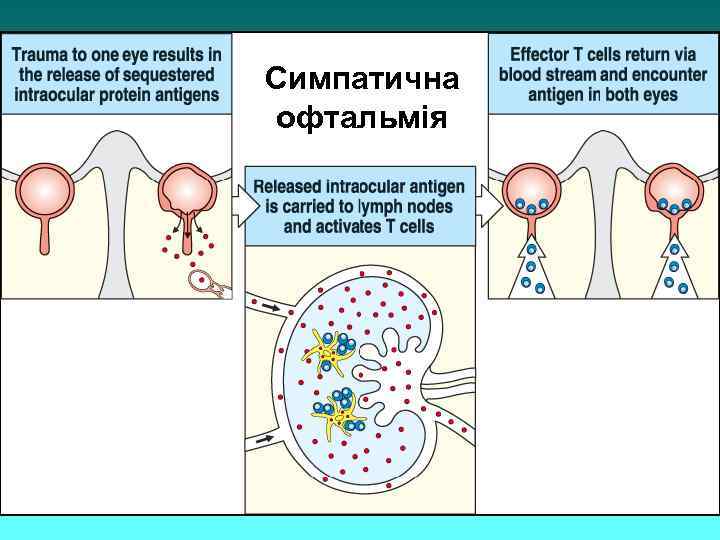 Симпатична офтальмія
Симпатична офтальмія
 Лікування І. Етіотропна терапія (стимуляція розвитку толерантності – per os отримують антиген (напр. , мілорал при ЦД). ІІ. Патогенетична терапія: 1) імуносупресія: а) медикаментозна (ГКС, цитостатики); б) хірургічна (тимектомія при міастенії гравіс). 2) детоксикаційна терапія (ентеросорбція, гемосорбція, плазмаферез). 3) Т-клітинна вакцинація (активація Тс). 4) моноклональні антитіла (до CD 3, до IL 2 r).
Лікування І. Етіотропна терапія (стимуляція розвитку толерантності – per os отримують антиген (напр. , мілорал при ЦД). ІІ. Патогенетична терапія: 1) імуносупресія: а) медикаментозна (ГКС, цитостатики); б) хірургічна (тимектомія при міастенії гравіс). 2) детоксикаційна терапія (ентеросорбція, гемосорбція, плазмаферез). 3) Т-клітинна вакцинація (активація Тс). 4) моноклональні антитіла (до CD 3, до IL 2 r).
 Дякую за увагу!
Дякую за увагу!


