Лекция 7 IV, V группы ПСХЭ Д.И. Менделеева.pptx
- Количество слайдов: 12
 IV, V группы ПСХЭ Д. И. Менделеева
IV, V группы ПСХЭ Д. И. Менделеева
 Натрия нитрит (natrii nitris) Na. NO 2 Получение: Восстановление расплавленного нитрата натрия свинцом Промышленный способ: поглощение раствора карбоната натрия диоксидом азота Смесь солей разделяют фракционной перекристаллизацией. Вначале кристаллизуется натрия нитрат (так как он менее растворим в воде). После тщательной очистки от примесей получают лекарственное вещество.
Натрия нитрит (natrii nitris) Na. NO 2 Получение: Восстановление расплавленного нитрата натрия свинцом Промышленный способ: поглощение раствора карбоната натрия диоксидом азота Смесь солей разделяют фракционной перекристаллизацией. Вначале кристаллизуется натрия нитрат (так как он менее растворим в воде). После тщательной очистки от примесей получают лекарственное вещество.
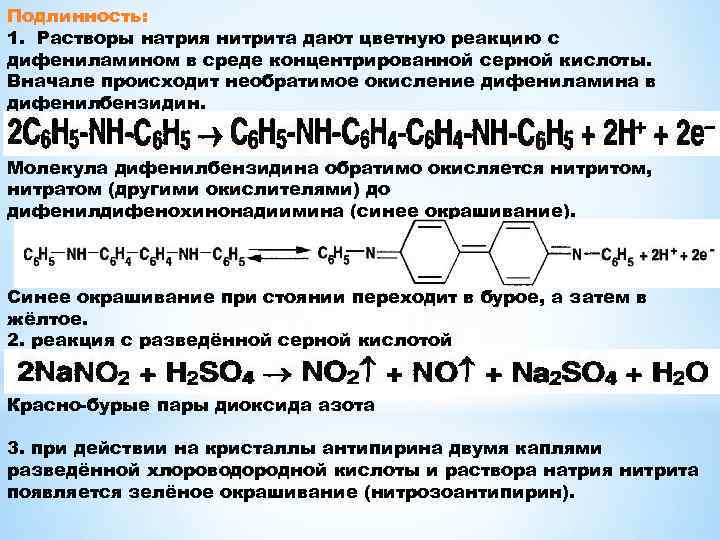 Подлинность: 1. Растворы натрия нитрита дают цветную реакцию с дифениламином в среде концентрированной серной кислоты. Вначале происходит необратимое окисление дифениламина в дифенилбензидин. Молекула дифенилбензидина обратимо окисляется нитритом, нитратом (другими окислителями) до дифенилдифенохинонадиимина (синее окрашивание). Синее окрашивание при стоянии переходит в бурое, а затем в жёлтое. 2. реакция с разведённой серной кислотой Красно-бурые пары диоксида азота 3. при действии на кристаллы антипирина двумя каплями разведённой хлороводородной кислоты и раствора натрия нитрита появляется зелёное окрашивание (нитрозоантипирин).
Подлинность: 1. Растворы натрия нитрита дают цветную реакцию с дифениламином в среде концентрированной серной кислоты. Вначале происходит необратимое окисление дифениламина в дифенилбензидин. Молекула дифенилбензидина обратимо окисляется нитритом, нитратом (другими окислителями) до дифенилдифенохинонадиимина (синее окрашивание). Синее окрашивание при стоянии переходит в бурое, а затем в жёлтое. 2. реакция с разведённой серной кислотой Красно-бурые пары диоксида азота 3. при действии на кристаллы антипирина двумя каплями разведённой хлороводородной кислоты и раствора натрия нитрита появляется зелёное окрашивание (нитрозоантипирин).
 Количественное определение: Перманганатометрия с последующей йодометрией Избыток перманганата калия определяют при добавлении йодида калия. Хранят в тёмном месте, в хорошо укупоренных склянках из оранжевого стекла. Применяют как коронарорасширяющее средство при стенокардии.
Количественное определение: Перманганатометрия с последующей йодометрией Избыток перманганата калия определяют при добавлении йодида калия. Хранят в тёмном месте, в хорошо укупоренных склянках из оранжевого стекла. Применяют как коронарорасширяющее средство при стенокардии.
 Висмута нитрат основной (Bismuthi subnitras) Bi(NO 3)3 Получение: Окисление свободного от примесей металлического висмута концентрированной азотной кислотой. Гидролиз в кипящей воде с образованием нерастворимой соли висмута нитрата основного.
Висмута нитрат основной (Bismuthi subnitras) Bi(NO 3)3 Получение: Окисление свободного от примесей металлического висмута концентрированной азотной кислотой. Гидролиз в кипящей воде с образованием нерастворимой соли висмута нитрата основного.
 Подлинность: 1. прокаливание, которое приводит к разложению с образованием жёлто-бурых паров (диоксид азота) и жёлтого остатка (оксид висмута). 2. реакция с сульфидом натрия в минеральной кислоте (выпадает коричнево-чёрный осадок). 3. реакция с йодидом калия (чёрный осадок)
Подлинность: 1. прокаливание, которое приводит к разложению с образованием жёлто-бурых паров (диоксид азота) и жёлтого остатка (оксид висмута). 2. реакция с сульфидом натрия в минеральной кислоте (выпадает коричнево-чёрный осадок). 3. реакция с йодидом калия (чёрный осадок)
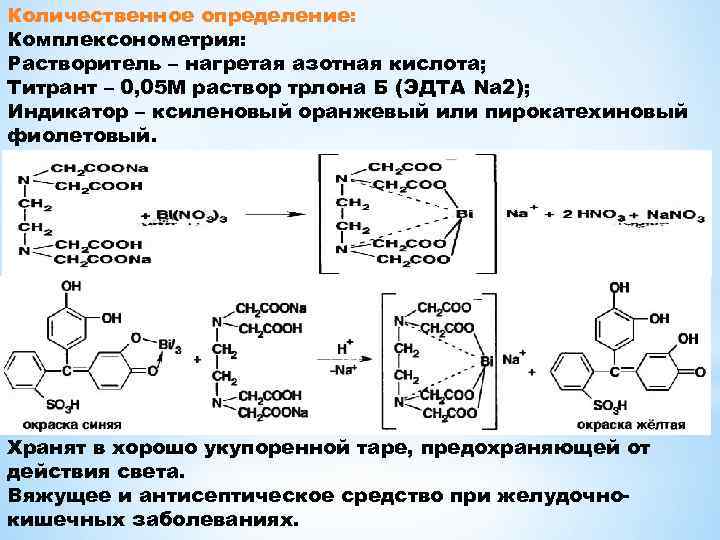 Количественное определение: Комплексонометрия: Растворитель – нагретая азотная кислота; Титрант – 0, 05 М раствор трлона Б (ЭДТА Na 2); Индикатор – ксиленовый оранжевый или пирокатехиновый фиолетовый. Хранят в хорошо укупоренной таре, предохраняющей от действия света. Вяжущее и антисептическое средство при желудочнокишечных заболеваниях.
Количественное определение: Комплексонометрия: Растворитель – нагретая азотная кислота; Титрант – 0, 05 М раствор трлона Б (ЭДТА Na 2); Индикатор – ксиленовый оранжевый или пирокатехиновый фиолетовый. Хранят в хорошо укупоренной таре, предохраняющей от действия света. Вяжущее и антисептическое средство при желудочнокишечных заболеваниях.
 Натрия гидрокарбонат (natrii hydrocarbonas) Na. HCO 3 Получение: аммиачно-хлоридный способ. На очищенный от примесей рассол хлорида натрия действуют аммиаком, а затем подвергают карбонизации в барботажных колоннах.
Натрия гидрокарбонат (natrii hydrocarbonas) Na. HCO 3 Получение: аммиачно-хлоридный способ. На очищенный от примесей рассол хлорида натрия действуют аммиаком, а затем подвергают карбонизации в барботажных колоннах.
 Подлинность: 1. с минеральной кислотой выделение углекислого газа Отличия карбонатов от гидрокарбонатов: 1. с фенолфталеином карбонат красное окрашивание, гидрокарбонат остаётся бесцветным или становится слаборозовым. 2. с насыщенным раствором сульфата магния карбонат образует осадок при обычной температуре А гидрокарбонат образует осадок только после кипячения (превращения в карбонат).
Подлинность: 1. с минеральной кислотой выделение углекислого газа Отличия карбонатов от гидрокарбонатов: 1. с фенолфталеином карбонат красное окрашивание, гидрокарбонат остаётся бесцветным или становится слаборозовым. 2. с насыщенным раствором сульфата магния карбонат образует осадок при обычной температуре А гидрокарбонат образует осадок только после кипячения (превращения в карбонат).
 Количественное определение: Кислотно-основное титрование (ацидиметрия): Титрант – 0, 1 М раствор хлороводородной кислоты; Индикатор – метиловый оранжевый Хранят в хорошо укупоренных банках. Применяют как антацидное средство, а также наружно, в виде полосканий, промываний, ингаляций.
Количественное определение: Кислотно-основное титрование (ацидиметрия): Титрант – 0, 1 М раствор хлороводородной кислоты; Индикатор – метиловый оранжевый Хранят в хорошо укупоренных банках. Применяют как антацидное средство, а также наружно, в виде полосканий, промываний, ингаляций.
 Лития карбонат – Lithium Carbonate (lithii carbonas) Li 2 CO 3 Получение: Действие карбонатов на соли лития или пропускание диоксида углерода в растворы гидроксида лития. Подлинность: 1. изменение окраски бесцветного пламени в карминово-красный цвет. 2. карбонат-ион обнаруживают по обильному выделению пузырьков газа после добавления к лития карбонату разведённой хлороводородной кислоты. 3. реакция в хлороводородной кислоте с гидрофосфатом динатрия и гидроксидом натрия после кипячения (белый осадок). 4. с фторидами щелочных металлов (белый осадок) 5. в щелочной среде с 8 -оксихинолином (голубовато-зелёная флуоресценция).
Лития карбонат – Lithium Carbonate (lithii carbonas) Li 2 CO 3 Получение: Действие карбонатов на соли лития или пропускание диоксида углерода в растворы гидроксида лития. Подлинность: 1. изменение окраски бесцветного пламени в карминово-красный цвет. 2. карбонат-ион обнаруживают по обильному выделению пузырьков газа после добавления к лития карбонату разведённой хлороводородной кислоты. 3. реакция в хлороводородной кислоте с гидрофосфатом динатрия и гидроксидом натрия после кипячения (белый осадок). 4. с фторидами щелочных металлов (белый осадок) 5. в щелочной среде с 8 -оксихинолином (голубовато-зелёная флуоресценция).
 Количественное определение: Кислотно-основное титрование (ацидиметрия): Титрант – 0, 1 М раствор хлороводородной кислоты; Индикатор – метиловый оранжевый. Хранят в хорошо укупоренной таре. Для лечения подагры и растворения почечных камней
Количественное определение: Кислотно-основное титрование (ацидиметрия): Титрант – 0, 1 М раствор хлороводородной кислоты; Индикатор – метиловый оранжевый. Хранят в хорошо укупоренной таре. Для лечения подагры и растворения почечных камней


