15 IVB группа.ppt
- Количество слайдов: 49

IV группа периодической системы IVB-группа
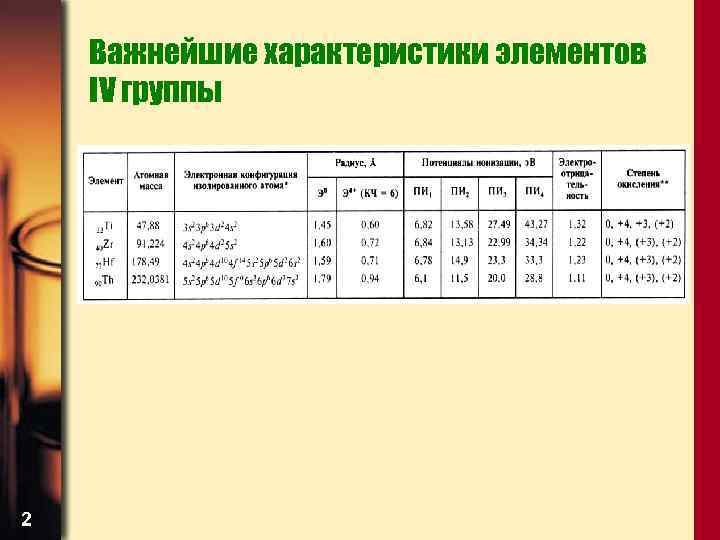
Важнейшие характеристики элементов IV группы 2

Общая характеристика • Фактически эта группа открывает химию переходных d-элементов, т. к. элементы IIIВ группы, открывающие d-ряды, практически ни в одном соединении не содержат dэлектронов • В состав этой группы входят Ti, Zr, Hf и Rf – резерфордий. Rf – 1 -й элемент, следующий за актинидами, его электронная конфигурация 5 f 145 d 27 s 2 аналогична конфигурации Hf 4 f 145 d 26 s 2. Он был получен в США на циклотроне, а обнаружен советскими учеными в продуктах спонтанного деления ядер 3

Общая характеристика 4 • В основном состоянии атомы элементов IVB группы имеют конфигурацию (n– 1)d 2 ns 2 • Суммарная энергия ионизации при переходе от Ti к Zr снижается, что обусловлено уменьшением энергии связи ns-электронов с ядрами; затем существенно не меняется • Из них лишь Ti проявляет высокую химическую активность. Атомный радиус заметно растет при переходе от Ti к Zr (увеличение числа электронных слоев), а затем к Hf – практически нет (лантанидное сжатие)

Общая характеристика • Для этих элементов наиболее характерна степень окисления +4, однако подавляющее большинство соединений, за исключением фторидов и оксидов ковалентные, в них отсутствуют ионы Мe 4+ • С ростом атомного радиуса степень ионности соединений аналогичного состава несколько увеличивается, возрастает Тпл и Ткип, повышается устойчивость к гидролизу 5

Общая характеристика • В ряду Ti – Zr – Hf устойчивость соединения с высшей степенью окисления возрастает. Так, для Ti устойчивы оксиды Ti. O, Ti 2 O 3, Ti. O 2 и фториды Ti. F 2, Ti. F 3, Ti. F 4, а для Zr и Hf – только Zr. O 2, Hf. O 2 и Zr. F 4, Hf. F 4 • Склонность к проявлению низких степеней окисления +2, +3 у титана выше, чем у его тяжелых аналогов. Так, в кислых водных растворах существуют акваанионы Ti(III), а аналогичные соединения Zr и Hf – нет, т. к. они легко окисляются водой. • Координационные числа: Ti – 6, реже – 4, Zr и Hf – часто 7 и 8 6

Нахождение в природе и получение • • • 7 Ti – 0, 6%; Zr ~10– 2%, Hf ~3· 10– 4% Минералы: Ti. O 2 (рутил, брукит, анатаз), Fe. Ti. O 3 и Ca. Ti. O 3 – ильменит и перовскит Zr – Zr. O 2 — бадделеит и Zr. Si. O 4 — циркон Hf — примесь в циркониевых минералах

Получение металлов Титановые руды «вскрывают» путём хлорирования (в присутствии углерода) при температуре красного каления: 2 Fe. Ti. O 3 + 6 C + 7 Cl 2 6 CO 2 Ti. Cl 4↑ + 2 Fe. Cl 3↑ + Ti. Cl 4 и Fe. Cl 3 разделяют методом фракционного испарения. Затем: Ti. Cl 4 + Мg Ti + 2 Mg. Cl 2 Титан «отмывают» от оставшегося Mg. Cl 2 водой, а от неизрасходованного Mg разбавленной HCl 8
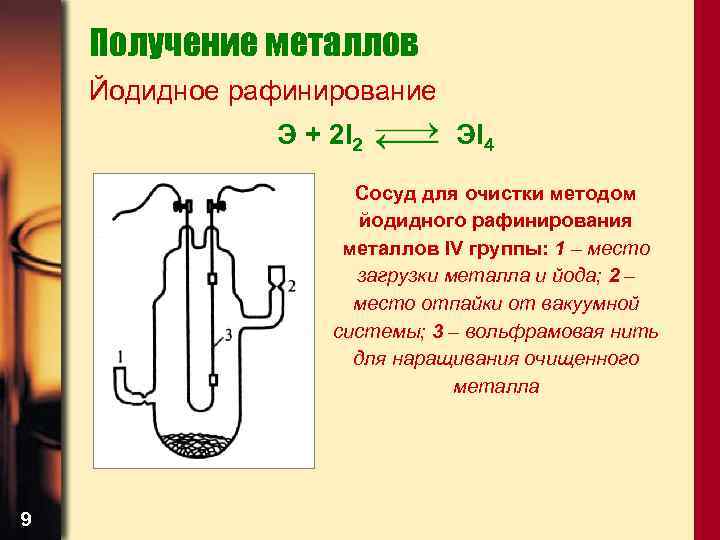
Получение металлов Йодидное рафинирование Э + 2 I 2 ЭI 4 Сосуд для очистки методом йодидного рафинирования металлов IV группы: 1 – место загрузки металла и йода; 2 – место отпайки от вакуумной системы; 3 – вольфрамовая нить для наращивания очищенного металла 9

Получение металлов Образцы титана (верхний ряд) и циркония, очищенные методом йодидного рафинирования 10
![Получение металлов Отделение циркония от гафния • Дробная кристаллизация Комплекс K 2[Zr. F 6] Получение металлов Отделение циркония от гафния • Дробная кристаллизация Комплекс K 2[Zr. F 6]](https://present5.com/presentation/14884915_68583143/image-11.jpg)
Получение металлов Отделение циркония от гафния • Дробная кристаллизация Комплекс K 2[Zr. F 6] K 2[Hf. F 6] Растворимость, моль/л 0, 07 0, 10 • Метод экстракции органическими растворителями • Цирконий в виде трибутилфосфатного комплекса нитрата цирконила [Zr. O(NO 3)2· 2 ТБФ] переходит в органическую фазу, а гафний остаётся в растворе. 11

Простые вещества Важнейшие свойства простых веществ 12 • Металлы подгруппы Ti диморфны. При обычных условиях – ГПУ-решетка, при высоких температурах – ОЦК • Ti – Zr – Hf – образование непрерывных твердых растворов для обеих модификаций

Простые вещества • Характеризуются сильно отрицательными электродными потенциалами. • Все металлы химически стабильны, на воздухе коррозионно устойчивы из-за пленки оксидов ЭО 2. Агрессивные окислители уплотняют оксидную пленку (H 2 SO 4, конц. HNO 3), а источники активных лигандов — растворяют эту пленку: ЭO 2 + 6 HF → H 2[ЭF 6] + 2 H 2 O ЭO 2 + 3 H 2 C 2 O 4 → H 2[Э(C 2 O 4)3] + 2 H 2 O к. ч. = 6 13

Простые вещества • Взаимодействие с неметаллами при повышенной температуре приводит к получению бинарных соединений (гидридов, галогенидов, оксидов, сульфидов, нитридов, карбидов, силицидов). • С другими металлами – твёрдые растворы замещения (с V и Cr) или интерметаллиды (с Fe, Co, Ni, Cu, Zn) Титан – необыкновенно коррозионностойкий металл. 14

Простые вещества • Сами металлы с кислотами легко реагируют, способны вытеснять Н 2 даже из Н 2 О: Э + 2 Н 2 О = ЭО 2 + 2 Н 2 (выше 800 ºС) • Также: 8 Ti + 4 HNO 3 + 18 HF → 3 H 2[Ti. F 6] + 4 NO↑ + 8 H 2 O фторо- и хлорокомплексы • Титан растворяется в концентрированной HF: Ti + 6 HF = H 2[Ti. F 6] + 2 H 2↑ 15

Простые вещества • Реакция с горячей HCl идет гораздо энергичнее, чем с H 2 SO 4 из-за образования хлоридных комплексов 2 Ti + 6 HCl = 2 Ti. Cl 3 + 3 H 2↑ (в отличие от Zr и Hf) • Взаимодействие с горячей конц. HNO 3: Ti + 4 HNO 3 + (n-2)H 2 O = Ti. O 2·n. H 2 O↓ + 4 NO 2↑ β-титановая кислота • Ti медленно растворяется в царской водке, взаимодействует с олеумом: Ti + 4 H 2 S 2 O 7 = Ti(SO 4)2 + 2 SO 2↑ + 4 H 2 SO 4 16

Простые вещества • Мелкодисперсный титан взаимодействует с концентрированными растворами щелочей: Ti + 2 Na. OH + H 2 O = Na 2 Ti. O 3 + 2 H 2↑ • Zr и Hf более устойчивы к окислению кислотами, не реагируют ни с одной из разбавленных кроме HF Э + 7 HF = H 3[ЭF 7] + 2 H 2↑ 3 Э + 4 HNO 3 + 18 HX = 3 H 2[ЭX 6] + 4 NO↑ + 8 H 2 O (X = Cl, F) Э + 5 H 2 SO 4 = H 2[Э(SO 4)3] + 2 SO 2↑ + 4 H 2 O 17

Простые вещества • Zr и Hf, в отличие от Ti, со щелочами не реагируют. Коррозия Hf не наблюдается даже в кипящем растворе Na. OH в присутствии Na 2 O 2 • В растворах щелочей устойчивы, реагируют на воздухе с расплавами Э + 2 Na. OH + O 2 (распл. ) → Na 2 ЭO 3 + H 2 O Э + 2 Na. Cl + 3/2 O 2 (распл. ) → Na 2 ЭO 3 + Cl 2 (для Zr – ортоформы Na 4 ЭО 4) 18

Простые вещества • Реакция с галогенами начинается при слабом нагревании, выделяется большое количество теплоты, образуются ЭHal 4 • С I 2 – 200 ºС • С азотом и водородом – при высоких (~1000 ºС), образуются нитриды ЭN и гидриды ЭНх (х = 1– 4) 19

Кислородные соединения • Степень окисления +4 Диоксиды ЭО 2 20
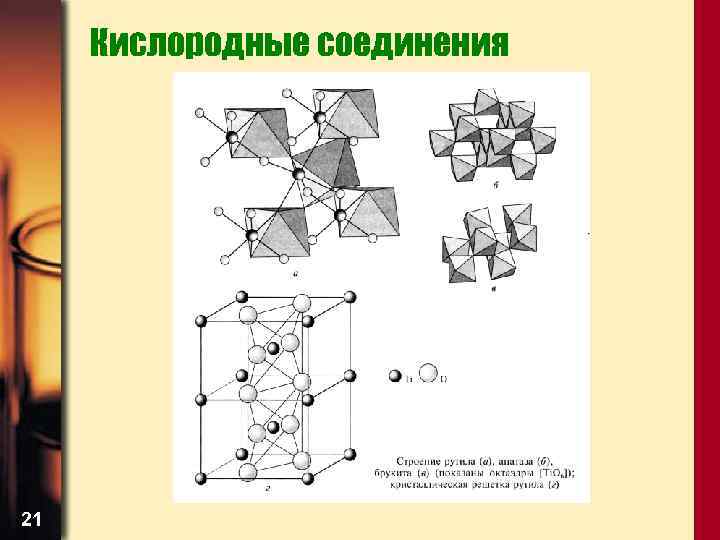
Кислородные соединения 21
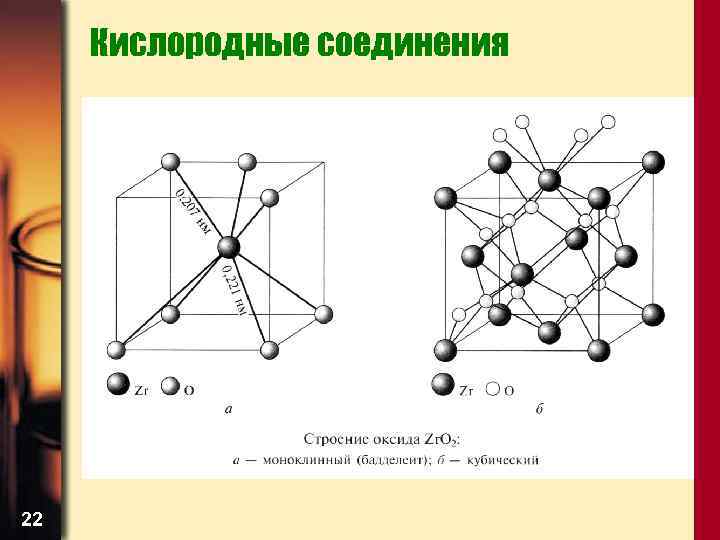
Кислородные соединения 22

Кислородные соединения Смешанные оксиды титана (или титанаты) Взаимодействие ЭО 2 при прокаливании с оксидами других элементов-металлов приводит к образованию смешанных оксидов (Fe. Ti. O 3, Ca. Ti. O 3). Только в ортотитанате бария Ba 2 Ti. O 4 есть изолированный оксоанион Ti. O 44 - 23

Кислородные соединения Ti. O 2 + K 2 CO 3 = K 2 Ti. O 3 + CO 2↑ При обработке водой подвергаются полному гидролизу: K 2 Ti. O 3 + (n+1)H 2 O = Ti. O 2·n. H 2 O↓ + 2 КОН образуется золь титановой кислоты. Цирконаты и гафнаты состава (ЩЗЭ)ЭО 3, (ЩЗЭ)2 ЭО 4, (ЩЭ)2 ЭО 3, (ЩЭ)4 ЭО 4 также представляют собой смешанные оксиды. Ba. Ti. O 3 обладает свойствами сегнето- и пьезоэлектрика. 24

Кислородные соединения • Гидраты оксидов ЭО 2·n. H 2 O • Для синтеза ЭО 2·n. H 2 O используют гидролиз различных растворимых соединений этих элементов. Они не проявляют свойств оснований Э(ОН)4 или кислот Н 4 ЭО 4. • Переход осадка ЭО 2·n. H 2 O в раствор под действием кислот и (в слабой степени) щелочей обусловлен пептизацией (превращением геля в золь). Получаемые при этом коллоидные растворы содержат относительно крупные частицы – гидратированные оксополимеры. 25

Кислородные соединения • Титан из титановой кислоты Ti. O 2·n. H 2 O можно при действии соляной кислоты перевести в истинный раствор в форме комплексной кислоты H 2[Ti. Cl 6]. Действие концентрированных щелочей на Ti. O 2·n. H 2 O связано с образованием гидроксокомплексов, например (ЩЭ)2[Ti(OH)6]. • Ортотитановая кислота Ti. O 2· 2 H 2 O – α-форма титановой кислоты. • Метатитановая кислота Ti. O 2·H 2 O – β-форма титановой кислоты. 26
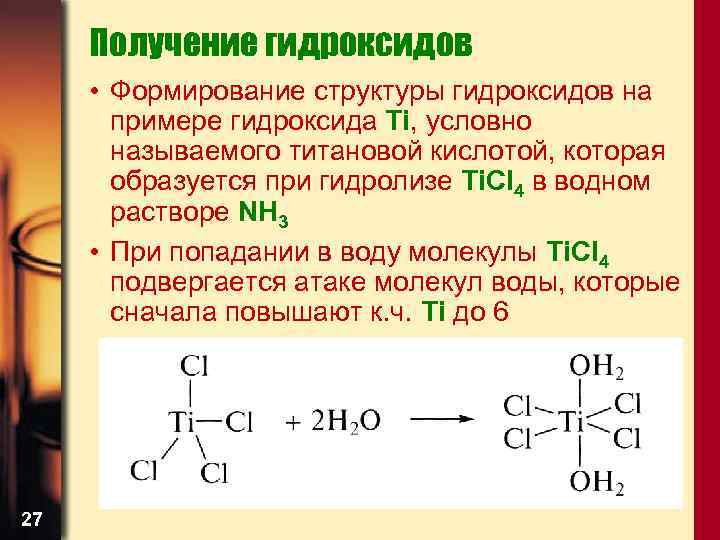
Получение гидроксидов • Формирование структуры гидроксидов на примере гидроксида Ti, условно называемого титановой кислотой, которая образуется при гидролизе Ti. Cl 4 в водном растворе NH 3 • При попадании в воду молекулы Ti. Cl 4 подвергается атаке молекул воды, которые сначала повышают к. ч. Ti до 6 27
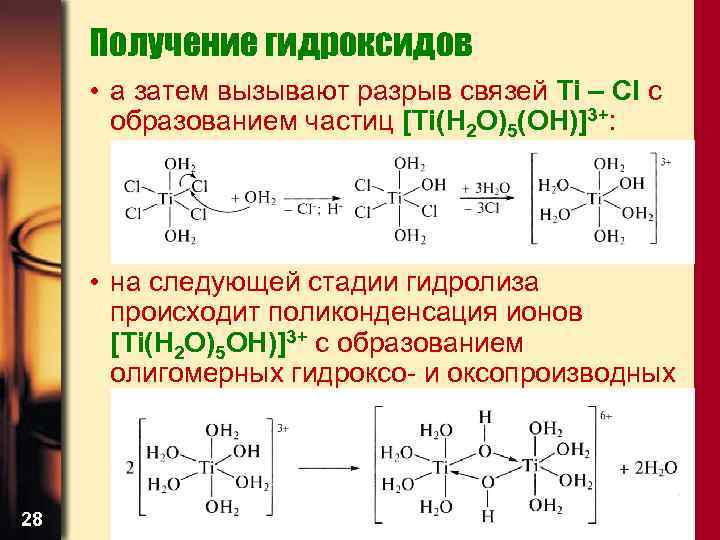
Получение гидроксидов • а затем вызывают разрыв связей Ti – Cl с образованием частиц [Ti(H 2 O)5(OH)]3+: • на следующей стадии гидролиза происходит поликонденсация ионов [Ti(H 2 O)5 OH)]3+ с образованием олигомерных гидроксо- и оксопроизводных 28
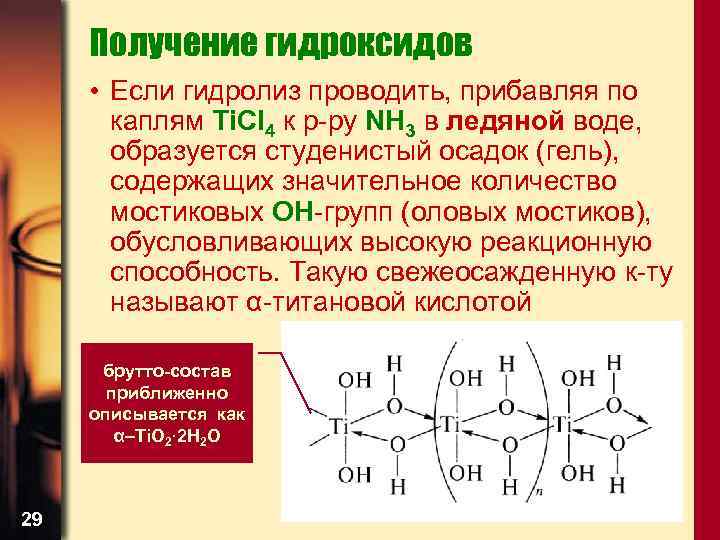
Получение гидроксидов • Если гидролиз проводить, прибавляя по каплям Ti. Cl 4 к р-ру NH 3 в ледяной воде, образуется студенистый осадок (гель), содержащих значительное количество мостиковых OH-групп (оловых мостиков), обусловливающих высокую реакционную способность. Такую свежеосажденную к-ту называют α-титановой кислотой брутто-состав приближенно описывается как α–Ti. O 2· 2 H 2 O 29

Кислородные соединения Низшие степени окисления Оксид титана (III) Ti 2 O 3 2 Ti. O 2 + H 2 (1200 ºС) → Ti 2 O 3 + H 2 O 3 Ti. O 2 + Ti (1500 ºС) → 2 Ti 2 O 3 При нагревании диспропорционирует: Ti 2 O 3 = Ti. O 2 + Ti. O Гидроксид титана Ti(OН)3 При хранении переходит в Ti 2 O 3·х. Н 2 О. Растворим в кислотах, но не растворяется в избытке щёлочи, т. е. является только основанием. 30

Кислородные соединения На воздухе Ti(OН)3 быстро окисляется: 4 Ti(OН)3 + О 2 + 2 Н 2 О = 4 Ti(OН)4 Соединения титана (III) – сильные восстановители. 8 Ti(OН)3 + Na. NO 3 + 6 Н 2 О = 8 Ti(OН)4 + NH 3 + Na. OH Квасцы красного цвета (ЩЭ)2 SO 4· Ti 2(SO 4)3· 24 H 2 O 31

Кислородные соединения Монооксид титана Ti. O Получают нагреванием Ti. O 2 с Ti в вакууме, имеет структуру типа Na. Cl. У Ti 2+ восстановительные свойства выражены сильнее, Ti. O вытесняет Н 2 из кислот! 2 Ti. O + 3 H 2 SO 4 → Ti 2(SO 4)3 + H 2 + 2 H 2 O Гидроксид титана Ti(OН)2 – чёрного цвета, мгновенно окисляется на воздухе. 32

Кислородные соединения • Перевод диоксидов в растворимое состояние – сплавление с пиросульфатами, кислыми фторидами, щелочами Zr. O 2 + 4 KHF 2 = K 3[Zr. F 7] + 2 H 2 O + KF Zr. O 2 + 2 Na. OH (tº) = Na 2 Zr. O 3 + H 2 O • А также хлорированием в присутствии углерода: Zr. O 2 + 2 Cl 2 (tº) = Zr. Cl 4 + 2 CO • Оксиды Ti и Zr важные керамические материалы 33
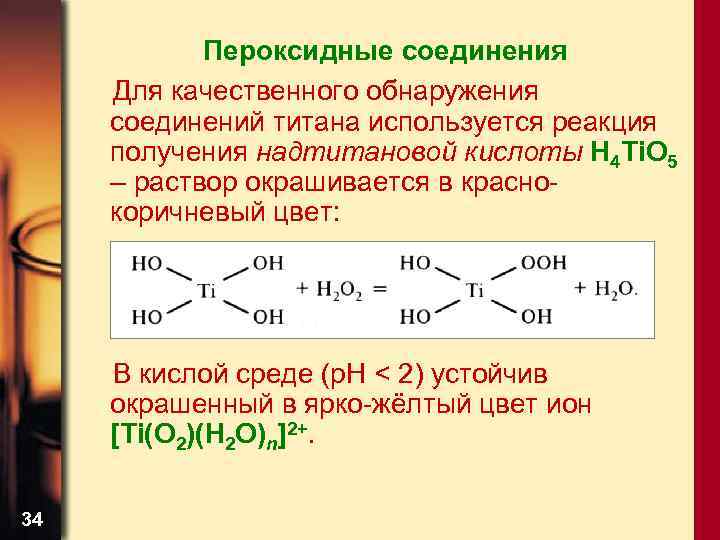
Пероксидные соединения Для качественного обнаружения соединений титана используется реакция получения надтитановой кислоты Н 4 Ti. O 5 – раствор окрашивается в краснокоричневый цвет: В кислой среде (р. Н < 2) устойчив окрашенный в ярко-жёлтый цвет ион [Ti(O 2)(H 2 O)n]2+. 34

Соли кислородсодержащих кислот • Негидролизованный безводный сульфат титана (IV) можно получить только в отсутствие воды: Ti. Cl 4 + 6 SО 3 = Ti(SO 4)2 + 2 S 2 O 5 Cl 2 Ti. O 2 + 2 K 2 S 2 О 7 = 2 K 2 SO 4 + Ti(SO 4)2 • При нагревании Ti. O 2 с концентрированной H 2 SO 4 образуется не средний сульфат Ti(SO 4)2, а гидролизованная форма – производное так называемого титанила – сульфата титанила Ti. OSO 4. 35
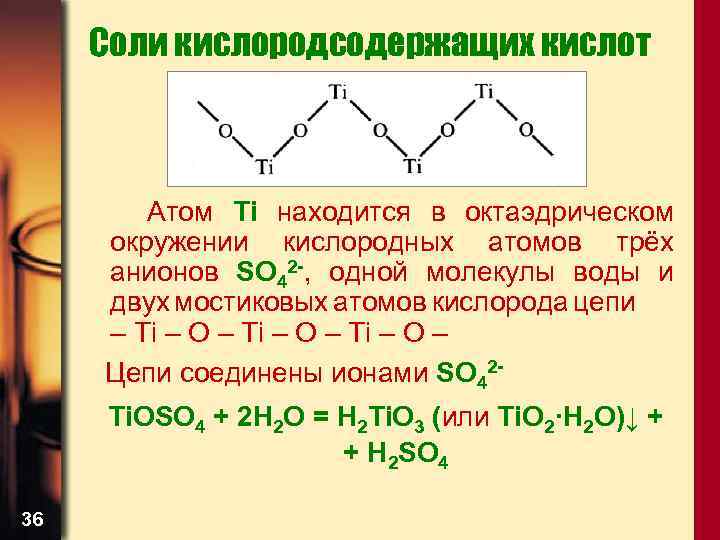
Соли кислородсодержащих кислот Атом Ti находится в октаэдрическом окружении кислородных атомов трёх анионов SO 42 -, одной молекулы воды и двух мостиковых атомов кислорода цепи – Ti – O – Цепи соединены ионами SO 42 Ti. OSO 4 + 2 H 2 О = H 2 Ti. O 3 (или Ti. O 2·H 2 O)↓ + + H 2 SO 4 36
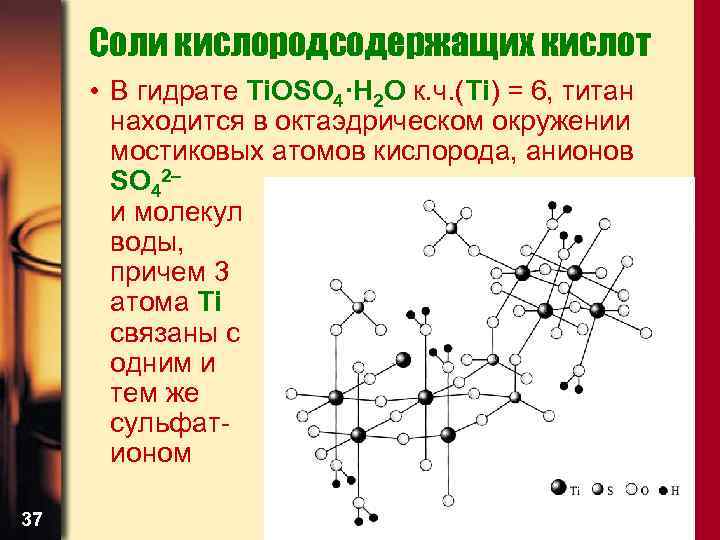
Соли кислородсодержащих кислот • В гидрате Ti. OSO 4·H 2 O к. ч. (Ti) = 6, титан находится в октаэдрическом окружении мостиковых атомов кислорода, анионов SO 42– и молекул воды, причем 3 атома Ti связаны с одним и тем же сульфатионом 37
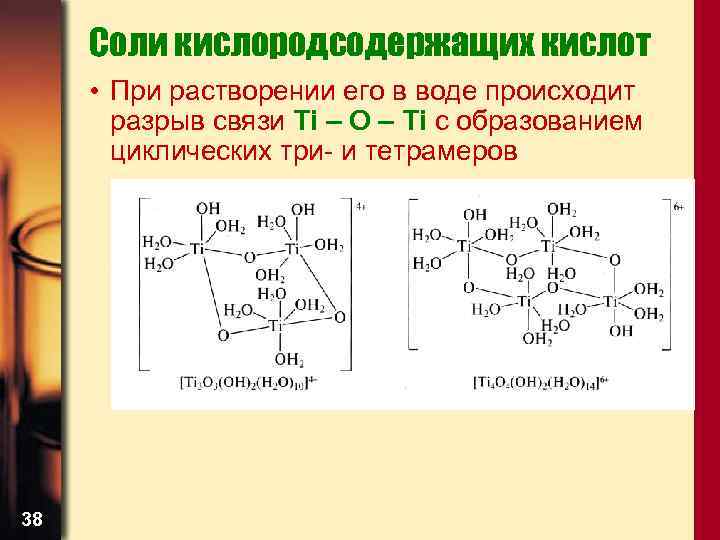
Соли кислородсодержащих кислот • При растворении его в воде происходит разрыв связи Ti – O – Ti с образованием циклических три- и тетрамеров 38
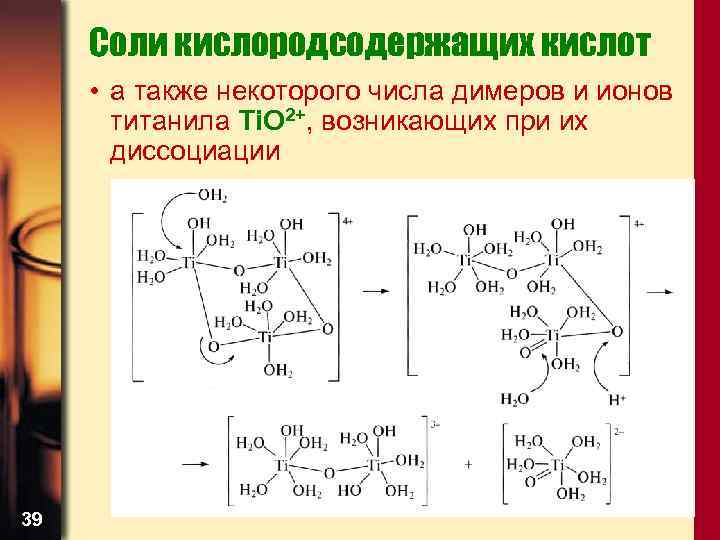
Соли кислородсодержащих кислот • а также некоторого числа димеров и ионов титанила Ti. O 2+, возникающих при их диссоциации 39

Соли кислородсодержащих кислот • Негидролизованные кристаллогидраты сульфатов Э(SO 4)2· 4 H 2 O можно выделить только из сильнокислых водных растворов (более чем 6 н. Н 2 SO 4). При растворении в воде они превращаются в так называемые соли цирконила и гафнила – основные соли ЭOSO 4·m. H 2 O или Э(OН)2 SO 4·(m-1)H 2 O. • Перхлораты и фосфаты элементов 4 -й группы, так же как и сульфаты и нитраты, гидролизуются сильнее всего в случае титана (IV), слабее всего – в случае тория (IV). 40

Соли кислородсодержащих кислот • Zr(SO 4)2· 4 H 2 O. На аноде, на самом деле: Zr(SO 4)2· 4 H 2 O → H 2+[Zr. O(SO 4)2]2–· 3 H 2 O • Нитраты не характерны Zr. O(NO 3)2· 2 H 2 O • Для Zr и Hf характерны пирофосфаты • ЭР 2 О 7 от Н 4 Р 2 О 7 и силикаты: Zr. Si. O 4 от Н 4 Si. O 4. Стабильная Э 4+ • Титанаты, цирконаты и гафнаты – сплавление: 2 KOH + 2 Zr. O 2 (1050 ºC) → K 2 Zr 2 O 5 + H 2 O • В концентрированных растворах щелочей: K 2[Ti(OH)6], K 2[Hf(OH)6] 41

Галогениды • Тетрагалогениды Фторид титана (IV) – соединение по типу ионных кристаллов (октаэдры [Ti. F 6], сочленённые углами). Ti. Cl 4 – жидкость. Ti. Br 4 и Til 4 – при комнатной температуре твёрдые вещества, имеют молекулярную структуру. При взаимодействии с H 2 O подвергаются глубокому гидролизу, образуя при этом две кислоты. 42

Галогениды • Тетрахлорид титана Ti. Cl 4 – в результате гидролиза образуются устойчивые аэрозоли (туманы), состоящие из мельчайших капель двух кислот: соляной и титановой (использование в военном деле для создания дымовых завес): Ti. Cl 4 + (2+n)H 2 О = Ti. O 2·n. H 2 O+ 4 HCl • Если Ti. Cl 4 попадает в водный раствор HCl, то с ростом концентрации HCl образуется гексахлоротитановая кислота H 2[Ti. Cl 6]. 43

Галогениды В промышленности безводные тетрахлориды получают по реакции: ЭО 2 + 2 Сl 2 ЭСl 4↑ + 2 CO↑ Трихлорид титана можно получить восстановлением галогенидов титана (IV): TICl 4 + H 2 Ti. Сl 3 + 2 HCl 2 H 2[TICl 6] + Zn = 2 Ti. Сl 3 + Zn. Cl 2 + 4 HCl Существует [TI(ОН 2)6]Cl 3 фиолетового цвета и [TI(ОН 2)4 Cl 2]Cl· 2 H 2 О – зелёного цвета – гидратная изомерия. 44

Галогениды • При нагревании тригалогениды диспропорционируют на ди- и тетрагалогениды: 2 ЭХ 3 = ЭХ 2 + ЭХ 4 • При сплавлении Ti. Cl 2 c хлоридами Rb и Cs образуются комплексные соли состава (ЩЭ)[TIСl 3] и (ЩЭ)2[TIСl 4]. 45

Гидриды • Гидриды Ti, Zr, Hf – хрупкие металлоподобные порошки переменного состава (в пределе ЭН 2), имеют структурный тип Сa. F 2. • Синтезируют ЭН 2 взаимодействием металлов с водородом. 46

Сульфиды • Сульфиды ЭS 2 – синтезируют взаимодействием простых веществ при нагревании. • Ti. S 2 – обладает металлической проводимостью; • Zr. S 2 – полупроводник; • Hf. S 2 – диэлектрик. 47

Нитриды ЭN и карбиды ЭC • Кристаллические (структурный тип Na. Cl), очень твёрдые и тугоплавкие вещества (Тпл нитридов 3200 -2630 о. С, карбидов 32503890 о. С). ЭN химически инертны. Нитрид титана (золотисто-жёлтого цвета) применяют в качестве покрытий, заменяющих золото. Покрытия из нитрида титана 48

Комплексные соединения • Ti, Zr, Hf имеют свободные d-орбитали. • В комплексных соединениях атомы Э(IV) имеют координационное число 4 или 6 в случае титана, более высокое КЧ у циркония и гафния – 6, 7, 8. • (ЩЭ)4[ЭF 8], (ЩЭ)3[ЭF 7] 49
15 IVB группа.ppt