Prezentatsia_k_lektsii4.ppt
- Количество слайдов: 41
 История химии и химической технологии Период классической химии Периодическая система химических элементов
История химии и химической технологии Период классической химии Периодическая система химических элементов
 Главные направления исследований, подготовивших основу для открытия периодического закона: 1) Определение атомных масс химических элементов Д. Дальтон (1803 -1810) Я. Берцелиус (1814 -1826) В. Реньо 1840 -е годы С. Канниццаро (1857 -1858) 2) Изучение сходства кристаллических форм соединений различных химических элементов (изоморфизм) Р. Гаюн (1801) Э. Митчерлих (1819) Я. Берцелиус (1820 -1826) К. Раммельсберг (1852)
Главные направления исследований, подготовивших основу для открытия периодического закона: 1) Определение атомных масс химических элементов Д. Дальтон (1803 -1810) Я. Берцелиус (1814 -1826) В. Реньо 1840 -е годы С. Канниццаро (1857 -1858) 2) Изучение сходства кристаллических форм соединений различных химических элементов (изоморфизм) Р. Гаюн (1801) Э. Митчерлих (1819) Я. Берцелиус (1820 -1826) К. Раммельсберг (1852)
 3) Систематизация химических элементов И. Деберейнер (1816, 1829) У. Одлинг (1857 -1868) М. Петтенкофер (1850) Ж. Дюма, (1851) Дж. Ньюлендс (1863 -1865) А. Штреккер (1859) Л. Мейер (1864 -1868)
3) Систематизация химических элементов И. Деберейнер (1816, 1829) У. Одлинг (1857 -1868) М. Петтенкофер (1850) Ж. Дюма, (1851) Дж. Ньюлендс (1863 -1865) А. Штреккер (1859) Л. Мейер (1864 -1868)
 4) Молекулярная теория, унитарная система, изучение форм соединений химических элементов А. Авогадро (1811 - 1826) Ж. Дюма (1832 -1840) А. Вильямсон (1850 - 1853) Ш. Жерар (1840 -1856) Э. Франкланд (1852)
4) Молекулярная теория, унитарная система, изучение форм соединений химических элементов А. Авогадро (1811 - 1826) Ж. Дюма (1832 -1840) А. Вильямсон (1850 - 1853) Ш. Жерар (1840 -1856) Э. Франкланд (1852)
 1869 год – Периодический закон Д. И. Менделеева Однако начнем с беспорядка, царившего в этот период
1869 год – Периодический закон Д. И. Менделеева Однако начнем с беспорядка, царившего в этот период
 Античные ученые - 10 Алхимики - 4
Античные ученые - 10 Алхимики - 4

 К 1830 году открыто 55 химических элементов Почему элементов столько? Сколько их еще осталось открыть ? Десять ? Сто ? Тысячу ? Бесконечное количество ?
К 1830 году открыто 55 химических элементов Почему элементов столько? Сколько их еще осталось открыть ? Десять ? Сто ? Тысячу ? Бесконечное количество ?
 Иеремия Вениамин Рихтер (1762 -1807) Стремился отыскать математические зависимости в химии «Начала стехиометрии или способ измерения химических элементов» Na Mg K 22, 9 24, 3 39, 09 Na – К = 16 Ca Sr 40, 08 87, 62 Ba 137, 3 Mg – Ca = 16
Иеремия Вениамин Рихтер (1762 -1807) Стремился отыскать математические зависимости в химии «Начала стехиометрии или способ измерения химических элементов» Na Mg K 22, 9 24, 3 39, 09 Na – К = 16 Ca Sr 40, 08 87, 62 Ba 137, 3 Mg – Ca = 16
 Иоганн Вольфганг Дёберейнер (1780 -1849) Случайное совпадение ? Или триады ?
Иоганн Вольфганг Дёберейнер (1780 -1849) Случайное совпадение ? Или триады ?
 P – 31 S – 32 Ca – 41 Li – 7 As – 75 Se – 79 Sr – 88 Na – 23 Sb – 122 Te – 129 Ba – 137 K – 39 Атомный вес среднего элемента триады примерно равен полусумме атомных весов двух крайних элементов…. . Опять совпадение?
P – 31 S – 32 Ca – 41 Li – 7 As – 75 Se – 79 Sr – 88 Na – 23 Sb – 122 Te – 129 Ba – 137 K – 39 Атомный вес среднего элемента триады примерно равен полусумме атомных весов двух крайних элементов…. . Опять совпадение?
 Хотя разбить все известные элементы на триады Дёберейнеру не удалось, тем не менее, закон триад явно указывал на наличие взаимосвязи между атомной массой и свойствами элементов и их соединений. Все дальнейшие попытки систематизации элементов основывались на размещении элементов в соответствии с их атомными массами.
Хотя разбить все известные элементы на триады Дёберейнеру не удалось, тем не менее, закон триад явно указывал на наличие взаимосвязи между атомной массой и свойствами элементов и их соединений. Все дальнейшие попытки систематизации элементов основывались на размещении элементов в соответствии с их атомными массами.
 Леопольд Гмелин (1788 -1853) В 1843 году предложил таблицу химически сходных элементов, расставленных по группам в порядке возрастания «соединительных масс» : Вне групп элементов, вверху таблицы, Гмелин поместил три «базисных» элемента – кислород, азот и водород. Под ними расставлены триады, тетрады и пентады
Леопольд Гмелин (1788 -1853) В 1843 году предложил таблицу химически сходных элементов, расставленных по группам в порядке возрастания «соединительных масс» : Вне групп элементов, вверху таблицы, Гмелин поместил три «базисных» элемента – кислород, азот и водород. Под ними расставлены триады, тетрады и пентады
 Герман Иванович Гесс (1802 -1850) В 1849 году в учебнике «Основания чистой химии» , рассмотрел четыре группы известных тогда элементов-неметаллов, имевших большое сходство в химических свойствах: углерод − бор − кремний азот − фосфор − мышьяк сера − селен − теллур хлор − бром − иод «Эта классификация еще очень далека от того, чтобы быть естественной, но она все-таки соединяет элементы в группы весьма сходные, и с распространением наших сведений она может усовершенствоваться»
Герман Иванович Гесс (1802 -1850) В 1849 году в учебнике «Основания чистой химии» , рассмотрел четыре группы известных тогда элементов-неметаллов, имевших большое сходство в химических свойствах: углерод − бор − кремний азот − фосфор − мышьяк сера − селен − теллур хлор − бром − иод «Эта классификация еще очень далека от того, чтобы быть естественной, но она все-таки соединяет элементы в группы весьма сходные, и с распространением наших сведений она может усовершенствоваться»
 Макс фон Петтенкофер (1818 -1901) Следующим шагом на пути к открытию периодического закона стали дифференциальные системы, направленные на выявление общих закономерностей в изменении атомного веса элементов. В 1850 г. немецкий врач Макс фон Петтенкофер попытался найти у элементов соотношения, подобные тем, что обнаруживаются в гомологических рядах, т. е. в рядах соединений, отличающихся друг от друга группой CH 2. Он указал, что атомные веса некоторых элементов отличаются друг от друга на величину, кратную восьми. На этом основании Петтенкофер высказал предположение, что элементы, возможно, являются сложными образованиями каких-то субэлементарных частиц. На следующий год подобные соображения высказал и французский химик-органик Жан Батист Андрэ Дюма.
Макс фон Петтенкофер (1818 -1901) Следующим шагом на пути к открытию периодического закона стали дифференциальные системы, направленные на выявление общих закономерностей в изменении атомного веса элементов. В 1850 г. немецкий врач Макс фон Петтенкофер попытался найти у элементов соотношения, подобные тем, что обнаруживаются в гомологических рядах, т. е. в рядах соединений, отличающихся друг от друга группой CH 2. Он указал, что атомные веса некоторых элементов отличаются друг от друга на величину, кратную восьми. На этом основании Петтенкофер высказал предположение, что элементы, возможно, являются сложными образованиями каких-то субэлементарных частиц. На следующий год подобные соображения высказал и французский химик-органик Жан Батист Андрэ Дюма.
 Различные варианты дифференциальных систем для описания свойств элементов были предложены: немецким химиком американцем Эрнстом Ленсеном Джосайя Парсонсом Куком (1857) английским химиком Уильямом Одлингом (1858) английским химиком Джоном Холлом Глэдстоном (1859)
Различные варианты дифференциальных систем для описания свойств элементов были предложены: немецким химиком американцем Эрнстом Ленсеном Джосайя Парсонсом Куком (1857) английским химиком Уильямом Одлингом (1858) английским химиком Джоном Холлом Глэдстоном (1859)
 Адольф Штреккер (1822 -1871) В 1859 г. издал работу «Теория и практика определения атомных весов» о наличии у химических элементов соотношений, подобных тем, что обнаруживаются в гомологических рядах органических соединений.
Адольф Штреккер (1822 -1871) В 1859 г. издал работу «Теория и практика определения атомных весов» о наличии у химических элементов соотношений, подобных тем, что обнаруживаются в гомологических рядах органических соединений.
 Александр Эмиль Бегуйе де Шанкуртуа (1820 - 1886) в 1862 г. предложил винтовой график элементов, расположенных в порядке возрастания атомных весов – «земная спираль» (vis tellurique). «Свойства элементов являются функцией чисел» . Выдвинул идею спирального расположения элементов в зависимости от их атомных масс. Он сгруппировал элементы по спирали вокруг цилиндра в порядке возрастания их масс. Оказалось, что через 16 единиц атомной массы появляются близкие по химическим свойствам элементы. В спирали Шанкуртуа они находятся на одной вертикальной линии, образующей цилиндр, на который навертывается эта спираль.
Александр Эмиль Бегуйе де Шанкуртуа (1820 - 1886) в 1862 г. предложил винтовой график элементов, расположенных в порядке возрастания атомных весов – «земная спираль» (vis tellurique). «Свойства элементов являются функцией чисел» . Выдвинул идею спирального расположения элементов в зависимости от их атомных масс. Он сгруппировал элементы по спирали вокруг цилиндра в порядке возрастания их масс. Оказалось, что через 16 единиц атомной массы появляются близкие по химическим свойствам элементы. В спирали Шанкуртуа они находятся на одной вертикальной линии, образующей цилиндр, на который навертывается эта спираль.
 Джон Александр Рейна Ньюлендс (1837 -1898) В начале 1864 г. прочёл анонимную статью, автор которой утверждал, что атомные веса большинства элементов с большей или меньшей точностью кратны восьми. Мнение анонимного автора было ошибочным, однако Ньюлендс решил продолжить исследования в этой области. В конце 1864 г. опубликовал таблицу элементов, отражающую предложенный им «закон октав» . Ньюлендс показал, что в ряду элементов, размещённых в порядке возрастания атомных весов, свойства восьмого элемента сходны со свойствами первого, т. е. идет повторение через семь номеров. Такая зависимость действительно имеет место для лёгких элементов, однако Ньюлендс пытается придать ей всеобщий характер.
Джон Александр Рейна Ньюлендс (1837 -1898) В начале 1864 г. прочёл анонимную статью, автор которой утверждал, что атомные веса большинства элементов с большей или меньшей точностью кратны восьми. Мнение анонимного автора было ошибочным, однако Ньюлендс решил продолжить исследования в этой области. В конце 1864 г. опубликовал таблицу элементов, отражающую предложенный им «закон октав» . Ньюлендс показал, что в ряду элементов, размещённых в порядке возрастания атомных весов, свойства восьмого элемента сходны со свойствами первого, т. е. идет повторение через семь номеров. Такая зависимость действительно имеет место для лёгких элементов, однако Ньюлендс пытается придать ей всеобщий характер.
 В таблице Ньюлендса сходные элементы располагались в горизонтальных рядах; однако, в одном и том же ряду часто оказывались и элементы совершенно непохожие. Кроме того, в некоторых ячейках Ньюлендс вынужден был разместить по два элемента; наконец, таблица Ньюлендса не содержит свободных мест. Вследствие присущих системе Ньюлендса недостатков современники отнеслись к закону октав весьма скептически. Доклад Ньюлендса на заседании Лондонского химического общества был встречен равнодушно, однако в 1887 году руководители Лондонского химического общества присудили Ньюлендсу медаль имени Дэви «за открытие периодического закона» .
В таблице Ньюлендса сходные элементы располагались в горизонтальных рядах; однако, в одном и том же ряду часто оказывались и элементы совершенно непохожие. Кроме того, в некоторых ячейках Ньюлендс вынужден был разместить по два элемента; наконец, таблица Ньюлендса не содержит свободных мест. Вследствие присущих системе Ньюлендса недостатков современники отнеслись к закону октав весьма скептически. Доклад Ньюлендса на заседании Лондонского химического общества был встречен равнодушно, однако в 1887 году руководители Лондонского химического общества присудили Ньюлендсу медаль имени Дэви «за открытие периодического закона» .
 Уильям Одлинг (1821 -1921) Одлинг предпринял несколько попыток систематизировать химические элементы, основываясь на их атомном весе и атомности (валентности), составив в период с 1857 по 1868 г. несколько таблиц элементов. В таблице, предложенной им в 1864 г. (не сопровождавшейся, однако, никакими комментариями), как и в «земной спирали» Шанкуртуа (1862), таблицах Ньюлендса (1864) и Мейера (1864 - 1870), видны, по словам Д. И. Менделеева, «начатки периодического закона» . Таблица Одлинга не была признана химиками, потому что в ней отсутствовали девять важнейших и хорошо изученных элементов – железо Fe, никель Ni, кобальт Co, медь Cu и другие. Одлинг обращал мало внимания на химические свойства простых веществ и поэтому просто не знал, куда поместить эти элементы.
Уильям Одлинг (1821 -1921) Одлинг предпринял несколько попыток систематизировать химические элементы, основываясь на их атомном весе и атомности (валентности), составив в период с 1857 по 1868 г. несколько таблиц элементов. В таблице, предложенной им в 1864 г. (не сопровождавшейся, однако, никакими комментариями), как и в «земной спирали» Шанкуртуа (1862), таблицах Ньюлендса (1864) и Мейера (1864 - 1870), видны, по словам Д. И. Менделеева, «начатки периодического закона» . Таблица Одлинга не была признана химиками, потому что в ней отсутствовали девять важнейших и хорошо изученных элементов – железо Fe, никель Ni, кобальт Co, медь Cu и другие. Одлинг обращал мало внимания на химические свойства простых веществ и поэтому просто не знал, куда поместить эти элементы.
 Юлиус Лотар Мейер (1830 -1895) В 1864 г. опубликовал в книге «Новейшие теории химии и их значение для химической статики» таблицу, в которую были включены 28 элементов, размещённые в шесть столбцов согласно их валентностям. Мейер намеренно ограничил число элементов в этой таблице, чтобы подчеркнуть закономерное изменение атомной массы в рядах подобных элементов
Юлиус Лотар Мейер (1830 -1895) В 1864 г. опубликовал в книге «Новейшие теории химии и их значение для химической статики» таблицу, в которую были включены 28 элементов, размещённые в шесть столбцов согласно их валентностям. Мейер намеренно ограничил число элементов в этой таблице, чтобы подчеркнуть закономерное изменение атомной массы в рядах подобных элементов
 Только в 1870 году после обнародования Д. И. Менделеевым Периодического закона, Мейер опубликовал статью «Природа элементов как функция их атомного веса» , где привел общую схему химических элементов, которая была, по его словам, «в существенном идентична с данной Менделеевым» . Статья содержала иллюстрацию Периодического закона в виде зависимости атомных объемов от атомных весов. Она состояла из девяти вертикальных столбцов, сходные элементы располагались в горизонтальных рядах; некоторые ячейки таблицы Мейер оставил незаполненными. Отвечая на попытки Мейера оспорить приоритет открытия Периодического закона, Менделеев писал: «Лотар Мейер раньше меня не имел в виду периодического закона, а после меня нового ничего к нему не прибавил»
Только в 1870 году после обнародования Д. И. Менделеевым Периодического закона, Мейер опубликовал статью «Природа элементов как функция их атомного веса» , где привел общую схему химических элементов, которая была, по его словам, «в существенном идентична с данной Менделеевым» . Статья содержала иллюстрацию Периодического закона в виде зависимости атомных объемов от атомных весов. Она состояла из девяти вертикальных столбцов, сходные элементы располагались в горизонтальных рядах; некоторые ячейки таблицы Мейер оставил незаполненными. Отвечая на попытки Мейера оспорить приоритет открытия Периодического закона, Менделеев писал: «Лотар Мейер раньше меня не имел в виду периодического закона, а после меня нового ничего к нему не прибавил»
 И наконец…. . Дмитрий Иванович Менделеев (1834 - 1907) В марте 1869 г. представил на заседании Русского химического общество сообщение «Опыт системы элементов, основанный на их атомном весе и химическом сходстве» о соотношении свойств и атомной массы элементов, предварительно разослав его русским и иностранным химикам.
И наконец…. . Дмитрий Иванович Менделеев (1834 - 1907) В марте 1869 г. представил на заседании Русского химического общество сообщение «Опыт системы элементов, основанный на их атомном весе и химическом сходстве» о соотношении свойств и атомной массы элементов, предварительно разослав его русским и иностранным химикам.
 Основные положения сообщения: 1. Элементы, расположенные по возрастанию их атомного веса, представляют явственную периодичность свойств; 2. Сходные по свойствам элементы имеют или близкие атомные веса (Ir, Pt, Os), или последовательно и однообразно увеличивающиеся (K, Rb, Cs); 3. Сопоставление элементов или их групп по величине атомного веса отвечает их т. н. атомности; 4. Элементы с малыми атомными весами имеют наиболее резко выраженные свойства, поэтому они являются типическими элементами; 5. Величина атомного веса определяет характер элемента; 6. Следует ожидать открытия ещё многих неизвестных элементов, например, сходных с Al или Si, с атомной массой 65 -75; 7. Величина атомного веса элемента может быть иногда исправлена, если знать аналоги данного элемента. 8. Некоторые аналоги элементов могут быть открыты по величине массы их атома.
Основные положения сообщения: 1. Элементы, расположенные по возрастанию их атомного веса, представляют явственную периодичность свойств; 2. Сходные по свойствам элементы имеют или близкие атомные веса (Ir, Pt, Os), или последовательно и однообразно увеличивающиеся (K, Rb, Cs); 3. Сопоставление элементов или их групп по величине атомного веса отвечает их т. н. атомности; 4. Элементы с малыми атомными весами имеют наиболее резко выраженные свойства, поэтому они являются типическими элементами; 5. Величина атомного веса определяет характер элемента; 6. Следует ожидать открытия ещё многих неизвестных элементов, например, сходных с Al или Si, с атомной массой 65 -75; 7. Величина атомного веса элемента может быть иногда исправлена, если знать аналоги данного элемента. 8. Некоторые аналоги элементов могут быть открыты по величине массы их атома.
 Вскоре вышло и первое издание учебника «Основы химии» , в котором была приведена первая периодическая таблица Менделеева (1869 г. )
Вскоре вышло и первое издание учебника «Основы химии» , в котором была приведена первая периодическая таблица Менделеева (1869 г. )
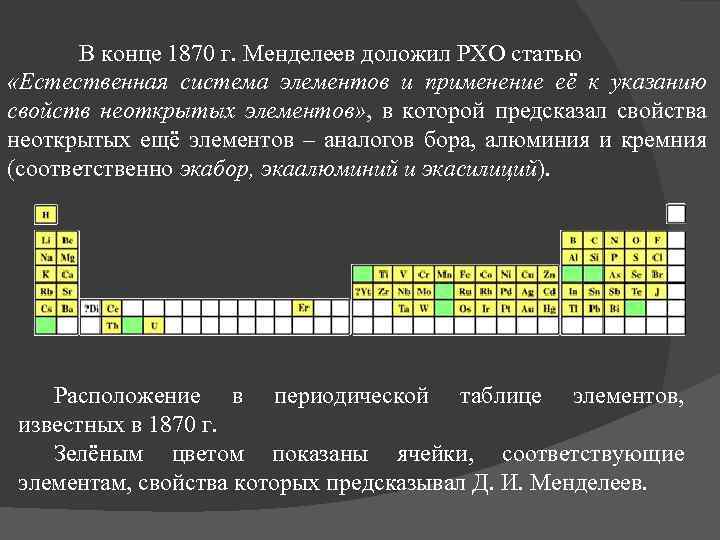 В конце 1870 г. Менделеев доложил РХО статью «Естественная система элементов и применение её к указанию свойств неоткрытых элементов» , в которой предсказал свойства неоткрытых ещё элементов – аналогов бора, алюминия и кремния (соответственно экабор, экаалюминий и экасилиций). Расположение в периодической таблице элементов, известных в 1870 г. Зелёным цветом показаны ячейки, соответствующие элементам, свойства которых предсказывал Д. И. Менделеев.
В конце 1870 г. Менделеев доложил РХО статью «Естественная система элементов и применение её к указанию свойств неоткрытых элементов» , в которой предсказал свойства неоткрытых ещё элементов – аналогов бора, алюминия и кремния (соответственно экабор, экаалюминий и экасилиций). Расположение в периодической таблице элементов, известных в 1870 г. Зелёным цветом показаны ячейки, соответствующие элементам, свойства которых предсказывал Д. И. Менделеев.
 В 1871 г. Менделеев в итоговой статье «Периодическая законность химических элементов» дал формулировку Периодического закона: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомного веса» . Тогда же Менделеев придал своей периодической таблице классический вид.
В 1871 г. Менделеев в итоговой статье «Периодическая законность химических элементов» дал формулировку Периодического закона: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомного веса» . Тогда же Менделеев придал своей периодической таблице классический вид.
 В связи с периодической таблицей химических элементов часто поднимается вопрос о приоритете. В российских источниках подчёркивается определяющая роль Менделеева и отрицается существенный вклад Мейера в создание периодической системы элементов. Большинство зарубежных историков химии считают, что все обсуждаемые выше таблицы можно считать периодическими. Обычно утверждается, что Шанкуртуа, Ньюлендс, Одлинг, Мейер и Менделеев независимо друг от друга пришли к идее периодичности, причём наибольший вклад в развитие идеи внесли Менделеев и Мейер. Следует упомянуть, что Лондонское королевское общество в 1882 г. присудило золотые медали имени Дэви совместно Д. И. Менделееву и Л. Мейеру с формулировкой «За открытие периодических соотношений атомных весов» ; в 1887 г. этой награды был удостоен ещё и Дж. Ньюлендс. При этом роль Менделеева в зарубежной историографии химии подчёркивается: введение термина «периодичность» , формулировка периодического закона и предсказание свойств неоткрытых элементов являются его исключительной заслугой.
В связи с периодической таблицей химических элементов часто поднимается вопрос о приоритете. В российских источниках подчёркивается определяющая роль Менделеева и отрицается существенный вклад Мейера в создание периодической системы элементов. Большинство зарубежных историков химии считают, что все обсуждаемые выше таблицы можно считать периодическими. Обычно утверждается, что Шанкуртуа, Ньюлендс, Одлинг, Мейер и Менделеев независимо друг от друга пришли к идее периодичности, причём наибольший вклад в развитие идеи внесли Менделеев и Мейер. Следует упомянуть, что Лондонское королевское общество в 1882 г. присудило золотые медали имени Дэви совместно Д. И. Менделееву и Л. Мейеру с формулировкой «За открытие периодических соотношений атомных весов» ; в 1887 г. этой награды был удостоен ещё и Дж. Ньюлендс. При этом роль Менделеева в зарубежной историографии химии подчёркивается: введение термина «периодичность» , формулировка периодического закона и предсказание свойств неоткрытых элементов являются его исключительной заслугой.
 Особая заслуга Менделеева состоит в том, что он не просто расположил элементы в определённом порядке, но представил эти закономерности как общий закон природы. На основании предположения, что атомная масса предопределяет свойства элемента, Менделеев взял на себя смелость изменить принятые атомные веса некоторых элементов и подробно описать свойства неоткрытых ещё элементов – прежде всего экабора, экаалюминия и экасилиция. Сам учёный по этому поводу высказался следующим образом: «Утверждение закона возможно только при помощи вывода из него следствий, без него невозможных и не ожидаемых, и оправдание тех следствий в опытной проверке. Потому-то, увидев периодический закон, я со своей стороны вывел из него такие логические следствия, которые могли показать – верен ли он или нет. Без такого способа испытания не может утвердиться ни один закон природы»
Особая заслуга Менделеева состоит в том, что он не просто расположил элементы в определённом порядке, но представил эти закономерности как общий закон природы. На основании предположения, что атомная масса предопределяет свойства элемента, Менделеев взял на себя смелость изменить принятые атомные веса некоторых элементов и подробно описать свойства неоткрытых ещё элементов – прежде всего экабора, экаалюминия и экасилиция. Сам учёный по этому поводу высказался следующим образом: «Утверждение закона возможно только при помощи вывода из него следствий, без него невозможных и не ожидаемых, и оправдание тех следствий в опытной проверке. Потому-то, увидев периодический закон, я со своей стороны вывел из него такие логические следствия, которые могли показать – верен ли он или нет. Без такого способа испытания не может утвердиться ни один закон природы»
 Развитие периодического закона
Развитие периодического закона
 Исправление атомных масс элементов Ве = 14 Ве = 9, 4 (1870 г. ) Богуслав Браунер Ве=9, 1 (1881 г. ) «…. . из найденной плотности следует, что бериллий должен занять место в системе, как это и было Вами указано» Л. Ф. Нильсон U = 120 U = 240 (1870 г. ) Г. Росско, К. Циммерман U = 120 (1881 г. )
Исправление атомных масс элементов Ве = 14 Ве = 9, 4 (1870 г. ) Богуслав Браунер Ве=9, 1 (1881 г. ) «…. . из найденной плотности следует, что бериллий должен занять место в системе, как это и было Вами указано» Л. Ф. Нильсон U = 120 U = 240 (1870 г. ) Г. Росско, К. Циммерман U = 120 (1881 г. )
 В 1871 г. изменил атомную массу индия (вместо 75, 6 принял 113, 6) Атомную массу церия, равную 92, исправил на 138, а затем на 140. Б. Браунер в 1885 году экспериментально установил…. 140, 24! Атомную массу тория изменил в 174 на 231. Иттрия – с 92 на 88. В 1883 году П. Клеве определил атомную массу иттрия – 89! Атомную массу титана принял равной 48, вместо 50. В 1885 году Т. Е. Торп экспериментально установил – титан = 48, 1
В 1871 г. изменил атомную массу индия (вместо 75, 6 принял 113, 6) Атомную массу церия, равную 92, исправил на 138, а затем на 140. Б. Браунер в 1885 году экспериментально установил…. 140, 24! Атомную массу тория изменил в 174 на 231. Иттрия – с 92 на 88. В 1883 году П. Клеве определил атомную массу иттрия – 89! Атомную массу титана принял равной 48, вместо 50. В 1885 году Т. Е. Торп экспериментально установил – титан = 48, 1
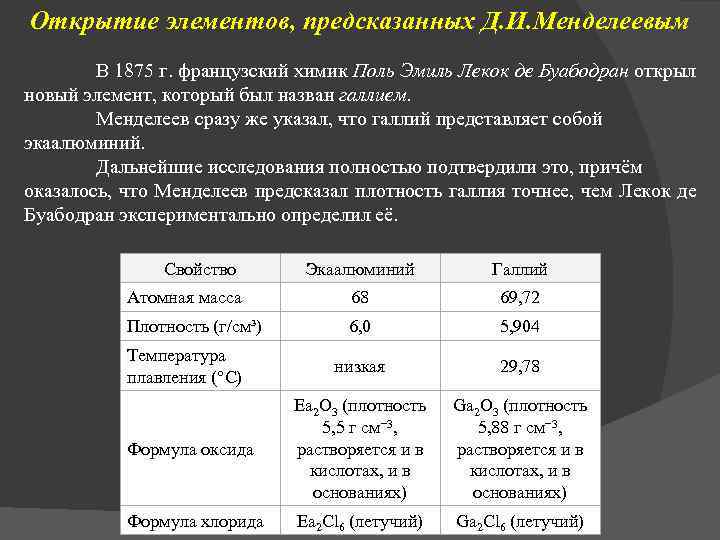 Открытие элементов, предсказанных Д. И. Менделеевым В 1875 г. французский химик Поль Эмиль Лекок де Буабодран открыл новый элемент, который был назван галлием. Менделеев сразу же указал, что галлий представляет собой экаалюминий. Дальнейшие исследования полностью подтвердили это, причём оказалось, что Менделеев предсказал плотность галлия точнее, чем Лекок де Буабодран экспериментально определил её. Свойство Экаалюминий Галлий Атомная масса 68 69, 72 Плотность (г/см³) 6, 0 5, 904 низкая 29, 78 Формула оксида Ea 2 O 3 (плотность 5, 5 г см− 3, растворяется и в кислотах, и в основаниях) Ga 2 O 3 (плотность 5, 88 г см− 3, растворяется и в кислотах, и в основаниях) Формула хлорида Ea 2 Cl 6 (летучий) Ga 2 Cl 6 (летучий) Температура плавления (°C)
Открытие элементов, предсказанных Д. И. Менделеевым В 1875 г. французский химик Поль Эмиль Лекок де Буабодран открыл новый элемент, который был назван галлием. Менделеев сразу же указал, что галлий представляет собой экаалюминий. Дальнейшие исследования полностью подтвердили это, причём оказалось, что Менделеев предсказал плотность галлия точнее, чем Лекок де Буабодран экспериментально определил её. Свойство Экаалюминий Галлий Атомная масса 68 69, 72 Плотность (г/см³) 6, 0 5, 904 низкая 29, 78 Формула оксида Ea 2 O 3 (плотность 5, 5 г см− 3, растворяется и в кислотах, и в основаниях) Ga 2 O 3 (плотность 5, 88 г см− 3, растворяется и в кислотах, и в основаниях) Формула хлорида Ea 2 Cl 6 (летучий) Ga 2 Cl 6 (летучий) Температура плавления (°C)
 В 1870 г. Менделеев предсказывает свойства элемента Eb – экабора с атомной массой 44. Удельная масса этого металла должна быть близка к 3, 0, его оксид - R 2 O 3 должен быть основанием, соли должны быть бесцветны. 12 марта 1879 года Л. Нильсон опубликовал статью «О скандии – новом редком металле» . Исследуя минералы он выделил неизвестную землю, анализ которой привел к открытию нового эле – метна – скандия. Идентичность его с экабором была установлена в августе 1879 года П. Клеве. Он написал Менделееву: «Ваш элемент экабор найден. Это скандий, открытый Нильсоном…. » В статье «Об атомном весе и некоторых характерных солях скандия» (1880 г. ) Нильсон привел следующие данные: атомная масса скандия – 44 формула оксида - Sc 2 O 3 оксид – основной соли – бесцветны. «Следовательно, не остается никакого сомнения, что в скандии открыт экабор» .
В 1870 г. Менделеев предсказывает свойства элемента Eb – экабора с атомной массой 44. Удельная масса этого металла должна быть близка к 3, 0, его оксид - R 2 O 3 должен быть основанием, соли должны быть бесцветны. 12 марта 1879 года Л. Нильсон опубликовал статью «О скандии – новом редком металле» . Исследуя минералы он выделил неизвестную землю, анализ которой привел к открытию нового эле – метна – скандия. Идентичность его с экабором была установлена в августе 1879 года П. Клеве. Он написал Менделееву: «Ваш элемент экабор найден. Это скандий, открытый Нильсоном…. » В статье «Об атомном весе и некоторых характерных солях скандия» (1880 г. ) Нильсон привел следующие данные: атомная масса скандия – 44 формула оксида - Sc 2 O 3 оксид – основной соли – бесцветны. «Следовательно, не остается никакого сомнения, что в скандии открыт экабор» .
 В 1886 г. немецкий химик Клеменс Александр Винклер открыл германий. Исследование свойств нового элемента показало, что он полностью идентичен с экасилицием (причем на тождественность германия и экасилиция первым указал Л. Мейер). Свойство Экасилиций Германий Атомная масса 72 72, 61 Плотность (г/см³) 5, 5 5, 35 высокая 947 серый тугоплавкий диоксид 4, 7 Реакция оксида слабое основание Температура кипения хлорида ниже 100 °C 86 °C 1, 9 Температура плавления (°C) Цвет Тип оксида Плотность оксида (г/см³) Плотность хлорида (г/см³) «Не подлежит больше никакому сомнению, что новый элемент есть не что иное, как предсказанный Менделеевым за 15 лет до этого экасилиций. Едва ли может быть дано более убедительное доказательство справедливости учения о периодичности элементов, чем воплощение бывшего до сих пор гипотетическим экосилиция в реальный германий!»
В 1886 г. немецкий химик Клеменс Александр Винклер открыл германий. Исследование свойств нового элемента показало, что он полностью идентичен с экасилицием (причем на тождественность германия и экасилиция первым указал Л. Мейер). Свойство Экасилиций Германий Атомная масса 72 72, 61 Плотность (г/см³) 5, 5 5, 35 высокая 947 серый тугоплавкий диоксид 4, 7 Реакция оксида слабое основание Температура кипения хлорида ниже 100 °C 86 °C 1, 9 Температура плавления (°C) Цвет Тип оксида Плотность оксида (г/см³) Плотность хлорида (г/см³) «Не подлежит больше никакому сомнению, что новый элемент есть не что иное, как предсказанный Менделеевым за 15 лет до этого экасилиций. Едва ли может быть дано более убедительное доказательство справедливости учения о периодичности элементов, чем воплощение бывшего до сих пор гипотетическим экосилиция в реальный германий!»
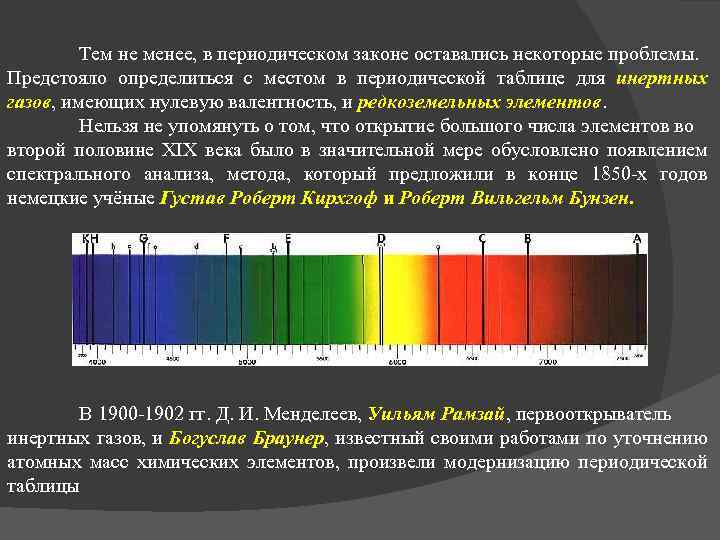 Тем не менее, в периодическом законе оставались некоторые проблемы. Предстояло определиться с местом в периодической таблице для инертных газов, имеющих нулевую валентность, и редкоземельных элементов. Нельзя не упомянуть о том, что открытие большого числа элементов во второй половине XIX века было в значительной мере обусловлено появлением спектрального анализа, метода, который предложили в конце 1850 -х годов немецкие учёные Густав Роберт Кирхгоф и Роберт Вильгельм Бунзен. В 1900 -1902 гг. Д. И. Менделеев, Уильям Рамзай, первооткрыватель инертных газов, и Богуслав Браунер, известный своими работами по уточнению атомных масс химических элементов, произвели модернизацию периодической таблицы
Тем не менее, в периодическом законе оставались некоторые проблемы. Предстояло определиться с местом в периодической таблице для инертных газов, имеющих нулевую валентность, и редкоземельных элементов. Нельзя не упомянуть о том, что открытие большого числа элементов во второй половине XIX века было в значительной мере обусловлено появлением спектрального анализа, метода, который предложили в конце 1850 -х годов немецкие учёные Густав Роберт Кирхгоф и Роберт Вильгельм Бунзен. В 1900 -1902 гг. Д. И. Менделеев, Уильям Рамзай, первооткрыватель инертных газов, и Богуслав Браунер, известный своими работами по уточнению атомных масс химических элементов, произвели модернизацию периодической таблицы
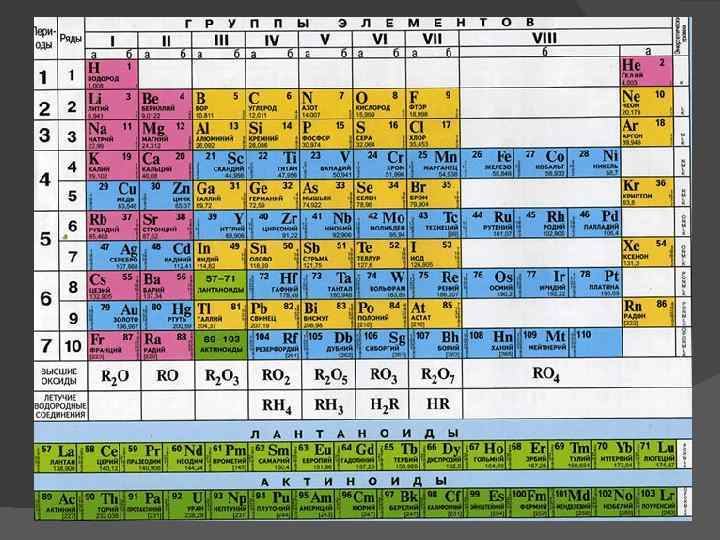
 Одной из последних модификаций является спиральная периодическая таблица Т. Бенфи (1960 г. ). Её отличительная особенность состоит в том, что в ней нашли своё место как d-элементы (переходные металлы), так и f-элементы (лантаноиды и актиноиды), кроме того, оставлены места для еще неоткрытых элементов.
Одной из последних модификаций является спиральная периодическая таблица Т. Бенфи (1960 г. ). Её отличительная особенность состоит в том, что в ней нашли своё место как d-элементы (переходные металлы), так и f-элементы (лантаноиды и актиноиды), кроме того, оставлены места для еще неоткрытых элементов.
 Необычна судьба ученого Николая Александровича Морозова: самоучка, народник, почти 30 лет провел в царских тюрьмах. Внес существенный вклад в астрономию, математику, историю, химию. Находясь в заключении за революционную деятельность в Шлиссельбургской крепости, увлекся исследованиями Периодического закона и Периодической системы Д. И. Менделеева. В частности, он заинтересовался: а не наблюдается ли Периодическая повторяемость свойств среди углеводородов? Морозов создает свою таблицу, состоящую из восьми вертикальных рядов - классов углеводородов, их радикалов и семи горизонтальных рядов Периоды 1 2 3 4 5 Группы(типы) CH 4 CH 3 CH 2 CH C C 2 H 6 C 2 H 5 C 2 H 4 C 2 H 3 C 2 H 2 C 3 H 8 C 3 H 7 C 3 H 6 C 3 H 5 C 3 H 4 C 4 H 10 C 4 H 9 C 4 H 8 C 4 H 7 C 4 H 6 C 11 H 2 n+2 Cn. H 2 n+1 Cn. H 2 n-1 Cn. H 2 n-2 0 1 II IV C 2 H C 3 H 3 C 4 H 5 Cn. H 2 n-3 V C 2 C 3 H 2 C 4 H 4 Cn. H 2 n-4 VI Рассматривая явное сходство своей таблицы и таблицы Д. И. Менделеева, он приходит к неожиданному, исключительно красивому научному прогнозу. Морозову удалось предсказать то, что не удалось сделать самому автору Периодического закона. Он обратил внимание на то, что во всех группах его таблицы, за исключением нулевой, находятся химически активные вещества.
Необычна судьба ученого Николая Александровича Морозова: самоучка, народник, почти 30 лет провел в царских тюрьмах. Внес существенный вклад в астрономию, математику, историю, химию. Находясь в заключении за революционную деятельность в Шлиссельбургской крепости, увлекся исследованиями Периодического закона и Периодической системы Д. И. Менделеева. В частности, он заинтересовался: а не наблюдается ли Периодическая повторяемость свойств среди углеводородов? Морозов создает свою таблицу, состоящую из восьми вертикальных рядов - классов углеводородов, их радикалов и семи горизонтальных рядов Периоды 1 2 3 4 5 Группы(типы) CH 4 CH 3 CH 2 CH C C 2 H 6 C 2 H 5 C 2 H 4 C 2 H 3 C 2 H 2 C 3 H 8 C 3 H 7 C 3 H 6 C 3 H 5 C 3 H 4 C 4 H 10 C 4 H 9 C 4 H 8 C 4 H 7 C 4 H 6 C 11 H 2 n+2 Cn. H 2 n+1 Cn. H 2 n-1 Cn. H 2 n-2 0 1 II IV C 2 H C 3 H 3 C 4 H 5 Cn. H 2 n-3 V C 2 C 3 H 2 C 4 H 4 Cn. H 2 n-4 VI Рассматривая явное сходство своей таблицы и таблицы Д. И. Менделеева, он приходит к неожиданному, исключительно красивому научному прогнозу. Морозову удалось предсказать то, что не удалось сделать самому автору Периодического закона. Он обратил внимание на то, что во всех группах его таблицы, за исключением нулевой, находятся химически активные вещества.
 «Каждая гениальная работа характеризуется двумя чертами: в ней говорится о большем, чем известно в данное время, она может плодотворно развиваться в направлениях, которые нельзя было предвидеть. По обоим этим признакам периодическая система является работой гения» . Чарльз Коулсон английский химик - теоретик
«Каждая гениальная работа характеризуется двумя чертами: в ней говорится о большем, чем известно в данное время, она может плодотворно развиваться в направлениях, которые нельзя было предвидеть. По обоим этим признакам периодическая система является работой гения» . Чарльз Коулсон английский химик - теоретик


