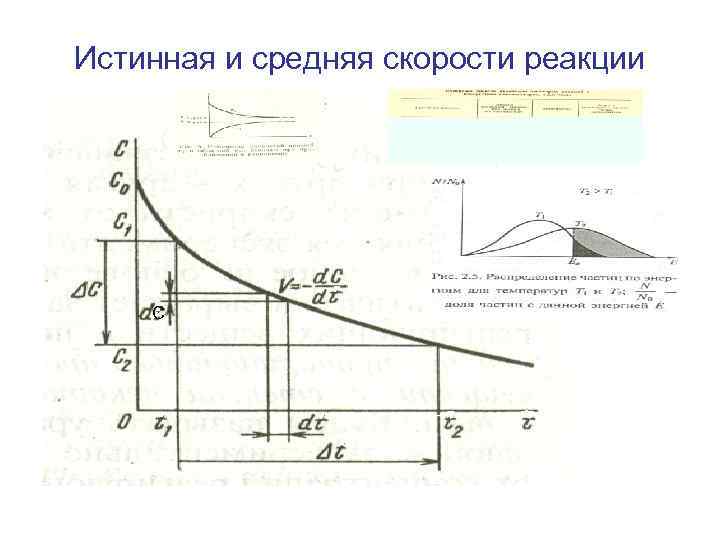
 Истинная и средняя скорости реакции С
Истинная и средняя скорости реакции С
 Варианты столкновений молекул А А А А В В А А В В В В Благоприятная (а) и неблагоприятные (б, в) ориентации молекул при столкновении
Варианты столкновений молекул А А А А В В А А В В В В Благоприятная (а) и неблагоприятные (б, в) ориентации молекул при столкновении
 Этапы химической реакции
Этапы химической реакции
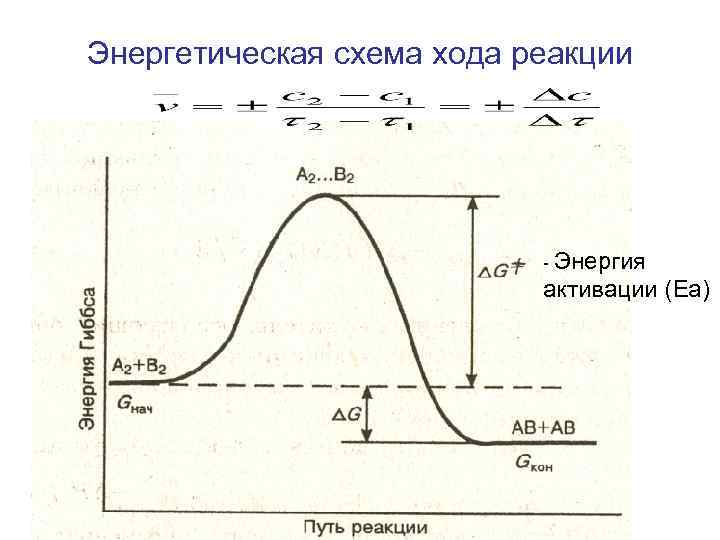 Энергетическая схема хода реакции - Энергия активации (Еа)
Энергетическая схема хода реакции - Энергия активации (Еа)
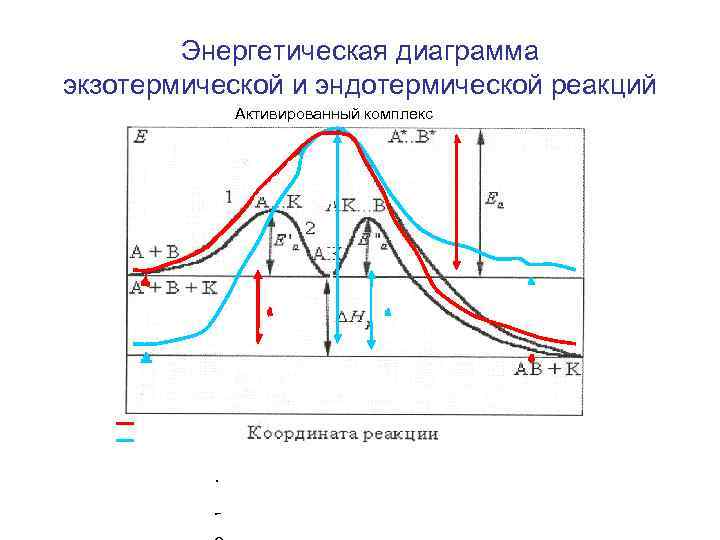 Энергетическая диаграмма экзотермической и эндотермической реакций Активированный комплекс Р и с у н о к 5 . 4 . Р
Энергетическая диаграмма экзотермической и эндотермической реакций Активированный комплекс Р и с у н о к 5 . 4 . Р
 Зависимость скорости реакции от природы вещества • CH 2(ONO 2)- CH 2(ONO 2) = 2 CO 2 + 2 H 2 O + N 2 Динитроэтиленгликоль Еа < 40 к. Дж/моль, реакция протекает мгновенно в р-рах и при взрывах. • К 2 О ∙Al 2 O 3 ∙ 6 Si. O 2 + CO 2 + 2 H 2 O = П о л е в о й ш п а т = K 2 CO 3 + 4 Si. O 2 + Al 2 O 3 ∙ 2 Si. O 2 ∙ 2 H 2 O к а о л и н и т Еа > 120 к. Дж/моль, реакция длится столетия. • H 2 SO 4 + Na 2 S 2 O 3 = Na 2 SO 4 + SO 2 + H 2 O Еа = 40 -/- 120 к. Дж/моль, р-ция протекает с измеримой скоростью.
Зависимость скорости реакции от природы вещества • CH 2(ONO 2)- CH 2(ONO 2) = 2 CO 2 + 2 H 2 O + N 2 Динитроэтиленгликоль Еа < 40 к. Дж/моль, реакция протекает мгновенно в р-рах и при взрывах. • К 2 О ∙Al 2 O 3 ∙ 6 Si. O 2 + CO 2 + 2 H 2 O = П о л е в о й ш п а т = K 2 CO 3 + 4 Si. O 2 + Al 2 O 3 ∙ 2 Si. O 2 ∙ 2 H 2 O к а о л и н и т Еа > 120 к. Дж/моль, реакция длится столетия. • H 2 SO 4 + Na 2 S 2 O 3 = Na 2 SO 4 + SO 2 + H 2 O Еа = 40 -/- 120 к. Дж/моль, р-ция протекает с измеримой скоростью.
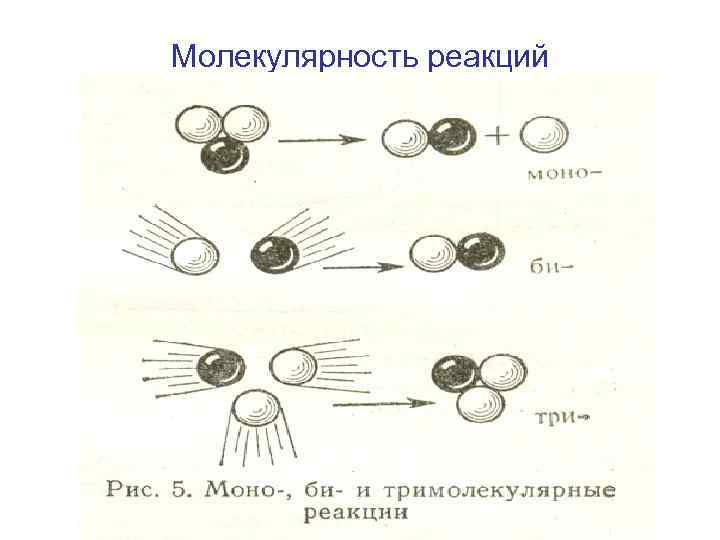 Молекулярность реакций
Молекулярность реакций
 Кинетические уравнения реакций различных типов
Кинетические уравнения реакций различных типов
 Распределение частиц по энергиям для температур Т 1 и Т 2 N/N 0 – доля частиц с данной энергией Е
Распределение частиц по энергиям для температур Т 1 и Т 2 N/N 0 – доля частиц с данной энергией Е
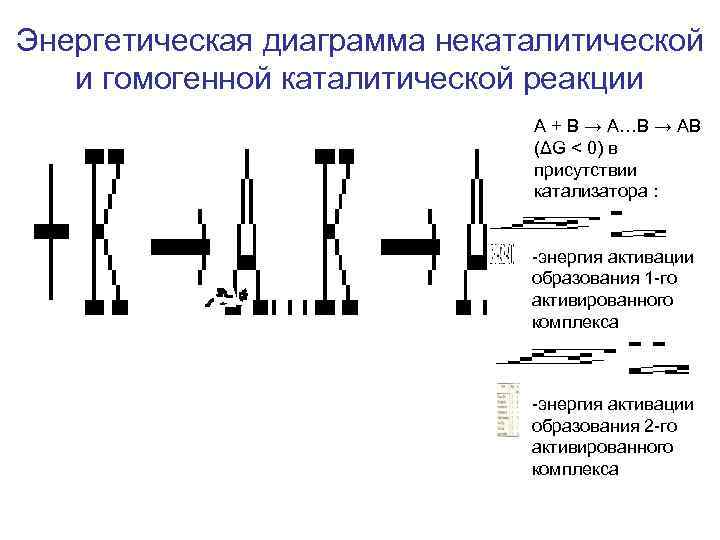 Энергетическая диаграмма некаталитической и гомогенной каталитической реакции A + B → А…B → AB (ΔG < 0) в присутствии катализатора : -энергия активации образования 1 -го активированного комплекса -энергия активации образования 2 -го активированного комплекса
Энергетическая диаграмма некаталитической и гомогенной каталитической реакции A + B → А…B → AB (ΔG < 0) в присутствии катализатора : -энергия активации образования 1 -го активированного комплекса -энергия активации образования 2 -го активированного комплекса
 Изменение Еа некоторых реакций в присутствии катализаторов, к. Дж/моль
Изменение Еа некоторых реакций в присутствии катализаторов, к. Дж/моль
 Скорость прямой и обратной реакций
Скорость прямой и обратной реакций
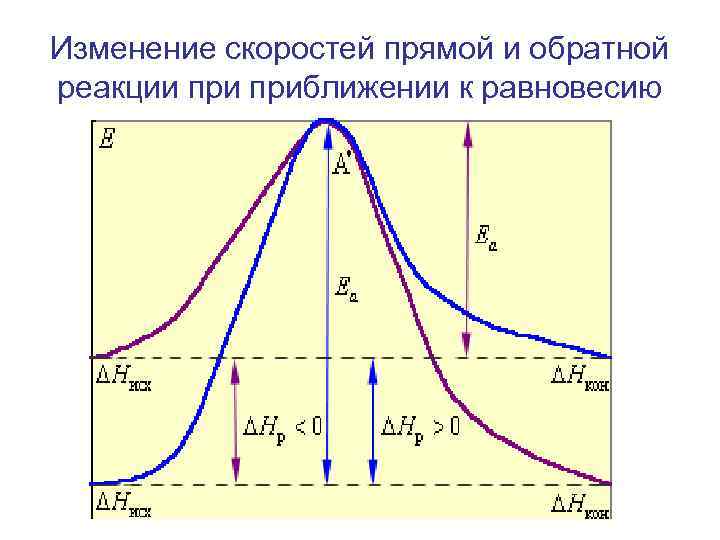 Изменение скоростей прямой и обратной реакции приближении к равновесию
Изменение скоростей прямой и обратной реакции приближении к равновесию
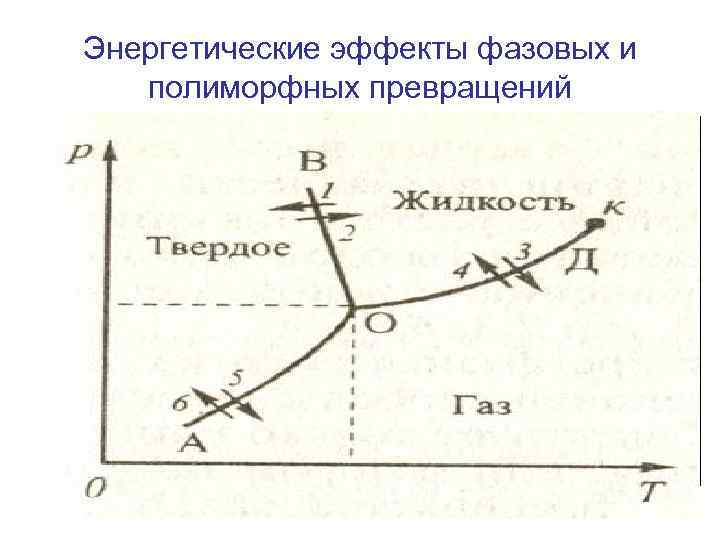 Энергетические эффекты фазовых и полиморфных превращений
Энергетические эффекты фазовых и полиморфных превращений
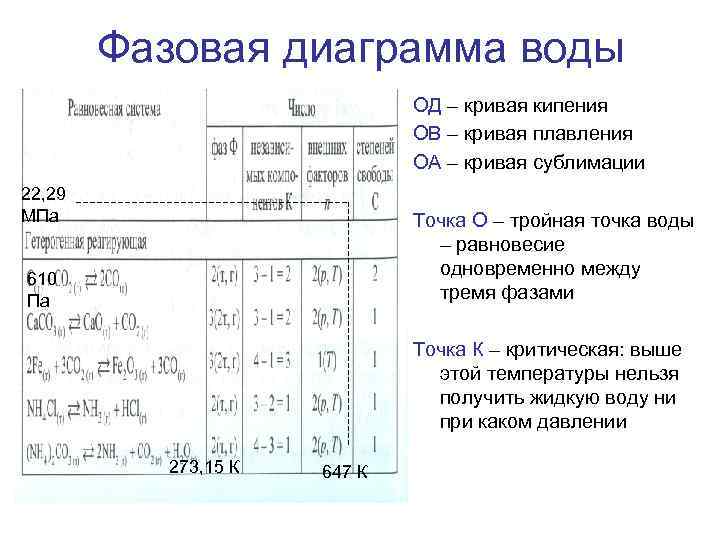 Фазовая диаграмма воды ОД – кривая кипения ОВ – кривая плавления ОА – кривая сублимации 22, 29 МПа Точка О – тройная точка воды – равновесие одновременно между тремя фазами 610 Па Точка К – критическая: выше этой температуры нельзя получить жидкую воду ни при каком давлении 273, 15 К 647 К
Фазовая диаграмма воды ОД – кривая кипения ОВ – кривая плавления ОА – кривая сублимации 22, 29 МПа Точка О – тройная точка воды – равновесие одновременно между тремя фазами 610 Па Точка К – критическая: выше этой температуры нельзя получить жидкую воду ни при каком давлении 273, 15 К 647 К
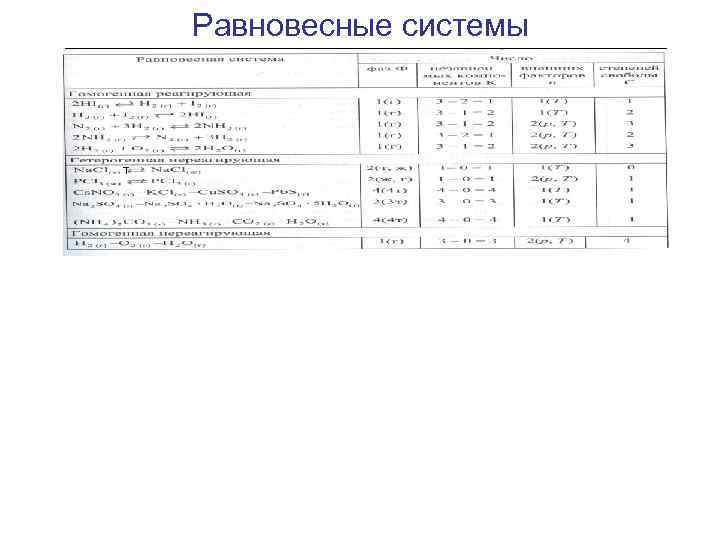 Равновесные системы т
Равновесные системы т