водородная связь.ppt
- Количество слайдов: 8

Исследовательская работа на тему: Водородная связь Работу выполнил: Гаврилов Дмитрий и Скобелева Наталья Руководитель: Тухта Валентина Анатольевна «Муниципальное общеобразовательное учреждение Вышневолоцкого района «Есеновичская средняя общеобразовательная школа»

ВОДОРОДНАЯ СВЯЗЬ § (Н-связь) – особый тип взаимодействия между реакционно-способными группами, при этом одна из групп содержит атом водорода, склонный к такому взаимодействию. Водородная связь – глобальное явление, охватывающее всю химию. В отличие от обычных химических связей, Н-связь появляется не в результате целенаправленного синтеза, а возникает в подходящих условиях сама и проявляется в виде межмолекулярных или внутримолекулярных взаимодействий

Особенности водородной связи § Отличительная черта водородной связи – сравнительно низкая прочность, ее энергия в 5– 10 раз ниже, чем энергия химической связи. По энергии она занимает промежуточное положение между химическими связями и Ван-дерваальсовыми взаимодействиями, теми, что удерживают молекулы в твердой или жидкой фазе.

Образование Н-связи § В образовании Н-связи определяющую роль играет электроотрицательность участвующих в связи атомов – способность оттягивать на себя электроны химической связи от атома – партнера, участвующего в этой связи. В результате на атоме А с повышенной электроотрицательностью возникает частичный отрицательный заряд d- , а на атоме-партнере – положительный d+, химическая связь при этом поляризуется: Аd-–Нd+.

Образование Н-связи § Возникший частичный положительный заряд на атоме водорода позволяет ему притягивать другую молекулу, также содержащую электроотрицательный элемент, таким образом, основную долю в образование Н-связи вносят электростатические взаимодействия

Формирование Н-связи § В формировании Н-связи участвуют три атома, два электроотрицательных (А и Б) и находящийся между ними атом водорода Н, структура такой связи может быть представлена следующим образом: Б···Нd+–Аd- (водородную связь обычно обозначают точечной линией). Атом А, химически связанный с Н, называют донором протона (лат. donare – дарить, жертвовать), а Б – его акцептором (лат. acceptor – приемщик). Чаще всего истинного «донорства» нет, и Н остается химически связанным с А. § Атомов – доноров А, поставляющих Н для образования Нсвязей, не много, практически всего три: N, O и F, в то же время набор атомов-акцепторов Б весьма широк.
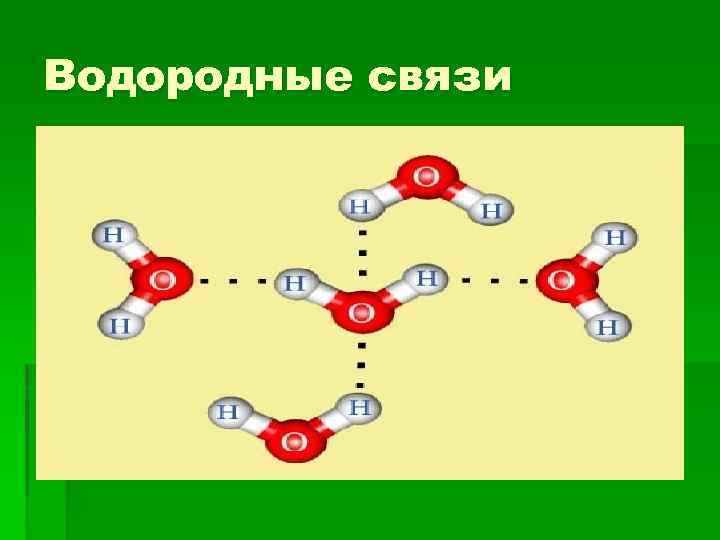
Водородные связи

Используемая литература § Пиментел Дж. , О. Мак-Клеллан. Водородная связь, пер. с англ. , М. , 1964 Эпштейн Л. М, Шубина Е. С. Многоликая водородная связь. «Природа» , 2003, № 1
водородная связь.ppt