биофизика 003-004.ppt
- Количество слайдов: 24
 Исследования с помощью калориметра показали среднюю величину физиологически доступной энергии, которая содержится в 1 грамме трех пищевых продуктов (в килокалориях): • углеводы - 4, 1; • белки - 4, 1; • жиры - 9, 3. Калория (от лат. calor - тепло), внесистемная единица количества теплоты. 1 кал = 4, 1868 дж Количество энергии, поглощенной за сутки животным организмом вместе с питательными веществами, равно выделенной за это же время теплоте. Сами по себе организмы не являются независимым источником какой либо новой формы энергии.
Исследования с помощью калориметра показали среднюю величину физиологически доступной энергии, которая содержится в 1 грамме трех пищевых продуктов (в килокалориях): • углеводы - 4, 1; • белки - 4, 1; • жиры - 9, 3. Калория (от лат. calor - тепло), внесистемная единица количества теплоты. 1 кал = 4, 1868 дж Количество энергии, поглощенной за сутки животным организмом вместе с питательными веществами, равно выделенной за это же время теплоте. Сами по себе организмы не являются независимым источником какой либо новой формы энергии.
 Виды теплоты Теплопродукция У гомойотермных животных в покое: 50% всей теплоты образуется в органах брюшной полости, 20% - в скелетных мышцах, 10% - при работе органов дыхания и кровообращения. Первичная теплота - это результат неизбежного рассеивания энергии в ходе реакций диссимиляции из-за необратимо протекающих биохимических реакций. Первичная теплота выделяется сразу же после поглощения организмом кислорода и продуктов питания независимо от того, совершает он работу или нет. Она идет на нагревание организма и рассеивается в окружающем пространстве. Выделение вторичной теплоты наблюдается лишь при реализации энергии макроэргических соединений (АТФ, ГТФ). Идет на совершение полезной работы.
Виды теплоты Теплопродукция У гомойотермных животных в покое: 50% всей теплоты образуется в органах брюшной полости, 20% - в скелетных мышцах, 10% - при работе органов дыхания и кровообращения. Первичная теплота - это результат неизбежного рассеивания энергии в ходе реакций диссимиляции из-за необратимо протекающих биохимических реакций. Первичная теплота выделяется сразу же после поглощения организмом кислорода и продуктов питания независимо от того, совершает он работу или нет. Она идет на нагревание организма и рассеивается в окружающем пространстве. Выделение вторичной теплоты наблюдается лишь при реализации энергии макроэргических соединений (АТФ, ГТФ). Идет на совершение полезной работы.
 Удельная теплопродукция – это количество теплоты, выделяемое единицей массы животного в единицу времени: q=Q /μ, T T , где : QT - количество теплоты, выделенное в единицу времени, μT - единица массы, q - удельная теплопродукция. Теплопродукция пропорциональна массе животного : q = a + b/M 2/3 , где : а – количество клеток, b – площадь поверхности, М – масса тела животного.
Удельная теплопродукция – это количество теплоты, выделяемое единицей массы животного в единицу времени: q=Q /μ, T T , где : QT - количество теплоты, выделенное в единицу времени, μT - единица массы, q - удельная теплопродукция. Теплопродукция пропорциональна массе животного : q = a + b/M 2/3 , где : а – количество клеток, b – площадь поверхности, М – масса тела животного.
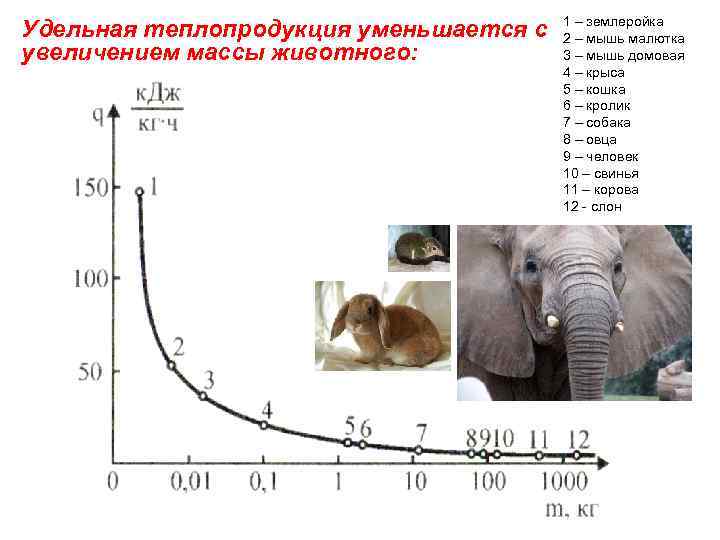 Удельная теплопродукция уменьшается с увеличением массы животного: 1 – землеройка 2 – мышь малютка 3 – мышь домовая 4 – крыса 5 – кошка 6 – кролик 7 – собака 8 – овца 9 – человек 10 – свинья 11 – корова 12 - слон
Удельная теплопродукция уменьшается с увеличением массы животного: 1 – землеройка 2 – мышь малютка 3 – мышь домовая 4 – крыса 5 – кошка 6 – кролик 7 – собака 8 – овца 9 – человек 10 – свинья 11 – корова 12 - слон
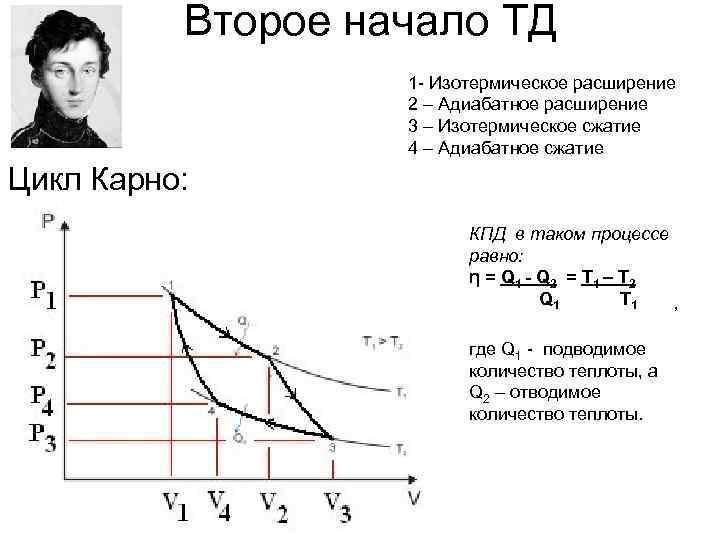 Второе начало ТД 1 - Изотермическое расширение 2 – Адиабатное расширение 3 – Изотермическое сжатие 4 – Адиабатное сжатие Цикл Карно: КПД в таком процессе равно: η = Q 1 - Q 2 = Т 1 – Т 2 Q 1 Т 1 , где Q 1 - подводимое количество теплоты, а Q 2 – отводимое количество теплоты.
Второе начало ТД 1 - Изотермическое расширение 2 – Адиабатное расширение 3 – Изотермическое сжатие 4 – Адиабатное сжатие Цикл Карно: КПД в таком процессе равно: η = Q 1 - Q 2 = Т 1 – Т 2 Q 1 Т 1 , где Q 1 - подводимое количество теплоты, а Q 2 – отводимое количество теплоты.
 Идеальный цикл Карно, удовлетворял требованию наивысшего коэффициента полезного действия, который зависит не от природы рабочего тела, совершающего круговой процесс, а только от температур нагревателя (Т 1) и холодильника (Т 2): η max = Т 1 – Т 2 Т 1 Все процессы в цикле Карно должны протекать квазистатически (обратимо!)
Идеальный цикл Карно, удовлетворял требованию наивысшего коэффициента полезного действия, который зависит не от природы рабочего тела, совершающего круговой процесс, а только от температур нагревателя (Т 1) и холодильника (Т 2): η max = Т 1 – Т 2 Т 1 Все процессы в цикле Карно должны протекать квазистатически (обратимо!)
 Клаузиус сформулировал положение «Теплота сама собой не может переходить от тела холодного к телу горячему» . Клаузиус ввел понятие энтропии в термодинамику. Если воспользоваться соотношением КПД идеальной машины Карно и любой другой, в которой процессы протекают необратимо: Q 1 - Q 2 ≤ Т 1 – Т 2 , откуда следует Q 2 - Q 1 ≥ 0 Q 1 Т 2 Т 1 Знак равенства имеет место только для обратимых процессов! Клаузиус: соотношение Q/Т (теплота / температура) есть функция состояния, S – энтропия S = Q/Т
Клаузиус сформулировал положение «Теплота сама собой не может переходить от тела холодного к телу горячему» . Клаузиус ввел понятие энтропии в термодинамику. Если воспользоваться соотношением КПД идеальной машины Карно и любой другой, в которой процессы протекают необратимо: Q 1 - Q 2 ≤ Т 1 – Т 2 , откуда следует Q 2 - Q 1 ≥ 0 Q 1 Т 2 Т 1 Знак равенства имеет место только для обратимых процессов! Клаузиус: соотношение Q/Т (теплота / температура) есть функция состояния, S – энтропия S = Q/Т
 • Возможное направление термодинамических процессов является предметом второго закона термодинамики Невозможность создания вечного двигателя. Все реальные процессы, сопровождаются рассеянием некоторой части энергии в теплоту. Теплота - деградированная форма энергии. Различные виды энергии делят на 3 класса: А, В, С.
• Возможное направление термодинамических процессов является предметом второго закона термодинамики Невозможность создания вечного двигателя. Все реальные процессы, сопровождаются рассеянием некоторой части энергии в теплоту. Теплота - деградированная форма энергии. Различные виды энергии делят на 3 класса: А, В, С.
 Свойства энтропии Ед. изм. : Дж/моль▪К Экстенсивный параметр ТД системы di. S – часть энтропии, обусловленная изменениями внутри системы de. S - поток энтропии, обусловленный взаимодействием с окружающей средой d. S = di. S + de. S
Свойства энтропии Ед. изм. : Дж/моль▪К Экстенсивный параметр ТД системы di. S – часть энтропии, обусловленная изменениями внутри системы de. S - поток энтропии, обусловленный взаимодействием с окружающей средой d. S = di. S + de. S
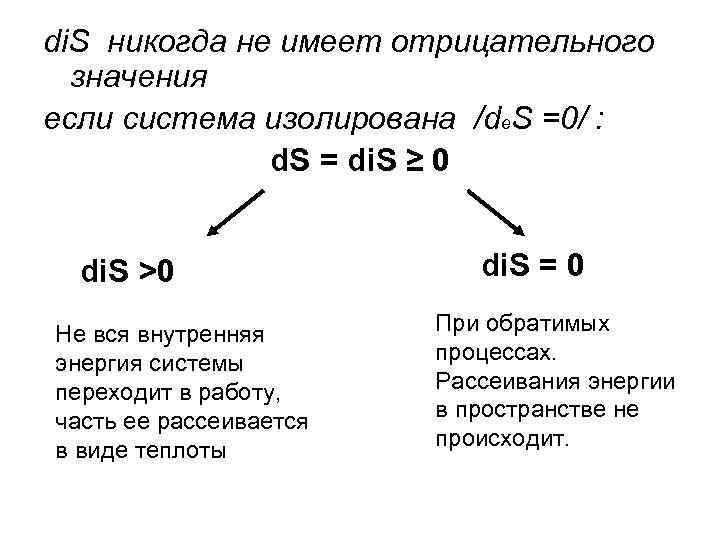 di. S никогда не имеет отрицательного значения если система изолирована /de. S =0/ : d. S = di. S ≥ 0 di. S >0 Не вся внутренняя энергия системы переходит в работу, часть ее рассеивается в виде теплоты di. S = 0 При обратимых процессах. Рассеивания энергии в пространстве не происходит.
di. S никогда не имеет отрицательного значения если система изолирована /de. S =0/ : d. S = di. S ≥ 0 di. S >0 Не вся внутренняя энергия системы переходит в работу, часть ее рассеивается в виде теплоты di. S = 0 При обратимых процессах. Рассеивания энергии в пространстве не происходит.
 для закрытых и открытых систем d e. S ≠ 0 Знак de. S зависит от конкретной ситуации пример : вариант стационарного неравновесного состояния неизолированной системы == В стационарном состоянии ТД величины постоянны во времени = de. S = - di. S < 0 di. S всегда положительна de. S – отрицательна отток энтропии в окружающую среду приток отрицательной энтропии в систему d. S = 0
для закрытых и открытых систем d e. S ≠ 0 Знак de. S зависит от конкретной ситуации пример : вариант стационарного неравновесного состояния неизолированной системы == В стационарном состоянии ТД величины постоянны во времени = de. S = - di. S < 0 di. S всегда положительна de. S – отрицательна отток энтропии в окружающую среду приток отрицательной энтропии в систему d. S = 0
 Изоляция системы Равновесное состояние Энтропия достигает максимального значения. Энтропия возрастает во всех реальных термодинамических процессах Неравенство d. S≥ 0 выражает второе начало ТД Всякое уменьшение энтропии требует участия внешних сил Энтропия внешней системы (взаимодействующей) будет возрастать! Возрастание энтропии самопроизвольно и необратимо
Изоляция системы Равновесное состояние Энтропия достигает максимального значения. Энтропия возрастает во всех реальных термодинамических процессах Неравенство d. S≥ 0 выражает второе начало ТД Всякое уменьшение энтропии требует участия внешних сил Энтропия внешней системы (взаимодействующей) будет возрастать! Возрастание энтропии самопроизвольно и необратимо
 Статистический смысл энтропии Принцип Больцмана: энтропия системы S в данном состоянии пропорциональна термодинамической вероятности W этого состояния: S = k ln W k – константа (постоянная) Больцмана =1, 38*10 -23 Дж/К W – термодинамическая вероятность, число всех возможных перегруппировок частиц, составляющих данное состояние системы.
Статистический смысл энтропии Принцип Больцмана: энтропия системы S в данном состоянии пропорциональна термодинамической вероятности W этого состояния: S = k ln W k – константа (постоянная) Больцмана =1, 38*10 -23 Дж/К W – термодинамическая вероятность, число всех возможных перегруппировок частиц, составляющих данное состояние системы.
 Термодинамическая вероятность является числом микросостояний системы, посредством которых реализуется данное макросостояние системы. Чем больше возможно микросостояний (вариантов расположения частиц), тем более неупорядочена система, тем больше - величины W и S.
Термодинамическая вероятность является числом микросостояний системы, посредством которых реализуется данное макросостояние системы. Чем больше возможно микросостояний (вариантов расположения частиц), тем более неупорядочена система, тем больше - величины W и S.
 Молекулы стремятся перейти из менее вероятного высокоупорядоченного состояния в статистически более вероятные состояния, характеризующиеся беспорядочным расположением молекул. Каждая система характеризуется тенденцией самопроизвольного перехода к состоянию максимального молекулярного беспорядка или хаоса.
Молекулы стремятся перейти из менее вероятного высокоупорядоченного состояния в статистически более вероятные состояния, характеризующиеся беспорядочным расположением молекул. Каждая система характеризуется тенденцией самопроизвольного перехода к состоянию максимального молекулярного беспорядка или хаоса.
 • Внешнее воздействие, переводящее систему из более вероятного состояния в менее вероятное, всегда создает некоторый порядок, который самопроизвольно исчезает , когда воздействие прекращается. Система стремится к разупорядоченному состоянию. Энтропию называют мерой разупорядоченности (хаоса) системы. • Порядок, создаваемый внешним воздействием, следует понимать в самом широком смысле. Это может быть создание градиентов интенсивных (силовых) параметров системы. Это может быть определенное упорядоченние или организация элементов системы в пространстве и связей между ними. Это может быть и временная организация процессов, протекающих в системах. В статистическом смысле энтропия характеризует не только рассеяние энергии, но и потерю пространственно-временной структурированности.
• Внешнее воздействие, переводящее систему из более вероятного состояния в менее вероятное, всегда создает некоторый порядок, который самопроизвольно исчезает , когда воздействие прекращается. Система стремится к разупорядоченному состоянию. Энтропию называют мерой разупорядоченности (хаоса) системы. • Порядок, создаваемый внешним воздействием, следует понимать в самом широком смысле. Это может быть создание градиентов интенсивных (силовых) параметров системы. Это может быть определенное упорядоченние или организация элементов системы в пространстве и связей между ними. Это может быть и временная организация процессов, протекающих в системах. В статистическом смысле энтропия характеризует не только рассеяние энергии, но и потерю пространственно-временной структурированности.
 Второе начало ТД для открытых систем • de. S/dt ˃ 0 показывает увеличение энтропии системы в результате того, что в организм постоянно поступает поток вещества и энергии. • de. S/dt ˂ 0 означает, что отток энтропии из организма превышает ее приток. • Величина di. S/dt , обусловленная процессами происходящими внутри организма, и выделением теплоты в окружающую среду , может принимать любое положительное значение.
Второе начало ТД для открытых систем • de. S/dt ˃ 0 показывает увеличение энтропии системы в результате того, что в организм постоянно поступает поток вещества и энергии. • de. S/dt ˂ 0 означает, что отток энтропии из организма превышает ее приток. • Величина di. S/dt , обусловленная процессами происходящими внутри организма, и выделением теплоты в окружающую среду , может принимать любое положительное значение.
 При условии, что di. S/dt ˃ 0 , возможны следующие три случая: 1. d. S/dt ˃ 0 1. 1. de. S/dt ˃ 0 1. 2. de. S/dt ˂ 0, но di. S/dt ˃ de. S/dt скорость производства энтропии внутри организма будет превышать скорость обмена энтропией с окружающей средой
При условии, что di. S/dt ˃ 0 , возможны следующие три случая: 1. d. S/dt ˃ 0 1. 1. de. S/dt ˃ 0 1. 2. de. S/dt ˂ 0, но di. S/dt ˃ de. S/dt скорость производства энтропии внутри организма будет превышать скорость обмена энтропией с окружающей средой
 2. d. S/dt ˂ 0 de. S/dt ˃ di. S/dt Общее изменение энтропии в системе становится отрицательным, т. е. скорость обмена энтропией с окружающей средой превышает скорость производства энтропии внутри организма. Отток из организма положительной энтропии или приток из окружающей среды отрицательной энтропии. Только при ЭТОМ условии обмена энтропией с внешней средой возможно существование и усложнение живых организмов в процессе эволюции.
2. d. S/dt ˂ 0 de. S/dt ˃ di. S/dt Общее изменение энтропии в системе становится отрицательным, т. е. скорость обмена энтропией с окружающей средой превышает скорость производства энтропии внутри организма. Отток из организма положительной энтропии или приток из окружающей среды отрицательной энтропии. Только при ЭТОМ условии обмена энтропией с внешней средой возможно существование и усложнение живых организмов в процессе эволюции.
 3. d. S/dt = 0 de. S/dt ˂ 0 скорость обмена энтропией с окружающей средой равна скорости производства энтропии за счет внутренних биофизических и биохимических процессов. Установление в системе стационарного состояния. Увеличение энтропии системы за счет происходящих в ней необратимых процессов компенсируется притоком отрицательной энтропии при взаимодействии системы с внешней средой.
3. d. S/dt = 0 de. S/dt ˂ 0 скорость обмена энтропией с окружающей средой равна скорости производства энтропии за счет внутренних биофизических и биохимических процессов. Установление в системе стационарного состояния. Увеличение энтропии системы за счет происходящих в ней необратимых процессов компенсируется притоком отрицательной энтропии при взаимодействии системы с внешней средой.
 Баланс энтропии при росте и развитии организмов В процессе роста и развития организмов происходит уменьшение скорости продуцирования энтропии, отнесенной к единице массы объекта d. S = di. S + de. S < 0
Баланс энтропии при росте и развитии организмов В процессе роста и развития организмов происходит уменьшение скорости продуцирования энтропии, отнесенной к единице массы объекта d. S = di. S + de. S < 0
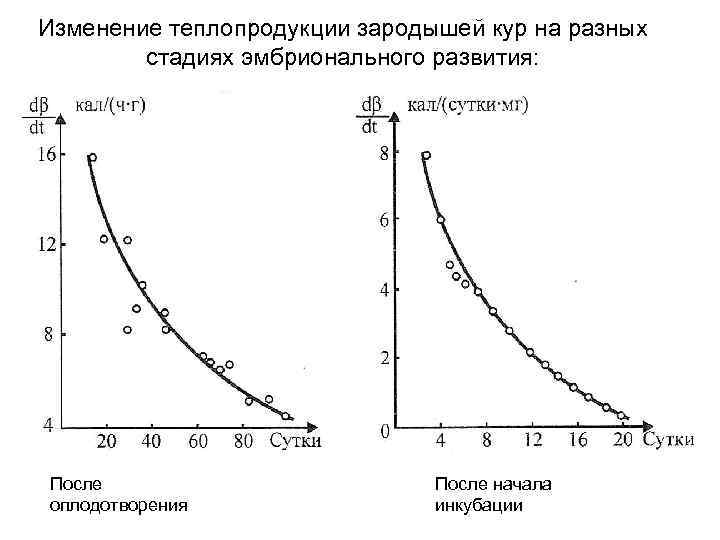 Изменение теплопродукции зародышей кур на разных стадиях эмбрионального развития: После оплодотворения После начала инкубации
Изменение теплопродукции зародышей кур на разных стадиях эмбрионального развития: После оплодотворения После начала инкубации
 Уменьшение скорости теплопродукции (dβ/dt) = уменьшение скорости продуцирования энтропии (d. S/dt) В процессе развития и роста организмов скорость продуцирования энтропии непрерывно снижается и достигает минимальных значений в конечном стационарном состоянии. Благодаря более интенсивным процессам обмена веществ отток энтропии превышает ее продукцию: de. S/dt ˃ di. S/dt
Уменьшение скорости теплопродукции (dβ/dt) = уменьшение скорости продуцирования энтропии (d. S/dt) В процессе развития и роста организмов скорость продуцирования энтропии непрерывно снижается и достигает минимальных значений в конечном стационарном состоянии. Благодаря более интенсивным процессам обмена веществ отток энтропии превышает ее продукцию: de. S/dt ˃ di. S/dt
 Старение сопровождается возрастанием энтропии! d. S = di. S + de. S > 0 di. S/dt > de. S/dt Энтропия достигает максимального значения при термодинамическом равновесии. Жизнь – это постоянная борьба против тенденции к возрастанию энтропии
Старение сопровождается возрастанием энтропии! d. S = di. S + de. S > 0 di. S/dt > de. S/dt Энтропия достигает максимального значения при термодинамическом равновесии. Жизнь – это постоянная борьба против тенденции к возрастанию энтропии


