кишечник рыбы.pptx
- Количество слайдов: 16

Исследование микробиоценоза кишечника радужной форели (Parasalmo mykiss) Выполнила: Якименко В. А. , студентка М(б)б-3. Научный руководитель: Ускова И. В. , к. б. н. , доцент кафедры «Микробиологии и биохимии» МГТУ.

Качественный состав микробиоценоза рыбы имеет огромное значение, поскольку патогенные и условно патогенные микроорганизмы могут привести к ослаблению защитных сил макроорганизмов. Поэтому важно проводить микробиологический исследования микробиоценоза кишечника радужной форели, которые несомненно представляют научный и практический интерес. Всё выше изложенное в конечном итоге определило цели и задачи научной работы. Целью данной работы являлось изучение микробиоценоза кишечника радужной форели (Parasalmo mykiss). Для достижения указанной цели поставлены следующие задачи: 1) Определить таксономический состав микробиоценоза кишечника радужной форели в садковых хозяйствах реки Туломы; 2) Изучить численную характеристику в составе микробиоценоза кишечника радужной форели.

Видовое разнообразие кишечного тракта рыб Микробиоценоз кишечника рыбы состоит из аэробов, факультативных и облигатных анаэробов, причем состав изменятся в зависимости от возраста, пищевого статуса и окружающих условий. В пищеварительном тракте пресноводных рыб преобладают виды родов Enterobacter, Aeromonas и Acinetobacter. Также встречаются Escherihia, Klebsiella, Proteus, Serratia, Alcaligines, Eikenella, Bacteroides, Citrobacter freundii, Hafnia alvei, Cytophaga/Flexibacter, Bacillus, Listeria, Propionobacterium, Staphilococcus, Moraxella, Pseudomonas.
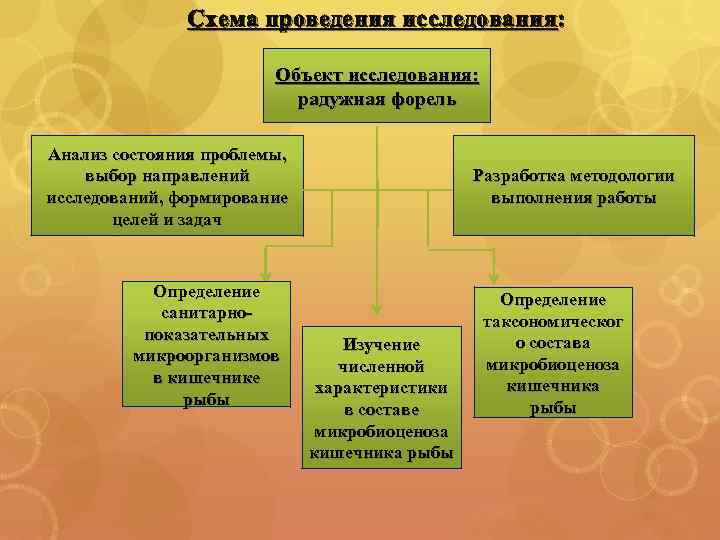
Схема проведения исследования: Объект исследования: радужная форель Анализ состояния проблемы, выбор направлений исследований, формирование целей и задач Определение санитарнопоказательных микроорганизмов в кишечнике рыбы Разработка методологии выполнения работы Изучение численной характеристики в составе микробиоценоза кишечника рыбы Определение таксономическог о состава микробиоценоза кишечника рыбы

Методика выполнения исследования Отбор проб 24 часа Подготовка проб к анализу 72 часа Учёт микроорганизмов на плотной среде Микроскопия, окраска по Граму Получение чистой культуры 5 -е сутки Учёт микроорганизмов на жидкой среде

Схема 1. Пересев микроорганизмов на плотные питательные среды Содержимое кишечника рыбы РПА Стафилококкагар Лактобак -агар Формула расчета объема пробы r Объем цилиндра V=П×r 2×h h=1/П×r 2 h кишечник рыбы 1, 25 V=1/3, 14× 0, 25=1, 25×см 2
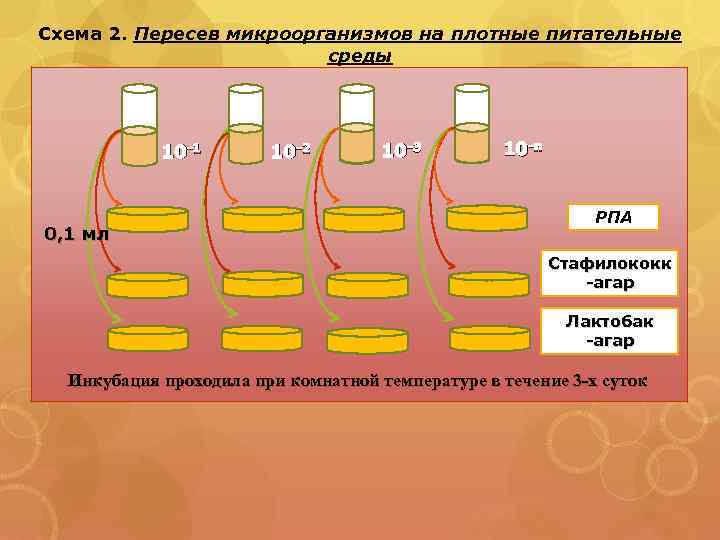
Схема 2. Пересев микроорганизмов на плотные питательные среды 10 -1 0, 1 мл 10 -2 10 -3 10 -n РПА Стафилококк -агар Лактобак -агар Инкубация проходила при комнатной температуре в течение 3 -х суток
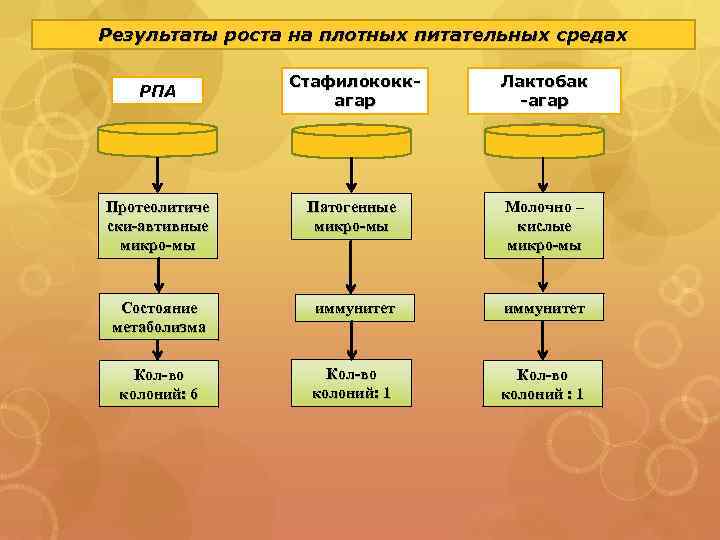
Результаты роста на плотных питательных средах Стафилококкагар Лактобак -агар Протеолитиче ски-автивные микро-мы Патогенные микро-мы Молочно – кислые микро-мы Состояние метаболизма иммунитет Кол-во колоний: 6 Кол-во колоний: 1 Кол-во колоний : 1 РПА
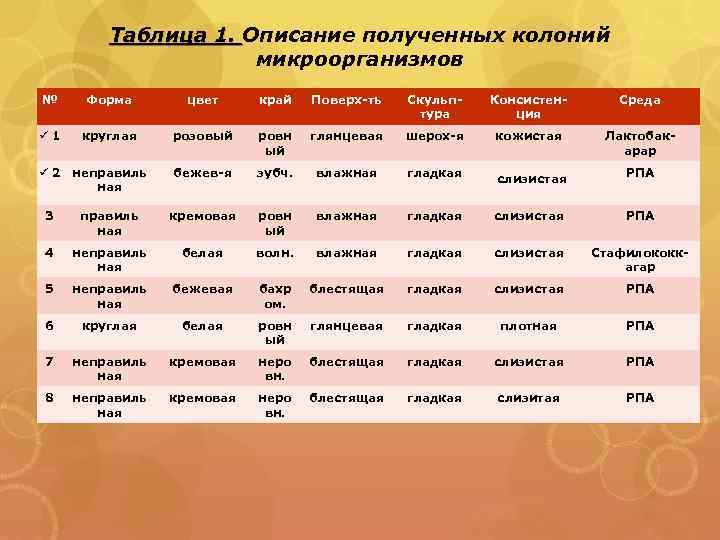
Таблица 1. Описание полученных колоний микроорганизмов № Форма цвет край Поверх-ть Скульптура Консистенция Среда ü 1 круглая розовый ровн ый глянцевая шерох-я кожистая Лактобакарар бежев-я зубч. влажная гладкая слизистая РПА ü 2 неправиль ная 3 правиль ная кремовая ровн ый влажная гладкая слизистая РПА 4 неправиль ная белая волн. влажная гладкая слизистая Стафилококкагар 5 неправиль ная бежевая бахр ом. блестящая гладкая слизистая РПА 6 круглая белая ровн ый глянцевая гладкая плотная РПА 7 неправиль ная кремовая неро вн. блестящая гладкая слизистая РПА 8 неправиль ная кремовая неро вн. блестящая гладкая слизитая РПА
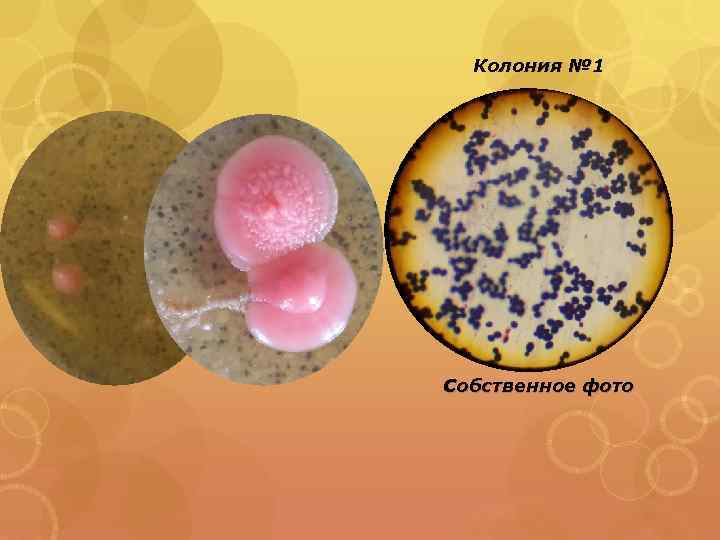
Колония № 1 Собственное фото
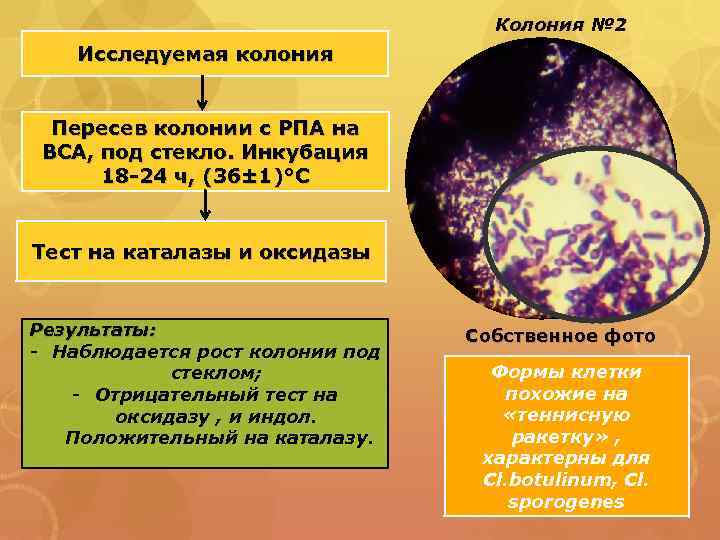
Колония № 2 Исследуемая колония Пересев колонии с РПА на ВСА, под стекло. Инкубация 18 -24 ч, (36± 1)°С Тест на каталазы и оксидазы Результаты: - Наблюдается рост колонии под стеклом; - Отрицательный тест на оксидазу , и индол. Положительный на каталазу. Собственное фото Формы клетки похожие на «теннисную ракетку» , характерны для Cl. botulinum, Cl. sporogenes
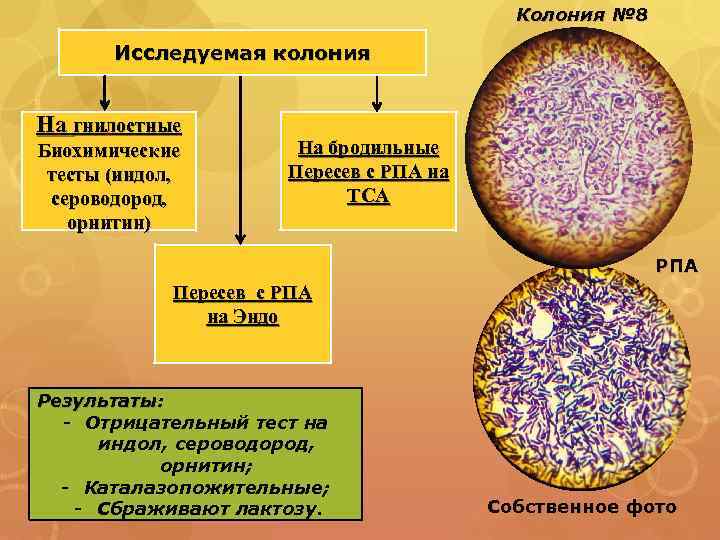
Колония № 8 Исследуемая колония На гнилостные Биохимические тесты (индол, сероводород, орнитин) На бродильные Пересев с РПА на ТСА РПА Пересев с РПА на Эндо Результаты: - Отрицательный тест на индол, сероводород, орнитин; - Каталазопожительные; - Сбраживают лактозу. Собственное фото

Схема 3. Посев микроорганизмов на жидкие питательные среды Десятикратное разведение: 10 -1 10 -2 евтрофы 10 -3 10 -n 5 мл 1 мл РПБ, при 210 С 1 мл аммонификаторы 5 мл РПБ, 3%пептон, Na. CL углеводородокисляющие микро-мы 1 мл По 2 повторности 1 мл 9 мл ММС+ дизельное топливо
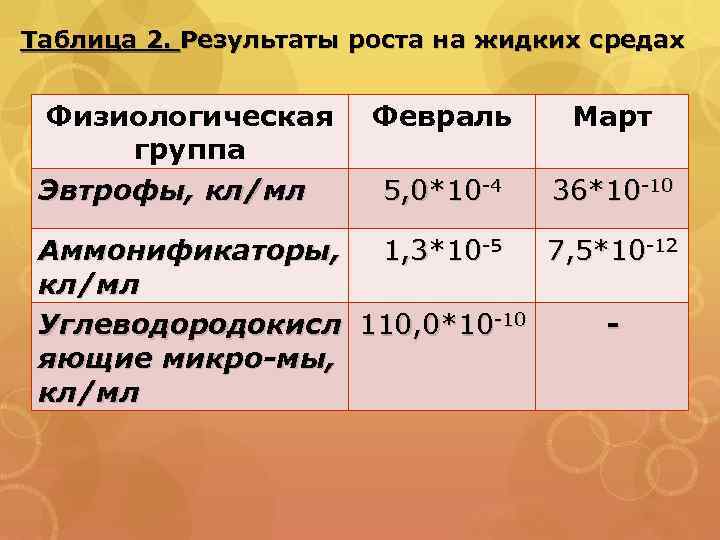
Таблица 2. Результаты роста на жидких средах Физиологическая группа Эвтрофы, кл/мл Февраль Март 5, 0*10 -4 36*10 -10 Аммонификаторы, 1, 3*10 -5 7, 5*10 -12 кл/мл Углеводородокисл 110, 0*10 -10 яющие микро-мы, кл/мл

Выводы 1) На плотных питательных средах, из восьми колоний микроорганизмов было идентифицировано 2 колонии. Это сахаролитические дрожжи, Cl. botulinum ; 2) Численность эвтрофных микроорганизмов в кишечнике радужной форели варьирует с 10 -4 -10 , возможно это связано с солнечной активностью; 3)Численности аммонифицирующих микроорганизмов варьирует с 10 -5 -10 -12. Это может быть связано с интенсивностью питания рыбы. . Во время зимовки и голодания пищеварительный тракт рыб не освобождается от бактериального населения. Однако в этот период в 10 раз и более уменьшается число бактерий по сравнению с их количеством при интенсивном питании 4)Высокая численность углеводородокисляющих микроорганизмов в феврале косвенно свидетельствует о интенсивных метаболических процессах. 5) Высокая численность аммонифицирующих и углеводородокисляющих микроорганизмов возможно указывает на интенсивные процессы метаболизма.

Спасибо за внимание!
кишечник рыбы.pptx