33_FazovRavnovesia.ppt
- Количество слайдов: 83
 Исследование фазовых равновесий ü Фазовые переходы ü Физико-химический анализ ü Равновесие в однокомпонентных системах ü Равновесие в двухкомпонентных системах • Фазовые диаграммы I типа • Фазовые диаграммы III типа • Фазовые диаграммы IV типа • Фазовые диаграммы VI типа • Сводная таблица типов диаграмм ü Равновесие в трехкомпонентных системах ü Методы изображения многокомпонентных систем ü Методы исследования фазовых равновесий • ТА, ДТА, ТГ и ДТГ • Исследования вязкости • Исследования поверхностного натяжения • Кондуктометрия 1
Исследование фазовых равновесий ü Фазовые переходы ü Физико-химический анализ ü Равновесие в однокомпонентных системах ü Равновесие в двухкомпонентных системах • Фазовые диаграммы I типа • Фазовые диаграммы III типа • Фазовые диаграммы IV типа • Фазовые диаграммы VI типа • Сводная таблица типов диаграмм ü Равновесие в трехкомпонентных системах ü Методы изображения многокомпонентных систем ü Методы исследования фазовых равновесий • ТА, ДТА, ТГ и ДТГ • Исследования вязкости • Исследования поверхностного натяжения • Кондуктометрия 1
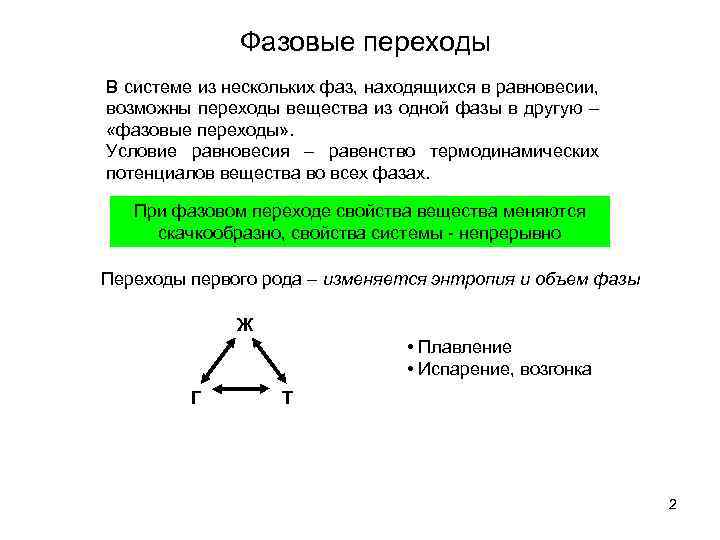 Фазовые переходы В системе из нескольких фаз, находящихся в равновесии, возможны переходы вещества из одной фазы в другую – «фазовые переходы» . Условие равновесия – равенство термодинамических потенциалов вещества во всех фазах. При фазовом переходе свойства вещества меняются скачкообразно, свойства системы - непрерывно Переходы первого рода – изменяется энтропия и объем фазы Ж • Плавление • Испарение, возгонка Г Т 2
Фазовые переходы В системе из нескольких фаз, находящихся в равновесии, возможны переходы вещества из одной фазы в другую – «фазовые переходы» . Условие равновесия – равенство термодинамических потенциалов вещества во всех фазах. При фазовом переходе свойства вещества меняются скачкообразно, свойства системы - непрерывно Переходы первого рода – изменяется энтропия и объем фазы Ж • Плавление • Испарение, возгонка Г Т 2
 Переходы второго рода – изменяется вторая производная по температуре для термодинамического потенциала, энтропии и т. п. Имеет смысл теплоемкости, сжимаемости, и т. п. 3
Переходы второго рода – изменяется вторая производная по температуре для термодинамического потенциала, энтропии и т. п. Имеет смысл теплоемкости, сжимаемости, и т. п. 3
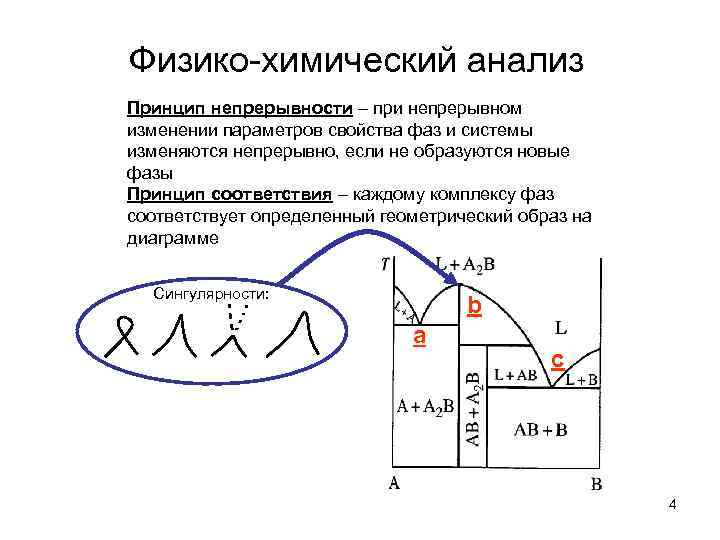 Физико-химический анализ Принцип непрерывности – при непрерывном изменении параметров свойства фаз и системы изменяются непрерывно, если не образуются новые фазы Принцип соответствия – каждому комплексу фаз соответствует определенный геометрический образ на диаграмме Сингулярности: b a c 4
Физико-химический анализ Принцип непрерывности – при непрерывном изменении параметров свойства фаз и системы изменяются непрерывно, если не образуются новые фазы Принцип соответствия – каждому комплексу фаз соответствует определенный геометрический образ на диаграмме Сингулярности: b a c 4
 h, Па∙с область ликвидуса t, o. C Зависимость вязкости растворов Fe 2 O 3 в расплаве Ba. F 2 -Ba. OB 2 O 3 -Pb. O от температуры. 5
h, Па∙с область ликвидуса t, o. C Зависимость вязкости растворов Fe 2 O 3 в расплаве Ba. F 2 -Ba. OB 2 O 3 -Pb. O от температуры. 5
 Т, К 1 Еа, к. Дж/моль 2 C(Fe 2 O 3), моль. % Зависимость энергии активации вязкого течения (1) и температуры ликвидуса (2), определенного по зависимости вязкости от температуры, от концентрации раствора Fe 2 O 3 в расплаве Pb. O-B 2 O 3 -Ba. O-Ba. F 2 6
Т, К 1 Еа, к. Дж/моль 2 C(Fe 2 O 3), моль. % Зависимость энергии активации вязкого течения (1) и температуры ликвидуса (2), определенного по зависимости вязкости от температуры, от концентрации раствора Fe 2 O 3 в расплаве Pb. O-B 2 O 3 -Ba. O-Ba. F 2 6
 Т, К 1250 1200 1150 1100 1050 0 5 (Pb. O-B 2 O 3 -Ba. O-Ba. F 2) 10 1 5 20 Fe 2 O 3 Квазибинарная диаграмма плавкости системы Fe 2 O 3– (Pb. O-B 2 O 3 -Ba. O-Ba. F 2) 7
Т, К 1250 1200 1150 1100 1050 0 5 (Pb. O-B 2 O 3 -Ba. O-Ba. F 2) 10 1 5 20 Fe 2 O 3 Квазибинарная диаграмма плавкости системы Fe 2 O 3– (Pb. O-B 2 O 3 -Ba. O-Ba. F 2) 7
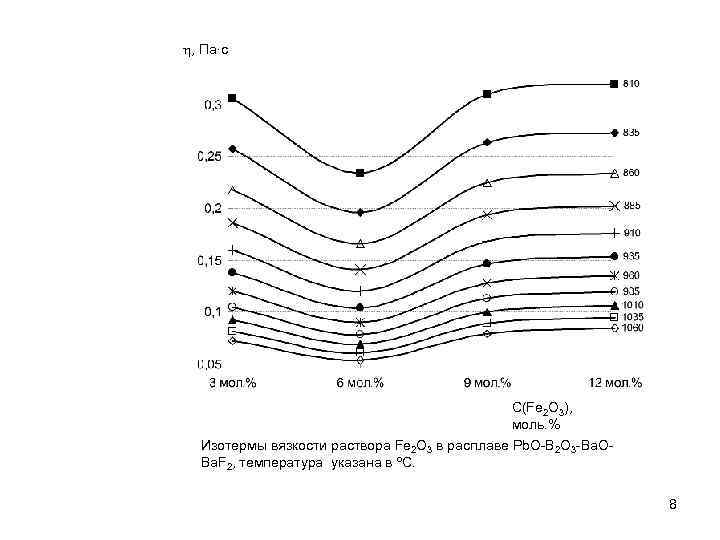 h, Па∙с C(Fe 2 O 3), моль. % Изотермы вязкости раствора Fe 2 O 3 в расплаве Pb. O-B 2 O 3 -Ba. OBa. F 2, температура указана в о. С. 8
h, Па∙с C(Fe 2 O 3), моль. % Изотермы вязкости раствора Fe 2 O 3 в расплаве Pb. O-B 2 O 3 -Ba. OBa. F 2, температура указана в о. С. 8
 ln 2, 0 1, 5 1, 0 0, 5 0, 0 -0, 5 -1, 0 1 -1, 5 -2, 0 31 7, 2 7, 4 7, 6 7, 8 8, 0 8, 2 2 8, 4 8, 6 1/Т*104 Звисимость логарифма удельной электропроводности от обратной температуры в расплаве ІАГ-B 2 O 3–Ba. O–Ba. F 2–Pb. O при 15 моль. % Pb. O: 1 – 4. 27 моль. % ІАГ; 2 – 4. 54 моль. % ІАГ; 3 – 4. 75 моль. % ІАГ. 9
ln 2, 0 1, 5 1, 0 0, 5 0, 0 -0, 5 -1, 0 1 -1, 5 -2, 0 31 7, 2 7, 4 7, 6 7, 8 8, 0 8, 2 2 8, 4 8, 6 1/Т*104 Звисимость логарифма удельной электропроводности от обратной температуры в расплаве ІАГ-B 2 O 3–Ba. O–Ba. F 2–Pb. O при 15 моль. % Pb. O: 1 – 4. 27 моль. % ІАГ; 2 – 4. 54 моль. % ІАГ; 3 – 4. 75 моль. % ІАГ. 9
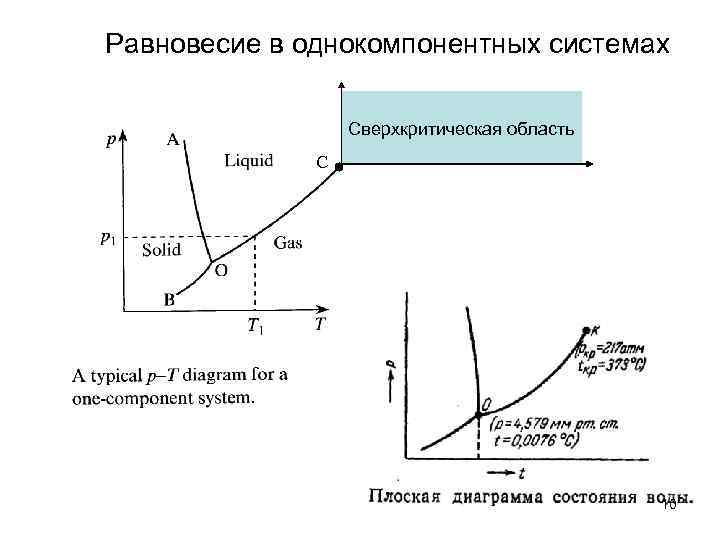 Равновесие в однокомпонентных системах Сверхкритическая область С 10
Равновесие в однокомпонентных системах Сверхкритическая область С 10
 11
11
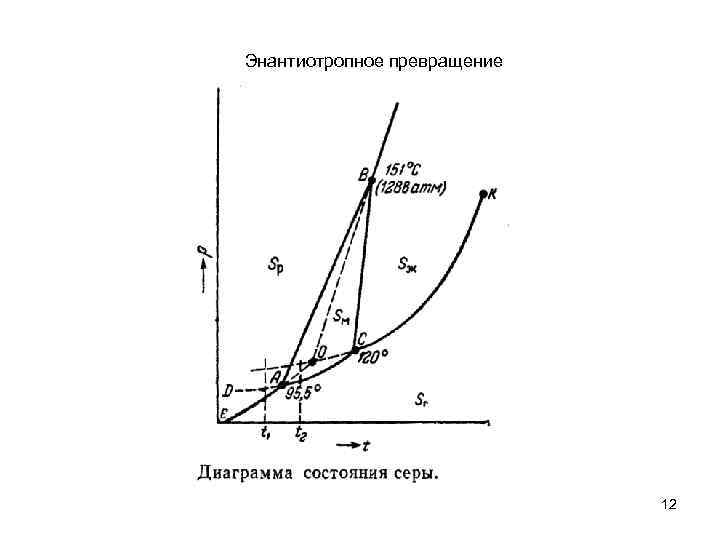 Энантиотропное превращение 12
Энантиотропное превращение 12
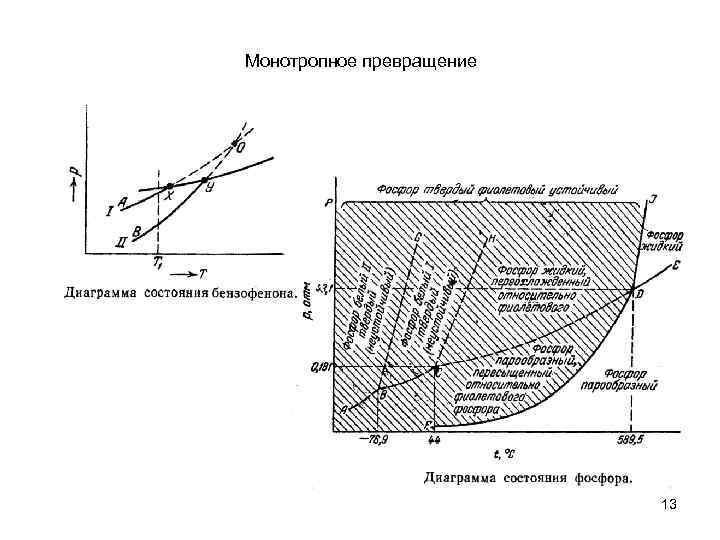 Монотропное превращение 13
Монотропное превращение 13
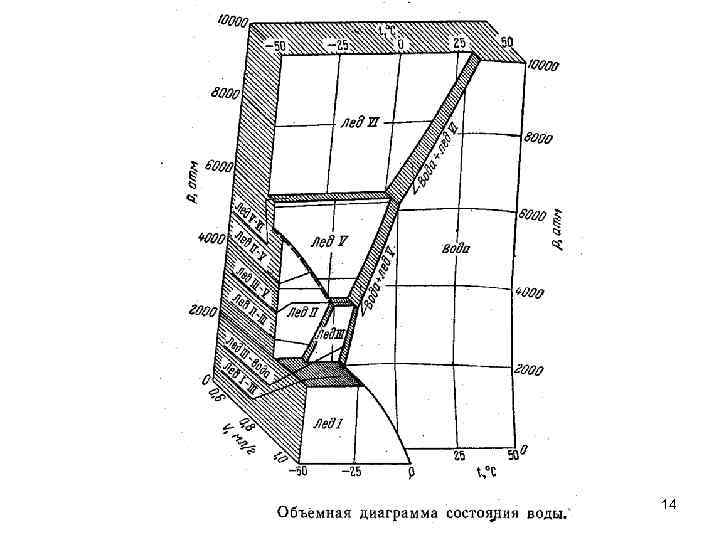 14
14
 Равновесие в двухкомпонентных системах 15
Равновесие в двухкомпонентных системах 15
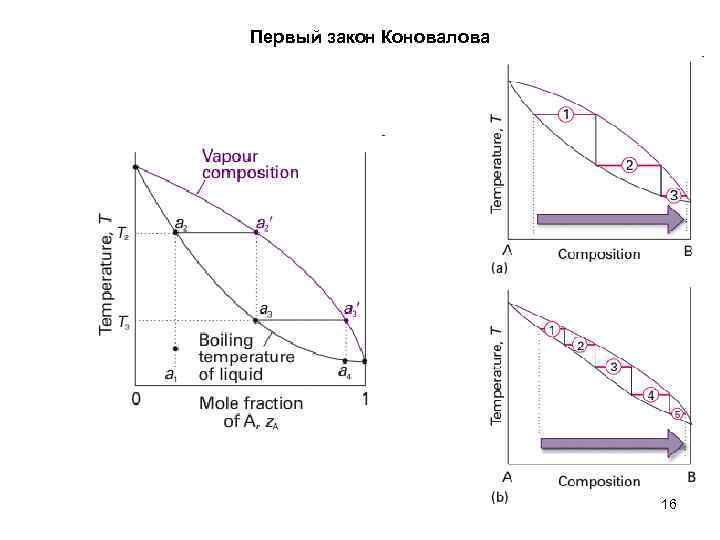 Первый закон Коновалова 16
Первый закон Коновалова 16
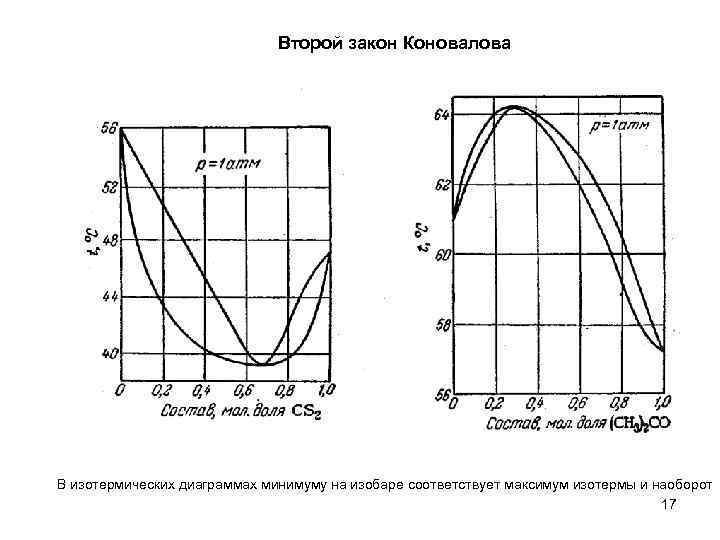 Второй закон Коновалова В изотермических диаграммах минимуму на изобаре соответствует максимум изотермы и наоборот 17
Второй закон Коновалова В изотермических диаграммах минимуму на изобаре соответствует максимум изотермы и наоборот 17
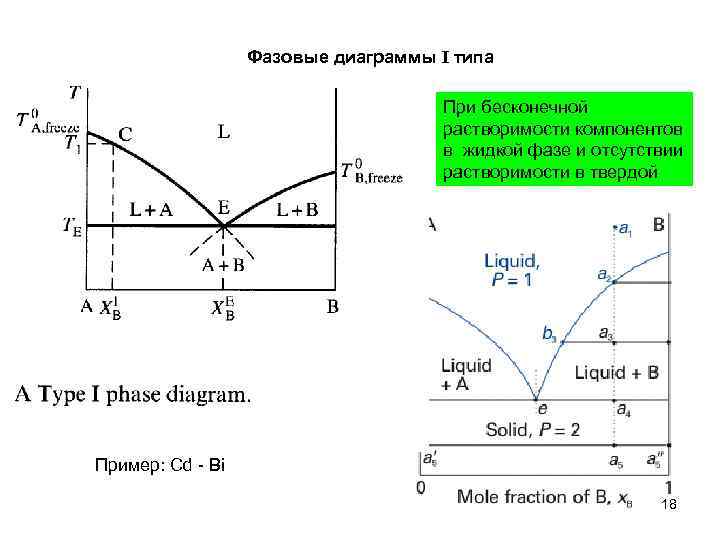 Фазовые диаграммы I типа При бесконечной растворимости компонентов в жидкой фазе и отсутствии растворимости в твердой Пример: Cd - Bi 18
Фазовые диаграммы I типа При бесконечной растворимости компонентов в жидкой фазе и отсутствии растворимости в твердой Пример: Cd - Bi 18
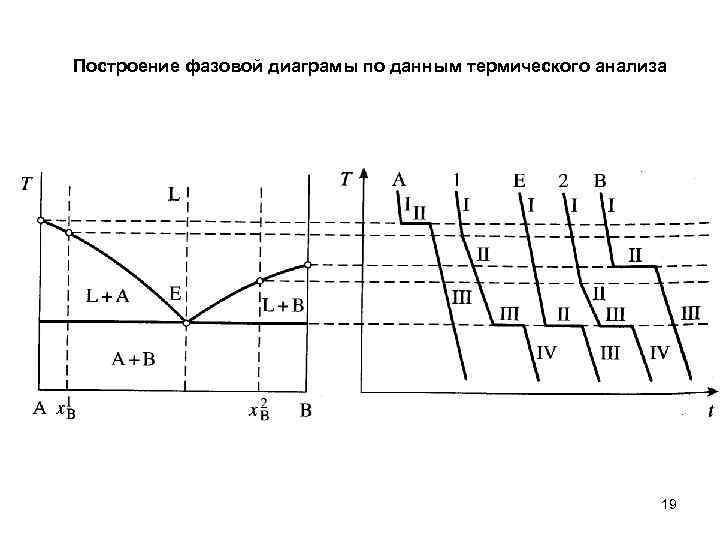 Построение фазовой диаграмы по данным термического анализа 19
Построение фазовой диаграмы по данным термического анализа 19
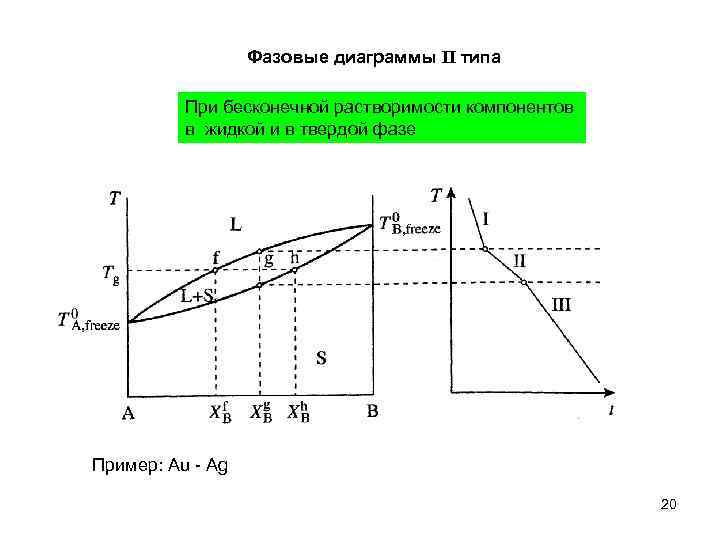 Фазовые диаграммы II типа При бесконечной растворимости компонентов в жидкой и в твердой фазе Пример: Au - Ag 20
Фазовые диаграммы II типа При бесконечной растворимости компонентов в жидкой и в твердой фазе Пример: Au - Ag 20
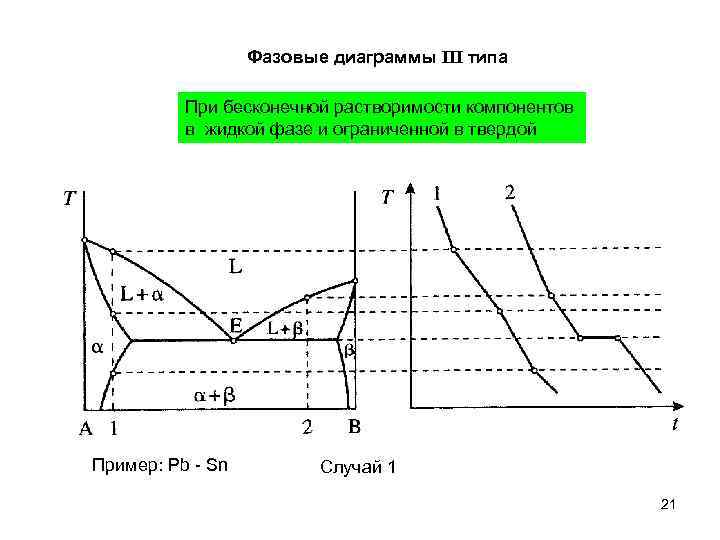 Фазовые диаграммы III типа При бесконечной растворимости компонентов в жидкой фазе и ограниченной в твердой Пример: Pb - Sn Случай 1 21
Фазовые диаграммы III типа При бесконечной растворимости компонентов в жидкой фазе и ограниченной в твердой Пример: Pb - Sn Случай 1 21
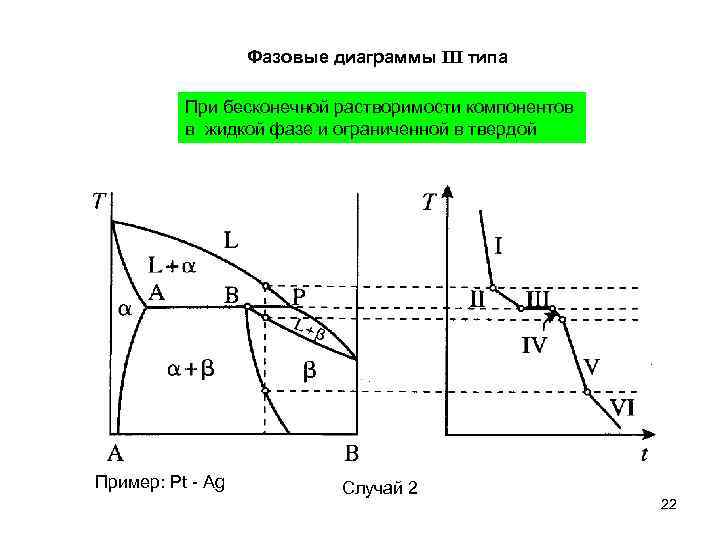 Фазовые диаграммы III типа При бесконечной растворимости компонентов в жидкой фазе и ограниченной в твердой Пример: Pt - Ag Случай 2 22
Фазовые диаграммы III типа При бесконечной растворимости компонентов в жидкой фазе и ограниченной в твердой Пример: Pt - Ag Случай 2 22
 Геометрические образы эвтектической и перитектической точки эвтектическая точка L → + перитектическая точка L+ → 23
Геометрические образы эвтектической и перитектической точки эвтектическая точка L → + перитектическая точка L+ → 23
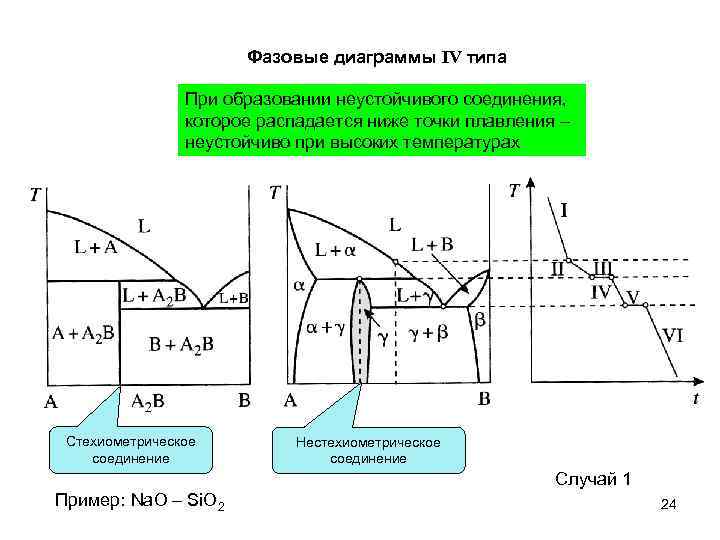 Фазовые диаграммы IV типа При образовании неустойчивого соединения, которое распадается ниже точки плавления – неустойчиво при высоких температурах Стехиометрическое соединение Нестехиометрическое соединение Случай 1 Пример: Na. O – Si. O 2 24
Фазовые диаграммы IV типа При образовании неустойчивого соединения, которое распадается ниже точки плавления – неустойчиво при высоких температурах Стехиометрическое соединение Нестехиометрическое соединение Случай 1 Пример: Na. O – Si. O 2 24
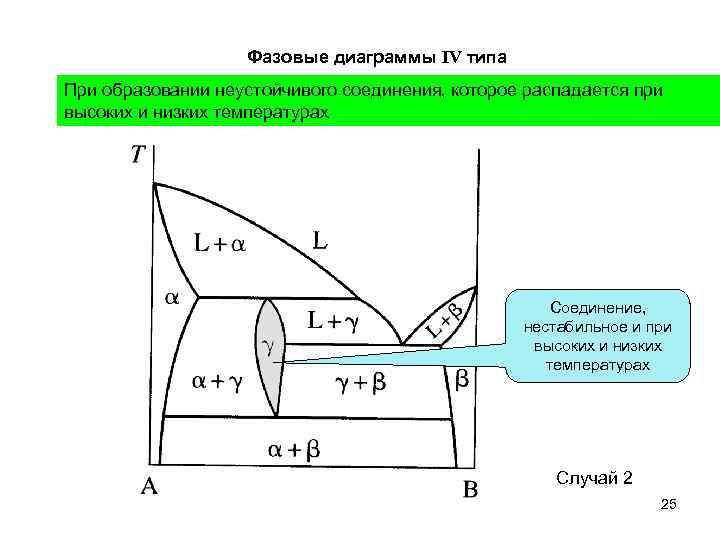 Фазовые диаграммы IV типа При образовании неустойчивого соединения, которое распадается при высоких и низких температурах Соединение, нестабильное и при высоких и низких температурах Случай 2 25
Фазовые диаграммы IV типа При образовании неустойчивого соединения, которое распадается при высоких и низких температурах Соединение, нестабильное и при высоких и низких температурах Случай 2 25
 Фазовые диаграммы V типа При образовании соединения, устойчивого вплоть до точки плавления Стабильное стехиометрическое соединение А 2 В+ нестабильное соединение АВ Стабильное нестехиометрическое соединение Случай 1 26
Фазовые диаграммы V типа При образовании соединения, устойчивого вплоть до точки плавления Стабильное стехиометрическое соединение А 2 В+ нестабильное соединение АВ Стабильное нестехиометрическое соединение Случай 1 26
 Фазовые диаграммы V типа При образовании соединения, устойчивого вплоть до точки плавления, но нестабильного при низких температурах Случай 2 27
Фазовые диаграммы V типа При образовании соединения, устойчивого вплоть до точки плавления, но нестабильного при низких температурах Случай 2 27
 Фазовые диаграммы VI типа Расслаивание на несколько фаз в твердом или жидком состоянии Разделение фаз происходит если термодинамически выгоднее распад на две фазы одинаковой структуры, но разные по химическому составу. 28
Фазовые диаграммы VI типа Расслаивание на несколько фаз в твердом или жидком состоянии Разделение фаз происходит если термодинамически выгоднее распад на две фазы одинаковой структуры, но разные по химическому составу. 28
 29
29
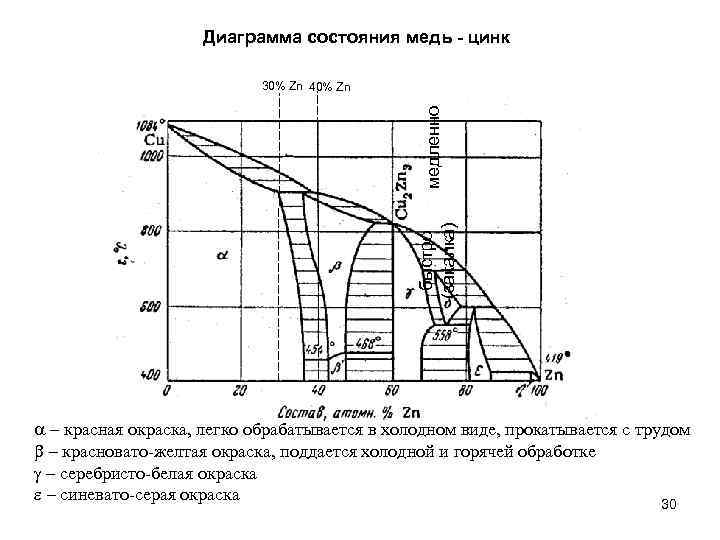 Диаграмма состояния медь - цинк быстро (закалка) медленно 30% Zn 40% Zn a – красная окраска, легко обрабатывается в холодном виде, прокатывается с трудом b – красновато-желтая окраска, поддается холодной и горячей обработке g – серебристо-белая окраска e – синевато-серая окраска 30
Диаграмма состояния медь - цинк быстро (закалка) медленно 30% Zn 40% Zn a – красная окраска, легко обрабатывается в холодном виде, прокатывается с трудом b – красновато-желтая окраска, поддается холодной и горячей обработке g – серебристо-белая окраска e – синевато-серая окраска 30
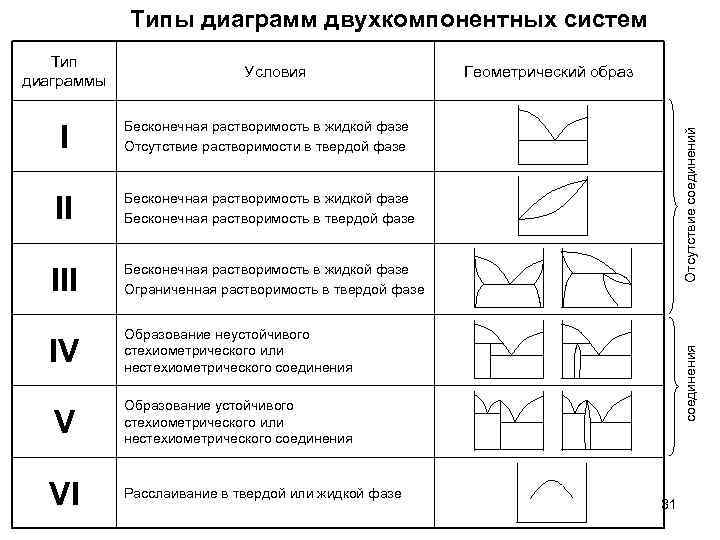 Типы диаграмм двухкомпонентных систем Тип диаграммы Условия Бесконечная растворимость в жидкой фазе Отсутствие растворимости в твердой фазе II Бесконечная растворимость в жидкой фазе Бесконечная растворимость в твердой фазе Бесконечная растворимость в жидкой фазе Ограниченная растворимость в твердой фазе IV Образование неустойчивого стехиометрического или нестехиометрического соединения V Образование устойчивого стехиометрического или нестехиометрического соединения VI Расслаивание в твердой или жидкой фазе соединения III Отсутствие соединений I Геометрический образ 31
Типы диаграмм двухкомпонентных систем Тип диаграммы Условия Бесконечная растворимость в жидкой фазе Отсутствие растворимости в твердой фазе II Бесконечная растворимость в жидкой фазе Бесконечная растворимость в твердой фазе Бесконечная растворимость в жидкой фазе Ограниченная растворимость в твердой фазе IV Образование неустойчивого стехиометрического или нестехиометрического соединения V Образование устойчивого стехиометрического или нестехиометрического соединения VI Расслаивание в твердой или жидкой фазе соединения III Отсутствие соединений I Геометрический образ 31
 17% Si 80% Si 32
17% Si 80% Si 32
 33
33
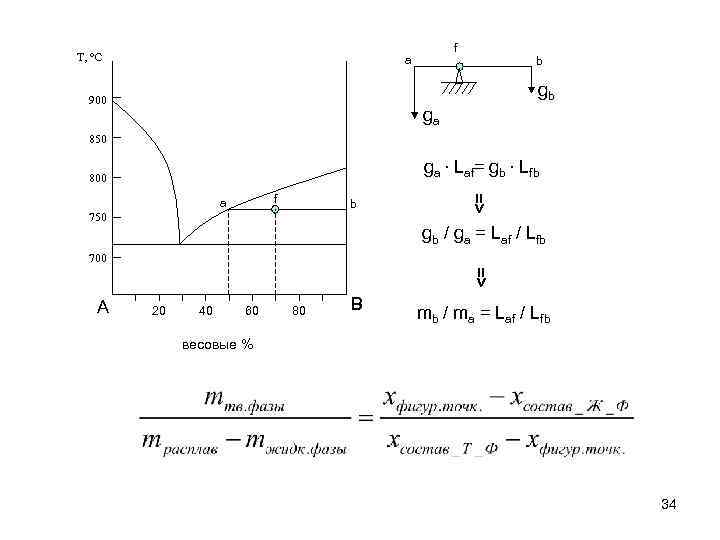 T, o. C f a b gb 900 ga 850 ga ∙ Laf= gb ∙ Lfb 800 b 750 => f a gb / ga = Laf / Lfb 700 => A 20 40 60 80 B mb / ma = Laf / Lfb весовые % 34
T, o. C f a b gb 900 ga 850 ga ∙ Laf= gb ∙ Lfb 800 b 750 => f a gb / ga = Laf / Lfb 700 => A 20 40 60 80 B mb / ma = Laf / Lfb весовые % 34
 1 23 4 5 6 4 r 2 0 Зависимости удельного сопротивления (r), вязкости жидкой фазы (h), плотности (d) и температуры начала кристаллизации (t) от состава в системе вода-серный ангидрид 0. 3 1. 8 d h 0. 2 1. 4 1. 0 40 h 0. 1 1. 2. 3. 4. 5. 20 0 0 t, o. C -20 Соединения H 2 SO 4∙ 4 H 2 O H 2 SO 4∙ 2 H 2 O H 2 SO 4∙H 2 O H 2 SO 4 H 2 S 2 O 7 -40 -60 H 2 O SO 3 0 20 40 60 80 100 35
1 23 4 5 6 4 r 2 0 Зависимости удельного сопротивления (r), вязкости жидкой фазы (h), плотности (d) и температуры начала кристаллизации (t) от состава в системе вода-серный ангидрид 0. 3 1. 8 d h 0. 2 1. 4 1. 0 40 h 0. 1 1. 2. 3. 4. 5. 20 0 0 t, o. C -20 Соединения H 2 SO 4∙ 4 H 2 O H 2 SO 4∙ 2 H 2 O H 2 SO 4∙H 2 O H 2 SO 4 H 2 S 2 O 7 -40 -60 H 2 O SO 3 0 20 40 60 80 100 35
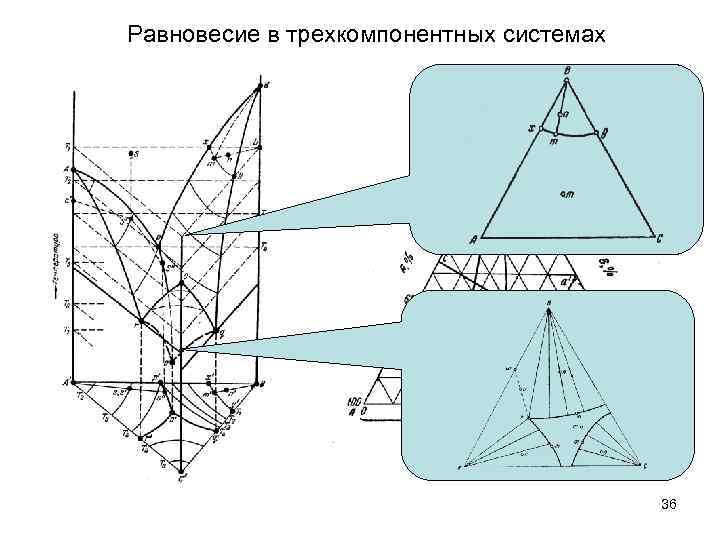 Равновесие в трехкомпонентных системах 36
Равновесие в трехкомпонентных системах 36
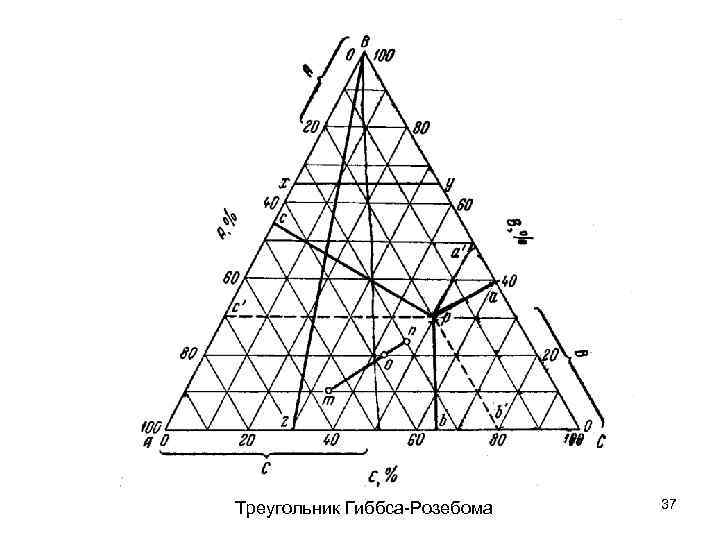 Треугольник Гиббса-Розебома 37
Треугольник Гиббса-Розебома 37
 Cечение при температуре ниже Тпл но выше температуры тройной эвтектики 38
Cечение при температуре ниже Тпл но выше температуры тройной эвтектики 38
 Проекция поверхности ликвидуса Частное сечение объемной диаграммы системы Y 2 O 3 -Ba. O-Cu. O 39
Проекция поверхности ликвидуса Частное сечение объемной диаграммы системы Y 2 O 3 -Ba. O-Cu. O 39
 Равновесие в многокомпонентных системах A Для четырехкомпонентных систем возможно только отображение состава по методу Гиббса в тетраэдре Для пяти- и более компонентных систем применяются методы упрощения – используют квази. D бинарные и квазитройные диаграммы B C 40
Равновесие в многокомпонентных системах A Для четырехкомпонентных систем возможно только отображение состава по методу Гиббса в тетраэдре Для пяти- и более компонентных систем применяются методы упрощения – используют квази. D бинарные и квазитройные диаграммы B C 40
 Т, К 1250 1200 1150 1100 1050 0 5 (Pb. O-B 2 O 3 -Ba. O-Ba. F 2) 10 1 5 20 Fe 2 O 3 Квазибинарная диаграмма плавкости системы Fe 2 O 3–(Pb. O-B 2 O 3 -Ba. O-Ba. F 2) 41
Т, К 1250 1200 1150 1100 1050 0 5 (Pb. O-B 2 O 3 -Ba. O-Ba. F 2) 10 1 5 20 Fe 2 O 3 Квазибинарная диаграмма плавкости системы Fe 2 O 3–(Pb. O-B 2 O 3 -Ba. O-Ba. F 2) 41
 Методы исследования фазовых равновесий • Термический и дифференциальный термический анализ • Термогравиметрический анализ • Исследования зависимостей состав - свойство ü вязкость ü поверхностное натяжение ü плотность ü электропроводность • спектральные и акустические методы анализа 42
Методы исследования фазовых равновесий • Термический и дифференциальный термический анализ • Термогравиметрический анализ • Исследования зависимостей состав - свойство ü вязкость ü поверхностное натяжение ü плотность ü электропроводность • спектральные и акустические методы анализа 42
 • • механические – плотность, вязкость; поверхностные – поверхностное натяжение; оптические – показатель преломления; спектральные – оптическая плотность или интегральная интенсивность полос поглощения в различных областях спектра (ИК, видимая, УФ), поглощение в области радиочастот (резонансная спектроскопия); акустические – скорость распространения звука (адиабатическая сжимаемость); тепловые – теплоты смешения, теплопроводность; электрические и магнитные – электропроводность, доли переноса тока, электропотенциалы, магнитная восприимчивость, диэлектрическая проницаемость. все физико-химические свойства разделить на 3 группы: • • • свойства смеси аддитивно слагаются из свойств компонентов (при определенном способе выражения состава); cвойства смеси в более или менее явной форме рассчитываются, исходя из свойств компонентов; свойства смеси не находятся в какой-либо связи с величинами свойств компонентов, либо свойство имеет физический смысл лишь в применении к смеси, но не к отдельному компоненту. К первой группе относятся: плотность, показательное преломление, оптическая плотность, магнитная восприимчивость и др. Ко второй группе относятся: вязкость, диэлектрическая проницаемость. К третьей группе относятся: электропроводность, теплота смешения. 43
• • механические – плотность, вязкость; поверхностные – поверхностное натяжение; оптические – показатель преломления; спектральные – оптическая плотность или интегральная интенсивность полос поглощения в различных областях спектра (ИК, видимая, УФ), поглощение в области радиочастот (резонансная спектроскопия); акустические – скорость распространения звука (адиабатическая сжимаемость); тепловые – теплоты смешения, теплопроводность; электрические и магнитные – электропроводность, доли переноса тока, электропотенциалы, магнитная восприимчивость, диэлектрическая проницаемость. все физико-химические свойства разделить на 3 группы: • • • свойства смеси аддитивно слагаются из свойств компонентов (при определенном способе выражения состава); cвойства смеси в более или менее явной форме рассчитываются, исходя из свойств компонентов; свойства смеси не находятся в какой-либо связи с величинами свойств компонентов, либо свойство имеет физический смысл лишь в применении к смеси, но не к отдельному компоненту. К первой группе относятся: плотность, показательное преломление, оптическая плотность, магнитная восприимчивость и др. Ко второй группе относятся: вязкость, диэлектрическая проницаемость. К третьей группе относятся: электропроводность, теплота смешения. 43
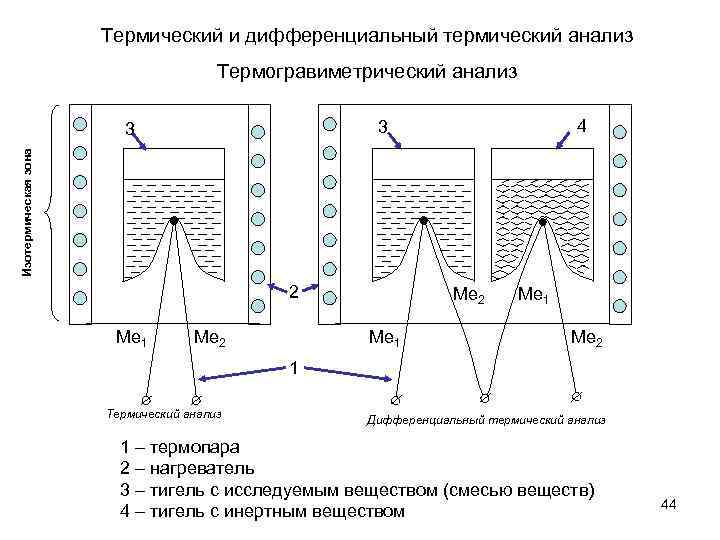 Термический и дифференциальный термический анализ Термогравиметрический анализ 4 3 Изотермическая зона 3 2 Ме 1 Ме 2 1 Термический анализ Дифференциальный термический анализ 1 – термопара 2 – нагреватель 3 – тигель с исследуемым веществом (смесью веществ) 4 – тигель с инертным веществом 44
Термический и дифференциальный термический анализ Термогравиметрический анализ 4 3 Изотермическая зона 3 2 Ме 1 Ме 2 1 Термический анализ Дифференциальный термический анализ 1 – термопара 2 – нагреватель 3 – тигель с исследуемым веществом (смесью веществ) 4 – тигель с инертным веществом 44
 45 Пример кривых ТА, ДТА и ТГА для системы YBa 2 Cu 3 O 7 -d - Ba. O/Cu. O 3 -25/75 мол. %
45 Пример кривых ТА, ДТА и ТГА для системы YBa 2 Cu 3 O 7 -d - Ba. O/Cu. O 3 -25/75 мол. %
 46
46
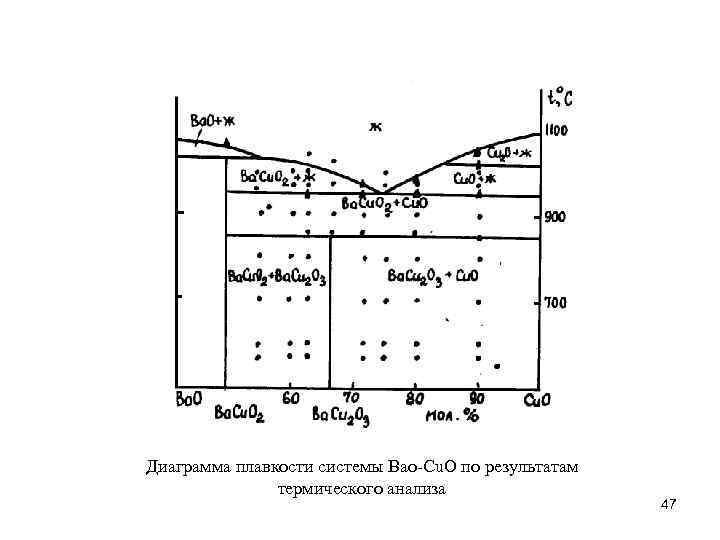 Диаграмма плавкости системы Bao-Cu. O по результатам термического анализа 47
Диаграмма плавкости системы Bao-Cu. O по результатам термического анализа 47
 Исследования вязкости Вязкость – свойство жидкости или газа оказывать сопротивление перемещению одной части относительно другой при сдвиге, растяжениии других деформациях Если в жидкости существует поле скоростей, причем скорость w каждого объема направлена параллельно оси х, то на площадку ds, перпендикулярную оси z действует вязкая сила d. F, действующая со стороны жидкости: , где h – динамическая вязкость Динамическая вязкость определяет характер течения в стационарных условиях (скорость в каждой точке пространства не зависит от времени). В нестационарных условиях течение определяется кинематической вязкостью n=h/r 48
Исследования вязкости Вязкость – свойство жидкости или газа оказывать сопротивление перемещению одной части относительно другой при сдвиге, растяжениии других деформациях Если в жидкости существует поле скоростей, причем скорость w каждого объема направлена параллельно оси х, то на площадку ds, перпендикулярную оси z действует вязкая сила d. F, действующая со стороны жидкости: , где h – динамическая вязкость Динамическая вязкость определяет характер течения в стационарных условиях (скорость в каждой точке пространства не зависит от времени). В нестационарных условиях течение определяется кинематической вязкостью n=h/r 48
 Методы измерения вязкости жидкостей основаны на регистрации в процессе измерения параметров, функционально связанных с вязкостью. Связь между параметрами и динамической или кинематической вязкостью обосновывается в математических теориях методов. При выводе расчетных формул принимают следующие положения: • скольжение на поверхности соприкосновения жидкость твердое тело плотность отсутствует, т. е. имеет место полное смачивание; • движение жидкости с достаточной степенью точности описывается уравнением Навье-Стокса для несжимаемой жидкости; • система рассматривается при стационарном, размерном движении жидкости или твердого тела в жидкости. 49
Методы измерения вязкости жидкостей основаны на регистрации в процессе измерения параметров, функционально связанных с вязкостью. Связь между параметрами и динамической или кинематической вязкостью обосновывается в математических теориях методов. При выводе расчетных формул принимают следующие положения: • скольжение на поверхности соприкосновения жидкость твердое тело плотность отсутствует, т. е. имеет место полное смачивание; • движение жидкости с достаточной степенью точности описывается уравнением Навье-Стокса для несжимаемой жидкости; • система рассматривается при стационарном, размерном движении жидкости или твердого тела в жидкости. 49
 МЕТОДЫ ИЗМЕРЕНИЯ ВЯЗКОСТИ Методы измерения вязкости делятся на стационарные капиллярного истечения падающего тела ротационные (вращающихся цилиндров) метод стационарных колебаний (вибрационный); нестационарные основанные на наблюдениях крутильных колебаний основанные на наблюдениях продольных колебаний 50
МЕТОДЫ ИЗМЕРЕНИЯ ВЯЗКОСТИ Методы измерения вязкости делятся на стационарные капиллярного истечения падающего тела ротационные (вращающихся цилиндров) метод стационарных колебаний (вибрационный); нестационарные основанные на наблюдениях крутильных колебаний основанные на наблюдениях продольных колебаний 50
 Капиллярные методы Вязкость измеряется по скорости истечения исследуемого расплава через капилляр. В основе метода лежит использование уравнения Пуазейля, связывающего время истечения τ определенного объема жидкости V через капилляр радиуса r и длины l под давлением Р: используют в относительном варианте: измеряют время истечения двух жидкостей - с известной вязкостью (η 1) и исследуемой жидкости (η 2) и, зная плотности двух жидкостей (d 1 и d 2), вычисляют вязкость по формуле: 51
Капиллярные методы Вязкость измеряется по скорости истечения исследуемого расплава через капилляр. В основе метода лежит использование уравнения Пуазейля, связывающего время истечения τ определенного объема жидкости V через капилляр радиуса r и длины l под давлением Р: используют в относительном варианте: измеряют время истечения двух жидкостей - с известной вязкостью (η 1) и исследуемой жидкости (η 2) и, зная плотности двух жидкостей (d 1 и d 2), вычисляют вязкость по формуле: 51
 Методы падающего тела Метод основан на использовании уравнения Стокса где F – сила, равная разности веса и выталкивающей силы, к – радиус шара, w - скорость F g L где r и rж – плотность шара и жидкости. Тогда В относительном варианте: 52
Методы падающего тела Метод основан на использовании уравнения Стокса где F – сила, равная разности веса и выталкивающей силы, к – радиус шара, w - скорость F g L где r и rж – плотность шара и жидкости. Тогда В относительном варианте: 52
 Ротационные методы В основе группы методов вращения лежит измерение вязкости по углу закручивания. r 1 r 2 Используется только в относительном варианте 53
Ротационные методы В основе группы методов вращения лежит измерение вязкости по углу закручивания. r 1 r 2 Используется только в относительном варианте 53
 Осцилляционные методы 5 4 7 6 3 1 Вязкость определяется по затуханию колебаний жесткой системы погруженной в жидкость или содержащей в себе жидкость метод крутильных колебаний помещенному в расплав телу вращения, подвешенному на упругой нити, придаются крутильные колебания. Силы вязкого трения расплава тормозят вращение маятника, период и амплитуда затухающих колебаний зависят от вязкости и плотности исследуемого расплава. Амплитуда колебаний А описывается уравнением: 2 Схема установки для измерения вязкости расплава по вибрационному методу: 1 -раствор-расплав; 2 -платиновый датчик; 3 -держатель датчика (алундовый шток); 4 -пружина; 5 -массивная площадка; 6 -магниты; 7 -индукционная катушка. где t — время измерения, τ — период полного колебания, δ — логарифмический декремент затухания, А 0 — константа прибора вибрационный метод 54
Осцилляционные методы 5 4 7 6 3 1 Вязкость определяется по затуханию колебаний жесткой системы погруженной в жидкость или содержащей в себе жидкость метод крутильных колебаний помещенному в расплав телу вращения, подвешенному на упругой нити, придаются крутильные колебания. Силы вязкого трения расплава тормозят вращение маятника, период и амплитуда затухающих колебаний зависят от вязкости и плотности исследуемого расплава. Амплитуда колебаний А описывается уравнением: 2 Схема установки для измерения вязкости расплава по вибрационному методу: 1 -раствор-расплав; 2 -платиновый датчик; 3 -держатель датчика (алундовый шток); 4 -пружина; 5 -массивная площадка; 6 -магниты; 7 -индукционная катушка. где t — время измерения, τ — период полного колебания, δ — логарифмический декремент затухания, А 0 — константа прибора вибрационный метод 54
 Методы стационарных колебаний Вязкость определяется по резонансной амплитуде или сдвигу фаз колебаний жесткой системы погруженной в жидкость Для вязких жидкостей Определяют частоту вынужденных колебаний, при которой сдвиг фаз между силой и смещением равен p/2. Тогда Для маловязких жидкостей Определяют частоту, при которой амплитуда максимальна, тогда 55
Методы стационарных колебаний Вязкость определяется по резонансной амплитуде или сдвигу фаз колебаний жесткой системы погруженной в жидкость Для вязких жидкостей Определяют частоту вынужденных колебаний, при которой сдвиг фаз между силой и смещением равен p/2. Тогда Для маловязких жидкостей Определяют частоту, при которой амплитуда максимальна, тогда 55
 ТЕМПЕРАТУРНАЯ ЗАВИСИМОСТЬ ВЯЗКОСТИ В соответствии с активационной моделью жидкости, развитой Френкелем, вязкость выражается формулой где G — модуль сдвига, τ — время релаксации. Время релаксации можно представить как время связи атома (иона) с данным положением равновесия в квазирешетке. В этом случае вероятность преодоления потенциального барьера любым атомом (ионом) будет пропорциональна величине Поскольку время пребывания частицы жидкости около данного положения равновесия обратно пропорционально вероятности его перехода в новое положение равновесия, то Это уравнение позволяет определить Еh: 56
ТЕМПЕРАТУРНАЯ ЗАВИСИМОСТЬ ВЯЗКОСТИ В соответствии с активационной моделью жидкости, развитой Френкелем, вязкость выражается формулой где G — модуль сдвига, τ — время релаксации. Время релаксации можно представить как время связи атома (иона) с данным положением равновесия в квазирешетке. В этом случае вероятность преодоления потенциального барьера любым атомом (ионом) будет пропорциональна величине Поскольку время пребывания частицы жидкости около данного положения равновесия обратно пропорционально вероятности его перехода в новое положение равновесия, то Это уравнение позволяет определить Еh: 56
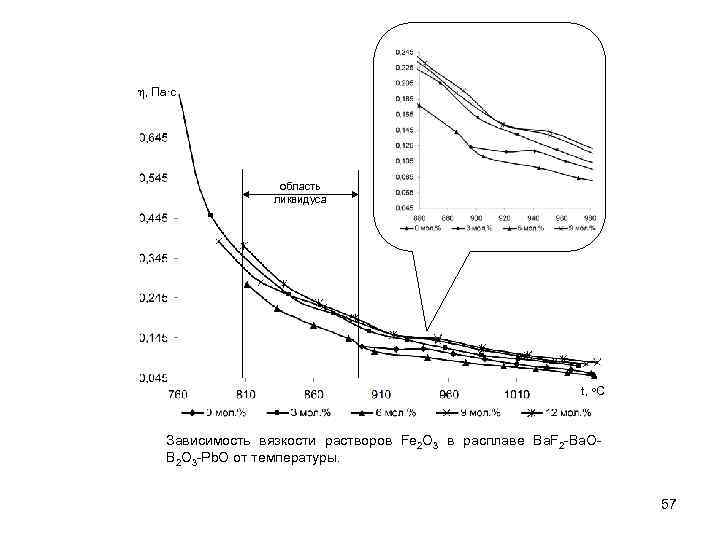 h, Па∙с область ликвидуса t, o. C Зависимость вязкости растворов Fe 2 O 3 в расплаве Ba. F 2 -Ba. OB 2 O 3 -Pb. O от температуры. 57
h, Па∙с область ликвидуса t, o. C Зависимость вязкости растворов Fe 2 O 3 в расплаве Ba. F 2 -Ba. OB 2 O 3 -Pb. O от температуры. 57
 Вязкость эвтектических систем или систем с непрерывным рядом твердых растворов 58
Вязкость эвтектических систем или систем с непрерывным рядом твердых растворов 58
 Вязкость систем с образованием соединений 59
Вязкость систем с образованием соединений 59
 Вязкость систем с расслоением 60
Вязкость систем с расслоением 60
 Вязкость систем с обменным взаимодействием а) вязкость продукта выше вязкости исходных веществ б) вязкость продукта имеет промежуточное значение в) вязкость продукта меньше вязкости исходных веществ 1 – отсутствие взаимодействия 2 -5 – системы с взаимодействием, 2<3<4<5 Вискозиметрия позволяет: • фиксировать слабые взаимодействия в двойных жидких системах • определять стехиометрию взаимодействия 61
Вязкость систем с обменным взаимодействием а) вязкость продукта выше вязкости исходных веществ б) вязкость продукта имеет промежуточное значение в) вязкость продукта меньше вязкости исходных веществ 1 – отсутствие взаимодействия 2 -5 – системы с взаимодействием, 2<3<4<5 Вискозиметрия позволяет: • фиксировать слабые взаимодействия в двойных жидких системах • определять стехиометрию взаимодействия 61
 Плотность Скалярная физическая величина, которая определяется как отношение массы тела к занимаемому этим телом объёму. Исходя из определения плотности, её размерность кг/м³ и г/см³. Плотность находится по формуле: 62
Плотность Скалярная физическая величина, которая определяется как отношение массы тела к занимаемому этим телом объёму. Исходя из определения плотности, её размерность кг/м³ и г/см³. Плотность находится по формуле: 62
 Методы измерения плотности твердых тел: • Гидростатическое взвешивание • волюметрия Приборы для измерения плотности жидкостей: • Пикнометр – прибор для измерения истинной плотности. • Ареометр (денсиметр, плотномер) – измеритель плотности жидкостей. • Поплавковые плотномеры • Массовые плотномеры • Гидростатические плотномеры • Радиоизотопные плотномеры • Вибрационные плотномеры • Ультразвуковые плотномеры 63
Методы измерения плотности твердых тел: • Гидростатическое взвешивание • волюметрия Приборы для измерения плотности жидкостей: • Пикнометр – прибор для измерения истинной плотности. • Ареометр (денсиметр, плотномер) – измеритель плотности жидкостей. • Поплавковые плотномеры • Массовые плотномеры • Гидростатические плотномеры • Радиоизотопные плотномеры • Вибрационные плотномеры • Ультразвуковые плотномеры 63
 Волюметр Пикнометры 64
Волюметр Пикнометры 64
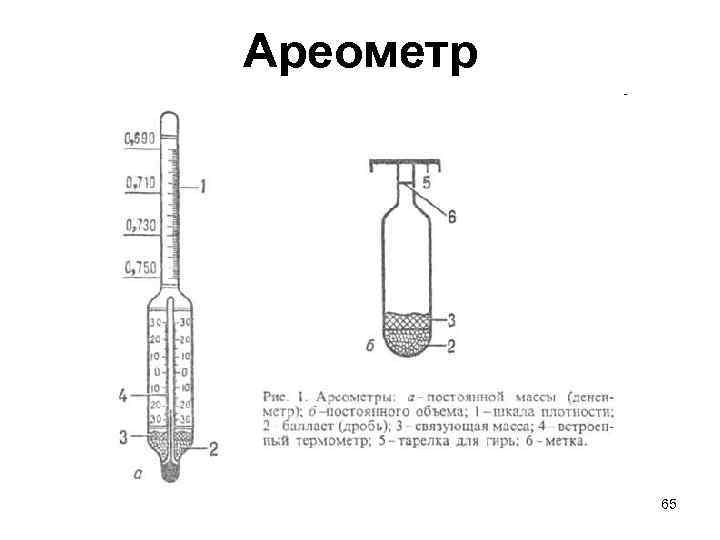 Ареометр 65
Ареометр 65
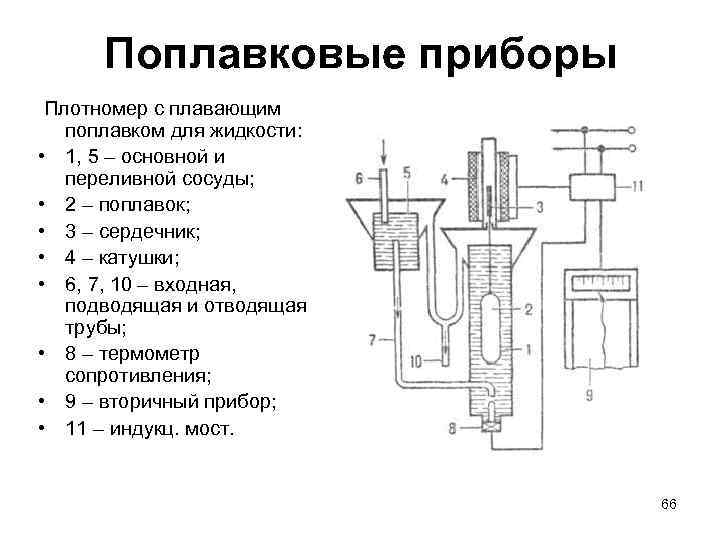 Поплавковые приборы Плотномер с плавающим поплавком для жидкости: • 1, 5 – основной и переливной сосуды; • 2 – поплавок; • 3 – сердечник; • 4 – катушки; • 6, 7, 10 – входная, подводящая и отводящая трубы; • 8 – термометр сопротивления; • 9 – вторичный прибор; • 11 – индукц. мост. 66
Поплавковые приборы Плотномер с плавающим поплавком для жидкости: • 1, 5 – основной и переливной сосуды; • 2 – поплавок; • 3 – сердечник; • 4 – катушки; • 6, 7, 10 – входная, подводящая и отводящая трубы; • 8 – термометр сопротивления; • 9 – вторичный прибор; • 11 – индукц. мост. 66
 Массовые приборы 67
Массовые приборы 67
 Поверхностное натяжение – мера нескомпенсированости межмолекулярных сил у границы раздела фаз, определяется как работа обратимого изотермического образования единицы площади поверхности раздела фаз где U(s) – полная поверхностная энергия слоя, S(s) – поверхностная энтропия слоя, ni(s) – избыток компонента i в поверхностном слое 68
Поверхностное натяжение – мера нескомпенсированости межмолекулярных сил у границы раздела фаз, определяется как работа обратимого изотермического образования единицы площади поверхности раздела фаз где U(s) – полная поверхностная энергия слоя, S(s) – поверхностная энтропия слоя, ni(s) – избыток компонента i в поверхностном слое 68
 Методы измерения поверхностного натяжения жидкости Статические методы: • Метод поднятия в капилляре • Метод Вильгельми • Метод лежачей капли • Метод определения по форме висячей капли • Метод вращающейся капли Динамические методы: • Метод дю Нуи (метод отрыва кольца) • Сталагмометрический, или метод счета капель • Метод максимального давления пузырька • Метод осциллирующей струи • Метод стоячих волн • Метод бегущих волн 69
Методы измерения поверхностного натяжения жидкости Статические методы: • Метод поднятия в капилляре • Метод Вильгельми • Метод лежачей капли • Метод определения по форме висячей капли • Метод вращающейся капли Динамические методы: • Метод дю Нуи (метод отрыва кольца) • Сталагмометрический, или метод счета капель • Метод максимального давления пузырька • Метод осциллирующей струи • Метод стоячих волн • Метод бегущих волн 69
 Метод вращающейся капли Схема вращающегося капилляра с каплей жидкости(а) и капля жидкости (б). 70
Метод вращающейся капли Схема вращающегося капилляра с каплей жидкости(а) и капля жидкости (б). 70
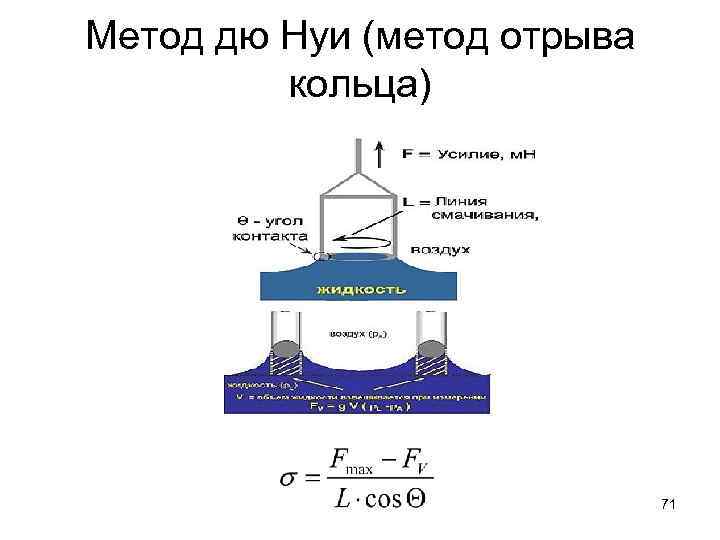 Метод дю Нуи (метод отрыва кольца) 71
Метод дю Нуи (метод отрыва кольца) 71
 Метод Вильгельми 72
Метод Вильгельми 72
 Метод лежачей капли 73
Метод лежачей капли 73
 Метод отрыва пластинки Метод позволяет вычислить поверхностное натяжение непосредственно по экспериментальным данным: DP=POTP – P 0=2 (l+x), где Ротр – вес в момент отрыва пластинки, Р 0 – вес пластинки Рабочим телом может быть кольцо, цилиндр, стержень, пластинка 74
Метод отрыва пластинки Метод позволяет вычислить поверхностное натяжение непосредственно по экспериментальным данным: DP=POTP – P 0=2 (l+x), где Ротр – вес в момент отрыва пластинки, Р 0 – вес пластинки Рабочим телом может быть кольцо, цилиндр, стержень, пластинка 74
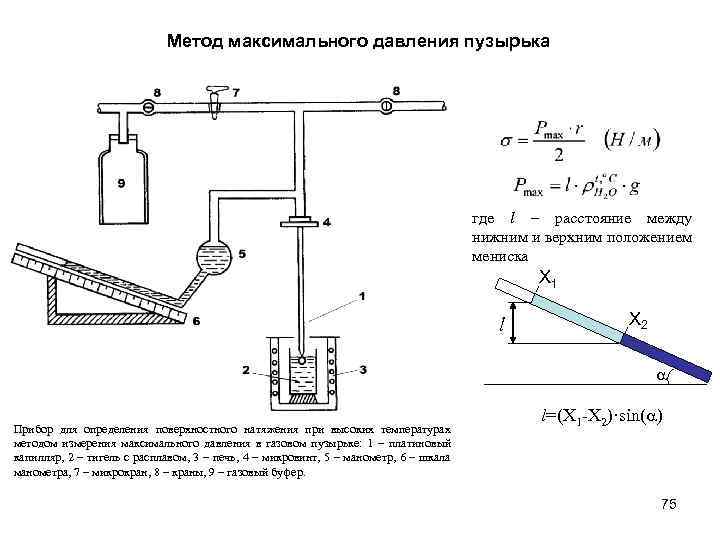 Метод максимального давления пузырька где l – расстояние между нижним и верхним положением мениска X 1 l X 2 a Прибор для определения поверхностного натяжения при высоких температурах методом измерения максимального давления в газовом пузырьке: 1 – платиновый капилляр, 2 – тигель с расплавом, 3 – печь, 4 – микровинт, 5 – манометр, 6 – шкала манометра, 7 – микрокран, 8 – краны, 9 – газовый буфер. l=(X 1 -X 2)·sin(a) 75
Метод максимального давления пузырька где l – расстояние между нижним и верхним положением мениска X 1 l X 2 a Прибор для определения поверхностного натяжения при высоких температурах методом измерения максимального давления в газовом пузырьке: 1 – платиновый капилляр, 2 – тигель с расплавом, 3 – печь, 4 – микровинт, 5 – манометр, 6 – шкала манометра, 7 – микрокран, 8 – краны, 9 – газовый буфер. l=(X 1 -X 2)·sin(a) 75
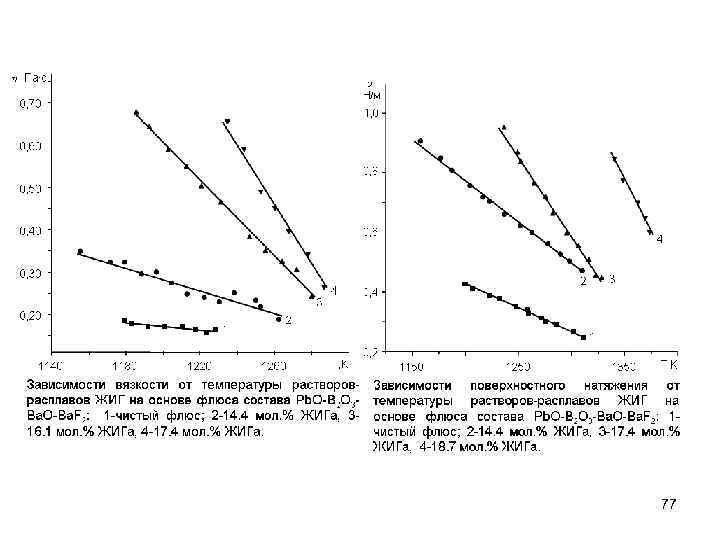
 Температурная зависимость поверхностного натяжения Зависимости поверхностного натяжения расплавов от температуры описываются уравнениями прямой: = a – b T Изломы на линиях коррелируют с изломами на зависимостях вязкости от температуры Согласно кинетической теории жидкостей поверхностное натяжение связано с энергией активации вязкого течения: Eh=4·p ·r 2 · ·NA что позволяет определить объем единицы течения Зависимость поверхностного натяжения от температуры в различных растворителях 76
Температурная зависимость поверхностного натяжения Зависимости поверхностного натяжения расплавов от температуры описываются уравнениями прямой: = a – b T Изломы на линиях коррелируют с изломами на зависимостях вязкости от температуры Согласно кинетической теории жидкостей поверхностное натяжение связано с энергией активации вязкого течения: Eh=4·p ·r 2 · ·NA что позволяет определить объем единицы течения Зависимость поверхностного натяжения от температуры в различных растворителях 76
 77
77
 Зависимость поверхностного натяжения от состава 1) продукта выше исходных веществ (фенол – пиперидин) 2) продукта меньше исходных веществ (вода – хлораль) 3) продукта имеет промежуточное значение (вода – уксусная кислота) 78
Зависимость поверхностного натяжения от состава 1) продукта выше исходных веществ (фенол – пиперидин) 2) продукта меньше исходных веществ (вода – хлораль) 3) продукта имеет промежуточное значение (вода – уксусная кислота) 78
 Электропроводность – способность вещества проводить электрический ток; величина, обратная сопротивлению Электропроводность не может быть ни в явной, ни в неявной форме связана с величинами свойств компонентов, поскольку большая часть электропроводных жидких систем образована непроводящими ток компонентами. Принято пользоваться диаграммами «удельная электропроводность — состав» . Поскольку электропроводность относится к заведомо неаддитивным свойствам, способ выражения концентрации при этом может быть произвольным, однако для наглядности чаще всего выбирают мольные доли. 79
Электропроводность – способность вещества проводить электрический ток; величина, обратная сопротивлению Электропроводность не может быть ни в явной, ни в неявной форме связана с величинами свойств компонентов, поскольку большая часть электропроводных жидких систем образована непроводящими ток компонентами. Принято пользоваться диаграммами «удельная электропроводность — состав» . Поскольку электропроводность относится к заведомо неаддитивным свойствам, способ выражения концентрации при этом может быть произвольным, однако для наглядности чаще всего выбирают мольные доли. 79
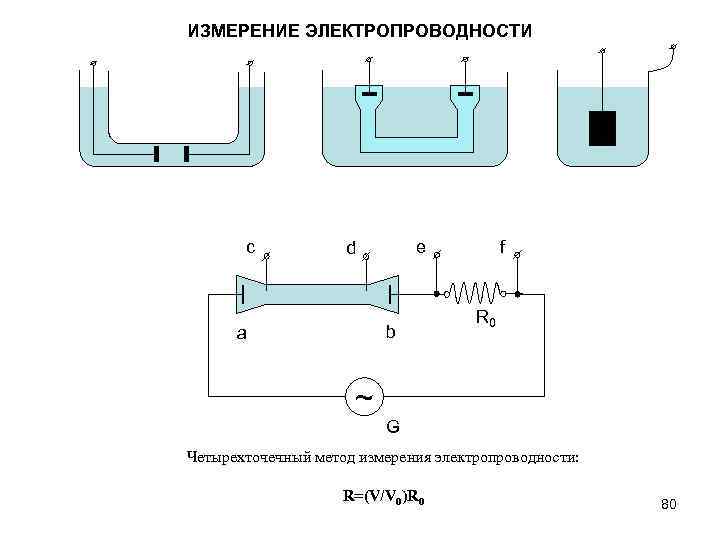 ИЗМЕРЕНИЕ ЭЛЕКТРОПРОВОДНОСТИ c e d b a f R 0 ~ G Четырехточечный метод измерения электропроводности: R=(V/V 0)R 0 80
ИЗМЕРЕНИЕ ЭЛЕКТРОПРОВОДНОСТИ c e d b a f R 0 ~ G Четырехточечный метод измерения электропроводности: R=(V/V 0)R 0 80
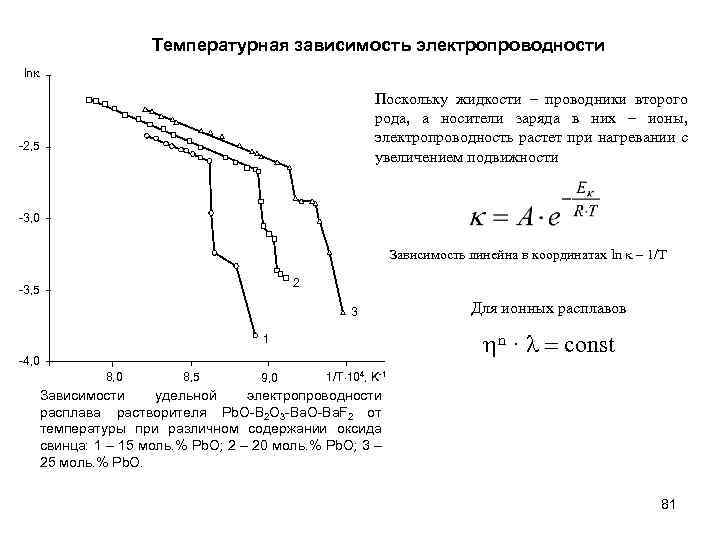 Температурная зависимость электропроводности ln Поскольку жидкости – проводники второго рода, а носители заряда в них – ионы, электропроводность растет при нагревании с увеличением подвижности -2, 5 -3, 0 Зависимость линейна в координатах ln – 1/T 2 -3, 5 3 hn · l = const 1 -4, 0 8, 5 9, 0 Для ионных расплавов 1/T 104, K-1 Зависимости удельной электропроводности расплава растворителя Pb. O-В 2 O 3 -Ba. O-Ba. F 2 от температуры при различном содержании оксида свинца: 1 – 15 моль. % Pb. O; 2 – 20 моль. % Pb. O; 3 – 25 моль. % Pb. O. 81
Температурная зависимость электропроводности ln Поскольку жидкости – проводники второго рода, а носители заряда в них – ионы, электропроводность растет при нагревании с увеличением подвижности -2, 5 -3, 0 Зависимость линейна в координатах ln – 1/T 2 -3, 5 3 hn · l = const 1 -4, 0 8, 5 9, 0 Для ионных расплавов 1/T 104, K-1 Зависимости удельной электропроводности расплава растворителя Pb. O-В 2 O 3 -Ba. O-Ba. F 2 от температуры при различном содержании оксида свинца: 1 – 15 моль. % Pb. O; 2 – 20 моль. % Pb. O; 3 – 25 моль. % Pb. O. 81
 Электропроводность при отсутствии химического взаимодействия компонентов (электролит А – индиферрентный растворитель В) 82
Электропроводность при отсутствии химического взаимодействия компонентов (электролит А – индиферрентный растворитель В) 82
 Т, К 1300 1200 1100 0 5 (Pb. O-B 2 O 3 -Ba. O-Ba. F 2) 10 15 20 25 Y 3 Fe 5 O 12 мол. % Квазибинарная диаграмма системы Y 3 Fe 5 O 12 – (Pb. O-B 2 O 3 -Ba. O-Ba. F 2) (по измерениям электропроводности) 83
Т, К 1300 1200 1100 0 5 (Pb. O-B 2 O 3 -Ba. O-Ba. F 2) 10 15 20 25 Y 3 Fe 5 O 12 мол. % Квазибинарная диаграмма системы Y 3 Fe 5 O 12 – (Pb. O-B 2 O 3 -Ba. O-Ba. F 2) (по измерениям электропроводности) 83


