Презентация11-n.ppt
- Количество слайдов: 55

Использование модифицированных олигонуклеотидов в молекулярной биологии и медицине
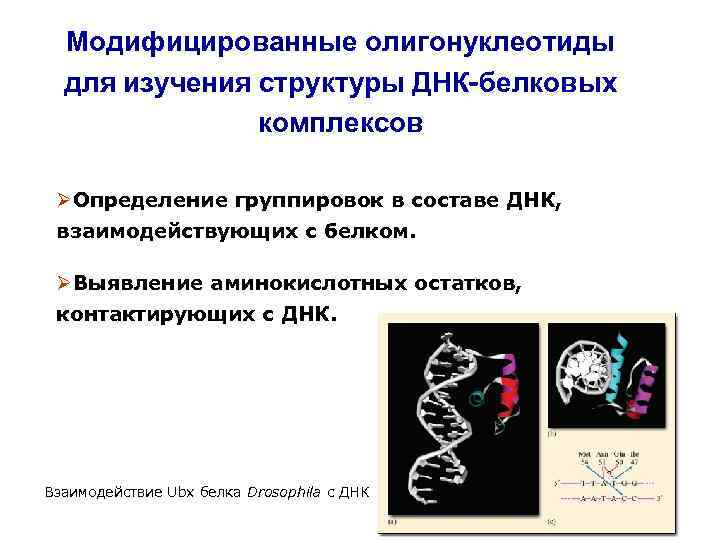
Модифицированные олигонуклеотиды для изучения структуры ДНК-белковых комплексов ØОпределение группировок в составе ДНК, взаимодействующих с белком. ØВыявление аминокислотных остатков, контактирующих с ДНК. Взаимодействие Ubx белка Drosophila с ДНК
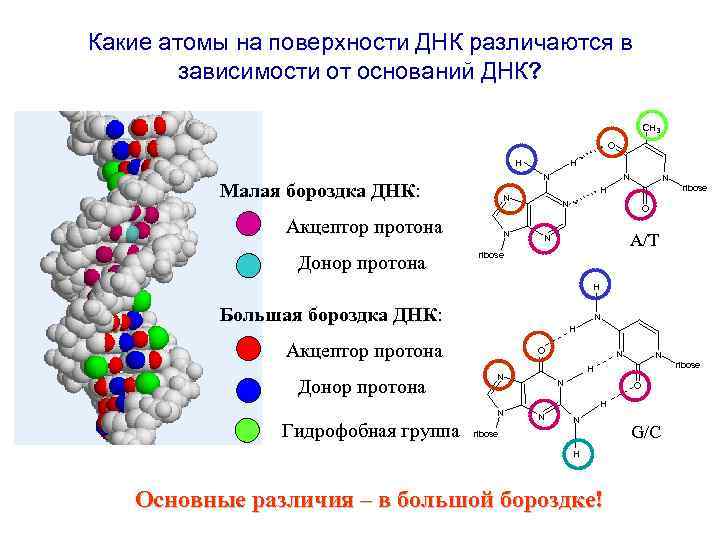
Какие атомы на поверхности ДНК различаются в зависимости от оснований ДНК? . . H H O N Малая бороздка ДНК: N N N ribose H N. N Акцептор протона Донор протона CH 3 O A/T N ribose H Большая бороздка ДНК: N H Акцептор протона Донор протона O Гидрофобная группа N ribose H N N O H N N ribose H Основные различия – в большой бороздке! G/C
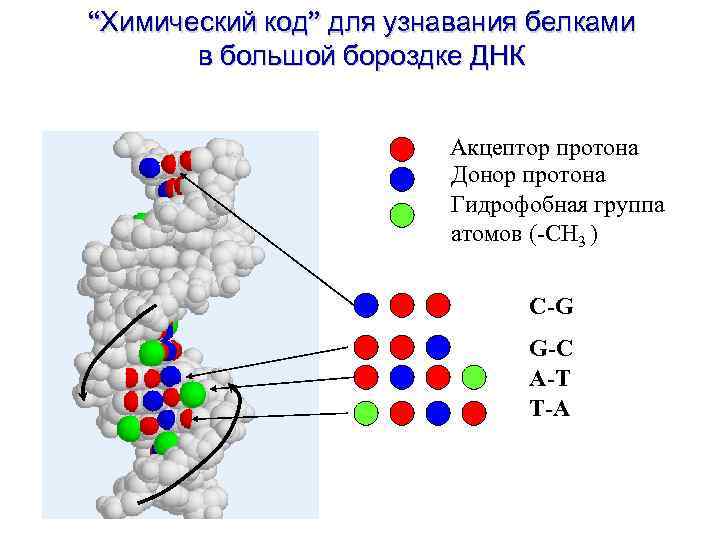
“Химический код” для узнавания белками в большой бороздке ДНК Акцептор протона Донор протона Гидрофобная группа атомов (-CH 3 ) C-G G-C A-T T-A
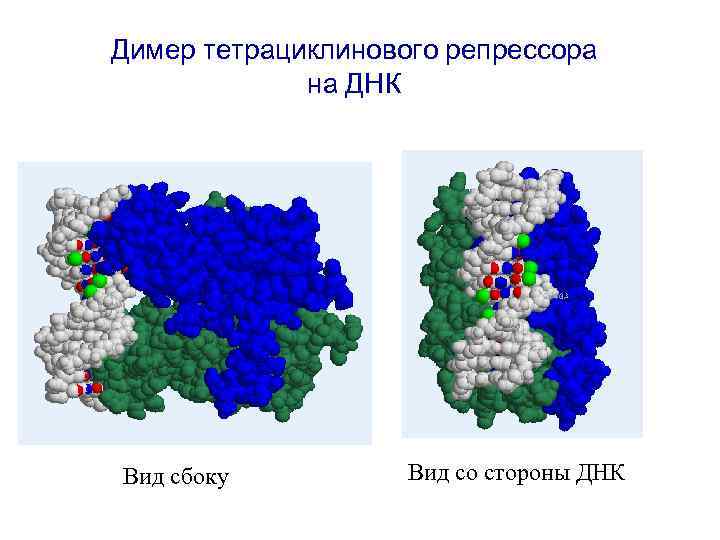
Димер тетрациклинового репрессора на ДНК Вид сбоку Вид со стороны ДНК
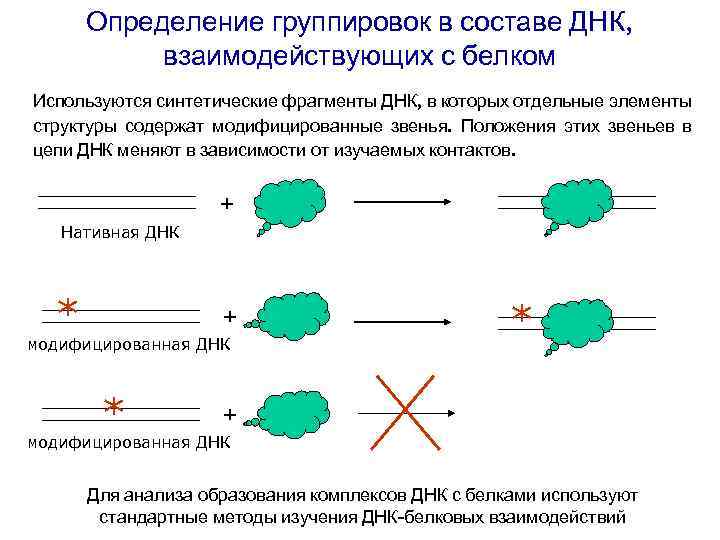
Определение группировок в составе ДНК, взаимодействующих с белком Используются синтетические фрагменты ДНК, в которых отдельные элементы структуры содержат модифицированные звенья. Положения этих звеньев в цепи ДНК меняют в зависимости от изучаемых контактов. + Нативная ДНК * + модифицированная ДНК * * + модифицированная ДНК Для анализа образования комплексов ДНК с белками используют стандартные методы изучения ДНК-белковых взаимодействий
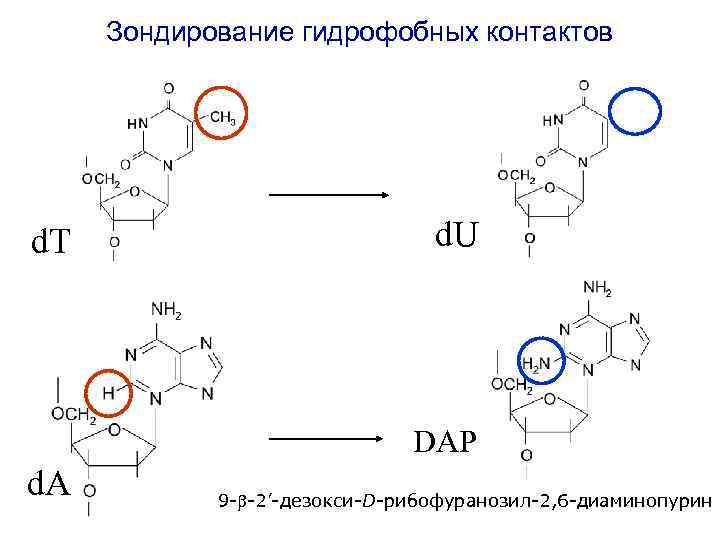
Зондирование гидрофобных контактов d. T d. U DAP d. A 9 - -2’-дезокси-D-рибофуранозил-2, 6 -диаминопурин
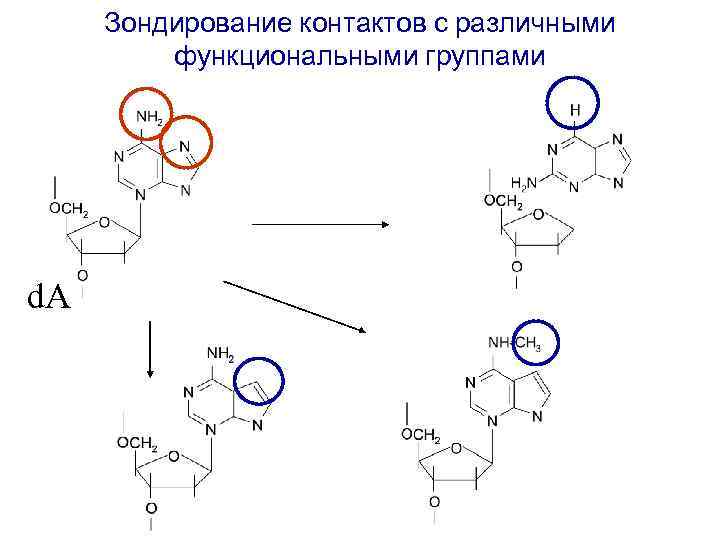
Зондирование контактов с различными функциональными группами d. A
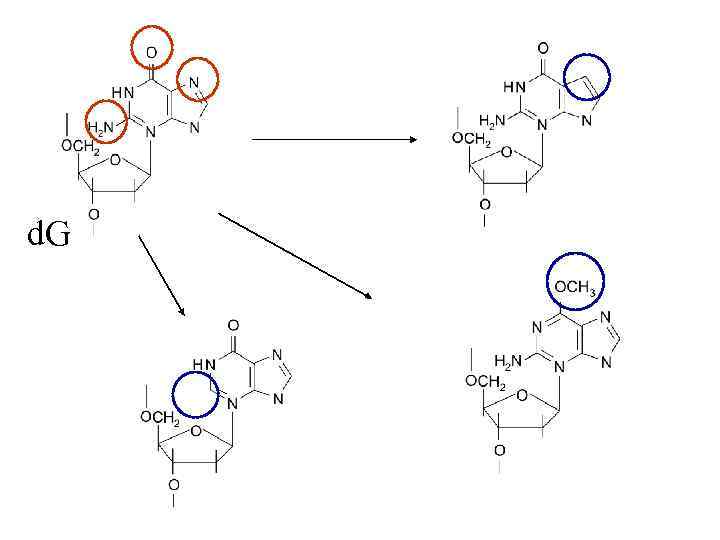
d. G
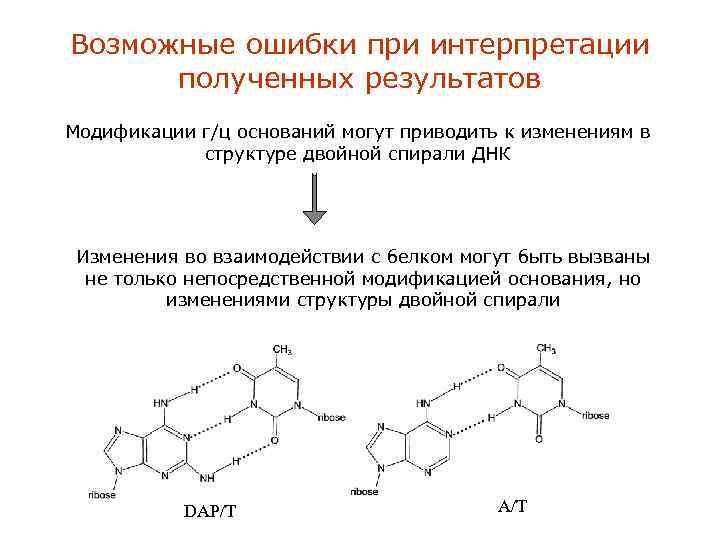
Возможные ошибки при интерпретации полученных результатов Модификации г/ц оснований могут приводить к изменениям в структуре двойной спирали ДНК Изменения во взаимодействии с белком могут быть вызваны не только непосредственной модификацией основания, но изменениями структуры двойной спирали DAP/T A/T
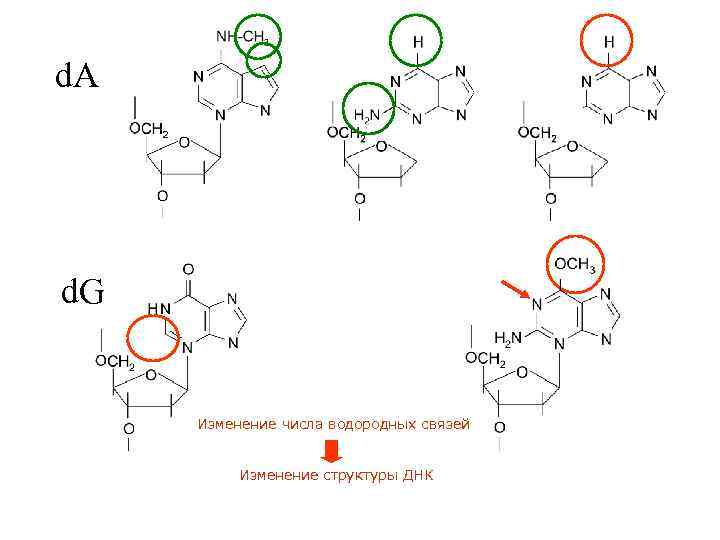
d. A d. G Изменение числа водородных связей Изменение структуры ДНК
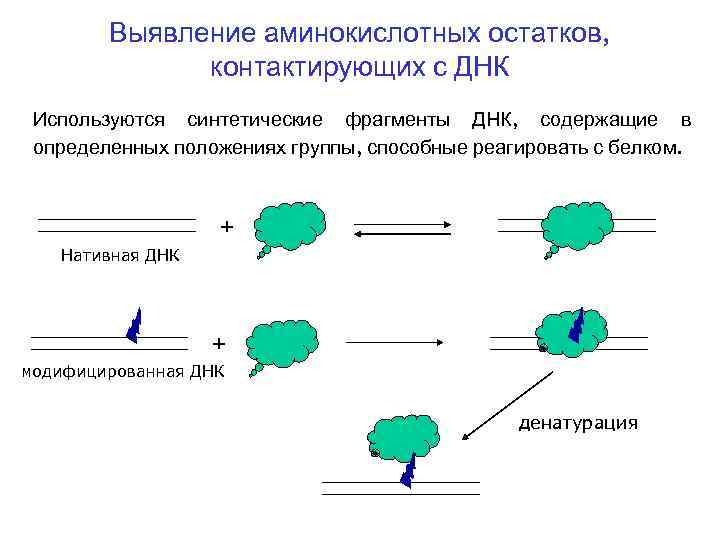
Выявление аминокислотных остатков, контактирующих с ДНК Используются синтетические фрагменты ДНК, содержащие в определенных положениях группы, способные реагировать с белком. + Нативная ДНК + модифицированная ДНК денатурация
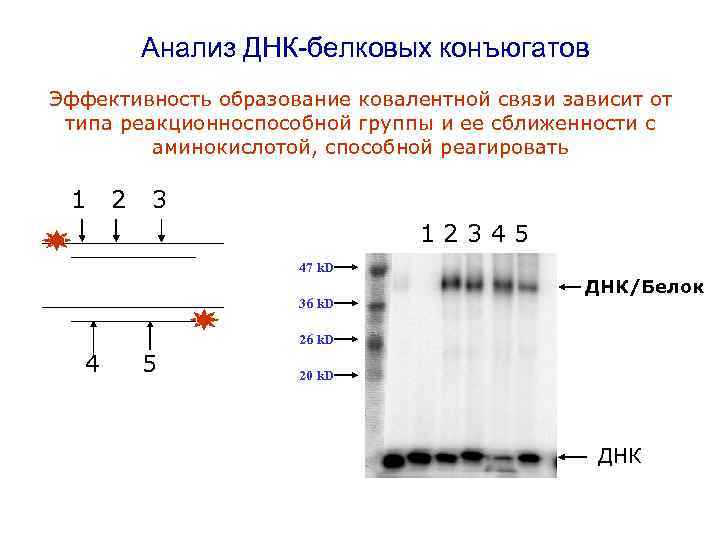
Анализ ДНК-белковых конъюгатов Эффективность образование ковалентной связи зависит от типа реакционноспособной группы и ее сближенности с аминокислотой, способной реагировать 1 2 3 12345 47 k. D 36 k. D ДНК/Белок 26 k. D 4 5 20 k. D ДНК
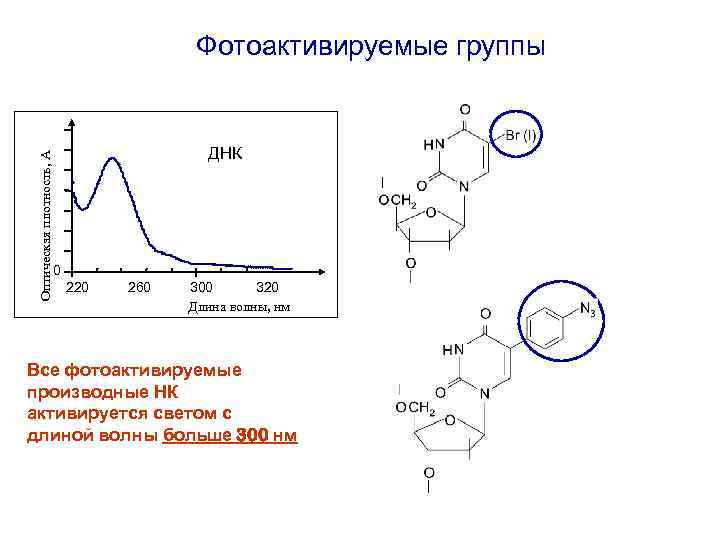
Оптическая плотность, А Фотоактивируемые группы ДНК 0 220 260 300 320 Длина волны, нм Все фотоактивируемые производные НК активируется светом с длиной волны больше 300 нм
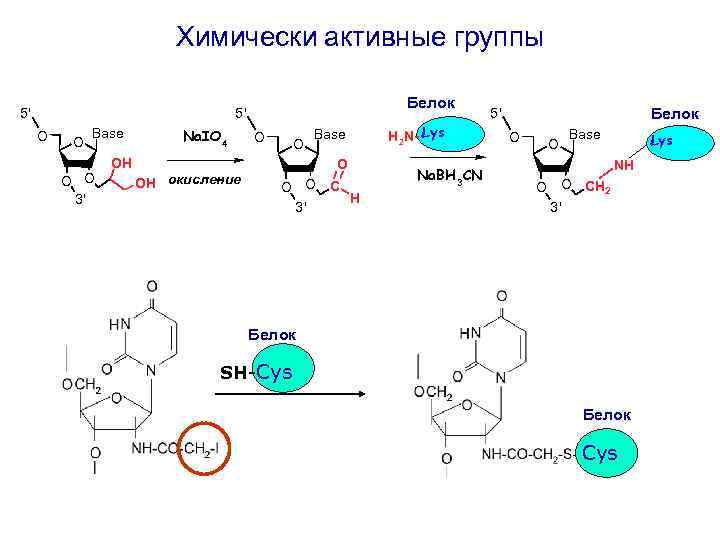
Химически активные группы Белок 5' 5' O O Base O O 3' Na. IO 4 O O Base OH OH окисление O O O C H 3' H 2 N- Lys Na. BH 3 CN Белок 5' O O Base Lys NH O O CH 2 3' 2 1 Белок SH-Cys Белок Cys
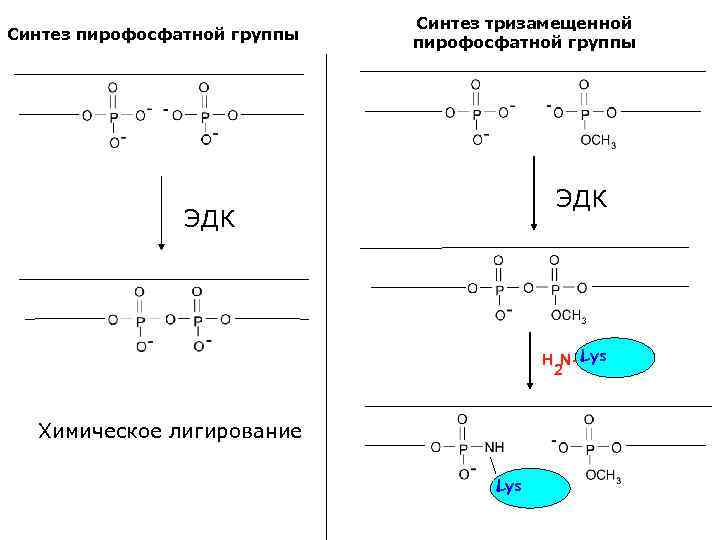
Синтез пирофосфатной группы Синтез тризамещенной пирофосфатной группы ЭДК H N- Lys 2 Химическое лигирование Lys
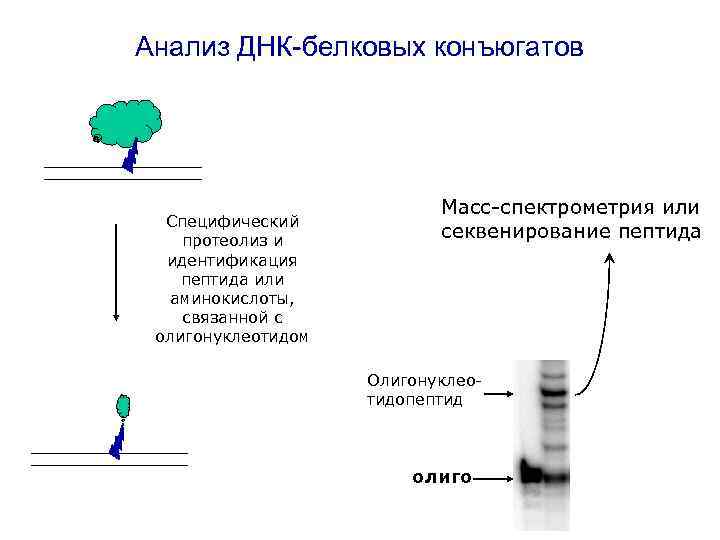
Анализ ДНК-белковых конъюгатов Специфический протеолиз и идентификация пептида или аминокислоты, связанной с олигонуклеотидом Масс-спектрометрия или секвенирование пептида Олигонуклеотидопептид олиго

Общая стратегия анализа взаимодействий в ДНК-белковых комплексах ü Выделение ДНК-белкового комплекса и выяснение его устойчивости ü Установление «площади посадки» белка на ДНК методом футпринтинга ü Установление функциональных групп ДНК, взаимодействующих с белком, методом интерференции и с использованием модифицированных ДНК ü Определение аминокислотных остатков белка, взаимодействующих с ДНК, методом кросс-линкинга с последующей масс-спектрометрией ü Подтверждение правильности определения аминокислот путем сайт-направленного мутагенеза

Использование модифицированных олигонуклеотидов в гибридизационной диагностике Основано на способности олигонуклеотидов образовывать специфические комплексы с комплементарными последовательностями ДНК и РНК
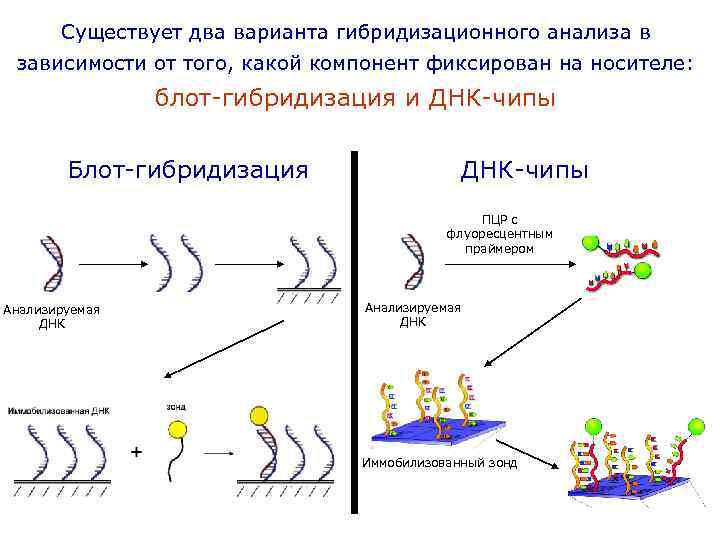
Существует два варианта гибридизационного анализа в зависимости от того, какой компонент фиксирован на носителе: блот-гибридизация и ДНК-чипы Блот-гибридизация ДНК-чипы ПЦР с флуоресцентным праймером Анализируемая ДНК Иммобилизованный зонд
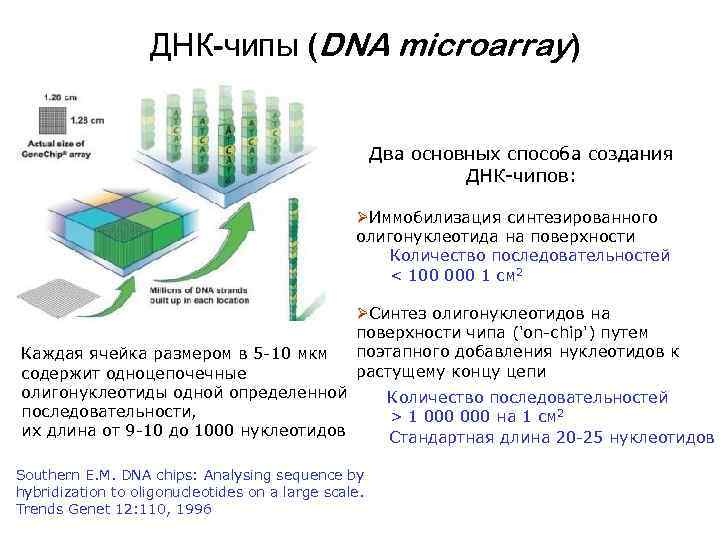
ДНК-чипы (DNA microarray) Два основных способа создания ДНК-чипов: ØИммобилизация синтезированного олигонуклеотида на поверхности Количество последовательностей < 100 000 1 см 2 Каждая ячейка размером в 5 -10 мкм содержит одноцепочечные олигонуклеотиды одной определенной последовательности, их длина от 9 -10 до 1000 нуклеотидов ØСинтез олигонуклеотидов на поверхности чипа ('on-chip') путем поэтапного добавления нуклеотидов к растущему концу цепи Southern E. M. DNA chips: Analysing sequence by hybridization to oligonucleotides on a large scale. Trends Genet 12: 110, 1996 Количество последовательностей > 1 000 на 1 см 2 Стандартная длина 20 -25 нуклеотидов
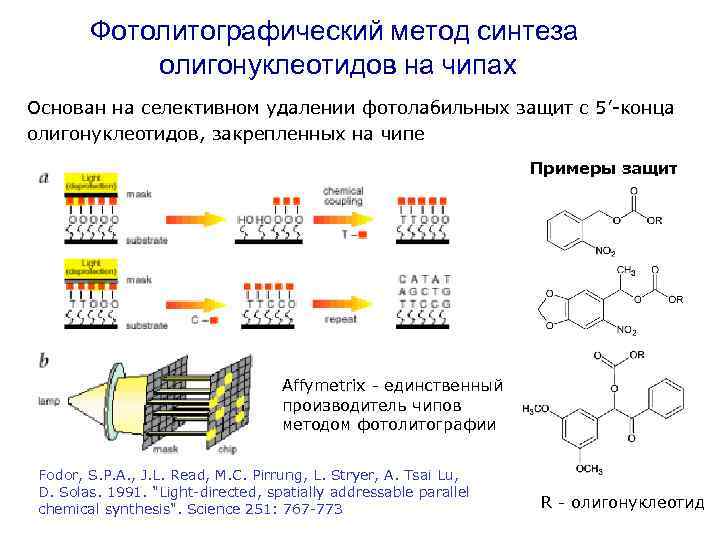
Фотолитографический метод синтеза олигонуклеотидов на чипах Основан на селективном удалении фотолабильных защит с 5’-конца олигонуклеотидов, закрепленных на чипе Примеры защит Affymetrix - единственный производитель чипов методом фотолитографии Fodor, S. P. A. , J. L. Read, M. C. Pirrung, L. Stryer, A. Tsai Lu, D. Solas. 1991. "Light-directed, spatially addressable parallel chemical synthesis". Science 251: 767 -773 R - олигонуклеотид
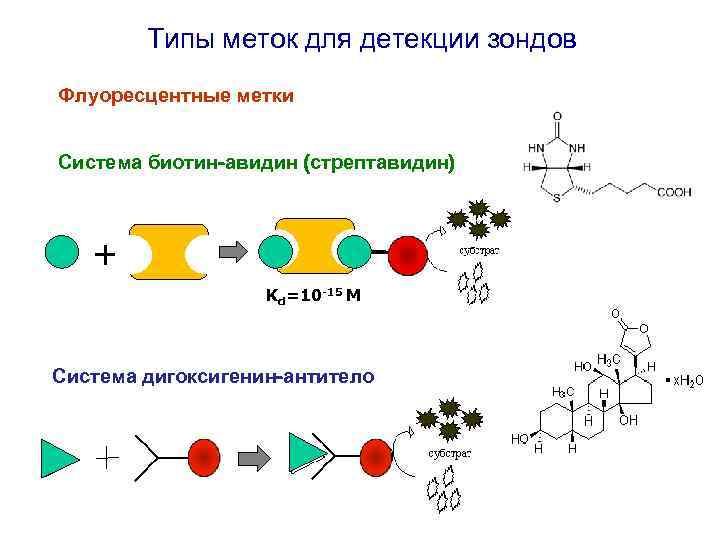
Типы меток для детекции зондов Флуоресцентные метки Система биотин-авидин (стрептавидин) + Kd=10 -15 M Система дигоксигенин-антитело
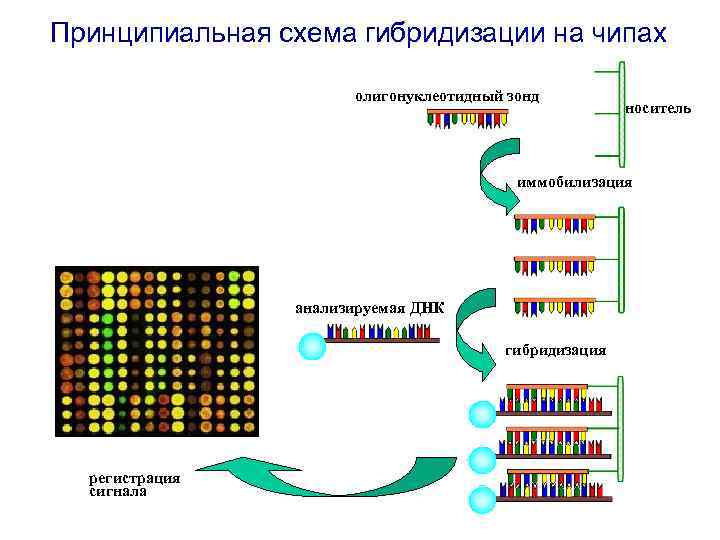
Принципиальная схема гибридизации на чипах олигонуклеотидный зонд носитель иммобилизация анализируемая ДНК гибридизация регистрация сигнала
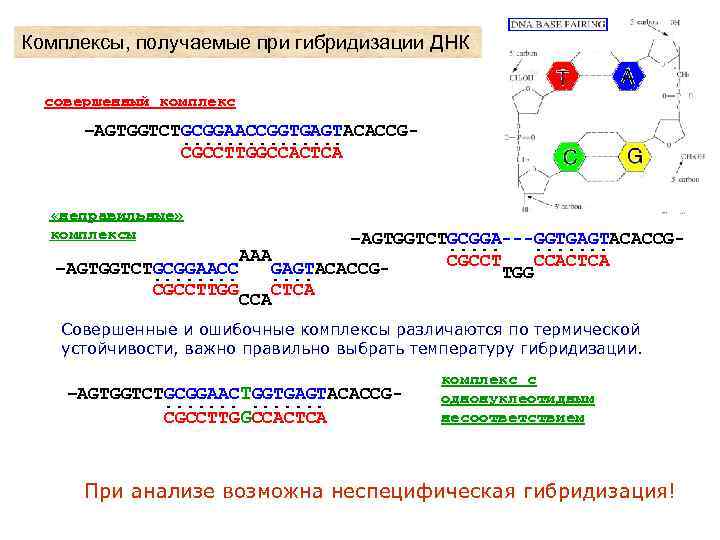
Комплексы, получаемые при гибридизации ДНК совершенный комплекс –AGTGGTCTGCGGAACCGGTGAGTACACCG. . . . CGCCTTGGCCACTCA «неправильные» комплексы –AGTGGTCTGCGGA---GGTGAGTACACCG. . . AAA CGCCT CCACTCA –AGTGGTCTGCGGAACC GAGTACACCGTGG. . . CGCCTTGG CTCA CCA Совершенные и ошибочные комплексы различаются по термической устойчивости, важно правильно выбрать температуру гибридизации. –AGTGGTCTGCGGAACTGGTGAGTACACCG. . . CGCCTTGGCCACTCA комплекс с однонуклеотидным несоответствием При анализе возможна неспецифическая гибридизация!
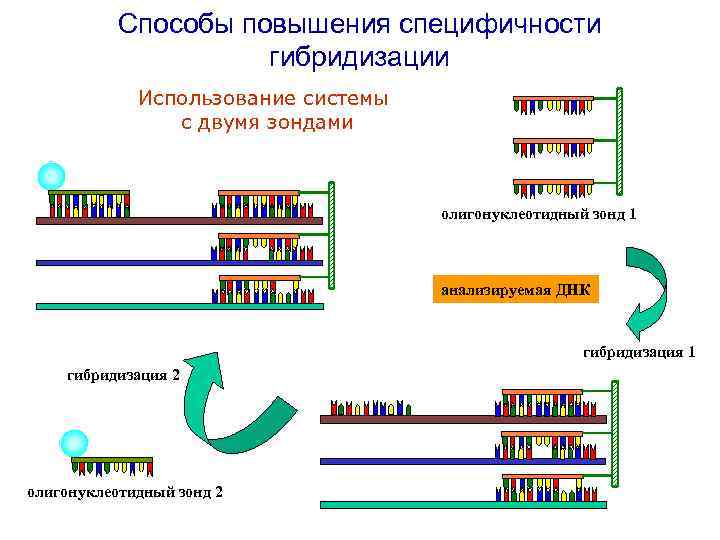
Способы повышения специфичности гибридизации Использование системы с двумя зондами олигонуклеотидный зонд 1 анализируемая ДНК гибридизация 1 гибридизация 2 олигонуклеотидный зонд 2
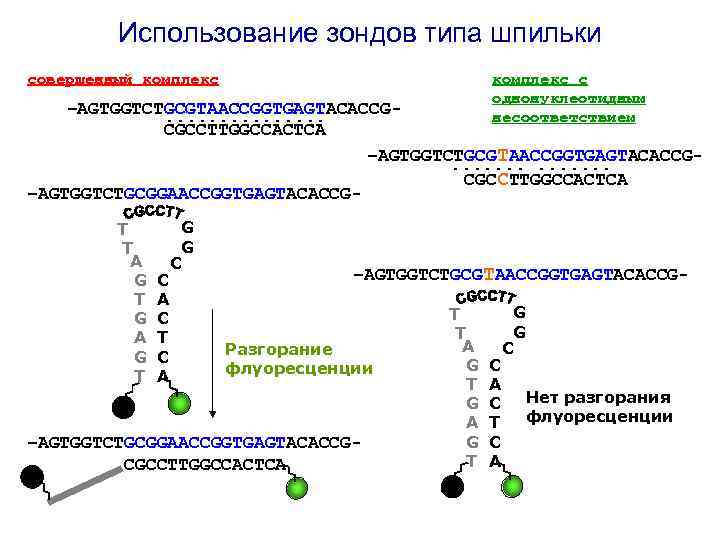
Использование зондов типа шпильки совершенный комплекс с однонуклеотидным несоответствием –AGTGGTCTGCGTAACCGGTGAGTACACCG. . . . CGCCTTGGCCACTCA –AGTGGTCTGCGTAACCGGTGAGTACACCG. . . CGCCTTGGCCACTCA –AGTGGTCTGCGGAACCGGTGAGTACACCGT T A G T G A G T C A C T C A G G C –AGTGGTCTGCGTAACCGGTGAGTACACCG- Разгорание флуоресценции –AGTGGTCTGCGGAACCGGTGAGTACACCGCGCCTTGGCCACTCA T T A G T G A G T C A C T C A G G C Нет разгорания флуоресценции
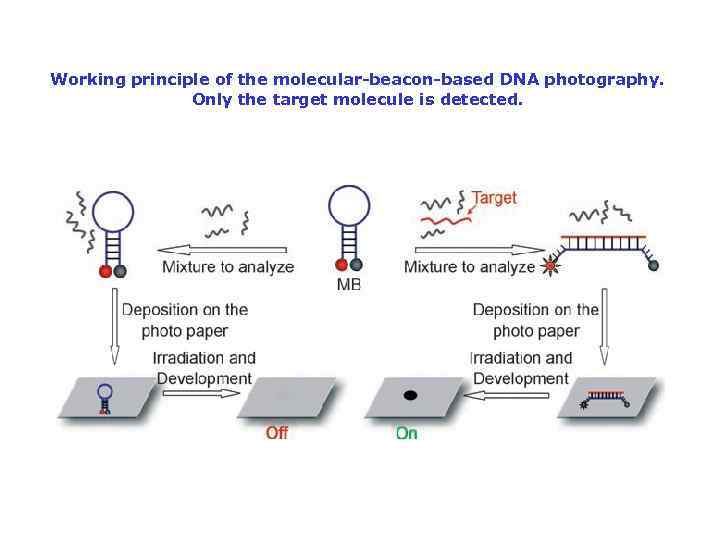
Working principle of the molecular-beacon-based DNA photography. Only the target molecule is detected.
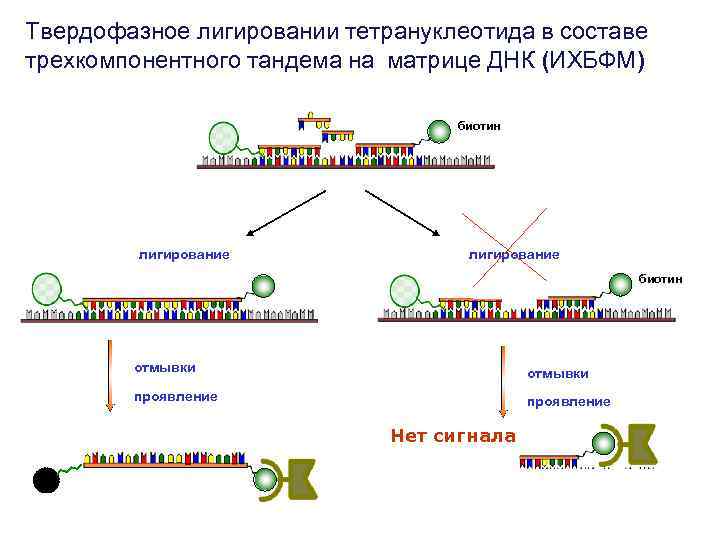
Твердофазное лигировании тетрануклеотида в составе трехкомпонентного тандема на матрице ДНК (ИХБФМ) биотин лигирование биотин отмывки проявление Нет сигнала

Лигирование коротких олигонуклеотидов возможно только при отсутствии «ошибок» в сайте связывания тетрануклеотида М – 20 -звенная последовательность, соответствующая одной из цепей к. ДНК гена env ВИЧ-1 x 2 x 3 x 4 N нет M нет П~p. N 8 Предложенный подход позволяет достоверно тестировать однонуклеотидные замены

Применение ДНК-чипов Ø Идентификация мутаций в генах, связанных с различными заболеваниями Ø Наблюдение за активностью генов (анализ экспрессии) Ø Диагностика инфекционных заболеваний и определение наиболее эффективного метода антибиотикотерапии Ø Идентификация генов, важных для нормального развития различных организмов Ø Скрининг микроорганизмов, как патогенных, так и полезных
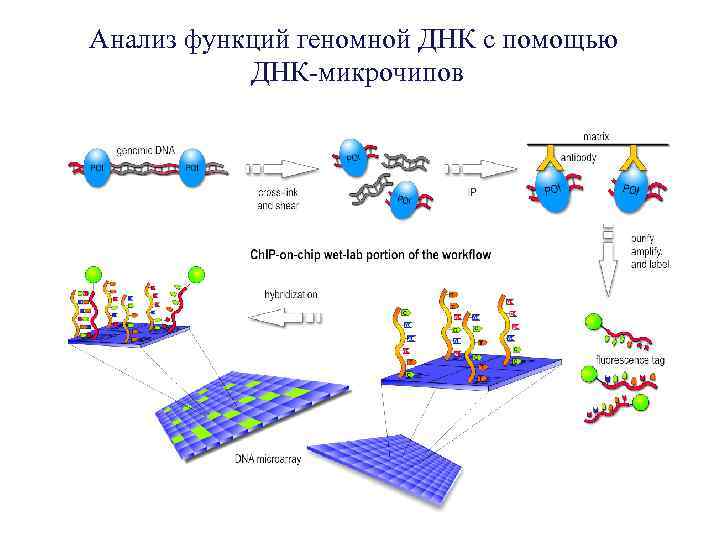
Анализ функций геномной ДНК с помощью ДНК-микрочипов
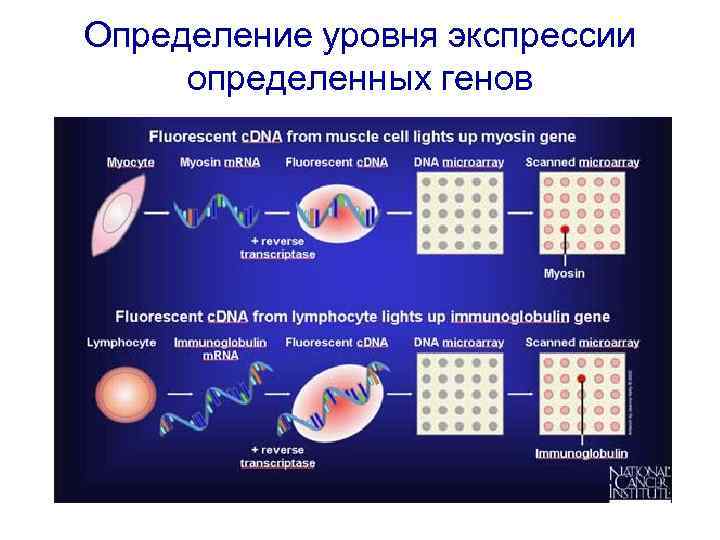
Определение уровня экспрессии определенных генов
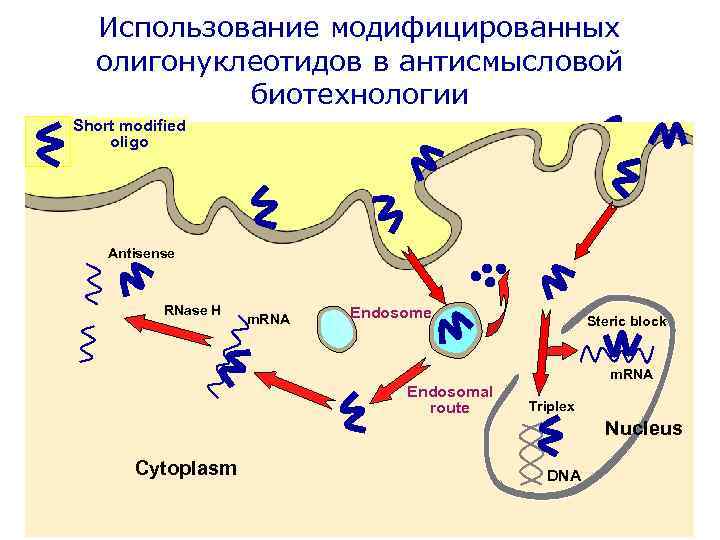
Использование модифицированных олигонуклеотидов в антисмысловой биотехнологии Short modified oligo Antisense RNase H m. RNA Endosome Steric block m. RNA Endosomal route Triplex Nucleus Cytoplasm DNA

Основные проблемы Немодифицированные олигонуклеотиды ØПодвержены быстрому гидролизу нуклеазами ØПлохо проникают в клетки ØМогут обладать побочными эффектами за счет неспецифического связывания с нецелевыми последовательностями РНК
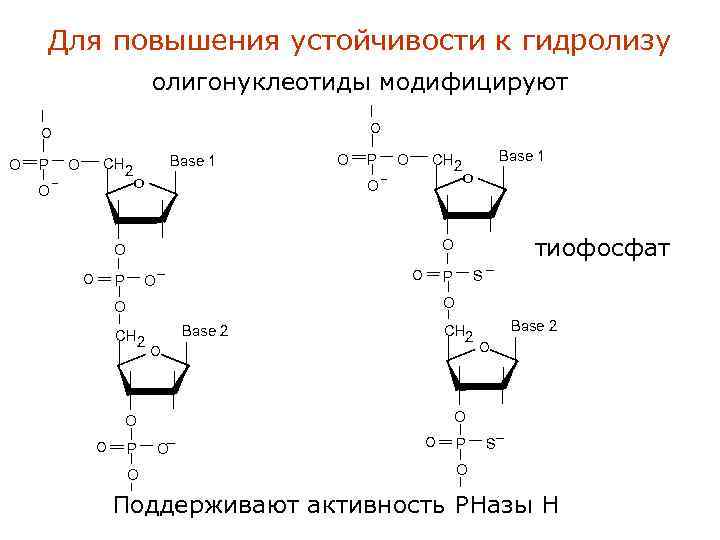
Для повышения устойчивости к гидролизу олигонуклеотиды модифицируют O O CH 2 O P _ Base 1 O O O CH 2 O P _ O S P тиофосфат _ O O CH 2 O O O Base 1 P O Base 2 CH 2 О Base 2 О O _ O O P S _ O Поддерживают активность РНазы Н
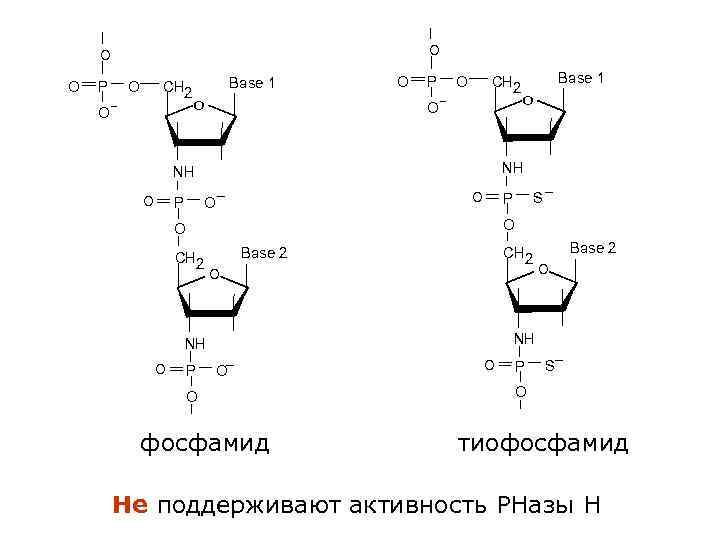
O O CH 2 O P _ Base 1 O O O CH 2 O P _ O S P _ O O CH 2 NH O O NH NH O Base 1 P Base 2 CH 2 О Base 2 О NH _ O O фосфамид O P S _ O тиофосфамид Не поддерживают активность РНазы Н
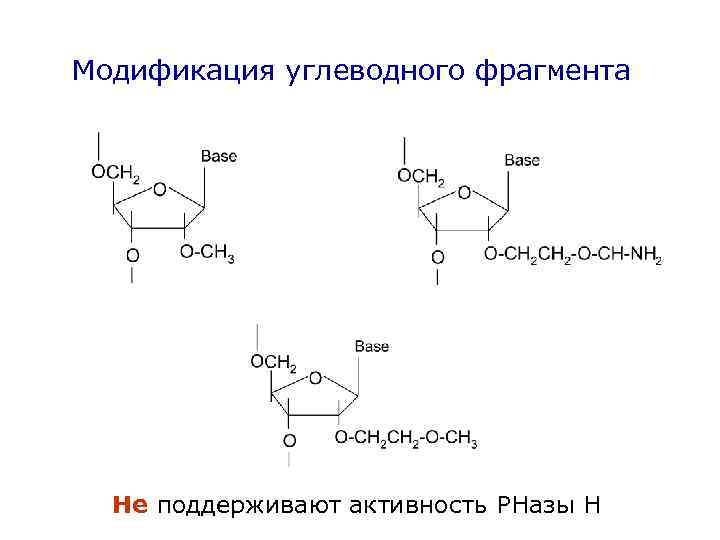
Модификация углеводного фрагмента Не поддерживают активность РНазы Н
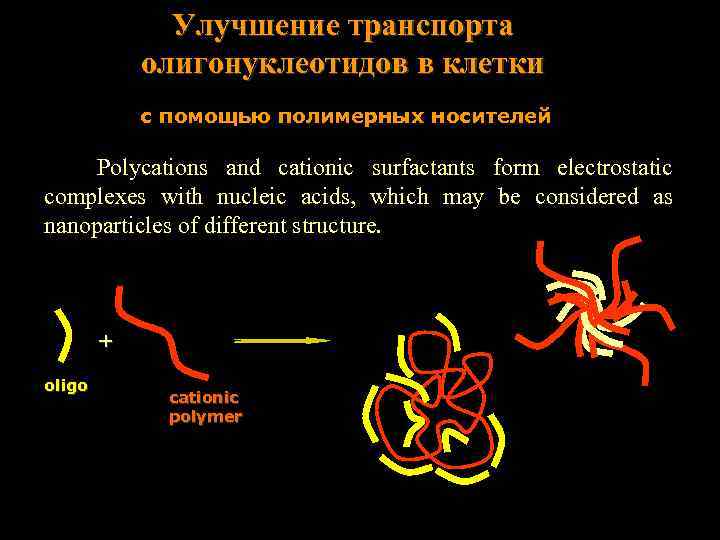
Улучшение транспорта олигонуклеотидов в клетки с помощью полимерных носителей Polycations and cationic surfactants form electrostatic complexes with nucleic acids, which may be considered as nanoparticles of different structure. + oligo cationic polymer
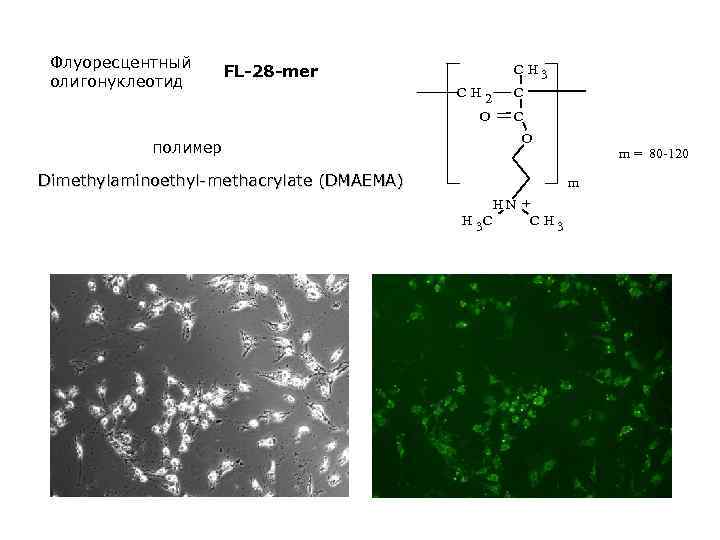
Флуоресцентный олигонуклеотид FL-28 -mer полимер CH 3 CH 2 O C C O Dimethylaminoethyl-methacrylate (DMAEMA) m = 80 -120 m HN + H 3 C C H 3
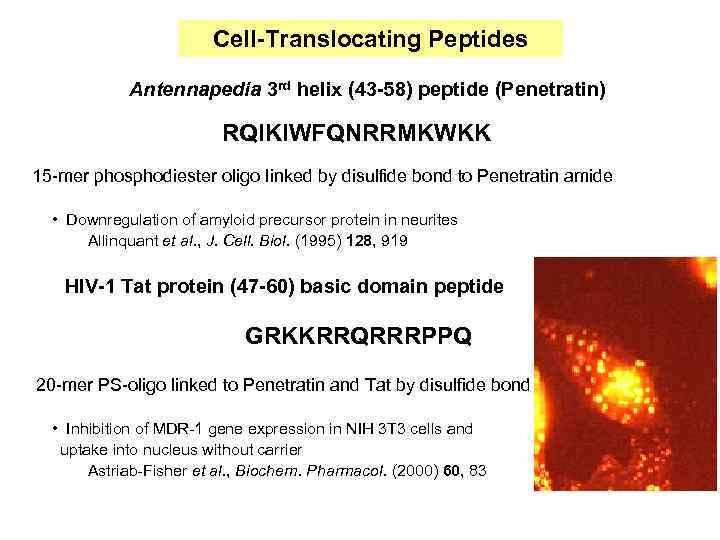
Cell-Translocating Peptides Antennapedia 3 rd helix (43 -58) peptide (Penetratin) RQIKIWFQNRRMKWKK 15 -mer phosphodiester oligo linked by disulfide bond to Penetratin amide • Downregulation of amyloid precursor protein in neurites Allinquant et al. , J. Cell. Biol. (1995) 128, 919 HIV-1 Tat protein (47 -60) basic domain peptide GRKKRRQRRRPPQ 20 -mer PS-oligo linked to Penetratin and Tat by disulfide bond • Inhibition of MDR-1 gene expression in NIH 3 T 3 cells and uptake into nucleus without carrier Astriab-Fisher et al. , Biochem. Pharmacol. (2000) 60, 83
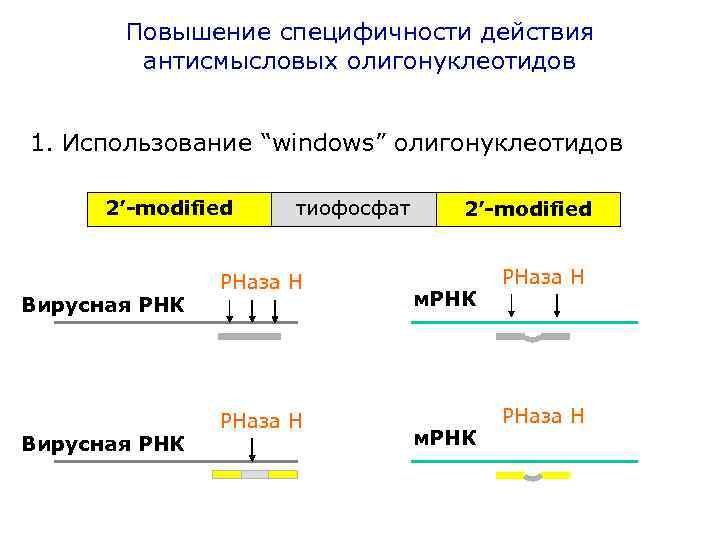
Повышение специфичности действия антисмысловых олигонуклеотидов 1. Использование “windows” олигонуклеотидов 2’-modified Вирусная РНК тиофосфат РНаза Н 2’-modified м. РНК РНаза Н

2. Использование олигонуклеотидов типа шпилки совершенный комплекс с однонуклеотидным несоответствием –AGTGGTCTGCGTAACCGGTGAGTACACCG. . . . CGCCTTGGCCACTCA –AGTGGTCTGCGTAACCGGTGAGTACACCG. . . CGCCTTGGCCACTCA –AGTGGTCTGCGGAACCGGTGAGTACACCGT T A G T G A G T C A C T C A G G C –AGTGGTCTGCGTAACCGGTGAGTACACCG- –AGTGGTCTGCGGAACCGGTGAGTACACCGCGCCTTGGCCACTCA T T A G T G A G T C A C T C A G G C
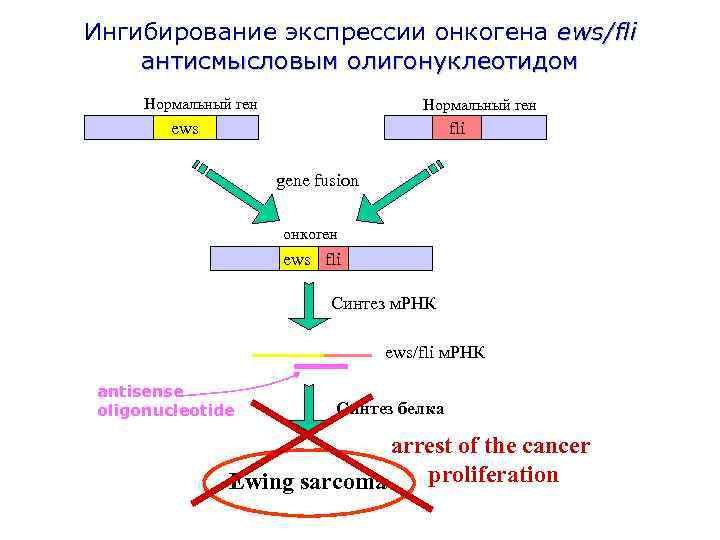
Ингибирование экспрессии онкогена ews/fli антисмысловым олигонуклеотидом Нормальный ген fli ews gene fusion онкоген ews fli Синтез м. РНК ews/fli м. РНК antisense oligonucleotide Синтез белка arrest of the cancer proliferation Ewing sarcoma
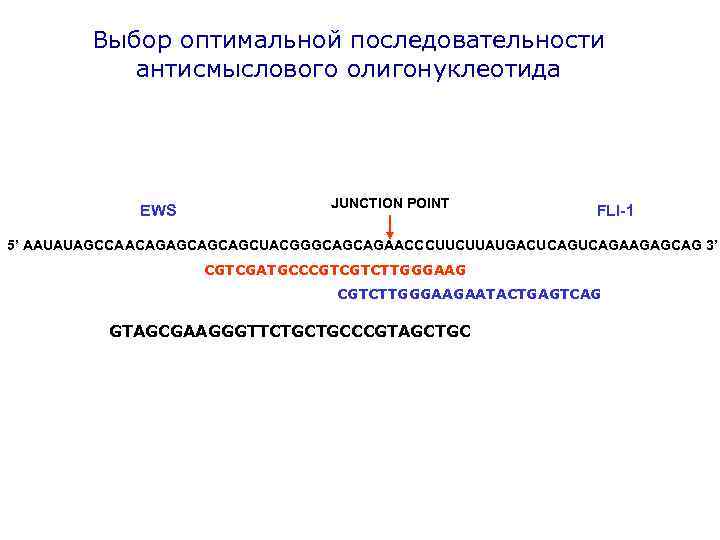
Выбор оптимальной последовательности антисмыслового олигонуклеотида JUNCTION POINT EWS FLI-1 5’ AAUAUAGCCAACAGAGCAGCAGCUACGGGCAGCAGAACCCUUCUUAUGACUCAGAAGAGCAG 3’ CGTCGATGCCCGTCGTCTTGGGAAGAATACTGAGTCAG GTAGCGAAGGGTTCTGCTGCCCGTAGCTGC
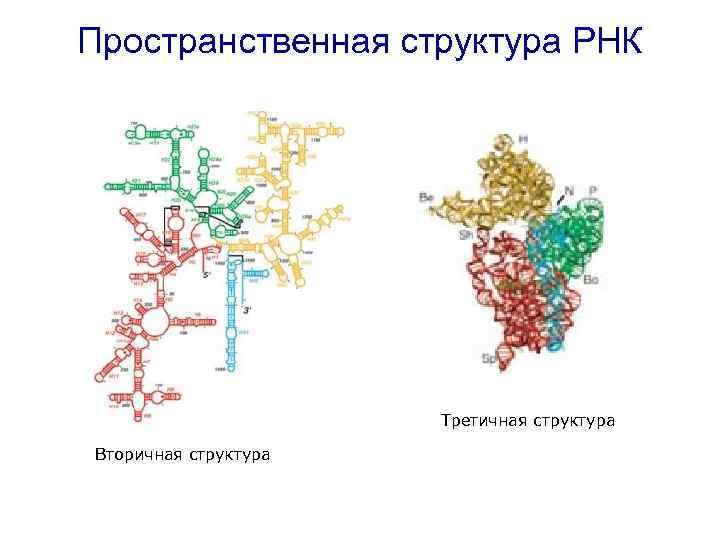
Пространственная структура РНК Третичная структура Вторичная структура
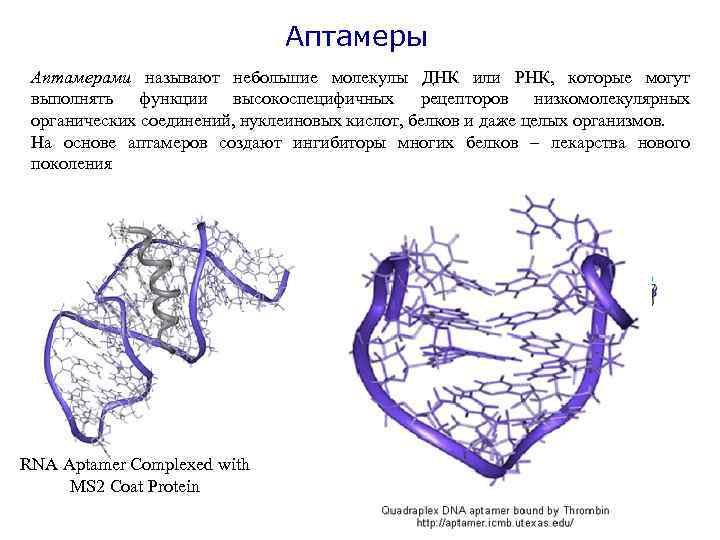
Аптамеры Аптамерами называют небольшие молекулы ДНК или РНК, которые могут выполнять функции высокоспецифичных рецепторов низкомолекулярных органических соединений, нуклеиновых кислот, белков и даже целых организмов. На основе аптамеров создают ингибиторы многих белков – лекарства нового поколения RNA Aptamer Complexed with MS 2 Coat Protein
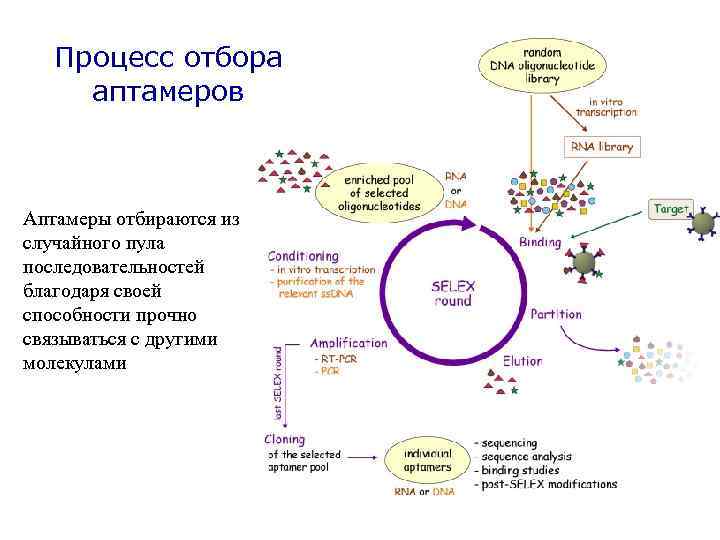
Процесс отбора аптамеров Аптамеры отбираются из случайного пула последовательностей благодаря своей способности прочно связываться с другими молекулами
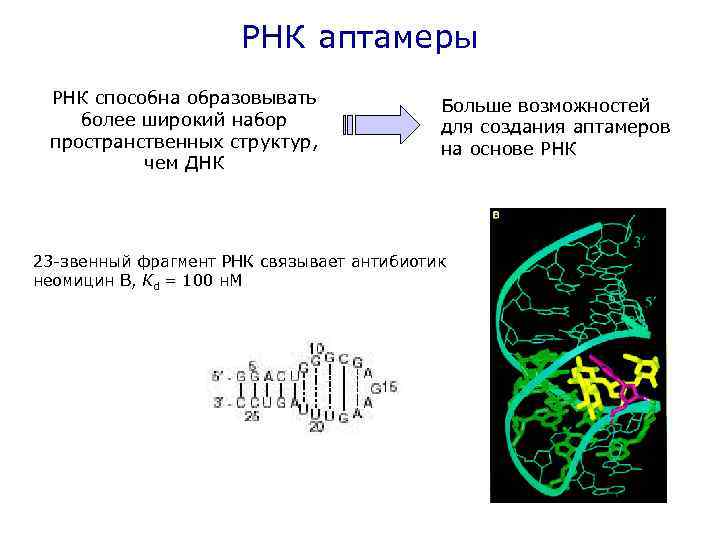
РНК аптамеры РНК способна образовывать более широкий набор пространственных структур, чем ДНК Больше возможностей для создания аптамеров на основе РНК 23 -звенный фрагмент РНК связывает антибиотик неомицин В, Кd = 100 н. М
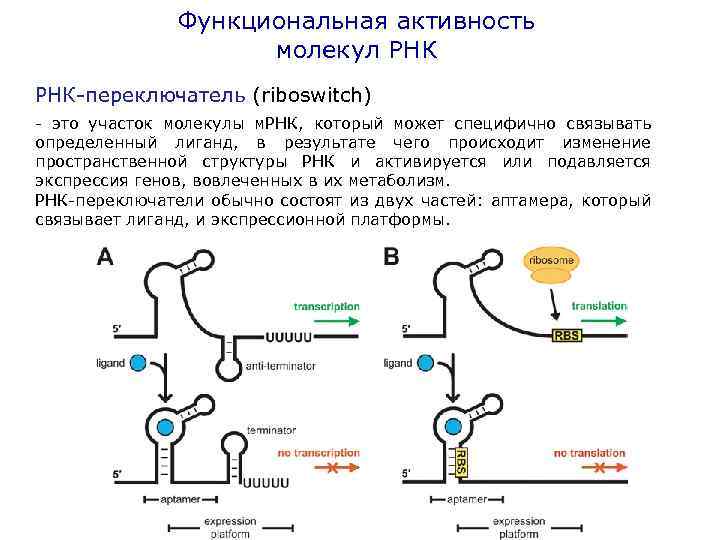
Функциональная активность молекул РНК-переключатель (riboswitch) - это участок молекулы м. РНК, который может специфично связывать определенный лиганд, в результате чего происходит изменение пространственной структуры РНК и активируется или подавляется экспрессия генов, вовлеченных в их метаболизм. РНК-переключатели обычно состоят из двух частей: аптамера, который связывает лиганд, и экспрессионной платформы.
![Модификация ДНК с с помощью реакции [3 + 2]-диполярного циклоприсоединения азидов и алкинов DNA Модификация ДНК с с помощью реакции [3 + 2]-диполярного циклоприсоединения азидов и алкинов DNA](https://present5.com/presentation/3540715_78225256/image-51.jpg)
Модификация ДНК с с помощью реакции [3 + 2]-диполярного циклоприсоединения азидов и алкинов DNA Click Chemistry Cu. AAC = (Cu(I)+catalyzed azide–alkyne cycloaddition) Модификация нуклеиновых кислот с помощью реакции [3 + 2]-диполярного циклоприсоединения азидов и алкинов А. В. Устинов, И. А. Степанова, В. В. Дубнякова, Т. С. Зацепин, Е. В. Ножевникова, В. А. Коршун Биоорганическая химия, 2010, 36, 437– 481 Click chemistry with DNA. El-Sagheer AH, Brown T. Chem. Soc. Rev. 2010, 39, 1388 -1405
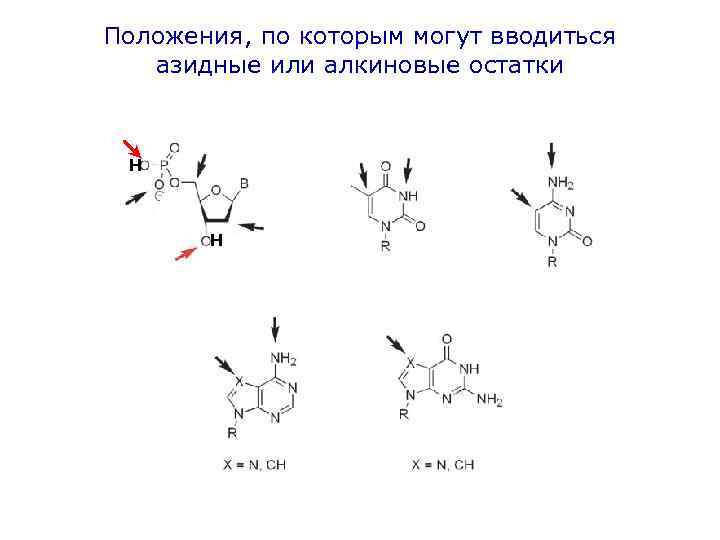
Положения, по которым могут вводиться азидные или алкиновые остатки Н Н
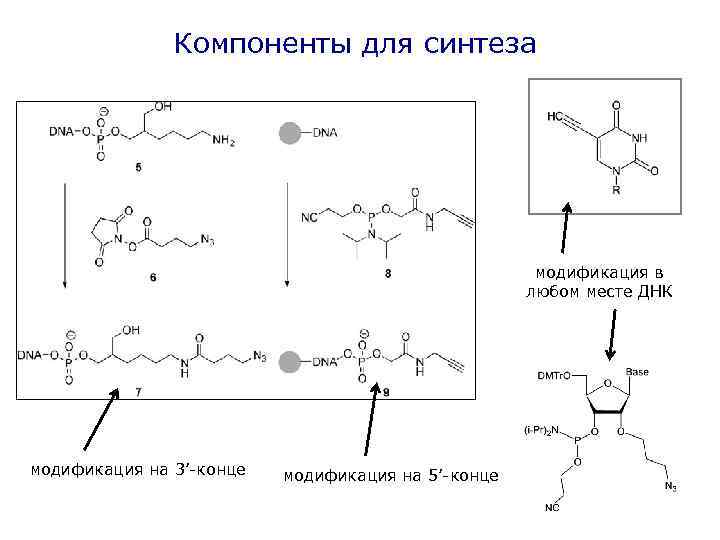
Компоненты для синтеза модификация в любом месте ДНК модификация на 3’-конце модификация на 5’-конце
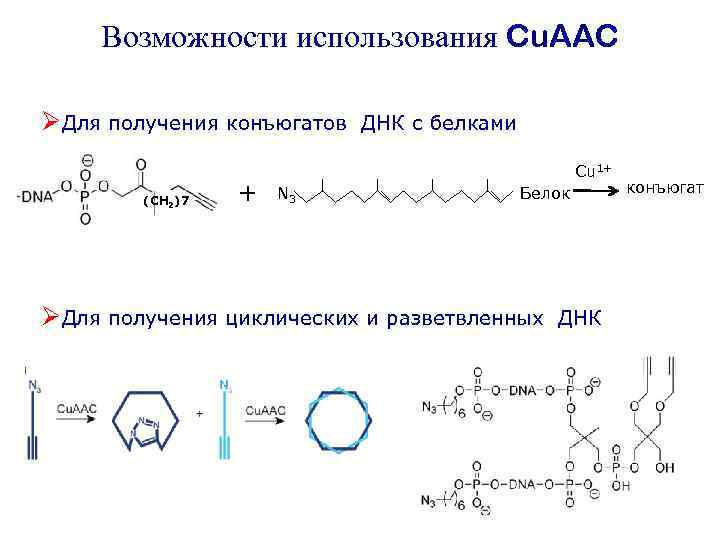
Возможности использования Cu. AAC ØДля получения конъюгатов (СН 2)7 + ДНК с белками Cu 1+ N 3 Белок ØДля получения циклических и разветвленных ДНК конъюгат
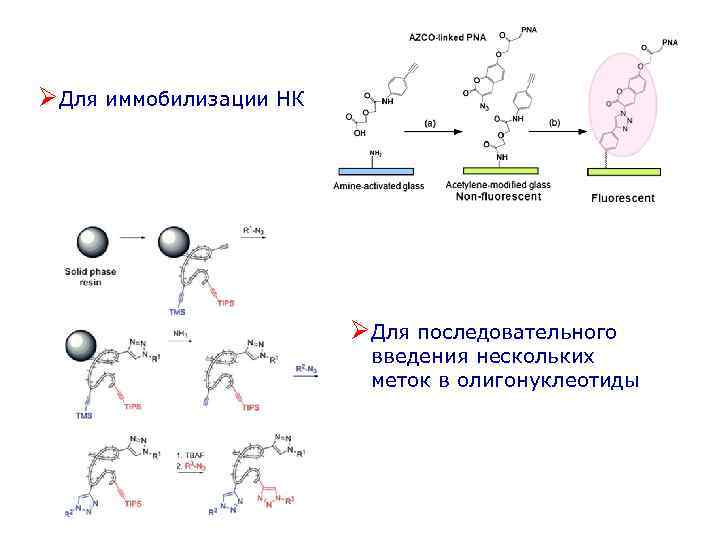
ØДля иммобилизации НК ØДля последовательного введения нескольких меток в олигонуклеотиды
Презентация11-n.ppt