2. Парообразование. Насыщенный пар.pptx
- Количество слайдов: 27
 Испарение жидкостей. Насыщенный пар
Испарение жидкостей. Насыщенный пар
 Переход из одного состояния в другое называется фазовым переходом. Все реальные газы (кислород, азот, водород и т. д. ) при определенных условиях способны превращаться в жидкость.
Переход из одного состояния в другое называется фазовым переходом. Все реальные газы (кислород, азот, водород и т. д. ) при определенных условиях способны превращаться в жидкость.
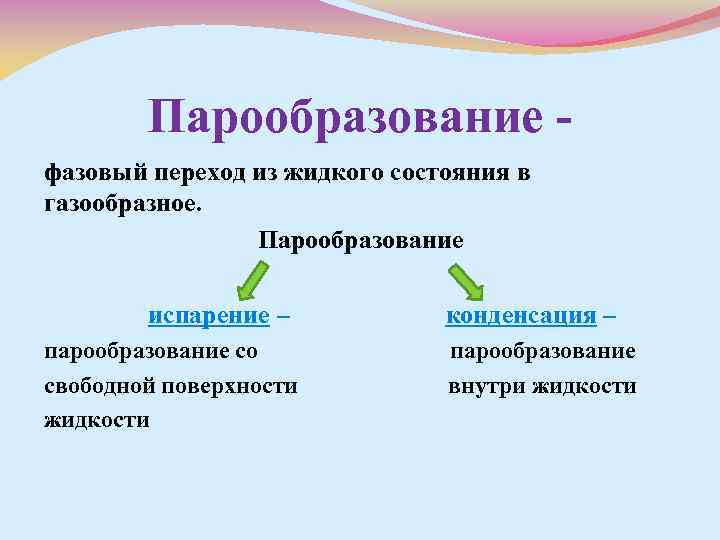 Парообразование фазовый переход из жидкого состояния в газообразное. Парообразование испарение – конденсация – парообразование со парообразование свободной поверхности внутри жидкости
Парообразование фазовый переход из жидкого состояния в газообразное. Парообразование испарение – конденсация – парообразование со парообразование свободной поверхности внутри жидкости
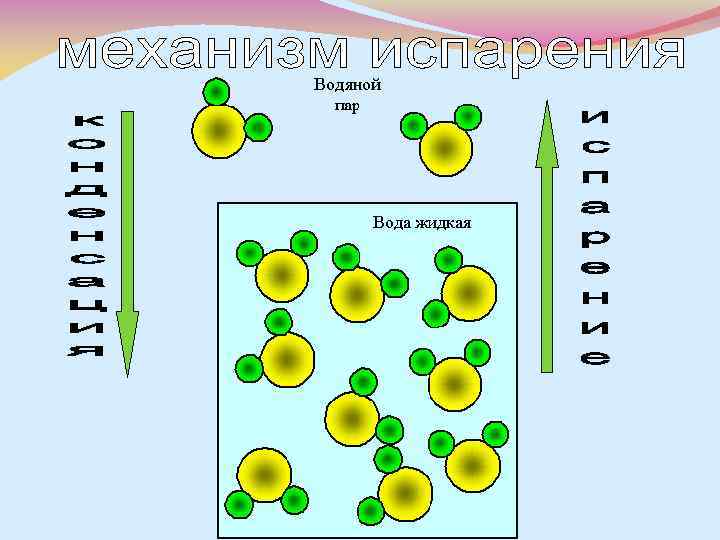
 Испарение с точки зрения МКТ С точки зрения молекулярно-кинетической теории, испарение – это процесс, при котором с поверхности жидкости вылетают наиболее быстрые молекулы, кинетическая энергия которых превышает энергию их связи с остальными молекулами жидкости. Это приводит к уменьшению средней кинетической энергии оставшихся молекул, т. е. к охлаждению жидкости.
Испарение с точки зрения МКТ С точки зрения молекулярно-кинетической теории, испарение – это процесс, при котором с поверхности жидкости вылетают наиболее быстрые молекулы, кинетическая энергия которых превышает энергию их связи с остальными молекулами жидкости. Это приводит к уменьшению средней кинетической энергии оставшихся молекул, т. е. к охлаждению жидкости.
 Испарение твёрдых тел Процесс перехода вещества из твёрдого состояния непосредственно в газообразное, называется сублимацией или возгонкой.
Испарение твёрдых тел Процесс перехода вещества из твёрдого состояния непосредственно в газообразное, называется сублимацией или возгонкой.
 Конденсация – это процесс, обратный процессу испарения. При конденсации молекулы пара возвращаются в жидкость. Это приводит к увеличению средней кинетической энергии молекул жидкости, т. е. к нагреванию жидкости.
Конденсация – это процесс, обратный процессу испарения. При конденсации молекулы пара возвращаются в жидкость. Это приводит к увеличению средней кинетической энергии молекул жидкости, т. е. к нагреванию жидкости.
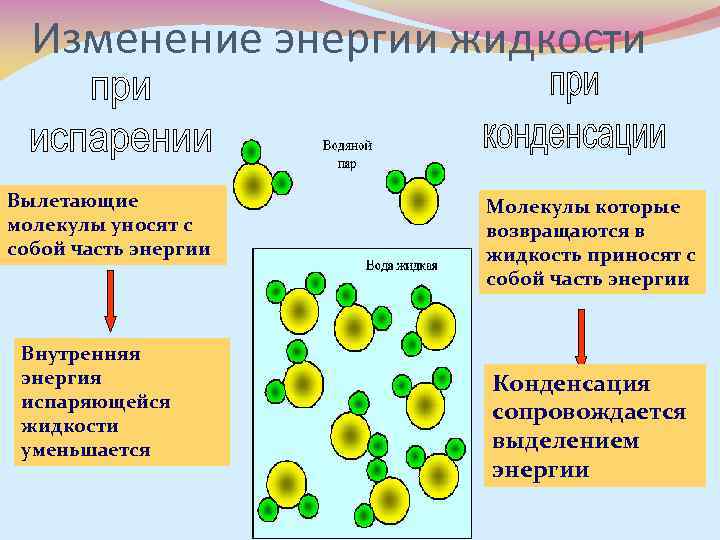 Изменение энергии жидкости Вылетающие молекулы уносят с собой часть энергии Внутренняя энергия испаряющейся жидкости уменьшается Молекулы которые возвращаются в жидкость приносят с собой часть энергии Конденсация сопровождается выделением энергии
Изменение энергии жидкости Вылетающие молекулы уносят с собой часть энергии Внутренняя энергия испаряющейся жидкости уменьшается Молекулы которые возвращаются в жидкость приносят с собой часть энергии Конденсация сопровождается выделением энергии
 Процесс испарения идет с поглощением энергии извне. При конденсации выделяется. энергия
Процесс испарения идет с поглощением энергии извне. При конденсации выделяется. энергия
 Скорость испарения зависит от:
Скорость испарения зависит от:
 Насыщенный пар Процессы испарения и конденсации идут одновременно. Если за одно и тоже время число молекул, покидающих поверхность жидкости, становится равным числу молекул пара, возвращающихся в неё, то число молекул пара над жидкостью будет оставаться постоянным. Такое состояние называют динамическим равновесием пара и жидкости. Пар, находящийся в динамическом равновесии со своей жидкостью, называют насыщенным.
Насыщенный пар Процессы испарения и конденсации идут одновременно. Если за одно и тоже время число молекул, покидающих поверхность жидкости, становится равным числу молекул пара, возвращающихся в неё, то число молекул пара над жидкостью будет оставаться постоянным. Такое состояние называют динамическим равновесием пара и жидкости. Пар, находящийся в динамическом равновесии со своей жидкостью, называют насыщенным.
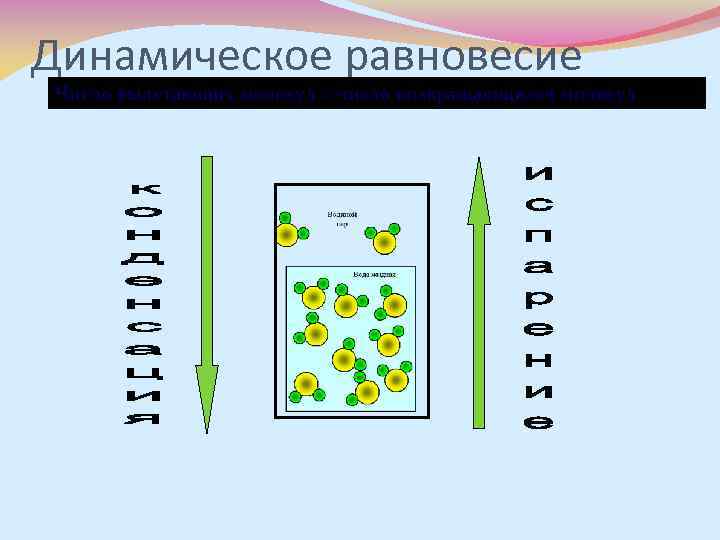 Динамическое равновесие Число вылетающих молекул = число возвращающихся молекул
Динамическое равновесие Число вылетающих молекул = число возвращающихся молекул
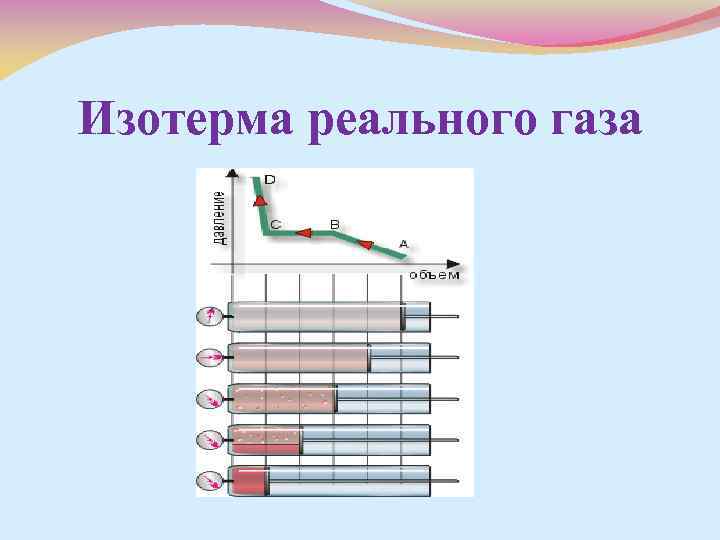 Изотерма реального газа
Изотерма реального газа
 Давление насыщенного пара Концентрация молекул насыщенного пара не зависит от его объёма при постоянной температуре. Для насыщенного пара p = nk. T. р ~ n n не зависит от объёма р не зависит от V. Независящее от объёма давление пара, при котором жидкость находится в равновесии со своим паром, называют давлением насыщенного пара.
Давление насыщенного пара Концентрация молекул насыщенного пара не зависит от его объёма при постоянной температуре. Для насыщенного пара p = nk. T. р ~ n n не зависит от объёма р не зависит от V. Независящее от объёма давление пара, при котором жидкость находится в равновесии со своим паром, называют давлением насыщенного пара.
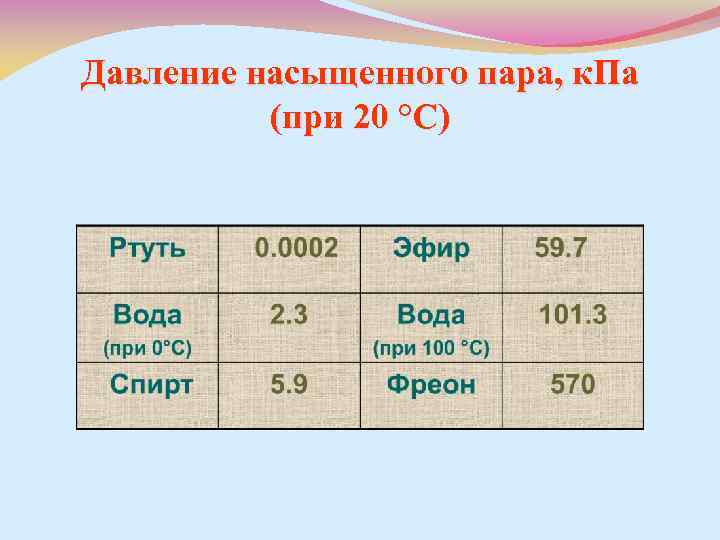 Давление насыщенного пара, к. Па (при 20 °С)
Давление насыщенного пара, к. Па (при 20 °С)
 Давление насыщенного пара p 0 данного вещества зависит только от его температуры и не зависит от объема При повышении температуры давление насыщенного пара и его плотность возрастают, а плотность жидкости уменьшается из-за теплового расширения.
Давление насыщенного пара p 0 данного вещества зависит только от его температуры и не зависит от объема При повышении температуры давление насыщенного пара и его плотность возрастают, а плотность жидкости уменьшается из-за теплового расширения.
 Зависимость р(Т), найденная экспериментально, не является прямо пропорциональной, как у идеального газа при постоянном объеме. С увеличением температуры давление насыщенного пара растет быстрее, чем давление идеального газа (смотри рисунок, участок АВ)
Зависимость р(Т), найденная экспериментально, не является прямо пропорциональной, как у идеального газа при постоянном объеме. С увеличением температуры давление насыщенного пара растет быстрее, чем давление идеального газа (смотри рисунок, участок АВ)
 В закрытом сосуде часть жидкости превращается в пар. В результате согласно формуле p=nk. T пар p=nk. T давление насыщенного пара растет не только вследствие повышения температуры жидкости, но и вследствие увеличения концентрации молекул (плотности) пара. В основном увеличение давления при повышении температуры определяется именно увеличением концентрации
В закрытом сосуде часть жидкости превращается в пар. В результате согласно формуле p=nk. T пар p=nk. T давление насыщенного пара растет не только вследствие повышения температуры жидкости, но и вследствие увеличения концентрации молекул (плотности) пара. В основном увеличение давления при повышении температуры определяется именно увеличением концентрации
 Основное различие в поведении идеального газа и насыщенного пара При изменении температуры пара в закрытом сосуде (или при изменении объёма пара при постоянной температуре) меняется масса пара. Жидкость частично превращается в пар или, напротив, пар частично конденсируется. С идеальным газом ничего подобного не происходит.
Основное различие в поведении идеального газа и насыщенного пара При изменении температуры пара в закрытом сосуде (или при изменении объёма пара при постоянной температуре) меняется масса пара. Жидкость частично превращается в пар или, напротив, пар частично конденсируется. С идеальным газом ничего подобного не происходит.
 Когда вся жидкость испарится, пар при дальнейшем нагревании перестанет быть насыщенным и его давление при постоянном объеме будет возрастать прямо пропорционально абсолютной температуре (смотри рисунок, участок ВС)
Когда вся жидкость испарится, пар при дальнейшем нагревании перестанет быть насыщенным и его давление при постоянном объеме будет возрастать прямо пропорционально абсолютной температуре (смотри рисунок, участок ВС)
 Критическая температура Пар превращается в жидкость не при любой температуре. Максимальная температура, при которой пар ещё может превратиться в жидкость, называется критической температурой.
Критическая температура Пар превращается в жидкость не при любой температуре. Максимальная температура, при которой пар ещё может превратиться в жидкость, называется критической температурой.
 Кривые зависимости плотности жидкости и её насыщенного пара от температуры При критической температуре обе кривые сливаются, т. е. плотность жидкости становится равной плотности пара. Различие между жидкостью и паром исчезает.
Кривые зависимости плотности жидкости и её насыщенного пара от температуры При критической температуре обе кривые сливаются, т. е. плотность жидкости становится равной плотности пара. Различие между жидкостью и паром исчезает.
 Газ и пар Газ: состояние вещества при температуре выше критической. Пар: состояние вещества при температуре ниже критической – у пара есть возможность превратиться в жидкость.
Газ и пар Газ: состояние вещества при температуре выше критической. Пар: состояние вещества при температуре ниже критической – у пара есть возможность превратиться в жидкость.
 Кипение переход жидкости в пар, происходящий с образованием пузырьков пара по всему объёму жидкости или на поверхности сосуда. В объеме образуются пузыри, заполненные насыщенным паром. Они поднимаются вверх под действием выталкивающей силы и разрываются на поверхности. Центрами их образования являются мельчайшие пузырьки посторонних газов или частиц различных примесей.
Кипение переход жидкости в пар, происходящий с образованием пузырьков пара по всему объёму жидкости или на поверхности сосуда. В объеме образуются пузыри, заполненные насыщенным паром. Они поднимаются вверх под действием выталкивающей силы и разрываются на поверхности. Центрами их образования являются мельчайшие пузырьки посторонних газов или частиц различных примесей.
 При кипении давление паров, образующихся внутри пузырьков у дна сосуда, таково, что пузырьки могут расширяться, преодолевая атмосферное давление, а также давление столба воды. Кипение происходит при такой температуре, когда давление насыщенных паров сравнивается с давлением внутри жидкости.
При кипении давление паров, образующихся внутри пузырьков у дна сосуда, таково, что пузырьки могут расширяться, преодолевая атмосферное давление, а также давление столба воды. Кипение происходит при такой температуре, когда давление насыщенных паров сравнивается с давлением внутри жидкости.
 Температура кипения определяется, следовательно, давлением насыщенного пара, а значит, его температурой.
Температура кипения определяется, следовательно, давлением насыщенного пара, а значит, его температурой.
 Чем больше внешнее давление, тем выше Чем больше внешнее давление, температура кипения. Так в паровом котле при давлении, достигающем 16 атм. (1, 6· 106 Па), вода не кипит и при температуре 200 С. И наоборот, уменьшая внешнее давление, можно понизить температуру кипения.
Чем больше внешнее давление, тем выше Чем больше внешнее давление, температура кипения. Так в паровом котле при давлении, достигающем 16 атм. (1, 6· 106 Па), вода не кипит и при температуре 200 С. И наоборот, уменьшая внешнее давление, можно понизить температуру кипения.


