Ионные равновесия в растворах электролитов Водородный показатель среды



![Ионное произведение воды Отсюда произведение постоянных величин Kд ∙ [H2O] Ионное произведение воды Отсюда произведение постоянных величин Kд ∙ [H2O]](https://present5.com/presentacii-2/20171207\494-lektsia_10_rn_gidroliz.ppt\494-lektsia_10_rn_gidroliz_3.jpg)



![Водородный показатель pH Очевидно, –lg ([H+] ∙ [OH–]) = – lg 1 Водородный показатель pH Очевидно, –lg ([H+] ∙ [OH–]) = – lg 1](https://present5.com/presentacii-2/20171207\494-lektsia_10_rn_gidroliz.ppt\494-lektsia_10_rn_gidroliz_7.jpg)































494-lektsia_10_rn_gidroliz.ppt
- Количество слайдов: 42
 Ионные равновесия в растворах электролитов Водородный показатель среды (рН)
Ионные равновесия в растворах электролитов Водородный показатель среды (рН)
 Константа диссоциации воды Вода слабый электролит: Н20 Н+ + ОН- ее константа диссоциации при 298 K равна: При столь малой константе диссоциации концентрация воды остается практически неизменной и равной:
Константа диссоциации воды Вода слабый электролит: Н20 Н+ + ОН- ее константа диссоциации при 298 K равна: При столь малой константе диссоциации концентрация воды остается практически неизменной и равной:
![>Ионное произведение воды Отсюда произведение постоянных величин Kд ∙ [H2O] >Ионное произведение воды Отсюда произведение постоянных величин Kд ∙ [H2O]](https://present5.com/presentacii-2/20171207\494-lektsia_10_rn_gidroliz.ppt\494-lektsia_10_rn_gidroliz_3.jpg) Ионное произведение воды Отсюда произведение постоянных величин Kд ∙ [H2O] = [H+]∙[OH–] = const. Произведение концентраций ионов, на которые диссоциирует вода, называется ионным произведением воды Kв
Ионное произведение воды Отсюда произведение постоянных величин Kд ∙ [H2O] = [H+]∙[OH–] = const. Произведение концентраций ионов, на которые диссоциирует вода, называется ионным произведением воды Kв
 Реакция среды В воде : Н20 Н+ + ОН- [H+] = [OH–] = = 1 ∙ 10 –7 равенство [H+] и [OH–] соответствует нейтральной среде в растворе кислоты: [H+] > 1 ∙ 10 –7 кислая среда [OH–] < 1 ∙ 10 –7 в растворе щелочи [OH–] > 1 ∙ 10 –7 щелочная [H+] < 1 ∙ 10 –7 среда
Реакция среды В воде : Н20 Н+ + ОН- [H+] = [OH–] = = 1 ∙ 10 –7 равенство [H+] и [OH–] соответствует нейтральной среде в растворе кислоты: [H+] > 1 ∙ 10 –7 кислая среда [OH–] < 1 ∙ 10 –7 в растворе щелочи [OH–] > 1 ∙ 10 –7 щелочная [H+] < 1 ∙ 10 –7 среда
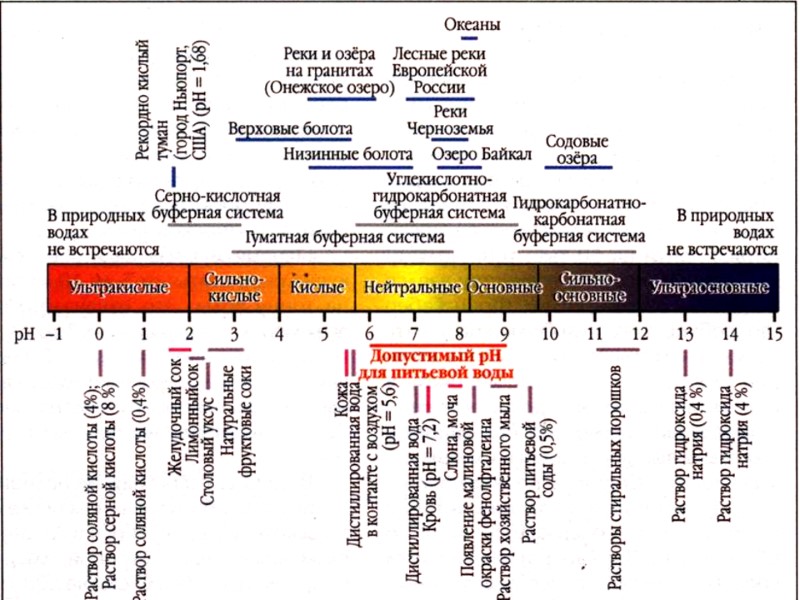
 Водородный показатель pH Для определения кислотно-основных свойств растворов пользуются понятием водородный показатель среды pH Водородный показатель это десятичный логарифм концентрации водородных ионов с обратным знаком : pH = –lg [H+]
Водородный показатель pH Для определения кислотно-основных свойств растворов пользуются понятием водородный показатель среды pH Водородный показатель это десятичный логарифм концентрации водородных ионов с обратным знаком : pH = –lg [H+]
 Гидроксильный показатель pОH гидроксильный показатель среды pОH – это десятичный логарифм концентрации ионов гидроксила с обратным знаком : pОH = –lg [ОH-]
Гидроксильный показатель pОH гидроксильный показатель среды pОH – это десятичный логарифм концентрации ионов гидроксила с обратным знаком : pОH = –lg [ОH-]
![>Водородный показатель pH Очевидно, –lg ([H+] ∙ [OH–]) = – lg 1 >Водородный показатель pH Очевидно, –lg ([H+] ∙ [OH–]) = – lg 1](https://present5.com/presentacii-2/20171207\494-lektsia_10_rn_gidroliz.ppt\494-lektsia_10_rn_gidroliz_7.jpg) Водородный показатель pH Очевидно, –lg ([H+] ∙ [OH–]) = – lg 1 ∙ 10–14 pH + pOH = 14 При [H+] > 1 ∙ 10 –7 pH < 7 кислая среда, При [H+] <1 ∙ 10 –7 pH > 7 щелочная среда, При [H+] = 1 ∙ 10 –7 pH = 7 нейтральная среда
Водородный показатель pH Очевидно, –lg ([H+] ∙ [OH–]) = – lg 1 ∙ 10–14 pH + pOH = 14 При [H+] > 1 ∙ 10 –7 pH < 7 кислая среда, При [H+] <1 ∙ 10 –7 pH > 7 щелочная среда, При [H+] = 1 ∙ 10 –7 pH = 7 нейтральная среда

 Практическое определение реакции среды колориметрическим методом Индикаторы – вещества, меняющие свою окраску в зависимости от реакции среды.
Практическое определение реакции среды колориметрическим методом Индикаторы – вещества, меняющие свою окраску в зависимости от реакции среды.
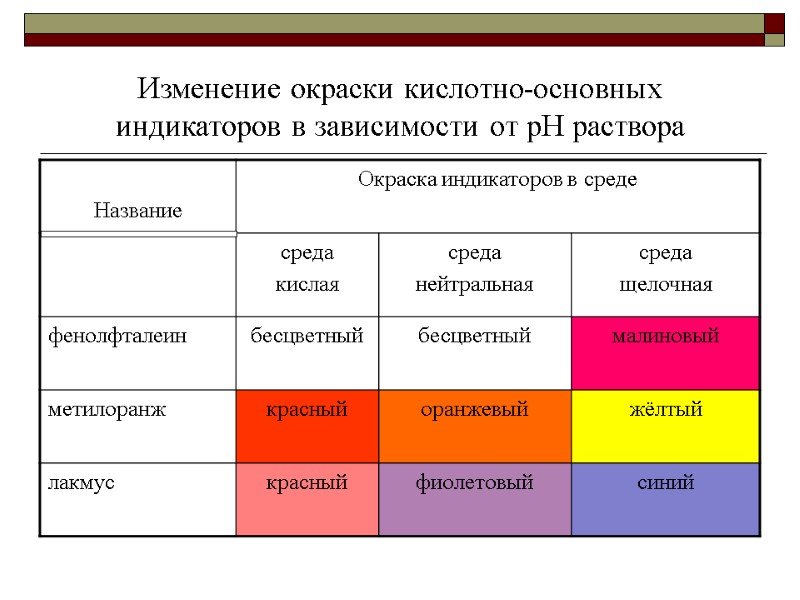
 Изменение окраски кислотно-основных индикаторов в зависимости от pH раствора
Изменение окраски кислотно-основных индикаторов в зависимости от pH раствора
 Универсальная индикаторная бумага
Универсальная индикаторная бумага

 §2. Определение рН среды потенциометрическим методом. Потенциометрия – это электрохимический метод анализа, основанный на зависимости величины электродного потенциала, а, следовательно, и ЭДС, составленного из соответствующих электродов гальванического элемента, от состава раствора. Для определения величины рН среды применяются рН-индикаторные электроды. Потенциал стеклянного электрода зависит от концентрации (активности) ионов водорода в растворе.
§2. Определение рН среды потенциометрическим методом. Потенциометрия – это электрохимический метод анализа, основанный на зависимости величины электродного потенциала, а, следовательно, и ЭДС, составленного из соответствующих электродов гальванического элемента, от состава раствора. Для определения величины рН среды применяются рН-индикаторные электроды. Потенциал стеклянного электрода зависит от концентрации (активности) ионов водорода в растворе.
 Наиболее широко в лабораторной практике применяется стеклянный индикаторный электрод. Стеклянный индикаторный электрод Хлорсеребряный электрод сравнения
Наиболее широко в лабораторной практике применяется стеклянный индикаторный электрод. Стеклянный индикаторный электрод Хлорсеребряный электрод сравнения
 Гидролиз Гидролиз – процесс взаимодействия вещества с водой, в результате которого нарушается ионное равновесие воды и меняется рН среды. Гидролиз является частным случаем реакций сольволиза, т. е. реакций обмена между растворителем и растворенным веществом.
Гидролиз Гидролиз – процесс взаимодействия вещества с водой, в результате которого нарушается ионное равновесие воды и меняется рН среды. Гидролиз является частным случаем реакций сольволиза, т. е. реакций обмена между растворителем и растворенным веществом.
 Гидролизу подвергаются: Соли Углеводы Белки Мыла Сложные эфиры Жиры Феноляты Алкоголяты Галогенангидриды и другие вещества.
Гидролизу подвергаются: Соли Углеводы Белки Мыла Сложные эфиры Жиры Феноляты Алкоголяты Галогенангидриды и другие вещества.
 Соли могут быть образованы: Сильным основанием + сильной кислотой например: Na2SO4 Сильным основанием + слабой кислотой например: Na2CO3 Слабым основанием + сильной кислотой например: (NH4)2SO4 Слабым основанием + слабой кислотой например: (NH4)2CO3
Соли могут быть образованы: Сильным основанием + сильной кислотой например: Na2SO4 Сильным основанием + слабой кислотой например: Na2CO3 Слабым основанием + сильной кислотой например: (NH4)2SO4 Слабым основанием + слабой кислотой например: (NH4)2CO3
 При рассмотрении процессов гидролиза солей следует помнить: Гидролизу подвергаются только те соли, в состав которых входит ион от слабого электролита. ИОН СЛАБОГО ЭЛЕКТРОЛИТА – ДВИГАТЕЛЬ ГИДРОЛИЗА Соли, образованные сильным основанием сильной кислотой гидролизу не подвергаются.
При рассмотрении процессов гидролиза солей следует помнить: Гидролизу подвергаются только те соли, в состав которых входит ион от слабого электролита. ИОН СЛАБОГО ЭЛЕКТРОЛИТА – ДВИГАТЕЛЬ ГИДРОЛИЗА Соли, образованные сильным основанием сильной кислотой гидролизу не подвергаются.
 При рассмотрении процессов гидролиза солей следует помнить: Обычно гидролиз идет незначительно и преимущественно по первой ступени (один ион слабого электролита взаимодействует только с одной молекулой воды).
При рассмотрении процессов гидролиза солей следует помнить: Обычно гидролиз идет незначительно и преимущественно по первой ступени (один ион слабого электролита взаимодействует только с одной молекулой воды).
 При рассмотрении процессов гидролиза солей следует помнить: Соли, образованные слабым основанием и слабой кислотой, гидролизуются практически полностью. Реакцию среды при гидролизе определяется по виду иона сильного электролита. соль сильного основания – среда щелочная соль сильной кислоты – среда кислая
При рассмотрении процессов гидролиза солей следует помнить: Соли, образованные слабым основанием и слабой кислотой, гидролизуются практически полностью. Реакцию среды при гидролизе определяется по виду иона сильного электролита. соль сильного основания – среда щелочная соль сильной кислоты – среда кислая
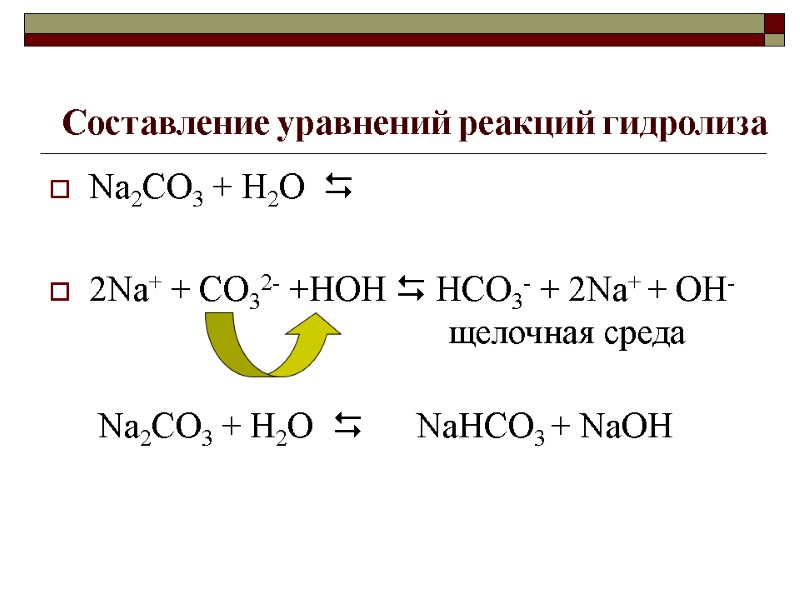
 Составление уравнений реакций гидролиза Na2CO3 + Н2О 2Na+ + CO32- +HOH HCO3- + 2Na+ + OH- щелочная среда Na2CO3 + Н2О NaНСО3 + NaOH
Составление уравнений реакций гидролиза Na2CO3 + Н2О 2Na+ + CO32- +HOH HCO3- + 2Na+ + OH- щелочная среда Na2CO3 + Н2О NaНСО3 + NaOH
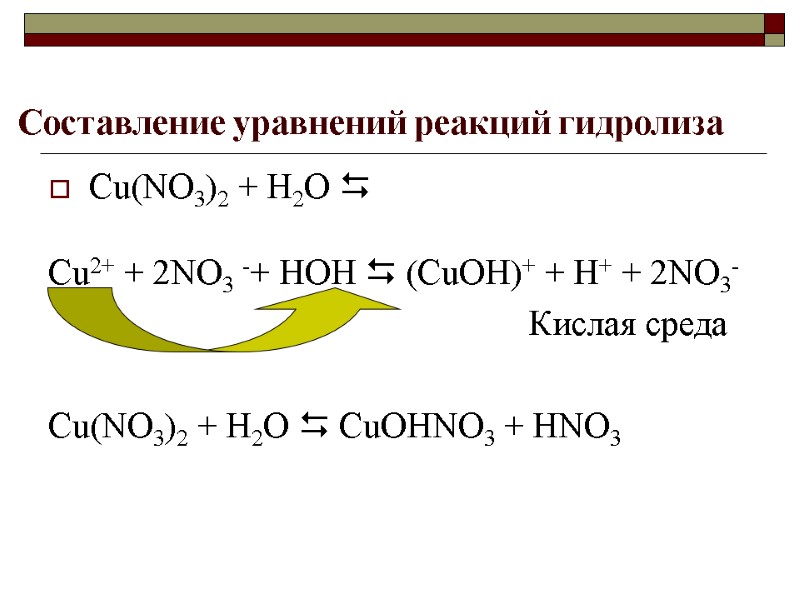
 Составление уравнений реакций гидролиза Сu(NO3)2 + Н2О Cu2+ + 2NO3 -+ HOH (CuOH)+ + H+ + 2NO3- Кислая среда Сu(NO3)2 + Н2О СuOHNO3 + HNO3
Составление уравнений реакций гидролиза Сu(NO3)2 + Н2О Cu2+ + 2NO3 -+ HOH (CuOH)+ + H+ + 2NO3- Кислая среда Сu(NO3)2 + Н2О СuOHNO3 + HNO3
 Составление уравнений реакций гидролиза Cr2S3 + 6Н2О Cr2S3 + 6Н2О 2 Cr(OH)3 + 3H2S Среда близка к нейтральной рН ≈ 7
Составление уравнений реакций гидролиза Cr2S3 + 6Н2О Cr2S3 + 6Н2О 2 Cr(OH)3 + 3H2S Среда близка к нейтральной рН ≈ 7
 Ступенчатый гидролиз I ступень: Na2CO3 + Н2О NaНСО3 + NaOH II ступень: NaНСО3+ Н2О NaOH + H2CO3 Гидролиз солей слабых многоосновных кислот и слабых многокислотных оснований по второй и третьей ступеням протекает незначительно.
Ступенчатый гидролиз I ступень: Na2CO3 + Н2О NaНСО3 + NaOH II ступень: NaНСО3+ Н2О NaOH + H2CO3 Гидролиз солей слабых многоосновных кислот и слабых многокислотных оснований по второй и третьей ступеням протекает незначительно.
 Факторы, влияющие на процесс гидролиза. Природа гидролизующегося вещества. Чем слабее электролит, образовавший соль, тем активнее происходит процесс гидролиза. Концентрация. Разбавление раствора способствует гидролизу.
Факторы, влияющие на процесс гидролиза. Природа гидролизующегося вещества. Чем слабее электролит, образовавший соль, тем активнее происходит процесс гидролиза. Концентрация. Разбавление раствора способствует гидролизу.
 Факторы, влияющие на процесс гидролиза. Температура. Повышение температуры усиливает гидролиз. Пример: гидролиз раствора ацетата натрия CH3COONa
Факторы, влияющие на процесс гидролиза. Температура. Повышение температуры усиливает гидролиз. Пример: гидролиз раствора ацетата натрия CH3COONa
 При добавлении к раствору ацетата натрия индикатора фенолфталеин цвет раствора - бледно-малиновый CH3COONa + HOH→ CH3COOH + NaOH CH3COO- + Na+ + HOH→ CH3COOH + Na+ + OH- CH3COO- + HOH→ CH3COOH + OH- (pH >7) Среда – слабощелочная. При нагревании раствора процесс гидролиза усиливается, среда становится более щелочной и, поэтому, раствор становится ярко малиновым.
При добавлении к раствору ацетата натрия индикатора фенолфталеин цвет раствора - бледно-малиновый CH3COONa + HOH→ CH3COOH + NaOH CH3COO- + Na+ + HOH→ CH3COOH + Na+ + OH- CH3COO- + HOH→ CH3COOH + OH- (pH >7) Среда – слабощелочная. При нагревании раствора процесс гидролиза усиливается, среда становится более щелочной и, поэтому, раствор становится ярко малиновым.
 ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА ГИДРОЛИЗ Цвет индикатора фенолфталеин в растворе ацетата натрия До нагревания После нагревания
ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА ГИДРОЛИЗ Цвет индикатора фенолфталеин в растворе ацетата натрия До нагревания После нагревания
 Количественные характеристики процесса гидролиза. Cтепень гидролиза ( β) β = Так, в 0,1 н. растворе СН3СООNa β = 0,01 %
Количественные характеристики процесса гидролиза. Cтепень гидролиза ( β) β = Так, в 0,1 н. растворе СН3СООNa β = 0,01 %
 Количественные характеристики процесса гидролиза. Константа гидролиза (К гидр.) Для соли слабого основания и слабой кислоты
Количественные характеристики процесса гидролиза. Константа гидролиза (К гидр.) Для соли слабого основания и слабой кислоты
 Равновесие в системе осадок раствор BaSO4 Ba2+ + SO42- Ва2+ + SO42- BaSO4
Равновесие в системе осадок раствор BaSO4 Ba2+ + SO42- Ва2+ + SO42- BaSO4
 Произведение растворимости В насыщенном растворе труднорастворимого сильного электролита произведение концентраций его ионов в степенях их стехиометрических коэффициентов при данной температуре есть величина постоянная, называемая произведением растворимости (ПР).
Произведение растворимости В насыщенном растворе труднорастворимого сильного электролита произведение концентраций его ионов в степенях их стехиометрических коэффициентов при данной температуре есть величина постоянная, называемая произведением растворимости (ПР).
 Произведение растворимости (ПР) характеризует растворимость (S) труднорастворимого электролита при данной температуре. s s s CaSO4 Ca2+ + SO42- ПР(CaSO4) = [Ca2+] ∙ [SO42-] = S2 = 2,5∙10 –5 S = √2,5∙10 –5 = 5∙ 10 -3 [моль/л]
Произведение растворимости (ПР) характеризует растворимость (S) труднорастворимого электролита при данной температуре. s s s CaSO4 Ca2+ + SO42- ПР(CaSO4) = [Ca2+] ∙ [SO42-] = S2 = 2,5∙10 –5 S = √2,5∙10 –5 = 5∙ 10 -3 [моль/л]
 Из двух однотипных солей, например, CaSO4 и BaSO4, большей растворимостью обладает та соль, у которой ПР больше. ПР(CaSO4) = [Ca2+] ∙ [SO42-] = 2,5∙10 –5 ПР(BaSO4) = [Ba2+] ∙ [SO42-] = 1,1∙10 –10 S (BaSO4) < S (CaSO4)
Из двух однотипных солей, например, CaSO4 и BaSO4, большей растворимостью обладает та соль, у которой ПР больше. ПР(CaSO4) = [Ca2+] ∙ [SO42-] = 2,5∙10 –5 ПР(BaSO4) = [Ba2+] ∙ [SO42-] = 1,1∙10 –10 S (BaSO4) < S (CaSO4)




 Условие образования и растворения осадков. ПК – произведение концентраций ионов в степенях, соответствующих стехиометрическим коэффициентам для системы в неравновесном состоянии. Зная величину ПК и сравнив ее с величиной ПР, можно установить, растворится или выпадет осадок при данной температуре:
Условие образования и растворения осадков. ПК – произведение концентраций ионов в степенях, соответствующих стехиометрическим коэффициентам для системы в неравновесном состоянии. Зная величину ПК и сравнив ее с величиной ПР, можно установить, растворится или выпадет осадок при данной температуре:
 Условие образования и растворения осадков. Если ПК = ПР, ΔG = 0 – система находится в состоянии равновесия (раствор насыщенный). Если ПК < ПР, ΔG < 0 – самопроизвольно протекает процесс растворения осадка (раствор ненасыщенный). Если ПК > ПР, ΔG > 0 – возможен обратный процесс – выпадание осадка (раствор пересыщенный).
Условие образования и растворения осадков. Если ПК = ПР, ΔG = 0 – система находится в состоянии равновесия (раствор насыщенный). Если ПК < ПР, ΔG < 0 – самопроизвольно протекает процесс растворения осадка (раствор ненасыщенный). Если ПК > ПР, ΔG > 0 – возможен обратный процесс – выпадание осадка (раствор пересыщенный).
 S 2S S Ag2SO4 2Ag+ +SO42- ПР (Ag2SO4) [Ag+]2 ∙ [SO42-] = 2S2 ∙S = 4S3 = 2 ∙ 10 -5 S = При добавлении Na2SO4 равновесие смещается влево. Растворимость уменьшается.
S 2S S Ag2SO4 2Ag+ +SO42- ПР (Ag2SO4) [Ag+]2 ∙ [SO42-] = 2S2 ∙S = 4S3 = 2 ∙ 10 -5 S = При добавлении Na2SO4 равновесие смещается влево. Растворимость уменьшается.
 Если в насыщенный раствор электролита ввести некоторое количество одноименных ионов, то концентрация другого иона должна уменьшиться и часть растворенного электролита выпадет в осадок, то есть от введения в раствор одноименных ионов растворимость электролита понижается.
Если в насыщенный раствор электролита ввести некоторое количество одноименных ионов, то концентрация другого иона должна уменьшиться и часть растворенного электролита выпадет в осадок, то есть от введения в раствор одноименных ионов растворимость электролита понижается.

