Lecture Grodno Biochem.pptx
- Количество слайдов: 72
 Ионные каналы растений: структура, физиологические свойства и подходы для исследования Демидчик Вадим Викторович Кафедра клеточной биологии и биоинженерии растений БГУ
Ионные каналы растений: структура, физиологические свойства и подходы для исследования Демидчик Вадим Викторович Кафедра клеточной биологии и биоинженерии растений БГУ
 Введение: Клеточная сигнализация и перенос веществ через плазматическую мембрану выступают ключевым звеном регуляции процессов жизнедеятельности клетки и организма в целом. В основе этих явлений лежит функционирование мембранных белковых комплексов, называемых ионотропными рецепторами и ионными каналами. В последние годы развитие электрофизиологических методик и их совмещение со спектрофотометрическими, люминометрическими и молекулярно-биологическими подходами позволило совершить революционный прорыв в понимании закономерностей работы рецепторов и ионных каналов. Благодаря этому большинство из них было детально изучены на уровне отдельных генов и белков.
Введение: Клеточная сигнализация и перенос веществ через плазматическую мембрану выступают ключевым звеном регуляции процессов жизнедеятельности клетки и организма в целом. В основе этих явлений лежит функционирование мембранных белковых комплексов, называемых ионотропными рецепторами и ионными каналами. В последние годы развитие электрофизиологических методик и их совмещение со спектрофотометрическими, люминометрическими и молекулярно-биологическими подходами позволило совершить революционный прорыв в понимании закономерностей работы рецепторов и ионных каналов. Благодаря этому большинство из них было детально изучены на уровне отдельных генов и белков.
 Перечень вопросов: 1. Структурные и функциональные особенности различных классов катионных каналов растений. 2. Общие принципы биофизического анализа функционирования ионных каналов и рецепторов. Метод фиксации потенциала, выделение проводимости для отдельных катионов, изучение селективности и фармакологических свойств каналов. 3. Получение и анализ воль-амперных характеристик катионных каналов, типы каналов по потенциалозависимости. 4. Принципы техники MIFE, преимущества и недостатки этого метода. 5. Электрофизиологический анализ при помощи методики пэтч-кламп. Технические аспекты техники пэтч-кламп, особенности изготовления пэтчпипеток и подготовки простопластов. 6. Люминометрический подход, использование экворина и других зондов при изучении транспортно-сигнальных процессов на мембранах.
Перечень вопросов: 1. Структурные и функциональные особенности различных классов катионных каналов растений. 2. Общие принципы биофизического анализа функционирования ионных каналов и рецепторов. Метод фиксации потенциала, выделение проводимости для отдельных катионов, изучение селективности и фармакологических свойств каналов. 3. Получение и анализ воль-амперных характеристик катионных каналов, типы каналов по потенциалозависимости. 4. Принципы техники MIFE, преимущества и недостатки этого метода. 5. Электрофизиологический анализ при помощи методики пэтч-кламп. Технические аспекты техники пэтч-кламп, особенности изготовления пэтчпипеток и подготовки простопластов. 6. Люминометрический подход, использование экворина и других зондов при изучении транспортно-сигнальных процессов на мембранах.
 Литература: 1. Демидчик В. В. 2012. Characterisation of root plasma membrane Ca 2+- permeable cation channels: techniques and basic concepts. In A. G. Volkov: Plant Electrophysiology. Springer-Verlag. - Berlin Heidelberg. pp. 360 -390. 2. Демидчик В. В. 2010. Основные закономерности функционирования неселективных катионных каналов плазматической мембраны клеток корня высших растений. Докторская диссертация. Минск. – 272 с. Дополнительная литература: 1. Сайт кафедры биофизики биологического факультета МГУ http: //www. library. biophys. msu. ru/rubin/2030721. pdf 2. Ионные каналы возбудимой клетки (структура, функция, патология). 2010. Зефиров А. Л. , Ситдикова Г. Ф. Казань: Арт-кафе, 271 с.
Литература: 1. Демидчик В. В. 2012. Characterisation of root plasma membrane Ca 2+- permeable cation channels: techniques and basic concepts. In A. G. Volkov: Plant Electrophysiology. Springer-Verlag. - Berlin Heidelberg. pp. 360 -390. 2. Демидчик В. В. 2010. Основные закономерности функционирования неселективных катионных каналов плазматической мембраны клеток корня высших растений. Докторская диссертация. Минск. – 272 с. Дополнительная литература: 1. Сайт кафедры биофизики биологического факультета МГУ http: //www. library. biophys. msu. ru/rubin/2030721. pdf 2. Ионные каналы возбудимой клетки (структура, функция, патология). 2010. Зефиров А. Л. , Ситдикова Г. Ф. Казань: Арт-кафе, 271 с.
 Цепь событий на разделе фаз «клетка-среда»
Цепь событий на разделе фаз «клетка-среда»
 Вещества в виде ионов преодолевают мембраны растительной клетки несколькими способами, основные из которых: 1. Диффузия через липидную фазу. Идет крайне медленно, так как липидный бислой очень плохо пропускает ионы (по градиенту электрохимического потенциала). Пример – стероиды. 2. Облегченная диффузия при помощи ионных каналов. Это быстрый процесс, так как ионы свободнее движутся через пору канала, имитирующую гидратную оболочку (происходит по градиенту электрохимического потенциала). 3. Перенос веществ с участием транспортеров и помп. Использует энергию АТФ или энергизируется разницей электрохимических потенциалов Н+, Na+, K+, других ионов. Идет медленнее, чем диффузия через ионные каналы, но значительно быстрее, чем диффузия через липидную фазу. Может происходить как по градиенту электрохимического потенциала, так и против него. 4. Эндоцитоз. Представляет собой захват внешнего материала клеткой, осуществляемый путём инвагинации плазматической мембраны и формирования везикул, в дальнейшем утилизируемых внутри клетки. Является малоизученным в плане ионного транспорта процессом.
Вещества в виде ионов преодолевают мембраны растительной клетки несколькими способами, основные из которых: 1. Диффузия через липидную фазу. Идет крайне медленно, так как липидный бислой очень плохо пропускает ионы (по градиенту электрохимического потенциала). Пример – стероиды. 2. Облегченная диффузия при помощи ионных каналов. Это быстрый процесс, так как ионы свободнее движутся через пору канала, имитирующую гидратную оболочку (происходит по градиенту электрохимического потенциала). 3. Перенос веществ с участием транспортеров и помп. Использует энергию АТФ или энергизируется разницей электрохимических потенциалов Н+, Na+, K+, других ионов. Идет медленнее, чем диффузия через ионные каналы, но значительно быстрее, чем диффузия через липидную фазу. Может происходить как по градиенту электрохимического потенциала, так и против него. 4. Эндоцитоз. Представляет собой захват внешнего материала клеткой, осуществляемый путём инвагинации плазматической мембраны и формирования везикул, в дальнейшем утилизируемых внутри клетки. Является малоизученным в плане ионного транспорта процессом.
 Вопросы для обсуждения: - каковы биофизические закономерности ионного переноса? - ген или проводимость? - для чего нужен и как устроен катионный канал? - как можно изучить механизмы его функционирования и физиологические роли? геномика, транскриптомика и феномика каналов - классические регуляторы катионных каналов - открытие новых механизмов регуляции катионных каналов растений под действием: активных форм кислорода (АФК) аминокислот пуринов (АТФ, АДФ)
Вопросы для обсуждения: - каковы биофизические закономерности ионного переноса? - ген или проводимость? - для чего нужен и как устроен катионный канал? - как можно изучить механизмы его функционирования и физиологические роли? геномика, транскриптомика и феномика каналов - классические регуляторы катионных каналов - открытие новых механизмов регуляции катионных каналов растений под действием: активных форм кислорода (АФК) аминокислот пуринов (АТФ, АДФ)
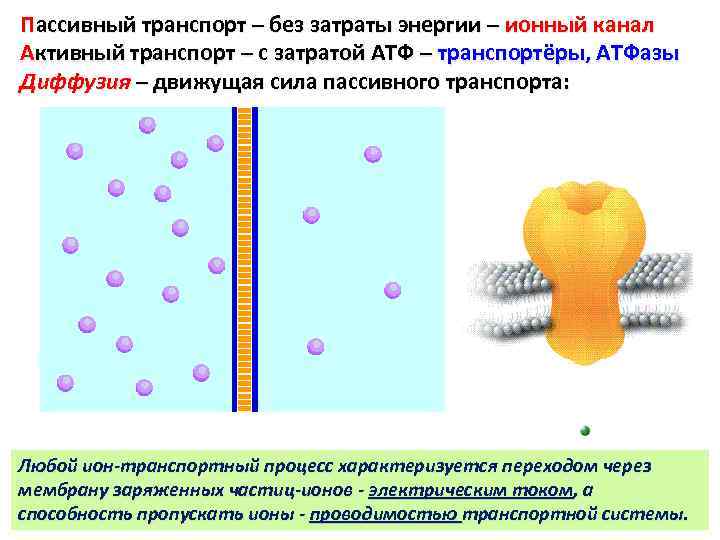 Пассивный транспорт – без затраты энергии – ионный канал Активный транспорт – с затратой АТФ – транспортёры, АТФазы Диффузия – движущая сила пассивного транспорта: Любой ион-транспортный процесс характеризуется переходом через мембрану заряженных частиц-ионов - электрическим током, а способность пропускать ионы - проводимостью транспортной системы.
Пассивный транспорт – без затраты энергии – ионный канал Активный транспорт – с затратой АТФ – транспортёры, АТФазы Диффузия – движущая сила пассивного транспорта: Любой ион-транспортный процесс характеризуется переходом через мембрану заряженных частиц-ионов - электрическим током, а способность пропускать ионы - проводимостью транспортной системы.
 Принципиальная вводная информация «Ген или проводимость? » ген - кодирует информацию о канале проводимость - характеристика «прохождения» иона через канал, т. е. активность канал(а)ов в плазматической мембране, приводящая к реализации его физиологических функций (именно проводимость изучают физиологии). «Фактор неопределенности» мы пока не знаем динамику субъединиц каналов в нативной мембране исследовали способность субъединиц из разных семейств образовывать функциональный канал. При этом, известно, что у животных это происходит, повышая разнообразие проводимостей в огромное количество раз.
Принципиальная вводная информация «Ген или проводимость? » ген - кодирует информацию о канале проводимость - характеристика «прохождения» иона через канал, т. е. активность канал(а)ов в плазматической мембране, приводящая к реализации его физиологических функций (именно проводимость изучают физиологии). «Фактор неопределенности» мы пока не знаем динамику субъединиц каналов в нативной мембране исследовали способность субъединиц из разных семейств образовывать функциональный канал. При этом, известно, что у животных это происходит, повышая разнообразие проводимостей в огромное количество раз.
 Катионный канал это гомо- или гетеротетрамерный мембранный белок, формирующий пору, селективно пропускающую катионы.
Катионный канал это гомо- или гетеротетрамерный мембранный белок, формирующий пору, селективно пропускающую катионы.
 Для чего нужен и как устроен катионный канал? Классическая схема Строение ионного канала по Бертилу Хилле (1970 -е) Важнейшие прямые функции: - ионный и информационный обмен; - целостность мембраны и эл. потенц. - осмобаланс, т. е. регуляция тургора и объема, роста растяжением; - индукция ферментов прогр. кл. см. (ПКС), регуляция ферментов цитоплазмы. Непрямые: контроль практически всех физиолого-биохимических превращений, экспрессии генов и ген. программ разв.
Для чего нужен и как устроен катионный канал? Классическая схема Строение ионного канала по Бертилу Хилле (1970 -е) Важнейшие прямые функции: - ионный и информационный обмен; - целостность мембраны и эл. потенц. - осмобаланс, т. е. регуляция тургора и объема, роста растяжением; - индукция ферментов прогр. кл. см. (ПКС), регуляция ферментов цитоплазмы. Непрямые: контроль практически всех физиолого-биохимических превращений, экспрессии генов и ген. программ разв.
 Классические свойства (характеристики): - наличие проводимости в мембране и ее величина (амплитуда токов) - преимущественная направленность тока - внутрь или наружу - потенциал-зависимость тока (вольт-амперная характеристика: ВАХ) и кинетика активации-деактивации - селективность ( «отфильтровывание» ионов) - фармакологический профиль (чувствительность к ингибиторам, активаторам и модуляторам) - регуляция под действием р. Н, ионов температуры фосфорилирования на цитопл. стороне
Классические свойства (характеристики): - наличие проводимости в мембране и ее величина (амплитуда токов) - преимущественная направленность тока - внутрь или наружу - потенциал-зависимость тока (вольт-амперная характеристика: ВАХ) и кинетика активации-деактивации - селективность ( «отфильтровывание» ионов) - фармакологический профиль (чувствительность к ингибиторам, активаторам и модуляторам) - регуляция под действием р. Н, ионов температуры фосфорилирования на цитопл. стороне
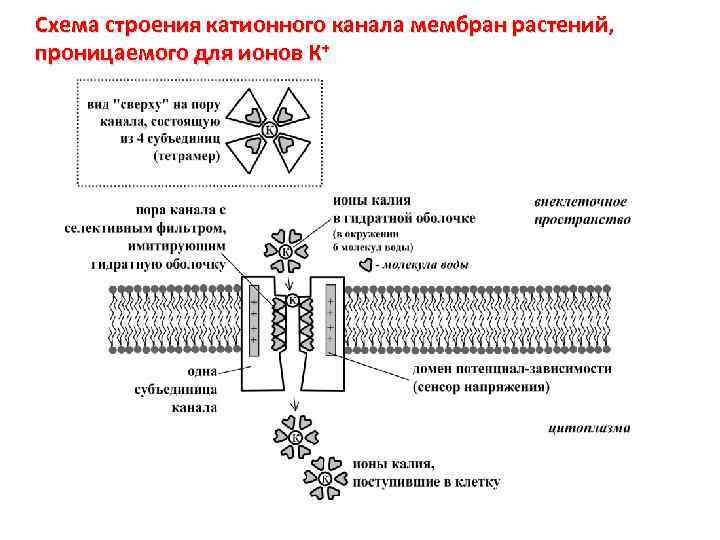 Схема строения катионного канала мембран растений, проницаемого для ионов К+
Схема строения катионного канала мембран растений, проницаемого для ионов К+
 Катионный канал это гомо- или гетеротетрамерный (? ) мембранный белок, формирующий пору, селективно пропускающую катионы.
Катионный канал это гомо- или гетеротетрамерный (? ) мембранный белок, формирующий пору, селективно пропускающую катионы.
 Катионный канал это гомо- или гетеротетрамерный (? ) мембранный белок, формирующий пору, селективно пропускающую катионы.
Катионный канал это гомо- или гетеротетрамерный (? ) мембранный белок, формирующий пору, селективно пропускающую катионы.
 Современная теория потенциалзависимости и селективности: Roderick Mac. Kinnon 2003 Nobel Prize in Chemistry Кристаллография потенциалзависимых К+-каналов Paddle – «весло» , «затвор» , «воротный механизм» Если мембранный потенциал растет, то «затвор» открывает канал
Современная теория потенциалзависимости и селективности: Roderick Mac. Kinnon 2003 Nobel Prize in Chemistry Кристаллография потенциалзависимых К+-каналов Paddle – «весло» , «затвор» , «воротный механизм» Если мембранный потенциал растет, то «затвор» открывает канал
 Современная теория потенциалзависимости и селективности: Salkoff & Wyman 1981 Nature 293: 228 -230 Mac. Kinnon 1991 Nature 350 : 232– 235 Roderick Mac. Kinnon 2003 Nobel Prize in Chemistry
Современная теория потенциалзависимости и селективности: Salkoff & Wyman 1981 Nature 293: 228 -230 Mac. Kinnon 1991 Nature 350 : 232– 235 Roderick Mac. Kinnon 2003 Nobel Prize in Chemistry
 Семейства генов катионных каналов Arabidopsis thaliana L. Heynh. и структурная организация их продуктов № 1 2 3 1 Наименование семейства каналов (на основе схожести структуры и эволюционного происхождения) Кол-во генов Особенности структуры К+-селективные катионные каналы (15 генов) Шейкеры 9 Тетрамер, 6 трансмембранных доменов, один поровый сайт, К+-селективный фильтр (GYGD-домен), домен GYGD-домен), потенциал-зависимости. K+-селективные каналы с 6 Димер, 4 трансмембранных домена, два поровых тандемной порой сайта, К+-селективный фильтр (GYGD-домен), домен GYGD-домен), потенциал-зависимости отсутствует. Неселективные катионные каналы (41 ген) Ионотропные глутаматные 20 Тетрамер, 3 трансмембранных домена, один поровый рецепторы сайт, один наружный сайт активации аминокислотами, селективный фильтр неизвестной структуры, домен потенциал-зависимости не определен. Каналы, активирующиеся 20 Тетрамер, 6 трансмембранных доменов, один поровый циклическими нуклеотидами сайт, селективный фильтр неизвестной структуры, домен потенциал-зависимости. Двухпоровый канал 1 Димер, 12 трансмембранных доменов, два поровых сайта, селективный фильтр, проницаемый для Са 2+ и Na+, домен потенциал-зависимости. Механочувствительные катионные каналы (13 генов) Механочувствительно-подобные 10 Тример или тетрамер, 2 трансмембранных домена. каналы Механочувствительные MCA 2 Тример или тетрамер, 1 трансмембранный домен. каналы Механочувствительные Пьезо 1 Олигомер, 30 трансмембранных доменов. каналы Аннексины (8 генов) Аннексины 8 Встраиваемые в мембрану цитоплазматические белки, формирующие неселективный катионный канал. K+-селективные
Семейства генов катионных каналов Arabidopsis thaliana L. Heynh. и структурная организация их продуктов № 1 2 3 1 Наименование семейства каналов (на основе схожести структуры и эволюционного происхождения) Кол-во генов Особенности структуры К+-селективные катионные каналы (15 генов) Шейкеры 9 Тетрамер, 6 трансмембранных доменов, один поровый сайт, К+-селективный фильтр (GYGD-домен), домен GYGD-домен), потенциал-зависимости. K+-селективные каналы с 6 Димер, 4 трансмембранных домена, два поровых тандемной порой сайта, К+-селективный фильтр (GYGD-домен), домен GYGD-домен), потенциал-зависимости отсутствует. Неселективные катионные каналы (41 ген) Ионотропные глутаматные 20 Тетрамер, 3 трансмембранных домена, один поровый рецепторы сайт, один наружный сайт активации аминокислотами, селективный фильтр неизвестной структуры, домен потенциал-зависимости не определен. Каналы, активирующиеся 20 Тетрамер, 6 трансмембранных доменов, один поровый циклическими нуклеотидами сайт, селективный фильтр неизвестной структуры, домен потенциал-зависимости. Двухпоровый канал 1 Димер, 12 трансмембранных доменов, два поровых сайта, селективный фильтр, проницаемый для Са 2+ и Na+, домен потенциал-зависимости. Механочувствительные катионные каналы (13 генов) Механочувствительно-подобные 10 Тример или тетрамер, 2 трансмембранных домена. каналы Механочувствительные MCA 2 Тример или тетрамер, 1 трансмембранный домен. каналы Механочувствительные Пьезо 1 Олигомер, 30 трансмембранных доменов. каналы Аннексины (8 генов) Аннексины 8 Встраиваемые в мембрану цитоплазматические белки, формирующие неселективный катионный канал. K+-селективные
 Анионные каналы растений Три семейства генов кодируют многообразие анионных проводимостей мембран растительной клетки: CLC (“chloride channel”, в пер. с англ. «хлорный канал» ) SLAC (“slow anion channel”, в пер. с англ. «медленный анионный канал» ) ALMT (“aluminum-activated malate transporter”, в пер. с англ. «активируемый алюминием малатный транспортер» ) У арабидопсиса, тополя и риса семейство CLC представлено 5, 8 и 5 генами, SLAC - 5, 4 и 7 генами, ALMT – 13, 22 и 8 генами, соответственно. Многие представители SLAC и ALMT экспрессируются в плазматической мембране. Каналы семейства CLC, вероятно, выполняют функцию анионных каналов эндомембран. Высокая проницаемость к крупным органическим анионам отмечена для семейства ALMT, представители которого экспрессируются во всех типах мембран. Электрофизиологические исследования анионных каналов плазматических мембран клеток высших растений проводятся с конца восьмидесятых годов прошлого века. Выделены два основных типа проводимостей, ответственных за транспорт анионов: Rи S-каналы (R - “rapid”, т. е. с быстрой кинетикой активации; S - “slow”, т. е. с медленной кинетикой активации).
Анионные каналы растений Три семейства генов кодируют многообразие анионных проводимостей мембран растительной клетки: CLC (“chloride channel”, в пер. с англ. «хлорный канал» ) SLAC (“slow anion channel”, в пер. с англ. «медленный анионный канал» ) ALMT (“aluminum-activated malate transporter”, в пер. с англ. «активируемый алюминием малатный транспортер» ) У арабидопсиса, тополя и риса семейство CLC представлено 5, 8 и 5 генами, SLAC - 5, 4 и 7 генами, ALMT – 13, 22 и 8 генами, соответственно. Многие представители SLAC и ALMT экспрессируются в плазматической мембране. Каналы семейства CLC, вероятно, выполняют функцию анионных каналов эндомембран. Высокая проницаемость к крупным органическим анионам отмечена для семейства ALMT, представители которого экспрессируются во всех типах мембран. Электрофизиологические исследования анионных каналов плазматических мембран клеток высших растений проводятся с конца восьмидесятых годов прошлого века. Выделены два основных типа проводимостей, ответственных за транспорт анионов: Rи S-каналы (R - “rapid”, т. е. с быстрой кинетикой активации; S - “slow”, т. е. с медленной кинетикой активации).
 Примеры основных субъединиц катионных каналов растений:
Примеры основных субъединиц катионных каналов растений:
 Alignments of plant ion channel sequences with other cation channels. (A) CNGC full-length c. DNAs, human cone photoreceptor Hs. CNG 3, rabbit olfactory receptor Oc. CNG 3, Drosophila Dm. EAG, human HCN 2, Drosophila Shaker KC channel, and Arabidopsis KC channels KAT 1, AKT 1, SKOR, and KCO 1. (B) S 4 voltagesensing domains of the same channel sequences, showing positively charged residues including histidine (p. Ka=6. 5). (C) Putative pore regions predicted for plant i. GLR c. DNAs, Synechocystis Glu. R 0, rat Glu. R 6, rat NMDAR 1, human Ntype Ca channel alpha 1 B subunit pore motif III (Ca. C 2. 1), mouse type 1 IP 3 receptor (IP 3 R), and mouse ryanodine receptor (Ry. R). Chemical properties of amino acid side Demidchik et al. 2002 Annual Reviews of Plant Biology 53: 67 -107
Alignments of plant ion channel sequences with other cation channels. (A) CNGC full-length c. DNAs, human cone photoreceptor Hs. CNG 3, rabbit olfactory receptor Oc. CNG 3, Drosophila Dm. EAG, human HCN 2, Drosophila Shaker KC channel, and Arabidopsis KC channels KAT 1, AKT 1, SKOR, and KCO 1. (B) S 4 voltagesensing domains of the same channel sequences, showing positively charged residues including histidine (p. Ka=6. 5). (C) Putative pore regions predicted for plant i. GLR c. DNAs, Synechocystis Glu. R 0, rat Glu. R 6, rat NMDAR 1, human Ntype Ca channel alpha 1 B subunit pore motif III (Ca. C 2. 1), mouse type 1 IP 3 receptor (IP 3 R), and mouse ryanodine receptor (Ry. R). Chemical properties of amino acid side Demidchik et al. 2002 Annual Reviews of Plant Biology 53: 67 -107
 М Structural domains of some families олекулярная физиология катионных каналов: of cation transporters. Single alpha - subunits are shown for each type. структура и расположение генов, субъединиц, Asterisk indicates presence in plants. функциональных доменов Ca. M, calmodulinbinding domain; CNB, cyclic nucleotide-binding - влияние факторов транскрипции, РНК-интерференции и domain; PBP, periplasmic amino acid посттрансляционной модификации, взаимодействия с другими binding protein-like domain. белками, липидами и метаболитами на активность(A) 2 TM IP, e. g. , Ksc. A from Streptomyces lividans. (B) 6 TM 1 P, проводимость e. g. , Shaker-type depolarization- уровень, пространственное распределение и динамика activated KC channels. (C) 6 TM 1 P, экспрессии e. g. , HCN, EAG/ERG/ELK, and plant AKT and KAT channels. (D) 6 TM 1 P animal CNGC 1 P Некоторые channels. (E) 6 TM (F) обзоры: plant putative CNGC channels. Rainer 1 P, e. g. , At. CCH 1. (G) 4 x 6 TM 2012 Annu Rev Physiol 1777– 1811 1 P, et al. , 2009 Annu Rev Physiol 71: 59– 82 Ward e. g. , depolarization-activated neuronal Na. C and Ca 2 C channels. (H) Demidchik & Maathuis 2007 New Phytol 175: 387– 404 2 x 2 TM 1 P, e. g. , KCO family. (I ) 8 TM 1 P channels, e. g. , TOK KC channels. (J) Bacterial i. GLR, Glu. R 0. (K) Eukaryotic low molecular weight Demidchik et al. 2002 Annual Reviews of Plant Biology 53: 67 -107 i. GLR-like proteins. (L) Plant and
М Structural domains of some families олекулярная физиология катионных каналов: of cation transporters. Single alpha - subunits are shown for each type. структура и расположение генов, субъединиц, Asterisk indicates presence in plants. функциональных доменов Ca. M, calmodulinbinding domain; CNB, cyclic nucleotide-binding - влияние факторов транскрипции, РНК-интерференции и domain; PBP, periplasmic amino acid посттрансляционной модификации, взаимодействия с другими binding protein-like domain. белками, липидами и метаболитами на активность(A) 2 TM IP, e. g. , Ksc. A from Streptomyces lividans. (B) 6 TM 1 P, проводимость e. g. , Shaker-type depolarization- уровень, пространственное распределение и динамика activated KC channels. (C) 6 TM 1 P, экспрессии e. g. , HCN, EAG/ERG/ELK, and plant AKT and KAT channels. (D) 6 TM 1 P animal CNGC 1 P Некоторые channels. (E) 6 TM (F) обзоры: plant putative CNGC channels. Rainer 1 P, e. g. , At. CCH 1. (G) 4 x 6 TM 2012 Annu Rev Physiol 1777– 1811 1 P, et al. , 2009 Annu Rev Physiol 71: 59– 82 Ward e. g. , depolarization-activated neuronal Na. C and Ca 2 C channels. (H) Demidchik & Maathuis 2007 New Phytol 175: 387– 404 2 x 2 TM 1 P, e. g. , KCO family. (I ) 8 TM 1 P channels, e. g. , TOK KC channels. (J) Bacterial i. GLR, Glu. R 0. (K) Eukaryotic low molecular weight Demidchik et al. 2002 Annual Reviews of Plant Biology 53: 67 -107 i. GLR-like proteins. (L) Plant and
 К+-селективные катионные каналы по мнению Р. Хейдрика (подход скорее всего
К+-селективные катионные каналы по мнению Р. Хейдрика (подход скорее всего
 Shaker-тип - превалирует у высших растений – 6 трансмембранных доменов (1 -6), один поровый домен (Р) 28 генов у арабидопсиса. От Шейкеров животных отличаются строением поры (Р) и механизму гейтинга (открываниязакрывания) Demidchik et al. 2002 Annual Reviews of Plant Biology 53: 67 -107
Shaker-тип - превалирует у высших растений – 6 трансмембранных доменов (1 -6), один поровый домен (Р) 28 генов у арабидопсиса. От Шейкеров животных отличаются строением поры (Р) и механизму гейтинга (открываниязакрывания) Demidchik et al. 2002 Annual Reviews of Plant Biology 53: 67 -107
 Физиология Shaker-типа у высших растений – классическая функция: поглощение и выделение К+ дополнительные функции: транспорт NH 4+, Na+, Cs+ и Ca 2+, Са 2+-сигнализация, поддержание электрического потенциала, осмотического давления, работы устьиц и т. д.
Физиология Shaker-типа у высших растений – классическая функция: поглощение и выделение К+ дополнительные функции: транспорт NH 4+, Na+, Cs+ и Ca 2+, Са 2+-сигнализация, поддержание электрического потенциала, осмотического давления, работы устьиц и т. д.
 Молекулярная физиология катионных каналов: - структура и расположение генов, субъединиц, функциональных доменов - влияние факторов транскрипции, РНК-интерференции и посттрансляционной модификации, взаимодействия с другими белками, липидами и метаболитами на активностьпроводимость - уровень, пространственное распределение и динамика экспрессии Некоторые обзоры: Rainer 2012 Annu Rev Physiol 1777– 1811 Ward et al. , 2009 Annu Rev Physiol 71: 59– 82 Demidchik & Maathuis 2007 New Phytol 175: 387– 404
Молекулярная физиология катионных каналов: - структура и расположение генов, субъединиц, функциональных доменов - влияние факторов транскрипции, РНК-интерференции и посттрансляционной модификации, взаимодействия с другими белками, липидами и метаболитами на активностьпроводимость - уровень, пространственное распределение и динамика экспрессии Некоторые обзоры: Rainer 2012 Annu Rev Physiol 1777– 1811 Ward et al. , 2009 Annu Rev Physiol 71: 59– 82 Demidchik & Maathuis 2007 New Phytol 175: 387– 404
 Изучение ионных каналов: - на уровне поток ионов в органах и целом растении - на уровне популяции каналов целой клетки - на уровне одиночных каналов - на уровне доменов и аминоксилот Некоторые экспериментальные подходы: - двухэлектродная фиксация напряжения - пэтч-кламп - Са 2+-люминометрия, флуоресцентные зонды - внешние сканирующие ион-селективные электроды - внутриклеточное измерение при помощи «острых» ион-селективных электродов» - позитронная томография - стандартная молекулярная генетика - генерация и анализ свойств химерных белков
Изучение ионных каналов: - на уровне поток ионов в органах и целом растении - на уровне популяции каналов целой клетки - на уровне одиночных каналов - на уровне доменов и аминоксилот Некоторые экспериментальные подходы: - двухэлектродная фиксация напряжения - пэтч-кламп - Са 2+-люминометрия, флуоресцентные зонды - внешние сканирующие ион-селективные электроды - внутриклеточное измерение при помощи «острых» ион-селективных электродов» - позитронная томография - стандартная молекулярная генетика - генерация и анализ свойств химерных белков
 Некоторые аспекты использования методов "реверсивной генетики" при изучении неселективных катионных каналов растений Несмотря на успехи бионформационных исследований, методы «реверсивной генетики» не дали значительных результатов в случае НКК высших растений. Пока не обнаружено прямой взаимосвязи с отдельными членами данных семейств НКК и катионными проводимостями мембран. Не ясной остается структура и особенности функционирования не только селективного фильтра, но и гейтинг-аппарата большинства НКК, отсутствуют исследования его молекулярно-генетической и структурной природы. Трудности классических подходов, связанных с генерацией растенийнокаутов и «сверх-экспрессоров» НКК, в первую очередь возникают из-за высокой редандности этих систем. Так, в «двойных нокаутах» (когда «не функциональны» 2 белка) отсутствуют изменения картины трансмембранных катионных токов.
Некоторые аспекты использования методов "реверсивной генетики" при изучении неселективных катионных каналов растений Несмотря на успехи бионформационных исследований, методы «реверсивной генетики» не дали значительных результатов в случае НКК высших растений. Пока не обнаружено прямой взаимосвязи с отдельными членами данных семейств НКК и катионными проводимостями мембран. Не ясной остается структура и особенности функционирования не только селективного фильтра, но и гейтинг-аппарата большинства НКК, отсутствуют исследования его молекулярно-генетической и структурной природы. Трудности классических подходов, связанных с генерацией растенийнокаутов и «сверх-экспрессоров» НКК, в первую очередь возникают из-за высокой редандности этих систем. Так, в «двойных нокаутах» (когда «не функциональны» 2 белка) отсутствуют изменения картины трансмембранных катионных токов.
 Эпидермальные клетки представлены (примерно 1: 1) трихобластами (образующими корневые волоски) и атрихобластами (необразующими корневые волоски) 100 μм атрихобласт Основной объект: эпидермис корня Arabidopsis thaliana
Эпидермальные клетки представлены (примерно 1: 1) трихобластами (образующими корневые волоски) и атрихобластами (необразующими корневые волоски) 100 μм атрихобласт Основной объект: эпидермис корня Arabidopsis thaliana
 Все эпидермальные клетки корня участвуют в поглощении минеральных элементов из почвы, но наиболее активны зона роста растяжением (ЗРР) и кончики корневых волосков (КВ). В этих клетках измерена наибольшая плотность ионных токов (до 5 -10 раз выше, чем в зрелых клетках). 300 μм Балджи – зачаточные корневые волоски Эпидермис зоны роста растяжением корня Arabidopsis thaliana
Все эпидермальные клетки корня участвуют в поглощении минеральных элементов из почвы, но наиболее активны зона роста растяжением (ЗРР) и кончики корневых волосков (КВ). В этих клетках измерена наибольшая плотность ионных токов (до 5 -10 раз выше, чем в зрелых клетках). 300 μм Балджи – зачаточные корневые волоски Эпидермис зоны роста растяжением корня Arabidopsis thaliana
 Методы: Пэтч-кламп анализ только протопласты
Методы: Пэтч-кламп анализ только протопласты
 Пэтч-кламп
Пэтч-кламп
 Методы: Пэтч-кламп анализ
Методы: Пэтч-кламп анализ
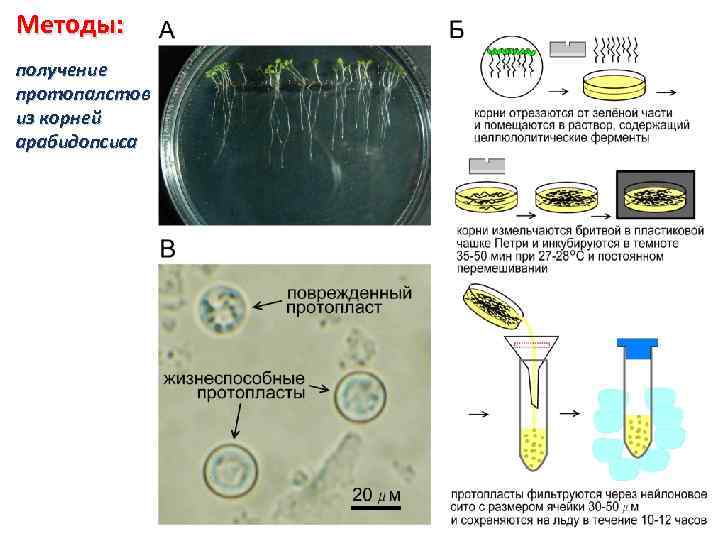 Методы: получение протопалстов из корней арабидопсиса
Методы: получение протопалстов из корней арабидопсиса
 PATCH-CLAMP ELECTROPHYSIOLOGY Electrical scheme allows to fix (clamp) the membrane voltage and record current through the membrane at the same time
PATCH-CLAMP ELECTROPHYSIOLOGY Electrical scheme allows to fix (clamp) the membrane voltage and record current through the membrane at the same time
 Few words about electrophysiological techniques PATCH-CLAMP ELECTROPHYSIOLOGY: Bathing cytosol solution Very tight (gigaohmic resistance) contact between protoplast membrane and pipette glass (KIMAX-51) does not allow leakage and is achieved by negative pressure in the pipette solution flows into the cytosol (can be controlled) Glass micropipette Protoplast Demidchik V (2012) Characterisation of root plasma membrane Ca 2+-permeable cation channels: techniques and basic concepts In AG Volkov “Plant Electrophysiology”, Springer-Verlag. P. 339 -370.
Few words about electrophysiological techniques PATCH-CLAMP ELECTROPHYSIOLOGY: Bathing cytosol solution Very tight (gigaohmic resistance) contact between protoplast membrane and pipette glass (KIMAX-51) does not allow leakage and is achieved by negative pressure in the pipette solution flows into the cytosol (can be controlled) Glass micropipette Protoplast Demidchik V (2012) Characterisation of root plasma membrane Ca 2+-permeable cation channels: techniques and basic concepts In AG Volkov “Plant Electrophysiology”, Springer-Verlag. P. 339 -370.
 Whole-cell current-voltage curve (I-V curve): Current activates in response to voltage changes because current is driven by voltage and channels have got a voltage sensor I, p. A + positive I ( ) or cation efflux I-V curve: +50 m. V -50 m. V -100 m. V I = 100 p. A I = 20 p. A I = -5 p. A I = -20 p. A I = -100 p. A current - negative I ( ) or cation influx I = 0 p. A +100 m. V time V, m. V
Whole-cell current-voltage curve (I-V curve): Current activates in response to voltage changes because current is driven by voltage and channels have got a voltage sensor I, p. A + positive I ( ) or cation efflux I-V curve: +50 m. V -50 m. V -100 m. V I = 100 p. A I = 20 p. A I = -5 p. A I = -20 p. A I = -100 p. A current - negative I ( ) or cation influx I = 0 p. A +100 m. V time V, m. V
 Properties of ionic channels current (I) is driven by voltage (V) conductance is a channel’s capacity to conduct the current. The amplitude (size) of currents tells us about expression of channels and their functional activities. I – current (A or p. A) – measure of ion movement/activity of channel V – voltage (V or m. V) – driving force for ion movement Current-Voltage Curve is a “biophysical passport” of the channel showing its properties such as conductance and voltage-dependence cation efflux cation influx
Properties of ionic channels current (I) is driven by voltage (V) conductance is a channel’s capacity to conduct the current. The amplitude (size) of currents tells us about expression of channels and their functional activities. I – current (A or p. A) – measure of ion movement/activity of channel V – voltage (V or m. V) – driving force for ion movement Current-Voltage Curve is a “biophysical passport” of the channel showing its properties such as conductance and voltage-dependence cation efflux cation influx
 Электрический потенциал плазматической мембраны растительной клетки и соответствующие катионные токи А – шкала физиологическизначимых потенциалов и ВАХ деполяризационно-активируемых, гиперпоразиционно-активируемых и потенциал-независимых катионных каналов. Разность потенциалов покоя (РПП) плазматической мембраны (ПМ) обычно находится в диапазоне от 150 до -105 м. В. Гипер- и деполяризация – более негативные или более позитивные значения потенциала соответственно. Б – кинетика тока, вызванного гиперполяризацией (синяя стрелка) или деполяризацией (красная стрелка) ПМ, соответствующая быстро- и медленно-активируемым каналам.
Электрический потенциал плазматической мембраны растительной клетки и соответствующие катионные токи А – шкала физиологическизначимых потенциалов и ВАХ деполяризационно-активируемых, гиперпоразиционно-активируемых и потенциал-независимых катионных каналов. Разность потенциалов покоя (РПП) плазматической мембраны (ПМ) обычно находится в диапазоне от 150 до -105 м. В. Гипер- и деполяризация – более негативные или более позитивные значения потенциала соответственно. Б – кинетика тока, вызванного гиперполяризацией (синяя стрелка) или деполяризацией (красная стрелка) ПМ, соответствующая быстро- и медленно-активируемым каналам.
 Вольт-Амперная Характеристика (ВАХ) проводимости или ионного канала
Вольт-Амперная Характеристика (ВАХ) проводимости или ионного канала
 Кривые временного хода (кинетика) изменения токов через мембрану в ответ на изменение напряжение
Кривые временного хода (кинетика) изменения токов через мембрану в ответ на изменение напряжение
 Изготовление пэтч-кламп пипеток
Изготовление пэтч-кламп пипеток
 Изготовление пэтч-кламп пипеток
Изготовление пэтч-кламп пипеток
 Регистрация одиночных каналов:
Регистрация одиночных каналов:
 У высших растений отсутствуют гены классических кальциевых каналов, однако есть кальциевая проводимость. Генетическая основа кальциевой проводимости плазматических мембран высших растений не ясна. Для их анализа и классификации можно использовать чувствительность к напряжению, лигандам, кинетику активации, особенности взаимодействия с блокаторами и другие биофизические свойства. На основе чувствительности к напряжению на мембране можно выделить три основных типа Са 2+-проницаемых каналов плазматической мембраны высших растений: - каналы, активирующиеся при деполяризации DACCs - depolarisation activated cation channels - каналы, активирующиеся при гиперполяризации HACCs - hyperpolarisation activated cation channels - каналы, нечувствительные к напряжению VICs - voltage independent channels
У высших растений отсутствуют гены классических кальциевых каналов, однако есть кальциевая проводимость. Генетическая основа кальциевой проводимости плазматических мембран высших растений не ясна. Для их анализа и классификации можно использовать чувствительность к напряжению, лигандам, кинетику активации, особенности взаимодействия с блокаторами и другие биофизические свойства. На основе чувствительности к напряжению на мембране можно выделить три основных типа Са 2+-проницаемых каналов плазматической мембраны высших растений: - каналы, активирующиеся при деполяризации DACCs - depolarisation activated cation channels - каналы, активирующиеся при гиперполяризации HACCs - hyperpolarisation activated cation channels - каналы, нечувствительные к напряжению VICs - voltage independent channels
 Во многих растительных клетках, например, в таких важных для жизни растения тканях как эпидермис (трихобласты и атрихобласты), кора корня и клетки зоны роста растяжением (ЗРР), НКК всех трех типов функционируют совместно, образуя взамосвязанную систему транспорта Са 2+ и других катионов. Demidchik et al. 2002 Plant J
Во многих растительных клетках, например, в таких важных для жизни растения тканях как эпидермис (трихобласты и атрихобласты), кора корня и клетки зоны роста растяжением (ЗРР), НКК всех трех типов функционируют совместно, образуя взамосвязанную систему транспорта Са 2+ и других катионов. Demidchik et al. 2002 Plant J
 Функциональная классификация НКК ПМ высших растений: 1) стационарные деполяризационно-активируемые НКК (Д-НКК); 2) стационарные гиперполяризационно-активируемые НКК (Г-НКК); 3) стационарные потенциал-независимые НКК (ПН-НКК); 4) НКК, активируемые циклическими нуклеотидами; 5) НКК, активируемые аминокислотами; 6) НКК, активируемые реактивными формами кислорода (РФК); 7) НКК, активируемые патогенными элиситорами.
Функциональная классификация НКК ПМ высших растений: 1) стационарные деполяризационно-активируемые НКК (Д-НКК); 2) стационарные гиперполяризационно-активируемые НКК (Г-НКК); 3) стационарные потенциал-независимые НКК (ПН-НКК); 4) НКК, активируемые циклическими нуклеотидами; 5) НКК, активируемые аминокислотами; 6) НКК, активируемые реактивными формами кислорода (РФК); 7) НКК, активируемые патогенными элиситорами.
 Потенциальные новые регуляторы: - аминокислоты (открыто 20 генов ионотропных глутаматных рецепторов у растений) - НКК? - пурины (известны деполяризация и в геном низших растений есть пуриноцепторы) - НКК? - активные формы кислорода (наши работы по меди на водорослях указывали на возможность наличия таких систем в корне высших растений) - НКК?
Потенциальные новые регуляторы: - аминокислоты (открыто 20 генов ионотропных глутаматных рецепторов у растений) - НКК? - пурины (известны деполяризация и в геном низших растений есть пуриноцепторы) - НКК? - активные формы кислорода (наши работы по меди на водорослях указывали на возможность наличия таких систем в корне высших растений) - НКК?
 Двойной пэтчкламп анализ Nature Protocols (2006) 1, 1799 - 1809
Двойной пэтчкламп анализ Nature Protocols (2006) 1, 1799 - 1809
 Как выделить из общей проводимости плазматической мембраны именно неселективные катионные каналы (НКК)?
Как выделить из общей проводимости плазматической мембраны именно неселективные катионные каналы (НКК)?
 Натриевая проводимость - маркер неселективности!
Натриевая проводимость - маркер неселективности!

 Но данная проводимость оказалась также хорошо проницаема для кальция и других двухвалентных катионов
Но данная проводимость оказалась также хорошо проницаема для кальция и других двухвалентных катионов
 Но данная проводимость оказалась также хорошо проницаема для кальция и других двухвалентных катионов
Но данная проводимость оказалась также хорошо проницаема для кальция и других двухвалентных катионов
 Глутамат- и глицинактивируемые катионные проводимости А – входящие ЦК-токи до (верхняя панель) и после (нижняя панель) добавления 1 м. М Na-глутамата (10 мин); Б – эффект 1 м. М хинина на глутамат-активируемые токи; В – ВАХ до и после добавления глутамата (X Sx). НР: 100 м. М Na. Cl, 0. 5 м. М Са. Сl 2, р. Н 6, 0. НР: 0, 5 м. М Са. Cl 2, р. Н 6, 0. ПР: 30 м. М Na+, 25 м. М глюконат+, 5 м. М Cl-, р. Н 7, 2, 100 н. М 2+
Глутамат- и глицинактивируемые катионные проводимости А – входящие ЦК-токи до (верхняя панель) и после (нижняя панель) добавления 1 м. М Na-глутамата (10 мин); Б – эффект 1 м. М хинина на глутамат-активируемые токи; В – ВАХ до и после добавления глутамата (X Sx). НР: 100 м. М Na. Cl, 0. 5 м. М Са. Сl 2, р. Н 6, 0. НР: 0, 5 м. М Са. Cl 2, р. Н 6, 0. ПР: 30 м. М Na+, 25 м. М глюконат+, 5 м. М Cl-, р. Н 7, 2, 100 н. М 2+
 Пурин-активируемые катионные проводимости АТФ-активируемые Na+-токи через плазматическую мембрану клеток зрелого эпидермиса корня арабидопсиса. Типичные ЦК-токи до (верхняя панель) до и после (нижняя панель) добавления 30 М АТФ (5 мин); Б - ВАХ (n = 4; X Sx) до и после добавления АТФ. НР: 10 м. М Na. Cl, 0. 5 м. М Са. Сl 2, р. Н 6, 0. ПР: 50 м. М Na+, 40 м. М глюконат+, 10 м. М Cl-, р. Н 7, 2, 100 н. М Са 2+.
Пурин-активируемые катионные проводимости АТФ-активируемые Na+-токи через плазматическую мембрану клеток зрелого эпидермиса корня арабидопсиса. Типичные ЦК-токи до (верхняя панель) до и после (нижняя панель) добавления 30 М АТФ (5 мин); Б - ВАХ (n = 4; X Sx) до и после добавления АТФ. НР: 10 м. М Na. Cl, 0. 5 м. М Са. Сl 2, р. Н 6, 0. ПР: 50 м. М Na+, 40 м. М глюконат+, 10 м. М Cl-, р. Н 7, 2, 100 н. М Са 2+.
 Пурин-активируемые катионные проводимости
Пурин-активируемые катионные проводимости
 Методы: MIFETM - microelectrode ion flux estimation Вибрационные ионселективные микроэлектроды
Методы: MIFETM - microelectrode ion flux estimation Вибрационные ионселективные микроэлектроды
 Методы: Эквориновая Са 2+-хемилюминометрия - протопласты или - интактные корни
Методы: Эквориновая Са 2+-хемилюминометрия - протопласты или - интактные корни
![Фазы типичного временного хода повышения уровня [Са 2+]цит. в ответ на оксидативный стресс (1 Фазы типичного временного хода повышения уровня [Са 2+]цит. в ответ на оксидативный стресс (1](https://present5.com/presentation/26808232_384525018/image-60.jpg) Фазы типичного временного хода повышения уровня [Са 2+]цит. в ответ на оксидативный стресс (1 м. М Н 2 O 2, 5 µМ Cu 2+, 0, 1 м. М L-аскорбиновой кислоты; Са 2+аквориновая люминометрии; протопласты из эпидермиса корня растений арабидопсиса, конститутивно экспрессирующих апоэкворин). 1 – фаза покоя (базальный уровень [Са 2+]цит. до стрессового воздействия; около 100 н. М). 2 – первичное непродолжительное «спайкообразное» увеличение [Са 2+]цит. (обычный компонент Са 2+-сигнала, связанный с активацией механочувствительных каналов). 3 – вторичное увеличение [Са 2+]цит. (более продолжительное, имеет сложную форму и часто состоит из нескольких стадий). 4 – затухание Са 2+-волны (связано с закрыванием катионных каналов и активацией систем устранения Са 2+ из цитоплазмы). 5 – возвращение на базальный уровень.
Фазы типичного временного хода повышения уровня [Са 2+]цит. в ответ на оксидативный стресс (1 м. М Н 2 O 2, 5 µМ Cu 2+, 0, 1 м. М L-аскорбиновой кислоты; Са 2+аквориновая люминометрии; протопласты из эпидермиса корня растений арабидопсиса, конститутивно экспрессирующих апоэкворин). 1 – фаза покоя (базальный уровень [Са 2+]цит. до стрессового воздействия; около 100 н. М). 2 – первичное непродолжительное «спайкообразное» увеличение [Са 2+]цит. (обычный компонент Са 2+-сигнала, связанный с активацией механочувствительных каналов). 3 – вторичное увеличение [Са 2+]цит. (более продолжительное, имеет сложную форму и часто состоит из нескольких стадий). 4 – затухание Са 2+-волны (связано с закрыванием катионных каналов и активацией систем устранения Са 2+ из цитоплазмы). 5 – возвращение на базальный уровень.
![Пурин-активируемые катионные проводимости Изменения [Са 2+]цит. в интактных корнях арабидопсиса в ответ на гидролизуемые Пурин-активируемые катионные проводимости Изменения [Са 2+]цит. в интактных корнях арабидопсиса в ответ на гидролизуемые](https://present5.com/presentation/26808232_384525018/image-61.jpg) Пурин-активируемые катионные проводимости Изменения [Са 2+]цит. в интактных корнях арабидопсиса в ответ на гидролизуемые и негидролизуемые аналоги АТФ и АДФ
Пурин-активируемые катионные проводимости Изменения [Са 2+]цит. в интактных корнях арабидопсиса в ответ на гидролизуемые и негидролизуемые аналоги АТФ и АДФ



 Роль реактивных форм кислорода в росте клеток корня арабидопсиса А – зрелый эпидермис корня растений дикого типа и rhd 2 (сканирующая электронная криогенная микроскопия; напыление золотом); Б изменение длины корневого волоска (ДКВ) и параллельное увеличение интенсивности флуоресценции (ИФ; относительные единицы) РФКзонда ХЛ-ДХДГФ, соответствующее генерации РФК в диком типе и rhd 2; В – эффект ингибитора НАДФН-оксидазы дифенилен-иодония (добавленного в среду культивирования) на рост корня в длину у растений дикого типа и rhd 2 (X Sx).
Роль реактивных форм кислорода в росте клеток корня арабидопсиса А – зрелый эпидермис корня растений дикого типа и rhd 2 (сканирующая электронная криогенная микроскопия; напыление золотом); Б изменение длины корневого волоска (ДКВ) и параллельное увеличение интенсивности флуоресценции (ИФ; относительные единицы) РФКзонда ХЛ-ДХДГФ, соответствующее генерации РФК в диком типе и rhd 2; В – эффект ингибитора НАДФН-оксидазы дифенилен-иодония (добавленного в среду культивирования) на рост корня в длину у растений дикого типа и rhd 2 (X Sx).
 Повышение цитоплазматической активности Са 2+ в протопластах (справа целый трихобласт), изолированных из апекса корневого волоска растений дикого типа (А и Б) и rhd 2 (В и Г), индуцируемое 15 -минутным воздействием ОН -генерирующей смеси. ОН -генерирующая смесь содержала 0, 2 м. М Cu. Cl 2, 0, 2 м. М аскорбата и 2 м. М Н 2 О 2. А и В - НР без Gd 3+; Б и Г - НР содержал 0. 1 м. М Gd 3+. Использовалась конфокальная флуоресцентная микроскопия. [Са 2+]цит. был оценен с помощью флуоресцентной метки Calcium Green. Зеленая окраска 2+
Повышение цитоплазматической активности Са 2+ в протопластах (справа целый трихобласт), изолированных из апекса корневого волоска растений дикого типа (А и Б) и rhd 2 (В и Г), индуцируемое 15 -минутным воздействием ОН -генерирующей смеси. ОН -генерирующая смесь содержала 0, 2 м. М Cu. Cl 2, 0, 2 м. М аскорбата и 2 м. М Н 2 О 2. А и В - НР без Gd 3+; Б и Г - НР содержал 0. 1 м. М Gd 3+. Использовалась конфокальная флуоресцентная микроскопия. [Са 2+]цит. был оценен с помощью флуоресцентной метки Calcium Green. Зеленая окраска 2+
 Воздействие • OH на K+-каналы (пэтч-кламп) : A – выходящий К+-ток через плазматическую мембрану протопласта, изолированного из эпидермиса корня Arabidopsis thaliana; B – вольт-амперная характеристика (ВАХ); Cu/a - • OHгенерирующая смесь (1 м. M Cu. Cl 2, 1 м. M аскорбат); gork 1 -1 – мутант, утрачивающий наружупроводящий К+-канал (Hosy et al. 2003, Ivashikina et al. 2001, Ache et al. 2000).
Воздействие • OH на K+-каналы (пэтч-кламп) : A – выходящий К+-ток через плазматическую мембрану протопласта, изолированного из эпидермиса корня Arabidopsis thaliana; B – вольт-амперная характеристика (ВАХ); Cu/a - • OHгенерирующая смесь (1 м. M Cu. Cl 2, 1 м. M аскорбат); gork 1 -1 – мутант, утрачивающий наружупроводящий К+-канал (Hosy et al. 2003, Ivashikina et al. 2001, Ache et al. 2000).
 • OH-активируемые выходящие потоки К+, измеренные при помощи MIFE (внеклеточные вибрирующие ион-селективные электроды) Выход K+ в диком типе (WT) и gork 1 -1 индуцировался • OH (A, B), Na. Cl (C) и элиситором (целлюлизином) из Triсhoderma viride (D).
• OH-активируемые выходящие потоки К+, измеренные при помощи MIFE (внеклеточные вибрирующие ион-селективные электроды) Выход K+ в диком типе (WT) и gork 1 -1 индуцировался • OH (A, B), Na. Cl (C) и элиситором (целлюлизином) из Triсhoderma viride (D).
 К+-потоки в несколько раз больше в растущих клетках. Н 2 О 2 индуцировал очень слабые К+-потоки. A – действие • OH в зоне роста растяжением корня B, C – влияние H 2 O 2 в зрелом эпидермисе корня
К+-потоки в несколько раз больше в растущих клетках. Н 2 О 2 индуцировал очень слабые К+-потоки. A – действие • OH в зоне роста растяжением корня B, C – влияние H 2 O 2 в зрелом эпидермисе корня
 Симптомы клеточной смерти в корне арабидопсиса: A, B и C – 40 -часовая обработка буферным раствором (control), • OH (1 м. M Cu/a) или 250 м. M Na. Cl (летальное засоление)
Симптомы клеточной смерти в корне арабидопсиса: A, B и C – 40 -часовая обработка буферным раствором (control), • OH (1 м. M Cu/a) или 250 м. M Na. Cl (летальное засоление)
 FITC-VADfmk: Активация каспозоподобных протеаз 15 -часовая экспозиция (если не указано дополнительно)
FITC-VADfmk: Активация каспозоподобных протеаз 15 -часовая экспозиция (если не указано дополнительно)
 TUNEL: ‘Td. T-mediated d. UTP nick end labeling’ Определение активности эндонуклеаз прогр. клет. смерти: Casp. ACETM (Promega) A – 15 -часовая обработка 1 м. M Cu/a или 250 м. M Na. Cl; B – эффект ДНКазы (позитивный контроль); C – процент клеток, демонстрирующих деградацию ДНК
TUNEL: ‘Td. T-mediated d. UTP nick end labeling’ Определение активности эндонуклеаз прогр. клет. смерти: Casp. ACETM (Promega) A – 15 -часовая обработка 1 м. M Cu/a или 250 м. M Na. Cl; B – эффект ДНКазы (позитивный контроль); C – процент клеток, демонстрирующих деградацию ДНК


