20. Иодиметрия, иодиметрия.ppt
- Количество слайдов: 29
 Иодометрия Титрант – Na 2 S 2 O 3 5 H 2 O 0, 1; 0, 02; и 0, 01 моль/л Стандартный раствор по точной навеске приготовить нельзя, т. к. кристаллизационная вода со временем выветривается, раствор неустойчив и легко разлагается под действием кислорода воздуха, на свету и в кислой среде: S 2 O 32– + H+ HSO 3– + S 2 S 2 O 32– + O 2 2 SO 42– + 2 S
Иодометрия Титрант – Na 2 S 2 O 3 5 H 2 O 0, 1; 0, 02; и 0, 01 моль/л Стандартный раствор по точной навеске приготовить нельзя, т. к. кристаллизационная вода со временем выветривается, раствор неустойчив и легко разлагается под действием кислорода воздуха, на свету и в кислой среде: S 2 O 32– + H+ HSO 3– + S 2 S 2 O 32– + O 2 2 SO 42– + 2 S
 Готовят раствор приблизительно нужной концентрации, выдерживают не менее 10 дней Для стабилизации добавляют безводный Na 2 CO 3, при этом подавляется реакция: Na 2 S 2 O 3 + CO 2 Na. HSO 3 + Na. HCO 3 + S Стандартизация - по дихромату калия (заместительное титрование)
Готовят раствор приблизительно нужной концентрации, выдерживают не менее 10 дней Для стабилизации добавляют безводный Na 2 CO 3, при этом подавляется реакция: Na 2 S 2 O 3 + CO 2 Na. HSO 3 + Na. HCO 3 + S Стандартизация - по дихромату калия (заместительное титрование)
 K 2 Cr 2 O 7 + 6 KI + 7 H 2 SO 4 3 I 2 + Cr 2(SO 4)3 + 4 K 2 SO 4 + 7 H 2 O I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6 Ind – свежеприготовленный крахмал 5 -кратный избыток KI (для растворения I 2 и понижения потенциала системы I 2|2 I–) Выдерживаем 5 мин. на холоду (I 2 летуч), т. к. реакция идет медленно Ind добавляют в конце титрования, т. к. I 2 адсорбируется на поверхности крахмала и раствор может быть перетитрован
K 2 Cr 2 O 7 + 6 KI + 7 H 2 SO 4 3 I 2 + Cr 2(SO 4)3 + 4 K 2 SO 4 + 7 H 2 O I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6 Ind – свежеприготовленный крахмал 5 -кратный избыток KI (для растворения I 2 и понижения потенциала системы I 2|2 I–) Выдерживаем 5 мин. на холоду (I 2 летуч), т. к. реакция идет медленно Ind добавляют в конце титрования, т. к. I 2 адсорбируется на поверхности крахмала и раствор может быть перетитрован
 В колбу для титрования помещаются: Точный объем станд. р-ра K 2 Cr 2 O 7 5 -ти кратный избыток KI (по отн-ю к K 2 Cr 2 O 7) Раствор серной кислоты Выдерживают 5 минут на холоду Титруют Na 2 S 2 O 3 до светло-желтой окраски Добавляют свежеприготовленный р-р крахмала Титруют до обесцвечивания раствора
В колбу для титрования помещаются: Точный объем станд. р-ра K 2 Cr 2 O 7 5 -ти кратный избыток KI (по отн-ю к K 2 Cr 2 O 7) Раствор серной кислоты Выдерживают 5 минут на холоду Титруют Na 2 S 2 O 3 до светло-желтой окраски Добавляют свежеприготовленный р-р крахмала Титруют до обесцвечивания раствора
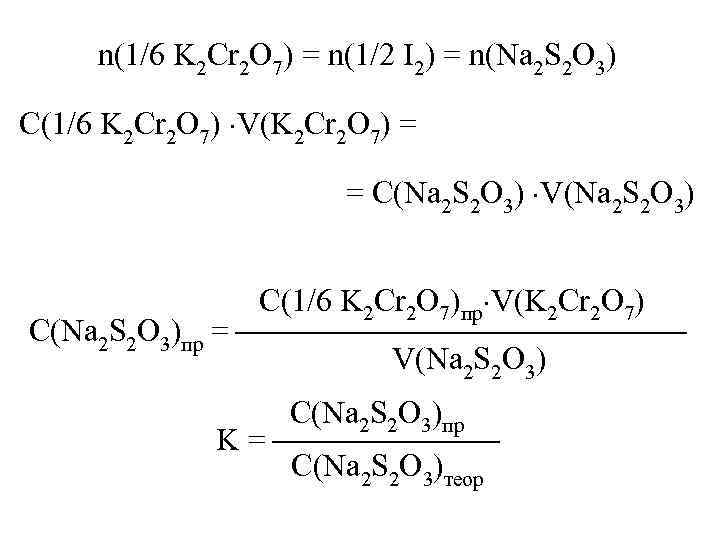 n(1/6 K 2 Cr 2 O 7) = n(1/2 I 2) = n(Na 2 S 2 O 3) С(1/6 K 2 Cr 2 O 7) V(K 2 Cr 2 O 7) = = С(Na 2 S 2 O 3) V(Na 2 S 2 O 3) С(1/6 K 2 Cr 2 O 7)пр V(K 2 Cr 2 O 7) С(Na 2 S 2 O 3)пр = V(Na 2 S 2 O 3) С(Na 2 S 2 O 3)пр K = С(Na 2 S 2 O 3)теор
n(1/6 K 2 Cr 2 O 7) = n(1/2 I 2) = n(Na 2 S 2 O 3) С(1/6 K 2 Cr 2 O 7) V(K 2 Cr 2 O 7) = = С(Na 2 S 2 O 3) V(Na 2 S 2 O 3) С(1/6 K 2 Cr 2 O 7)пр V(K 2 Cr 2 O 7) С(Na 2 S 2 O 3)пр = V(Na 2 S 2 O 3) С(Na 2 S 2 O 3)пр K = С(Na 2 S 2 O 3)теор
 Заместительная иодометрия применяется для определения окислителей: водорода пероксида, меди(II) сульфата, калия перманганата и др. Водорода пероксид: H 2 O 2 + 2 KI + H 2 SO 4 I 2 + 2 H 2 O + K 2 SO 4 I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6 O 21– + 2 е 2 O 2– С(Na 2 S 2 O 3)·M(1/2 H 2 O 2) Т(Na 2 S 2 O 3/H 2 O 2) = —————— 1000
Заместительная иодометрия применяется для определения окислителей: водорода пероксида, меди(II) сульфата, калия перманганата и др. Водорода пероксид: H 2 O 2 + 2 KI + H 2 SO 4 I 2 + 2 H 2 O + K 2 SO 4 I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6 O 21– + 2 е 2 O 2– С(Na 2 S 2 O 3)·M(1/2 H 2 O 2) Т(Na 2 S 2 O 3/H 2 O 2) = —————— 1000
 Меди (II) сульфат: 2 Cu. SO 4 + 4 KI 2 Cu. I + I 2 + 2 K 2 SO 4 I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6 Cu 2+ + 1 е Cu+ С(Na 2 S 2 O 3)·M(Cu. SO 4) Т(Na 2 S 2 O 3/Cu. SO 4) = ————— 1000 Слабокислая среда (для предотвращения образования гидроксокомплексов меди(II) 5 -ти кратный избыток KI
Меди (II) сульфат: 2 Cu. SO 4 + 4 KI 2 Cu. I + I 2 + 2 K 2 SO 4 I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6 Cu 2+ + 1 е Cu+ С(Na 2 S 2 O 3)·M(Cu. SO 4) Т(Na 2 S 2 O 3/Cu. SO 4) = ————— 1000 Слабокислая среда (для предотвращения образования гидроксокомплексов меди(II) 5 -ти кратный избыток KI
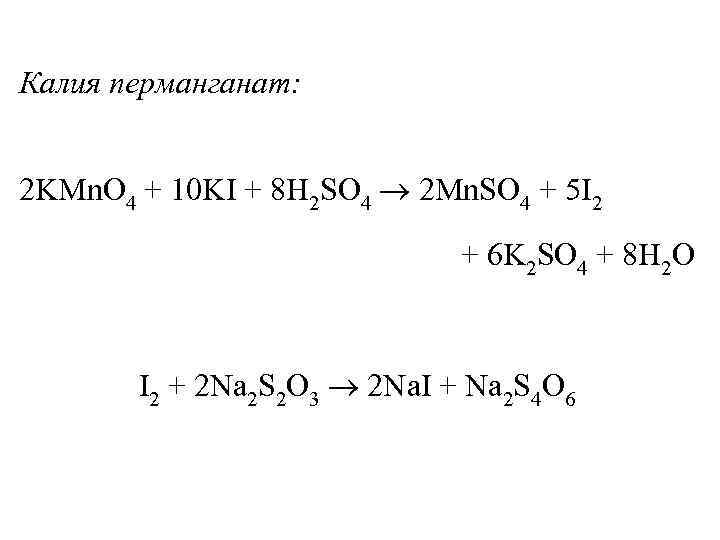 Калия перманганат: 2 KMn. O 4 + 10 KI + 8 H 2 SO 4 2 Mn. SO 4 + 5 I 2 + 6 K 2 SO 4 + 8 H 2 O I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6
Калия перманганат: 2 KMn. O 4 + 10 KI + 8 H 2 SO 4 2 Mn. SO 4 + 5 I 2 + 6 K 2 SO 4 + 8 H 2 O I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6
 В колбу для титрования помещают: Аликвоту или т. н. окис-ля (+растворитель) 5 -ти кратный избыток KI (по отн-ю к ок-лю) Раствор серной кислоты Выдерживают 5 минут на холоду Титруют Na 2 S 2 O 3 до светло-желтой окраски Добавляют свежеприготовленный р-р крахмала Титруют до обесцвечивания раствора
В колбу для титрования помещают: Аликвоту или т. н. окис-ля (+растворитель) 5 -ти кратный избыток KI (по отн-ю к ок-лю) Раствор серной кислоты Выдерживают 5 минут на холоду Титруют Na 2 S 2 O 3 до светло-желтой окраски Добавляют свежеприготовленный р-р крахмала Титруют до обесцвечивания раствора
 Расчет массы и массовой доли (%) m(KMn. O 4) = V(Na 2 S 2 O 3)·K·T(Na 2 S 2 O 3/KMn. O 4) V(Na 2 S 2 O 3)·K·T(Na 2 S 2 O 3/KMn. O 4)· 100 (KMn. O 4) = ———————, % а(KMn. O 4) С(Na 2 S 2 O 3)·M(1/5 KMn. O 4) Т(Na 2 S 2 O 3/KMn. O 4) = ————— 1000
Расчет массы и массовой доли (%) m(KMn. O 4) = V(Na 2 S 2 O 3)·K·T(Na 2 S 2 O 3/KMn. O 4) V(Na 2 S 2 O 3)·K·T(Na 2 S 2 O 3/KMn. O 4)· 100 (KMn. O 4) = ———————, % а(KMn. O 4) С(Na 2 S 2 O 3)·M(1/5 KMn. O 4) Т(Na 2 S 2 O 3/KMn. O 4) = ————— 1000
 ИОДИМЕТРИЯ Титрант – раствор I 2 в растворе KI обычно с С(1/2 I 2) = 0, 1 или 0, 01 моль/л. I 2 + 2 e 2 I– f (I 2) = 1/2
ИОДИМЕТРИЯ Титрант – раствор I 2 в растворе KI обычно с С(1/2 I 2) = 0, 1 или 0, 01 моль/л. I 2 + 2 e 2 I– f (I 2) = 1/2
 Стандартизация по стандартному раствору Na 2 S 2 O 3 (Ind – крахмал): I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6 С(Na 2 S 2 O 3)пр V(Na 2 S 2 O 3) С(1/2 I 2)пр = V(1/2 I 2) С(1/2 I 2)пр K = С(1/2 I 2)тр
Стандартизация по стандартному раствору Na 2 S 2 O 3 (Ind – крахмал): I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6 С(Na 2 S 2 O 3)пр V(Na 2 S 2 O 3) С(1/2 I 2)пр = V(1/2 I 2) С(1/2 I 2)пр K = С(1/2 I 2)тр
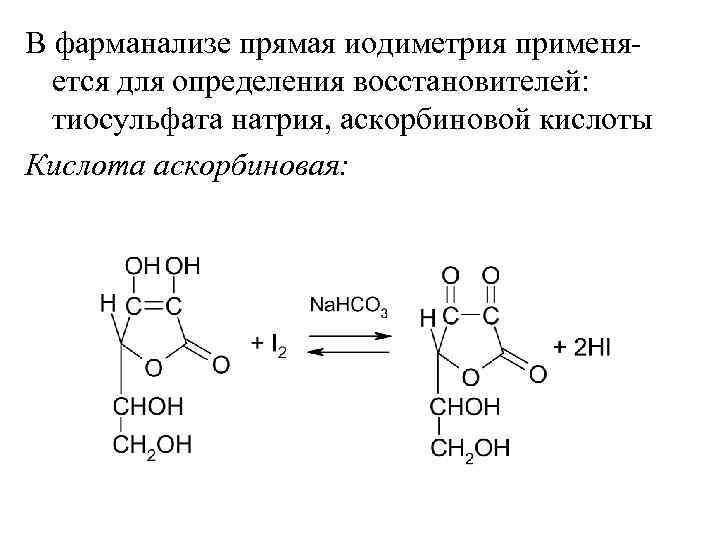 В фарманализе прямая иодиметрия применяется для определения восстановителей: тиосульфата натрия, аскорбиновой кислоты Кислота аскорбиновая:
В фарманализе прямая иодиметрия применяется для определения восстановителей: тиосульфата натрия, аскорбиновой кислоты Кислота аскорбиновая:
 Т. к. потенциал пары I 2|2 I– невелик, для сдвига реакции вправо связывают продукты реакции: Na. HCO 3 + HI Na. I + CO 2 + H 2 O CH 3 COONa + HI Na. I + CH 3 COOH Ind – крахмал C 21+ – 2 е C 22+ С(1/2 I 2) · M(1/2 Аск. к. ) Т(I 2 /Аск. к. ) = —————— 1000
Т. к. потенциал пары I 2|2 I– невелик, для сдвига реакции вправо связывают продукты реакции: Na. HCO 3 + HI Na. I + CO 2 + H 2 O CH 3 COONa + HI Na. I + CH 3 COOH Ind – крахмал C 21+ – 2 е C 22+ С(1/2 I 2) · M(1/2 Аск. к. ) Т(I 2 /Аск. к. ) = —————— 1000
 Обратная иодиметрия применяется для различных лекарственных препаратов, при этом йод может: либо окислять лек. препарат (изониазид) либо вступать в реакцию электрофильного замещения (антипирин, фенол, салициловая кислота и др. )
Обратная иодиметрия применяется для различных лекарственных препаратов, при этом йод может: либо окислять лек. препарат (изониазид) либо вступать в реакцию электрофильного замещения (антипирин, фенол, салициловая кислота и др. )
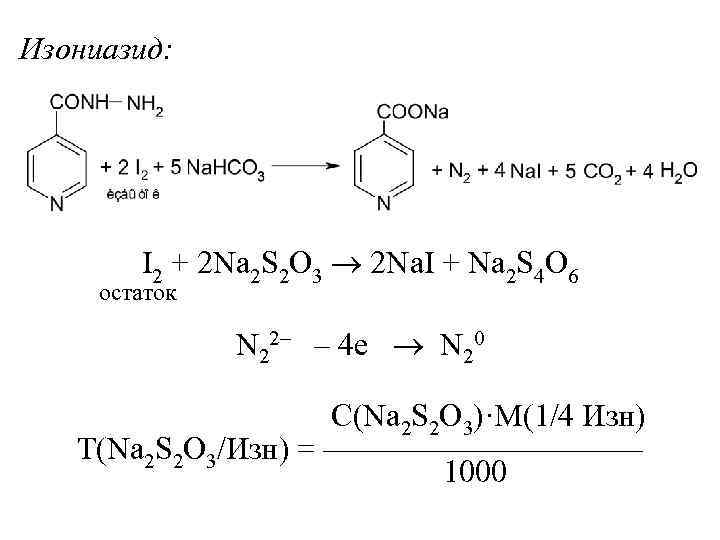 Изониазид: I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6 остаток N 22– – 4 е N 20 С(Na 2 S 2 O 3)·M(1/4 Изн) Т(Na 2 S 2 O 3/Изн) = ————— 1000
Изониазид: I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6 остаток N 22– – 4 е N 20 С(Na 2 S 2 O 3)·M(1/4 Изн) Т(Na 2 S 2 O 3/Изн) = ————— 1000
 m(Изн) = (VI 2 K VNa 2 S 2 O 3 K) Т(Na 2 S 2 O 3/ Изн) (VI 2 K VNa 2 S 2 O 3 K) ТNa 2 S 2 O 3/Изн 100 (Изн)= (%) а (Изн)
m(Изн) = (VI 2 K VNa 2 S 2 O 3 K) Т(Na 2 S 2 O 3/ Изн) (VI 2 K VNa 2 S 2 O 3 K) ТNa 2 S 2 O 3/Изн 100 (Изн)= (%) а (Изн)
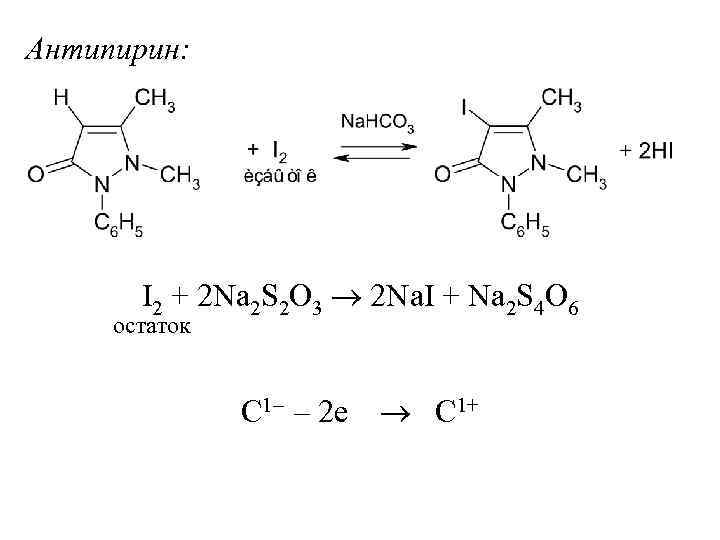 Антипирин: I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6 остаток C 1– – 2 е C 1+
Антипирин: I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6 остаток C 1– – 2 е C 1+
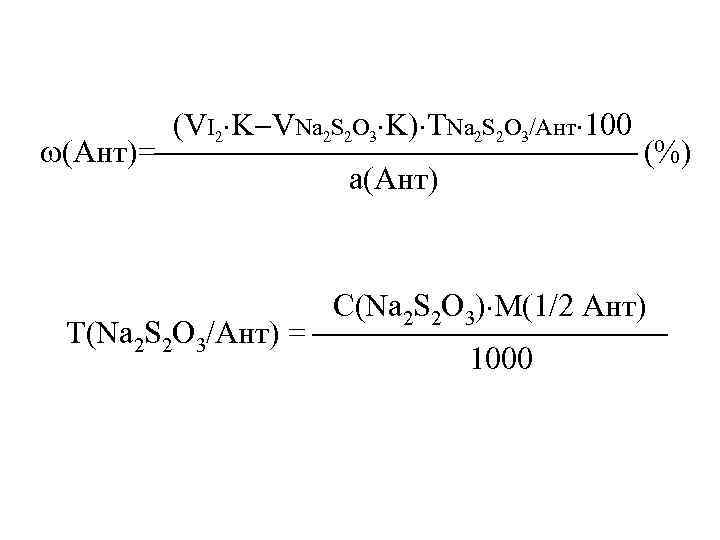 (VI 2 K VNa 2 S 2 O 3 K) ТNa 2 S 2 O 3/Ант 100 (Ант)= (%) а(Ант) С(Na 2 S 2 O 3) М(1/2 Ант) Т(Na 2 S 2 O 3/Ант) = 1000
(VI 2 K VNa 2 S 2 O 3 K) ТNa 2 S 2 O 3/Ант 100 (Ант)= (%) а(Ант) С(Na 2 S 2 O 3) М(1/2 Ант) Т(Na 2 S 2 O 3/Ант) = 1000
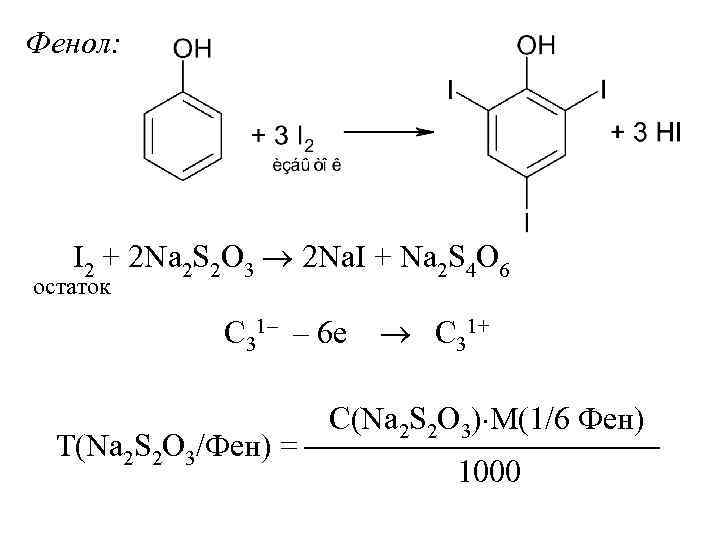 Фенол: I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6 остаток C 31– – 6 е C 31+ С(Na 2 S 2 O 3) М(1/6 Фен) Т(Na 2 S 2 O 3/Фен) = 1000
Фенол: I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6 остаток C 31– – 6 е C 31+ С(Na 2 S 2 O 3) М(1/6 Фен) Т(Na 2 S 2 O 3/Фен) = 1000
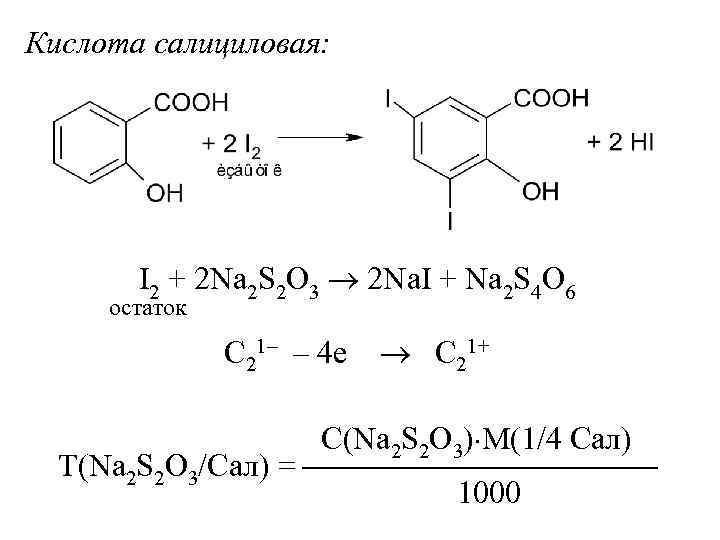 Кислота салициловая: I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6 остаток C 21– – 4 е C 21+ С(Na 2 S 2 O 3) М(1/4 Сал) Т(Na 2 S 2 O 3/Сал) = 1000
Кислота салициловая: I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6 остаток C 21– – 4 е C 21+ С(Na 2 S 2 O 3) М(1/4 Сал) Т(Na 2 S 2 O 3/Сал) = 1000
 Определение воды по методу К. Фишера Основан на титровании воды в анализируемом объекте реактивом Фишера Реактив Фишера – раствор диоксида серы, йода и пиридина в метаноле: № 1 – SO 2 в пиридине (C 5 H 5 N·SO 2) № 2 – I 2 в метаноле При смешивании: C 5 H 5 N·SO 2 + CH 3 OH C 5 H 5 NH+·CH 3 SO 3–
Определение воды по методу К. Фишера Основан на титровании воды в анализируемом объекте реактивом Фишера Реактив Фишера – раствор диоксида серы, йода и пиридина в метаноле: № 1 – SO 2 в пиридине (C 5 H 5 N·SO 2) № 2 – I 2 в метаноле При смешивании: C 5 H 5 N·SO 2 + CH 3 OH C 5 H 5 NH+·CH 3 SO 3–
 При титровании навески препарата, содержащей 0, 03 -0, 05 г воды протекает реакция: H 2 O + C 5 H 5 NH+·CH 3 SO 3– + I 2 + 2 C 5 H 5 N C 5 H 5 NH+·CH 3 SO 4– + 2 C 5 H 5 NH+·I– Без воды реакция не протекает S 4+ – 2 e S 6+ I 2 + 2 e 2 I– Пиридин связывает кислые продукты реакции и создает оптимальное р. Н среды в интервале 5 -8
При титровании навески препарата, содержащей 0, 03 -0, 05 г воды протекает реакция: H 2 O + C 5 H 5 NH+·CH 3 SO 3– + I 2 + 2 C 5 H 5 N C 5 H 5 NH+·CH 3 SO 4– + 2 C 5 H 5 NH+·I– Без воды реакция не протекает S 4+ – 2 e S 6+ I 2 + 2 e 2 I– Пиридин связывает кислые продукты реакции и создает оптимальное р. Н среды в интервале 5 -8
 Окончание титрования определяют визуально – избыточная капля титранта окрашивает желтый раствор в красновато-коричневый цвет (свободный I 2) Параллельно проводят контрольный опыт (Vоп Vк. о. ) Т · 100 (H 2 O), %= а(Анализ. в-ва) Т – титр реактива Фишера
Окончание титрования определяют визуально – избыточная капля титранта окрашивает желтый раствор в красновато-коричневый цвет (свободный I 2) Параллельно проводят контрольный опыт (Vоп Vк. о. ) Т · 100 (H 2 O), %= а(Анализ. в-ва) Т – титр реактива Фишера
 Для титрования применяют прибор: закрытая система, состоящая из бюретки, защищенной осушительной трубкой (Ca. Cl 2, силикагель), сосуда для подачи реактива и колбы для титрования, соединенных с бюреткой Колба для титрования имеет осушительную трубку Перемешивают магнитной мешалкой
Для титрования применяют прибор: закрытая система, состоящая из бюретки, защищенной осушительной трубкой (Ca. Cl 2, силикагель), сосуда для подачи реактива и колбы для титрования, соединенных с бюреткой Колба для титрования имеет осушительную трубку Перемешивают магнитной мешалкой


 Установление титра реактива Фишера Точную массу воды (около 0, 04 г) помещают в колбу для титрования, содержащую метанол и титруют реактивом Фишера Параллельно проводят контрольный опыт, титруя такой же объем метанола m(воды) Т = Vоп Vк. о.
Установление титра реактива Фишера Точную массу воды (около 0, 04 г) помещают в колбу для титрования, содержащую метанол и титруют реактивом Фишера Параллельно проводят контрольный опыт, титруя такой же объем метанола m(воды) Т = Vоп Vк. о.
 Недостатки метода: 1. Строгое соблюдение герметичности 2. Невозможность определения воды в присутствии веществ, реагирующих с компонентами реактива (аскорбиновая кислота, сульфиды, альдегиды, кетоны, карбонаты и гидрокарбонаты щелочных металлов и др. )
Недостатки метода: 1. Строгое соблюдение герметичности 2. Невозможность определения воды в присутствии веществ, реагирующих с компонентами реактива (аскорбиновая кислота, сульфиды, альдегиды, кетоны, карбонаты и гидрокарбонаты щелочных металлов и др. )


