Першина.pptx
- Количество слайдов: 13
 ИНВЕРСИОННОВОЛЬТАМПЕРОМЕТРИЧЕСКОЕ ОПРЕДЕЛЕНИЕ ПАЛЛАДИЯ И ПЛАТИНЫ В РАЗЛИЧНЫХ СРЕДАХ Выпускница: Першина Е. В. Научный руководитель: Щеглова Н. В.
ИНВЕРСИОННОВОЛЬТАМПЕРОМЕТРИЧЕСКОЕ ОПРЕДЕЛЕНИЕ ПАЛЛАДИЯ И ПЛАТИНЫ В РАЗЛИЧНЫХ СРЕДАХ Выпускница: Першина Е. В. Научный руководитель: Щеглова Н. В.
 ЦЕЛЬ РАБОТЫ: Разработка методик прямого определения платины и палладия в растворах их хлоридных и нитритных комплексов, методом инверсионной вольтамперометрии. ЗАДАЧИ: Выбрать оптимальные для определения платины и палладия фоновый электролит, время и потенциал накопления; Подобрать условия для совместного определения палладия и платины; Проверить мешающее влияние сопутствующих ионов. 2
ЦЕЛЬ РАБОТЫ: Разработка методик прямого определения платины и палладия в растворах их хлоридных и нитритных комплексов, методом инверсионной вольтамперометрии. ЗАДАЧИ: Выбрать оптимальные для определения платины и палладия фоновый электролит, время и потенциал накопления; Подобрать условия для совместного определения палладия и платины; Проверить мешающее влияние сопутствующих ионов. 2
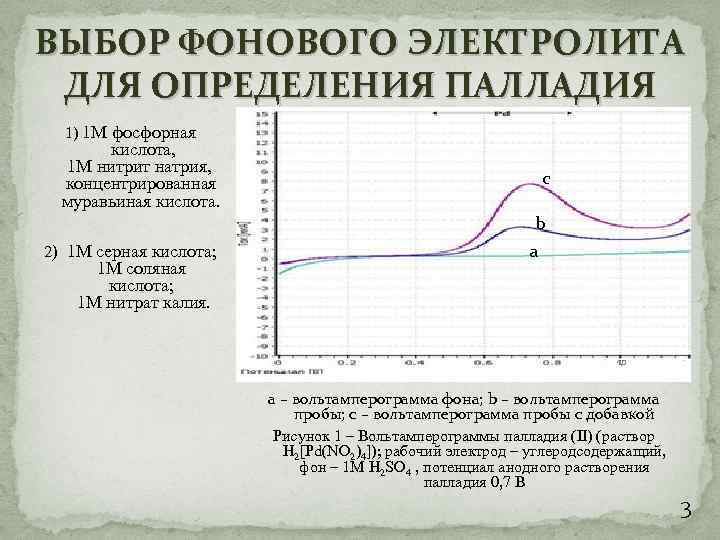 ВЫБОР ФОНОВОГО ЭЛЕКТРОЛИТА ДЛЯ ОПРЕДЕЛЕНИЯ ПАЛЛАДИЯ 1) 1 М фосфорная кислота, 1 М нитрит натрия, концентрированная муравьиная кислота. c b 2) 1 М серная кислота; 1 М соляная кислота; 1 М нитрат калия. a а – вольтамперограмма фона; b – вольтамперограмма пробы; с – вольтамперограмма пробы с добавкой Рисунок 1 – Вольтамперограммы палладия (II) (раствор H 2[Pd(NO 2)4]); рабочий электрод – углеродсодержащий, фон – 1 М H 2 SO 4 , потенциал анодного растворения палладия 0, 7 В 3
ВЫБОР ФОНОВОГО ЭЛЕКТРОЛИТА ДЛЯ ОПРЕДЕЛЕНИЯ ПАЛЛАДИЯ 1) 1 М фосфорная кислота, 1 М нитрит натрия, концентрированная муравьиная кислота. c b 2) 1 М серная кислота; 1 М соляная кислота; 1 М нитрат калия. a а – вольтамперограмма фона; b – вольтамперограмма пробы; с – вольтамперограмма пробы с добавкой Рисунок 1 – Вольтамперограммы палладия (II) (раствор H 2[Pd(NO 2)4]); рабочий электрод – углеродсодержащий, фон – 1 М H 2 SO 4 , потенциал анодного растворения палладия 0, 7 В 3
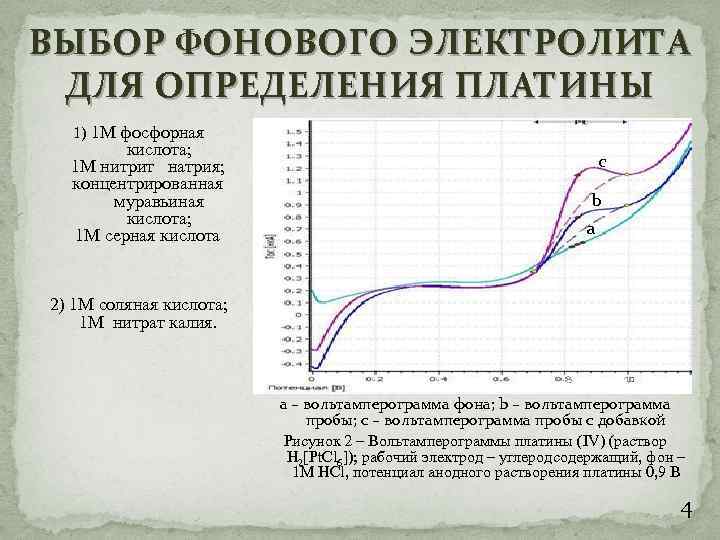 ВЫБОР ФОНОВОГО ЭЛЕКТРОЛИТА ДЛЯ ОПРЕДЕЛЕНИЯ ПЛАТИНЫ 1) 1 М фосфорная кислота; 1 М нитрит натрия; концентрированная муравьиная кислота; 1 М серная кислота c b a 2) 1 М соляная кислота; 1 М нитрат калия. а – вольтамперограмма фона; b – вольтамперограмма пробы; с – вольтамперограмма пробы с добавкой Рисунок 2 – Вольтамперограммы платины (IV) (раствор H 2[Pt. Cl 6]); рабочий электрод – углеродсодержащий, фон – 1 М HCl, потенциал анодного растворения платины 0, 9 В 4
ВЫБОР ФОНОВОГО ЭЛЕКТРОЛИТА ДЛЯ ОПРЕДЕЛЕНИЯ ПЛАТИНЫ 1) 1 М фосфорная кислота; 1 М нитрит натрия; концентрированная муравьиная кислота; 1 М серная кислота c b a 2) 1 М соляная кислота; 1 М нитрат калия. а – вольтамперограмма фона; b – вольтамперограмма пробы; с – вольтамперограмма пробы с добавкой Рисунок 2 – Вольтамперограммы платины (IV) (раствор H 2[Pt. Cl 6]); рабочий электрод – углеродсодержащий, фон – 1 М HCl, потенциал анодного растворения платины 0, 9 В 4
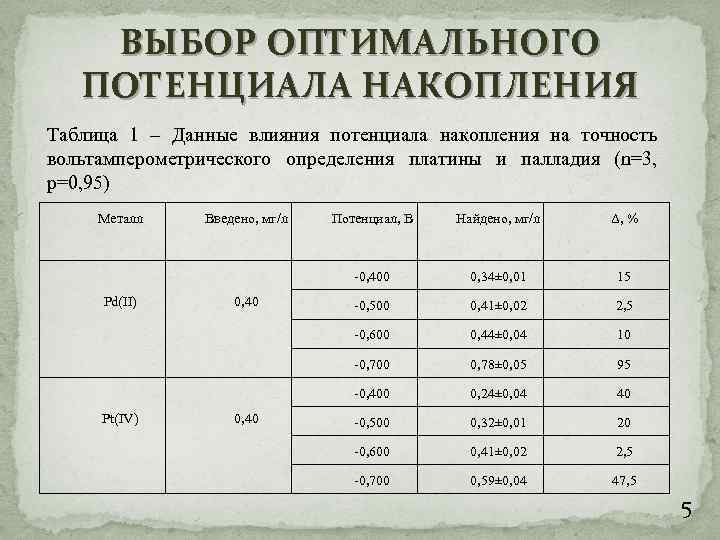 ВЫБОР ОПТИМАЛЬНОГО ПОТЕНЦИАЛА НАКОПЛЕНИЯ Таблица 1 – Данные влияния потенциала накопления на точность вольтамперометрического определения платины и палладия (n=3, p=0, 95) Металл 0, 34± 0, 01 15 -0, 500 0, 41± 0, 02 2, 5 0, 44± 0, 04 10 0, 78± 0, 05 95 -0, 400 0, 40 Δ, % -0, 700 Pt(IV) Найдено, мг/л -0, 600 0, 40 Потенциал, В -0, 400 Pd(II) Введено, мг/л 0, 24± 0, 04 40 -0, 500 0, 32± 0, 01 20 -0, 600 0, 41± 0, 02 2, 5 -0, 700 0, 59± 0, 04 47, 5 5
ВЫБОР ОПТИМАЛЬНОГО ПОТЕНЦИАЛА НАКОПЛЕНИЯ Таблица 1 – Данные влияния потенциала накопления на точность вольтамперометрического определения платины и палладия (n=3, p=0, 95) Металл 0, 34± 0, 01 15 -0, 500 0, 41± 0, 02 2, 5 0, 44± 0, 04 10 0, 78± 0, 05 95 -0, 400 0, 40 Δ, % -0, 700 Pt(IV) Найдено, мг/л -0, 600 0, 40 Потенциал, В -0, 400 Pd(II) Введено, мг/л 0, 24± 0, 04 40 -0, 500 0, 32± 0, 01 20 -0, 600 0, 41± 0, 02 2, 5 -0, 700 0, 59± 0, 04 47, 5 5
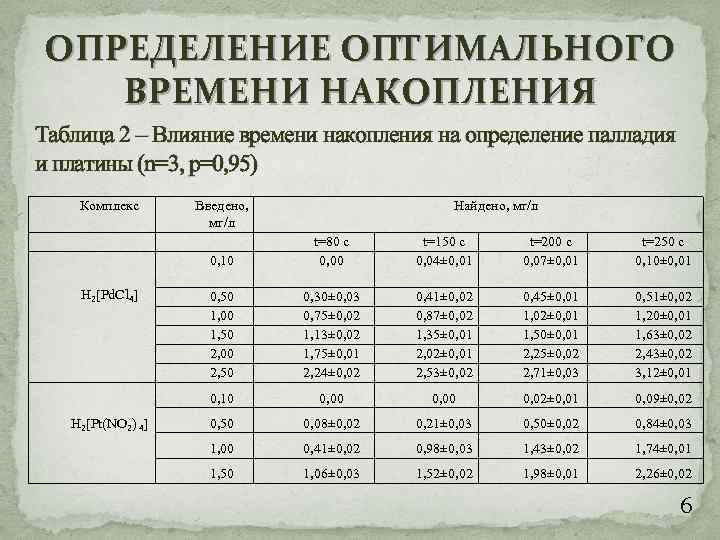 ОПРЕДЕЛЕНИЕ ОПТИМАЛЬНОГО ВРЕМЕНИ НАКОПЛЕНИЯ Таблица 2 – Влияние времени накопления на определение палладия и платины (n=3, p=0, 95) Комплекс Введено, мг/л Найдено, мг/л 0, 10 H 2[Pt(NO 2) 4] t=150 c 0, 04± 0, 01 t=200 c 0, 07± 0, 01 t=250 c 0, 10± 0, 01 0, 50 1, 00 1, 50 2, 00 2, 50 0, 30± 0, 03 0, 75± 0, 02 1, 13± 0, 02 1, 75± 0, 01 2, 24± 0, 02 0, 41± 0, 02 0, 87± 0, 02 1, 35± 0, 01 2, 02± 0, 01 2, 53± 0, 02 0, 45± 0, 01 1, 02± 0, 01 1, 50± 0, 01 2, 25± 0, 02 2, 71± 0, 03 0, 51± 0, 02 1, 20± 0, 01 1, 63± 0, 02 2, 43± 0, 02 3, 12± 0, 01 0, 10 H 2[Pd. Cl 4] t=80 c 0, 00 0, 02± 0, 01 0, 09± 0, 02 0, 50 0, 08± 0, 02 0, 21± 0, 03 0, 50± 0, 02 0, 84± 0, 03 1, 00 0, 41± 0, 02 0, 98± 0, 03 1, 43± 0, 02 1, 74± 0, 01 1, 50 1, 06± 0, 03 1, 52± 0, 02 1, 98± 0, 01 2, 26± 0, 02 6
ОПРЕДЕЛЕНИЕ ОПТИМАЛЬНОГО ВРЕМЕНИ НАКОПЛЕНИЯ Таблица 2 – Влияние времени накопления на определение палладия и платины (n=3, p=0, 95) Комплекс Введено, мг/л Найдено, мг/л 0, 10 H 2[Pt(NO 2) 4] t=150 c 0, 04± 0, 01 t=200 c 0, 07± 0, 01 t=250 c 0, 10± 0, 01 0, 50 1, 00 1, 50 2, 00 2, 50 0, 30± 0, 03 0, 75± 0, 02 1, 13± 0, 02 1, 75± 0, 01 2, 24± 0, 02 0, 41± 0, 02 0, 87± 0, 02 1, 35± 0, 01 2, 02± 0, 01 2, 53± 0, 02 0, 45± 0, 01 1, 02± 0, 01 1, 50± 0, 01 2, 25± 0, 02 2, 71± 0, 03 0, 51± 0, 02 1, 20± 0, 01 1, 63± 0, 02 2, 43± 0, 02 3, 12± 0, 01 0, 10 H 2[Pd. Cl 4] t=80 c 0, 00 0, 02± 0, 01 0, 09± 0, 02 0, 50 0, 08± 0, 02 0, 21± 0, 03 0, 50± 0, 02 0, 84± 0, 03 1, 00 0, 41± 0, 02 0, 98± 0, 03 1, 43± 0, 02 1, 74± 0, 01 1, 50 1, 06± 0, 03 1, 52± 0, 02 1, 98± 0, 01 2, 26± 0, 02 6
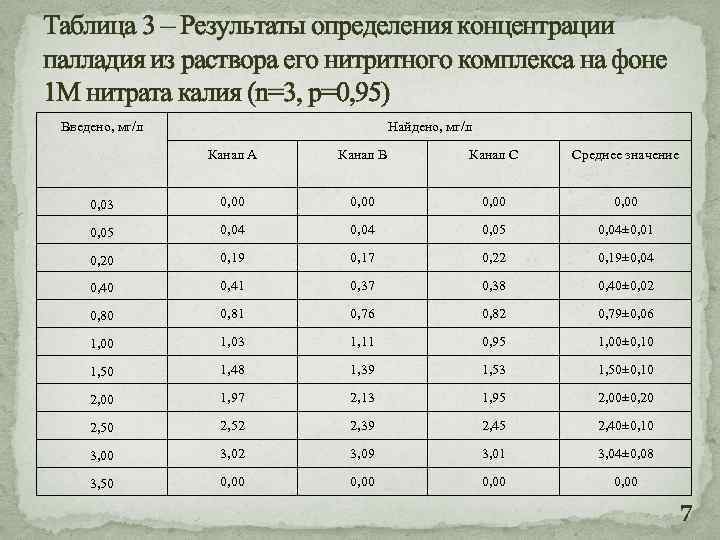 Таблица 3 – Результаты определения концентрации палладия из раствора его нитритного комплекса на фоне 1 М нитрата калия (n=3, p=0, 95) Введено, мг/л Найдено, мг/л Канал А Канал В Канал С Среднее значение 0, 03 0, 00 0, 05 0, 04± 0, 01 0, 20 0, 19 0, 17 0, 22 0, 19± 0, 04 0, 40 0, 41 0, 37 0, 38 0, 40± 0, 02 0, 80 0, 81 0, 76 0, 82 0, 79± 0, 06 1, 00 1, 03 1, 11 0, 95 1, 00± 0, 10 1, 50 1, 48 1, 39 1, 53 1, 50± 0, 10 2, 00 1, 97 2, 13 1, 95 2, 00± 0, 20 2, 52 2, 39 2, 45 2, 40± 0, 10 3, 02 3, 09 3, 01 3, 04± 0, 08 3, 50 0, 00 7
Таблица 3 – Результаты определения концентрации палладия из раствора его нитритного комплекса на фоне 1 М нитрата калия (n=3, p=0, 95) Введено, мг/л Найдено, мг/л Канал А Канал В Канал С Среднее значение 0, 03 0, 00 0, 05 0, 04± 0, 01 0, 20 0, 19 0, 17 0, 22 0, 19± 0, 04 0, 40 0, 41 0, 37 0, 38 0, 40± 0, 02 0, 80 0, 81 0, 76 0, 82 0, 79± 0, 06 1, 00 1, 03 1, 11 0, 95 1, 00± 0, 10 1, 50 1, 48 1, 39 1, 53 1, 50± 0, 10 2, 00 1, 97 2, 13 1, 95 2, 00± 0, 20 2, 52 2, 39 2, 45 2, 40± 0, 10 3, 02 3, 09 3, 01 3, 04± 0, 08 3, 50 0, 00 7
 Таблица 4 – Диапазон определяемых концентраций палладия и платины (n = 3, p = 0, 95) Хлоридные комплексы Нитритные комплексы Фоновый электролит; диапазон определяемых концентраций, мг/л Платина 1 М KNO 3 : 0, 05 – 3, 0 Δ = 10% 1 М H 2 SO 4 : 0, 1 – 2, 0 Δ = 5% Палладий 1 М HCl: 0, 05 – 2, 6 Δ = 10% 1 М H 2 SO 4 : 0, 1 – 5, 0 Δ = 15% 1 М HCl: 0, 1 – 2, 0 Δ =15% 1 М KNO 3 : 0, 1 – 3, 0 Δ =20% 8
Таблица 4 – Диапазон определяемых концентраций палладия и платины (n = 3, p = 0, 95) Хлоридные комплексы Нитритные комплексы Фоновый электролит; диапазон определяемых концентраций, мг/л Платина 1 М KNO 3 : 0, 05 – 3, 0 Δ = 10% 1 М H 2 SO 4 : 0, 1 – 2, 0 Δ = 5% Палладий 1 М HCl: 0, 05 – 2, 6 Δ = 10% 1 М H 2 SO 4 : 0, 1 – 5, 0 Δ = 15% 1 М HCl: 0, 1 – 2, 0 Δ =15% 1 М KNO 3 : 0, 1 – 3, 0 Δ =20% 8
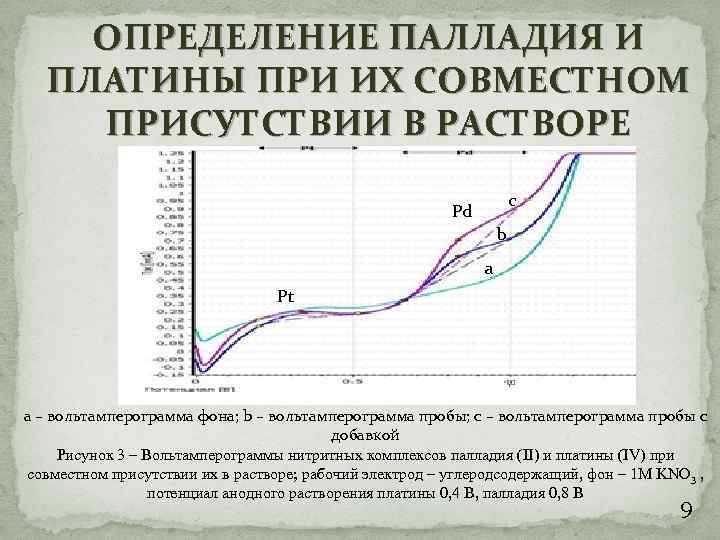 ОПРЕДЕЛЕНИЕ ПАЛЛАДИЯ И ПЛАТИНЫ ПРИ ИХ СОВМЕСТНОМ ПРИСУТСТВИИ В РАСТВОРЕ c Pd b a Pt а – вольтамперограмма фона; b – вольтамперограмма пробы; с – вольтамперограмма пробы с добавкой Рисунок 3 – Вольтамперограммы нитритных комплексов палладия (II) и платины (IV) при совместном присутствии их в растворе; рабочий электрод – углеродсодержащий, фон – 1 М KNO 3 , потенциал анодного растворения платины 0, 4 В, палладия 0, 8 В 9
ОПРЕДЕЛЕНИЕ ПАЛЛАДИЯ И ПЛАТИНЫ ПРИ ИХ СОВМЕСТНОМ ПРИСУТСТВИИ В РАСТВОРЕ c Pd b a Pt а – вольтамперограмма фона; b – вольтамперограмма пробы; с – вольтамперограмма пробы с добавкой Рисунок 3 – Вольтамперограммы нитритных комплексов палладия (II) и платины (IV) при совместном присутствии их в растворе; рабочий электрод – углеродсодержащий, фон – 1 М KNO 3 , потенциал анодного растворения платины 0, 4 В, палладия 0, 8 В 9
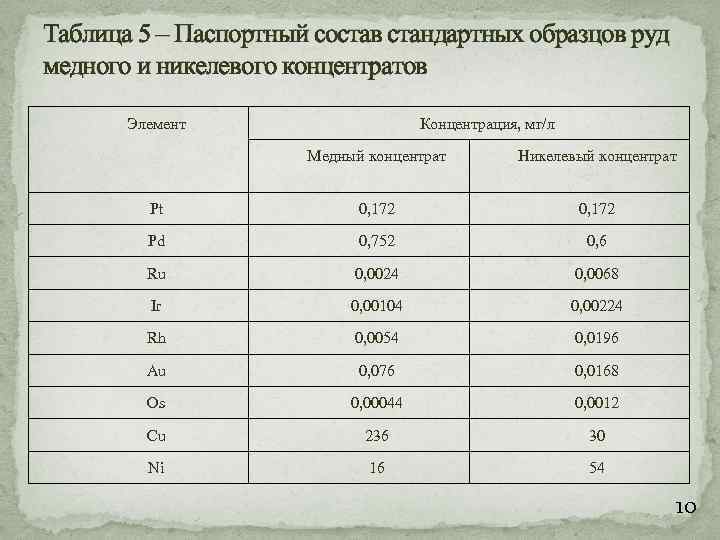 Таблица 5 – Паспортный состав стандартных образцов руд медного и никелевого концентратов Элемент Концентрация, мг/л Медный концентрат Никелевый концентрат Pt 0, 172 Pd 0, 752 0, 6 Ru 0, 0024 0, 0068 Ir 0, 00104 0, 00224 Rh 0, 0054 0, 0196 Au 0, 076 0, 0168 Os 0, 00044 0, 0012 Cu 236 30 Ni 16 54 10
Таблица 5 – Паспортный состав стандартных образцов руд медного и никелевого концентратов Элемент Концентрация, мг/л Медный концентрат Никелевый концентрат Pt 0, 172 Pd 0, 752 0, 6 Ru 0, 0024 0, 0068 Ir 0, 00104 0, 00224 Rh 0, 0054 0, 0196 Au 0, 076 0, 0168 Os 0, 00044 0, 0012 Cu 236 30 Ni 16 54 10
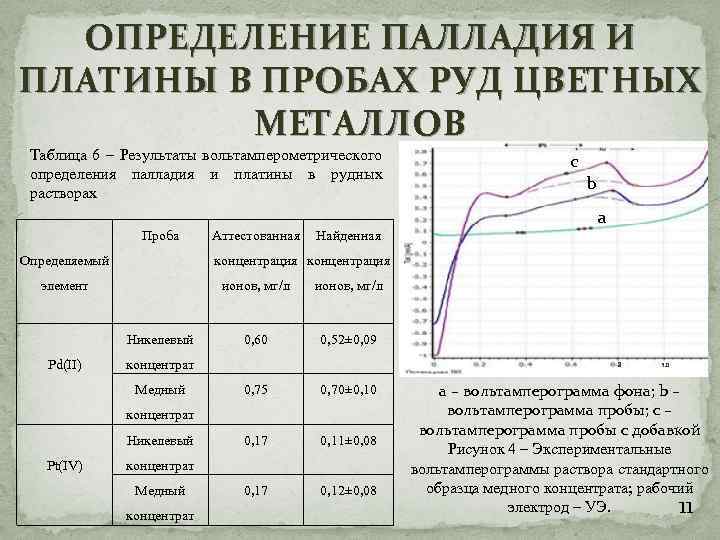 ОПРЕДЕЛЕНИЕ ПАЛЛАДИЯ И ПЛАТИНЫ В ПРОБАХ РУД ЦВЕТНЫХ МЕТАЛЛОВ Таблица 6 – Результаты вольтамперометрического определения палладия и платины в рудных растворах. Проба Определяемый Найденная ионов, мг/л Никелевый a ионов, мг/л 0, 60 0, 52± 0, 09 0, 75 0, 70± 0, 10 0, 17 0, 11± 0, 08 0, 17 0, 12± 0, 08 концентрат Медный концентрат Никелевый Pt(IV) b концентрация элемент Pd(II) Аттестованная c концентрат Медный концентрат а – вольтамперограмма фона; b – вольтамперограмма пробы; с – вольтамперограмма пробы с добавкой Рисунок 4 – Экспериментальные вольтамперограммы раствора стандартного образца медного концентрата; рабочий электрод – УЭ. 11
ОПРЕДЕЛЕНИЕ ПАЛЛАДИЯ И ПЛАТИНЫ В ПРОБАХ РУД ЦВЕТНЫХ МЕТАЛЛОВ Таблица 6 – Результаты вольтамперометрического определения палладия и платины в рудных растворах. Проба Определяемый Найденная ионов, мг/л Никелевый a ионов, мг/л 0, 60 0, 52± 0, 09 0, 75 0, 70± 0, 10 0, 17 0, 11± 0, 08 0, 17 0, 12± 0, 08 концентрат Медный концентрат Никелевый Pt(IV) b концентрация элемент Pd(II) Аттестованная c концентрат Медный концентрат а – вольтамперограмма фона; b – вольтамперограмма пробы; с – вольтамперограмма пробы с добавкой Рисунок 4 – Экспериментальные вольтамперограммы раствора стандартного образца медного концентрата; рабочий электрод – УЭ. 11
 ВЫВОДЫ: 1. Исследована возможность прямого определения микроколичеств платины и палладия в растворах их хлоридных и нитритных комплексов методом инверсионной вольтамперометрии с использованием в качестве индикаторного углеродсодержащего электрода. 2. Исследована серия фоновых электролитов, из которых пригодными являются для определения палладия 1 М серная кислота из его хлоридных и нитритных комплексов; 1 М соляная кислота для определения хлоридных комплексов палладия и платины; 1 М нитрат калия – для определения нитритных комплексов палладия и платины. 3. Экспериментально установленные диапазоны определяемых концентраций составили для палладия: на фоне серной кислоты 0, 1 – 2, 0 мг/л и 0, 1 – 5, 0 мг/л в хлоридных и нитритных комплексах соответственно; на фоне соляной кислоты 0, 05 – 2, 5 мг/л; на фоне нитрата калия 0, 05 – 3, 0 мг/л. Для платины: 0, 1 – 1, 5 мг/л на фоне соляной кислоты, 0, 1 – 2, 0 мг/л на фоне нитрата калия. 12
ВЫВОДЫ: 1. Исследована возможность прямого определения микроколичеств платины и палладия в растворах их хлоридных и нитритных комплексов методом инверсионной вольтамперометрии с использованием в качестве индикаторного углеродсодержащего электрода. 2. Исследована серия фоновых электролитов, из которых пригодными являются для определения палладия 1 М серная кислота из его хлоридных и нитритных комплексов; 1 М соляная кислота для определения хлоридных комплексов палладия и платины; 1 М нитрат калия – для определения нитритных комплексов палладия и платины. 3. Экспериментально установленные диапазоны определяемых концентраций составили для палладия: на фоне серной кислоты 0, 1 – 2, 0 мг/л и 0, 1 – 5, 0 мг/л в хлоридных и нитритных комплексах соответственно; на фоне соляной кислоты 0, 05 – 2, 5 мг/л; на фоне нитрата калия 0, 05 – 3, 0 мг/л. Для платины: 0, 1 – 1, 5 мг/л на фоне соляной кислоты, 0, 1 – 2, 0 мг/л на фоне нитрата калия. 12
 ВЫВОДЫ: 4. Установлено оптимальное время накопления: 250 с для растворов с концентрацией металла до 1, 5 мг/л, 150 с для растворов с концентрацией больше 1, 5 мг/л. 5. Выбрана величина потенциала накопления: -0, 500 В для растворов палладия; -0, 600 В для растворов платины. Потенциал определения палладия и платины при совместном присутствии -0, 600 В. 6. Изучено влияние присутствия в растворе ионов золота, серебра и меди на определение палладия и платины вольтамперометрическим методом. 7. Правильность разработанной методики проверена путем анализа стандартных образцов руд медного и никелевого концентратов. 13
ВЫВОДЫ: 4. Установлено оптимальное время накопления: 250 с для растворов с концентрацией металла до 1, 5 мг/л, 150 с для растворов с концентрацией больше 1, 5 мг/л. 5. Выбрана величина потенциала накопления: -0, 500 В для растворов палладия; -0, 600 В для растворов платины. Потенциал определения палладия и платины при совместном присутствии -0, 600 В. 6. Изучено влияние присутствия в растворе ионов золота, серебра и меди на определение палладия и платины вольтамперометрическим методом. 7. Правильность разработанной методики проверена путем анализа стандартных образцов руд медного и никелевого концентратов. 13


