Lect_4_.PPT
- Количество слайдов: 46
 Интерметаллические соединения Различные металлы часто смешиваются друг с другом в расплавленном состоянии с образованием жидких гомогенных растворов. Твердый раствор, полученный быстрым охлаждением (закалкой) жидкости, будет представлять собой разупорядоченный сплав, поскольку атомы в нем распределены случайным образом. Когда охлаждение осуществляется медленно, в некоторых случаях можно получить истинные твердые растворы. Однако более часто встречающимся процессом является сегрегация, которая реализуется одним из следующих способов: 1
Интерметаллические соединения Различные металлы часто смешиваются друг с другом в расплавленном состоянии с образованием жидких гомогенных растворов. Твердый раствор, полученный быстрым охлаждением (закалкой) жидкости, будет представлять собой разупорядоченный сплав, поскольку атомы в нем распределены случайным образом. Когда охлаждение осуществляется медленно, в некоторых случаях можно получить истинные твердые растворы. Однако более часто встречающимся процессом является сегрегация, которая реализуется одним из следующих способов: 1
 1. Металлы кристаллизуются раздельно (полная сегрегация). 2. Кристаллизуются два вида твердых растворов, раствор металла 1 в металле 2 и наоборот (ограниченная смешиваемость). 3. Кристаллизуется сплав с определенным составом, который может отличаться от состава исходной жидкости (формирование интерметаллида). Состав жидкой фазы непрерывно изменяется в процессе кристаллизации, и далее могут формироваться другие интерметаллические соединения, характеризующиеся своими собственными индивидуальными составами. 2
1. Металлы кристаллизуются раздельно (полная сегрегация). 2. Кристаллизуются два вида твердых растворов, раствор металла 1 в металле 2 и наоборот (ограниченная смешиваемость). 3. Кристаллизуется сплав с определенным составом, который может отличаться от состава исходной жидкости (формирование интерметаллида). Состав жидкой фазы непрерывно изменяется в процессе кристаллизации, и далее могут формироваться другие интерметаллические соединения, характеризующиеся своими собственными индивидуальными составами. 2
 Тенденция к образованию твердых растворов зависит, главным образом, от двух факторов: от близости химических свойств элементов и относительных размеров их атомов. Разупорядоченные сплавы образуют два металла, которые можно считать химически родственными, и имеющие атомы практически одного и того же размера. Например, серебро и золото, которые кристаллизуются в кубической плотнейшей упаковке, обладают атомами практически одинакового размера и формируют твердые растворы (смешанные кристаллы) переменного состава. В них атомы серебра и золота статистически занимают позиции в кубической плотнейшей упаковке. Если элементы обладают меньшим сходством физико химических параметров, может реализоваться ограниченная растворимость в твердом состоянии, как в случае, например, системы Zn Сu. Максимальное содержание Zn в растворе на основе Сu составляет 38, 4 мол. %, а содержание Сu в растворе на основе Zn равно 2, 3 мол. % 3
Тенденция к образованию твердых растворов зависит, главным образом, от двух факторов: от близости химических свойств элементов и относительных размеров их атомов. Разупорядоченные сплавы образуют два металла, которые можно считать химически родственными, и имеющие атомы практически одного и того же размера. Например, серебро и золото, которые кристаллизуются в кубической плотнейшей упаковке, обладают атомами практически одинакового размера и формируют твердые растворы (смешанные кристаллы) переменного состава. В них атомы серебра и золота статистически занимают позиции в кубической плотнейшей упаковке. Если элементы обладают меньшим сходством физико химических параметров, может реализоваться ограниченная растворимость в твердом состоянии, как в случае, например, системы Zn Сu. Максимальное содержание Zn в растворе на основе Сu составляет 38, 4 мол. %, а содержание Сu в растворе на основе Zn равно 2, 3 мол. % 3
 Структуры с упорядоченным атомным распределением образуются когда атомы различаются по размерам или обладают несходными физико химическими параметрами. В этом случае упорядоченные структуры должны быть энергетически более выгодными и обладать более высокими значениями энергии кристаллической решетки. Кроме того, упорядоченное распределение сфер различных размеров всегда способствует лучшему заполнению пространства. Для структур других типов соединений также соблюдается принцип наиболее эффективного заполнения пространства. Определенный порядок расположения атомов невозможен без определенного химического состава. Поэтому, металлические атомы, имеющие различные радиусы, в твердом состоянии преимущественно соединяются в определенных стехиометрических соотношениях, формируя интерметаллические соединения. 4
Структуры с упорядоченным атомным распределением образуются когда атомы различаются по размерам или обладают несходными физико химическими параметрами. В этом случае упорядоченные структуры должны быть энергетически более выгодными и обладать более высокими значениями энергии кристаллической решетки. Кроме того, упорядоченное распределение сфер различных размеров всегда способствует лучшему заполнению пространства. Для структур других типов соединений также соблюдается принцип наиболее эффективного заполнения пространства. Определенный порядок расположения атомов невозможен без определенного химического состава. Поэтому, металлические атомы, имеющие различные радиусы, в твердом состоянии преимущественно соединяются в определенных стехиометрических соотношениях, формируя интерметаллические соединения. 4
 Интерметаллическими соединениями называются химические соединения двух или нескольких металлов между собой – интерметаллиды. Они относятся к металлическим соединениям металлидам. Интерметаллиды образуются при: взаимодействиях компонентов при сплавлении, конденсации из пара, реакциях в твердом состоянии вследствие взаимной диффузии (при химико термической обработке), при распаде пересыщенного твердого раствора одного металла в другом, в результате интенсивной пластической деформации при механическом сплавлении (механоактивации). 5
Интерметаллическими соединениями называются химические соединения двух или нескольких металлов между собой – интерметаллиды. Они относятся к металлическим соединениям металлидам. Интерметаллиды образуются при: взаимодействиях компонентов при сплавлении, конденсации из пара, реакциях в твердом состоянии вследствие взаимной диффузии (при химико термической обработке), при распаде пересыщенного твердого раствора одного металла в другом, в результате интенсивной пластической деформации при механическом сплавлении (механоактивации). 5
 для интерметаллидов характерны преимущественно металлический тип связи и специфические металлические свойства. среди интерметаллидов имеются также соединения с ионной связью, так называемые валентные соединения. Они образуются из элементов различной химической природы и представляют собой стехиометрические соединения, например Na. Au. соединения с промежуточным характером связи ионно металлической, ковалентной. 6
для интерметаллидов характерны преимущественно металлический тип связи и специфические металлические свойства. среди интерметаллидов имеются также соединения с ионной связью, так называемые валентные соединения. Они образуются из элементов различной химической природы и представляют собой стехиометрические соединения, например Na. Au. соединения с промежуточным характером связи ионно металлической, ковалентной. 6
 С уменьшением различия в электрохимических характеристиках компонентов наблюдается и изменение свойств интерметаллидов от характерных для ионных соединений (Mg 2 Si, Mg 2 Ge) к свойствам, типичным для металлов (Mg 2 Pb). В соединениях структурного типа Ni. As или родственных типов Ni 2 In, Ni. Te 2 или Cd. I 2 сложная природа химической связи. Она изменяется с изменением положения компонентов в периодической системе. Одновременно изменяется и состав интерметаллида. 7
С уменьшением различия в электрохимических характеристиках компонентов наблюдается и изменение свойств интерметаллидов от характерных для ионных соединений (Mg 2 Si, Mg 2 Ge) к свойствам, типичным для металлов (Mg 2 Pb). В соединениях структурного типа Ni. As или родственных типов Ni 2 In, Ni. Te 2 или Cd. I 2 сложная природа химической связи. Она изменяется с изменением положения компонентов в периодической системе. Одновременно изменяется и состав интерметаллида. 7
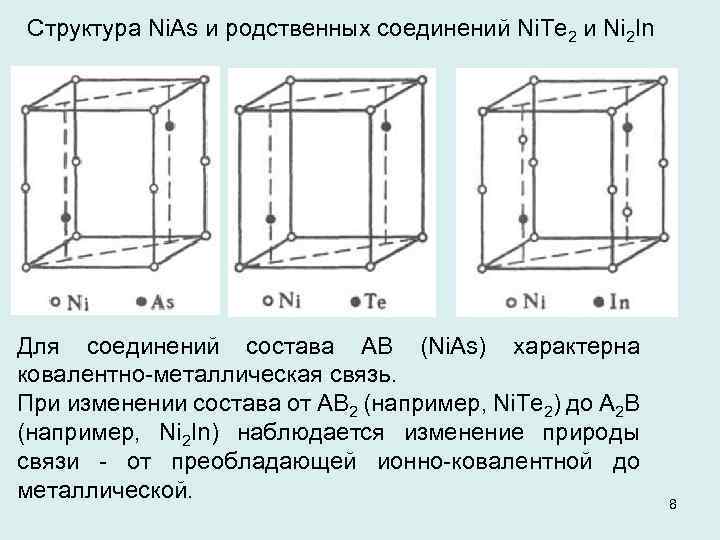 Структура Ni. As и родственных соединений Ni. Te 2 и Ni 2 In Для соединений состава АВ (Ni. As) характерна ковалентно металлическая связь. При изменении состава от АВ 2 (например, Ni. Te 2) до А 2 В (например, Ni 2 In) наблюдается изменение природы связи от преобладающей ионно ковалентной до металлической. 8
Структура Ni. As и родственных соединений Ni. Te 2 и Ni 2 In Для соединений состава АВ (Ni. As) характерна ковалентно металлическая связь. При изменении состава от АВ 2 (например, Ni. Te 2) до А 2 В (например, Ni 2 In) наблюдается изменение природы связи от преобладающей ионно ковалентной до металлической. 8
 Свойства интерметаллидов Физические и химические свойства интерметаллидов в гораздо большей степени, чем кристаллическая структура, зависят от природы химической связи. Ионные интерметаллиды обладают свойствами, характерными для солей: высокой температурой плавления, пониженной (по сравнению с металлической) электрической проводимостью, наличием узких областей гомогенности и др. , многие разлагаются водой. Для интерметаллидов с преобладающей металлической связью характерны свойства металлов, более или менее значительная способность к пластической деформации. 9
Свойства интерметаллидов Физические и химические свойства интерметаллидов в гораздо большей степени, чем кристаллическая структура, зависят от природы химической связи. Ионные интерметаллиды обладают свойствами, характерными для солей: высокой температурой плавления, пониженной (по сравнению с металлической) электрической проводимостью, наличием узких областей гомогенности и др. , многие разлагаются водой. Для интерметаллидов с преобладающей металлической связью характерны свойства металлов, более или менее значительная способность к пластической деформации. 9
 Полупроводниковыми свойствами обладают, как правило, соединения металлов с неметаллами. Некоторые интерметаллиды используют как магнитные материалы (Sm. Co 5, Fe 3 Ni, Cu 2 Mn. Al и др. ), сверхпроводники (Nb 3 Sn и др. ), аккумуляторы Н 2 (соединения РЗЭ, РЗЭ и Mg, напр. Ce. Mg 12). На основе интерметаллидов созданы защитные покрытия из тугоплавких металлов (Ni 3 Al, Ni 3 Nb, Ti 3 Al и др. ). 10
Полупроводниковыми свойствами обладают, как правило, соединения металлов с неметаллами. Некоторые интерметаллиды используют как магнитные материалы (Sm. Co 5, Fe 3 Ni, Cu 2 Mn. Al и др. ), сверхпроводники (Nb 3 Sn и др. ), аккумуляторы Н 2 (соединения РЗЭ, РЗЭ и Mg, напр. Ce. Mg 12). На основе интерметаллидов созданы защитные покрытия из тугоплавких металлов (Ni 3 Al, Ni 3 Nb, Ti 3 Al и др. ). 10
 Среди двойных интерметаллидов наиболее распространены : соединения Курнакова, фазы Лавеса, фазы Юм Розери (электронные соединения), фазы, подобные фазы. 11
Среди двойных интерметаллидов наиболее распространены : соединения Курнакова, фазы Лавеса, фазы Юм Розери (электронные соединения), фазы, подобные фазы. 11
 Соединения Курнакова представляют собой упорядоченные твердые растворы (сверхструктуры). Они характеризуются упорядоченным расположением атомов компонентов: атомы каждого из металлов занимают в кристаллической решетке строго определенное положение, создавая как бы несколько вставленных одна в другую подрешеток. По сравнению с неупорядоченными твердыми растворами того же состава имеют большие (часто в 2 3 раза) размеры элементарных ячеек. Имеют составы АВ, А 2 В, А 3 В и т. д. Из за металлического характера связи эти фазы могут обладать широкими областями гомогенности. 12
Соединения Курнакова представляют собой упорядоченные твердые растворы (сверхструктуры). Они характеризуются упорядоченным расположением атомов компонентов: атомы каждого из металлов занимают в кристаллической решетке строго определенное положение, создавая как бы несколько вставленных одна в другую подрешеток. По сравнению с неупорядоченными твердыми растворами того же состава имеют большие (часто в 2 3 раза) размеры элементарных ячеек. Имеют составы АВ, А 2 В, А 3 В и т. д. Из за металлического характера связи эти фазы могут обладать широкими областями гомогенности. 12
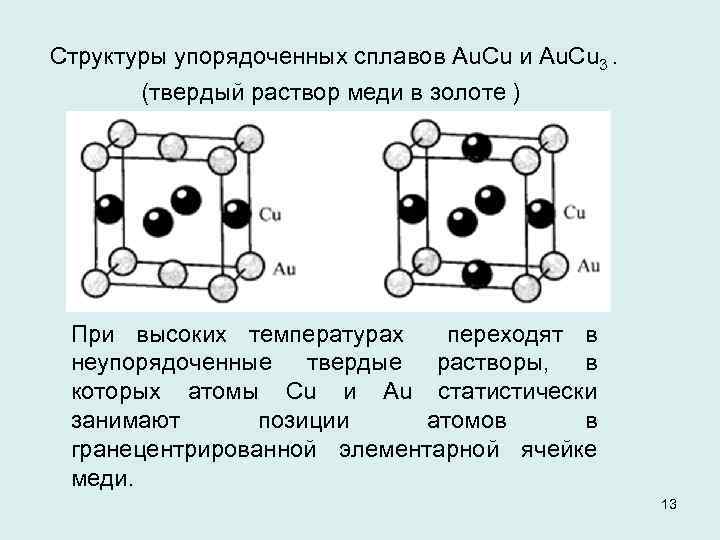 Структуры упорядоченных сплавов Аu. Сu и Аu. Сu 3. (твердый раствор меди в золоте ) При высоких температурах переходят в неупорядоченные твердые растворы, в которых атомы Сu и Аu статистически занимают позиции атомов в гранецентрированной элементарной ячейке меди. 13
Структуры упорядоченных сплавов Аu. Сu и Аu. Сu 3. (твердый раствор меди в золоте ) При высоких температурах переходят в неупорядоченные твердые растворы, в которых атомы Сu и Аu статистически занимают позиции атомов в гранецентрированной элементарной ячейке меди. 13
 Фазы Лавеса Некоторые сплавы, где атомы А обладают большими размерами по сравнению с атомами В относятся к фазам Лавеса. Они отвечают составу АВ 2 (реже АВ), обладают узкими областями гомогенности. Эти фазы возникают при взаимодействии металлов практически всех групп периодической системы при условии, что соотношение атомных радиусов компонентов r А/ r В ~ 1, 22. Кристаллизуются в структурных типах Mg. Cu 2 кубическая, Mg. Ni 2 гексагональная и Mg. Zn 2 – гексагональная. 14
Фазы Лавеса Некоторые сплавы, где атомы А обладают большими размерами по сравнению с атомами В относятся к фазам Лавеса. Они отвечают составу АВ 2 (реже АВ), обладают узкими областями гомогенности. Эти фазы возникают при взаимодействии металлов практически всех групп периодической системы при условии, что соотношение атомных радиусов компонентов r А/ r В ~ 1, 22. Кристаллизуются в структурных типах Mg. Cu 2 кубическая, Mg. Ni 2 гексагональная и Mg. Zn 2 – гексагональная. 14
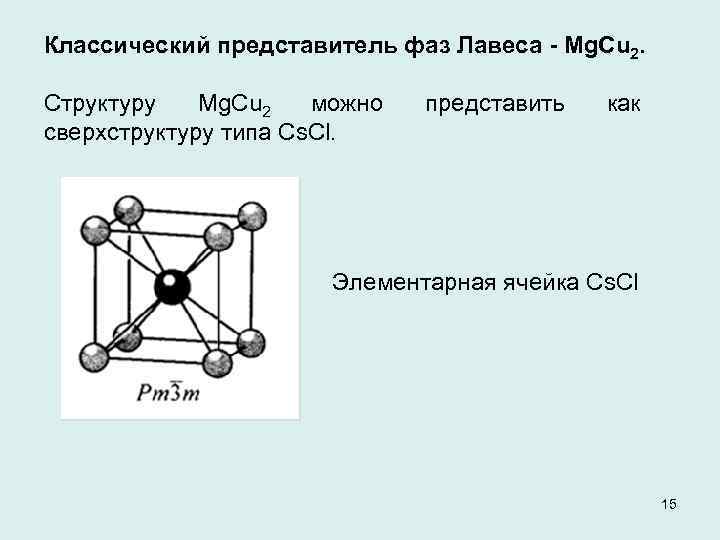 Классический представитель фаз Лавеса - Mg. Cu 2. Структуру Mg. Cu 2 можно сверхструктуру типа Сs. Сl. представить как Элементарная ячейка Cs. Cl 15
Классический представитель фаз Лавеса - Mg. Cu 2. Структуру Mg. Cu 2 можно сверхструктуру типа Сs. Сl. представить как Элементарная ячейка Cs. Cl 15
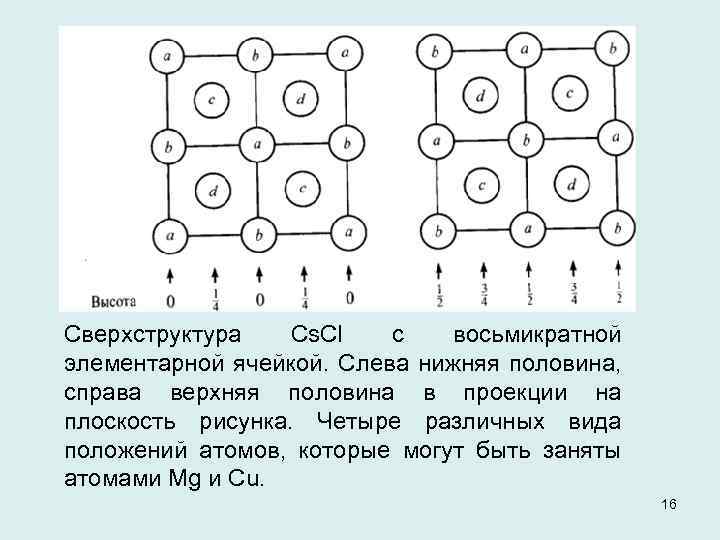 Сверхструктура Cs. Cl с восьмикратной элементарной ячейкой. Слева нижняя половина, справа верхняя половина в проекции на плоскость рисунка. Четыре различных вида положений атомов, которые могут быть заняты атомами Mg и Cu. 16
Сверхструктура Cs. Cl с восьмикратной элементарной ячейкой. Слева нижняя половина, справа верхняя половина в проекции на плоскость рисунка. Четыре различных вида положений атомов, которые могут быть заняты атомами Mg и Cu. 16
 Сверхструктуры типа Сs. Сl возникают при умножении элементарной ячейки и заселении атомных позиций различными видами атомов. Если удвоить ребра ячейки во всех трех измерениях, получается ячейка, состоящая из восьми подъячеек Сs. Сl, каждая из которых содержит один атом в ее центре. В этой ячейке находится 16 атомов, которые можно подразделить на четыре группы по четыре атома в каждой, причем каждая группа обладает гранецентрированным расположением. В зависимости от того, как распределяются атомы различных элементов среди этих четырех групп, образуются различные типы структуры. 17
Сверхструктуры типа Сs. Сl возникают при умножении элементарной ячейки и заселении атомных позиций различными видами атомов. Если удвоить ребра ячейки во всех трех измерениях, получается ячейка, состоящая из восьми подъячеек Сs. Сl, каждая из которых содержит один атом в ее центре. В этой ячейке находится 16 атомов, которые можно подразделить на четыре группы по четыре атома в каждой, причем каждая группа обладает гранецентрированным расположением. В зависимости от того, как распределяются атомы различных элементов среди этих четырех групп, образуются различные типы структуры. 17
 Приведенные типы структуры характерны для соединений с разным характером химической связи, начиная от чисто ионной и заканчивая металлической. Структуру Mg. Cu 2 можно представить как сверхструктуру типа Сs. Сl, со следующим заселением позиций а, b, с и d: a : Mg b : Cu 4 с : Mg d : Cu 4. 18
Приведенные типы структуры характерны для соединений с разным характером химической связи, начиная от чисто ионной и заканчивая металлической. Структуру Mg. Cu 2 можно представить как сверхструктуру типа Сs. Сl, со следующим заселением позиций а, b, с и d: a : Mg b : Cu 4 с : Mg d : Cu 4. 18
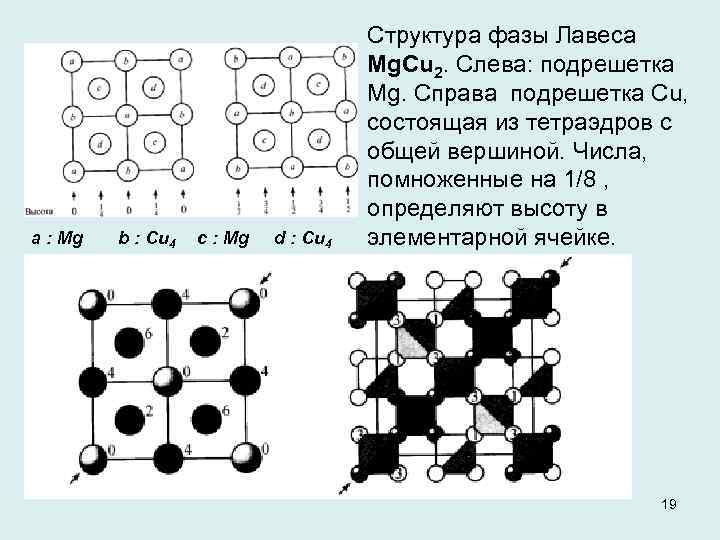 a : Mg b : Cu 4 с : Mg d : Cu 4 Структура фазы Лавеса Мg. Сu 2. Слева: подрешетка Mg. Справа подрешетка Cu, состоящая из тетраэдров с общей вершиной. Числа, помноженные на 1/8 , определяют высоту в элементарной ячейке. 19
a : Mg b : Cu 4 с : Mg d : Cu 4 Структура фазы Лавеса Мg. Сu 2. Слева: подрешетка Mg. Справа подрешетка Cu, состоящая из тетраэдров с общей вершиной. Числа, помноженные на 1/8 , определяют высоту в элементарной ячейке. 19
 Тетраэдр, состоящий из четырех атомов Cu, размещен вместо одиночного атома в позиции b; те же тетраэдры из атомов Cu находятся в позиции d. Атомы магния имеют такое же расположение, как в алмазе. Атомы меди в структуре типа Mg. Cu 2 образуют сетки из тетраэдров с общей вершиной так, чтобы каждый атом Cu был связан с шестью другими атомами Cu. Коэффициент заполнения пространства (коэффициент компактности) для структурного типа Mg. Cu 2 (элементарная ячейка содержит 8 атомов Mg и 16 атомов Cu) равен 71, 0 %, что несколько ниже по сравнению с плотнейшими упаковками (74, 1 %). 20
Тетраэдр, состоящий из четырех атомов Cu, размещен вместо одиночного атома в позиции b; те же тетраэдры из атомов Cu находятся в позиции d. Атомы магния имеют такое же расположение, как в алмазе. Атомы меди в структуре типа Mg. Cu 2 образуют сетки из тетраэдров с общей вершиной так, чтобы каждый атом Cu был связан с шестью другими атомами Cu. Коэффициент заполнения пространства (коэффициент компактности) для структурного типа Mg. Cu 2 (элементарная ячейка содержит 8 атомов Mg и 16 атомов Cu) равен 71, 0 %, что несколько ниже по сравнению с плотнейшими упаковками (74, 1 %). 20
 Координационным многогранником в структуре Mg. Cu 2 является полиэдр Франка — Каспера. Эти полиэдры имеют равные или различные треугольные грани, и, по крайней мере, пять треугольников обладают общей вершиной. Такие полиэдры допускают координационные числа 12, 14, 15, и 16. Полиэдры Франка—Каспера и соответствующие высокие координационные числа известны среди многочисленных интерметаллидов. 21
Координационным многогранником в структуре Mg. Cu 2 является полиэдр Франка — Каспера. Эти полиэдры имеют равные или различные треугольные грани, и, по крайней мере, пять треугольников обладают общей вершиной. Такие полиэдры допускают координационные числа 12, 14, 15, и 16. Полиэдры Франка—Каспера и соответствующие высокие координационные числа известны среди многочисленных интерметаллидов. 21
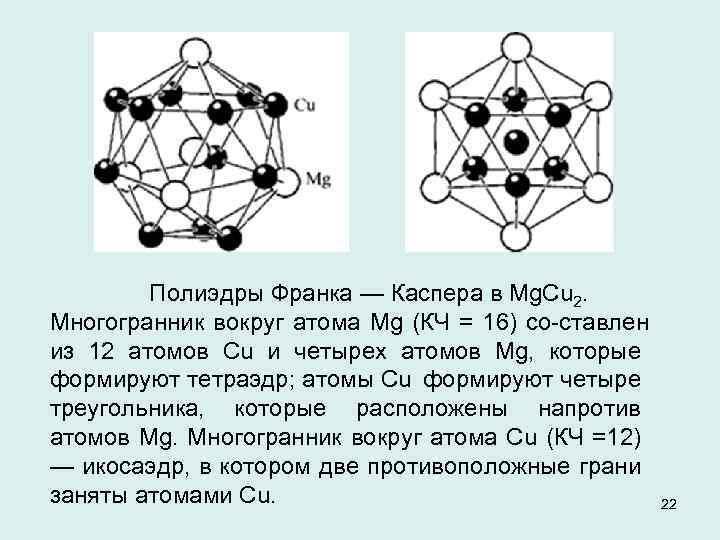 Полиэдры Франка — Каспера в Mg. Cu 2. Многогранник вокруг атома Mg (КЧ = 16) со ставлен из 12 атомов Cu и четырех атомов Mg, которые формируют тетраэдр; атомы Cu формируют четыре треугольника, которые расположены напротив атомов Mg. Многогранник вокруг атома Cu (КЧ =12) — икосаэдр, в котором две противоположные грани заняты атомами Cu. 22
Полиэдры Франка — Каспера в Mg. Cu 2. Многогранник вокруг атома Mg (КЧ = 16) со ставлен из 12 атомов Cu и четырех атомов Mg, которые формируют тетраэдр; атомы Cu формируют четыре треугольника, которые расположены напротив атомов Mg. Многогранник вокруг атома Cu (КЧ =12) — икосаэдр, в котором две противоположные грани заняты атомами Cu. 22
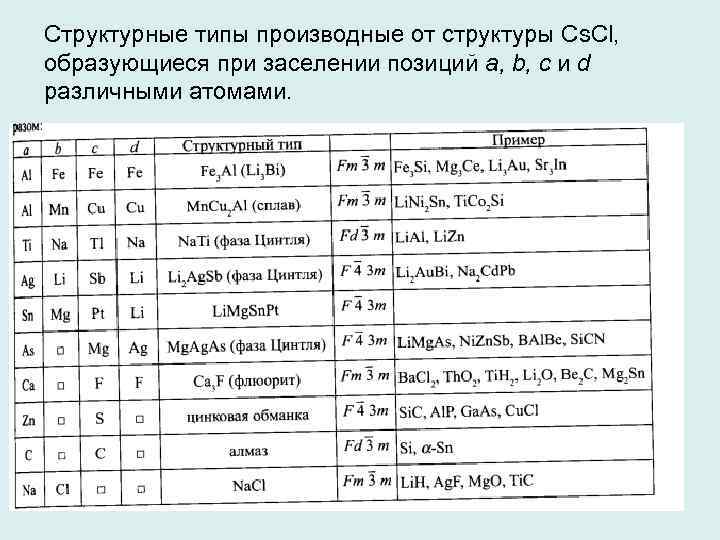 Структурные типы производные от структуры Cs. Cl, образующиеся при заселении позиций a, b, с и d различными атомами. 23
Структурные типы производные от структуры Cs. Cl, образующиеся при заселении позиций a, b, с и d различными атомами. 23
 Фазы Юм - Розери Фазами Юм Розери (фазами латуни, «электронными соединениями» ) называются некоторые сплавы, обладающие структурами различных типов латуни (латунь = сплав Сu и Zn). Они образуются при взаимодействии металлов при достаточно малом различии в величинах атомных радиусов компонентов. Латуни представляют собой классическую иллюстрацию определяющего влияния концентрации валентных электронов (VEC) на структуру металлического сплава. VEC = (число валентных электронов) / (число атомов). 24
Фазы Юм - Розери Фазами Юм Розери (фазами латуни, «электронными соединениями» ) называются некоторые сплавы, обладающие структурами различных типов латуни (латунь = сплав Сu и Zn). Они образуются при взаимодействии металлов при достаточно малом различии в величинах атомных радиусов компонентов. Латуни представляют собой классическую иллюстрацию определяющего влияния концентрации валентных электронов (VEC) на структуру металлического сплава. VEC = (число валентных электронов) / (число атомов). 24
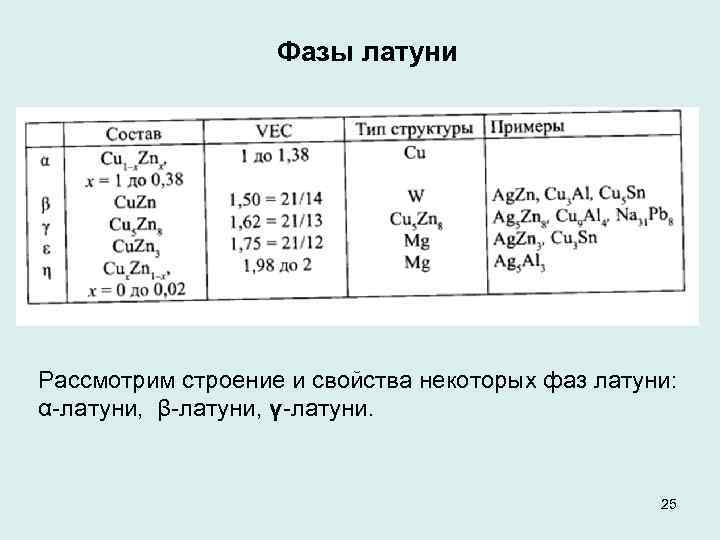 Фазы латуни Рассмотрим строение и свойства некоторых фаз латуни: α латуни, β латуни, γ латуни. 25
Фазы латуни Рассмотрим строение и свойства некоторых фаз латуни: α латуни, β латуни, γ латуни. 25
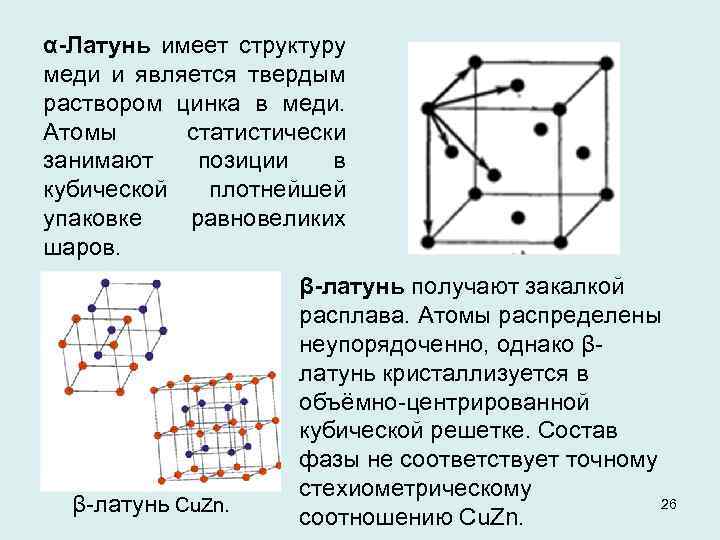 α-Латунь имеет структуру меди и является твердым раствором цинка в меди. Атомы статистически занимают позиции в кубической плотнейшей упаковке равновеликих шаров. β латунь Cu. Zn. β-латунь получают закалкой расплава. Атомы распределены неупорядоченно, однако β латунь кристаллизуется в объёмно центрированной кубической решетке. Состав фазы не соответствует точному стехиометрическому 26 соотношению Сu. Zn.
α-Латунь имеет структуру меди и является твердым раствором цинка в меди. Атомы статистически занимают позиции в кубической плотнейшей упаковке равновеликих шаров. β латунь Cu. Zn. β-латунь получают закалкой расплава. Атомы распределены неупорядоченно, однако β латунь кристаллизуется в объёмно центрированной кубической решетке. Состав фазы не соответствует точному стехиометрическому 26 соотношению Сu. Zn.
 Эта фаза устойчива при содержании атомов цинка от 45 до 48 мол. %. β латунь относится к структурному типу, объединяющему около 160 структур (Ag. Zn, Ca. Hg, Li. Ag, Cs. Br и другие). Структура β латуни является производной по отношению к структуре Fe. γ - латунь существует в диапазоне концентраций от Cu 5 Zn 6, 9 до Cu 5 Zn 9, 7. Структуру γ-латуни можно описать как сверхструктуру объёмно центрированной кубической упаковки с утроенным параметром кристаллической решетки. При этом элементарная ячейка увеличивает объем в З 3 раза, то есть в 27 раз. Однако элементарная ячейка содержит только 52 атома вместо 2 х 27 = 54 атома имеются две вакансии. Распределение вакансий в структуре является упорядоченным. 27
Эта фаза устойчива при содержании атомов цинка от 45 до 48 мол. %. β латунь относится к структурному типу, объединяющему около 160 структур (Ag. Zn, Ca. Hg, Li. Ag, Cs. Br и другие). Структура β латуни является производной по отношению к структуре Fe. γ - латунь существует в диапазоне концентраций от Cu 5 Zn 6, 9 до Cu 5 Zn 9, 7. Структуру γ-латуни можно описать как сверхструктуру объёмно центрированной кубической упаковки с утроенным параметром кристаллической решетки. При этом элементарная ячейка увеличивает объем в З 3 раза, то есть в 27 раз. Однако элементарная ячейка содержит только 52 атома вместо 2 х 27 = 54 атома имеются две вакансии. Распределение вакансий в структуре является упорядоченным. 27
 Имеются четыре вида позиций для металлических атомов в отношении 3: 2: 2: 6, но до некоторой степени наблюдается и статистическое распределение атомов. В Cu 5 Zn 8 атомы металлов занимают четыре вида кристаллографических позиций при следующем соотношении ЗСu: 2 Zn: 6 Zn. Сплавы с довольно различными составами могут обладать одинаковыми структурами. Определяющим фактором в этой ситуации выступает концентрация валентных электронов. 28
Имеются четыре вида позиций для металлических атомов в отношении 3: 2: 2: 6, но до некоторой степени наблюдается и статистическое распределение атомов. В Cu 5 Zn 8 атомы металлов занимают четыре вида кристаллографических позиций при следующем соотношении ЗСu: 2 Zn: 6 Zn. Сплавы с довольно различными составами могут обладать одинаковыми структурами. Определяющим фактором в этой ситуации выступает концентрация валентных электронов. 28
 Структуры этих интерметаллидов повторяют характерные структуры металлов. Для двойных интерметаллидов установлены следующие типы электронных соединений: в области значений VEC около 3/2 образуются фазы Юм Розери структурных типов латуни, Cs. Cl, Mn, Mg; около VEC = 21/13 фазы со структурой типа латуни; около VEC = 7/4 фазы структурного типа латуни. 29
Структуры этих интерметаллидов повторяют характерные структуры металлов. Для двойных интерметаллидов установлены следующие типы электронных соединений: в области значений VEC около 3/2 образуются фазы Юм Розери структурных типов латуни, Cs. Cl, Mn, Mg; около VEC = 21/13 фазы со структурой типа латуни; около VEC = 7/4 фазы структурного типа латуни. 29
 Влияние концентрации валентных электронов на структуру образующейся фазы, можно представить следующим образом. Если начать с меди и прибавлять все больше и большее количество цинка, происходит увеличение концентрации валентных электронов. Добавленные электроны занимают более высокие энергетические уровни, то есть энергия уровня Ферми повышается и приближается к границам первой зоны Бриллюэна. Это сближение происходит приблизительно при значении VEC = 1, 36. Более высокие значения VEC требуют размещения в области разрыхляющих состояний. Объемно центрированная кубическая решетка (структурный тип W при VEC = 1, 50) становится более благоприятной, поскольку это позволяет увеличить значения VEC в пределах первой зоны Бриллюэна приблизительно до VEC = 1, 48. 30
Влияние концентрации валентных электронов на структуру образующейся фазы, можно представить следующим образом. Если начать с меди и прибавлять все больше и большее количество цинка, происходит увеличение концентрации валентных электронов. Добавленные электроны занимают более высокие энергетические уровни, то есть энергия уровня Ферми повышается и приближается к границам первой зоны Бриллюэна. Это сближение происходит приблизительно при значении VEC = 1, 36. Более высокие значения VEC требуют размещения в области разрыхляющих состояний. Объемно центрированная кубическая решетка (структурный тип W при VEC = 1, 50) становится более благоприятной, поскольку это позволяет увеличить значения VEC в пределах первой зоны Бриллюэна приблизительно до VEC = 1, 48. 30
 -Фазы образуют переходные металлы главным образом подгрупп Vб, VIб с металлами подгрупп VIIб, VIIIб также при условии достаточно малого различия в величинах их атомных радиусов (эти интерметаллиды иногда называют электронными соединениями переходных металлов). Состав большинства интерметаллидов не отвечает простым атомным соотношениям компонентов, т. к. обычно эти соотношения определяются структурным типом и наличием упорядоченного расположения атомов компонентов. Упорядоченные структуры характерны для многих фаз Юм Розери, фаз Лавеса и родственных им соединений (например, Sm. Co 5), для фаз структурного типа Cr 3 Si, фаз (например, Fе 7 Мо 6), некоторых фаз. Многие интерметаллиды, например, фазы Юм Розери, фаза Fe. Cr, являются неупорядоченными. 31
-Фазы образуют переходные металлы главным образом подгрупп Vб, VIб с металлами подгрупп VIIб, VIIIб также при условии достаточно малого различия в величинах их атомных радиусов (эти интерметаллиды иногда называют электронными соединениями переходных металлов). Состав большинства интерметаллидов не отвечает простым атомным соотношениям компонентов, т. к. обычно эти соотношения определяются структурным типом и наличием упорядоченного расположения атомов компонентов. Упорядоченные структуры характерны для многих фаз Юм Розери, фаз Лавеса и родственных им соединений (например, Sm. Co 5), для фаз структурного типа Cr 3 Si, фаз (например, Fе 7 Мо 6), некоторых фаз. Многие интерметаллиды, например, фазы Юм Розери, фаза Fe. Cr, являются неупорядоченными. 31
 Состав и структура некоторых фаз Юм - Розери 32
Состав и структура некоторых фаз Юм - Розери 32
 Кристаллическая структура интерметаллидов Состав и структура интерметаллидов зависят от электроотрицательности компонентов, числа валентных электронов, величин атомных (металлических или ковалентных) или ионных радиусов (в зависимости от преобладающего типа химической связи), т. е. в целом от положения компонентов в периодической системе. По характеру химической связи можно выделить структуры следующих типов: • структуры с низкими координационными числами, характерные для интерметаллидов с ковалентной связью. При этом атомы элемента из подгрупп б периодической системы в структуре типа Са. F 2 расположены внутри тетраэдра (к. ч. = 4, например, Pt. Al 2, Au. In 2), а в структуре типа Ni. As в центре 33 тригональной призмы (к. ч. = 6).
Кристаллическая структура интерметаллидов Состав и структура интерметаллидов зависят от электроотрицательности компонентов, числа валентных электронов, величин атомных (металлических или ковалентных) или ионных радиусов (в зависимости от преобладающего типа химической связи), т. е. в целом от положения компонентов в периодической системе. По характеру химической связи можно выделить структуры следующих типов: • структуры с низкими координационными числами, характерные для интерметаллидов с ковалентной связью. При этом атомы элемента из подгрупп б периодической системы в структуре типа Са. F 2 расположены внутри тетраэдра (к. ч. = 4, например, Pt. Al 2, Au. In 2), а в структуре типа Ni. As в центре 33 тригональной призмы (к. ч. = 6).
 • структуры ионных и металлических кристаллов, которые можно рассматривать как плотные упаковки сферических частиц. Благодаря плотной упаковке одни и те же структурные типы характерны для кристаллов с ионным и металлическим типом связи. Главный параметр, определяющий возникновение того или иного структурного типа для ионных и металлических кристаллов, отношение соответствующих ионных и металлических радиусов компонентов. • вместе с тем среди интерметаллидов, как и среди металлов, имеются специфические кристаллические структуры. В основе наиболее общей систематики структурных типов интерметаллидов лежат координационные характеристики атома меньшего размера. 34
• структуры ионных и металлических кристаллов, которые можно рассматривать как плотные упаковки сферических частиц. Благодаря плотной упаковке одни и те же структурные типы характерны для кристаллов с ионным и металлическим типом связи. Главный параметр, определяющий возникновение того или иного структурного типа для ионных и металлических кристаллов, отношение соответствующих ионных и металлических радиусов компонентов. • вместе с тем среди интерметаллидов, как и среди металлов, имеются специфические кристаллические структуры. В основе наиболее общей систематики структурных типов интерметаллидов лежат координационные характеристики атома меньшего размера. 34
 С помощью координационных полиэдров, которые используют для описания структур интерметаллидов, устанавливается родственность трех структурных типов фаз Лавеса (усеченные тетраэдры) Mg. Cu 2, Mg. Zn 2 и Mg. Ni 2. Всего выделено 14 классов (или семейств) структурных типов. К числу наиболее распространенных относятся интерметаллиды, имеющие структуры, близкие к структурам чистых металлов плотнейшие кубическую гранецентрированную и гексагональную, а также кубическую объёмно центрированную. Координационные многогранники для плотнейших упаковок шаров одинакового размера кубооктаэдр и его гексагональный аналог - характерны для интерметаллидов, компоненты которых имеют близкие атомные радиусы. 35
С помощью координационных полиэдров, которые используют для описания структур интерметаллидов, устанавливается родственность трех структурных типов фаз Лавеса (усеченные тетраэдры) Mg. Cu 2, Mg. Zn 2 и Mg. Ni 2. Всего выделено 14 классов (или семейств) структурных типов. К числу наиболее распространенных относятся интерметаллиды, имеющие структуры, близкие к структурам чистых металлов плотнейшие кубическую гранецентрированную и гексагональную, а также кубическую объёмно центрированную. Координационные многогранники для плотнейших упаковок шаров одинакового размера кубооктаэдр и его гексагональный аналог - характерны для интерметаллидов, компоненты которых имеют близкие атомные радиусы. 35
 Кроме соединений со структурами типов Сu и Mg к данному классу принадлежат семейства сверхструктур (например, Au. Cu 3, Pt 7 Cu), а также структурные типы Ni 3 Sn, Ti. Cu 3 и другие. Координационному числу = 8 + 6 соответствует координационный многогранник в виде куба (8 соседей у центрального атома), атомы второй координационной сферы располагаются в вершинах октаэдра. К этому классу относятся структурные типы Fe, сверхструктуры на основе решетки типа Fe (напр. , латунь или Cu. Zn, Fe 3 Al). 36
Кроме соединений со структурами типов Сu и Mg к данному классу принадлежат семейства сверхструктур (например, Au. Cu 3, Pt 7 Cu), а также структурные типы Ni 3 Sn, Ti. Cu 3 и другие. Координационному числу = 8 + 6 соответствует координационный многогранник в виде куба (8 соседей у центрального атома), атомы второй координационной сферы располагаются в вершинах октаэдра. К этому классу относятся структурные типы Fe, сверхструктуры на основе решетки типа Fe (напр. , латунь или Cu. Zn, Fe 3 Al). 36
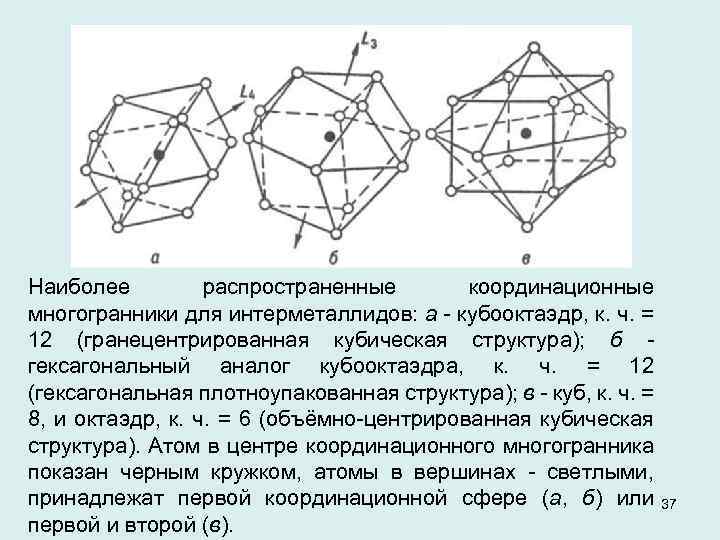 Наиболее распространенные координационные многогранники для интерметаллидов: а кубооктаэдр, к. ч. = 12 (гранецентрированная кубическая структура); б гексагональный аналог кубооктаэдра, к. ч. = 12 (гексагональная плотноупакованная структура); в куб, к. ч. = 8, и октаэдр, к. ч. = 6 (объёмно центрированная кубическая структура). Атом в центре координационного многогранника показан черным кружком, атомы в вершинах светлыми, принадлежат первой координационной сфере (а, б) или первой и второй (в). 37
Наиболее распространенные координационные многогранники для интерметаллидов: а кубооктаэдр, к. ч. = 12 (гранецентрированная кубическая структура); б гексагональный аналог кубооктаэдра, к. ч. = 12 (гексагональная плотноупакованная структура); в куб, к. ч. = 8, и октаэдр, к. ч. = 6 (объёмно центрированная кубическая структура). Атом в центре координационного многогранника показан черным кружком, атомы в вершинах светлыми, принадлежат первой координационной сфере (а, б) или первой и второй (в). 37
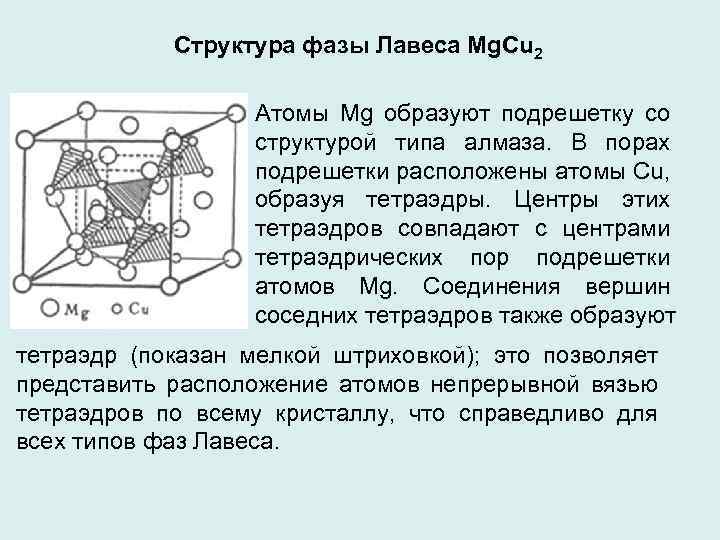 Структура фазы Лавеса Mg. Cu 2 Атомы Mg образуют подрешетку со структурой типа алмаза. В порах подрешетки расположены атомы Сu, образуя тетраэдры. Центры этих тетраэдров совпадают с центрами тетраэдрических пор подрешетки атомов Mg. Соединения вершин соседних тетраэдров также образуют тетраэдр (показан мелкой штриховкой); это позволяет представить расположение атомов непрерывной вязью тетраэдров по всему кристаллу, что справедливо для всех типов фаз Лавеса.
Структура фазы Лавеса Mg. Cu 2 Атомы Mg образуют подрешетку со структурой типа алмаза. В порах подрешетки расположены атомы Сu, образуя тетраэдры. Центры этих тетраэдров совпадают с центрами тетраэдрических пор подрешетки атомов Mg. Соединения вершин соседних тетраэдров также образуют тетраэдр (показан мелкой штриховкой); это позволяет представить расположение атомов непрерывной вязью тетраэдров по всему кристаллу, что справедливо для всех типов фаз Лавеса.
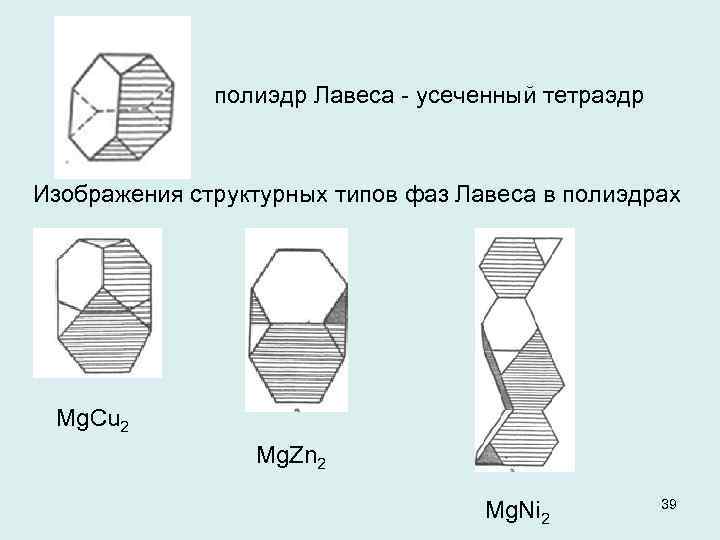 полиэдр Лавеса усеченный тетраэдр Изображения структурных типов фаз Лавеса в полиэдрах Mg. Cu 2 Mg. Zn 2 Mg. Ni 2 39
полиэдр Лавеса усеченный тетраэдр Изображения структурных типов фаз Лавеса в полиэдрах Mg. Cu 2 Mg. Zn 2 Mg. Ni 2 39
 Систематика структурных типов интерметаллидов 40
Систематика структурных типов интерметаллидов 40
 Одним из главных принципов структурообразования для кристаллов интерметаллидов следует считать предложенный Ф. Лавесом в 1967 принцип наиболее полного заполнения пространства. Оно обеспечивается или плотнейшей упаковкой сфер при одинаковом радиусе компонентов (к. ч. = 12; пустоты, между атомами имеют конфигурацию тетраэдров и октаэдров), или идеальной упаковкой нескольких искаженных тетраэдров (характеризуется только одним типом пустот тетраэдрическим). Интерметаллиды, для которых характерно небольшое различие атомных радиусов, описываются многогранниками Франка – Каспера. Это сложенные из тетраэдров выпуклые многогранники с треугольными гранями имеющие 12, 14, 15 и 16 вершин. В других случаях, например, для фаз Лавеса, условия плотной упаковки требуют обязательного и существенного различия величин атомных радиусов компонентов. 41
Одним из главных принципов структурообразования для кристаллов интерметаллидов следует считать предложенный Ф. Лавесом в 1967 принцип наиболее полного заполнения пространства. Оно обеспечивается или плотнейшей упаковкой сфер при одинаковом радиусе компонентов (к. ч. = 12; пустоты, между атомами имеют конфигурацию тетраэдров и октаэдров), или идеальной упаковкой нескольких искаженных тетраэдров (характеризуется только одним типом пустот тетраэдрическим). Интерметаллиды, для которых характерно небольшое различие атомных радиусов, описываются многогранниками Франка – Каспера. Это сложенные из тетраэдров выпуклые многогранники с треугольными гранями имеющие 12, 14, 15 и 16 вершин. В других случаях, например, для фаз Лавеса, условия плотной упаковки требуют обязательного и существенного различия величин атомных радиусов компонентов. 41
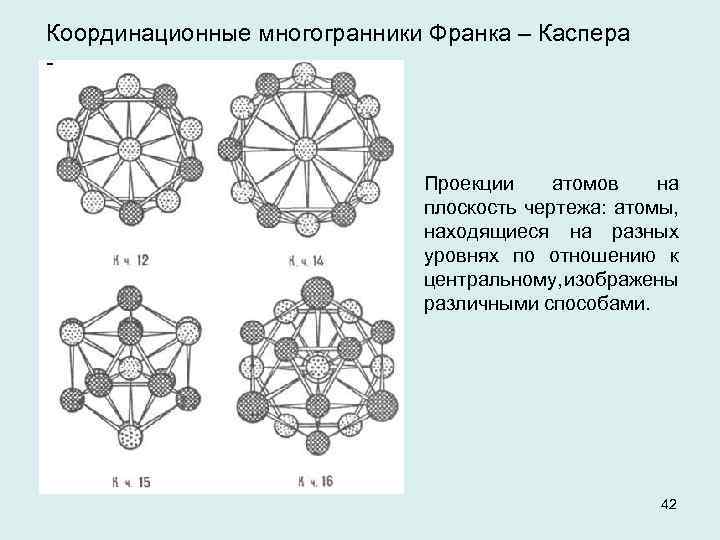 Координационные многогранники Франка – Каспера Проекции атомов на плоскость чертежа: атомы, находящиеся на разных уровнях по отношению к центральному, изображены различными способами. 42
Координационные многогранники Франка – Каспера Проекции атомов на плоскость чертежа: атомы, находящиеся на разных уровнях по отношению к центральному, изображены различными способами. 42
 Свойства интерметаллидов Физические и химические свойства интерметаллидов в гораздо большей степени, чем кристаллическая. структура, зависят от природы химической связи. Ионные интерметаллиды обладают свойствами, характерными для солей: высокой температурой плавления, пониженной (по сравнению с металлической) электрической проводимостью, наличием узких областей гомогенности и др. , многие разлагаются водой. Для интерметаллидов с преобладающей металлической связью характерны свойства металлов, более или менее значительной способность к пластической деформации. Полупроводниковыми свойствами обладают, как правило, соединения металлов с неметаллами. Некоторые интерметаллиды используют как магнитные материалы (Sm. Co 5, Fe 3 Ni, Cu 2 Mn. Al и др. ), сверхпроводники (Nb 3 Sn и др. ), аккумуляторы Н 2 (соед. РЗЭ, РЗЭ и Mg, напр. La. Ni 5, Ce. Mg 12). На основе интерметаллидов созданы защитные покрытия из тугоплавких металлов (Ni 3 Al, Ni 3 Nb, Ti 3 Al и др. ). 43
Свойства интерметаллидов Физические и химические свойства интерметаллидов в гораздо большей степени, чем кристаллическая. структура, зависят от природы химической связи. Ионные интерметаллиды обладают свойствами, характерными для солей: высокой температурой плавления, пониженной (по сравнению с металлической) электрической проводимостью, наличием узких областей гомогенности и др. , многие разлагаются водой. Для интерметаллидов с преобладающей металлической связью характерны свойства металлов, более или менее значительной способность к пластической деформации. Полупроводниковыми свойствами обладают, как правило, соединения металлов с неметаллами. Некоторые интерметаллиды используют как магнитные материалы (Sm. Co 5, Fe 3 Ni, Cu 2 Mn. Al и др. ), сверхпроводники (Nb 3 Sn и др. ), аккумуляторы Н 2 (соед. РЗЭ, РЗЭ и Mg, напр. La. Ni 5, Ce. Mg 12). На основе интерметаллидов созданы защитные покрытия из тугоплавких металлов (Ni 3 Al, Ni 3 Nb, Ti 3 Al и др. ). 43
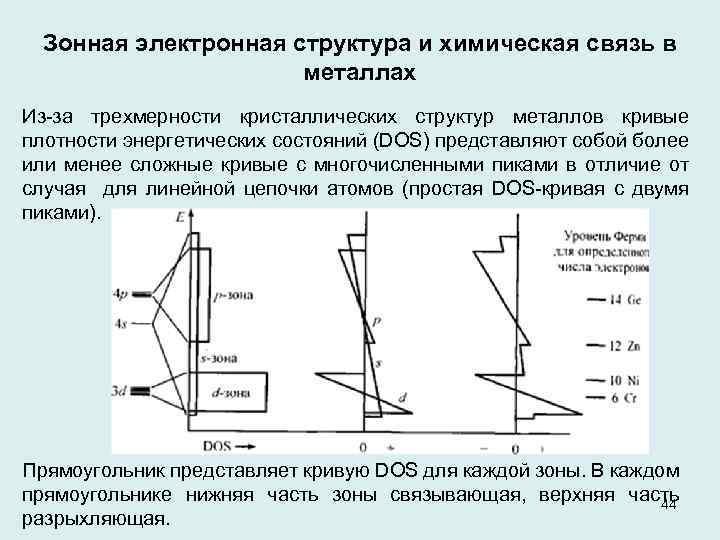 Зонная электронная структура и химическая связь в металлах Из за трехмерности кристаллических структур металлов кривые плотности энергетических состояний (DOS) представляют собой более или менее сложные кривые с многочисленными пиками в отличие от случая для линейной цепочки атомов (простая DOS кривая с двумя пиками). Прямоугольник представляет кривую DOS для каждой зоны. В каждом прямоугольнике нижняя часть зоны связывающая, верхняя часть 44 разрыхляющая.
Зонная электронная структура и химическая связь в металлах Из за трехмерности кристаллических структур металлов кривые плотности энергетических состояний (DOS) представляют собой более или менее сложные кривые с многочисленными пиками в отличие от случая для линейной цепочки атомов (простая DOS кривая с двумя пиками). Прямоугольник представляет кривую DOS для каждой зоны. В каждом прямоугольнике нижняя часть зоны связывающая, верхняя часть 44 разрыхляющая.
 Диаграмма заселенности области перекрывания электронных орбиталей в кристаллах (СООР) металлов показывает составляющие для правой и левой части каждой зоны, р -зона характеризуется большим значением разрыхляющей составляющей по сравнению с величиной связывающей составляющей, поэтому преобладает ее левая часть. В ряду калий, кальций, скандий, . . . от элемента к элементу прибавляется валентный электрон, а уровень Ферми поднимается. Для некоторых количеств валентных электронов уровень Ферми отмечен с правой стороны рисунка. Видно, что первые связывающие состояния заселены, поэтому прочность связи для металлов увеличивается от калия до хрома. От седьмого до десятого валентного электрона доступны только разрыхляющие состояния, поэтому прочности связи падает от хрома до никеля. Следующие электроны (Cu, Zn) являются слабо связывающими. С числом валентных электронов, большим, чем 14, заселение области перекрывания орбиталей в кристалле для металлических структур становится отрицательным. Как результат, структуры с низкими координационными числами становятся наиболее предпочтительными. 45
Диаграмма заселенности области перекрывания электронных орбиталей в кристаллах (СООР) металлов показывает составляющие для правой и левой части каждой зоны, р -зона характеризуется большим значением разрыхляющей составляющей по сравнению с величиной связывающей составляющей, поэтому преобладает ее левая часть. В ряду калий, кальций, скандий, . . . от элемента к элементу прибавляется валентный электрон, а уровень Ферми поднимается. Для некоторых количеств валентных электронов уровень Ферми отмечен с правой стороны рисунка. Видно, что первые связывающие состояния заселены, поэтому прочность связи для металлов увеличивается от калия до хрома. От седьмого до десятого валентного электрона доступны только разрыхляющие состояния, поэтому прочности связи падает от хрома до никеля. Следующие электроны (Cu, Zn) являются слабо связывающими. С числом валентных электронов, большим, чем 14, заселение области перекрывания орбиталей в кристалле для металлических структур становится отрицательным. Как результат, структуры с низкими координационными числами становятся наиболее предпочтительными. 45
 Описанная в общих чертах картина не отличается достаточной точностью, но она правильно отражает тенденции, которые можно проиллюстрировать изменением температур плавления металлов (значения представлены в °С): К Са Sc Тi V Сг Мn Fе Со Ni Сu Zп 63 839 1539 1667 1915 1900 1244 1535 1495 1455 1083 420 В действительности существуют тонкие отклонения от этой довольно простой картины. До некоторой степени сдвиг энергетических уровней от элемента к элементу, различные структурные типы, характеризующиеся различной зонной структурой, — все это вместе с концентрацией валентных электронов определяет, какая из этих структур станет более или менее благоприятной для данного вещества. Более точные расчеты показывают, что только разрыхляющие составляющие следует ожидать с появлением одиннадцатого валентного электрона. 46
Описанная в общих чертах картина не отличается достаточной точностью, но она правильно отражает тенденции, которые можно проиллюстрировать изменением температур плавления металлов (значения представлены в °С): К Са Sc Тi V Сг Мn Fе Со Ni Сu Zп 63 839 1539 1667 1915 1900 1244 1535 1495 1455 1083 420 В действительности существуют тонкие отклонения от этой довольно простой картины. До некоторой степени сдвиг энергетических уровней от элемента к элементу, различные структурные типы, характеризующиеся различной зонной структурой, — все это вместе с концентрацией валентных электронов определяет, какая из этих структур станет более или менее благоприятной для данного вещества. Более точные расчеты показывают, что только разрыхляющие составляющие следует ожидать с появлением одиннадцатого валентного электрона. 46


