Интерметаллические соединения.pptx
- Количество слайдов: 21
 Интерметаллические соединения
Интерметаллические соединения
 Интерметаллиды ИНТЕРМЕТАЛЛИДЫ - химические соединения двух или нескольких металлов между собой. Интерметаллиды, как и другие химические соединения, имеют фиксированное соотношение между компонентами(АВ, АВ 2, АВ 3, А 2 В, А 3 В). Относятся к металлическим соединениям, или металлидам. Интерметаллиды образуются в результате взаимодействия компонентов при сплавлении, конденсации из пара, а также при реакциях в твердом состоянии вследствие взаимной диффузии, при распаде пересыщенного твердого раствора одного металла в другом, в результате интенсивной пластической деформации при механическом сплавлении. В противоположность твердым растворам интерметаллиды имеют кристаллическую структуру, отличную от структур исходных металлов. Состав интерметаллических соединений не всегда подчиняется правилам валентности, но эти соединения имеют ярко выраженную индивидуальность свойств. Два металла могут образовывать между собой не одно, а несколько соединений, например, Na. Sn 3, Na. Sn 2, Na. Sn, Na 4 Sn 3, Na 2 Sn, Na 4 Sn и др. , существующие лишь в определенных пределах состава и температуры.
Интерметаллиды ИНТЕРМЕТАЛЛИДЫ - химические соединения двух или нескольких металлов между собой. Интерметаллиды, как и другие химические соединения, имеют фиксированное соотношение между компонентами(АВ, АВ 2, АВ 3, А 2 В, А 3 В). Относятся к металлическим соединениям, или металлидам. Интерметаллиды образуются в результате взаимодействия компонентов при сплавлении, конденсации из пара, а также при реакциях в твердом состоянии вследствие взаимной диффузии, при распаде пересыщенного твердого раствора одного металла в другом, в результате интенсивной пластической деформации при механическом сплавлении. В противоположность твердым растворам интерметаллиды имеют кристаллическую структуру, отличную от структур исходных металлов. Состав интерметаллических соединений не всегда подчиняется правилам валентности, но эти соединения имеют ярко выраженную индивидуальность свойств. Два металла могут образовывать между собой не одно, а несколько соединений, например, Na. Sn 3, Na. Sn 2, Na. Sn, Na 4 Sn 3, Na 2 Sn, Na 4 Sn и др. , существующие лишь в определенных пределах состава и температуры.
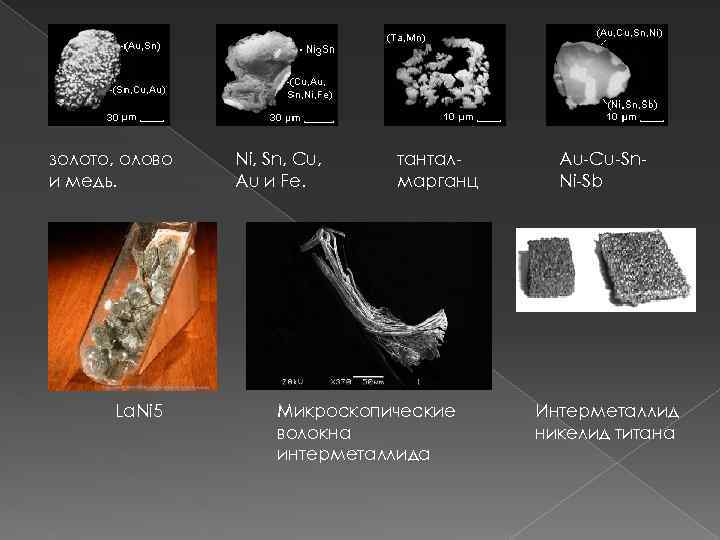 золото, олово и медь. La. Ni 5 Ni, Sn, Cu, Au и Fe. танталмарганц Микроскопические волокна интерметаллида Au-Cu-Sn. Ni-Sb Интерметаллид никелид титана
золото, олово и медь. La. Ni 5 Ni, Sn, Cu, Au и Fe. танталмарганц Микроскопические волокна интерметаллида Au-Cu-Sn. Ni-Sb Интерметаллид никелид титана
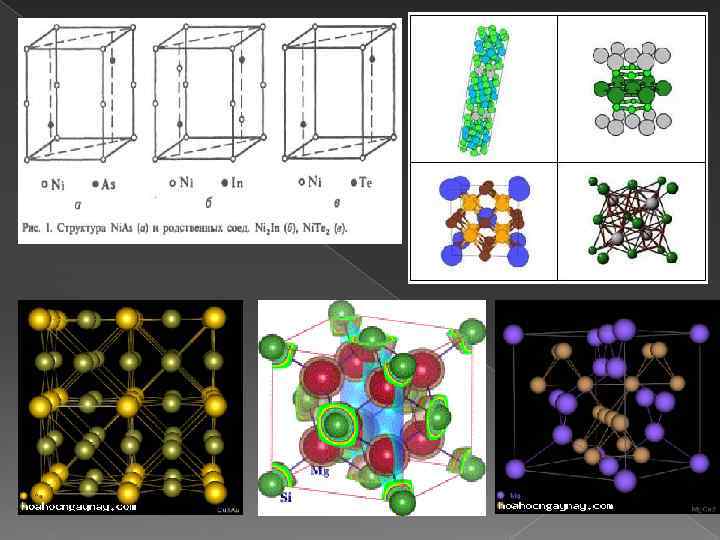
 Химические связи Для интерметаллидов характерны преимущественно металлический тип химической связи и специфические металлические свойства. Однако среди интерметаллидов имеются также солеобразные соединения с ионной связью (например Na. Au), соединенный с промежуточными характером связи - ионно-металлической и ковалентно-металлической, а также с ковалентной. Так, в ряду соединений Mg с элементами подгруппы IV вместе с уменьшением различия в электрохимических характеристиках компонентов наблюдается и изменение свойств интерметаллидов - от характерных для ионных соединений (Mg 2 Si, Mg 2 Ge) к свойствам, типичным для металлов (Mg 2 Pb). В соединениях структурного типа Ni. As (рис. 1) или родственных типов Ni 2 In, Ni. Te 2 или Cd. I 2, представляющих собой соединения переходных металлов подгрупп VII, VIII и металлов подгруппы Сu с элементами подгрупп III-VI, сложная природа химической связи, которая изменяется с изменением положения компонентов в периодической системе; одновременно изменяется и состав интерметаллидов. Для соединений состава АВ характерна ковалентно-металлическая связь; при изменении состава интерметаллидов от АВ 2 (например, Ni. Te 2) до А 2 В (например, Ni 2 In) наблюдается изменение природы связи - от преобладающей ионноковалентной до металлической.
Химические связи Для интерметаллидов характерны преимущественно металлический тип химической связи и специфические металлические свойства. Однако среди интерметаллидов имеются также солеобразные соединения с ионной связью (например Na. Au), соединенный с промежуточными характером связи - ионно-металлической и ковалентно-металлической, а также с ковалентной. Так, в ряду соединений Mg с элементами подгруппы IV вместе с уменьшением различия в электрохимических характеристиках компонентов наблюдается и изменение свойств интерметаллидов - от характерных для ионных соединений (Mg 2 Si, Mg 2 Ge) к свойствам, типичным для металлов (Mg 2 Pb). В соединениях структурного типа Ni. As (рис. 1) или родственных типов Ni 2 In, Ni. Te 2 или Cd. I 2, представляющих собой соединения переходных металлов подгрупп VII, VIII и металлов подгруппы Сu с элементами подгрупп III-VI, сложная природа химической связи, которая изменяется с изменением положения компонентов в периодической системе; одновременно изменяется и состав интерметаллидов. Для соединений состава АВ характерна ковалентно-металлическая связь; при изменении состава интерметаллидов от АВ 2 (например, Ni. Te 2) до А 2 В (например, Ni 2 In) наблюдается изменение природы связи - от преобладающей ионноковалентной до металлической.
 Фазы интерметаллидов Среди двойных интерметаллидов наиболее распространены соединения Курнакова, фазы Лавеса, фазы Юм-Розери, s-фазы, s-подобные фазы. Особенно многочисленными являются соединения Курнакова, характеризующиеся упорядоченным расположением атомов компонентов. Которые имеют составы АВ, А 2 В, А 3 В, однако в силу металлического характера связи, фазы могут обладать широкими областями гомогенности. Фазы Лавеса - соединения состава АВ 2 (реже АВ) - образуются обычно при определенном соотношении атомных радиусов компонентов r. А/r. В и обладают узкими областями гомогенности. При взаимодействии металлов подгруппы Iб, а также некоторых переходных с металлами подгрупп IIIa, IVa, IIб-Vб при условии достаточно малого различия в величинах атомных радиусов компонентов образуются фазы Юм-Розери, часто называемых также электронными соединениями. s-Фазы образуют переходные металлы главным образом подгрупп Vб, VIб с металлами подгрупп VIIб, VIIIб также при условии достаточно малого различия в величинах их атомных радиусов. s-Подобные фазы, например, m-, c-, Р-фазы, сходны по кристаллической структуре с s-фазами, но все же имеют небольшие отличия. Состав большинства интерметаллидов не отвечает простым атомным соотношениям компонентов, т. к. обычно эти соотношения определяются структурным типом и наличием упорядоченного расположения атомов компонентов.
Фазы интерметаллидов Среди двойных интерметаллидов наиболее распространены соединения Курнакова, фазы Лавеса, фазы Юм-Розери, s-фазы, s-подобные фазы. Особенно многочисленными являются соединения Курнакова, характеризующиеся упорядоченным расположением атомов компонентов. Которые имеют составы АВ, А 2 В, А 3 В, однако в силу металлического характера связи, фазы могут обладать широкими областями гомогенности. Фазы Лавеса - соединения состава АВ 2 (реже АВ) - образуются обычно при определенном соотношении атомных радиусов компонентов r. А/r. В и обладают узкими областями гомогенности. При взаимодействии металлов подгруппы Iб, а также некоторых переходных с металлами подгрупп IIIa, IVa, IIб-Vб при условии достаточно малого различия в величинах атомных радиусов компонентов образуются фазы Юм-Розери, часто называемых также электронными соединениями. s-Фазы образуют переходные металлы главным образом подгрупп Vб, VIб с металлами подгрупп VIIб, VIIIб также при условии достаточно малого различия в величинах их атомных радиусов. s-Подобные фазы, например, m-, c-, Р-фазы, сходны по кристаллической структуре с s-фазами, но все же имеют небольшие отличия. Состав большинства интерметаллидов не отвечает простым атомным соотношениям компонентов, т. к. обычно эти соотношения определяются структурным типом и наличием упорядоченного расположения атомов компонентов.
 Фазы Лавеса — самый многочисленный класс интерметаллических соединений. Фазы Лавеса получили своё название в честь немецкого кристаллохимика Фрица Лавеса, опубликовавшего вместе с Х. Витте в 1936 году большую работу, посвящённую кристаллической структуре и условиям образования ряда двойных соединений на основе магния. Подавляющее большинство двойных фаз Лавеса имеют стехиометрический состав AB 2, хотя имеются малочисленные исключения из этого правила. В настоящее время известно множество тройных интерметаллидов со структурой фаз Лавеса. Фазы Лавеса относятся к семейству фаз Франка-Каспера. Из-за зависимости их кристаллической структуры от электронной структуры их также часто причисляют к фазам Юм-Розери. Элементарная ячейка фазы Лавеса типа Mg. Zn 2. Атомы магния показаны зелёным цветом
Фазы Лавеса — самый многочисленный класс интерметаллических соединений. Фазы Лавеса получили своё название в честь немецкого кристаллохимика Фрица Лавеса, опубликовавшего вместе с Х. Витте в 1936 году большую работу, посвящённую кристаллической структуре и условиям образования ряда двойных соединений на основе магния. Подавляющее большинство двойных фаз Лавеса имеют стехиометрический состав AB 2, хотя имеются малочисленные исключения из этого правила. В настоящее время известно множество тройных интерметаллидов со структурой фаз Лавеса. Фазы Лавеса относятся к семейству фаз Франка-Каспера. Из-за зависимости их кристаллической структуры от электронной структуры их также часто причисляют к фазам Юм-Розери. Элементарная ячейка фазы Лавеса типа Mg. Zn 2. Атомы магния показаны зелёным цветом
 Типы фаз Лавеса Фазы Лавеса образуются атомами двух сортов A и B, причем атом сорта A всегда имеет больший атомный радиус (R), чем атом сорта B, причем существует идеальное соотношение радиусов компонентов RA: RB=1. 225. К фазам Лавеса относятся соединения, кристаллизующиеся в несколько родственных структурных типов, из которых наиболее многочисленными являются три нижеследующих: гексагональный тип Mg. Zn 2, 12 атомов в элементарной ячейке; кубический тип Mg. Cu 2 , 24 атома в элементарной ячейке; гексагональный тип Mg. Ni 2, 24 атома в элементарной ячейке.
Типы фаз Лавеса Фазы Лавеса образуются атомами двух сортов A и B, причем атом сорта A всегда имеет больший атомный радиус (R), чем атом сорта B, причем существует идеальное соотношение радиусов компонентов RA: RB=1. 225. К фазам Лавеса относятся соединения, кристаллизующиеся в несколько родственных структурных типов, из которых наиболее многочисленными являются три нижеследующих: гексагональный тип Mg. Zn 2, 12 атомов в элементарной ячейке; кубический тип Mg. Cu 2 , 24 атома в элементарной ячейке; гексагональный тип Mg. Ni 2, 24 атома в элементарной ячейке.
 Полиэдр Все эти структуры имеют схожее расположение атомов, которое проявляется в идентичных координационных полиэдрах (многогранник, образованный атомами одного сорта вокруг атомов другого). Так, во всех фазах Лавеса координационный полиэдр вокруг атома сорта A представляет собой так называемый Лавесовский полиэдр, имеющий форму усечённого тетраэдра. Сами же атомы сорта A располагаются в алмазоподобной подрешётке. Все фазы Лавеса являются политипами, то есть имеют разный порядок укладки одинаковых структурных единиц, в качестве которой в данном случае выступает многослойный «сэндвич» . Так кубическая фаза Лавеса Mg. Cu 2 представляет собой трёхслойную укладку элементарных структурных единиц в порядке …ABCABC…, фаза Mg. Zn 2 является двухслойной …ABAB…, а фаза Mg. Ni 2 — четырёхслойной …ABAC…. Поскольку возможны (хотя и редко встречаются) и другие последовательности укладки слоёв, то семейство фаз Лавеса является более многочисленным. Всего же к фазам Лавеса относится не менее 1000 различных интерметаллических соединений.
Полиэдр Все эти структуры имеют схожее расположение атомов, которое проявляется в идентичных координационных полиэдрах (многогранник, образованный атомами одного сорта вокруг атомов другого). Так, во всех фазах Лавеса координационный полиэдр вокруг атома сорта A представляет собой так называемый Лавесовский полиэдр, имеющий форму усечённого тетраэдра. Сами же атомы сорта A располагаются в алмазоподобной подрешётке. Все фазы Лавеса являются политипами, то есть имеют разный порядок укладки одинаковых структурных единиц, в качестве которой в данном случае выступает многослойный «сэндвич» . Так кубическая фаза Лавеса Mg. Cu 2 представляет собой трёхслойную укладку элементарных структурных единиц в порядке …ABCABC…, фаза Mg. Zn 2 является двухслойной …ABAB…, а фаза Mg. Ni 2 — четырёхслойной …ABAC…. Поскольку возможны (хотя и редко встречаются) и другие последовательности укладки слоёв, то семейство фаз Лавеса является более многочисленным. Всего же к фазам Лавеса относится не менее 1000 различных интерметаллических соединений.
 Кристаллическая структура Классификация интерметаллидов по кристаллическим структурным типам плохо коррелирует с типами химической связи, т. к. одни и те же структуры могут быть у соединены с различной природой химической связи. Можно лишь выделить структуры с низкими координационными числами (к. ч. ), характерные для интерметаллидов с ковалентной связью. При этом атомы элемента из подгрупп б периодической системы в структуре типа Са. F 2 расположены внутри тетраэдра (к. ч. = 4, напр. , Pt. Al 2, Au. In 2), а в структуре типа Ni. As - в центре тригональной призмы (к. ч. = 6). Структуры ионных и металлических кристаллов можно рассматривать как плотные упаковки сферических частиц. Благодаря плотной упаковке одни и те же структурные типы характерны для кристаллов с ионным и металлическим типом связи. Главный параметр, определяющий возникновение того или иного структурного типа для ионных и металлических кристаллов, - отношение соответственно ионных и металлических радиусов компонентов. Ограничение числа реализующихся структурных типов для интерметаллидов связано с тем, что диапазон изменений металлических атомных радиусов существенно уже, чем диапазон изменений радиусов катионов и анионов в ионных соединениях.
Кристаллическая структура Классификация интерметаллидов по кристаллическим структурным типам плохо коррелирует с типами химической связи, т. к. одни и те же структуры могут быть у соединены с различной природой химической связи. Можно лишь выделить структуры с низкими координационными числами (к. ч. ), характерные для интерметаллидов с ковалентной связью. При этом атомы элемента из подгрупп б периодической системы в структуре типа Са. F 2 расположены внутри тетраэдра (к. ч. = 4, напр. , Pt. Al 2, Au. In 2), а в структуре типа Ni. As - в центре тригональной призмы (к. ч. = 6). Структуры ионных и металлических кристаллов можно рассматривать как плотные упаковки сферических частиц. Благодаря плотной упаковке одни и те же структурные типы характерны для кристаллов с ионным и металлическим типом связи. Главный параметр, определяющий возникновение того или иного структурного типа для ионных и металлических кристаллов, - отношение соответственно ионных и металлических радиусов компонентов. Ограничение числа реализующихся структурных типов для интерметаллидов связано с тем, что диапазон изменений металлических атомных радиусов существенно уже, чем диапазон изменений радиусов катионов и анионов в ионных соединениях.
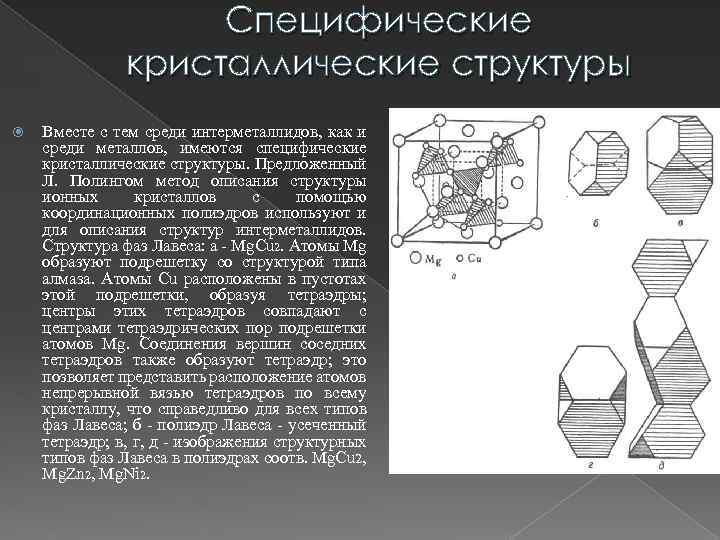 Специфические кристаллические структуры Вместе с тем среди интерметаллидов, как и среди металлов, имеются специфические кристаллические структуры. Предложенный Л. Полингом метод описания структуры ионных кристаллов с помощью координационных полиэдров используют и для описания структур интерметаллидов. Структура фаз Лавеса: a - Mg. Cu 2. Атомы Mg образуют подрешетку со структурой типа алмаза. Атомы Сu расположены в пустотах этой подрешетки, образуя тетраэдры; центры этих тетраэдров совпадают с центрами тетраэдрических пор подрешетки атомов Mg. Соединения вершин соседних тетраэдров также образуют тетраэдр; это позволяет представить расположение атомов непрерывной вязью тетраэдров по всему кристаллу, что справедливо для всех типов фаз Лавеса; б - полиэдр Лавеса - усеченный тетраэдр; в, г, д - изображения структурных типов фаз Лавеса в полиэдрах соотв. Mg. Cu 2, Mg. Zn 2, Mg. Ni 2.
Специфические кристаллические структуры Вместе с тем среди интерметаллидов, как и среди металлов, имеются специфические кристаллические структуры. Предложенный Л. Полингом метод описания структуры ионных кристаллов с помощью координационных полиэдров используют и для описания структур интерметаллидов. Структура фаз Лавеса: a - Mg. Cu 2. Атомы Mg образуют подрешетку со структурой типа алмаза. Атомы Сu расположены в пустотах этой подрешетки, образуя тетраэдры; центры этих тетраэдров совпадают с центрами тетраэдрических пор подрешетки атомов Mg. Соединения вершин соседних тетраэдров также образуют тетраэдр; это позволяет представить расположение атомов непрерывной вязью тетраэдров по всему кристаллу, что справедливо для всех типов фаз Лавеса; б - полиэдр Лавеса - усеченный тетраэдр; в, г, д - изображения структурных типов фаз Лавеса в полиэдрах соотв. Mg. Cu 2, Mg. Zn 2, Mg. Ni 2.
 Систематика структурных типов В основе наиб. общей систематики структурных типов интерметаллидов (П. И. Крипякевич, 1963) лежат координац. характеристики атома меньшего размера. Всего выделено 14 классов (или семейств) структурных типов, главные из них указаны в табл.
Систематика структурных типов В основе наиб. общей систематики структурных типов интерметаллидов (П. И. Крипякевич, 1963) лежат координац. характеристики атома меньшего размера. Всего выделено 14 классов (или семейств) структурных типов, главные из них указаны в табл.
 Координационные многогранники К числу наиболее распространенных относятся интерметаллиды, имеющие структуры, близкие к структурам чистых металлов, плотнейшие кубическую гранецентрированную и гексагональную (к. ч. = 12), а также кубическую объемноцентрированную (к. ч. = 8 + 6, где 8 и 6 - число атомов соотв. в первой и второй координационных сферах). Координационные многогранники для плотнейших упаковок шаров одинакового размера - кубооктаэдр и его гексагон. аналог (рис. 3, а, б) характерны для интерметаллидов, компоненты которых имеют близкие атомные радиусы. Кроме соединений со структурами типов Сu и Mg к данному классу принадлежат семейства сверхструктур (напр. , Au. Cu 3, Pt 7 Cu), а также структурные типы Ni 3 Sn, Ti. Cu 3 и др. К. ч. = 8 + 6 соответствует координационный многогранник в виде куба (8 соседей у центрального атома), атомы второй координационной сферы располагаются в вершинах октаэдра. К этому классу относятся структурные типы a-Fe, сверхструктуры на основе решетки типа a-Fe (например, b-латунь или Cu. Zn, Fe 3 Al).
Координационные многогранники К числу наиболее распространенных относятся интерметаллиды, имеющие структуры, близкие к структурам чистых металлов, плотнейшие кубическую гранецентрированную и гексагональную (к. ч. = 12), а также кубическую объемноцентрированную (к. ч. = 8 + 6, где 8 и 6 - число атомов соотв. в первой и второй координационных сферах). Координационные многогранники для плотнейших упаковок шаров одинакового размера - кубооктаэдр и его гексагон. аналог (рис. 3, а, б) характерны для интерметаллидов, компоненты которых имеют близкие атомные радиусы. Кроме соединений со структурами типов Сu и Mg к данному классу принадлежат семейства сверхструктур (напр. , Au. Cu 3, Pt 7 Cu), а также структурные типы Ni 3 Sn, Ti. Cu 3 и др. К. ч. = 8 + 6 соответствует координационный многогранник в виде куба (8 соседей у центрального атома), атомы второй координационной сферы располагаются в вершинах октаэдра. К этому классу относятся структурные типы a-Fe, сверхструктуры на основе решетки типа a-Fe (например, b-латунь или Cu. Zn, Fe 3 Al).
 Наиболее распространенные координационные многогранники для интерметаллидов: а - кубооктаэдр, к. ч. = 12 (гранецентрированная кубическая структура); б - гексагональный аналог кубооктаэдра, к. ч. = 12 (гексагональная плотноупакованная структура); в - куб, к. ч. = 8, и октаэдр, к. ч. = 6 (объемноцентрированная кубическая структура). Атом в центре координационного многогранника показан черным кружком, атомы в вершинах - светлыми, принадлежат первой координационной сфере (а, б) или первой и второй (в).
Наиболее распространенные координационные многогранники для интерметаллидов: а - кубооктаэдр, к. ч. = 12 (гранецентрированная кубическая структура); б - гексагональный аналог кубооктаэдра, к. ч. = 12 (гексагональная плотноупакованная структура); в - куб, к. ч. = 8, и октаэдр, к. ч. = 6 (объемноцентрированная кубическая структура). Атом в центре координационного многогранника показан черным кружком, атомы в вершинах - светлыми, принадлежат первой координационной сфере (а, б) или первой и второй (в).
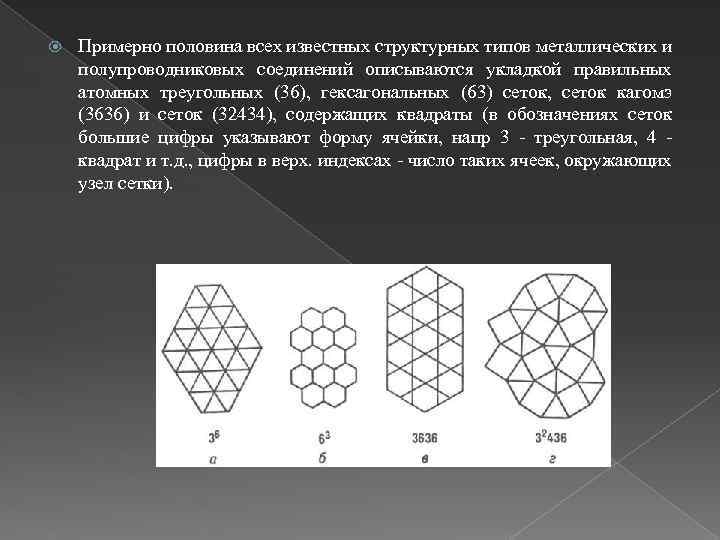 Примерно половина всех известных структурных типов металлических и полупроводниковых соединений описываются укладкой правильных атомных треугольных (36), гексагональных (63) сеток, сеток кагомэ (3636) и сеток (32434), содержащих квадраты (в обозначениях сеток большие цифры указывают форму ячейки, напр 3 - треугольная, 4 квадрат и т. д. , цифры в верх. индексах - число таких ячеек, окружающих узел сетки).
Примерно половина всех известных структурных типов металлических и полупроводниковых соединений описываются укладкой правильных атомных треугольных (36), гексагональных (63) сеток, сеток кагомэ (3636) и сеток (32434), содержащих квадраты (в обозначениях сеток большие цифры указывают форму ячейки, напр 3 - треугольная, 4 квадрат и т. д. , цифры в верх. индексах - число таких ячеек, окружающих узел сетки).
 Известные решетки металлов - гексагональная плотноупакованная и кубическая гранецентрированная - представляют собой двух- (ABA. . . ) и трехслойные (АВСА. . . ) упаковки треугольных сеток 36; в структурах соединений сетки содержат атомы разного сорта с упорядоченным или неупорядоченным расположением, может быть искаженными и иметь пятиугольные ячейки. В качестве примера на рисунке представлена структура s-фазы, показанная сетками. Структура s-фазы; представлена двумя сетками кагоме, повернутыми одна по отношению к другой на 90°; атомы, находящиеся между этими сетками, обозначены черными кружками. Несмотря на удобство описания структур с помощью плоских атомных сеток, следует учитывать трехмерный характер координации атомов в структурах кристаллов интерметаллидов. Одним из главных принципов структурообразования для этих кристаллов следует считать предложенный Ф. Лавесом в 1967 принцип наиболее полного заполнения пространства, которое обеспечивается или плотнейшей упаковкой сфер при одинаковом радиусе компонентов (к. ч. = 12; поры, или пустоты, между атомами имеют конфигурацию тетраэдров и октаэдров), или идеальной упаковкой нескольких искаженных тетраэдров
Известные решетки металлов - гексагональная плотноупакованная и кубическая гранецентрированная - представляют собой двух- (ABA. . . ) и трехслойные (АВСА. . . ) упаковки треугольных сеток 36; в структурах соединений сетки содержат атомы разного сорта с упорядоченным или неупорядоченным расположением, может быть искаженными и иметь пятиугольные ячейки. В качестве примера на рисунке представлена структура s-фазы, показанная сетками. Структура s-фазы; представлена двумя сетками кагоме, повернутыми одна по отношению к другой на 90°; атомы, находящиеся между этими сетками, обозначены черными кружками. Несмотря на удобство описания структур с помощью плоских атомных сеток, следует учитывать трехмерный характер координации атомов в структурах кристаллов интерметаллидов. Одним из главных принципов структурообразования для этих кристаллов следует считать предложенный Ф. Лавесом в 1967 принцип наиболее полного заполнения пространства, которое обеспечивается или плотнейшей упаковкой сфер при одинаковом радиусе компонентов (к. ч. = 12; поры, или пустоты, между атомами имеют конфигурацию тетраэдров и октаэдров), или идеальной упаковкой нескольких искаженных тетраэдров
 Дж. Каспер и Ф. Франк в 1958 нашли 4 типа сложенных из тетраэдров выпуклых многогранников с треугольными гранями, имеющих 12, 14, 15 и 16 вершин. Эти многогранники описывают сложные атомные структуры некоторых металлических элементов и ряда интерметаллидов (например, s-фаз). Для большинства интерметаллидов, описываемых многогранниками Каспера -Франка, характерно небольшое различие атомных радиусов. В других случаях, например, для фаз Лавеса, условия плотной упаковки требуют обязательного и существ. различия величин атомных радиусов компонентов интерметаллида. Состав и структура интерметаллидов зависят от электроотрицательности компонентов, числа валентных электронов, величин атомных (металлических или ковалентных) или ионных радиусов (в зависимости от преобладающего типа хим. связи), т. е. в целом от положения компонентов в периодической системе.
Дж. Каспер и Ф. Франк в 1958 нашли 4 типа сложенных из тетраэдров выпуклых многогранников с треугольными гранями, имеющих 12, 14, 15 и 16 вершин. Эти многогранники описывают сложные атомные структуры некоторых металлических элементов и ряда интерметаллидов (например, s-фаз). Для большинства интерметаллидов, описываемых многогранниками Каспера -Франка, характерно небольшое различие атомных радиусов. В других случаях, например, для фаз Лавеса, условия плотной упаковки требуют обязательного и существ. различия величин атомных радиусов компонентов интерметаллида. Состав и структура интерметаллидов зависят от электроотрицательности компонентов, числа валентных электронов, величин атомных (металлических или ковалентных) или ионных радиусов (в зависимости от преобладающего типа хим. связи), т. е. в целом от положения компонентов в периодической системе.
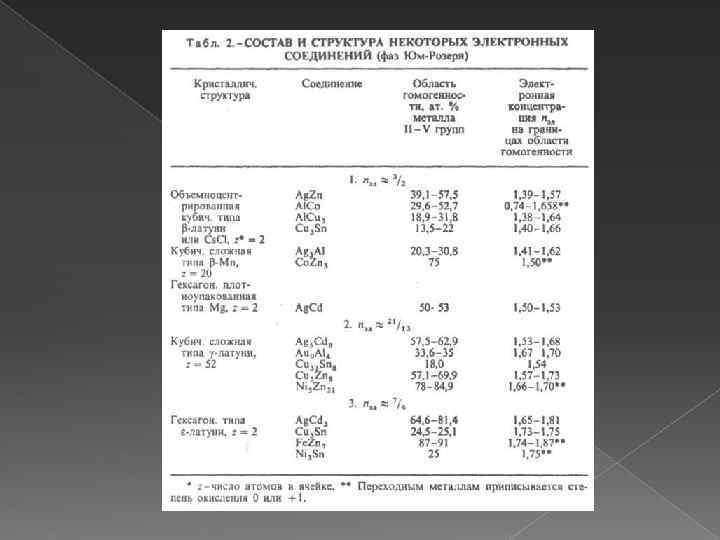
 Состав и структура фаз Юм-Розери Главный фактор, определяющий состав и строение фаз Юм-Розери, электронная концентрация nэл, равная отношению числа валентных электронов к числу атомов в решетке интерметаллида. Структуры этих интерметаллидов повторяют характерные структуры металлов. Для двойных интерметаллидов установлены следующие типы электронных соединений: в области значений nэл ок. 3/2 образуются b-фазы Юм. Розери структурных типов b-латуни, Cs. Cl, b-Mn, Mg; ок. nэл = 21/13 - gфазы со структурой типа g-латуни; ок. nзл = 7/4 - e-фазы структурного типа e-латуни. Значения nэл соответствуют границам области гомогенности (для компонента в более высокой степени окисления) данной фазы. Другой случай проявления ограничивающего действия фактора электронной концентрации известен для трехкомпонентных систем, например, для Mg. Cu 2 -Mg. Al 2, когда замещение меди алюминием приводит к последовательной смене структурных типов от Mg. Cu 2 (nэл = 1, 33 -1, 73) к Mg. Ni 2 (nэл= 1, 81 -1, 95) и к Mg. Zn 2 (nэл = 1, 98 -2, 05).
Состав и структура фаз Юм-Розери Главный фактор, определяющий состав и строение фаз Юм-Розери, электронная концентрация nэл, равная отношению числа валентных электронов к числу атомов в решетке интерметаллида. Структуры этих интерметаллидов повторяют характерные структуры металлов. Для двойных интерметаллидов установлены следующие типы электронных соединений: в области значений nэл ок. 3/2 образуются b-фазы Юм. Розери структурных типов b-латуни, Cs. Cl, b-Mn, Mg; ок. nэл = 21/13 - gфазы со структурой типа g-латуни; ок. nзл = 7/4 - e-фазы структурного типа e-латуни. Значения nэл соответствуют границам области гомогенности (для компонента в более высокой степени окисления) данной фазы. Другой случай проявления ограничивающего действия фактора электронной концентрации известен для трехкомпонентных систем, например, для Mg. Cu 2 -Mg. Al 2, когда замещение меди алюминием приводит к последовательной смене структурных типов от Mg. Cu 2 (nэл = 1, 33 -1, 73) к Mg. Ni 2 (nэл= 1, 81 -1, 95) и к Mg. Zn 2 (nэл = 1, 98 -2, 05).
 Свойства интерметаллидов Физические и химические свойства интерметаллидов в гораздо большей степени, чем кристаллическая структура, зависят от природы химической связи. Ионные интерметаллиды обладают свойствами, характерными для солей, с высокой температурой плавления, пониженной электрической проводимостью, наличием на диаграммах состояния узких областей гомогенности и др. , многие разлагаются водой. Для интерметаллидов с преобладающей металлической связью характерны свойства металлов, прежде всего более или менее значительная способность к пластической деформации. Все же многие интерметаллиды отличаются низкой пластичностью и сообщают повышенную хрупкость сплавам, в которых они являются одной из структурных составляющих. Благодаря особенностям кристаллической и электронной структур интерметаллидов в них происходит как бы оптимизация важных в практическом отношении физических свойств (высокая температура плавления и низкая диффузионная подвижность компонентов в жаропрочных сплавах, магнитокристаллическая анизотропия и высокая коэрцитивная сила в сплавах для постоянных магнитов, нулевая магнитострикция и высокая магнитная проницаемость в магнитно-мягких сплавах, сверхпроводимость, например, в сплавах Nb 3 Sn, Nb 3 Al. Свойствами полупроводников обладают, как правило, соединения металлов с неметаллами.
Свойства интерметаллидов Физические и химические свойства интерметаллидов в гораздо большей степени, чем кристаллическая структура, зависят от природы химической связи. Ионные интерметаллиды обладают свойствами, характерными для солей, с высокой температурой плавления, пониженной электрической проводимостью, наличием на диаграммах состояния узких областей гомогенности и др. , многие разлагаются водой. Для интерметаллидов с преобладающей металлической связью характерны свойства металлов, прежде всего более или менее значительная способность к пластической деформации. Все же многие интерметаллиды отличаются низкой пластичностью и сообщают повышенную хрупкость сплавам, в которых они являются одной из структурных составляющих. Благодаря особенностям кристаллической и электронной структур интерметаллидов в них происходит как бы оптимизация важных в практическом отношении физических свойств (высокая температура плавления и низкая диффузионная подвижность компонентов в жаропрочных сплавах, магнитокристаллическая анизотропия и высокая коэрцитивная сила в сплавах для постоянных магнитов, нулевая магнитострикция и высокая магнитная проницаемость в магнитно-мягких сплавах, сверхпроводимость, например, в сплавах Nb 3 Sn, Nb 3 Al. Свойствами полупроводников обладают, как правило, соединения металлов с неметаллами.
 Образование поверхностных оксидных пленок повышает сопротивляемость интерметаллидов к окислению. Наиболее стойки к окислению при повышенных температурах (выше 1000 °С) алюминиды и бериллиды. Ряд интерметаллидов, в частности интерметаллиды щелочных и щелочно-земельных металлов и некоторые соединения Аl, разлагаются в присутствии влаги. Скорость разложения легкоплавких интерметаллидов возрастает в ходе реакции (20 -40 ч); Mg. Cu 2, Mg. Zn 2, Al 3 Mg 2, Cu. Al 2 влагой не разлагаются. Характер взаимодействия интерметаллидов с Н 2 зависит от реакционной способности компонентов по отношению к водороду. Если все компоненты интерметаллида являются активными гидридообразователями, происходит диссоциация интерметаллида с образованием индивидуальных гидридов, насыщение водородом может привести к аморфизации интерметаллида. В других случаях возникают сложные гидриды как фазы на основе интерметаллида. Это определяется не только особенностями кристаллической структуры, но и особенностями электронной структуры компонентов и самого интерметаллида (наличием электронных вакансий). Такими особенностями обладают фазы Лавеса, а также родственные им фазы с участием переходных металлов, прежде всего редкоземельных элементов.
Образование поверхностных оксидных пленок повышает сопротивляемость интерметаллидов к окислению. Наиболее стойки к окислению при повышенных температурах (выше 1000 °С) алюминиды и бериллиды. Ряд интерметаллидов, в частности интерметаллиды щелочных и щелочно-земельных металлов и некоторые соединения Аl, разлагаются в присутствии влаги. Скорость разложения легкоплавких интерметаллидов возрастает в ходе реакции (20 -40 ч); Mg. Cu 2, Mg. Zn 2, Al 3 Mg 2, Cu. Al 2 влагой не разлагаются. Характер взаимодействия интерметаллидов с Н 2 зависит от реакционной способности компонентов по отношению к водороду. Если все компоненты интерметаллида являются активными гидридообразователями, происходит диссоциация интерметаллида с образованием индивидуальных гидридов, насыщение водородом может привести к аморфизации интерметаллида. В других случаях возникают сложные гидриды как фазы на основе интерметаллида. Это определяется не только особенностями кристаллической структуры, но и особенностями электронной структуры компонентов и самого интерметаллида (наличием электронных вакансий). Такими особенностями обладают фазы Лавеса, а также родственные им фазы с участием переходных металлов, прежде всего редкоземельных элементов.


