Тема 1 Оснвные понятия 2013 PowerPoint.pptx
- Количество слайдов: 46


• Инструктаж по технике безопасности при работе в кабинете химии.

М. В. Ломоносов «Широко простирает химия руки свои в дела человеческие»

1. Что изучает химия? Химия – это наука о веществах, их свойствах и превращениях веществ.

Что такое вещество? Это то, из чего состоят физические тела Что это за вещество и кто его придумал? Дальше!
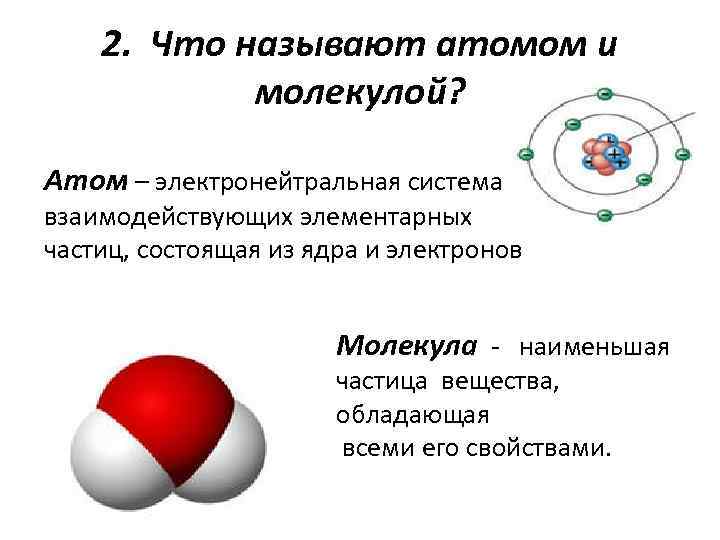
2. Что называют атомом и молекулой? Атом – электронейтральная система взаимодействующих элементарных частиц, состоящая из ядра и электронов Молекула - наименьшая частица вещества, обладающая всеми его свойствами.

Написание химических формул атомов и молекул • Химический знак— • Индекс— • Коэффициент--

Что такое химический элемент? Это определённый вид атомов

Систематизировать понятия и составить схему • Вещества простые • вещества сложные вещества, металлы, неметаллы, соли, кислоты, основания, оксиды


Примеры атомов и молекул • Атомы • Водород-Н • Кислород- О • Молекулы • Водород Н 2 • Кислород О 2 • Вода Н 2 О • Спирт С 2 Н 5 ОН

Массы атомов и молекул • За единицу атомной массы в химии и физике с 1961 года принята атомная единица массы (а. е. м. ), которая равна 1/12 массы атома изотопа углерода 12 С…

Что такое абсолютная и относительная атомная и молекулярная массы?

Расчет относительной молекулярной массы

Закон сохранения массы • Сколько атомов вступает в реакцию столько и получается
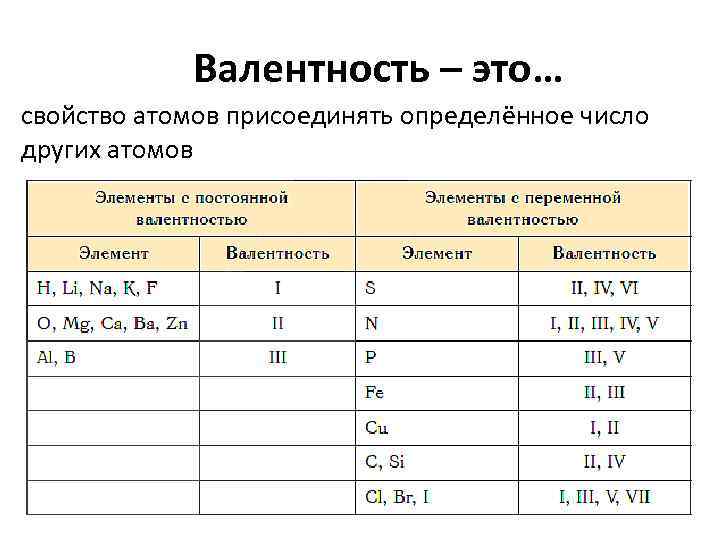
Валентность – это… свойство атомов присоединять определённое число других атомов

Алгоритм определения валентности, если известна валентность атома с постоянной валентностью Правило валентности: в молекуле общее число валентных единиц одного химического элемента равно общему числу валентных единиц другого химического элемента Na. CL

Типы химических реакций • Обмена • АВ+СД=СВ+АД • Замещения • АВ+С=СВ+А • Соединения • А+В=АВ • Разложения • АВ=А+В • АВС=АВ+С

Закончить фразы • Валентность бывает постоянной и …… • За единицу валентности принято…. . • Правило валентности: в молекуле общее число валентных единиц одного химического элемента равно… • Определить валентность: • N 2 O 5 Ca. CL 2 H 2 S

Дать определение понятиям • Атомная единица массы (а. е. м. ) • Относительная атомная масса (А r) – • Относительная молекулярная масса (М r ) • Найти относительную молекулярную массу молекулы: • серной кислоты, гидроксида натрия, оксида углерода -2

Количество вещества • Количества вещества (V) – число атомов, молекул или других структурных единиц данного вещества. • За единицу измерения количества вещества принят МОЛЬ • 1 Моль равен

МОЛЬ • • Моль – это … Число Авогадро – это… Постоянная Авогадро- это … Молярная масса М вещества – это…

синквейн – стихотворение из 5 строк по строгим правилам: 1. Тема, выраженная одним словом Вещество; 2. Описание темы двумя прилагательными; 3. Описание действия в рамках темы 3 глаголами; 4. Фраза из 4 слов, выражающая суть или отношение автора к теме; 5. Одно слово – синоним к первому.

• Относительная атомная масса (см. атомная масса химического элемента) Аr • Относительная молекулярная масса ( сумма относительных атомных масс всех атомов, образующих молекулу вещества) Mr

• КОЛИЧЕСТВО ВЕЩЕСТВА – число атомов, молекул или других структурных единиц вещества (моль) • Молярная масса – масса 1 моль вещества (г /моль, кг/ моль) М • Молярный объем – объем 1 моль газа при н. у. Vm = 22, 4 л/моль
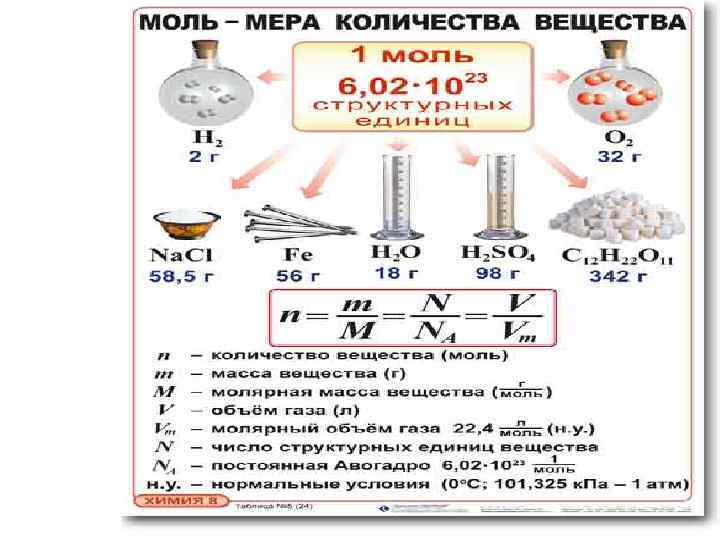

Количество вещества


Ответить на вопросы 1. Какое количество вещества ( моль) содержит 12, 04· 10²³ атомов натрия? 2. Какова масса 2 моль азота? 3. Какой объем занимают 1, 5 моль кислорода? 4. Какова масса 3 литров гелия?

1. n 2. = N/ Na = 12, 04 · 10²³ / 6, 02 · 10²³ = 2 моль m = n · M(N₂) = 2 моль · 28 г/ моль = 56 г. 3. V= n · Vm = 1, 5 моль · 22, 4 л/моль = 4. m= n· M = = 33, 6 л. V/Vm · M(He)= 3 л. /22, 4 л/моль · 4 г/моль = 0, 54 г.

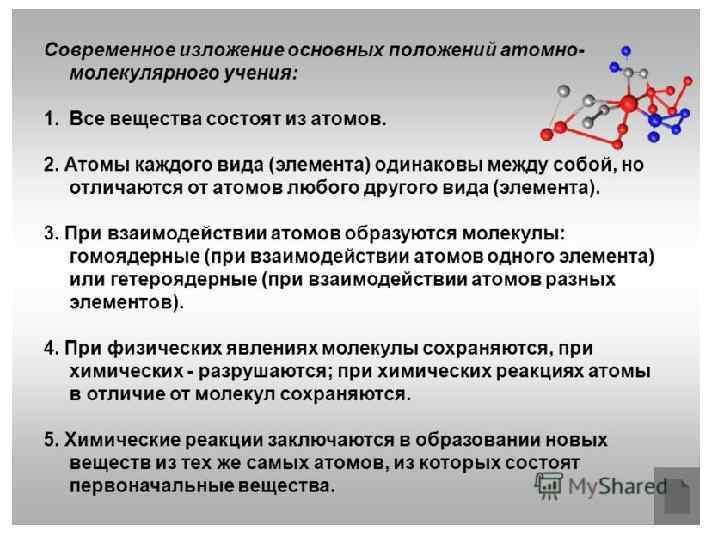
Основные положения атомномолекулярного учения. Атомно-молекулярное теория базируется на следующих законах и утверждениях: • Все вещества состоят из атомов • Атомы одного химического вещества (химический элемент) обладают одинаковыми свойствами, но отличаются от атомов другого вещества • При взаимодействии атомов образуются молекулы (гомоядерные — простые вещества, гетероядерные — сложные вещества) • При физических явлениях молекулы не изменяются, при химических происходит изменение их состава • Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состояли исходные вещества

Закон Авогадро

Закон постоянства состава вещества • Закон постоянства состава вещества: • каждое химически чистое вещество с молекулярным строением независимо от места нахождения и способа получения имеет один и тот же постоянный качественный и количественный состав.

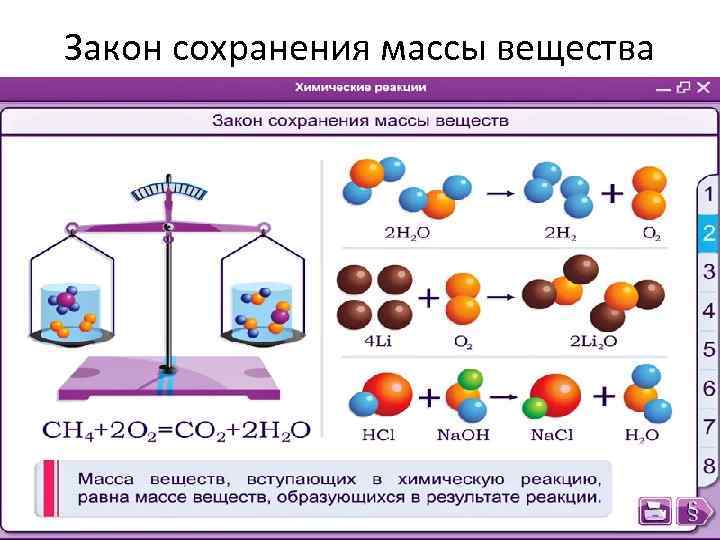
Закон сохранения массы вещества • Закон сохранения массы веществ в реакциях


Урок 1. • 5. Строение атома. -Ядро : протоны и нейтроны -Электроны

Урок 1

Урок 1

Урок 1. • 6. Химический элемент, изотопы. Химический элемент – совокупность атомов с одинаковым зарядом ядра ( числом протонов). Изотопы - разновидность атомов одного химического элемента с разным числом нейтронов в ядре.

Урок 1 - Каков порядковый номер калия? - Сколько протонов в его ядре? - Сколько электронов в атоме калия? - Сколько нейтронов в ядре калия? - Чему равно массовое число атома калия? №= 19 р = 19 е = 19 n = 20 Ar(K) = 39

Урок 1 7. Вещество. Это вид материи; физическая субстанция со специфическими химическими свойствами.

8. Простые и сложные вещества

ТЕСТЫ -мельчайшая химически неделимая электронейтраль ная частица вещества -виды элементарных частиц? -что называют массовым числом? -вид атомов с одинаковым зарядом ядра? -разновидность атомов с одинаковым зарядом ядра, но разной массой?

ТЕСТЫ Найдите соответствие : 1. Химический элемент А) состоит из атомов одного вида, обладает 2. Простое вещество постоянными физическими свойствами 3. Сложное вещество Б) состоит из атомов разных видов, имеет 4. Смесь постоянные свойства В) состоит из разных веществ, которые отличаются по свойствам ОТВЕТ: 1 – Г; 2 - А; Г) один вид атомов, физические свойства 3 – Б; 4 - В которого обычно не характеризуются Только сложные вещества перечислены в ряду : 1) воздух, вода, кислород 2) серная кислота, водород, озон 3) поваренная соль, вода, сероводород 4) кислород, азот, хлор Только простые вещества перечислены в ряду: 1) железо, кислород, соляная кислота 2) оксид натрия, вода, азот 3) фтор, кислород, сера 4) углерод, вода, сера ОТВЕТ: 1 - 3 ОТВЕТ: 3
Тема 1 Оснвные понятия 2013 PowerPoint.pptx