139.ppt
- Количество слайдов: 16

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Лекция Металлы p- блока 13 Al 3 s 23 p 1 50 Sn 5 s 25 p 2 82 Pb 6 s 26 p 2 Алюминий Олово Свинец 26, 982 118, 71 207, 2

Цель лекции: ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА изложение основных химических свойств и реакций p-элементов Компетенции, формируемые у студента: Умения: прогнозировать на основе современных представлений о строении атомов и химической связи, возможность протекания ОВР реакций, химические свойства соединений p-элементов Модуль V. Лекция. Р- металлы

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Природные соединения Минерал касситерит Sn. O 2 используется для получения Sn Модуль V. Лекция. Р- металлы Минерал корунд – природный оксид алюминия Минерал галенит Pb. S– основной минерал для получения Pb

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Свойства простых веществ Алюминий __ серебристо-белый, мягкий, легкий металл (плотность 2, 7 г/см 3), с температурой плавления 660 о. С. Олово – серебристо-белый металл, очень мягкий и пластичный. Олово отличается низкой температурой плавления 232 о. С Свинец – тяжелый металл синевато-серого цвета, очень мягкий. Плотность свинца – 11, 34 г/см 3, температура плавления – 334 о. С. Модуль V. Лекция. Р- металлы
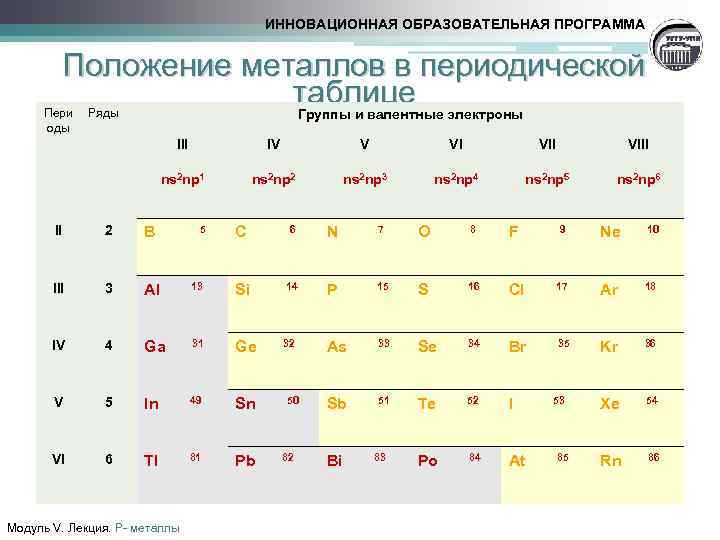
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Положение металлов в периодической таблице Группы и валентные электроны Пери оды Ряды III 2 3 4 V VI VIII ns 2 np 2 ns 2 np 3 ns 2 np 4 ns 2 np 5 ns 2 np 6 Al IV VI B III V ns 2 np 1 II IV C 6 N 7 O 8 F 9 Ne 10 13 Si 14 P 15 S 16 Cl 17 Ar 18 Ga 31 Ge 32 As 33 Se 34 Br 35 Kr 36 5 In 49 Sn Sb 51 Te 52 I Xe 54 6 Tl 81 Pb Po 84 At Rn 86 Модуль V. Лекция. Р- металлы 5 50 82 Bi 83 53 85

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Cвойства простых веществ Алюминий активный металл, Ео (Al 3+/ Al) = – 1, 66 В Высокая восстановительная способность алюминия используется для алюмотермического получения металлов 2 Al + Cr 2 O 3 = 2 Cr + Al 2 O 3 Модуль V. Лекция. Р- металлы

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Оксид и гидроксид алюминия Al. OOH + 3 H+ = Al 3+ + 2 H 2 O Al(OH)3 + 3 H+ = Al 3+ + 3 H 2 O Al. OOH + OH– + H 2 O = [Al(OH)4]– Al(OH)3 + OH– = [Al(OH)4]– При сплавлении оксида Al 2 O 3 с щелочью образуются алюминаты: Al 2 O 3 + 2 Na. OH = 2 Na. Al. O 2 + H 2 O Na. Al. O 2 + 2 H 2 O = Na[Al(OH)4] Модуль V. Лекция. Р- металлы

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Пооучение простых веществ Sn –из минерала касситерита Sn. O 2+ C = Sn + CO 2 Pb–из сульфидных минералов (Pb. S –галенит) 2 Pb. S + 3 O 2= 2 Pb. O + 2 SO 2 Pb. O + CO = Pb + CO 2 Модуль V. Лекция. Р- металлы

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Олово и свинец Реагируют при нагревании с галогенами, кислородом, серой Sn + 2 Cl 2 = Sn. Cl 4 Pb + Br 2 = Pb. Br 2 Pb + S = Pb. S Sn + S = Sn. S Sn + 2 S = Sn. S 2 Модуль V. Лекция. Р- металлы
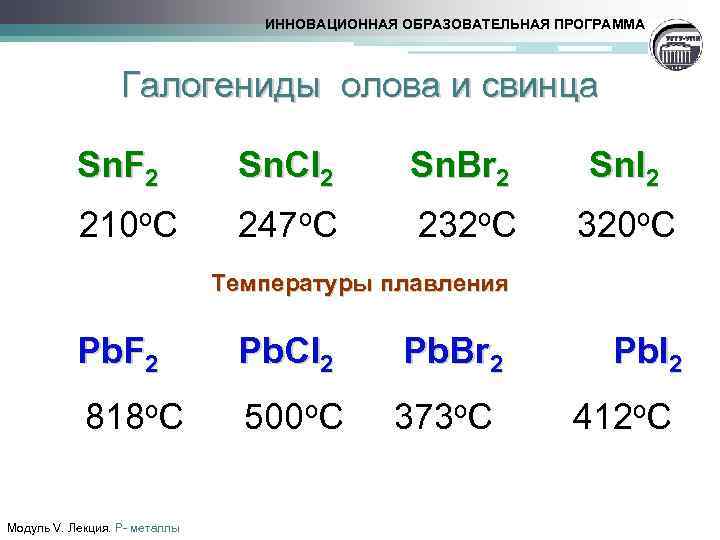
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Галогениды олова и свинца Sn. F 2 Sn. Cl 2 Sn. Br 2 Sn. I 2 210 о. С 247 о. С 232 о. С 320 о. С Температуры плавления Pb. F 2 Pb. Cl 2 Pb. Br 2 Pb. I 2 818 о. С 500 о. С 373 о. С 412 о. С Модуль V. Лекция. Р- металлы

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Олово и свинец малоактивные металлы: Ео (Sn 2+/ Sn) = – 0, 14 В; Ео (Pb 2+/ Pb) = – 0, 126 В Sn + H 2 SO 4 = Sn. SO 4 + H 2 Sn + 2 H 2 O+ 4 KOH = K 4[Sn(OH)6] + H 2 3 Pb +8 HNO 3 = 3 Pb(NO 3)2 +2 NO +2 H 2 O Модуль V. Лекция. Р- металлы

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Оксиды и гидроксиды Sn. O + 2 HCl = Sn. Cl 2 + H 2 O Pb. O + 2 HNO 3 = Pb(NO 3)2 + H 2 O Sn. O + 4 KOH + H 2 O = K 4[Sn(OH)6] Pb. O 2 + 4 HCl = Pb. Cl 2 + 2 H 2 O Pb 3 O 4 + 8 HCl = 3 Pb. Cl 2 + 4 H 2 O Pb 3 O 4 + 4 HNO 3 = 2 Pb(NO 3)2 + Pb. O 2 + 2 H 2 O Модуль V. Лекция. Р- металлы

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Сульфиды 2 Pb. S +3 O 2 = 2 Pb. O + 2 SO 2 Pb. S +2 O 2 = Pb. SO 4 3 Pb. S + 8 HNO 3 = 3 Pb(NO 3)2 + 2 NO + 3 S + 4 H 2 O Pb. S + 4 H 2 O 2 = Pb. SO 4 + 4 H 2 O Sn. Cl 4 +2 H 2 S = Sn. S 2 + 4 HCl Sn. S 2 + K 2 S = K 2[Sn. S 3] [Sn. S 3]2– + 2 H+ = Sn. S 2 + H 2 S Модуль V. Лекция. Р- металлы

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА ОВР соединений олова и свинца Соединения Pb(+4) являются сильными окислителями Pb. O 2 + 2 S = Pb. S + SO 2 3 Pb. O 2 + 4 H 2 S = 3 Pb. S + SO 2 + 4 H 2 O Pb. O 2 + Pb +2 H 2 SO 4 = 2 Pb. SO 4 + 2 H 2 O Соединения Sn(+2) являются хорошими восстановителями 2 Fe. Cl 3 + Sn. Cl 2 +2 HCl = 2 Fe. Cl 2 + H 2[Sn. Cl 6] 3 K 4[Sn(OH)6] + 2 Bi(NO 3)3 = 2 Bi + 3 K 4[Sn(OH)6] Модуль V. Лекция. Р- металлы

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Заключение § Устойчивая степень окисления у Al +3 § Для Sn и Pb характерны две степени окисления: +2 и +4. § Соединения Sn (+2) типичные восстановители. § Соединения Pb(+4) сильные окислители. § Оксиды и гидроксиды Sn и Pb в степенях окисления +2 и +4 – амфотерны. Sn(+2), Sn(+4) и Pb(+2) образуют растворимые прочные гидроксокоплексы: [Pb(OH)6]4–, [Sn(OH)6]2– § Оксид Pb. O является очень сильным окислителем. § Соединения Sn(+2) являются хорошими восстановителями. 2 Модуль V. Лекция. Р- металлы

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Рекомендуемая литература § § Никольский А. Б. , Суворов А. В. Химия. - СПб: Химиздат, 2001 § Карапетьянц М. Х. Общая и неорганическая химия. - М. : Химия, 2000 § Угай Я. А. Общая и неорганическая химия. - М. : Высш. шк. , 2007 § Неорганическая химия. В 3 т. Т. 1: Физико-химические основы неорганической химии. Под ред. Ю. Д. Третьякова. - М. : Академия, 2004 § Гаршин А. П. Неорганическая химия в схемах, рисунках, таблицах, формулах, химических реакциях. - СПб. : Лань, 2000 Степин Б. Д. , Цветков А. А. Неорганическая химия. - М. : Высш. шк. , 1994 Модуль V. Лекция. Р- металлы
139.ppt