Л3_Химическая_кинетика.ppt
- Количество слайдов: 22

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Лекция 3 ХИМИЧЕСКАЯ КИНЕТИКА

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Содержание § Общие понятия § Скорость реакций в гомогенных и гетерогенных системах § Энергия активации § Влияние различных факторов на скорость химических реакций q Влияние концентрации. Кинетические уравнения q Влияние давления q q Влияние температуры Влияние катализаторов Модуль I. Лекция 3. Химическая кинетика

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Основные понятия химической кинетики § Химическая кинетика изучает скорости и механизмы химических процессов, а также факторы, влияющие на них § Скорость реакции равна числу элементарных актов взаимодействия, происходящих за единицу времени в единице реакционного пространства § Элементарный акт - каждое непосредственное взаимодействие частиц, приводящее к изменению их химического строения § Элементарная стадия химического превращения - сумма всех однотипных элементарных актов § Механизм химической реакции ‑ совокупность элементарных стадий, из которых складывается данная реакция Модуль I. Лекция 3. Химическая кинетика

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Молекулярность реакции определяется числом молекул, одновременным взаимодействием между которыми осуществляется элементарный химический акт § Мономолекулярная реакция: N 2 O 5 = NO + NO 2 + O 2 § Бимолекулярная реакция: 2 Н = Н 2, § Тримолекулярная реакция: Cl 2 + 2 NO = 2 NOCl § Реакции с молекулярностью выше трех неизвестны Модуль I. Лекция 3. Химическая кинетика

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Скорость реакции в гомогенных системах – средняя скорость реакции в интервале времени , – изменение количества вещества, моль V – объем системы, л С – концентрация вещества, моль/л Модуль I. Лекция 3. Химическая кинетика
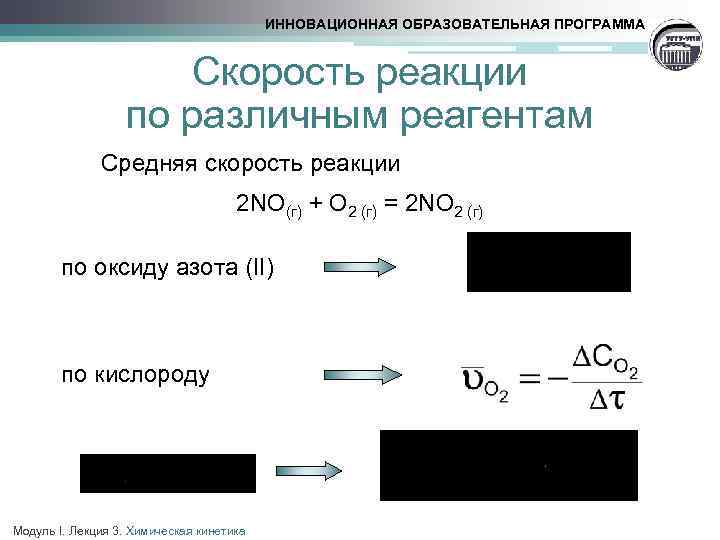
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Cкорость реакции по различным реагентам Средняя скорость реакции 2 NO(г) + O 2 (г) = 2 NO 2 (г) по оксиду азота (II) по кислороду Модуль I. Лекция 3. Химическая кинетика
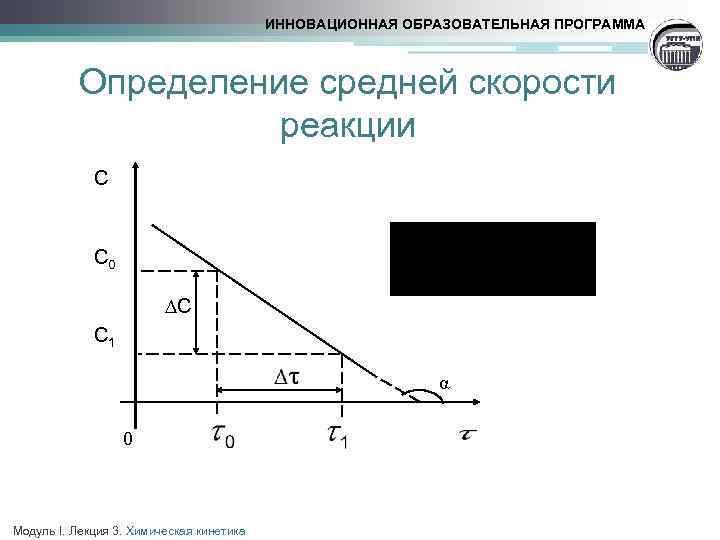
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Определение средней скорости реакции С С 0 ∆С С 1 0 Модуль I. Лекция 3. Химическая кинетика α
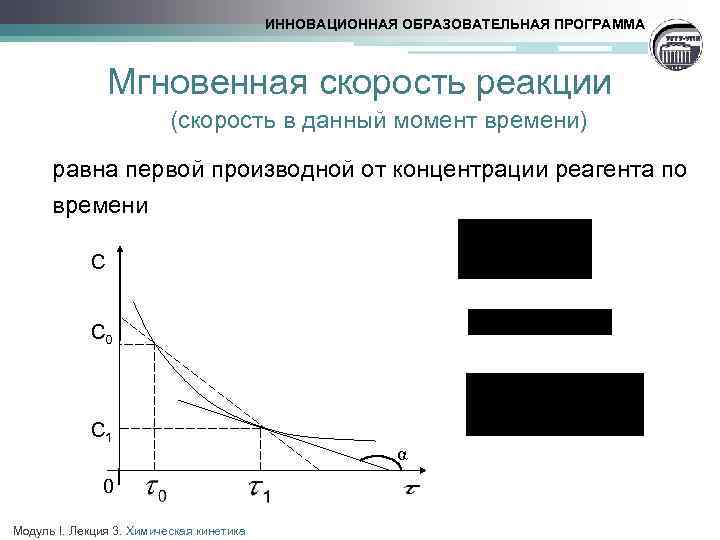
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Мгновенная скорость реакции (скорость в данный момент времени) равна первой производной от концентрации реагента по времени С С 0 С 1 0 Модуль I. Лекция 3. Химическая кинетика α

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Скорость реакции в гетерогенных системах В гетерогенной системе взаимодействие компонентов происходит на поверхности раздела фаз S - площадь поверхности раздела фаз, м 2 Размерность скорости реакции в гетерогенных системах Модуль I. Лекция 3. Химическая кинетика

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Энергия активации § Химическое взаимодействие осуществляется при столкновении частиц, которые обладают избытком энергии, достаточным для преодоления сил взаимного отталкивания их электронных оболочек § При эффективном соударении частицы переходят в неустойчивое промежуточное состояние нестабильный активированный комплекс, с более высоким уровнем энергии, чем средний уровень энергии частиц системы § Энергия активации (Еа) - минимальная избыточная энергия частиц по сравнению со средним уровнем, необходимая для протекания реакции Модуль I. Лекция 3. Химическая кинетика
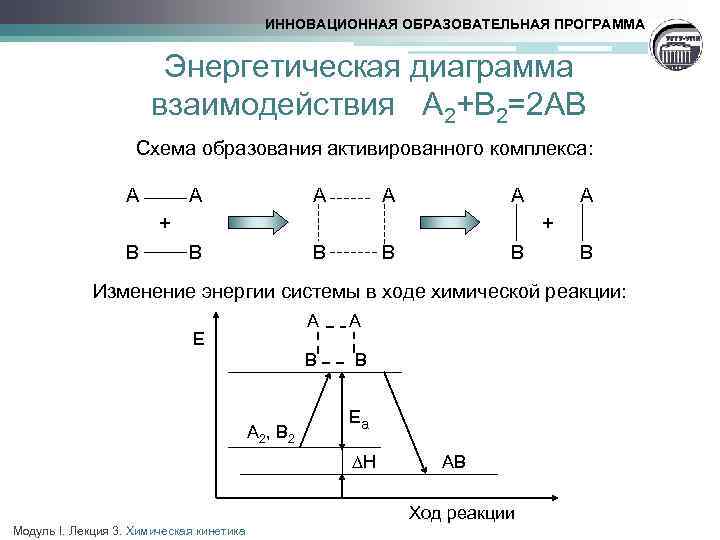
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Энергетическая диаграмма взаимодействия А 2+В 2=2 АВ Схема образования активированного комплекса: А А + В В Изменение энергии системы в ходе химической реакции: А Е В А В А 2, В 2 Еа ∆Н Модуль I. Лекция 3. Химическая кинетика АВ Ход реакции

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Влияние концентрации на скорость химической реакции § Закон действующих масс: скорость элементарной химической реакции пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам § § Элементарные реакции - реакции, протекающие в одну стадию § Кинетические уравнения элементарных реакций: Кинетическое уравнение - математическая зависимость скорости реакции от концентрации бимолекулярной A + B = C тримолекулярной 2 A + B = D k – константа скорости СА, СВ – концентрации веществ, моль/л Модуль I. Лекция 3. Химическая кинетика

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Порядок химической реакции § Показатели степени концентрации реагентов в кинетическом уравнении называют порядком реакции по каждому из реагентов Реакции A + b. B + c. C + … = e. E + f. F + … соответствует кинетическое уравнение где , , - порядок реакции по веществам А, В и С § Общий порядок реакции (или порядок реакции) определяется суммой показателей степени концентраций реагентов в кинетическом уравнении: + + 2 N 2 O = 2 N 2 + O 2 реакция нулевого порядка 2 N 2 O 5 = 4 NO 2 + O 2 реакция первого порядка H 2 + I 2 = 2 HI реакция второго порядка Модуль I. Лекция 3. Химическая кинетика

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Особенности гетерогенных реакций Стадии гетерогенных реакций : § подвод вещества к реакционной поверхности § химическое взаимодействие § отвод продукта реакции от поверхности Для реакции C + O 2 = CO 2 лимитирующая стадия - подвод вещества Скорость реакции Ca. CO 3 + 2 HCl = Ca. Cl 2 + H 2 O + CO 2 определяется скоростью химического взаимодействия I стадия: Ca. CO 3 + H+ = Ca 2+ + HCO 3‑ II стадия: HCO 3‑ + H+ = H 2 O + CO 2 I стадия лимитирующая Модуль I. Лекция 3. Химическая кинетика

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Влияние давления на скорость химической реакции Влияние давления существенно для реакций с участием газообразных веществ, так концентрация реагентов меняется пропорционально давлению (T = const) Пример. Реакции 2 NO(г) + 2 H 2(г) = N 2(г) + 2 Н 2 О(г) соответствует кинетическое уравнение При увеличении давления в 3 раза константа скорости не изменяется, а концентрации реагирующих веществ увеличиваются в 3 раза скорость увеличивается в 27 раз Модуль I. Лекция 3. Химическая кинетика

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Правило Вант-Гоффа При повышении температуры на каждые 100 скорость большинства реакций увеличивается в 2 4 раза: и ‑ скорость реакции при температурах Т 1 и Т 2 (Т 2 > Т 1) ‑ температурный коэффициент скорости, равный 2 4 Например, при повышении температуры с 20 до 400 С скорость реакции (γ = 2) увеличивается в 4 раза: Модуль I. Лекция 3. Химическая кинетика
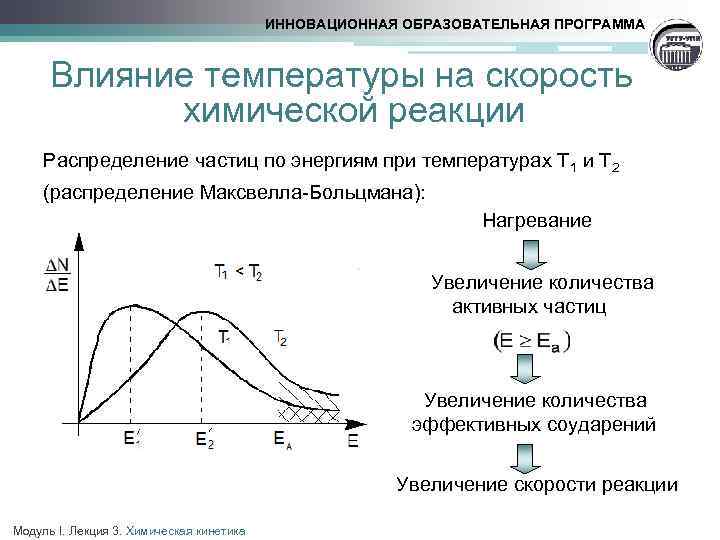
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Влияние температуры на скорость химической реакции Распределение частиц по энергиям при температурах Т 1 и Т 2 (распределение Максвелла-Больцмана): Нагревание Увеличение количества активных частиц Увеличение количества эффективных соударений Увеличение скорости реакции Модуль I. Лекция 3. Химическая кинетика

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Зависимость константы скорости от температуры Уравнение Аррениуса Еа ‑ энергия активации, к. Дж/моль R ‑ универсальная газовая постоянная, равная 8, 31∙ 10 -3 Т ‑ абсолютная температура, К А - коэффициент пропорциональности, отражающий вероятность столкновения активных частиц; величина постоянная для данной реакции Модуль I. Лекция 3. Химическая кинетика

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА § § § Влияние катализаторов на скорость химической реакции Катализаторы - вещества, увеличивающие скорость реакции и остающиеся в конце реакции химически неизменными Катализаторы применяют для изменения скорости термодинамически возможных процессов ( G<0) Ингибиторы - вещества, снижающие скорость реакции Промоторы – вещества, добавки которых к катализатору усиливают эффективность его действия Автокатализ – увеличение скорости реакции под действием одного из продуктов Выделяют гомогенный и гетерогенный катализ 2 SO 2(г) + О 2(г)= 2 SO 3(г) катализатор NO(г) - катализатор V 2 O 5(к) или Pt(к) гомогенный катализ гетерогенный катализ Модуль I. Лекция 3. Химическая кинетика
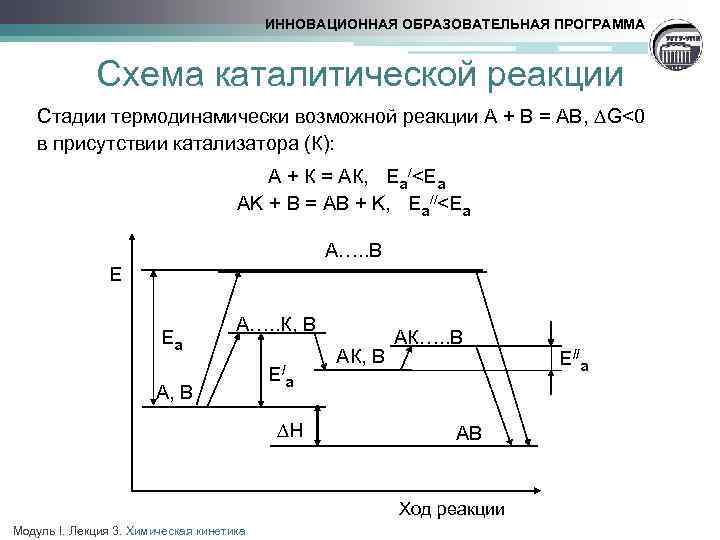
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Схема каталитической реакции Стадии термодинамически возможной реакции А + В = АВ, G<0 в присутствии катализатора (К): А + К = АК, Еа <Eа AK + B = AB + K, Еа <Eа А…. . В Е Еа А…. . К, В А, В Е/а ∆Н Модуль I. Лекция 3. Химическая кинетика АК…. . В АК, В АВ Ход реакции Е//а

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА § § Заключение Химическая кинетика изучает скорости и механизмы химических процессов, а также факторы, влияющие на них Скорость реакции ‑ изменение количества любого из реагирующих веществ или продуктов реакции за единицу времени в единице реакционного пространства Энергия активации ‑ минимальная избыточная энергия частиц по сравнению со средним уровнем, необходимая для протекания реакции Скорость реакции зависит от C, p, T и катализатора: – зависимость скорости от концентраций реагирующих веществ выражается экспериментально получаемым кинетическим уравнением; – изменение давления в системе приводит к пропорциональному изменению концентраций газообразных реагентов и соответствующему изменению скорости – в соответствии с правилом Вант-Гоффа при повышении температуры на каждые 10 о скорость большинства реакций увеличивается в 2 4 раза – катализаторы ‑ вещества, увеличивающие скорость реакции за счет снижения энергии активации Модуль I. Лекция 3. Химическая кинетика

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Рекомендуемая литература § § Никольский А. Б. , Суворов А. В. Химия. - СПб: Химиздат, 2001 § Карапетьянц М. Х. Общая и неорганическая химия. - М. : Химия, 2000 § Угай Я. А. Общая и неорганическая химия. - М. : Высш. шк. , 2007 § Неорганическая химия. В 3 т. Т. 1: Физико-химические основы неорганической химии. Под ред. Ю. Д. Третьякова. - М. : Академия, 2004 § Стромберг А. Г. , Семченко Д. П. Физическая химия. - М. : Высш. шк. , 2003 § Гаршин А. П. Неорганическая химия в схемах, рисунках, таблицах, формулах, химических реакциях. - СПб. : Лань, 2000 Степин Б. Д. , Цветков А. А. Неорганическая химия. - М. : Высш. шк. , 1994 Модуль I. Лекция 3. Химическая кинетика
Л3_Химическая_кинетика.ppt