Иммунология репродукции 2.ppt
- Количество слайдов: 109
Иммунология репродукции. Иммунопатогенез. Иммунодиагностика

Иммунология беременности Эмбрион и плод человека получают от отца 50% генетической информации, которая чужеродна для организма матери. Другая половина генетической информации плода является общей для организма плода и матери. Плод всегда является генетически полусовместимым трансплантатом по отношению к организму матери. Важнейшим фактором защиты плода является иммунологическая толерантность материнского организма к антигенам плода отцовского происхождения.
Плод - всегда генетически полусовместимый трансплантат по отношению к организму матери. Важную роль играет иммунологическая толерантность материнского организма к Аг отца.

Иммунология беременности Некоторые гормоны, продуцируемые уже на самых ранних сроках беременности (хорионический гонадотропин, плацентарный лактоген, прогестерон и эстрогены), обладают выраженными иммуносупрессивными свойствами. Большую роль в иммунной защите плода играет плацента. Иммунологические взаимоотношения системы «матьплод» являются физиологическим процессом, направленным на создание и обеспечение необходимых условий для нормального развития плода. Нарушение этого процесса нередко приводит к развитию патологии беременности (невынашивание, гестозы и др. ).

Эмбрион является потенциальным индуктором для развития выраженного иммунного ответа материнского организма в случае проникновения их в кровеносное русло матери. При попадании лимфоцитов матери в кровоток плода также развивается реакция со стороны эмбриона. В пупочном канатике находятся лимфоциты плода, разрушающие лимфоциты матери.

Роль матки Матка не является иммунологически привилегированным органом. Об этом свидетельствует: наличие хорошего кровотока, большие дренажные способности лимфатической системы и возможность развития иммунного ответа при попадании в орган патогенного агента.

Роль плаценты У здоровых женщин репродуктивного возраста в секреторную фазу цикла и на ранних сроках беременности в строме эндометрия встречаются БГЛ или NK (более 75% ИКК, обнаруживаемых в децидуальной оболочке матки во время имплантации). Фенотип NK децидуальной ткани не экспрессирует молекулу CD 16, а уровень экспрессии CD 64 и CDЗ 2 ничтожно мал. NK -клетки децидуальной оболочки являются активированными, о чём свидетельствует высокий уровень экспрессии молекулы семейства интегринов (VLA-1 или CD 49 а). Во второй фазе цикла NK-клетки подвергаются пролиферации и дифференцировке и принимают участие в наступлении менструации (при условии отсутствия в матке плодного яйца).

Роль плаценты • Плацента является иммуносорбентом антифетальных антител к HLA (иммуносорбционные свойства плаценты).

Защита плода трофобластом Материнскотрофобластический иммунологический баланс регулируется на уровне аллогенных взаимоотношений между материнскими клетками и внеэмбриональными тканями.

Особенности трофобласта Присутствуют рецепторы Fc. R к Ig G – участие в переносе материнских иммуноглобулинов в кровоток плода. Клетки трофобласта за счет поверхностных сиаловых кислот несут высокий отрицательный заряд – затруднение контакта с другими клетками, в том числе и с лимфоцитами. В синцитиотрофобласте и ворсинчатом цитотрофобласте почти полностью отсутствуют HLA I локусы А, В и HLA II (локус D), особенно отцовского происхождения.
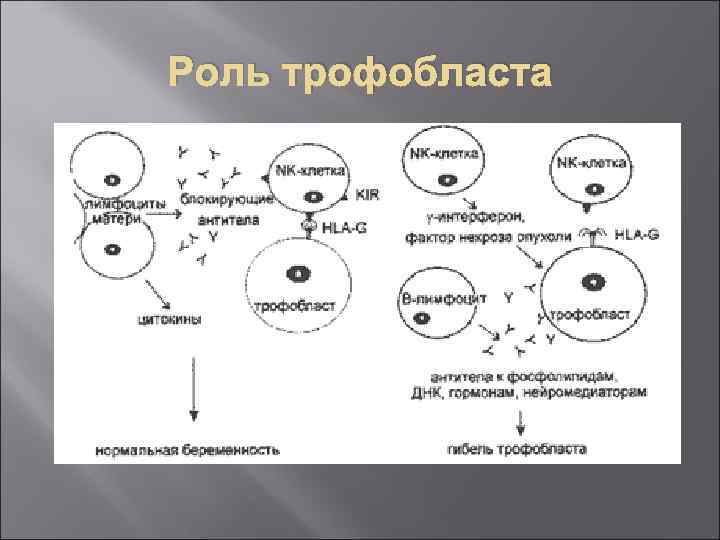
Роль трофобласта

Особенности трофобласта

Особенности трофобласта HLA-C молекулы характеризуются низким уровнем экспрессии бета-2 -микроглобулина и присутствуют на поверхности клетки только в форме тяжелых цепей. HLA I (локус G) включает 20 гомологичных генов, псевдогены и генные фрагменты. HLA-G антигены относятся к неклассическим HLA (класса Ib) и экспрессируются лишь на плацентарных тканях зародыша в зоне плодоматеринского взаимодействия. Экспрессия HLA-G "ассоциирована с беременностью".

Роль плаценты В процессе внедрения в децидуальную оболочку матки клетки трофобласта секретируют различные типы металлопротеаз, что обеспечивает разрушение матриксных белков эндометрия и проникновение трофобласта в глубжележащие слои. В ответ на это происходит локальное увеличение синтеза цитокинов (ТФР), а также тканевых ингибиторов металлопротеаз. К месту имплантации устремляются различные ИКК (NK-клетки, макрофаги и дендритные клетки), синтезирующие громадный спектр цитокинов, стимулируя дальнейшее внедрение трофобласта, или подавляя данный процесс.

Механизмы защиты трофобласта

Роль плаценты Во время имплантации клеток трофобласта происходит обмен сигналами между ними и ИКК. Рост, пролиферацию клеток трофобласта и процесс их проникновения в эндометрий контролируют NK децидуальной ткани. NK вырабатывают ТФР-β подавляющий активацию и пролиферацию цитотоксических клеток. Контакт клеток трофобласта с CD 3 - CD 16 - CD 56+клетками инициирует синтез большого количества ГМКСФ и некоторых других факторов роста, что является важным аутокринно-паракрииным механизмом регуляции роста и дифференцировки плаценты. Лимфоциты децидуальных оболочек выделяют ГМКСФ спонтанно или после стимуляции антигенами отца, представляемыми на клетках трофобласта.

Роль плаценты Взаимоотношения между CD 3 - CD 16 - CD 56+- клетками и клетками вневорсинного трофобласта способствуют дальнейшему продвижению трофобласта в эндометрий (в зоны спиральных артерий децидуальной оболочки). По мере продвижения они осуществляют ремоделирование данных артерий (перестройка эндотелия и пр. ), что создаёт условия для формирования плаценты и обеспечения адекватного кровоснабжения плода. Основу иммунологических механизмов невынашивания беременности могут составлять взаимоотношения между клетками трофобласта и киллерами, имеющими фенотип CD 3 - CD 16 - CD 56+. В пользу этой точки зрения свидетельствуют данные о селективном накопленни в эндометрии данного типа клеток у женщин с привычным невынашиванием беременности.

Роль плаценты В плаценте клетки трофобласта находятся в контакте с материнской кровью. Клетки вневорсинного трофобласта экспрессируют на своей поверхности молекулы НLA-C, -Е и -G системы МНС 1 класса, защищающие трофобласт от цитотоксического воздействия NК-клеток. NК-клетки атакуют только те клетки-мишени, которые не экспрессируют аутологичные молекулы МНС 1 класса. Более того, «классические» молекулы МНС 1 класса (НLАА и НLA-B) на поверхности трофобласта вообще не экспрессируются. NK-клетки экспрессируют все 3 типа лигандов к вышеназванным молекулам клеток трофобласта. Результатом подобных лиганд-рецепторных взаимодействий является подавление цитотоксичности в результате активации соответствующих лигандов на поверхности NK (КIR - killing inhibitory receptor).

Роль плаценты NK располагающиеся в месте имплантации, синтезируют большое количество провоспалительных цитокинов Тh 1 звена (ИЛ-15 и ИЛ-18), не нарушая обычного течения гестации. Моноциты, инфильтрирующие эндометрий во время беременности, синтезируют и секретируют ИЛ-12, способствующий ориентации иммунного ответа по Тh 1 зависимому пути. Повышение синтеза плацентой провоспалительных цитокинов ФНО-α и ИФН-γ увеличивает частоту прерываний беременности у мышей, а экзогенное введение ИЛ-1 О препятствует этому. У женщин с привычным невынашиванием беременности имеются лишь косвенные свидетельства наличия Тh 1/Тh 2 дисбаланса в данном процессе.
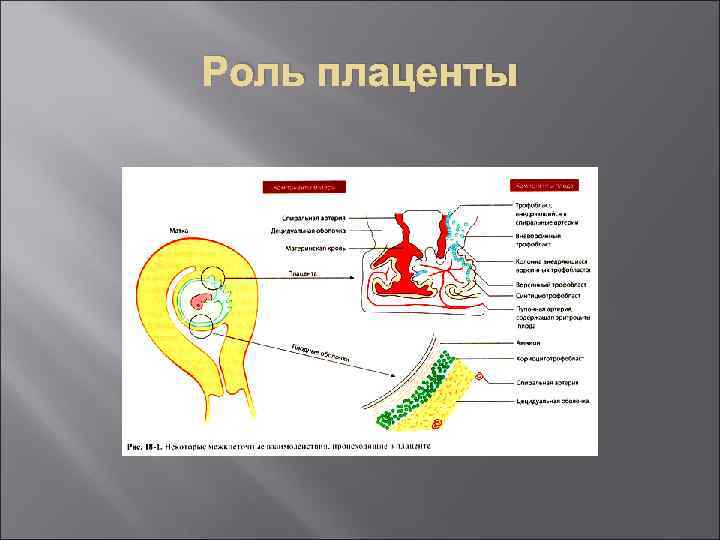
Роль плаценты

Роль плаценты

Прогестерон Прогестерон в высоких концентрациях миметирует глюкокортикоидные эффекты в силу низкоавидного связывания с рецепторами кортизола. Обладает противовоспалительными свойствами - Снижает образование кислородных радикалов макрофагами. - Подавляет продукцию ИЛ-1β, ИФ-γ лимфоцитами. - Снижает продукцию ИЛ-8 человеческими эндометриальными клетками. - Ингибирует продукцию ИЛ-6 децидуальными стромальными клетками человека в культуре. - Индуцирует синтез лимфоцитами иммуносупрессивного фактора (предотвращающего аборт). Прогестерон ингибирует ответ лимфоцитов на митогены и аллоантигены, способен продлевать время выживания трансплантата. Прогестерон имеет непрямое влияние на активность NК. Прогестерон-индуцированный блокирующий фактор (PIBF) (белок, который опосредует иммунологические эффекты прогестерона), блокирует активность NК in vitro и предотвращает выкидыш.

Эстрогены (эстрадиол, эстрон, эстриол) Эстрогены тормозят клеточный (Тh 1 -зависимый) и стимулируют гуморальный (Th 2 -зависимый) иммунный ответ. Уменьшают бласттрансформирующую способность Т-лимфоцитов Выявляется обратная корреляция между уровнем активности NК и концентрацией эстрадиола в плазме крови при беременности по мере ее прогрессирования. Избыток эстрогенов снижает устойчивость к опухолям и паразитам. Назначение эстрогена повышает активность Тхелперов (CD 4 клеток) и супрессирует активность CD 8 клеток. Эстрадиол ингибирует секрецию ФНО-α, ИЛ-1 и ИЛ-6, cтимулирующих клеточное звено.

Хорионический гонадотропин ХГ - основной гликопротеиновый гормон, секретируемый плацентой во время беременности. Высокие дозы ХГ (у овариоэктомированных самок животных) вызывают иммуносупрессию. Угнетает клеточный иммунный ответ. Снижает активность Т-лимфоцитов и ЕКК, угнетает синтез ИЛ-2. Снижает фагоцитарную активность моноцитов.

Механизмы блокады отцовских аллоантигенов. Слой Фибриноидного материала (толщиной 0, 1 -2 мкм), окружающий трофобласт. Состоит из мукополисахаридов (протеогликанов), в составе углеводного компонента которых присутствуют гиалуроновая и сиаловая кислоты. Фибриноид плаценты - конечный продукт трансформации растворимого в крови фибриногена в нерастворимый фибрин. Слой фибриноида, а также сиаломуцин и серомукоид частично маскируют антигены плода в трофобласте. Слой фибрина, отличный от фибриноидного слоя; находится между трофобластом и децидуальной тканью, появляется лишь на 10 неделе.

Антитела, иммунные комплексы Адсорбция антител к антигенам плода, играет ведущую роль в защите развивающегося плода против иммунного ответа матери на антигены фетоплацентарного комплекса. В-лимфоциты плаценты синтезируют преимущественно Ig G 1 - фетопротективный. При нормальной беременности превалирует гуморальный иммунитет, хотя продукция Ат варьирует от образования цитотоксических Ат Ig G 2 ( индуцированного клетками Th 1) до образования нецитотоксических Ат - Ig G 1 (индуцированного Th 2). Преобладание Th 1 -клеточного иммунного ответа связано с повышенным риском выкидыша.

Беременность и инфекции Инфекции, возникающие во время беременности, представляют серьёзную опасность как для матери, так и для плода. Из бактериальных инфекций при беременности чаще всего встречаются инфекции мочевыводящих путей, в ряде случаев протекающих в виде бессимптомной бактериурии. Чаще всего при посеве обнаруживают E. coli. К развитию инфекций мочевыводящих путей предрасполагают физиологические изменения во время беременности, обусловленные гормональными влияниями, а также расширение мочеточников и пузырно-мочеточниковый рефлюкс.

Беременность и инфекции У трети беременных с бессимптомной бактериурией в III триместре беременности развивается пиелонефрит. Беременность предрасполагает к развитию листериоза (возбудитель - Listeria monocytogenes). Заболевание чаще возникает в III триместре и по своей клинической картине напоминает инфекцию мочевыводящих путей. Для постановки правильного диагноза необходим посев крови, так как результаты посева мочи бывают отрицательными. Бактериальные инфекции околоплодных оболочек (хориоамниониты) несут большую опасность для плода и часто сопровождаются преждевременными родами.

Беременность и инфекции Заражение плодных оболочек обусловлено полимикробной флорой (E. coli, Gardnerella vaginalis, Мусорlasma spp. , и др. ) и чаще всего происходит восходящим путём при преждевременном излитии околоплодных вод. Развитие у ребёнка гонококковой инфекции может происходить как в результате его внутриутробного заражения, так и во время родов. Чаще всего гонококковая инфекция у новорождённых проявляется в форме конъюнктивита (бленнорея). Внутриутробное заражение сифилисом может произойти на любом сроке беременности, однако на сроке до 4 месяцев это случается редко. В отсутствие лечения возможно мёртворождение, а также врождённый сифилис (латентный).

Беременность и инфекции Особо опасны вирусные инфекции. Некоторые вирусы (цитомегаловирус, вирус простого герпеса, Varicella zoster, вирус краснухи) обладают тератогенным действием. Возможно заражение ребёнка в родах - при прохождении через инфицированные родовые пути. Особенно тяжёлые последствия для ребёнка возникают при инфицировании организма будущей матери вирусом краснухи (в I триместре беременности). Если мать заболевает краснухой в I триместре беременности, риск поражения плода достигает 80%, при заражении в конце II триместра - 25%. В I триместре беременности (на 4 - 5 неделе) происходит закладка органов и тканей плода. Последствиями внутриутробного инфицирования плода вирусом краснухи могут быть выкидыш или преждевременные роды, а также врождённые пороки сердца, глухота, катаракта и умственная отсталость ребёнка. Врождённую краснуху диагностируют путём определения специфических антител (Ig. M в крови плода). Инфицирование организма беременной женщины вирусом ветряной оспы может иметь тяжёлые последствия как для неё самой (ветряночная пневмония), так и для плода (пороки развития).

Беременность и инфекции Токсоплазмоз. Заражение происходит внутриутробно или во время родов. Риск самопроизвольного аборта максимален при заражении матери в I триместре беременности, риск врождённого токсоплазмоза - при заражении в III триместре. Особенностью данной инфекции является её бессимптомное течение. У больного ребёнка симптомы врождённого токсоплазмоза также могут отсутствовать и проявляться только в подростковом возрасте. Чаще всего развивается хориоретинит, встречаются случаи возникновения эпилептических припадков, психомоторной заторможенности и пр. Пороков развития не бывает. Повышение восприимчивости к инфицированию патогенами типа Listeria, Тохорlasma и др. косвенно свидетельствует о развитии в организме транзиторного Тh 1/Тh 2 дисбаланса в сторону преобладания Тh 2 -опосредованного пути иммунного ответа. Это повышает восприимчивость организма женщины к инфицированию внутриклеточными патогенами. Во время беременности целесообразно проведение оценки иммунного статуса. Особое значение имеет наличие у беременных антигенспецифичного иммунитета против возбудителей краснухи, кори, ветряной оспы и полиомиелита.
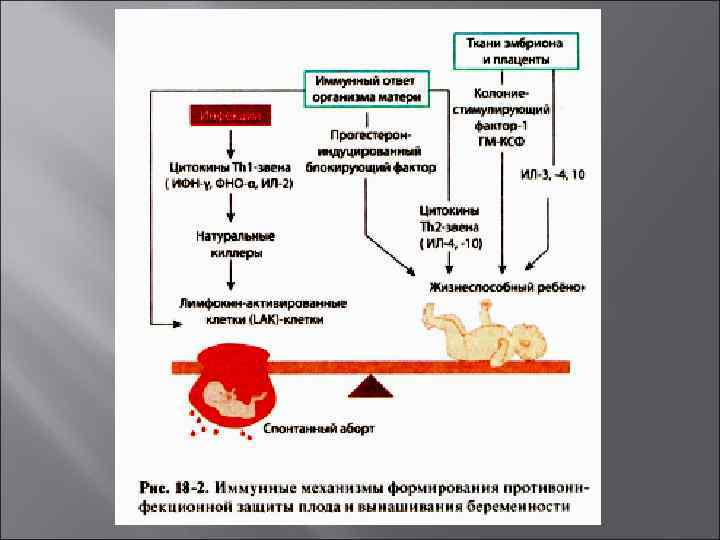

Невынашивание беременности Примерно в каждом пятом случае беременность заканчивается выкидышем. Причины невынашивания беременности: анатомические аномалии, гормональные нарушения, генетические дефекты, инфекции, аутоиммунные заболевания (СКВ или антифосфолипидный синдром), патология системы гемостаза. Роль иммунологических нарушений в невынашивании беременности невелика (не более 10%). Основным является срыв механизмов иммунологической толерантности организма матери по отношению к антигенам плода.

Невынашивание беременности Серологические исследования, должны быть направлены на диагностику состояний, способных привести к развитию данной патологии. К ним относят СКВ и антифосфолипидный синдром. Установлена роль аутоантител в патогенезе невынашивания беременности. К патогенетически значимым аутоантителам относят антитела к кардиолипину и антифосфолипидные антитела. Антифосфолипидные антитела (Ig. G и Ig. M) иногда выявляют в сыворотке у здоровых лиц (2 -7%).

Невынашивание беременности Выявлена корреляция между титром вышеуказанных аутоантител класса Ig. G в сыворотке и частотой развития самопроизвольных абортов у беременных, болеющих СКВ. Окончательные иммунопатогенетические механизмы действия антифосфолипидных антител к настоящему времени не изучены. Одним из основных проявлений их действия являются тромбозы. Поэтому беременным с высоким титром аутоантител показано проведение терапии, направленной на предупреждение развития тромбозов (ацетилсалициловая кислота, гепарин).

Возможные исходы беременности у больных СКВ Около 70% беременностей с СКВ заканчиваются рождением жизнеспособного плода и не ухудшают прогноз заболевания матери. К факторам риска неблагоприятного течения и исхода беременности относят высокую активность волчаночного процесса при зачатии и в период гестации, наличие поражения почек, гипертензии и вторичного антифосфолипидного синдрома у беременной. Из иммунологических предикторов осложнений выделяют позитивность по антифосфолипидным антителам. Присутствие Ro/SSA или La/SSB антител, гипокомплементемию. Внутриутробная гибель плода обычно происходит у беременных с высоким уровнем антифосфолипидных антител.

Возможные исходы беременности у больных СКВ Кроме преждевременных родов, спонтанных абортов и антенатальной гибели плода неблагоприятным исходом для новорождённого может явиться неонатальная волчанка (1 -2%). Она обусловлена трансплацентарным переносом материнских Ro/SSA или La/SSB антител.

Возможные исходы беременности у больных СКВ Культивирование плацентарной ткани с добавлением сыворотки беременных женщин с антифосфолипидным синдромом или СКВ инициирует снижение скорости пролиферации трофобласта и запускает в нём процесс апоптоза. Проведение адекватной терапии СКВ способствует вынашиванию беременности. В ряде случаев развитие беременности приводит к изменению течения самого аутоиммунного заболевания у будущей матери. Описанные выше закономерности можно проследить и при других аутоиммунных заболеваниях соединительной ткани.


Преэклампсия Развитие преэклампсии характеризуется нарушением плацентарного кровотока и развивающейся гипоксией плода. Нарушение плацентарного кровотока является следствием нарушения процессов и имплантации и ремоделирования сосудов, что приводит к последующей гипоксии плода. Клинические симптомы преэклампсии (протеинурия, отёки и артериальная гипертензия) обусловлены массивным повреждением эндотелия сосудов матери и развитием системного воспалительного процесса сосудистой стенки. Это происходит в результате высвобождения из ишемизированной плаценты большого количества биологически активных веществ и метаболитов и их последующего поступления в системный кровоток. К факторам, способным вызвать нарушение васкуляризации плаценты, относят цитокины, продуцируемые самой плацентой, факторы роста и ингибиторы металлопротеаз.

Преэклампсия Преэклампсия обычно развивается во время первой беременности, повторная беременность сопровождается меньшим риском развития данного состояния. Это обусловлено предварительной сенсибилизацией организма матери к антигенам системы НLA экспрессированным на поверхности клеток трофобласта во время предыдущей беременности. Во время повторной беременности происходит кооперация уже обученных децидуальных NК-клеток (СDЗ-СD 16 -СD 56+-клеток) с клетками трофобласта, экспрессирующими аналогичные молекулы НLA-C, НLA-E и НLA-G системы МНС I класса. Это обеспечивает лучшую имплантацию, уменьшает вероятность развития ишемии плаценты и преэклампсии. Подобная закономерность справедлива, если клетки трофобласта во время первой и второй беременности экспрессируют идентичные молекулы НLA-C, НLA-E и НLA-G системы МНС I класса. Это возможно в том случае, если отец первого и второго ребёнка - одно и то же лицо.

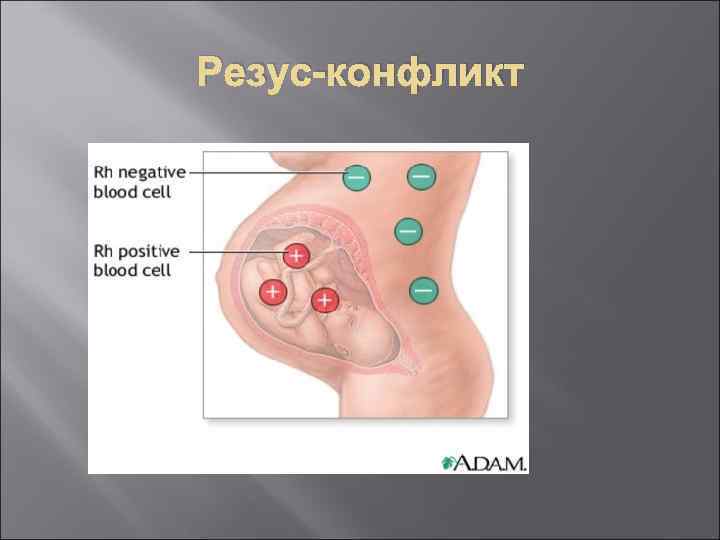
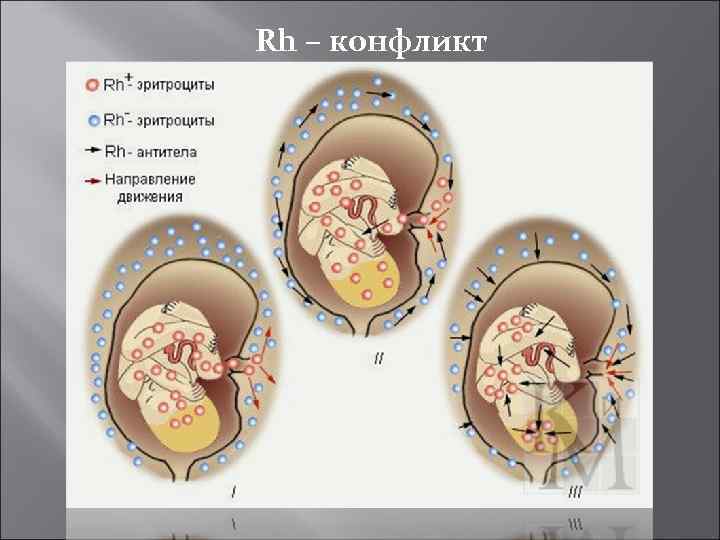
Аллоиммунизация (сенсибилизация) организма будущей матери к антигенам плода происходит только в том случае, если фетальные эритроциты попадают с системный кровоток организма матери. Образующиеся в организме матери антитела в дальнейшем проходят через плацентарный барьер и взаимодействуют с эритроцитами плода. Опсонизированные материнскими антителами эритроциты подвергаются фагоцитозу в селезёнке и печени плода, приводя к развитию гемолитической болезни новорождённых. Наиболее типичной причиной гемолитической болезни новорождённых является резус-конфликт между организмом матери и плодом, причём будущая мать должна быть Rh-негативной, а плод -Rh-позитивным.

Аллоиммунизация Основным Rh-антигеном, определяющим развитие иммунологического конфликта между организмом матери и плодом, является D-антиген. Развитие иммунологического конфликта, основанного на несовместимости Rh-антигенов можно предотвратить путём введения специфического анти- D иммуноглобулина во время беременности и сразу после её разрешения. Препарат разрушает фетальные эритроциты в организме матери и препятствует, тем самым, образованию к ним антител. Это, в свою очередь, создаёт предпосылки для нормального течения беременности. Гемолитическая болезнь новорождённых может являться следствием несовместимости по антигенам группы крови (АВО-несовместимость).
Резус-конфликт
Rh – конфликт

АВО - несовместимость АГ эритроцитов А и В способны также вызвать выраженный иммунный ответ. Факторы, предрасполагающие к развитию АВО несовместимости: Первая беременность (30 % случаев). Иммунизация по системе АВО наиболее часто развивается при первых беременностях, а анти-Dсенсибилизация - при 3 -4 -ой беременности; Rh совместимая беременность (Rh+ группа крови матери и плода); Группа крови I(О).

Аллоиммунизация фетальными тромбоцитами инициирует образование в организме матери антитромбоцитарных антител, ответственных за развитие аллоиммунной неонатальной тромбоцитопенической пурпуры. Заболевание встречается редко (1: 1000 новорождённых). Это связано с тем, что основным антигеном, инициирующим образование антитромбоцитарных антител, является антиген НРА 1 а, который экспрессируется на поверхности тромбоцитов у подавляющего числа людей и поэтому не инициирует образование антитромбоцитарных антител.

Аллоиммунизация Аллоиммунную неонатальную тромбоцитопеническую пурпуру следует отличать от идиопатической тромбоцитопенической пурпуры, при которой в организме матери появляются аутоантитела к собственным тромбоцитам. В организме матери нередко можно обнаружить антитела к антигенам гистосовместимости плода. Титр антител после первой беременности крайне низок, но может увеличиваться при развитии повторной и последующих беременностей. Данные аутоантитела относятся к классу G, поэтому могут проходить через плацентарный барьер. Отрицательные последствия для плода в результате действия данных антител не известны.

Органоспецифичные аутоиммунные заболевания при беременности Развитие органоспецифичных аутоиммунных заболеваний во время беременности может затрагивать как организм матери, так и организм плода. Подобные заболевания могут быть следствием синтеза аутоантител класса G, которые циркулируют в крови и могут преодолевать плацентарный барьер. Примером такого заболевания является миастения гравис, развивающаяся как у матери, так и у 10% детей, рождённых от страдающих данным заболеванием матерей.

Органоспецифичные аутоиммунные заболевания при беременности

Органоспецифичные аутоиммунные заболевания при беременности Идиопатическая тромбоцитопеническая пурпура развивается в организме матери вследствие синтеза антител к собственным тромбоцитам. Это достаточно редкое заболевание, которое способно при вести к невынашиванию беременности. Антитромбоцитарные антитела могут проникать через плацентарный барьер и вызывать неонатальную тромбоцитопению новорождённых (до 50% случаев). Наличие антител свидетельствует об аутоиммунной идиопатической тромбоцитопении, в то время как обнаружение антител исключительно на поверхности тромбоцитов ребенка - об аллоиммунной неонатальной тромбоцитопении. Аналогичные механизмы могут обуславливать развитие нейтропении, являющейся следствием выработки антинейтрофильных аутоантител.

Антитела к гормонам Образующиеся в организме аутоантитела к гормонам, играющим роль в процессах имплантации и вынашивания беременности, могут повлиять на её течение. С иммунологической точки зрения весьма привлекательным является создание так называемых «контрацептивных вакцин» , способных инициировать в организме будущей матери развитие антител к гормональным факторам, регулирующим процессы имплантации и вынашивания беременности. действительно, если в результате иммунизации к данным гормонам удастся получить нейтрализующие аутоантитела в достаточном титре, перспективы для создания вышеназванных вакцин будут выглядеть вполне реальными.

Антитела к гормонам В отличие от противоопухолевых вакцин, целью которых является усиление клеточного противоопухолевого иммунитета, в создании контрацептивных вакцин основной целью является стимуляция гуморального звена иммунной системы с целью синтеза нейтрализующих антител. К настоящему времени проходят испытания некоторых контрацептивных вакцин. Например, положительно завершилась 2 стадия клинических испытаний по оценке эффективности вакцины, направленной на синтез антител к гонадотропному гормону. Проводили испытания (на обезьянах-самцах) вакцины, инициирующей синтез антител к фолликулостимулирующему гормону. Низкая иммуногенность вакцины и её низкая способность вызывать аспермию.


Некоторые случаи бесплодия невыясненного генеза и привычного невынашивания связаны с отсутствием продукции LIF (Leukemia Inhibitory Factor) эндометрием или его количественным дефицитом. Экпрессия Fas-лиганда на трофобластах. При взаимодействии с цитотоксическими лимфоцитами или NK идет запуск программы апоптоза лимфоцита.
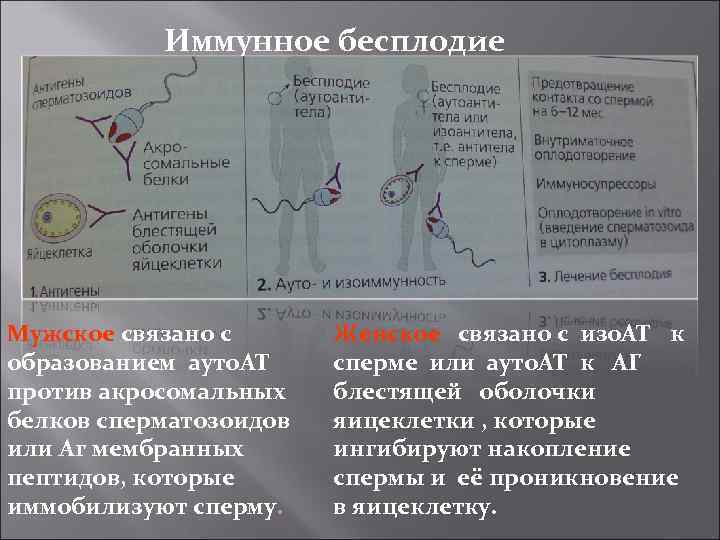
Иммунное бесплодие Мужское связано с образованием ауто. АТ против акросомальных белков сперматозоидов или Аг мембранных пептидов, которые иммобилизуют сперму. Женское связано с изо. АТ к сперме или ауто. АТ к АГ блестящей оболочки яицеклетки , которые ингибируют накопление спермы и её проникновение в яицеклетку.

Причины мужского бесплодия Антитела выявляются у 15 % бесплодных мужчин. Антиспермальные Ig. G, Ig M, Ig А могут нарушать функциональную активность сперматозоидов (обездвиживать или приводить к их гибели), препятствовать проникновению в полость матки. Нарушение механизмов иммуносупрессии; Нарушение гематотестикулярного барьера (семенники – забарьерный орган); Некоторые инфекции – простатит, мембранные бактериальные Аг , действие перекрестно реагирующих Аг.

Антиспермальные антитела • Антиспермальные антитела - антитела к антигенам мембраны сперматозоидов. В настоящее время антиспермальные антитела (чаще всего Ig. G, реже Ig. А или Ig. M) выявляют в сыворотке крови, цервикальной слизи, семенной жидкости, на поверхности сперматозоидов. • Антиспермальные антитела обнаруживают у некоторых здоровых мужчин (не более 10%), у мужчин с бесплодием (до 30%), а также у бесплодных женщин. • В физиологических условиях образованию антиспермальных антител в разных отделах мужской репродуктинной системы препятствуют различные механизмы. К таковым относят:

Антиспермальные антитела гематотестикулярный барьер (изолирует клетки сперматогенеза от иммунокомпетентных клеток организма); способность сперматозоидов к мимикрии ( «сбрасывают» с оболочки ранее сорбированные антигены и адсорбируют новые, в том числе и из женского репродуктивного тракта); иммуносупрессивный фактор спермоплазмы, секретируемый в придаточных железах мужской репродуктивной системы. Сбой механизмов защиты на любом из вышеуказанных уровней приводит к синтезу у мужчины антиспермальных антител.

Антиспермальные антитела Попадание спермы в женские половые пути может инициировать развитие иммунного ответа и приводить к синтезу антиспермальных антител. В большинстве случаев этого не происходит. Этому также препятствуют различные механизмы: повышение уровня клеток с супрессорной активностью в период овуляции; уменьшение концентрации иммуноглобулинов и С 3 компонента системы комплемента; мимикрия сперматозоидов и иммуносупрессивный фактор спермоплазмы. Вопрос о способности антиспермальных антител влиять на качество эякулята до настоящего времени является предметом дискуссий. Некоторые исследователи считают, что данные антитела вызывают снижение подвижности и жизнеспособности сперматозоидов, нарушая целостность их мембраны.

Антиспермальные антитела могут оказывать повреждающее действие на функцию предстательной железы. Тем не менее, обнаружение данных антител у здоровых мужчин ставит под сомнение данную точку зрения. другие исследователи считают, что если антиспермальные антитела и играют какую-либо патологическую роль (приводя к нарушению фертильности), то это происходит исключительно в организме женщины. Антиспермальные антитела классов Ig. G и Ig. A в цервикальной слизи и других жидкостях женского репродуктивного тракта препятствуют продвижению сперматозоидов и их пенетрации через цервикальную слизь, блокируют рецепторные участки на головке сперматозоида, ответствеиные за связывание с оболочкой яйцеклетки.

Причины женского бесплодия Заболевания половой сферы (активация иммунного ответа на инфицирующие агенты); Увеличение пропорции Т-хелперов (CD 4+) в биоптате эндометрия (в процессе беременности), приводящее к патологическому состоянию эндометрия. Антифосфолипидный синдром (АФС). С бесплодием коррелируют титры антител более 1: 16.
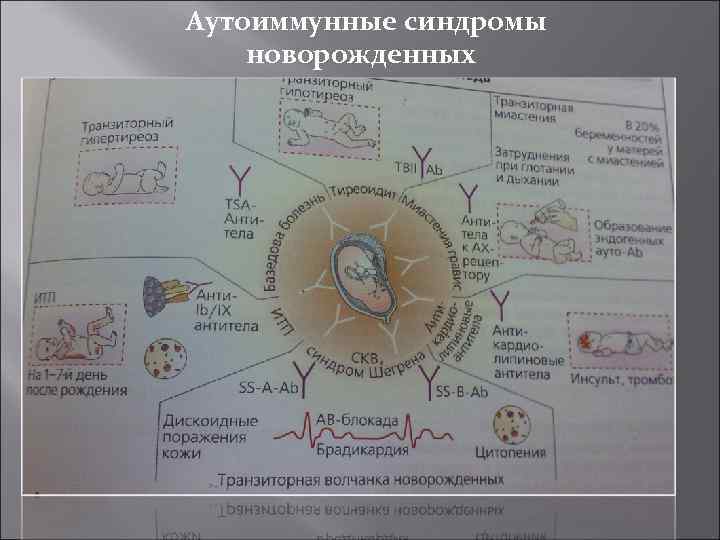
Аутоиммунные синдромы новорожденных
В течение беременности лейкоциты в крови определяют несколько раз. Время первого анализа наступает, когда производится постановка на учет при беременности. Мазок должен дать подтверждение, что лейкоцитов – в норме по количеству; Нормальным в случае беременности показателем признаны 15 -20 лейкоцитов; Когда количество лейкоцитов повышено в мазке – имеет смысл обеспокоиться, так как это сигнал об инфекции, например кольпит; Чем выше степень наличия лейкоцитов в мазке, тем тревожнее признак воспаление. Нужно помнить, что мазок может дать только сведения о наличии инфекции. Его причины – разнообразны, и выявить их не так легко. Диагноз уточняется проведением дополнительных исследований. Применяются определенные разновидности исследований, например – на посевы, иммунологические, ПЦР.

ВОЗРАСТНАЯ ИММУНОЛОГИЯ. ОСОБЕННОСТИ ФУНКЦИОНИРОВАНИЯ ИС В ДЕТСКОМ И ПОЖИЛОМ ВОЗРАСТЕТ. А. профессор Бажукова зав. каф. микробиологии, вирусологии и иммунологии

Иммунологическая реактивность у детей Процесс закладки иммунной системы Реализация ее потенциальных возможностей в развертывании специфических реакций Реализация ее потенциальных возможностей в достижении зрелости

Иммунологическая реактивность у детей Созревание иммунной реактивности плода Иммунный статус детей после рождения

Иммунная реактивность плода Закладка тимуса на 2 месяце внутриутробного развития в области 3 -4 жаберного кармана 6 нед. - имеет эпителиальный характер 7 -8 нед. – «заселение» лимфоцитоподобными клетками Конец 3 мес. – формирование тимуса

Иммунная реактивность плода Лимфатические узлы и другие периферические образования закладываются на 4 месяце. Окончательное формирование в постнатальном периоде Лимфоидные фолликулы подвздошной кишки, аппендикса и пейеровых бляшек содержат «клетки предшественники» плазматических клеток. Они дозревают до плазматических клеток синтезирующих Ig. A к 14 -16 неделе.

Иммунная реактивность плода Стволовые клетки – 3 -8 нед. Эмбриогенеза обнаруживаются в печени, кровяных островках желточного мешка. Позднее продуцируются в костном мозге. Лимфоциты – 9 нед. в тимусе 12 -15 нед. в селезенке 8 -10 нед. в периферической крови Т- лимфоциты (CD 3+) -10 -11 неделе В- лимфоциты (CD 19+) – 10 -12 нед. в печени, с 12 нед. в селезенке

Иммунная реактивность плода Синтез и секреция иммуноглобулинов : Ig. M – 11 нед (1/10 материнские) Ig. G - 22 нед Система комплемента: 8 нед – С 2 и С 4 – макрофаги; С 5 и С 4 - печень, легкие и перитонеальные клетки; С 1 и С 3 – толстый и тонкий кишечник 18 нед – данные компоненты появляются в сыворотке крови плода Неспецифические факторы защиты формируются на ранних стадиях онтогенеза.

Иммунная реактивность плода «Работа» иммунной системы: 13 нед –способность к отторжению трансплантата Супрессия функции гуморального иммунного ответа (Ат мало) – хорионический гонадотропин, α-фетопротеин, α-2 -глобулин. Ограничено взаимодействие ИКК. (ВУИ – преждевременная активация)



Иммунная реактивность плода Особенности ИС плода Толерантность собственной ИС Пассивный гуморальный иммунитет (Ig. G матери) Несовершенство системы комплемента (30 -50% от показателей взрослых) Система местного иммунитета в раннем и позднем онтогенезе не развита

Иммунный статус детей после рождения Иммунный статус здорового доношенного ребенка, рожденного здоровой матерью Своеобразный пассивный иммунитет новорожденного (Ig. G матери, недостаток Ig. М – риск развития конфликта по изоантигенам и противоинфекционной защите от ГОБ) Физиологический лейкоцитоз - 12 -15 х109 кл/л Лимфоциты - 35%: Т-лимфоциты – низкий % при высоком абсолютном содержании (ТCD 3+ - 60% (ТCD 4+) и 15% (ТCD 8+) Снижено содержание антителозависимых киллеров Недостаточные функции Т-лимфоцитов (РБТЛ на ФГА в норме или снижена, высокий уровень метаболизма по интенсивности синтеза НК)


Иммунный статус детей после рождения Иммунный статус здорового доношенного ребенка, рожденного здоровой матерью Увеличение численности В-CD 19+ клеток (рецепторы Ig. М и Ig. Е) Обнаружены Ig. G и Ig. М; Ig. А и Ig. Е –редко выявляются Ig. М нарастают к 2 -3 неделе жизни ребенка и снижаются к 1 мес и затем медленно возрастают достигая к 6 -12 мес уровня взрослых Ig. G возрастают к 7 -8 годам (на искусственном вскармливании быстрее) Ig. А отсутствуют в 1 -ый месяц жизни ребенка, медленно нарастают и к 1 году составляют 28% уровня взрослых. Нормализация к 8 -15 годам. Ig. Е отсутствуют у новорожденных, постепенно нарастают и достигают нормы к 11 -12 годам. Ускорение их накопления свидетельствует об аллергизации. Ig. D не определяются у новорожденных, появляются на 6 неделе жизни ребенка и достигают нормы к 5 -10 -15 годам.

Иммунный статус детей после рождения Содержание иммуноглобулинов определяется суммой Ат различной специфичности: Первыми появляются Ат к вирусам и бактериофагам, Н-Аг ГОБ микроорганизмов кожи, позднее – на О-Аг ГОБ. Большое влияние на синтез Ат оказывает нормальная микрофлора ребенка. Ат-образование идет по первичному типу, требуется большое количество Аг. Замедлено переключение синтеза с Ig. М на Ig. G (5 -20 д у взрослых и 20 -40 д у детей).

Иммунный статус детей после рождения Неспецифические факторы защиты: Хемотаксис и функциональная активность фагоцитов снижены Снижена переваривающая способность гранулоцитов за счет незрелости лизосомальных ферментов Снижены уровни комплемента и пропердина Значительно повышена активность лизоцима и его содержание в слюне (до 200 мкг/мл) выше чем в сыворотке. Наибольшее – 1 год, к 6 годам снижается в 3 раза, к 7 -15 годам возрастает но не достигает первоначальных величин.

Иммунный статус детей после рождения Местный иммунитет Ig. А – защита от инфекций s. Ig. А начинает обнаруживаться на 1 -2 неделе жизни ребенка, в копрофильтрате с 3 недели Пополняется за счет молозива и грудного молока, после 3 -5 дней лактации снижается выработка но постоянно пополняется при увеличении употребления грудного молока Плазматические клетки слизистых синтезируют все классы иммуноглобулинов. (стенка кишечника синтезирует до 3 г иммуноглобулинов в сутки) Местный иммунитет формируется 1 -12 годам жизни ребенка.

Иммунный статус детей после рождения Местный иммунитет обеспечивается и клеточными факторами: Альвеолярные макрофаги нарастают через 24 часа после рождения и стабилизируется к 1 мес. Микробицидные свойства макрофагов и др. фагоцитов отстают в первые недели и месяцы жизни ребенка

Иммунный статус детей после рождения ИС в первые годы жизни динамична После рождения снижается число лейкоцитов, повышается % содержание лимфоцитов и снижаются гранулоциты (перекрест этих показателей на 5 сутки), аналогичный перекрест снижение Лф и повышение нейтрофилов (в 4 -5 лет) Медленно повышается содержание Т-лимфоцитов В-лимфоциты снижаются до нормы.

Иммунный статус детей после рождения Особенности ИС новорожденного: Доминирует материнский пассивный иммунитет Отмечается синтез собственных Ат

Иммунный статус детей после рождения В 6 -12 месяцев созревает иммунная реактивность (организм ребенка до 1 года плохо защищен от инфекционных агентов. Недостаток клеточного ответа) В 1 -3 года включается полноценный Т-клеточный иммунитет (полностью начинает работать иногда только к периоду полового созревания) К 3 -4 годам созревает плазмоцитарная реакция Учитывая характер становления ИС необходимо с осторожностью назначать иммунотропные препараты в эти возрастные группы, чтобы не извратить естественный ход развития ИС. «Медленно стартующие дети» у них в воспалительный процесс могут вовлекаться печень и селезенка и другие органы РЭС

Критические периоды развития ИС 8 -12 нед внутриутробного развития – стартует дифференцировка органов и клеток ИС I. Период новорожденности – огромное число Аг поступает после рождения ребенка: супрессорное влияние пассивного материнского иммунитета; функциональный дисбаланс CD 3+ (T) лимфоцитов; супрессорная функция незрелых тимоцитов и CD 8+ клеток II. 3 -6 месяцев – ослабление пассивного иммунитета; супрессорная направленность сохраняется; первичный иммунный ответ на Аг без формирования иммунологической памяти; такой ответ при вакцинации в этот период

Критические периоды развития ИС III. 1 -ый год жизни – сохраняется первичный характер иммунного ответа на многие Аг; возможно переключение классов иммуноглобулинов с Ig. М на Ig. G, запаздывает образование субклассов Ig. G 2 и Ig. G 4; супрессорная направленность иммунного ответа сменяется хелперной; система местного иммунитета не развита, дети чувствительны к ОРВИ IV. 4 -6 годы жизни – средняя концентрация Ig. М и Ig. G соответствует таковой у взрослых; Ig. А не достигает нормы; содержание Ig. Е доходит до максимальных величин; высока частота атопических, паразитарных и иммунокомплексных заболеваний.

Критические периоды развития ИС V. Подростковый возраст (девочки 12 -13 лет, мальчики 14 -15 лет) – пубертатный скачек роста сочетается с уменьшением массы лимфоидных органов; повышение секреции половых гормонов (андрогенов) ведет к подавлению клеточного звена иммунитета и стимуляции гормональных механизмов.

Особенности ИС у детей Т-звено иммунитета При рождении лимфоциты - 3 -9 х109 кл/л (2430%); к 4 -5 суткам 2, 5 -10 х109 кл/л (40 -50%) Высокий метаболизм у новорожденных (увеличен синтез ДНК и РНК) БТЛ выражена хорошо как у доношенных так и у недоношенных Высокий уровень спонтанной трансформации (610% тогда как у взрослых 0, 2%)

Особенности ИС у детей В-звено иммунитета Начинает активно функционировать при Аг раздражении Ig. G – при рождении их уровень выше чем у матери, ко 2 -3 -й неделе снижается и достигает максимальной концентрации к 1 -4 мес Ig. М – в минимальных количествах при рождении (<0, 2 г/л), к 1 неделе возрастает Ig. А – отсутствует при рождении или следовые концентрации, возрастает к 1 нед.

Особенности ИС у детей Фагоцитарное звено Нейтрофилы при рождении 4, 5 -20 х109 кл/л (5070%); к 4 дню снижается до 2, 5 -6 х109 кл/л (30 -40%), поглотительная активность в норме а переваривающая снижена (незавершенный фагоцитоз), низкий фагоцитарный резерв клеток Моноциты в течение всего периода новорожденности 0, 6 -2 х109 кл/л (4 -9%), низкая бактерицидная активность и недостаточная миграционная способность

Иммунная реактивность при климаксе Гиперреактивность иммунных реакций по отношению к компонентам яичников. Снижение функции CD 8 -клеток при умеренной активации В-лимфоцитов за счет гиперпродукции Ig. G. Изменения иммунного статуса у обоих полов в возрасте до 50 лет проявляются снижением «цензорной функции иммунитета» , увеличение риска развития инфекций, аутоиммунных и онкологических заболеваний.

Иммунная реактивность при старении Как в России, так и во всем мире проблемы старения становятся все более актуальными и в медицинском, и в социальном аспектах: по данным ВОЗ число лиц пожилого и старческого возраста за последние десятки лет увеличилось в 2 раза. Связь широкого круга возрастных патологических процессов с дефектами иммунной системы привела к предположению, что старение ее может ограничивать продолжительность жизни. Вместе с тем одной из основных причин старения считают нарушения в функционировании иммунной системы как в целом, так и в отдельных ее звеньях. С нарушениями работы именно иммунной системы ассоциируются многие заболевания пожилого и старческого возраста, к которым прежде всего относятся аутоиммунные заболевания, опухоли, болезни суставов, почек, амилоидоз, патология сердечнососудистой системы, инфекционные заболевания.

Иммунная реактивность при старении С нарушениями работы иммунной системы ассоциируются многие заболевания пожилого и старческого возраста, к которым прежде всего относятся аутоиммунные заболевания, опухоли, болезни суставов, почек, амилоидоз, патология сердечно-сосудистой системы, инфекционные заболевания Дегенерация и гибель клеток – нервной ткани (старческое слабоумие, болезнь Паркинсона).

Иммунная реактивность при старении Накоплены данные об участии генов системы гистосовместимости в регуляции иммунореактивности и об их связи с патологией. Набор антигенов каждой особи строго индивидуален, фенотип человека определяет особенности функционирования многих органов и систем, и в целом общеповеденческую реакцию при взаимодействии с окружающей средой. Выявлена связь комплекса гистосовместимости с чувствительностью к вирусным инфекциям, опухолям и аутоиммуным заболеваниям.

Иммунная реактивность при старении Интерес представляет связь комплекса гистосовместимости HLA c рядом патологических состояний, из которых можно выделить следующие группы: артропатии, связанные с HLA-В 27 (анкилозирующий спондиллит, реактивный артрит и острый передний увеит); иммунопатии, связанные с HLA-В 8 и DR 3 (ювенильный диабет, миастения гравис, целиакия, гипертиформный дерматит, аддисонова болезнь, тиреотоксикоз); заболевания, связанные с фенотипом HLA-В 7, DR 2 (множественный склероз, недостаточность С 4 компонента комплемента).

Иммунная реактивность при старении На возрастные ослабления функций иммунной системы влияют как экзогенные, так и эндогенные факторы: изменение клеточного окружения (нарушения нейрогуморального равновесия), изменения самих клеток иммунной системы. Многими исследователями старость рассматривается как Т-иммунодефицит, при этом отмечается достаточно высокий уровень иммунологической резистентности, т. е. можно говорить о сбалансированном Тиммунодефиците. Результаты исследований свидетельствуют о том, что характерные для старения изменения в популяции Тклеток обусловлены возрастной инволюцией тимуса.

Иммунная реактивность при старении Доказательством служат следующие факты: ослабление Т-зависимых иммунных функций совпадает с началом инволюции тимуса. С этим ослаблением связано повышение восприимчивости к некоторым инфекциям и склонность к аутоиммунным реакциям; иммунодефицит и аутоиммунитет у мышей, тимэктомированных при рождении, удается предотвратить путем пересадки им сингенного тимуса от молодых животных; больные с первичным иммунодефицитом чаще страдают аутоиммунными заболеваниями, у них чаще возникают злокачественные новообразования; способность тимуса влиять на дифференцировку и созревание Т-клеток с возрастом уменьшается

Иммунная реактивность при старении Уменьшение количества Т-лимфоцитов, но увеличивается количество молчащих, невостребованных клеток, что связано со снижением активности рецепторного аппарата клетки. Старение характеризуется более выраженным снижением уровня популяции ТCD 8+клеток и менее выраженным - Тхелперов (CD 4+ клеток). Наблюдается дефицит Т-клеток памяти. Снижение активности Т-клеток при старении, по-видимому, является следствием генетически запрограммированной инволюции функции тимуса. Инволюция тимуса, начинающаяся при половом созревании, это главное возрастное изменение иммунной системы. Инволюция состоит в прогрессивном истощении лимфоидного пула клеток в зонах коры и кистозных изменениях эпителиальных клеток.

Иммунная реактивность при старении Выход дифференцированных Т-клеток снижается с увеличением возраста. Прогрессивно снижается синтез и секреция полипептидных гормонов тимуса, таких как тимозин, тимопоэтин и тимулин. Во всех случаях снижение эндокринной активности тимуса играет патогенную роль в возрастных дисфункциях иммунной системы, поскольку заместительная гормонотерапия способна восстановить различные иммунные функции в старости. По мере возрастной инволюции тимус утрачивает свою способность трансформировать клетки предшественники в зрелые Т-лимфоциты. Возможно, что и снижение активности разных субпопуляций Т-лимфоцитов находится под генетическим контролем. Запрограммированная инволюция функции тимуса играет существенную роль в патогенезе старения.

Иммунная реактивность при старении Способность к пролиферации Т-клеток от старых индивидуумов снижена, происходит как снижение числа клеток, отвечающих на стимуляцию, так и преждевременное истощение мощности клона отвечающих клеток. C увеличением возраста прогрессивно снижается концентрация глюкокортикоидных рецепторов в селезенке. Это изменение связано с модификацией лимфоидных клеток, несущих различные плотности рецепторов, или с естественной неспособностью стареющих клеток поддерживать адекватный обмен рецепторных молекул.

Иммунная реактивность при старении По мере старения обнаруживаются также изменения рецепторов гормонов относительно низкой молекулярной массы, расположенных в мембранах лимфоидных клеток, хотя это больше связано с нарушением сигнальных проводящих систем. Было показано, что количество рецепторных молекул с возрастом снижается, в то время как их аффинные свойства не меняются. Возможно, что в стареющей популяции с измененной функцией иммунной системы присутствие в пище иммуномодуляторов усиливает дисфункцию иммунной системы, делая стариков более подверженными болезням, связанным с возрастом.

Иммунная реактивность при старении Инволюционные процессы в тимусе захватывают и Вклеточное звено - как путем взаимодействия клеток в иммунном ответе, так и путем влияния на формирование В-клеток из их предшественников в костном мозге. В-клеточный иммунодефицит зависит от внутренних дефектов самих В-клеток. Возрастные изменения гуморального иммунитета выявляются труднее. Старение ассоциируется с присутствием различных антител, особенно антител против ядерных антигенов. Старение действует на скорость продукции антител с помощью активированных В-клеток

Иммунная реактивность при старении Происходит снижение экспрессии антигенов гистосовместимости на Т-лимфоцитах, что способствует снижению распознавания аллоантигенов и дальнейшей передачи информации, необходимой для элиминации антигена и антителопродукции. Снижается способность Т-клеток продуцировать интерлейкин-2, Нарушается активность реакции на митогены. Уменьшение плотности распределения специфических рецепторов на поверхности Т-клеток. Снижается способность организма распознавать и давать ответ на малые антигены, каковыми являются аллоантигены "малых" эритроцитарных систем и ряда других клеток крови. Это связано суменьшением титра естественных изогемагглютининов.

Иммунная реактивность при старении Все изложенное объясняет причины некоторой арективности организма в пожилом возрасте в ответ на гемотрансфузионную терапию и вместе с тем требует более углубленных исследований при подборе доноров в случае необходимости интенсивной гемотрансфузионной терапии. С возрастом развивается дисбаланс иммуноглобулинов. Однозначным при старении является снижение в крови концентрации Ig. M, т. е. снижен первичный гуморальный ответ. Содержание Ig. G и Ig. A имеет тенденцию к увеличению. При наличии инфекционного процесса особенно возрастает концентрация Ig. A. Дисбаланс иммуноглобулинов указывает на снижение противомикробной защиты, с этим связано повышение восприимчивости к инфекциям у людей пожилого и старческого возраста.

Иммунная реактивность при старении Имеются сведения о снижении концентрации лизоцима, активности β-лизина и содержания С 3 -компонента комплемента у пожилых лиц. Изменения в макрофагальной системе при старении связаны со снижением миграционной способности клеток, с уменьшением числа активных клеток, со снижением интенсивности поглощения и разрушения захваченного материала, т. е. снижением поглотительной и переваривающей способности макрофагов. Характерно снижение противовирусной и противоопухолевой защиты, что связано с дисбалансом естественных киллеров (ЕК-клетки). Функциональная же их активность после 70 лет, как правило, снижается. Лишь у долгожителей отмечается вновь возрастание активности ЕК-клеток, берущих на себя реакции клеточного иммунитета.

Иммунная реактивность при старении Изменение спектра вырабатываемых цитокинов, нарушение созревания иммунного ответа, снижение аффинности антител, увеличение перекрестной реактивности, в том числе к собственным антигенам, что ведет к учащению явлений аутоиммунизации в старших возрастных группах.

Иммунная реактивность при старении Существует теория о том, что старение есть аутоиммунный процесс. Одной из существенных причин увеличения частоты случаев аутоиммунной патологии в старости, по-видимому, является функциональное ослабление иммунологического надзора, с одной стороны, и накопление мутантных клеток, несущих чуждые организму антигены, - с другой, что приводит к гиперпродукции аутоантител. Предполагается, что этот феномен является либо компенсаторной реакцией (увеличение выведения продуктов распада), либо нарушением контрольных механизмов иммунной системы в пожилом и старческом возрастах. При этом отмечена более высокая смертность в группе носителей аутоантител широкой специфичности.

Иммунная реактивность при старении Естественное старение - это процесс развития сбалансированного иммунодефицита, увядание всех звеньев иммунной системы. Болезни в старости усугубляют характерный для пожилых иммунодефицит. В связи с этим излечение многочисленных старческих недугов, практическое продление жизни человека тесно связано с необходимостью детальной оценки генетического и иммунного статуса больного, поиском и использованием на этой основе эффективной терапии, включающей адекватные средства иммунокоррекции. Отсрочить начало старения, смягчить проявления болезней пожилого возраста вполне возможно, препятствуя ослаблению нормальных функций иммунитета.
Иммунология репродукции 2.ppt