Иммунная система_Фарм_2013.ppt
- Количество слайдов: 170
 ИММУНОЛОГИЯ. Иммунная система. Естественный (врожденный) иммунитет Т. А. Канашкова
ИММУНОЛОГИЯ. Иммунная система. Естественный (врожденный) иммунитет Т. А. Канашкова
 Иммунология - наука о строении и закономерностях функционирования иммунной системы организма.
Иммунология - наука о строении и закономерностях функционирования иммунной системы организма.
 Направления иммунологии • Медицинская иммунология (гомоиммунология) – изучает иммунитет у человека • Зооиммунология – животных • Фитоиммунология – растений
Направления иммунологии • Медицинская иммунология (гомоиммунология) – изучает иммунитет у человека • Зооиммунология – животных • Фитоиммунология – растений
 Медицинская иммунология • Общая • Частная – Молекулярная – Клеточная – Физиология иммунитета – Иммунохимия – Иммуногенетика – Эволюционная иммунология – Иммунопрофилактика (вакцинология) – Аллергология – Иммуноонкология – Трансплантационная иммунология – Иммунология репродукции – Иммунопатология – Иммунобиотехнология – Иммунофармакология – Экологическая иммунология – Клиническая иммунология
Медицинская иммунология • Общая • Частная – Молекулярная – Клеточная – Физиология иммунитета – Иммунохимия – Иммуногенетика – Эволюционная иммунология – Иммунопрофилактика (вакцинология) – Аллергология – Иммуноонкология – Трансплантационная иммунология – Иммунология репродукции – Иммунопатология – Иммунобиотехнология – Иммунофармакология – Экологическая иммунология – Клиническая иммунология
 Предмет иммунологии: • иммунная система; • иммунологические феномены: – иммунитет – аллергия – иммунологическая память – иммунологическая толерантность – трансплантационный иммунитет
Предмет иммунологии: • иммунная система; • иммунологические феномены: – иммунитет – аллергия – иммунологическая память – иммунологическая толерантность – трансплантационный иммунитет
 Задачи иммунологии: • изучение строения, функции и развития иммунной системы в норме и при патологических состояниях; • изучение роли иммунной системы в возникновении и развитии инфекционных и неинфекционных болезней; • разработка и использование методов иммунодиагностики, иммунопрофилактики и иммунотерапии инфекционных и неинфекционных заболеваний человека.
Задачи иммунологии: • изучение строения, функции и развития иммунной системы в норме и при патологических состояниях; • изучение роли иммунной системы в возникновении и развитии инфекционных и неинфекционных болезней; • разработка и использование методов иммунодиагностики, иммунопрофилактики и иммунотерапии инфекционных и неинфекционных заболеваний человека.
 Методы иммунологии: 1. 2. 3. 4. 5. Иммуноморфологический Иммунохимический Иммунобиологический Экспериментальный Молекулярно-генетический
Методы иммунологии: 1. 2. 3. 4. 5. Иммуноморфологический Иммунохимический Иммунобиологический Экспериментальный Молекулярно-генетический
 История иммунологии – 3 периода 1 – период протоиммунологии (от античного периода до 80 -х гг. XIX в. ) – стихийное, эмпирическое познание защитных реакций организма 2 – экспериментальной и теоретической иммунологии (с 80 -х гг. XIX в. до середины XX в. ) – формирование классической иммунологии 3 – молекулярно-генетический (с середины XX в. до наших дней)
История иммунологии – 3 периода 1 – период протоиммунологии (от античного периода до 80 -х гг. XIX в. ) – стихийное, эмпирическое познание защитных реакций организма 2 – экспериментальной и теоретической иммунологии (с 80 -х гг. XIX в. до середины XX в. ) – формирование классической иммунологии 3 – молекулярно-генетический (с середины XX в. до наших дней)
 История возникновения и развития 1. Стихийная иммунология - immunis = чистый, невредимый, защищенный, устойчивый к заразной болезни (Фукидид - 5 век до н. э. (устойчивость к чуме), Ван Свейтен 1775, (устойчивость к оспе после вариоляции); - практическая иммунизация (только против оспы) (древние Греция, Китай, Индия, Европа Константинополь, 1701 г. , Лондон, 1746 г. , Россия - 1756 г. Д. Самойлович, Англия – 1796 г. , Э. Дженнер).
История возникновения и развития 1. Стихийная иммунология - immunis = чистый, невредимый, защищенный, устойчивый к заразной болезни (Фукидид - 5 век до н. э. (устойчивость к чуме), Ван Свейтен 1775, (устойчивость к оспе после вариоляции); - практическая иммунизация (только против оспы) (древние Греция, Китай, Индия, Европа Константинополь, 1701 г. , Лондон, 1746 г. , Россия - 1756 г. Д. Самойлович, Англия – 1796 г. , Э. Дженнер).
 История возникновения и развития Л. Пастер. Идея о специфической сущности взаимодействий в микробиологии и иммунологии, открытие и разработка феномена аттенуации для производства вакцин;
История возникновения и развития Л. Пастер. Идея о специфической сущности взаимодействий в микробиологии и иммунологии, открытие и разработка феномена аттенуации для производства вакцин;
 История возникновения и развития И. И. Мечников, 1883 г. Клеточная теория иммунитета. Фагоцитоз
История возникновения и развития И. И. Мечников, 1883 г. Клеточная теория иммунитета. Фагоцитоз
 История возникновения и развития П. Эрлих, 1908. Гуморальная теория иммунитета. Теория разнообразия специфичностей эффекторных механизмов иммунной системы (боковых цепей). Э. Беринг, 1902. Пассивная иммунизация против дифтерии и столбняка, открытие антител.
История возникновения и развития П. Эрлих, 1908. Гуморальная теория иммунитета. Теория разнообразия специфичностей эффекторных механизмов иммунной системы (боковых цепей). Э. Беринг, 1902. Пассивная иммунизация против дифтерии и столбняка, открытие антител.
 История возникновения и развития - Ш. Рише, 1913. Работа по анафилаксии; - Ж. Борде, 1919. Система комплемента; - К. Ландштейнер, 1930. Открытие групп крови. Фундаментальная работа «Специфичность серологический реакций» ;
История возникновения и развития - Ш. Рише, 1913. Работа по анафилаксии; - Ж. Борде, 1919. Система комплемента; - К. Ландштейнер, 1930. Открытие групп крови. Фундаментальная работа «Специфичность серологический реакций» ;
 История возникновения и развития - Ф. Бернет, 1960. Клональноселекционная теория иммунной системы, иммунологическая толерантность. Бернет четко сформулировал концепцию свое/чужеродное, впервые описал «свое» . Клональноселекционная теория и сегодня остается основой понимания работы иммунной системы.
История возникновения и развития - Ф. Бернет, 1960. Клональноселекционная теория иммунной системы, иммунологическая толерантность. Бернет четко сформулировал концепцию свое/чужеродное, впервые описал «свое» . Клональноселекционная теория и сегодня остается основой понимания работы иммунной системы.
 История возникновения и развития - 1969, Бретчер и Кон (модель 2 сигналов для В- лимфоцитов) : B-лф погибают, если распознают антиген посредством Вс. R, без помощи со стороны Тхелпера. Предполагалось, что Т- и В-лимфоциты распознают один и тот же антиген одновременно. - Р. Портер, 1972. Работа по структуре антител;
История возникновения и развития - 1969, Бретчер и Кон (модель 2 сигналов для В- лимфоцитов) : B-лф погибают, если распознают антиген посредством Вс. R, без помощи со стороны Тхелпера. Предполагалось, что Т- и В-лимфоциты распознают один и тот же антиген одновременно. - Р. Портер, 1972. Работа по структуре антител;
 История возникновения и развития -1975, Лафферти и Канингем: Модель 2 сигналов для Т-лимфоцитов. T-лф погибают, если распознают антиген только посредством Тc. R (1 сигнал), без помощи ко-стимуляции от клеток-АПК (2 сигнал). 1 сигнал может привести к формированию толерантности. –Б. Бенацерраф, Ж. Доссе, Д. Снелл, 1980. Главный комплекс гистосовместимости;
История возникновения и развития -1975, Лафферти и Канингем: Модель 2 сигналов для Т-лимфоцитов. T-лф погибают, если распознают антиген только посредством Тc. R (1 сигнал), без помощи ко-стимуляции от клеток-АПК (2 сигнал). 1 сигнал может привести к формированию толерантности. –Б. Бенацерраф, Ж. Доссе, Д. Снелл, 1980. Главный комплекс гистосовместимости;
 История возникновения и развития - Н. Йерне, 1984. Теория идиотипических сетей. Новая концепция «своего» : показал идентичность «своего» и «чужеродного» , сформулировал новый принцип работы иммунной системы как системы, поддерживающей свой гомеостаз. Таким образом, - «свое» = гомеостаз; - «чужое» = нарушающие гомеостаз влияния; - иммунный ответ = реакция, приводящая систему к исходному состоянию.
История возникновения и развития - Н. Йерне, 1984. Теория идиотипических сетей. Новая концепция «своего» : показал идентичность «своего» и «чужеродного» , сформулировал новый принцип работы иммунной системы как системы, поддерживающей свой гомеостаз. Таким образом, - «свое» = гомеостаз; - «чужое» = нарушающие гомеостаз влияния; - иммунный ответ = реакция, приводящая систему к исходному состоянию.
 История возникновения и развития -С. Тонегава, 1987. Молекулярная биология генов иммуноглобулинов. Решение проблемы разнообразия продуктов иммунной системы; - П. Догерти, Р. Цинкернагель, 1996. Открытие двойного распознавания в иммунологии (распознавание антигенов относительно своих антигенов гистосовместимости).
История возникновения и развития -С. Тонегава, 1987. Молекулярная биология генов иммуноглобулинов. Решение проблемы разнообразия продуктов иммунной системы; - П. Догерти, Р. Цинкернагель, 1996. Открытие двойного распознавания в иммунологии (распознавание антигенов относительно своих антигенов гистосовместимости).
 История возникновения и развития Ч. Дженуэй, 1989: (свое/инфекционное чужеродное): • АПК сами способны различать свое/чужеродное. • АПК активируются только при связывании молекул-PAMPs с помощью рецепторов для инфекционных агентов (сигнал 0, филогенетическая память о инфекционных микроорганизмах).
История возникновения и развития Ч. Дженуэй, 1989: (свое/инфекционное чужеродное): • АПК сами способны различать свое/чужеродное. • АПК активируются только при связывании молекул-PAMPs с помощью рецепторов для инфекционных агентов (сигнал 0, филогенетическая память о инфекционных микроорганизмах).
 П. Мацингер, 1994 - теория опасности: • Иммунная система отвечает на опасные антигены, а не на чужеродные • Клетки в нормальном состоянии могут «успокаивающе» действовать на АПК • Клетки, погибающие от апоптоза, активируют процесс фагоцитоза, но не ко-стимуляции. • Опасные антигены определяются как вызывающие некроз или стресс клеток. • АПК по теории опасности активируются сигналами опасности (продуктами поврежденных тканей).
П. Мацингер, 1994 - теория опасности: • Иммунная система отвечает на опасные антигены, а не на чужеродные • Клетки в нормальном состоянии могут «успокаивающе» действовать на АПК • Клетки, погибающие от апоптоза, активируют процесс фагоцитоза, но не ко-стимуляции. • Опасные антигены определяются как вызывающие некроз или стресс клеток. • АПК по теории опасности активируются сигналами опасности (продуктами поврежденных тканей).
 Достижения иммунологии • В области профилактики, диагностики и лечения инфекционных болезней: – Благодаря вакцинации ликвидирована натуральная оспа на земном шаре, снижена до единичных случаев заболеваемость корью, коклюшем, дифтерией и др. инфекциями – Разработана и внедрена в медицинскую практику иммунодиагностика практически всех инфекционных болезней – Для лечения многих инфекционных болезней применяются иммуномодуляторы и специфические иммуноглобулины
Достижения иммунологии • В области профилактики, диагностики и лечения инфекционных болезней: – Благодаря вакцинации ликвидирована натуральная оспа на земном шаре, снижена до единичных случаев заболеваемость корью, коклюшем, дифтерией и др. инфекциями – Разработана и внедрена в медицинскую практику иммунодиагностика практически всех инфекционных болезней – Для лечения многих инфекционных болезней применяются иммуномодуляторы и специфические иммуноглобулины
 Достижения иммунологии • В области онкологии: – Установлены антигены опухолей – Разработаны способы дифференциальной диагностики опухолей – Применение для лечения и профилактики ммуномодуляторов и адаптогенов • В области трансплантологии: – Изучены антигены гистосовместимости – Снижен риск отторжения трансплантатов – Решена проблема переливания крови
Достижения иммунологии • В области онкологии: – Установлены антигены опухолей – Разработаны способы дифференциальной диагностики опухолей – Применение для лечения и профилактики ммуномодуляторов и адаптогенов • В области трансплантологии: – Изучены антигены гистосовместимости – Снижен риск отторжения трансплантатов – Решена проблема переливания крови
 Достижения иммунологии • В других областях: – Разработаны иммунологические методы выявления причин бесплодия, аномалий в развитии плода, осложнений в здоровье ребенка и матери (в частности, решена проблема диагностики резус-гемолитической болезни новорожденных) – Установлены причины и иммунные механизмы поражения многих внутренних органов (аутоиммунные болезни) – Изучен иммунный статус организма и разработаны параметры нормоиммунограммы – Значительный прогресс достигнут в выявлении причин, механизмов, способов лечения и профилактики аллергий
Достижения иммунологии • В других областях: – Разработаны иммунологические методы выявления причин бесплодия, аномалий в развитии плода, осложнений в здоровье ребенка и матери (в частности, решена проблема диагностики резус-гемолитической болезни новорожденных) – Установлены причины и иммунные механизмы поражения многих внутренних органов (аутоиммунные болезни) – Изучен иммунный статус организма и разработаны параметры нормоиммунограммы – Значительный прогресс достигнут в выявлении причин, механизмов, способов лечения и профилактики аллергий
 Задачи на ближайшее будущее: • Ликвидация и ограничение инфекционной заболеваемости путем иммунопрофилактики принципиально новыми и более качественными вакцинами • Иммунодиагностика, иммунотерапия и иммунопрофилактика злокачественных новообразований • Реализация толерантности для устранения иммунологической несовместимости при пересадке органов и тканей
Задачи на ближайшее будущее: • Ликвидация и ограничение инфекционной заболеваемости путем иммунопрофилактики принципиально новыми и более качественными вакцинами • Иммунодиагностика, иммунотерапия и иммунопрофилактика злокачественных новообразований • Реализация толерантности для устранения иммунологической несовместимости при пересадке органов и тканей
 Задачи на ближайшее будущее: • Поиск эффективных путей профилактики и лечения иммунопатологических состояний и аллергий • Устранение иммунологических конфликтов между матерью и плодом на всех стадиях репродукции • Устранение неблагоприятного влияния на иммунную систему экологических факторов • Поиск новых иммуномодуляторов • Генотерапия и генодиагностика врожденных иммунодефицитов
Задачи на ближайшее будущее: • Поиск эффективных путей профилактики и лечения иммунопатологических состояний и аллергий • Устранение иммунологических конфликтов между матерью и плодом на всех стадиях репродукции • Устранение неблагоприятного влияния на иммунную систему экологических факторов • Поиск новых иммуномодуляторов • Генотерапия и генодиагностика врожденных иммунодефицитов
 Иммунная система, определение Иммунная система - совокупность лимфоидных органов, клеток и биомолекул, обеспечивающих адаптационные, защитные и репарационные механизмы организма. Иммунная система - система контроля, обеспечивающая индивидуальность и целостность организма. Иммунная система - совокупность органов, клеток, биомолекул, осуществляющих иммунные реакции.
Иммунная система, определение Иммунная система - совокупность лимфоидных органов, клеток и биомолекул, обеспечивающих адаптационные, защитные и репарационные механизмы организма. Иммунная система - система контроля, обеспечивающая индивидуальность и целостность организма. Иммунная система - совокупность органов, клеток, биомолекул, осуществляющих иммунные реакции.
 Особенности иммунной системы: • распространена по всему организму; • клетки и молекулы постоянно рециркулируют, благодаря чему достигают практически всех систем органов (за редким исключением) и ни один антиген не остается незамеченным; • имеет собственные специфические эффекторные механизмы, такие как антитела и эффекторные клетки; • обладает «иммунологической памятью» , т. е. специальными механизмами запоминания информации о чужеродных агентах - “антигенах”.
Особенности иммунной системы: • распространена по всему организму; • клетки и молекулы постоянно рециркулируют, благодаря чему достигают практически всех систем органов (за редким исключением) и ни один антиген не остается незамеченным; • имеет собственные специфические эффекторные механизмы, такие как антитела и эффекторные клетки; • обладает «иммунологической памятью» , т. е. специальными механизмами запоминания информации о чужеродных агентах - “антигенах”.
 Особенности иммунной системы: • иерархичность - подчинённость; • интегративность (кооперативность связи) внутрии межсистемная (c нервной, эндокринной системами); • специфичность реагирования; • высокая чувствительность; • разнообразие реакций (выработка антител, ГЗТ, ГНТ, иммунологическая память, иммунологическая толерантность, идиотипы—антиидиотипы и т. д. ); • определенный тип организации - наличие центральных и периферических органов, клеток, молекул
Особенности иммунной системы: • иерархичность - подчинённость; • интегративность (кооперативность связи) внутрии межсистемная (c нервной, эндокринной системами); • специфичность реагирования; • высокая чувствительность; • разнообразие реакций (выработка антител, ГЗТ, ГНТ, иммунологическая память, иммунологическая толерантность, идиотипы—антиидиотипы и т. д. ); • определенный тип организации - наличие центральных и периферических органов, клеток, молекул
 Структура иммунной системы (ИС). ИС включает несколько самостоятельных которые могут реагировать как единое целое: • собственно лимфоидная система, • система полиморфноядерных лейкоцитов, • система мононуклеарных фагоцитов, • система комплемента, • система свертывания. систем, Лимфоидная система Общая масса лимфоидной системы составляет 1, 5 -2 кг. Число лимфоидных клеток 1013. Традиционно выделяют Т-систему (тимусзависимая, ответ клеточного типа) и Всистему (бурсазависимая, ответ гуморального типа). Принцип строения: органно-циркуляторный.
Структура иммунной системы (ИС). ИС включает несколько самостоятельных которые могут реагировать как единое целое: • собственно лимфоидная система, • система полиморфноядерных лейкоцитов, • система мононуклеарных фагоцитов, • система комплемента, • система свертывания. систем, Лимфоидная система Общая масса лимфоидной системы составляет 1, 5 -2 кг. Число лимфоидных клеток 1013. Традиционно выделяют Т-систему (тимусзависимая, ответ клеточного типа) и Всистему (бурсазависимая, ответ гуморального типа). Принцип строения: органно-циркуляторный.
 Органы иммунной системы 1. Красный костный мозг 2. Инкапсулированные органы: – Тимус – Селезенка – Лимфатические узлы 3. Неинкапсулированные органы: – Лимфоидная ткань ЖКТ (миндалины, аппендикс, пейеровы бляшки, солитарные фолликулы, внутриэпителиальные лимфоциты) – Лимфоидная ткань бронхов (солитарные фолликулы и внутриэпителиальные лимфоциты) – Лимфоидная ткань слизистых оболочек – Лимфоидная ткань кожи – Периферическая кровь
Органы иммунной системы 1. Красный костный мозг 2. Инкапсулированные органы: – Тимус – Селезенка – Лимфатические узлы 3. Неинкапсулированные органы: – Лимфоидная ткань ЖКТ (миндалины, аппендикс, пейеровы бляшки, солитарные фолликулы, внутриэпителиальные лимфоциты) – Лимфоидная ткань бронхов (солитарные фолликулы и внутриэпителиальные лимфоциты) – Лимфоидная ткань слизистых оболочек – Лимфоидная ткань кожи – Периферическая кровь
 Органы иммунной системы • Центральные (образование и антигеннезависимая дифференцировка иммунокомпетентных клеток): – Красный костный мозг – Тимус – Бурса (у птиц) • Периферические (антигензависимая дифференцировка клеток – иммунный ответ): – Все остальные
Органы иммунной системы • Центральные (образование и антигеннезависимая дифференцировка иммунокомпетентных клеток): – Красный костный мозг – Тимус – Бурса (у птиц) • Периферические (антигензависимая дифференцировка клеток – иммунный ответ): – Все остальные
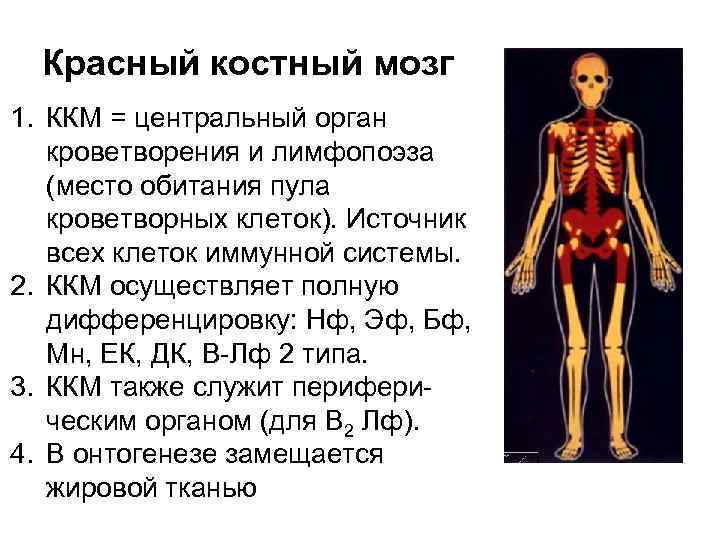 Красный костный мозг 1. ККМ = центральный орган кроветворения и лимфопоэза (место обитания пула кроветворных клеток). Источник всех клеток иммунной системы. 2. ККМ осуществляет полную дифференцировку: Нф, Эф, Бф, Мн, ЕК, ДК, В-Лф 2 типа. 3. ККМ также служит периферическим органом (для В 2 Лф). 4. В онтогенезе замещается жировой тканью
Красный костный мозг 1. ККМ = центральный орган кроветворения и лимфопоэза (место обитания пула кроветворных клеток). Источник всех клеток иммунной системы. 2. ККМ осуществляет полную дифференцировку: Нф, Эф, Бф, Мн, ЕК, ДК, В-Лф 2 типа. 3. ККМ также служит периферическим органом (для В 2 Лф). 4. В онтогенезе замещается жировой тканью
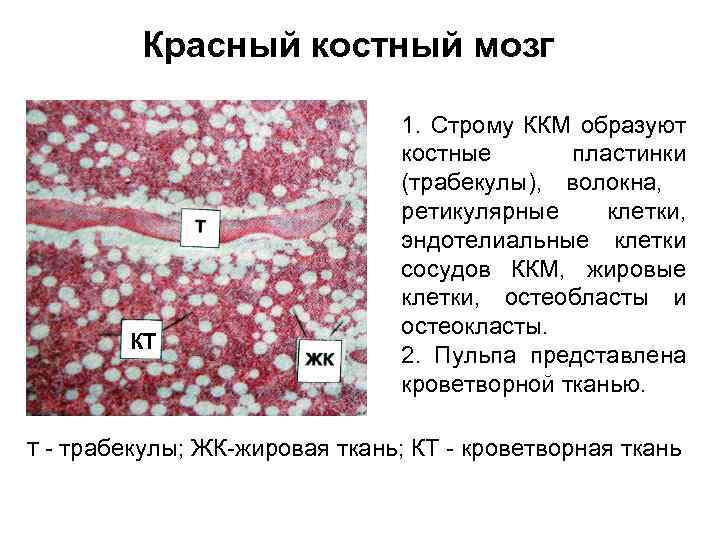 Красный костный мозг КТ Т- 1. Строму ККМ образуют костные пластинки (трабекулы), волокна, ретикулярные клетки, эндотелиальные клетки сосудов ККМ, жировые клетки, остеобласты и остеокласты. 2. Пульпа представлена кроветворной тканью. трабекулы; ЖК-жировая ткань; КТ - кроветворная ткань
Красный костный мозг КТ Т- 1. Строму ККМ образуют костные пластинки (трабекулы), волокна, ретикулярные клетки, эндотелиальные клетки сосудов ККМ, жировые клетки, остеобласты и остеокласты. 2. Пульпа представлена кроветворной тканью. трабекулы; ЖК-жировая ткань; КТ - кроветворная ткань
 Тимус 1. Функция тимуса установлена Д. Миллером и М. Бернетом в 1961 -1964 гг. 2. Тимус возникает в эмбриогенезе путём внедрения 3 и 4 брахиальных выпячиваний эктодермы и 3 и 4 -го карманов листка эндодермы, в мезодерму (мезенхиму). Далее зачаток мигрирует в область грудной клетки. Вскоре после миграции в зачаток тимуса проникают из крови предшественники Т—клеток. 3. Тимус состоит из двух больших долей, которые делятся на более мелкие дольки. В каждой дольке выделяют корковую и мозговую зоны.
Тимус 1. Функция тимуса установлена Д. Миллером и М. Бернетом в 1961 -1964 гг. 2. Тимус возникает в эмбриогенезе путём внедрения 3 и 4 брахиальных выпячиваний эктодермы и 3 и 4 -го карманов листка эндодермы, в мезодерму (мезенхиму). Далее зачаток мигрирует в область грудной клетки. Вскоре после миграции в зачаток тимуса проникают из крови предшественники Т—клеток. 3. Тимус состоит из двух больших долей, которые делятся на более мелкие дольки. В каждой дольке выделяют корковую и мозговую зоны.
 4. Клеточный состав тимуса: – эпителиальные клетки (нескольких типов, в т. ч. клетки-няньки). Секретируют цитокины (ИЛ 1, 3, 6, 7 и GM-CSF) и адресные молекулы для тимоцитов (LFA 3, ICAM 1); – тимоциты, ДК (располагаются между корковой и медуллярной областями) и Мф; – тельца Гассаля (медуллярные эпителиальные клетки, содержащие кератогиалин и филаменты); – миоидные клетки (из нейрального гребешка). Проникновение в и выход клеток из тимуса происходит через дольковые венулы с высоким эндотелием, эфферентные лимфатические сосуды.
4. Клеточный состав тимуса: – эпителиальные клетки (нескольких типов, в т. ч. клетки-няньки). Секретируют цитокины (ИЛ 1, 3, 6, 7 и GM-CSF) и адресные молекулы для тимоцитов (LFA 3, ICAM 1); – тимоциты, ДК (располагаются между корковой и медуллярной областями) и Мф; – тельца Гассаля (медуллярные эпителиальные клетки, содержащие кератогиалин и филаменты); – миоидные клетки (из нейрального гребешка). Проникновение в и выход клеток из тимуса происходит через дольковые венулы с высоким эндотелием, эфферентные лимфатические сосуды.
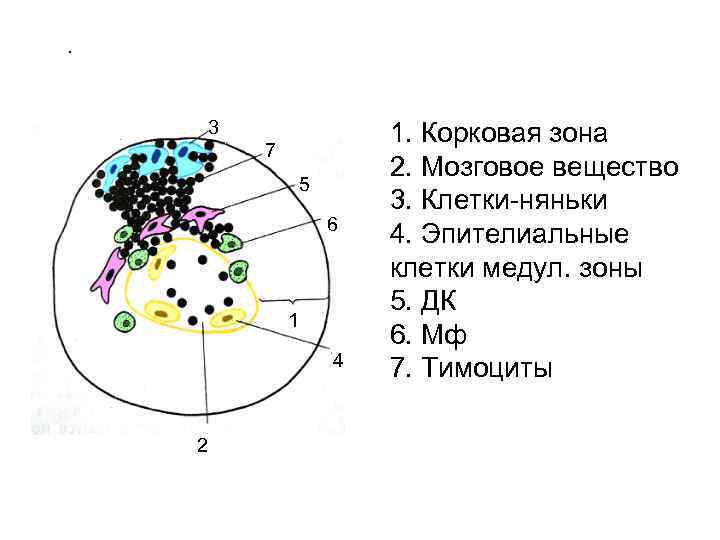 . 3 7 5 6 1 4 2 1. Корковая зона 2. Мозговое вещество 3. Клетки-няньки 4. Эпителиальные клетки медул. зоны 5. ДК 6. Мф 7. Тимоциты
. 3 7 5 6 1 4 2 1. Корковая зона 2. Мозговое вещество 3. Клетки-няньки 4. Эпителиальные клетки медул. зоны 5. ДК 6. Мф 7. Тимоциты
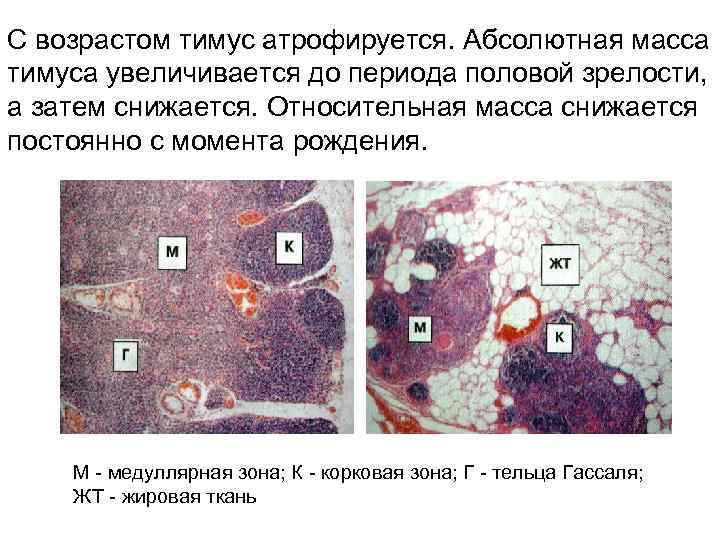 С возрастом тимус атрофируется. Абсолютная масса тимуса увеличивается до периода половой зрелости, а затем снижается. Относительная масса снижается постоянно с момента рождения. М - медуллярная зона; К - корковая зона; Г - тельца Гассаля; ЖТ - жировая ткань
С возрастом тимус атрофируется. Абсолютная масса тимуса увеличивается до периода половой зрелости, а затем снижается. Относительная масса снижается постоянно с момента рождения. М - медуллярная зона; К - корковая зона; Г - тельца Гассаля; ЖТ - жировая ткань
 Лимфатические узлы (ЛУ) 1. ЛУ = множественные инкапсулированные периферические лимфоидные органы бобовидной формы размером от 0, 5 до 1, 5 см. 2. Расположены симметрично-регионарно. Дренируют лимфу из всех барьерных тканей. 3. Включают Т- и В-зависимые зоны с различным клеточным составом и функциями: – Паракортикальная зона (Т) = тяжи ткани вокруг ВЭВ, стремящиеся к мозговой зоне. Тяжи граничат с кортикальным синусом, фолликулами и перивенулярными каналами. В этой области происходит презентация антигенов Т-клеткам интердигитатными ДК из покровных тканей.
Лимфатические узлы (ЛУ) 1. ЛУ = множественные инкапсулированные периферические лимфоидные органы бобовидной формы размером от 0, 5 до 1, 5 см. 2. Расположены симметрично-регионарно. Дренируют лимфу из всех барьерных тканей. 3. Включают Т- и В-зависимые зоны с различным клеточным составом и функциями: – Паракортикальная зона (Т) = тяжи ткани вокруг ВЭВ, стремящиеся к мозговой зоне. Тяжи граничат с кортикальным синусом, фолликулами и перивенулярными каналами. В этой области происходит презентация антигенов Т-клеткам интердигитатными ДК из покровных тканей.
 – Кортикальная зона (В) разделяется трабекулами на сектора. Функциональной единицей зоны является фолликул: • первичный фолликул образуется нестимулированными В-лимфоцитами и фолликулярными ДК. • герминативный центр (ГЦ). Крупное образование, содержащее активно делящиеся В-лимфоциты, ФДК и редкие Т-хелперы. Различают темную и светлую зоны ГЦ (процессы соматического мутирования и положительной Ag-зависимой селекции). После завершения иммуногенеза ГЦ уменьшается в размерах. Остаточный фолликул часто называют вторичным. – Медуллярная зона. Представлена многочисленными синусами, открывающимися в эфферентный сосуд. Содержит плазмациты, Мф и Т-клетки памяти.
– Кортикальная зона (В) разделяется трабекулами на сектора. Функциональной единицей зоны является фолликул: • первичный фолликул образуется нестимулированными В-лимфоцитами и фолликулярными ДК. • герминативный центр (ГЦ). Крупное образование, содержащее активно делящиеся В-лимфоциты, ФДК и редкие Т-хелперы. Различают темную и светлую зоны ГЦ (процессы соматического мутирования и положительной Ag-зависимой селекции). После завершения иммуногенеза ГЦ уменьшается в размерах. Остаточный фолликул часто называют вторичным. – Медуллярная зона. Представлена многочисленными синусами, открывающимися в эфферентный сосуд. Содержит плазмациты, Мф и Т-клетки памяти.
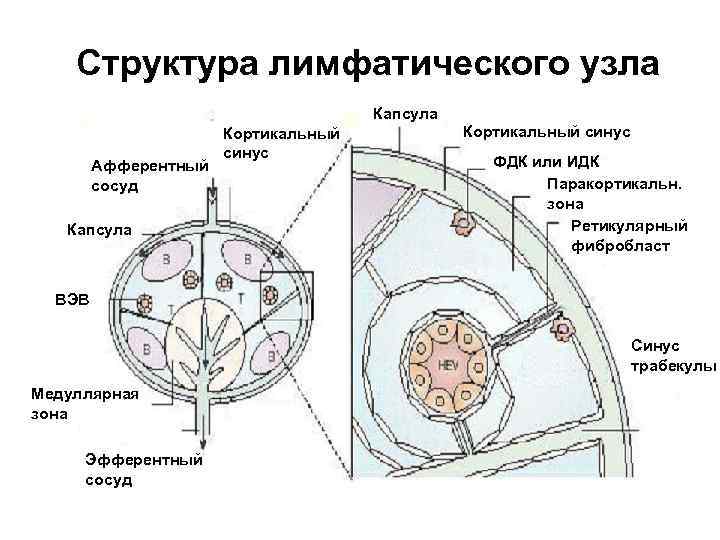 Структура лимфатического узла Капсула Афферентный сосуд Капсула Кортикальный синус ФДК или ИДК Паракортикальн. зона Ретикулярный фибробласт ВЭВ Синус трабекулы Медуллярная зона Эфферентный сосуд
Структура лимфатического узла Капсула Афферентный сосуд Капсула Кортикальный синус ФДК или ИДК Паракортикальн. зона Ретикулярный фибробласт ВЭВ Синус трабекулы Медуллярная зона Эфферентный сосуд
 Селезенка 1. Крупный непарный орган 7× 13 см, 80 -300 г. Не содержит лимфатических сосудов. 2. Строма селезенки образована короткими перегородками, трабекулами и ретикулярными клетками. Лимфоидная ткань (белая пульпа) представлена скоплением лимфоцитов вокруг артериол: 3. Т-зона непосредственно окружает артериолу и заполнена Т-лимфоцитами и дендритными клетками. 4. В-зона образована первичными и вторичными фолликулами (как в л/у). 5. Краевая зона содержит макрофаги, различные ДК, В 1 лимфоциты или В-лимфоциты, отвечающие на тимуснезависимые антигены.
Селезенка 1. Крупный непарный орган 7× 13 см, 80 -300 г. Не содержит лимфатических сосудов. 2. Строма селезенки образована короткими перегородками, трабекулами и ретикулярными клетками. Лимфоидная ткань (белая пульпа) представлена скоплением лимфоцитов вокруг артериол: 3. Т-зона непосредственно окружает артериолу и заполнена Т-лимфоцитами и дендритными клетками. 4. В-зона образована первичными и вторичными фолликулами (как в л/у). 5. Краевая зона содержит макрофаги, различные ДК, В 1 лимфоциты или В-лимфоциты, отвечающие на тимуснезависимые антигены.
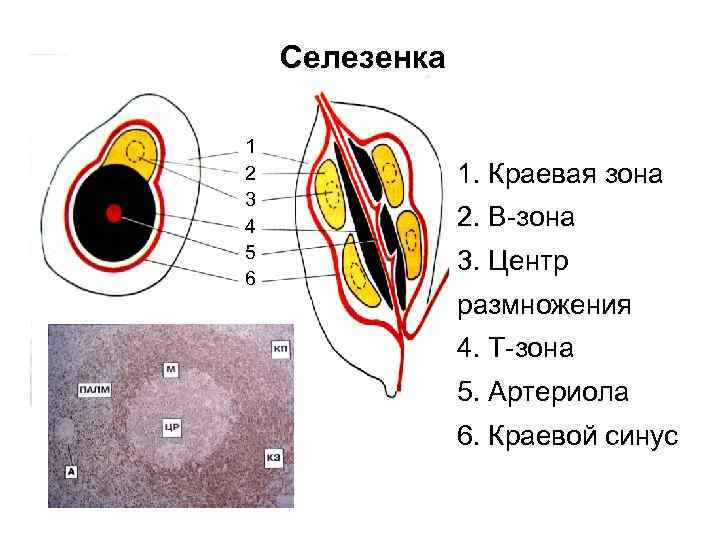 Селезенка 1 2 3 4 5 6 1. Краевая зона 2. В-зона 3. Центр размножения 4. Т-зона 5. Артериола 6. Краевой синус
Селезенка 1 2 3 4 5 6 1. Краевая зона 2. В-зона 3. Центр размножения 4. Т-зона 5. Артериола 6. Краевой синус
 Лимфоидная ткань слизистых оболочек • • глоточное кольцо Пирогова, пейеровы бляшки тонкого кишечника, лимфоидные фолликулы аппендикса, лимфоидная ткань слизистых оболочек бронхов и бронхиол, мочеполовой системы и др. , • внутриэпителиальные лимфоциты.
Лимфоидная ткань слизистых оболочек • • глоточное кольцо Пирогова, пейеровы бляшки тонкого кишечника, лимфоидные фолликулы аппендикса, лимфоидная ткань слизистых оболочек бронхов и бронхиол, мочеполовой системы и др. , • внутриэпителиальные лимфоциты.
 Лимфоидная ткань слизистых оболочек Теория общности ЛТСО пропагандируется сторонниками концепции «мукозальной» вакцинации. Применение определенных адъювантов дает обнадеживающие результаты (витамин Д 3, агенты, повышающие ц. АМФ). Общепризнанны следующие положения: • существуют адресные молекулы, обеспечивающие возвращение Т-лимфоцитов в регионы, где они проходили Ag-зависимую дифференцировку (кожа, респираторная система, ЖКТ, мочеполовой тракт); • тканевое микроокружение определяет стратегию и тип эффекторного ответа (например, синтез Ig. A и M).
Лимфоидная ткань слизистых оболочек Теория общности ЛТСО пропагандируется сторонниками концепции «мукозальной» вакцинации. Применение определенных адъювантов дает обнадеживающие результаты (витамин Д 3, агенты, повышающие ц. АМФ). Общепризнанны следующие положения: • существуют адресные молекулы, обеспечивающие возвращение Т-лимфоцитов в регионы, где они проходили Ag-зависимую дифференцировку (кожа, респираторная система, ЖКТ, мочеполовой тракт); • тканевое микроокружение определяет стратегию и тип эффекторного ответа (например, синтез Ig. A и M).
 Лимфоидная ткань, ассоциированная с ЖКТ Носоглоточное кольцо Пирогова Вальдейера: миндалины содержат В-зоны 1. - с первичными и вторичными фолликулами. Встречаются Тзоны, образующиеся вокруг ВЭВ. Эпителий в области скопления лимфоидной ткани образует карманы или глубокие щели, облегчая контакт с антигенами. Вокруг лимфоидных элементов - железистые ткани.
Лимфоидная ткань, ассоциированная с ЖКТ Носоглоточное кольцо Пирогова Вальдейера: миндалины содержат В-зоны 1. - с первичными и вторичными фолликулами. Встречаются Тзоны, образующиеся вокруг ВЭВ. Эпителий в области скопления лимфоидной ткани образует карманы или глубокие щели, облегчая контакт с антигенами. Вокруг лимфоидных элементов - железистые ткани.
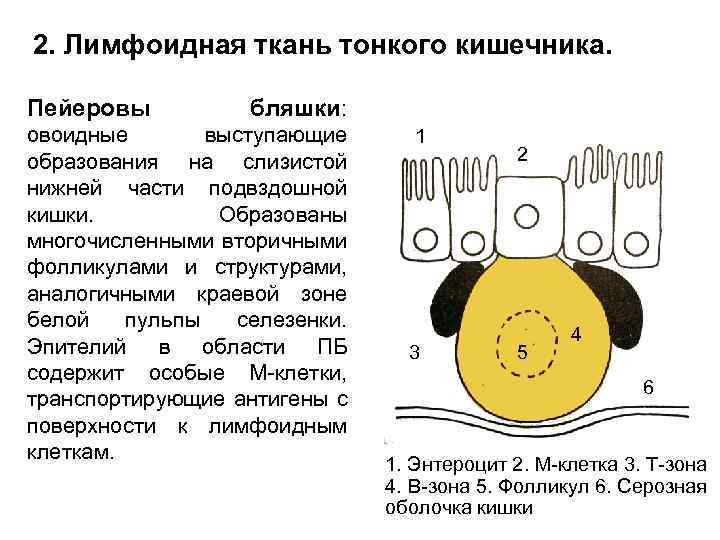 2. Лимфоидная ткань тонкого кишечника. Пейеровы бляшки: овоидные выступающие образования на слизистой нижней части подвздошной кишки. Образованы многочисленными вторичными фолликулами и структурами, аналогичными краевой зоне белой пульпы селезенки. Эпителий в области ПБ содержит особые М-клетки, транспортирующие антигены с поверхности к лимфоидным клеткам. 1 3 2 5 4 6 1. Энтероцит 2. М-клетка 3. Т-зона 4. В-зона 5. Фолликул 6. Серозная оболочка кишки
2. Лимфоидная ткань тонкого кишечника. Пейеровы бляшки: овоидные выступающие образования на слизистой нижней части подвздошной кишки. Образованы многочисленными вторичными фолликулами и структурами, аналогичными краевой зоне белой пульпы селезенки. Эпителий в области ПБ содержит особые М-клетки, транспортирующие антигены с поверхности к лимфоидным клеткам. 1 3 2 5 4 6 1. Энтероцит 2. М-клетка 3. Т-зона 4. В-зона 5. Фолликул 6. Серозная оболочка кишки
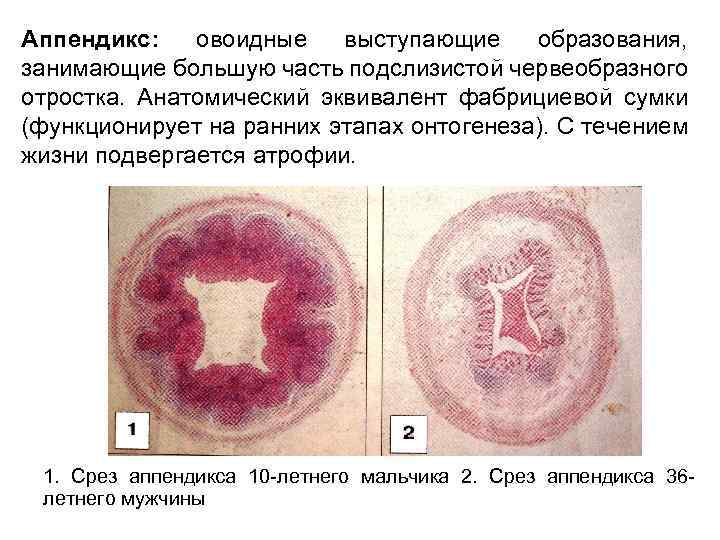 Аппендикс: овоидные выступающие образования, занимающие большую часть подслизистой червеобразного отростка. Анатомический эквивалент фабрициевой сумки (функционирует на ранних этапах онтогенеза). С течением жизни подвергается атрофии. 1. Срез аппендикса 10 -летнего мальчика 2. Срез аппендикса 36 летнего мужчины
Аппендикс: овоидные выступающие образования, занимающие большую часть подслизистой червеобразного отростка. Анатомический эквивалент фабрициевой сумки (функционирует на ранних этапах онтогенеза). С течением жизни подвергается атрофии. 1. Срез аппендикса 10 -летнего мальчика 2. Срез аппендикса 36 летнего мужчины
 Клетки мукозальной лимфоидной ткани ЖКТ 1. Т-лимфоциты lamina propria преимущественно CD 4+, Th 2 и Th 3 преобладают. 2. Внутриэпителиальные Т-клетки преимущественно CD 8+, значительная часть представлена γ/δ-Tc. R лимфоцитами. 3. Субпопуляции Т-лимфоцитов: α/β-Tc. R+ T клетки: • CD 8+ киллеры, тропные к ЖКТ; • CD 4+ эффекторы, тропные к ЖКТ; • Т-клетки памяти эффекторы/регуляторы. γ/δ -Tc. R+ Т-лимфоциты: • CD 8+ эффекторы/регуляторы. 4. Миелоидные ДК расположены на lamina propria тонкого кишечника и непосредственно захватывают антигены из кишечника
Клетки мукозальной лимфоидной ткани ЖКТ 1. Т-лимфоциты lamina propria преимущественно CD 4+, Th 2 и Th 3 преобладают. 2. Внутриэпителиальные Т-клетки преимущественно CD 8+, значительная часть представлена γ/δ-Tc. R лимфоцитами. 3. Субпопуляции Т-лимфоцитов: α/β-Tc. R+ T клетки: • CD 8+ киллеры, тропные к ЖКТ; • CD 4+ эффекторы, тропные к ЖКТ; • Т-клетки памяти эффекторы/регуляторы. γ/δ -Tc. R+ Т-лимфоциты: • CD 8+ эффекторы/регуляторы. 4. Миелоидные ДК расположены на lamina propria тонкого кишечника и непосредственно захватывают антигены из кишечника
 Функционирование мукозальной лимфоидной ткани 1. Место индукции иммунного ответа: лимфоэпителиальные ткани (Пейеровы бляшки) 2. Место эффекторного ответа: Lamina propria, эпителий 3. Формула ответа: • Ag захватывается М-клетками и доставляется к АПК • АПК активируются и мигрируют в Т-зону • АПК активируют Т-лимфоциты, Т-лимфоциты управляют В-лимфоцитами • Формируются фолликулы • В-лимфоциты трансформируются в Ig. A+ плазмациты 4. Т-клетки: • регулируют интенсивность ответа • выполняют эффекторную функцию
Функционирование мукозальной лимфоидной ткани 1. Место индукции иммунного ответа: лимфоэпителиальные ткани (Пейеровы бляшки) 2. Место эффекторного ответа: Lamina propria, эпителий 3. Формула ответа: • Ag захватывается М-клетками и доставляется к АПК • АПК активируются и мигрируют в Т-зону • АПК активируют Т-лимфоциты, Т-лимфоциты управляют В-лимфоцитами • Формируются фолликулы • В-лимфоциты трансформируются в Ig. A+ плазмациты 4. Т-клетки: • регулируют интенсивность ответа • выполняют эффекторную функцию
 Лимфоидная ткань, ассоциированная с бронхами (ЛТАБ) 1. Конститутивная ЛТАБ обнаруживается по ходу бронхов у мышей и человека. Развивается по антигеннезависимому пути (с высокой частотой встречаются клетки, нормально синтезирующие Ig. D). 2. Индуцированная ЛТАБ: • • • развивается при инфекциях респираторного тракта; замещает конвенционную лимфоидную ткань; характеризуется замедленной кинетикой развития; имеет типичную структуру: В-зоны, содержащие фолликулы, разделенные Т-зонами вокруг ВЭВ, но варьирует по выраженности, не связана с эпителием; значительное развитие наблюдается при повторных инфекциях респираторного тракта и приводит к снижению заболеваемости и смертности (на мышиных моделях)
Лимфоидная ткань, ассоциированная с бронхами (ЛТАБ) 1. Конститутивная ЛТАБ обнаруживается по ходу бронхов у мышей и человека. Развивается по антигеннезависимому пути (с высокой частотой встречаются клетки, нормально синтезирующие Ig. D). 2. Индуцированная ЛТАБ: • • • развивается при инфекциях респираторного тракта; замещает конвенционную лимфоидную ткань; характеризуется замедленной кинетикой развития; имеет типичную структуру: В-зоны, содержащие фолликулы, разделенные Т-зонами вокруг ВЭВ, но варьирует по выраженности, не связана с эпителием; значительное развитие наблюдается при повторных инфекциях респираторного тракта и приводит к снижению заболеваемости и смертности (на мышиных моделях)
 Лимфоидная ткань, ассоциированная с кожей 1. Эпидермис содержит: • кератиноциты: барьерная функция и функция раннего обнаружения (опасности). Синтезируют ИЛ 1, 18, ФНО-альфа, дефензины; • небольшое количество γ/δ CD 8+ Тлимфоцитов. 2. Дерма содержит клетки Лангерганса, тучные клетки и небольшое количество тропных к коже Т -клеток памяти. 3. Венулы дермы постоянно экспрессируют рецепторы хоминга для CLA+ Т-лимфоцитов (функция надзора).
Лимфоидная ткань, ассоциированная с кожей 1. Эпидермис содержит: • кератиноциты: барьерная функция и функция раннего обнаружения (опасности). Синтезируют ИЛ 1, 18, ФНО-альфа, дефензины; • небольшое количество γ/δ CD 8+ Тлимфоцитов. 2. Дерма содержит клетки Лангерганса, тучные клетки и небольшое количество тропных к коже Т -клеток памяти. 3. Венулы дермы постоянно экспрессируют рецепторы хоминга для CLA+ Т-лимфоцитов (функция надзора).
 Формула ответа 1. Индукция воспаления, активация и захват Ag специализированными АПК, транспортировка в регионарные лимфоузлы. 2. Формирование клонов тропных к коже Тлимфоцитов эффекторов/регуляторов. 3. Формирование клонов политропных Тлимфоцитов эффекторов/регуляторов
Формула ответа 1. Индукция воспаления, активация и захват Ag специализированными АПК, транспортировка в регионарные лимфоузлы. 2. Формирование клонов тропных к коже Тлимфоцитов эффекторов/регуляторов. 3. Формирование клонов политропных Тлимфоцитов эффекторов/регуляторов
 Клетки иммунной системы: • • В-лимфоциты Т-лимфоциты Естественные киллеры Фагоциты: – полиморфноядерные (Нф, Бф, Эф) – мононуклеарные (Мн, Мф) • • Дендритные клетки Фибробласты Эндотелиальные клетки Тучные клетки
Клетки иммунной системы: • • В-лимфоциты Т-лимфоциты Естественные киллеры Фагоциты: – полиморфноядерные (Нф, Бф, Эф) – мононуклеарные (Мн, Мф) • • Дендритные клетки Фибробласты Эндотелиальные клетки Тучные клетки
 Молекулы иммунной системы • • Иммуноглобулины (антитела) Белки системы комплемента Лизоцим Медиаторы иммунной системы – молекулы дистантного взаимодействия клеток: – гормоны: • тимуса • миелопептиды – цитокины
Молекулы иммунной системы • • Иммуноглобулины (антитела) Белки системы комплемента Лизоцим Медиаторы иммунной системы – молекулы дистантного взаимодействия клеток: – гормоны: • тимуса • миелопептиды – цитокины
 Молекулы иммунной системы • Рецепторы: – антигенспецифические: • Т-клеточный рецептор (TCR) • В-клеточный рецептор (BCR) – антигеннеспецифические: • к митогенам • гормонам тимуса • цитокинам • белкам системы комплемента • иммуноглобулинам и др.
Молекулы иммунной системы • Рецепторы: – антигенспецифические: • Т-клеточный рецептор (TCR) • В-клеточный рецептор (BCR) – антигеннеспецифические: • к митогенам • гормонам тимуса • цитокинам • белкам системы комплемента • иммуноглобулинам и др.
 Молекулы иммунной системы • Антигены: – дифференцировочные (CD-антигены - от англ. claster of definition) – главного комплекса гистосовместимости (ГКГ) • Адгезивные молекулы – мембранные молекулы контактного взаимодействия клеток друг с другом, с эндотелием или внеклеточным матриксом: – Интегрины – Селектины
Молекулы иммунной системы • Антигены: – дифференцировочные (CD-антигены - от англ. claster of definition) – главного комплекса гистосовместимости (ГКГ) • Адгезивные молекулы – мембранные молекулы контактного взаимодействия клеток друг с другом, с эндотелием или внеклеточным матриксом: – Интегрины – Селектины
 Главный комплекс гистосовместимости • (ГКГ или МНС - маjor histoсоmpatibility complex) – участок короткого плеча 6 -й хромосомы. • Включает гены трех классов – I, III. Каждый имеет несколько локусов – I (А, В, С и др. ), II (DP, DQ, DR), III (С 4, В, С 2 и др. ). У человека ГКГ называется также НLА (human lеucocyte antigens) !!! Антигены системы ГКГ I класса имеют все ядросодержащие клетки, а ГКГ II класса — только иммунокомпетентные клетки.
Главный комплекс гистосовместимости • (ГКГ или МНС - маjor histoсоmpatibility complex) – участок короткого плеча 6 -й хромосомы. • Включает гены трех классов – I, III. Каждый имеет несколько локусов – I (А, В, С и др. ), II (DP, DQ, DR), III (С 4, В, С 2 и др. ). У человека ГКГ называется также НLА (human lеucocyte antigens) !!! Антигены системы ГКГ I класса имеют все ядросодержащие клетки, а ГКГ II класса — только иммунокомпетентные клетки.
 • Важнейшей характеристикой генов ГКГ является их разнообразие и полиморфизм, так как в каждом локусе содержится большое количество генов разных специфичностей (много аллельных вариантов). Это является основой строгой индивидуальности набора трансплантационных антигенов у каждого человека. Возможных наборов вариантов более 400 млн.
• Важнейшей характеристикой генов ГКГ является их разнообразие и полиморфизм, так как в каждом локусе содержится большое количество генов разных специфичностей (много аллельных вариантов). Это является основой строгой индивидуальности набора трансплантационных антигенов у каждого человека. Возможных наборов вариантов более 400 млн.
 Основные функции ГКГ ØОбеспечивает реализацию иммунного ответа. Гены I и II классов кодируют белки – молекулы распознавания I и II классов. Названы так в связи с тем, что способны распознавать чужеродные антигены и участвовать в презентации АПК антигенного пептида Тлимфоцитам. ØОбеспечивает иммунологическую реактивность организма в целом. Это связано с наличием в ГКГ генов иммунного ответа (Ir – immune response) и генов подавления иммунного ответа (Is-immune supresion), регулирующих иммунный ответ
Основные функции ГКГ ØОбеспечивает реализацию иммунного ответа. Гены I и II классов кодируют белки – молекулы распознавания I и II классов. Названы так в связи с тем, что способны распознавать чужеродные антигены и участвовать в презентации АПК антигенного пептида Тлимфоцитам. ØОбеспечивает иммунологическую реактивность организма в целом. Это связано с наличием в ГКГ генов иммунного ответа (Ir – immune response) и генов подавления иммунного ответа (Is-immune supresion), регулирующих иммунный ответ
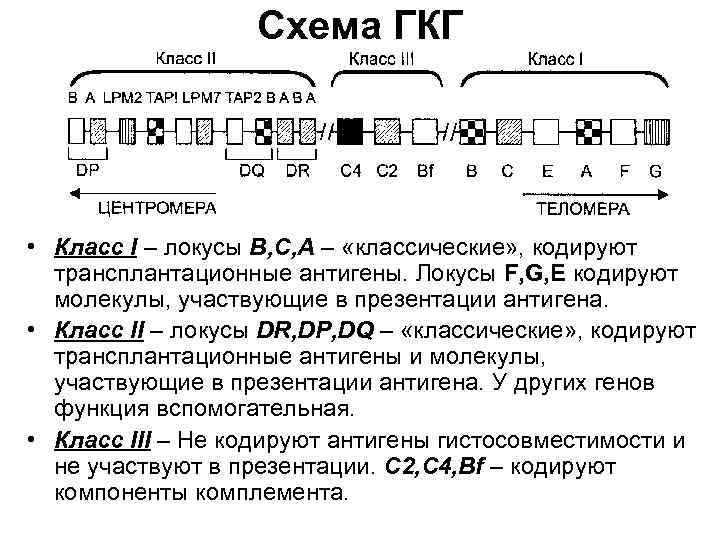 Схема ГКГ • Класс I – локусы В, С, А – «классические» , кодируют трансплантационные антигены. Локусы F, G, E кодируют молекулы, участвующие в презентации антигена. • Класс II – локусы DR, DP, DQ – «классические» , кодируют трансплантационные антигены и молекулы, участвующие в презентации антигена. У других генов функция вспомогательная. • Класс III – Не кодируют антигены гистосовместимости и не участвуют в презентации. С 2, С 4, Bf – кодируют компоненты комплемента.
Схема ГКГ • Класс I – локусы В, С, А – «классические» , кодируют трансплантационные антигены. Локусы F, G, E кодируют молекулы, участвующие в презентации антигена. • Класс II – локусы DR, DP, DQ – «классические» , кодируют трансплантационные антигены и молекулы, участвующие в презентации антигена. У других генов функция вспомогательная. • Класс III – Не кодируют антигены гистосовместимости и не участвуют в презентации. С 2, С 4, Bf – кодируют компоненты комплемента.
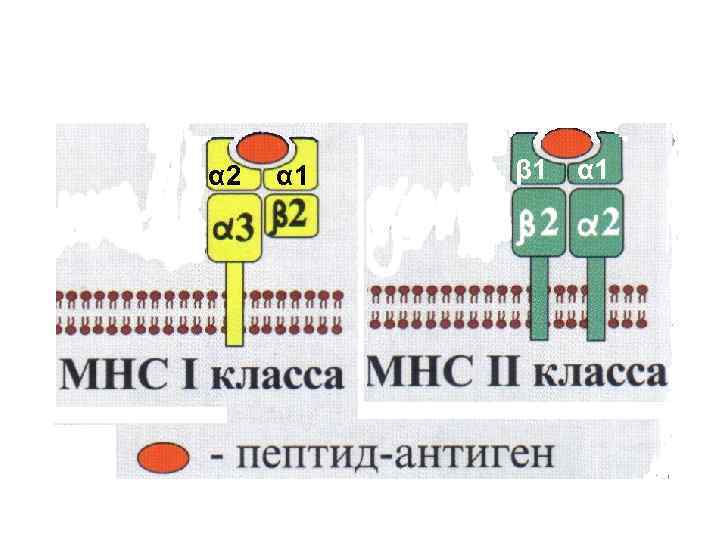
 Строение молекулы ГКГ I Трансмембранные гликопротеиды. Одна тяжелая цепь нековалентно ассоциированная с молекулой бета-2 микроглобулина. Эта тяжелая цепь делится на три внеклеточных домена – альфа-1 (концевой), альфа-2, альфа-3, трансмембранный фрагмент и цитоплазматический хвост. Между первым и вторым доменами борозда для пептида. Бета-2 -микроглобулин участвует в узнавании и связывании пептида. Обусловливает транспорт молекул 1 класса к мембране клетки и ее экспрессию. Мембрана клетки Цитоплазма
Строение молекулы ГКГ I Трансмембранные гликопротеиды. Одна тяжелая цепь нековалентно ассоциированная с молекулой бета-2 микроглобулина. Эта тяжелая цепь делится на три внеклеточных домена – альфа-1 (концевой), альфа-2, альфа-3, трансмембранный фрагмент и цитоплазматический хвост. Между первым и вторым доменами борозда для пептида. Бета-2 -микроглобулин участвует в узнавании и связывании пептида. Обусловливает транспорт молекул 1 класса к мембране клетки и ее экспрессию. Мембрана клетки Цитоплазма
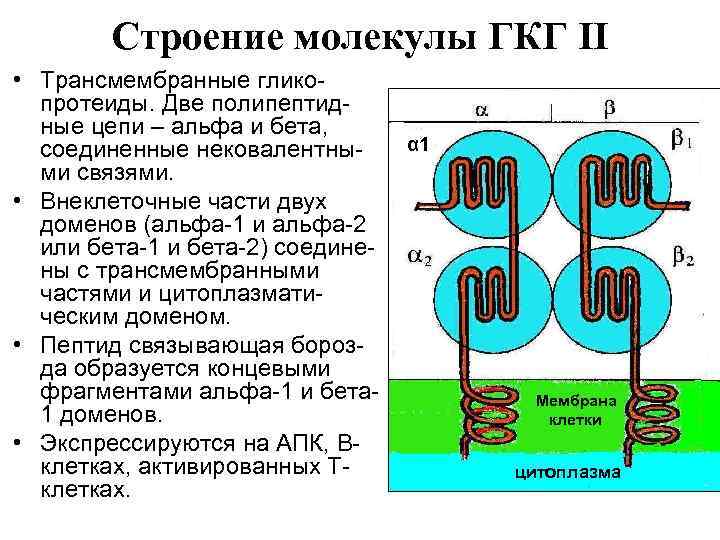 Строение молекулы ГКГ II • Трансмембранные гликопротеиды. Две полипептидные цепи – альфа и бета, соединенные нековалентными связями. • Внеклеточные части двух доменов (альфа-1 и альфа-2 или бета-1 и бета-2) соединены с трансмембранными частями и цитоплазматическим доменом. • Пептид связывающая борозда образуется концевыми фрагментами альфа-1 и бета 1 доменов. • Экспрессируются на АПК, Вклетках, активированных Тклетках. α 1 Мембрана клетки цитоплазма Цитоплазма
Строение молекулы ГКГ II • Трансмембранные гликопротеиды. Две полипептидные цепи – альфа и бета, соединенные нековалентными связями. • Внеклеточные части двух доменов (альфа-1 и альфа-2 или бета-1 и бета-2) соединены с трансмембранными частями и цитоплазматическим доменом. • Пептид связывающая борозда образуется концевыми фрагментами альфа-1 и бета 1 доменов. • Экспрессируются на АПК, Вклетках, активированных Тклетках. α 1 Мембрана клетки цитоплазма Цитоплазма
 α 2 α 1 β 1 α 1
α 2 α 1 β 1 α 1
 Связь ГКГ с заболеваниями • Наличие определенных антигенов ГКГ часто обусловливают предрасположенность к тому или иному заболеванию. Наиболее часто это связано с антигенами локусов А, В и DR. • Предрасположенность к аллергии и аутоиммунным заболеваниям, резистентность к инфекциям ассоциированы с конкретными фенотипами HLA системы: – 95% больных анкилозирующим спондилоартритом (болезнь Бехтерева) имеют антиген HLA-В 27. – системная красная волчанка - чаще у лиц с HLA-B 8, – псориаз – HLA-C 6, – врожденные аномалии сердца – HLA-A 2, – рассеянный склероз – HLA-DR 2.
Связь ГКГ с заболеваниями • Наличие определенных антигенов ГКГ часто обусловливают предрасположенность к тому или иному заболеванию. Наиболее часто это связано с антигенами локусов А, В и DR. • Предрасположенность к аллергии и аутоиммунным заболеваниям, резистентность к инфекциям ассоциированы с конкретными фенотипами HLA системы: – 95% больных анкилозирующим спондилоартритом (болезнь Бехтерева) имеют антиген HLA-В 27. – системная красная волчанка - чаще у лиц с HLA-B 8, – псориаз – HLA-C 6, – врожденные аномалии сердца – HLA-A 2, – рассеянный склероз – HLA-DR 2.
 Цитокины • Биоактивные пептиды или белки, обладающие гормоноподобным действием, и служащие для взаимодействия клеток иммунной, кроветворной, нервной, эндокринной систем • Секретируются главным образом активированными клетками иммунной системы. Индуцибельный процесс. • Являются факторами роста, активации, дифференцировки клеток. • После взаимодействия цитокинов с рецепторами клеток возникает сигнал, который через внутриклеточную систему ферментов и медиаторов передается в ядро, где активируются соответствующие гены. Продукты генов осуществляют регуляцию иммунной системы.
Цитокины • Биоактивные пептиды или белки, обладающие гормоноподобным действием, и служащие для взаимодействия клеток иммунной, кроветворной, нервной, эндокринной систем • Секретируются главным образом активированными клетками иммунной системы. Индуцибельный процесс. • Являются факторами роста, активации, дифференцировки клеток. • После взаимодействия цитокинов с рецепторами клеток возникает сигнал, который через внутриклеточную систему ферментов и медиаторов передается в ядро, где активируются соответствующие гены. Продукты генов осуществляют регуляцию иммунной системы.
 ü Цитокины действуют по эстафетному принципу: воздействие цитокина на клетку вызывает образование ею других цитокинов (цитокиновый каскад). ü Один и тот же цитокин может продуцироваться различными клетками организма в разных органах. ü Один и тот же цитокин может действовать на многие типы клеток, вызывая различные эффекты в зависимости от вида клеток-мишеней. ü Для цитокинов характерна взаимозаменяемость биологического действия. Несколько разных цитокинов могут вызывать один и тот же биологический эффект либо обладать похожей активностью.
ü Цитокины действуют по эстафетному принципу: воздействие цитокина на клетку вызывает образование ею других цитокинов (цитокиновый каскад). ü Один и тот же цитокин может продуцироваться различными клетками организма в разных органах. ü Один и тот же цитокин может действовать на многие типы клеток, вызывая различные эффекты в зависимости от вида клеток-мишеней. ü Для цитокинов характерна взаимозаменяемость биологического действия. Несколько разных цитокинов могут вызывать один и тот же биологический эффект либо обладать похожей активностью.
 По преобладающим свойствам различают цитокины: Ø Регуляторы воспаления: ФНОα, ИЛ 1, ИЛ 6, ИЛ 12; Ø Регуляторы активации, пролиферации и дифференцировки лимфоцитов: ИЛ 4, ИЛ 13, ИЛ 2 Ø Регуляторы иммунного воспаления: ИЛ 5, ИЛ 9, ИЛ 10, ИЛ 12 Ø Факторы роста и дифференцировки: ИЛ 3, ИЛ 7, ИЛ 11
По преобладающим свойствам различают цитокины: Ø Регуляторы воспаления: ФНОα, ИЛ 1, ИЛ 6, ИЛ 12; Ø Регуляторы активации, пролиферации и дифференцировки лимфоцитов: ИЛ 4, ИЛ 13, ИЛ 2 Ø Регуляторы иммунного воспаления: ИЛ 5, ИЛ 9, ИЛ 10, ИЛ 12 Ø Факторы роста и дифференцировки: ИЛ 3, ИЛ 7, ИЛ 11
 К цитокинам относятся: ►интерлейкины (ИЛ) ►факторы некроза опухолей (ФНО) ►трансформирующие ростовые факторы ►колониестимулирующие факторы (КСФ) ►хемокины ►интерфероны (ИФН)
К цитокинам относятся: ►интерлейкины (ИЛ) ►факторы некроза опухолей (ФНО) ►трансформирующие ростовые факторы ►колониестимулирующие факторы (КСФ) ►хемокины ►интерфероны (ИФН)
 ИНТЕРЛЕЙКИНЫ • Цитокины, ответственные за межклеточные взаимодействия между клетками иммунной системы. • Описано свыше 30 интерлейкинов, которые обозначаются буквами ИЛ и цифрой (ИЛ-1 ИЛ 30) или английской абревиатурой (например MIF). • Продуцируются макрофагами, Т-лимфоцитами, нейтрофилами, тучными клетками, базофилами, эндотелиоцитами и др. клетками при стимуляции антигенами. Все являются гликопротеидами
ИНТЕРЛЕЙКИНЫ • Цитокины, ответственные за межклеточные взаимодействия между клетками иммунной системы. • Описано свыше 30 интерлейкинов, которые обозначаются буквами ИЛ и цифрой (ИЛ-1 ИЛ 30) или английской абревиатурой (например MIF). • Продуцируются макрофагами, Т-лимфоцитами, нейтрофилами, тучными клетками, базофилами, эндотелиоцитами и др. клетками при стимуляции антигенами. Все являются гликопротеидами
 ФАКТОРЫ НЕКРОЗА ОПУХОЛЕЙ (ФНО) Имеется два вида ФНО. Оба относятся к воспалительным цитокинам. Рецепторы к ФНО присутствуют на большинстве типов клеток. 1. ФНО-альфа (кахексин). Продуцируется многими клетками, включая моноциты, Т- и В-лимфоциты. Стимулирует местное воспаление, синдром септического шока, вызывает лихорадку, повреждает клетки, в том числе и опухлевые. В больших концентрациях приводит к кахексии. Способствует активации Т- и В-лимфоцитов, продукции ИЛ-1 и ИЛ-6, экспрессии молекул ГКГ. 2. ФНО-бета (лимфотоксин). Секретируется Т- и Влимфоцитами. Также является медиатором воспаления, но основная функция – индукция апоптоза у клетокмишеней.
ФАКТОРЫ НЕКРОЗА ОПУХОЛЕЙ (ФНО) Имеется два вида ФНО. Оба относятся к воспалительным цитокинам. Рецепторы к ФНО присутствуют на большинстве типов клеток. 1. ФНО-альфа (кахексин). Продуцируется многими клетками, включая моноциты, Т- и В-лимфоциты. Стимулирует местное воспаление, синдром септического шока, вызывает лихорадку, повреждает клетки, в том числе и опухлевые. В больших концентрациях приводит к кахексии. Способствует активации Т- и В-лимфоцитов, продукции ИЛ-1 и ИЛ-6, экспрессии молекул ГКГ. 2. ФНО-бета (лимфотоксин). Секретируется Т- и Влимфоцитами. Также является медиатором воспаления, но основная функция – индукция апоптоза у клетокмишеней.
 РОСТОВЫЕ ФАКТОРЫ • Трансформирующий ростовой фактор-β (TGF-β – transforming growth factor- β) – иммуносупрессор, подавляет иммунный ответ, когда теряется его необходимость (например, при ликвидации инфекции). • Основная функция – подавление роста и активности Т-лимфоцитов. Также подавляет функции макрофагов, В-лимфоцитов, нейтрофилов, ЕК. • Продуцируется многими типами клеток, включая В- и Т-лимфоцитами, моноцитами.
РОСТОВЫЕ ФАКТОРЫ • Трансформирующий ростовой фактор-β (TGF-β – transforming growth factor- β) – иммуносупрессор, подавляет иммунный ответ, когда теряется его необходимость (например, при ликвидации инфекции). • Основная функция – подавление роста и активности Т-лимфоцитов. Также подавляет функции макрофагов, В-лимфоцитов, нейтрофилов, ЕК. • Продуцируется многими типами клеток, включая В- и Т-лимфоцитами, моноцитами.
 КОЛОНИЕСТИМУЛИРУЮЩИЕ ФАКТОРЫ (КСФ) • Цитокины кровотворения. Стимулируют процесс образования колоний миелоидных и моноцитарных клеток в костном мозге. • Продуцируются стромальными клетками кроветворных и лимфоидных органов, моноцитами, Ти В-лимфоцитами. • По специфичности различают три типа КСФ, усиливающих рост, дифференцировку и активацию: üГранулоцитов (КСФ-Г) üМоноцитов (КСФ-М) üГранулоцитов и моноцитов (КСФ-ГМ)
КОЛОНИЕСТИМУЛИРУЮЩИЕ ФАКТОРЫ (КСФ) • Цитокины кровотворения. Стимулируют процесс образования колоний миелоидных и моноцитарных клеток в костном мозге. • Продуцируются стромальными клетками кроветворных и лимфоидных органов, моноцитами, Ти В-лимфоцитами. • По специфичности различают три типа КСФ, усиливающих рост, дифференцировку и активацию: üГранулоцитов (КСФ-Г) üМоноцитов (КСФ-М) üГранулоцитов и моноцитов (КСФ-ГМ)
 ХЕМОКИНЫ • Название происходит от двух слов «хемотаксис» и «цитокин» , что отражает их основную функцию. • Являются пептидами (их более 50) и контролируют миграцию и активацию клеток иммунной системы (Гц, Мн, Тлф, Эф). Привлекают в очаг воспаления лимфоциты и лейкоциты из крови. • Продуцируются Гц, Мн, Лф, Тц, фибробластами, клетками эпителия чаще всего на действие ИЛ-1, ИЛ-6, а также при повреждениях. • Для хемокинов на клетках имеются специальные рецепторы. • Играют существенную роль при аллергии, инфекции, аутоиммунных болезнях, воспалении, опухлевом росте.
ХЕМОКИНЫ • Название происходит от двух слов «хемотаксис» и «цитокин» , что отражает их основную функцию. • Являются пептидами (их более 50) и контролируют миграцию и активацию клеток иммунной системы (Гц, Мн, Тлф, Эф). Привлекают в очаг воспаления лимфоциты и лейкоциты из крови. • Продуцируются Гц, Мн, Лф, Тц, фибробластами, клетками эпителия чаще всего на действие ИЛ-1, ИЛ-6, а также при повреждениях. • Для хемокинов на клетках имеются специальные рецепторы. • Играют существенную роль при аллергии, инфекции, аутоиммунных болезнях, воспалении, опухлевом росте.
 Интерфероны (INF) • Синтезируются неспецифическими клетками под влиянием вирусов, бактерий или других факторов, либо антигенстимулированными Т-лимфоцитами • 12 (у человека – 9) видов ИФ, обозначаемых греческими буквами • Объединены в три семейства: – Большинство – INF I типа (α, β, δ, ε, κ, τ, ω) – Тип II – INFγ (ранее – иммунный), – Тип III – INFλ 1, INFλ 2, INFλ 3 • Обладают противовирусной, противоопухолевой и иммунорегуляторной активностью
Интерфероны (INF) • Синтезируются неспецифическими клетками под влиянием вирусов, бактерий или других факторов, либо антигенстимулированными Т-лимфоцитами • 12 (у человека – 9) видов ИФ, обозначаемых греческими буквами • Объединены в три семейства: – Большинство – INF I типа (α, β, δ, ε, κ, τ, ω) – Тип II – INFγ (ранее – иммунный), – Тип III – INFλ 1, INFλ 2, INFλ 3 • Обладают противовирусной, противоопухолевой и иммунорегуляторной активностью
 Механизмы действия цитокинов Ø Интракринный механизм — действие цитокинов внутри клетки-продуцента. Ø Аутокринный механизм — действие секретируемого цитокина на саму секретирующую клетку Ø Паракринный механизм — на близкорасположенные клетки и ткани. Ø Эндокринный механизм — на расстоянии
Механизмы действия цитокинов Ø Интракринный механизм — действие цитокинов внутри клетки-продуцента. Ø Аутокринный механизм — действие секретируемого цитокина на саму секретирующую клетку Ø Паракринный механизм — на близкорасположенные клетки и ткани. Ø Эндокринный механизм — на расстоянии
 Клеточные рецепторы (CD-молекулы) • Для взаимодействия с цитокинами, комплементом, молекулами гормонов и др. на мембранах клеток системы иммунитета имеются рецепторы (антигены) – макромолекулы, обеспечивающие проведение сигнала в цитоплазму клетки, что приводит к ее активации, супрессии или апоптозу • Эти макромолекулы получили название CDантигенов (clusters of differentiation). Известно около 250 СD антигенов, обозначаемых буквами CD и цифрами (СD 1, CD 2 и тд. ). Некоторые из них являются маркерами определенных типов клеток
Клеточные рецепторы (CD-молекулы) • Для взаимодействия с цитокинами, комплементом, молекулами гормонов и др. на мембранах клеток системы иммунитета имеются рецепторы (антигены) – макромолекулы, обеспечивающие проведение сигнала в цитоплазму клетки, что приводит к ее активации, супрессии или апоптозу • Эти макромолекулы получили название CDантигенов (clusters of differentiation). Известно около 250 СD антигенов, обозначаемых буквами CD и цифрами (СD 1, CD 2 и тд. ). Некоторые из них являются маркерами определенных типов клеток
 Адгезивные молекулы • Одним из важнейших свойств клеток иммунной системы является их способность к миграции. • Это свойство реализуется прямым контактом и взаимодействием клеток между собой с помощью рецепторов, получивших общее название – АДГЕЗИНЫ. Адгезины постоянно присутствуют на мембране клеток или формируются на ней в процессе иммунного ответа. • Основой их реагирования является прилипание за счет сил физико-химических взаимодействий. Все адгезины играют ключевую роль в проникновении клеток иммунной системы в ткани.
Адгезивные молекулы • Одним из важнейших свойств клеток иммунной системы является их способность к миграции. • Это свойство реализуется прямым контактом и взаимодействием клеток между собой с помощью рецепторов, получивших общее название – АДГЕЗИНЫ. Адгезины постоянно присутствуют на мембране клеток или формируются на ней в процессе иммунного ответа. • Основой их реагирования является прилипание за счет сил физико-химических взаимодействий. Все адгезины играют ключевую роль в проникновении клеток иммунной системы в ткани.
 Основные группы адгезинов: ØНекоторые представители суперсемейства иммуноглобулинов ØСелектины ØИнтегрины ØМуцины ØКадгерины ØХемокины ØИ др.
Основные группы адгезинов: ØНекоторые представители суперсемейства иммуноглобулинов ØСелектины ØИнтегрины ØМуцины ØКадгерины ØХемокины ØИ др.
 Суперсемейство иммуноглобулинов • Включает молекулы белков у которых есть хотя бы один консервативный иммуноглобулиновый домен, состоящий из 70 -100 аминокислот. Т. е. они имеют сходство с молекулой Ig. • Суперсемейство включает более 70 молекул (молекулы МНС I и II классов, Т-клеточный рецептор, комплекс CD 3, корецепторы СD 4 и СD 8), • Адгезинами являются молекулы ICAM-1, ICAM-2, LFA-3, VCAM-1 и др. Молекулы ICAM (intercellular adhesion molecules) широко представлены на лейкоцитах и эндотелии сосудов и эпителии. Участвуют в воспалении и миграции лейкоцитов через стенки сосудов
Суперсемейство иммуноглобулинов • Включает молекулы белков у которых есть хотя бы один консервативный иммуноглобулиновый домен, состоящий из 70 -100 аминокислот. Т. е. они имеют сходство с молекулой Ig. • Суперсемейство включает более 70 молекул (молекулы МНС I и II классов, Т-клеточный рецептор, комплекс CD 3, корецепторы СD 4 и СD 8), • Адгезинами являются молекулы ICAM-1, ICAM-2, LFA-3, VCAM-1 и др. Молекулы ICAM (intercellular adhesion molecules) широко представлены на лейкоцитах и эндотелии сосудов и эпителии. Участвуют в воспалении и миграции лейкоцитов через стенки сосудов
 Селектины • Рецепторы поверхности лимфоцитов, нейтрофилов, моноцитов, эозинофилов, взаимодействующие с муциноподобными молекулами эндотелия сосудов. • Выделяют Е-селектин (на клетках эндотелия), Рселектин (на тромбоцитах), L-селектин (на лейкоцитах) • Обеспечивают начальный этап миграции клеток через эпителий – «роллинг-эффект» (эффект качения). • Участвуют в остановке клеток для их миграции через эндотелий сосудов.
Селектины • Рецепторы поверхности лимфоцитов, нейтрофилов, моноцитов, эозинофилов, взаимодействующие с муциноподобными молекулами эндотелия сосудов. • Выделяют Е-селектин (на клетках эндотелия), Рселектин (на тромбоцитах), L-селектин (на лейкоцитах) • Обеспечивают начальный этап миграции клеток через эпителий – «роллинг-эффект» (эффект качения). • Участвуют в остановке клеток для их миграции через эндотелий сосудов.
 Интегрины • Обеспечивают взаимодействие клеток с межклеточным веществом, связывают цитоскелет клеток с компонентами межклеточного матрикса. • Имеются на поверхности Т-лимфоцитов, моноцитов, макрофагов, дендритных клеток, нейтрофилов, компонентах внеклеточного матрикса. • Представлены двумя мембранными аминокислотными цепями • Обеспечивают адгезию ИКК крови к эндотелию сосудов, друг к другу, к внеклеточному матриксу и их миграцию в ткани.
Интегрины • Обеспечивают взаимодействие клеток с межклеточным веществом, связывают цитоскелет клеток с компонентами межклеточного матрикса. • Имеются на поверхности Т-лимфоцитов, моноцитов, макрофагов, дендритных клеток, нейтрофилов, компонентах внеклеточного матрикса. • Представлены двумя мембранными аминокислотными цепями • Обеспечивают адгезию ИКК крови к эндотелию сосудов, друг к другу, к внеклеточному матриксу и их миграцию в ткани.
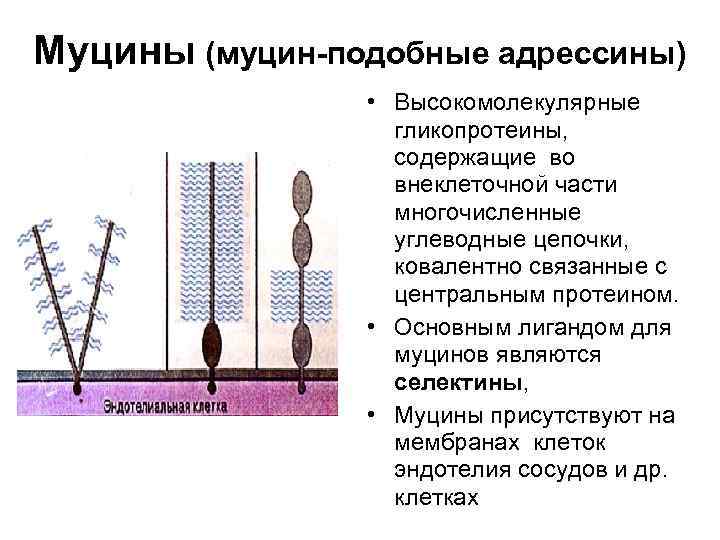 Муцины (муцин-подобные адрессины) • Высокомолекулярные гликопротеины, содержащие во внеклеточной части многочисленные углеводные цепочки, ковалентно связанные с центральным протеином. • Основным лигандом для муцинов являются селектины, • Муцины присутствуют на мембранах клеток эндотелия сосудов и др. клетках
Муцины (муцин-подобные адрессины) • Высокомолекулярные гликопротеины, содержащие во внеклеточной части многочисленные углеводные цепочки, ковалентно связанные с центральным протеином. • Основным лигандом для муцинов являются селектины, • Муцины присутствуют на мембранах клеток эндотелия сосудов и др. клетках
 Кадгерины • Кальцийзависимые адгезивные молекулы. Внеклеточные домены этих белков связывают ионы кальция. • Участвуют в структурной организации тканей, обеспечивают их целостность. • На иммуннокомпетентных клетках не обнаружены
Кадгерины • Кальцийзависимые адгезивные молекулы. Внеклеточные домены этих белков связывают ионы кальция. • Участвуют в структурной организации тканей, обеспечивают их целостность. • На иммуннокомпетентных клетках не обнаружены
 Хемокины • Группа молекул адгезии, обеспечивающая направленное движение ИКК согласно градиенту концентрации; • Участвуют в развитии клеточной фазы воспаления; • Способны связываться с элементами матрикса и рецепторами на поверхности клетки; • Вызывают активацию и изменение структуры цитоскелета клеток;
Хемокины • Группа молекул адгезии, обеспечивающая направленное движение ИКК согласно градиенту концентрации; • Участвуют в развитии клеточной фазы воспаления; • Способны связываться с элементами матрикса и рецепторами на поверхности клетки; • Вызывают активацию и изменение структуры цитоскелета клеток;
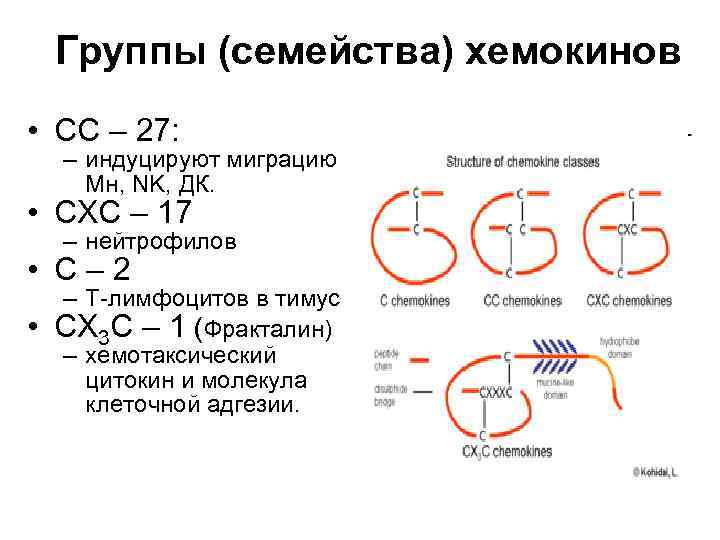 Группы (семейства) хемокинов • СС – 27: – индуцируют миграцию Мн, NK, ДК. • СХС – 17 – нейтрофилов • С– 2 • – Т-лимфоцитов в тимус СХ 3 С – 1 (Фракталин) – хемотаксический цитокин и молекула клеточной адгезии.
Группы (семейства) хемокинов • СС – 27: – индуцируют миграцию Мн, NK, ДК. • СХС – 17 – нейтрофилов • С– 2 • – Т-лимфоцитов в тимус СХ 3 С – 1 (Фракталин) – хемотаксический цитокин и молекула клеточной адгезии.
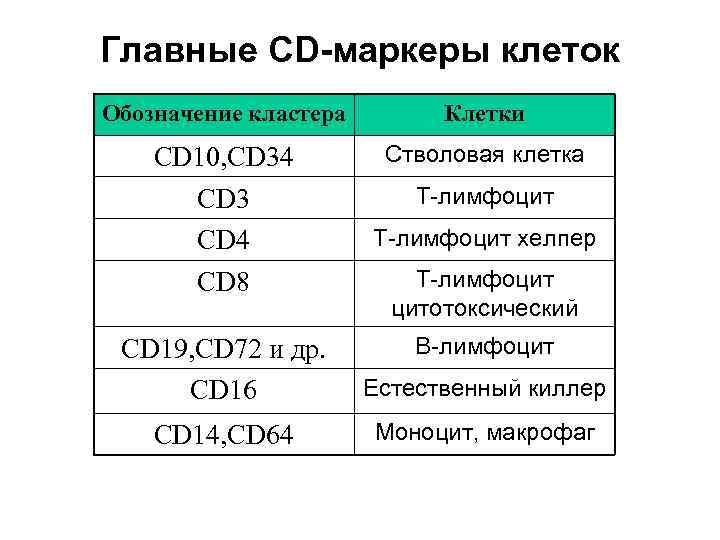 Главные CD-маркеры клеток Обозначение кластера Клетки СD 10, CD 34 CD 3 CD 4 CD 8 Стволовая клетка Т-лимфоцит хелпер Т-лимфоцит цитотоксический В-лимфоцит CD 19, CD 72 и др. CD 16 Естественный киллер CD 14, CD 64 Моноцит, макрофаг
Главные CD-маркеры клеток Обозначение кластера Клетки СD 10, CD 34 CD 3 CD 4 CD 8 Стволовая клетка Т-лимфоцит хелпер Т-лимфоцит цитотоксический В-лимфоцит CD 19, CD 72 и др. CD 16 Естественный киллер CD 14, CD 64 Моноцит, макрофаг
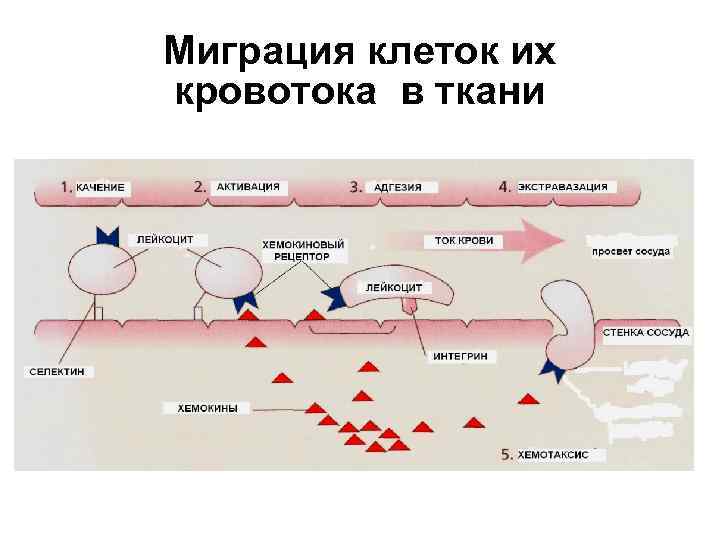
 РОЛЬ АДГЕЗИНОВ В РАЗВИТИИ ВОСПАЛЕНИЯ • Первый этап – под влиянием цитокинов на поверхности эндотелия и лейкоцитов появляются молекулы селектинов, которые тормозят движение лейкоцита, приближают его к эндотелию и он начинает «катиться» по его поверхности. • Второй этап – прикрепление. По мере приближения к очагу воспаления под влиянием хемокинов лейкоциты прилипают к эндотелию (распластываются). • Третий этап – трансмиграция. С помощью интегринов лейкоциты проникают между клетками эндотелия и попадают в ткань (воспалительный очаг).
РОЛЬ АДГЕЗИНОВ В РАЗВИТИИ ВОСПАЛЕНИЯ • Первый этап – под влиянием цитокинов на поверхности эндотелия и лейкоцитов появляются молекулы селектинов, которые тормозят движение лейкоцита, приближают его к эндотелию и он начинает «катиться» по его поверхности. • Второй этап – прикрепление. По мере приближения к очагу воспаления под влиянием хемокинов лейкоциты прилипают к эндотелию (распластываются). • Третий этап – трансмиграция. С помощью интегринов лейкоциты проникают между клетками эндотелия и попадают в ткань (воспалительный очаг).
 Взаимодействие клеток иммунной системы 1. Взаимодействие с клетками эндотелия (миграция клеток из сосудов в ткани). 2. Взаимодействие с элементами матрикса (миграция в тканях). 3. Взаимодействия клеток иммунной системы между собой (АПК, Т-лимфоциты, Влимфоциты). 4. Дистантные взаимодействия клеток иммунной системы между собой (цитокины). 5. Межсистемные взаимодействия (нейроэндокринная регуляция иммунной системы).
Взаимодействие клеток иммунной системы 1. Взаимодействие с клетками эндотелия (миграция клеток из сосудов в ткани). 2. Взаимодействие с элементами матрикса (миграция в тканях). 3. Взаимодействия клеток иммунной системы между собой (АПК, Т-лимфоциты, Влимфоциты). 4. Дистантные взаимодействия клеток иммунной системы между собой (цитокины). 5. Межсистемные взаимодействия (нейроэндокринная регуляция иммунной системы).
 Миграция клеток их кровотока в ткани
Миграция клеток их кровотока в ткани
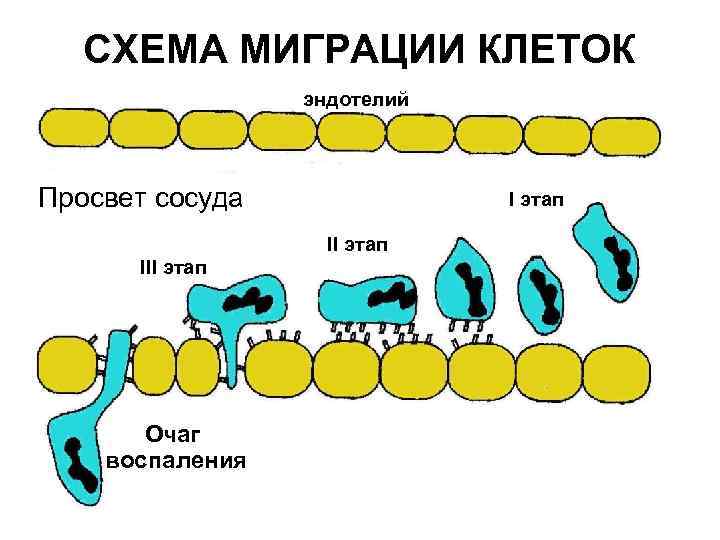 СХЕМА МИГРАЦИИ КЛЕТОК эндотелий Просвет сосуда I этап III этап Очаг воспаления
СХЕМА МИГРАЦИИ КЛЕТОК эндотелий Просвет сосуда I этап III этап Очаг воспаления
 Иммунологические феномены • • Иммунитет Аллергия Иммунологическая память Иммунологическая толерантность
Иммунологические феномены • • Иммунитет Аллергия Иммунологическая память Иммунологическая толерантность
 Иммунитет это совокупность защитных и приспособительных реакций организма, направленных на поддержание гомеостаза, на защиту от инфекций и других чужеродных агентов
Иммунитет это совокупность защитных и приспособительных реакций организма, направленных на поддержание гомеостаза, на защиту от инфекций и других чужеродных агентов
 Иммунитет: • Реакция древняя (возникла вместе с инфекцией • Универсальная (на всех этапах развития материи у всех особей без исключения) • Уникальная (встречается только у живых организмов) • Многокомпонентная и многообразная реакция в проявлениях
Иммунитет: • Реакция древняя (возникла вместе с инфекцией • Универсальная (на всех этапах развития материи у всех особей без исключения) • Уникальная (встречается только у живых организмов) • Многокомпонентная и многообразная реакция в проявлениях
 2 вида иммунитета • Естественный (врожденный) • Приобретенный (адаптивный)
2 вида иммунитета • Естественный (врожденный) • Приобретенный (адаптивный)
 Естественный (врожденный) иммунитет • Это такая форма невосприимчивости организма, которая осуществляется всей совокупностью биологических особенностей организма и которая не связана с явлением специфического иммунного ответа
Естественный (врожденный) иммунитет • Это такая форма невосприимчивости организма, которая осуществляется всей совокупностью биологических особенностей организма и которая не связана с явлением специфического иммунного ответа
 Врожденный иммунитет: • Видовой • Передается по наследству • Возникает без внешних воздействий, в результате реализации генома • Неспецифичен и неклонален • Проявляется сразу после попадания чужеродного агента Приобретенный иммунитет: • Индивидуальный • Не передаётся по наследству • Индуцирован • Специфичен • Проявляется не сразу В основе – иммунный ответ организма
Врожденный иммунитет: • Видовой • Передается по наследству • Возникает без внешних воздействий, в результате реализации генома • Неспецифичен и неклонален • Проявляется сразу после попадания чужеродного агента Приобретенный иммунитет: • Индивидуальный • Не передаётся по наследству • Индуцирован • Специфичен • Проявляется не сразу В основе – иммунный ответ организма
 Факторы врожденного иммунитета • Неиммунные – не связаны с иммунной системой • Иммунные – неспецифические факторы иммунной системы
Факторы врожденного иммунитета • Неиммунные – не связаны с иммунной системой • Иммунные – неспецифические факторы иммунной системы
 Неиммунные факторы • Барьерные свойства кожи и слизистых оболочек • Антимикробные (бактерицидные) свойства кожи и слизистых: – – Сальный секрет Молочная кислота, ионы тяжелых металлов пота Лизоцим Соляная кислота желудочного сока, желчь и др. • Нормальная микрофлора: – Конкуренция – Выделение бактериоцинов
Неиммунные факторы • Барьерные свойства кожи и слизистых оболочек • Антимикробные (бактерицидные) свойства кожи и слизистых: – – Сальный секрет Молочная кислота, ионы тяжелых металлов пота Лизоцим Соляная кислота желудочного сока, желчь и др. • Нормальная микрофлора: – Конкуренция – Выделение бактериоцинов
 Неиммунные факторы • Ареактивность клеток: – Отсутствие рецепторов (для вирусов и токсинов) – Отсутствие факторов роста для паразита • Гормональный баланс • Воспалительная реакция: – Температурная – Местная гипоксия – Ацидоз • Выделительная реакция
Неиммунные факторы • Ареактивность клеток: – Отсутствие рецепторов (для вирусов и токсинов) – Отсутствие факторов роста для паразита • Гормональный баланс • Воспалительная реакция: – Температурная – Местная гипоксия – Ацидоз • Выделительная реакция
 Иммунные факторы Гуморальные • Система комплемента • Лизоцим • Бета-лизины • Интерфероны • Белки острой фазы воспаления • Лактоферрин • Трансферрин и др. Клеточные • Фагоциты • Естественные киллеры
Иммунные факторы Гуморальные • Система комплемента • Лизоцим • Бета-лизины • Интерфероны • Белки острой фазы воспаления • Лактоферрин • Трансферрин и др. Клеточные • Фагоциты • Естественные киллеры
 Система комплемента (С) - Совокупность белков крови (более 30 белков и белковых комплексов), циркулирующих в неактивном состоянии и объединенных каскадным реагированием при их активации
Система комплемента (С) - Совокупность белков крови (более 30 белков и белковых комплексов), циркулирующих в неактивном состоянии и объединенных каскадным реагированием при их активации
 Состав системы комплемента: • Компоненты: С 1, С 2, С 3 …С 9 (всего 11 белков, компонент С 1 – 3 белка: q, r, s) • Факторы B, D, P • Регуляторные белки: С 1 -ингибитор, фактор I (С 3 в-инактиватор), фактор Н – действует вместе с фактором I • Рецепторы белков комплемента (на клетках)- CR 1 -CR 4
Состав системы комплемента: • Компоненты: С 1, С 2, С 3 …С 9 (всего 11 белков, компонент С 1 – 3 белка: q, r, s) • Факторы B, D, P • Регуляторные белки: С 1 -ингибитор, фактор I (С 3 в-инактиватор), фактор Н – действует вместе с фактором I • Рецепторы белков комплемента (на клетках)- CR 1 -CR 4
 Активация комплемента • Процесс расщепления белка на 2 фрагмента (а и в) либо изменение его конформации, в результате чего белок приобретает способность активировать последующий компонент системы. Протекает каскадно.
Активация комплемента • Процесс расщепления белка на 2 фрагмента (а и в) либо изменение его конформации, в результате чего белок приобретает способность активировать последующий компонент системы. Протекает каскадно.
 Пути активации С • Классический • Альтернативный • Лектиновый
Пути активации С • Классический • Альтернативный • Лектиновый
 Классический путь • Протекает в иммунном организме • Активаторы: – Иммунный комплекс (Аг-Ат) – Агрегированные Ig – СРБ+ПС • Участвуют все 9 компонентов • Основные ферментативно активные комплексы: – С 1 -эстераза – С 3 -конвертаза (С 4 в. С 2 а) – Мембраноатакующий комплекс (МАК): С 5 в 6789
Классический путь • Протекает в иммунном организме • Активаторы: – Иммунный комплекс (Аг-Ат) – Агрегированные Ig – СРБ+ПС • Участвуют все 9 компонентов • Основные ферментативно активные комплексы: – С 1 -эстераза – С 3 -конвертаза (С 4 в. С 2 а) – Мембраноатакующий комплекс (МАК): С 5 в 6789
 Альтернативный путь • Протекает в неиммунном организме (без участия комплекса Аг-Ат) • Основные активаторы – бактериальные продукты (ЛПС, ПС) • Не участвуют ранние белки (С 1, С 4, С 2) • Участвуют факторы B, D, P и поздние белки (С 3, С 5 -С 9).
Альтернативный путь • Протекает в неиммунном организме (без участия комплекса Аг-Ат) • Основные активаторы – бактериальные продукты (ЛПС, ПС) • Не участвуют ранние белки (С 1, С 4, С 2) • Участвуют факторы B, D, P и поздние белки (С 3, С 5 -С 9).
 Лектиновый путь • Инициируется маннансвязывающим белком (МСБ) - лектином крови, структурным аналогом С 1 q. • МСБ способен распознавать некоторые углеводы на поверхности микробов (например маннозу), связывается с маннозой поверхности микробной клетки с последующим расщеплением С 4 -, С 2 компонентов комплемента и образованием СЗ-конвертазы классического пути (С 4 b 2 a).
Лектиновый путь • Инициируется маннансвязывающим белком (МСБ) - лектином крови, структурным аналогом С 1 q. • МСБ способен распознавать некоторые углеводы на поверхности микробов (например маннозу), связывается с маннозой поверхности микробной клетки с последующим расщеплением С 4 -, С 2 компонентов комплемента и образованием СЗ-конвертазы классического пути (С 4 b 2 a).
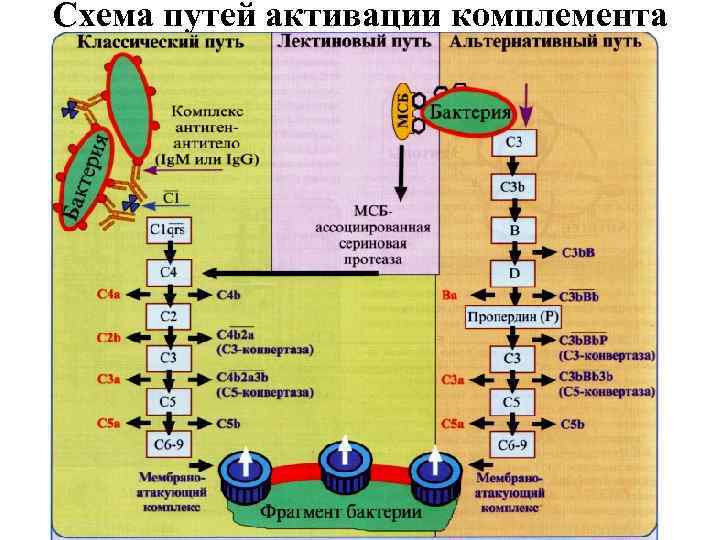 Схема путей активации комплемента
Схема путей активации комплемента
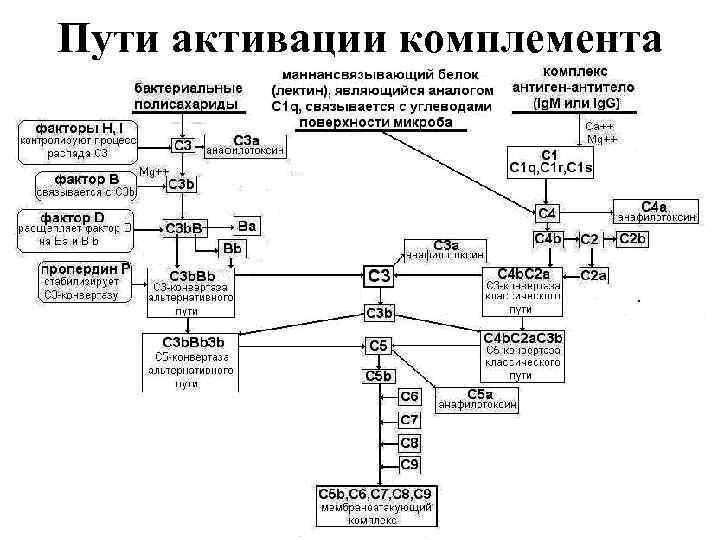 Пути активации комплемента
Пути активации комплемента
 Функции системы комплемента • Лизис мембран бактерий (бактериолиз) • Цитолиз (лизис соматических клеток) – в цитотоксических и аутоиммунных реакциях • Нейтрализация вирусов – С 1, С 4, С 2 • Хемотаксическая активность для фагоцитов – С 5 а, С 3 а • Опсонизация объектов фагоцитоза (С 3 в)
Функции системы комплемента • Лизис мембран бактерий (бактериолиз) • Цитолиз (лизис соматических клеток) – в цитотоксических и аутоиммунных реакциях • Нейтрализация вирусов – С 1, С 4, С 2 • Хемотаксическая активность для фагоцитов – С 5 а, С 3 а • Опсонизация объектов фагоцитоза (С 3 в)
 Функции системы комплемента • Анафилатоксическая активность (С 3 а, С 5 а) – индукция воспаления: – адсорбция на рецепторах тучных клеток и базофилах, индукция их дегрануляции – прямое воздействие на гладкие мышечные волокна и повышение проницаемости сосудов – активация фагоцитов в выбросу лизосомальных ферментов • Иммунорегуляция (С 3 а, С 5 а) – активация и ингибиция Т-лимфоцитов при взаимодействии с рецепторами
Функции системы комплемента • Анафилатоксическая активность (С 3 а, С 5 а) – индукция воспаления: – адсорбция на рецепторах тучных клеток и базофилах, индукция их дегрануляции – прямое воздействие на гладкие мышечные волокна и повышение проницаемости сосудов – активация фагоцитов в выбросу лизосомальных ферментов • Иммунорегуляция (С 3 а, С 5 а) – активация и ингибиция Т-лимфоцитов при взаимодействии с рецепторами
 Регуляторные механизмы системы комплемента А. Ферменты плазмы крови: расщепляют и инактивируют компоненты комплемента • Фактор I – расщепляет С 3 b как в растворе, так и на поверхности клетки – расщепленный С 3 b не способен функционировать в составе комплекса С 4 b 2 a 3 b – образуются биоактивные продукты расщепления: С 3 с и С 3 е – фактор I расщепляет также С 4 b, но только в присутствии С 4 b связывающего белка • Инактиватор анафилатоксинов (сывороточная карбоксипептидаза N) - разрушает С 3 а, С 5 а, С 4 а
Регуляторные механизмы системы комплемента А. Ферменты плазмы крови: расщепляют и инактивируют компоненты комплемента • Фактор I – расщепляет С 3 b как в растворе, так и на поверхности клетки – расщепленный С 3 b не способен функционировать в составе комплекса С 4 b 2 a 3 b – образуются биоактивные продукты расщепления: С 3 с и С 3 е – фактор I расщепляет также С 4 b, но только в присутствии С 4 b связывающего белка • Инактиватор анафилатоксинов (сывороточная карбоксипептидаза N) - разрушает С 3 а, С 5 а, С 4 а
 Б. Белки плазмы крови: связывают и угнетают активность компонентов комплемента • С 1 INH - (альфа-глобулин плазмы) – угнетает активность С 1 -эстеразы путем диссоциации комплекса на субъединицы. Ингибирует также плазмин, калликреин, активированный фактор Хагемана и Xia фактор свертывания – клиническая значимость: недостаточность ингибитора ассоциируется с врожденным ангионевротическим отеком • Фактор H - работает вместе с фактором I, связывая и инактивируя С 3 b. При этом образуется неактивный i. C 3 b • C 4 b. BP - контролирует активность связанного с клеточной мембраной С 4 b. Подобно фактору Н в случае с С 3 b, С 4 b. BP связывается с С 4 b и делает его доступным атаке фактора I • S-белок (витронектин) - защищает клетки-мишени от лизиса путем связывания неустойчивого комплекса С 5 b 67. – результирующий комплекс не может встроиться в мембрану
Б. Белки плазмы крови: связывают и угнетают активность компонентов комплемента • С 1 INH - (альфа-глобулин плазмы) – угнетает активность С 1 -эстеразы путем диссоциации комплекса на субъединицы. Ингибирует также плазмин, калликреин, активированный фактор Хагемана и Xia фактор свертывания – клиническая значимость: недостаточность ингибитора ассоциируется с врожденным ангионевротическим отеком • Фактор H - работает вместе с фактором I, связывая и инактивируя С 3 b. При этом образуется неактивный i. C 3 b • C 4 b. BP - контролирует активность связанного с клеточной мембраной С 4 b. Подобно фактору Н в случае с С 3 b, С 4 b. BP связывается с С 4 b и делает его доступным атаке фактора I • S-белок (витронектин) - защищает клетки-мишени от лизиса путем связывания неустойчивого комплекса С 5 b 67. – результирующий комплекс не может встроиться в мембрану
 В. Регуляторные белки клеточных мембран • Фактор, ускоряющий разрушение (DAF) и мембранный кофакторный белок (MCP) выполняют те же функции, что фактор Н и C 4 b. BP, но действуют на С 3 b и C 4 b на поверхности клетки. • DAF препятствует образованию С 3 конвертаз путем ускорения диссоциации С 4 b с С 2 a и C 3 b c Bb – Клиническая значимость: дефицит DAF ассоциируется с пароксизмальной ночной гемоглобинурией - эритроциты таких людей характеризуются повышенной чувствительностью к комплемент-опосредованному лизису • MCP - интегральный мембранный белок, способствующий протеолитической инактивации С 3 b и C 4 b фактором I. • Гомологичный ограничивающий фактор (HRF) или С 8 связывающий белок; препятствует ассоциации С 8 с комплексом С 5 b 67.
В. Регуляторные белки клеточных мембран • Фактор, ускоряющий разрушение (DAF) и мембранный кофакторный белок (MCP) выполняют те же функции, что фактор Н и C 4 b. BP, но действуют на С 3 b и C 4 b на поверхности клетки. • DAF препятствует образованию С 3 конвертаз путем ускорения диссоциации С 4 b с С 2 a и C 3 b c Bb – Клиническая значимость: дефицит DAF ассоциируется с пароксизмальной ночной гемоглобинурией - эритроциты таких людей характеризуются повышенной чувствительностью к комплемент-опосредованному лизису • MCP - интегральный мембранный белок, способствующий протеолитической инактивации С 3 b и C 4 b фактором I. • Гомологичный ограничивающий фактор (HRF) или С 8 связывающий белок; препятствует ассоциации С 8 с комплексом С 5 b 67.
 Дефекты системы комплемента • Дефект ингибитора С 1 – наследственный ангионевротический отек • С 1, С 4, С 2 – аутоиммунные заболевания, нарушение удаления ИК • С 3 – рецидивирующие гнойные инфекции • С 5, 6, 7 – бактериальные инфекции (в основном, вызванные Neisseria)
Дефекты системы комплемента • Дефект ингибитора С 1 – наследственный ангионевротический отек • С 1, С 4, С 2 – аутоиммунные заболевания, нарушение удаления ИК • С 3 – рецидивирующие гнойные инфекции • С 5, 6, 7 – бактериальные инфекции (в основном, вызванные Neisseria)
 Лизоцим фермент муромидаза, расщепляет муреин клеточных стенок грамположительных бактерий содержится: - на слизистых (фактор местного иммунитета) - в лизосомах фагоцитов (фактор внутриклеточной бактерицидности) - в сыворотке (меньше)
Лизоцим фермент муромидаза, расщепляет муреин клеточных стенок грамположительных бактерий содержится: - на слизистых (фактор местного иммунитета) - в лизосомах фагоцитов (фактор внутриклеточной бактерицидности) - в сыворотке (меньше)
 Белки острой фазы • • • фибриноген, С-реактивный белок, амилоидный белок плазмы, маннозо-связывающий белок, альфа-1 -антитрипсин и др. • Эти факторы постоянно присутствуют в норме в плазме крови, однако при системном воспалении, под воздействием ИЛ 1, ФНОа и, особенно, ИЛ 6, их синтез клетками ретикуло-эндотелиальной системы и гепатоцитами повышается на несколько порядков. Определение некоторых белков острой фазы (ЦРБ) применяется в клинике для оценки интенсивности воспаления.
Белки острой фазы • • • фибриноген, С-реактивный белок, амилоидный белок плазмы, маннозо-связывающий белок, альфа-1 -антитрипсин и др. • Эти факторы постоянно присутствуют в норме в плазме крови, однако при системном воспалении, под воздействием ИЛ 1, ФНОа и, особенно, ИЛ 6, их синтез клетками ретикуло-эндотелиальной системы и гепатоцитами повышается на несколько порядков. Определение некоторых белков острой фазы (ЦРБ) применяется в клинике для оценки интенсивности воспаления.
 С-реактивный белок. Амилоидный белок плазмы • Оба фактора относят к семейству пентраксинов (состоят из 5 субъединиц) • По химическому строению и свойствам они относятся к лектинам С-типа, т. е. связываются с углеводными молекулами на поверхности клеток микробов • При связывании активируют комплемент по классическому и альтернативному пути. • Связанный ЦРБ является хемоаттрактантом и опсонином для нейтрофилов. • При деградации пентраксинов высвобождаются фрагменты, активирующие макрофаги и стимулирующие синтез провоспалительных цитокинов.
С-реактивный белок. Амилоидный белок плазмы • Оба фактора относят к семейству пентраксинов (состоят из 5 субъединиц) • По химическому строению и свойствам они относятся к лектинам С-типа, т. е. связываются с углеводными молекулами на поверхности клеток микробов • При связывании активируют комплемент по классическому и альтернативному пути. • Связанный ЦРБ является хемоаттрактантом и опсонином для нейтрофилов. • При деградации пентраксинов высвобождаются фрагменты, активирующие макрофаги и стимулирующие синтез провоспалительных цитокинов.
 Маннозо-связывающий белок • Относится к семейству коллектинов (по структуре напоминает С 1 q). Каждая цепь содержит коллагеноподобный участок и С-лектиновый участок, специфичный к терминальным сахарам микробов (маннозе, фукозе, глюкозамину). • При связывании соответствующих сахаров на фрагментах клеточной стенки микробов белок изменяет конформацию и превращается в сериновую протеазу. – Этот фермент способен активировать протеазы, ассоциированные с маннозо-связывающим белком (запуск лектинового пути активации комплемента), а также расщеплять факторы С 2 и С 4 (запуск классического пути активации системы комплемента).
Маннозо-связывающий белок • Относится к семейству коллектинов (по структуре напоминает С 1 q). Каждая цепь содержит коллагеноподобный участок и С-лектиновый участок, специфичный к терминальным сахарам микробов (маннозе, фукозе, глюкозамину). • При связывании соответствующих сахаров на фрагментах клеточной стенки микробов белок изменяет конформацию и превращается в сериновую протеазу. – Этот фермент способен активировать протеазы, ассоциированные с маннозо-связывающим белком (запуск лектинового пути активации комплемента), а также расщеплять факторы С 2 и С 4 (запуск классического пути активации системы комплемента).
 Интерфероны - группа белков, обладающих противовирусной активностью. Синтезируются эукариотическими клетками в ответ на внедрение ряда биологических агентов
Интерфероны - группа белков, обладающих противовирусной активностью. Синтезируются эукариотическими клетками в ответ на внедрение ряда биологических агентов
 Транспортные белки • Лактоферрин • Трансферрин • Церулоплазмин – Обладают бактериостатическим действием вследствие конкуренции с микроорганизмами на Fe, Cu, которые являются для них факторами роста
Транспортные белки • Лактоферрин • Трансферрин • Церулоплазмин – Обладают бактериостатическим действием вследствие конкуренции с микроорганизмами на Fe, Cu, которые являются для них факторами роста
 Клетки системы врожденного иммунитета Миелоидной природы 1. Мононуклеарные лейкоциты • Макрофаги, моноциты 2. Полиморфноядерные лейкоциты (гранулоциты) • Нейтрофилы • Эозинофилы • Базофилы 3. Тучные клетки 4. Дендритные клетки Лимфоидной природы 1. Естественные киллеры (ЕК) Лимфоциты с двойственной функцией 2. γδ T лимфоциты 3. B-1 B лимфоциты
Клетки системы врожденного иммунитета Миелоидной природы 1. Мононуклеарные лейкоциты • Макрофаги, моноциты 2. Полиморфноядерные лейкоциты (гранулоциты) • Нейтрофилы • Эозинофилы • Базофилы 3. Тучные клетки 4. Дендритные клетки Лимфоидной природы 1. Естественные киллеры (ЕК) Лимфоциты с двойственной функцией 2. γδ T лимфоциты 3. B-1 B лимфоциты
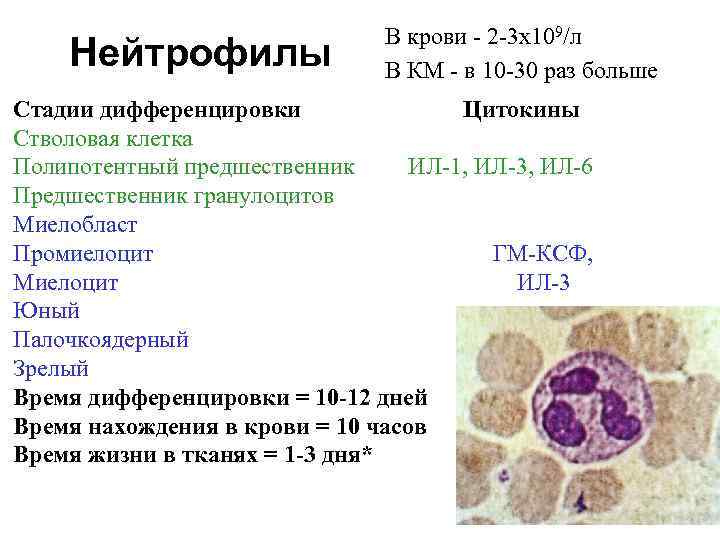 Нейтрофилы В крови - 2 -3 х109/л В КМ - в 10 -30 раз больше Стадии дифференцировки Цитокины Стволовая клетка Полипотентный предшественник ИЛ-1, ИЛ-3, ИЛ-6 Предшественник гранулоцитов Миелобласт Промиелоцит ГМ-КСФ, Миелоцит ИЛ-3 Юный Палочкоядерный Зрелый Время дифференцировки = 10 -12 дней Время нахождения в крови = 10 часов Время жизни в тканях = 1 -3 дня*
Нейтрофилы В крови - 2 -3 х109/л В КМ - в 10 -30 раз больше Стадии дифференцировки Цитокины Стволовая клетка Полипотентный предшественник ИЛ-1, ИЛ-3, ИЛ-6 Предшественник гранулоцитов Миелобласт Промиелоцит ГМ-КСФ, Миелоцит ИЛ-3 Юный Палочкоядерный Зрелый Время дифференцировки = 10 -12 дней Время нахождения в крови = 10 часов Время жизни в тканях = 1 -3 дня*
 Маркеры нейтрофилов 1. Ферменты: • миелопероксидаза • аминопептидаза • щелочная фосфатаза 2. Мембранные антигены: • ГКГС I класса • Интегрины бета 1: LFA 1, Mac 1; • CD 14, 31, 65, 66, 92 3. Рецепторы: • ТПР • для Fc фрагмента Ig. G 2 и 3 - CD 32, CD 16 • для факторов комплемента - CR 1, 2, 3 • для хемотаксинов - формил-Мет-Лей-Фен-пептидов, ИЛ 8 и др. CXC хемокинов, С 3 а и С 5 а; • для гормонов, нейромедиаторов.
Маркеры нейтрофилов 1. Ферменты: • миелопероксидаза • аминопептидаза • щелочная фосфатаза 2. Мембранные антигены: • ГКГС I класса • Интегрины бета 1: LFA 1, Mac 1; • CD 14, 31, 65, 66, 92 3. Рецепторы: • ТПР • для Fc фрагмента Ig. G 2 и 3 - CD 32, CD 16 • для факторов комплемента - CR 1, 2, 3 • для хемотаксинов - формил-Мет-Лей-Фен-пептидов, ИЛ 8 и др. CXC хемокинов, С 3 а и С 5 а; • для гормонов, нейромедиаторов.
 Функции нейтрофилов 1. Противомикробные: • • важнейший мобильный элемент иммунной системы фагоцитоз секреция противомикробных веществ регуляция воспаления (синтез цитокинов, хемокинов и медиаторов). 2. Цитотоксичность: • по механизму АЗКЦ 3. Трофическая: • Большинство нейтрофилов не покидают КМ • Остальные проникают в ткани и погибают от апоптоза • ~1 % выходит в ротовую полость через зубо-десневые щели.
Функции нейтрофилов 1. Противомикробные: • • важнейший мобильный элемент иммунной системы фагоцитоз секреция противомикробных веществ регуляция воспаления (синтез цитокинов, хемокинов и медиаторов). 2. Цитотоксичность: • по механизму АЗКЦ 3. Трофическая: • Большинство нейтрофилов не покидают КМ • Остальные проникают в ткани и погибают от апоптоза • ~1 % выходит в ротовую полость через зубо-десневые щели.
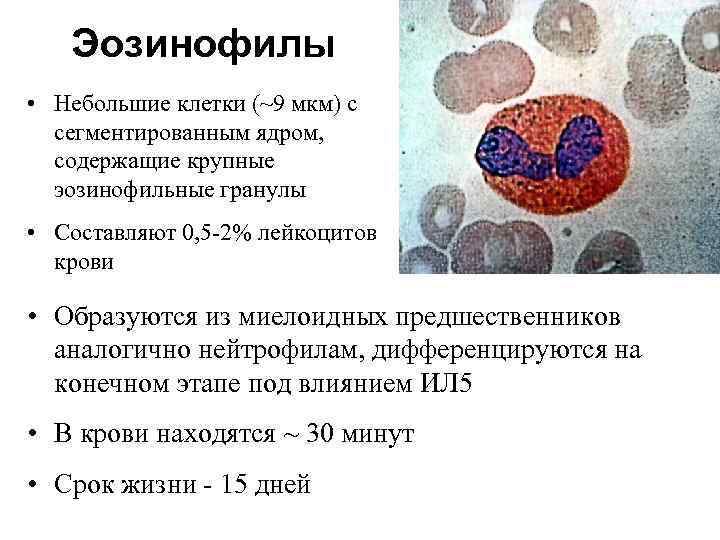 Эозинофилы • Небольшие клетки (~9 мкм) с сегментированным ядром, содержащие крупные эозинофильные гранулы • Составляют 0, 5 -2% лейкоцитов крови • Образуются из миелоидных предшественников аналогично нейтрофилам, дифференцируются на конечном этапе под влиянием ИЛ 5 • В крови находятся ~ 30 минут • Срок жизни - 15 дней
Эозинофилы • Небольшие клетки (~9 мкм) с сегментированным ядром, содержащие крупные эозинофильные гранулы • Составляют 0, 5 -2% лейкоцитов крови • Образуются из миелоидных предшественников аналогично нейтрофилам, дифференцируются на конечном этапе под влиянием ИЛ 5 • В крови находятся ~ 30 минут • Срок жизни - 15 дней
 Эозинофилы Маркеры: 1. Ферменты: • кислая фосфатаза, • арилсульфатаза, • эластаза, • миелопероксидаза 2. Основной белок 3. Рецепторы • для Fc фрагментов Ig. G II и Ig. E II (CD 32 и CD 23) • для факторов комплемента • для хемокинов (эотаксина) Функции: 1. внеклеточный цитолиз (против паразитов) 2. регуляция аллергического воспаления
Эозинофилы Маркеры: 1. Ферменты: • кислая фосфатаза, • арилсульфатаза, • эластаза, • миелопероксидаза 2. Основной белок 3. Рецепторы • для Fc фрагментов Ig. G II и Ig. E II (CD 32 и CD 23) • для факторов комплемента • для хемокинов (эотаксина) Функции: 1. внеклеточный цитолиз (против паразитов) 2. регуляция аллергического воспаления
 Моноциты Макрофаги Всего 1011 шт. Моноциты крови: 2 -8%, 500 - 1000 /мм 3 Стадии дифференцировки Цитокины Стволовая клетка Полипотентный предшественник ИЛ-1, ИЛ-3, ИЛ-6 Предшественник моноцитов Монобласт Промоноцит M-КСФ, ГМ-КСФ, Моноцит ИЛ-3 Макрофаг (Дендритная клетка) Время дифференцировки = 8 -10 дней Время нахождения в крови = 1 -4 дня Время жизни в тканях = месяцы
Моноциты Макрофаги Всего 1011 шт. Моноциты крови: 2 -8%, 500 - 1000 /мм 3 Стадии дифференцировки Цитокины Стволовая клетка Полипотентный предшественник ИЛ-1, ИЛ-3, ИЛ-6 Предшественник моноцитов Монобласт Промоноцит M-КСФ, ГМ-КСФ, Моноцит ИЛ-3 Макрофаг (Дендритная клетка) Время дифференцировки = 8 -10 дней Время нахождения в крови = 1 -4 дня Время жизни в тканях = месяцы
 Морфологические формы макрофагов • Крупные клетки (15 -25 мкм) с ядром неправильной формы и диффузным хроматином. Клетки полиморфные. • Бывают мобильные (свободные) и резидентные (фиксированные): • • • Купферовские клетки печени Альвеолярные макрофаги Перитонеальные макрофаги Мезенгиальные клетки почек Глиальные клетки ЦНС Макрофаги лимфоидных органов
Морфологические формы макрофагов • Крупные клетки (15 -25 мкм) с ядром неправильной формы и диффузным хроматином. Клетки полиморфные. • Бывают мобильные (свободные) и резидентные (фиксированные): • • • Купферовские клетки печени Альвеолярные макрофаги Перитонеальные макрофаги Мезенгиальные клетки почек Глиальные клетки ЦНС Макрофаги лимфоидных органов
 Маркеры макрофагов 1. Ферменты: • неспецифическая эстераза • бета-галактозидаза • 5 -нуклеотидаза • аминопептидаза 2. Антигены клеточной поверхности: • ГКГС I и II классов • Интегрины: бета 1 - VLA 1 -6; бета 2 - LFA 1, Mac 1 • ICAM 1, 2; CD 31, 45, 40, 86 и др. 3. Рецепторы: • для Fc фрагмента Ig. G - CD 64, CD 32, CD 16 • для факторов комплемента: CR 1, 2, 3, 4 • для фибрина, гормонов, нейромедиаторов и т. д.
Маркеры макрофагов 1. Ферменты: • неспецифическая эстераза • бета-галактозидаза • 5 -нуклеотидаза • аминопептидаза 2. Антигены клеточной поверхности: • ГКГС I и II классов • Интегрины: бета 1 - VLA 1 -6; бета 2 - LFA 1, Mac 1 • ICAM 1, 2; CD 31, 45, 40, 86 и др. 3. Рецепторы: • для Fc фрагмента Ig. G - CD 64, CD 32, CD 16 • для факторов комплемента: CR 1, 2, 3, 4 • для фибрина, гормонов, нейромедиаторов и т. д.
 Функции макрофагов 1. Фагоцитоз (клиренс апоптических клеток и ИК) 2. Внеклеточный цитолиз 3. Синтез защитных факторов 4. Процессинг и презентация антигена 5. Регуляция иммунного ответа
Функции макрофагов 1. Фагоцитоз (клиренс апоптических клеток и ИК) 2. Внеклеточный цитолиз 3. Синтез защитных факторов 4. Процессинг и презентация антигена 5. Регуляция иммунного ответа
 Дендритные клетки Группа клеток различной природы (КМ - локальные; миелоидные - лимфоидные), обладающих способностью эффективно захватывать, процессировать и презентировать антиген лимфоцитам. Уникальные свойства ДК: • высокая экспрессия молекул ГКГС I и II класса; • высокая экспрессия CD 80, CD 86 и CD 40; • способность продуцировать регуляторные цитокины, определяющие характер и тип иммунного ответа (ИЛ 12, ИФН-альфа); • высокая концентрация в лимфоидных органах; • диффузное распространение в организме (при большом общем количестве в тканях их мало);
Дендритные клетки Группа клеток различной природы (КМ - локальные; миелоидные - лимфоидные), обладающих способностью эффективно захватывать, процессировать и презентировать антиген лимфоцитам. Уникальные свойства ДК: • высокая экспрессия молекул ГКГС I и II класса; • высокая экспрессия CD 80, CD 86 и CD 40; • способность продуцировать регуляторные цитокины, определяющие характер и тип иммунного ответа (ИЛ 12, ИФН-альфа); • высокая концентрация в лимфоидных органах; • диффузное распространение в организме (при большом общем количестве в тканях их мало);
 ДЕНДРИТНЫЕ КЛЕТКИ • Отростчатые, ветвистые клетки; основные представители антигенпрезентирующих клеток. Они активируют наивные Т-лимфоциты при первом контакте их с антигеном. • Дендритные клетки костномозгового происхождения находятся в слизистых оболочках и коже (клетки Лангерганса) Они более активны, чем макрофаги, в индукции иммунного ответа. • Дендритные клетки некостномозгового происхождения - фолликулярные дендритные клетки находятся в первичных и вторичных фолликулах лимфоузлов, селезенки и лимфоидной ткани слизистых оболочек.
ДЕНДРИТНЫЕ КЛЕТКИ • Отростчатые, ветвистые клетки; основные представители антигенпрезентирующих клеток. Они активируют наивные Т-лимфоциты при первом контакте их с антигеном. • Дендритные клетки костномозгового происхождения находятся в слизистых оболочках и коже (клетки Лангерганса) Они более активны, чем макрофаги, в индукции иммунного ответа. • Дендритные клетки некостномозгового происхождения - фолликулярные дендритные клетки находятся в первичных и вторичных фолликулах лимфоузлов, селезенки и лимфоидной ткани слизистых оболочек.
 ДЕНДРИТНАЯ КЛЕТКА
ДЕНДРИТНАЯ КЛЕТКА
 Естественные киллеры (ЕК) • или нормальные киллеры (НК, NK). • Морфологически - большие (12 -15 мкм) гранулярные лимфоциты. • Составляют 5 -20% лимфоцитов периферической крови), • содержащие белок перфорин и сериновые эстеразы - гранзимы. • Накапливаются в тканях: печень - до 50% всех лимфоцитов; селезенка - 10%; легкие - 30%.
Естественные киллеры (ЕК) • или нормальные киллеры (НК, NK). • Морфологически - большие (12 -15 мкм) гранулярные лимфоциты. • Составляют 5 -20% лимфоцитов периферической крови), • содержащие белок перфорин и сериновые эстеразы - гранзимы. • Накапливаются в тканях: печень - до 50% всех лимфоцитов; селезенка - 10%; легкие - 30%.
 • ЕК происходят из КМ • Стадии дифференцировки: – стволовая клетка – предшественник лимфоцитов – предшественник тимоцитов – предшественник ЕК – ЕК. • Важную роль в развитии ЕК играют ИЛ 2, ИЛ 15 и ИЛ 21 (стимуляция), а также ИЛ 3 (угнетение). • Активируются ИЛ 2, ИЛ 18, ИФНгамма.
• ЕК происходят из КМ • Стадии дифференцировки: – стволовая клетка – предшественник лимфоцитов – предшественник тимоцитов – предшественник ЕК – ЕК. • Важную роль в развитии ЕК играют ИЛ 2, ИЛ 15 и ИЛ 21 (стимуляция), а также ИЛ 3 (угнетение). • Активируются ИЛ 2, ИЛ 18, ИФНгамма.
 Основное свойство ЕК • способность лизировать клетки-мишени без предварительного контакта с антигеном. Клетки-мишени для ЕК - практически все ядросодержащие клетки, но наибольшая активность проявляется по отношению к опухолевым и пораженным вирусом клеткам.
Основное свойство ЕК • способность лизировать клетки-мишени без предварительного контакта с антигеном. Клетки-мишени для ЕК - практически все ядросодержащие клетки, но наибольшая активность проявляется по отношению к опухолевым и пораженным вирусом клеткам.
 Цитотоксический механизм ЕК • Секреция белка перфорина. • Связываясь с мембраной клетки, перфорин формирует в ней трансмембранный канал, через который в клетку впрыскиваются гранзимы, активирующие в ней каспазы (сериновые протеазы), • Каспазы активируют эндонуклеазы → фрагментация ДНК → апоптоз. • Процесс лизиса осуществляется за 1 -2 часа – прямая (спонтанная) клеточноопосредованная цитотоксичность. • Действуют совместно с гамма-интерфероном и ИЛ-2
Цитотоксический механизм ЕК • Секреция белка перфорина. • Связываясь с мембраной клетки, перфорин формирует в ней трансмембранный канал, через который в клетку впрыскиваются гранзимы, активирующие в ней каспазы (сериновые протеазы), • Каспазы активируют эндонуклеазы → фрагментация ДНК → апоптоз. • Процесс лизиса осуществляется за 1 -2 часа – прямая (спонтанная) клеточноопосредованная цитотоксичность. • Действуют совместно с гамма-интерфероном и ИЛ-2
 Функции ЕК 1. Противоопухолевый иммунитет 2. Противовирусный иммунитет 3. Иммунитет против грибов и внутриклеточных паразитов 4. Регуляция иммунного ответа
Функции ЕК 1. Противоопухолевый иммунитет 2. Противовирусный иммунитет 3. Иммунитет против грибов и внутриклеточных паразитов 4. Регуляция иммунного ответа
 Распознавание в системе врожденного иммунитета 1. Возможности для распознавания ограничены геномом и высокой скоростью ответа микробы очень гетерогенны и вариабельны 2. Объекты для распознавания должны быть: • универсальными, • высоко консервативными • отсутствовать на собственных тканях 3. Требуется исключить повреждение собственных клеток и молекул • отсутствие мишени для распознавания • присутствие нейтрализующих факторов • одновременное распознавание своего (и запрещение атаки)
Распознавание в системе врожденного иммунитета 1. Возможности для распознавания ограничены геномом и высокой скоростью ответа микробы очень гетерогенны и вариабельны 2. Объекты для распознавания должны быть: • универсальными, • высоко консервативными • отсутствовать на собственных тканях 3. Требуется исключить повреждение собственных клеток и молекул • отсутствие мишени для распознавания • присутствие нейтрализующих факторов • одновременное распознавание своего (и запрещение атаки)
 Объекты (структуры, паттерны) распознавания – PAMP (от англ. – patogen-associated molecular patterns) 1. Пептидогликан грам+ бактерий 2. Липополисахарид грам- бактерий 3. Маннаны бактерий и грибов 4. Двунитевая РНК вирусов 5. Сp. G-содержащая ДНК бактерий и вирусов 6. Флагеллин бактерий и простейших 7. Формил-Мет-Лей-Фен-пептиды бактерий и др.
Объекты (структуры, паттерны) распознавания – PAMP (от англ. – patogen-associated molecular patterns) 1. Пептидогликан грам+ бактерий 2. Липополисахарид грам- бактерий 3. Маннаны бактерий и грибов 4. Двунитевая РНК вирусов 5. Сp. G-содержащая ДНК бактерий и вирусов 6. Флагеллин бактерий и простейших 7. Формил-Мет-Лей-Фен-пептиды бактерий и др.
 Рецепторы системы врожденного иммунитета 1. Рецепторы для распознавания микробов - результат эволюции/отбора и совершенствования полезных молекул - закреплены наследственно 2. Такие рецепторы имеют широкую специфичность: распознают скорее структуру вещества, чем конкретные детали (ПГ вообще) 3. Эти рецепторы стратегически экспрессированы на клетках системы врожденного иммунитета: • эпителий, • все типы эффекторных клеток системы врожденного иммунитета.
Рецепторы системы врожденного иммунитета 1. Рецепторы для распознавания микробов - результат эволюции/отбора и совершенствования полезных молекул - закреплены наследственно 2. Такие рецепторы имеют широкую специфичность: распознают скорее структуру вещества, чем конкретные детали (ПГ вообще) 3. Эти рецепторы стратегически экспрессированы на клетках системы врожденного иммунитета: • эпителий, • все типы эффекторных клеток системы врожденного иммунитета.
 4. Относятся к различным семействам биомолекул 5. При активации эти рецепторы немедленно вызывают эффекторный ответ: • уничтожение, лизис, фагоцитоз; • организацию воспаления; • организацию специфического иммунного ответа.
4. Относятся к различным семействам биомолекул 5. При активации эти рецепторы немедленно вызывают эффекторный ответ: • уничтожение, лизис, фагоцитоз; • организацию воспаления; • организацию специфического иммунного ответа.
 Рецепторы системы врожденного иммунитета 1. Лектины С-типа: 2. Пентраксины 3. Липид-трансферазы
Рецепторы системы врожденного иммунитета 1. Лектины С-типа: 2. Пентраксины 3. Липид-трансферазы
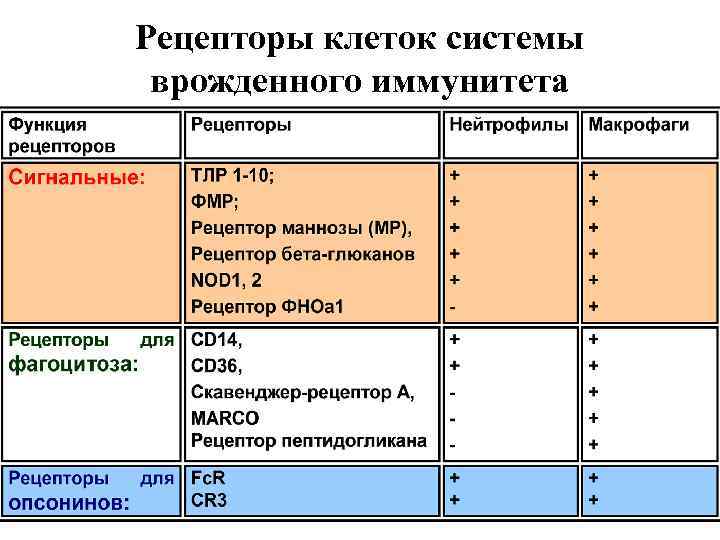 Рецепторы клеток системы врожденного иммунитета
Рецепторы клеток системы врожденного иммунитета
 TOLL-подобные рецепторы • ТПР появились около 500 миллионов лет назад; • участвуют в процессах эмбриогенеза и активации клеток системы врожденного иммунитета; • поверхностный рецептор Toll регулирует вентральную поляризацию эмбриона дрозофил и одновременно отвечает за устойчивость мух к инфекционным заболеваниям.
TOLL-подобные рецепторы • ТПР появились около 500 миллионов лет назад; • участвуют в процессах эмбриогенеза и активации клеток системы врожденного иммунитета; • поверхностный рецептор Toll регулирует вентральную поляризацию эмбриона дрозофил и одновременно отвечает за устойчивость мух к инфекционным заболеваниям.
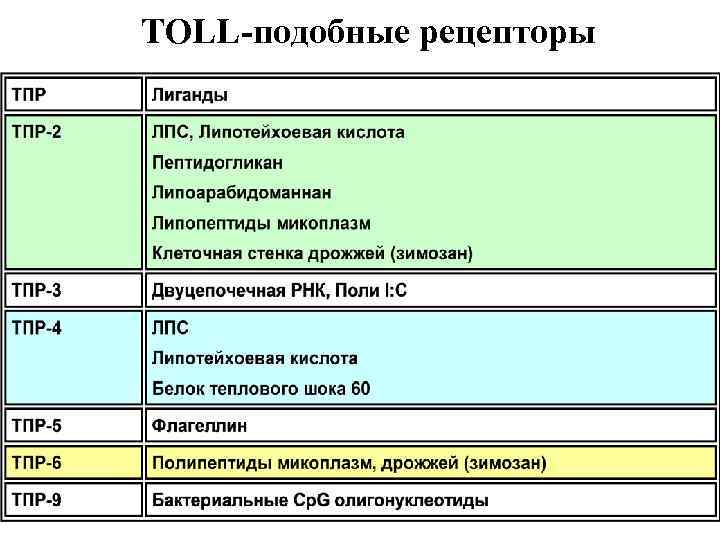 TOLL-подобные рецепторы
TOLL-подобные рецепторы
 TOLL-подобные рецепторы
TOLL-подобные рецепторы
 TOLL-подобные рецепторы Нейтрофилы и макрофаги экспрессируют практически все известные ТПР (1 -10). Исследования с помощью моноклональных антител и количественной РТ-ПЦР выявляют значительную экспрессию ТПР 1, умеренную 2, 4, 9, 5, 6, 7.
TOLL-подобные рецепторы Нейтрофилы и макрофаги экспрессируют практически все известные ТПР (1 -10). Исследования с помощью моноклональных антител и количественной РТ-ПЦР выявляют значительную экспрессию ТПР 1, умеренную 2, 4, 9, 5, 6, 7.
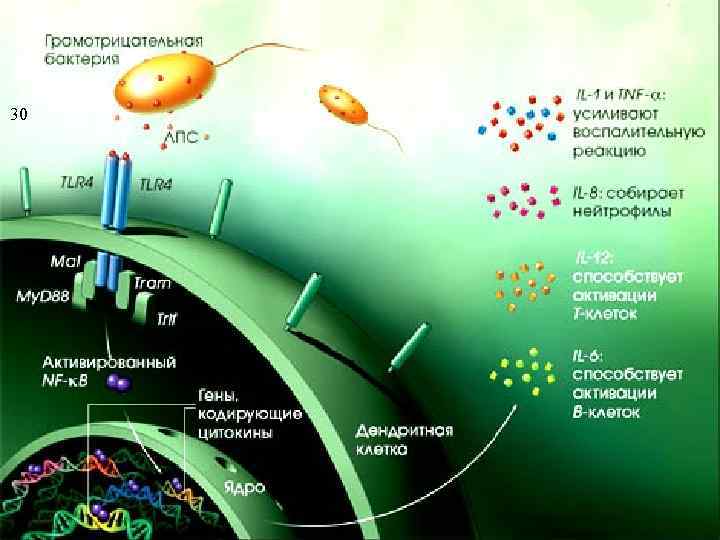 30
30
 Фагоцитоз • Процесс захвата и биодеградации чужеродных частиц и макромолекул специализированными клетками иммунной системы
Фагоцитоз • Процесс захвата и биодеградации чужеродных частиц и макромолекул специализированными клетками иммунной системы
 Фагоциты • Полиморфноядерные: – Нейтрофилы – Базофилы – Эозинофилы • Мононуклеарные: – моноциты – макрофаги
Фагоциты • Полиморфноядерные: – Нейтрофилы – Базофилы – Эозинофилы • Мононуклеарные: – моноциты – макрофаги
 Стадии фагоцитоза • Хемотаксис • Адгезия фагоцита к объекту фагоцитоза • Захват объекта и образование фагосомы • Слияние фагосомы с лизосомой и образование фаголизосомы • Умерщвление живого объекта • Переваривание
Стадии фагоцитоза • Хемотаксис • Адгезия фагоцита к объекту фагоцитоза • Захват объекта и образование фагосомы • Слияние фагосомы с лизосомой и образование фаголизосомы • Умерщвление живого объекта • Переваривание
 Хемотаксис • Направленное движение клеток, определяемое градиентом химических факторов (хемотаксинов, хемоаттрактантов) – Хемоаттрактанты: • Продукты бактерий (формоловые пептиды) • Хемокины • Продукты активации комплемента (С 3 а, С 5 а) • Протеолитические фрагменты факторов свертывания крови и фибринолизина и др.
Хемотаксис • Направленное движение клеток, определяемое градиентом химических факторов (хемотаксинов, хемоаттрактантов) – Хемоаттрактанты: • Продукты бактерий (формоловые пептиды) • Хемокины • Продукты активации комплемента (С 3 а, С 5 а) • Протеолитические фрагменты факторов свертывания крови и фибринолизина и др.
 Опсонины • Вещества, усиливающие фагоцитоз за счет связывания с поверхностью объекта и взаимодействия с рецепторами фагоцитов: – Антитела – Белки системы С (С 3 в и др. )
Опсонины • Вещества, усиливающие фагоцитоз за счет связывания с поверхностью объекта и взаимодействия с рецепторами фагоцитов: – Антитела – Белки системы С (С 3 в и др. )
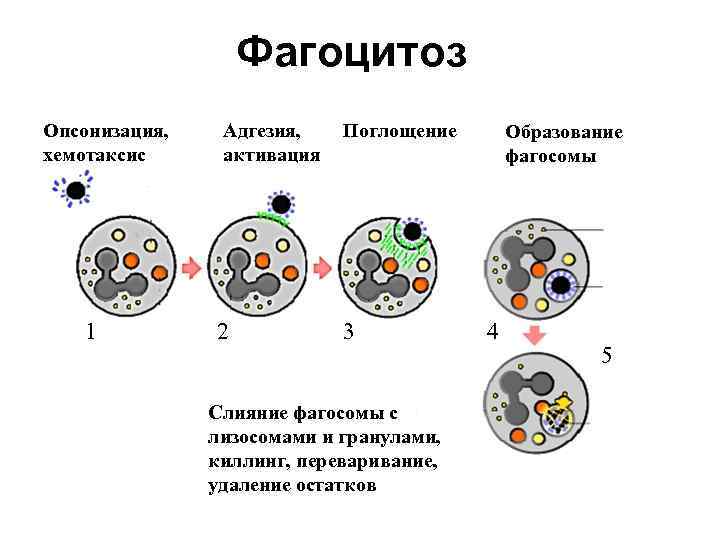 Фагоцитоз Опсонизация, хемотаксис 1 Адгезия, активация Поглощение 2 3 Слияние фагосомы с лизосомами и гранулами, киллинг, переваривание, удаление остатков Образование фагосомы 4 5
Фагоцитоз Опсонизация, хемотаксис 1 Адгезия, активация Поглощение 2 3 Слияние фагосомы с лизосомами и гранулами, киллинг, переваривание, удаление остатков Образование фагосомы 4 5
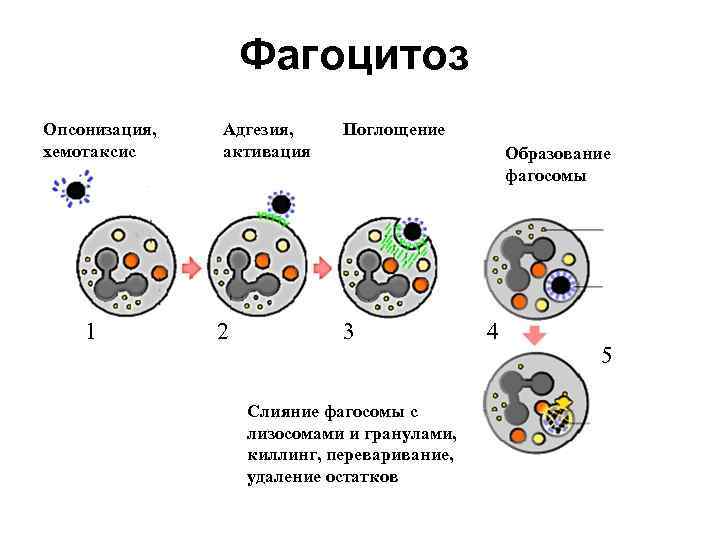 Фагоцитоз Опсонизация, хемотаксис 1 Адгезия, активация 2 Поглощение Образование фагосомы 3 Слияние фагосомы с лизосомами и гранулами, киллинг, переваривание, удаление остатков 4 5
Фагоцитоз Опсонизация, хемотаксис 1 Адгезия, активация 2 Поглощение Образование фагосомы 3 Слияние фагосомы с лизосомами и гранулами, киллинг, переваривание, удаление остатков 4 5
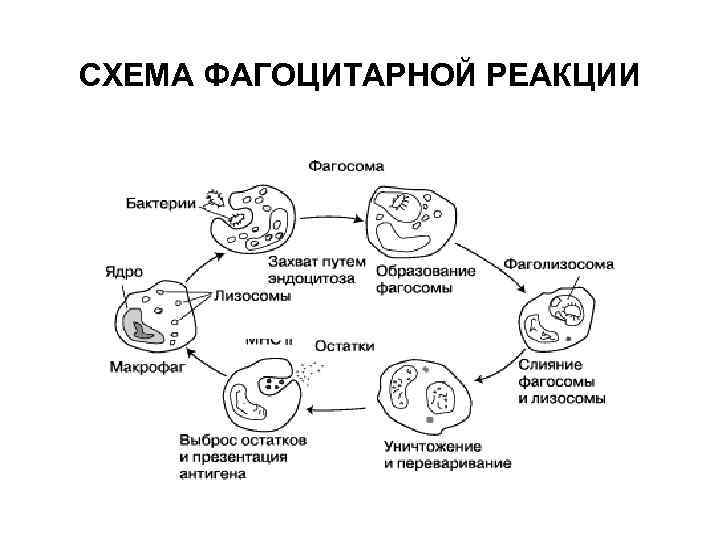 СХЕМА ФАГОЦИТАРНОЙ РЕАКЦИИ
СХЕМА ФАГОЦИТАРНОЙ РЕАКЦИИ
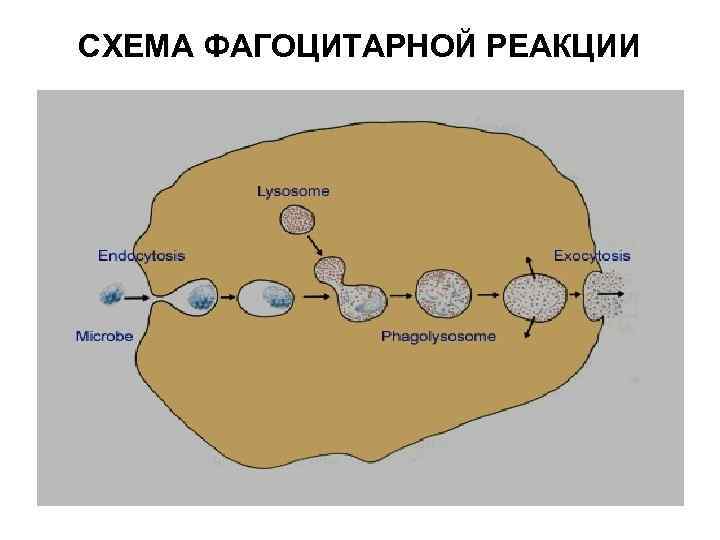 СХЕМА ФАГОЦИТАРНОЙ РЕАКЦИИ
СХЕМА ФАГОЦИТАРНОЙ РЕАКЦИИ
 Механизмы бактерицидности фагоцитов: • Образование токсических продуктов кислорода (с участием и без участия миелопероксидазы) • Азотистые метаболиты (NO, радикал NO-) • Активные субстанции , в т. ч. ферменты (лизоцим) • Локальное закисление
Механизмы бактерицидности фагоцитов: • Образование токсических продуктов кислорода (с участием и без участия миелопероксидазы) • Азотистые метаболиты (NO, радикал NO-) • Активные субстанции , в т. ч. ферменты (лизоцим) • Локальное закисление
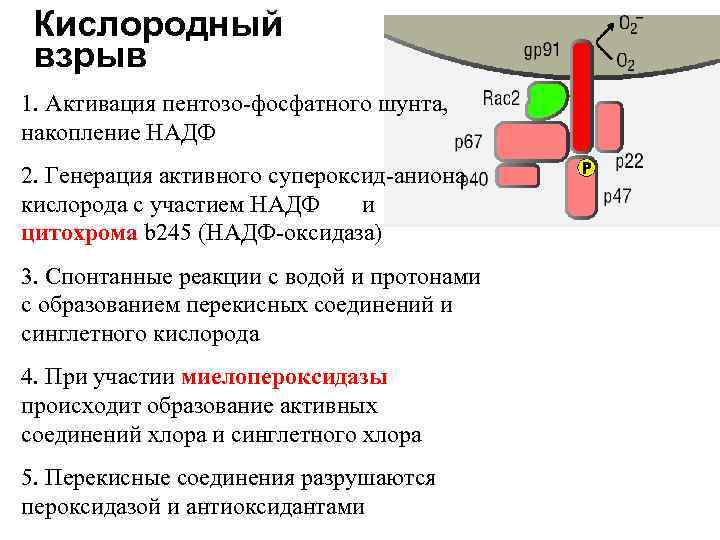 Кислородный взрыв 1. Активация пентозо-фосфатного шунта, накопление НАДФ 2. Генерация активного супероксид-аниона кислорода с участием НАДФ и цитохрома b 245 (НАДФ-оксидаза) 3. Спонтанные реакции с водой и протонами с образованием перекисных соединений и синглетного кислорода 4. При участии миелопероксидазы происходит образование активных соединений хлора и синглетного хлора 5. Перекисные соединения разрушаются пероксидазой и антиоксидантами
Кислородный взрыв 1. Активация пентозо-фосфатного шунта, накопление НАДФ 2. Генерация активного супероксид-аниона кислорода с участием НАДФ и цитохрома b 245 (НАДФ-оксидаза) 3. Спонтанные реакции с водой и протонами с образованием перекисных соединений и синглетного кислорода 4. При участии миелопероксидазы происходит образование активных соединений хлора и синглетного хлора 5. Перекисные соединения разрушаются пероксидазой и антиоксидантами
 Оксид азота • оксид азота NO образуется из аргинина с помощью NO-синтетазы, НАДФ и лейкотриена В 4 • различают конститутивную и индуцибельную NOсинтетазы (в 1000 раз активнее); • активируется ФНОа, ИЛ 1 и особенно ИФН-гамма; • угнетается ИЛ 10, 4, 13; • механизм действия включает: – нерепарируемые повреждения ДНК и инактивацию ферментов, быстрое связывание железа. • хорошо сочетается с механизмами кислородного взрыва
Оксид азота • оксид азота NO образуется из аргинина с помощью NO-синтетазы, НАДФ и лейкотриена В 4 • различают конститутивную и индуцибельную NOсинтетазы (в 1000 раз активнее); • активируется ФНОа, ИЛ 1 и особенно ИФН-гамма; • угнетается ИЛ 10, 4, 13; • механизм действия включает: – нерепарируемые повреждения ДНК и инактивацию ферментов, быстрое связывание железа. • хорошо сочетается с механизмами кислородного взрыва
 Микробоцидные факторы фагоцитов
Микробоцидные факторы фагоцитов
 Микробоцидные факторы фагоцитов Лизосомы • содержат ферменты (протеазы, липазы, катепсин G, фосфолипазы, фосфатазы, гликозидазы, лизоцим и др. ) Снижение р. Н в фагосомах
Микробоцидные факторы фагоцитов Лизосомы • содержат ферменты (протеазы, липазы, катепсин G, фосфолипазы, фосфатазы, гликозидазы, лизоцим и др. ) Снижение р. Н в фагосомах
 Активация фагоцитов Вызывается: • всеми лигандами ТПР (ЛПС) • цитокинами (ИФН-гамма) • адгезией (интегрины, хемокины) • активированными факторами комплемента • веществами - симуляторами перечисленных факторов Проявляется: • усилением фагоцитоза, кислородным взрывом • усилением экспрессии адгезинов, молекул костимуляции и ГКГС • синтезом цитокинов • повышением цитотоксичности • отменой апоптоза
Активация фагоцитов Вызывается: • всеми лигандами ТПР (ЛПС) • цитокинами (ИФН-гамма) • адгезией (интегрины, хемокины) • активированными факторами комплемента • веществами - симуляторами перечисленных факторов Проявляется: • усилением фагоцитоза, кислородным взрывом • усилением экспрессии адгезинов, молекул костимуляции и ГКГС • синтезом цитокинов • повышением цитотоксичности • отменой апоптоза
 Исходы фагоцитоза • Завершенный • Незавершенный: – Гибель фагоцита – Равновесие между фагоцитом и объектом (персистенция)
Исходы фагоцитоза • Завершенный • Незавершенный: – Гибель фагоцита – Равновесие между фагоцитом и объектом (персистенция)
 МЕХАНИЗМЫ ПЕРСИСТЕНЦИИ МИКРООРГАНИЗМОВ В ФАГОЦИТАХ • Блокада слияния фагосомы и лизосомы • Резистентность к действию лизосомальных ферментов • Способность патогенных микроорганизмов покидать фагосому до слияния ее с лизосомой
МЕХАНИЗМЫ ПЕРСИСТЕНЦИИ МИКРООРГАНИЗМОВ В ФАГОЦИТАХ • Блокада слияния фагосомы и лизосомы • Резистентность к действию лизосомальных ферментов • Способность патогенных микроорганизмов покидать фагосому до слияния ее с лизосомой
 Секреторная активность Мф • Ферменты • Белки плазмы (альфа-1 -антитрипсин, альфа-2 макроглобулин, фибронектин) • Факторы свертывания (V, VII, IX, X); • Компоненты комплемента (С 1, 2, 3, 4, 5, факторы P, В, D, I, H) • Производные арахидоновой кислоты (простагландины, тромбоксаны, лейкотриены) • Цитокины
Секреторная активность Мф • Ферменты • Белки плазмы (альфа-1 -антитрипсин, альфа-2 макроглобулин, фибронектин) • Факторы свертывания (V, VII, IX, X); • Компоненты комплемента (С 1, 2, 3, 4, 5, факторы P, В, D, I, H) • Производные арахидоновой кислоты (простагландины, тромбоксаны, лейкотриены) • Цитокины
 • Механизмы естественного и приобретенного иммунитета тесно связаны между собой. Некоторые механизмы действуют как в неспецифической, так и специфической защите. • Макрофаги, например, могут выполнять несколько функций: üФагоцитоз (естественный иммунитет) üПрезентация антигена Т-лимфоцитам, продукция цитокинов (приобретенный иммунитет) üСинтезируют компоненты комплемента, ферменты, белки плазмы и др. üУчаствуют в регуляции иммунного ответа
• Механизмы естественного и приобретенного иммунитета тесно связаны между собой. Некоторые механизмы действуют как в неспецифической, так и специфической защите. • Макрофаги, например, могут выполнять несколько функций: üФагоцитоз (естественный иммунитет) üПрезентация антигена Т-лимфоцитам, продукция цитокинов (приобретенный иммунитет) üСинтезируют компоненты комплемента, ферменты, белки плазмы и др. üУчаствуют в регуляции иммунного ответа
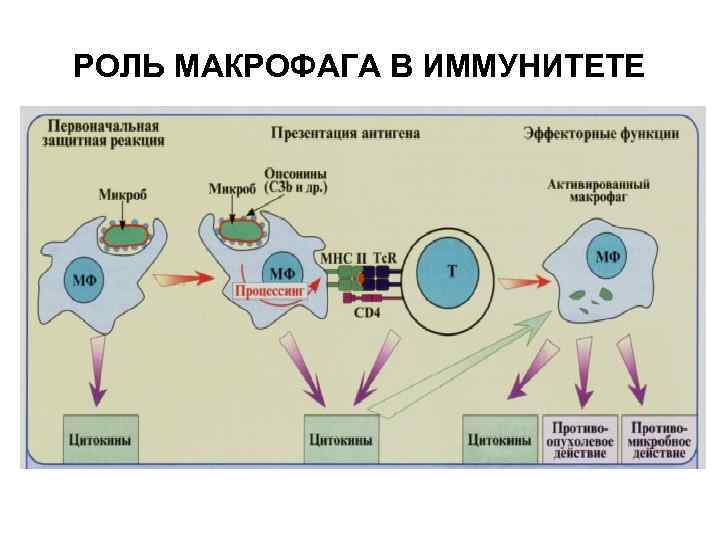 РОЛЬ МАКРОФАГА В ИММУНИТЕТЕ
РОЛЬ МАКРОФАГА В ИММУНИТЕТЕ


