Проточная ЦФ ИФТ.pptx
- Количество слайдов: 27

ИММУНОФЕНОТИПИРОВАНИЕ СУБПОПУЛЯЦИИ ЛИМФОЦИТОВ Основные принципы проточной цитометрии

Проточная цитометрия — автоматизированный анализ клеток, проходящих в потоке жидкости перед источником света.

Проточные цитометры Четыре основных компонента • Источник света — обычно лазер или дуговая ртутная лампа. • Контейнер для образца, проточная ячейка и оптическая система. • Электронная система — преобразует световые импульсы в цифровые сигналы. • Компьютерная система — управляет работой прибора, накапливает данные и выполняет стандартные аналитические операции.
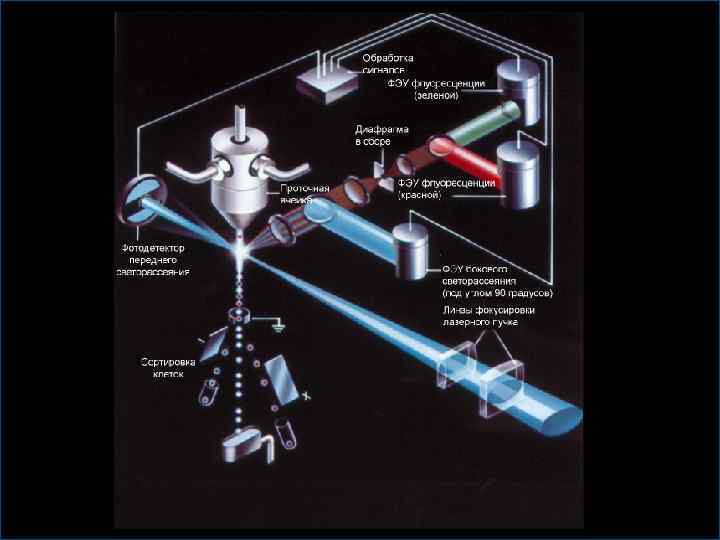

Проточные цитометры Что измеряется? • Малоугольное рассеяние света (FSC) — пропорциональное размеру клетки. • Боковое рассеяние света (SSC) — пропорциональное зернистости клетки. • Флуоресцентные сигналы — обычно от двух до восьми, но может быть и большее количество.

Проточные цитометры Основные возможности • Мультипараметрический анализ § Возможность одновременного измерения нескольких параметров (размера, зернистости, связанной флуоресценции) каждой клетки. • Гейтинг § Возможность установки селектора для определенной подвыборки событий или анализируемой клеточной популяции.

Преимущества проточной цитометрии Статистическая достоверность. Быстрота. Объективность. Количественное определение. Одновременный анализ нескольких параметров. Чувствительность — менее 2000 молекул на клетку. Малое количество требуемого образца.

Недостатки проточной цитометрии Необходимо наличие суспензии из отдельных клеток. Потеря структуры ткани. Медленная сортировка клеток и получение данных по небольшому количеству клеток. Стоимость оборудования. Потребность в обученном персонале. Ограничения по другим позициям. Трудности в управлении данными.

Применение проточной цитометрии Клиническая практика • Иммунофенотипирование • Анализ ДНК/клеточного цикла • Подсчет ретикулоцитов Исследовательская практика • Многие исследования, в том числе требующие сортировки клеток; измерения клеточной активации, например потока Ca++, изменений p. H и мембранного потенциала; экспрессии онкогенов и т. п.

Иммунофенотипирование Основано на распознавании поверхностных антигенов мембраны моноклональными антителами Применяется: • для классификации лейкемий и лимфом; • мониторинга уровня CD 4 у ВИЧ-инфицированных пациентов; • мониторинга отторжения органного трансплантата; • мониторинга состояния пациентов с аутоиммунными заболеваниями или с состояниями первичного иммунодефицита.

Иммунофенотипирование Подготовка клеток • Образцами обычно является периферическая кровь, костный мозг или ткань лимфатического узла, в зависимости от цели анализа. § Для определения CD 4 используется периферическая кровь.

Иммунофенотипирование Подготовка клеток • Используются два основных метода. § Метод лизирования с отмывкой. § Метод лизирования без отмывки. Должен использоваться в интегрированных приборах на единой платформе, в которых для подсчета абсолютного количества клеток применяются флуоресцентные микросферы.

Иммунофенотипирование Подготовка клеток • Метод лизирования с отмывкой - Внесите меченные флуорохромом моноклональные антитела в небольшое количество материала образца. - Инкубируйте 20 минут, внести лизирующее вещество на 10 минут, отмыть и ресуспендировать в фиксаторе. - Проведите анализ.

Иммунофенотипирование Подготовка клеток • Метод лизирования без отмывки - Внесите меченные флуорохромом моноклональные антитела в точно определенное количество образца. - Инкубируйте 20 минут, внесите лизирующее/фиксирующее вещество на 10 минут - Проведите анализ.

Иммунофенотипирование Получаемая информация является одновременно диагностической и прогностической. Используя панели специфических моноклональных антител, получают профиль типов присутствующих клеток. Абсолютные величины содержания клеток в периферической крови могут быть получены с использованием значений общего анализа крови (CBC) или с учетом известного количества флуоресцентных микросфер.

Панели антител для подсчета CD 4 Выбор используемой для подсчета CD 4 панели моноклональных антител зависит от нескольких факторов. Метод, используемый для определения CD 4 Полуавтоматический Ручной Предполагаемая стратегия гейтинга FSC против SSC или CD 45 против SSC

Панели антител для подсчета CD 4 Выбор используемой для подсчета CD 4 панели моноклональных антител зависит от нескольких факторов. Тип доступного прибора Проточный цитометр с определением от двух до шести цветов. Лабораторный стационарный (напр. , FACSCalibur), скоростной (напр. , FACSCount), портативный (напр. , PIMA). Стоимость

Панели антител для подсчета CD 4 Примеры панелей антител для подсчета CD 4 Для ручных методов, вероятно, будет использоваться только анти-CD 4. Для блокирования CD 4 на моноцитах также используется анти-CD 14. Для двухцветовых систем: анти-CD 3/анти-CD 4 и анти-CD 3/анти-CD 8; анти-CD 3/анти-CD 16+56 и анти-CD 3/анти-CD 19.

Панели антител для подсчета CD 4 Примеры панелей антител для подсчета CD 4 Для четырехцветовых систем: анти-CD 4/анти-CD 8/анти-CD 45/анти-CD 3; анти-CD 19/анти-CD 16+56/анти-CD 45/анти-CD 3. Для шестицветовых систем: анти-CD 3/анти-CD 16+56/анти-CD 45/ анти-CD 4/анти-CD 19/анти-CD 8.

Стратегии гейтинга Существует два типа стратегий гейтинга FSC против SSC Отбор популяции, подлежащей анализу, определяется характеристиками рассеяния света клеточными популяциями. Этот метод часто комбинируется с отдельным измерением флуоресценции CD 45 против CD 14 в процедуре обратного гейтинга. Требуется отдельный прогон анализа пробирки с контрольными антителами для установления уровня фоновой аутофлуоресценции.
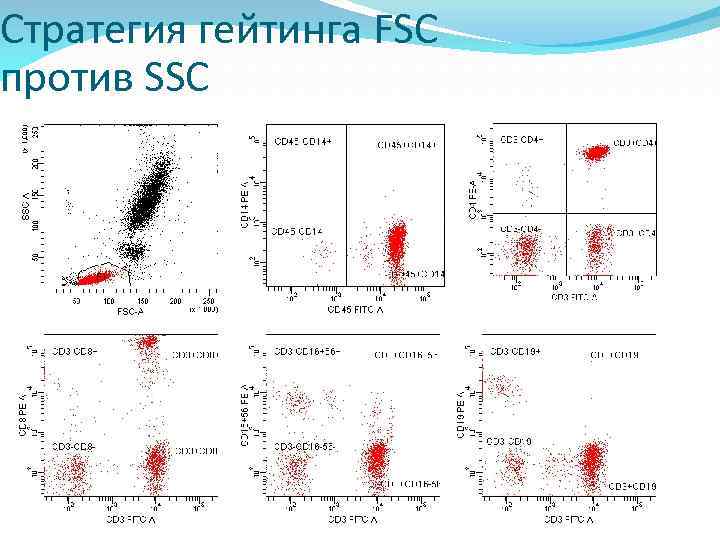
Стратегия гейтинга FSC против SSC

Стратегии гейтинга CD 45 против SSC Выбор популяции, подлежащей анализу, основан на сочетании флуоресценции CD 45 и бокового рассеяния света под углом 90° • Требуется присутствие анти-CD 45 во всех анализах. • При анализе лимфоцитов клетки всех прочих типов исключаются из процесса исследования. • Затем за счет наличия или отсутствия специфических маркеров (например, CD 3) определяются субпопуляции. • Изотипические контрольные материалы обычно не требуются, так как для определения уровней фоновой аутофлуоресценции могут быть использованы отрицательные значения популяций на диаграмме рассеяния.
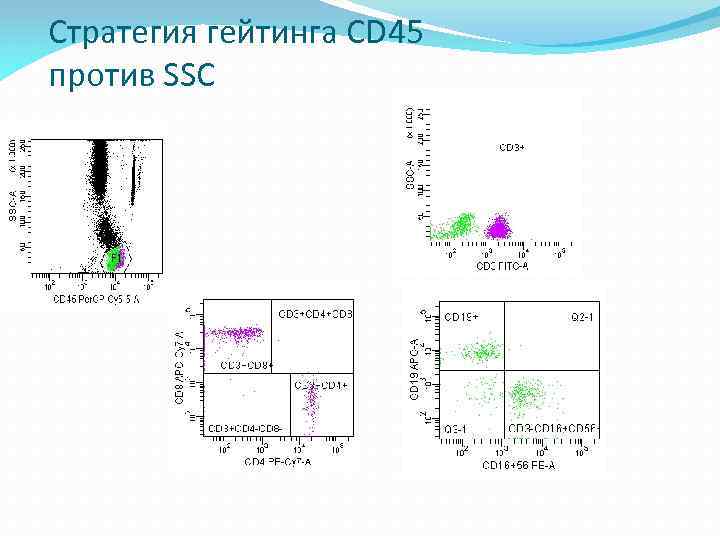
Стратегия гейтинга CD 45 против SSC

Резюме Проточная цитометрия является полуавтоматическим методом, который может быть использован для определения как физических характеристик клеток, так и других их свойств на основе связывания клеток с аналитами, которые либо обладают собственной флуоресценцией, либо связаны с молекулами флуоресцентного вещества. Проточные цитометры способны измерять одновременно несколько параметров каждой клетки.

Резюме Иммунофенотипирование — методика, в которой для определения типов клеток, присутствующих в образце, используются моноклональные антитела, меченные флуоресцентным веществом. Методы, используемые для количественного анализа CD 4, и стратегии обработки данных следует адаптировать в соответствии с потребностями и возможностями каждой лаборатории.

Вопросы Дайте определение проточной цитометрии; Опишите основные компоненты проточного цитометра; Опишите, что измеряет проточный цитометр; Основные возможности проточного цитометра; Преимущества и недостатки проточной цитометрии.

Вопросы Опишите возможные варианты применения проточной цитометрии в клинической и исследовательской практике; Дайте определение иммунофенотипирования; Основной протокол подготовки клеток для иммунофенотипирования; Опишите стратегии, которые могут быть использованы для анализа данных иммунофенотипирования.
Проточная ЦФ ИФТ.pptx