III группа Периодической системы















![Алюминий. Амфотерные свойства. Cо щелочами: 2 Al +2 Na. OH+6 H 2 O=2 Na[Al(OH)4]+3 Алюминий. Амфотерные свойства. Cо щелочами: 2 Al +2 Na. OH+6 H 2 O=2 Na[Al(OH)4]+3](https://present5.com/presentation/3/37562034_177393409.pdf-img/37562034_177393409.pdf-17.jpg)




 III группа Периодической системы
III группа Периодической системы
 Строение атомов Строение внешнего электронного уровня -. . . ns 2 p 1 C увеличением относительных атомных масс, усиливаются металлические свойства элементов. Бор представляет собой неметалл. Алюминий, галлий, индий и таллий — металлы.
Строение атомов Строение внешнего электронного уровня -. . . ns 2 p 1 C увеличением относительных атомных масс, усиливаются металлические свойства элементов. Бор представляет собой неметалл. Алюминий, галлий, индий и таллий — металлы.
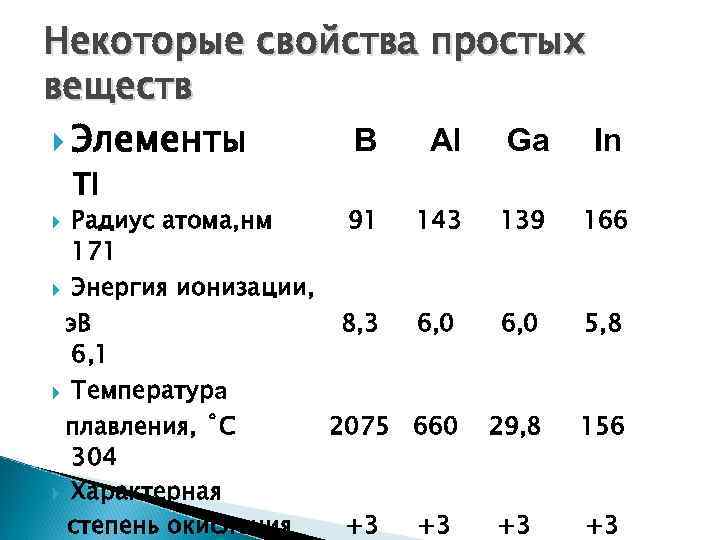
 Некоторые свойства простых веществ Элементы B Al Ga In Tl Радиус атома, нм 91 143 139 166 171 Энергия ионизации, э. В 8, 3 6, 0 5, 8 6, 1 Температура плавления, ˚С 2075 660 29, 8 156 304 Характерная степень окисления +3 +3
Некоторые свойства простых веществ Элементы B Al Ga In Tl Радиус атома, нм 91 143 139 166 171 Энергия ионизации, э. В 8, 3 6, 0 5, 8 6, 1 Температура плавления, ˚С 2075 660 29, 8 156 304 Характерная степень окисления +3 +3
 Нахождение в природе Бор - в виде солей борной кислоты (H 3 BO 3 ), например буры (Na 2 B 4 O 7∙ 1 O 2 H 2 O) Na 2 B 4 O 7. 4 H 2 O – разорит, Mg 7 Cl 2 B 16 O 30 – борацит. Алюминий – в виде алюмосиликатов в полевых шпатах и слюдах, например, калиевый полевой шпат К 2 O∙Al 2 O 3∙ 6 Si. O 2, каолин (Al 2 O 3∙ 2 Si. O 2∙ 2 H 2 O), Al 2 O 3∙n. H 2 O– боксит, Na 2 O∙Al 2 O 3∙ 6 Si. O 2 – нефелин, Na 3[Al. F 6] – криолит. Остальные относятся к редким рассеянным и собственных минералов не образуют.
Нахождение в природе Бор - в виде солей борной кислоты (H 3 BO 3 ), например буры (Na 2 B 4 O 7∙ 1 O 2 H 2 O) Na 2 B 4 O 7. 4 H 2 O – разорит, Mg 7 Cl 2 B 16 O 30 – борацит. Алюминий – в виде алюмосиликатов в полевых шпатах и слюдах, например, калиевый полевой шпат К 2 O∙Al 2 O 3∙ 6 Si. O 2, каолин (Al 2 O 3∙ 2 Si. O 2∙ 2 H 2 O), Al 2 O 3∙n. H 2 O– боксит, Na 2 O∙Al 2 O 3∙ 6 Si. O 2 – нефелин, Na 3[Al. F 6] – криолит. Остальные относятся к редким рассеянным и собственных минералов не образуют.
 бура (Na 2 B 4 O 7∙ 1 O 2 H 2 O) Mg 7 Cl 2 B 16 O 30 – борацит
бура (Na 2 B 4 O 7∙ 1 O 2 H 2 O) Mg 7 Cl 2 B 16 O 30 – борацит
 каолин Ортоклаз (Al 2 O 3∙ 2 Si. O 2∙ 2 H 2 O), К(Аl. Si 3 О 8) калиевый полевой шпат К 2 O∙Al 2 O 3∙ 6 Si. O 2
каолин Ортоклаз (Al 2 O 3∙ 2 Si. O 2∙ 2 H 2 O), К(Аl. Si 3 О 8) калиевый полевой шпат К 2 O∙Al 2 O 3∙ 6 Si. O 2
 Сапфир Mg. O∙Al 2 O 3 – шпинель изумруд
Сапфир Mg. O∙Al 2 O 3 – шпинель изумруд
 Бор. Получение. Аморфный бор получают из буры: Na 2 B 4 O 7 + H 2 SO 4 + 5 H 2 O = H 3 BO 3 + Na 2 SO 4 H 3 BO 3 = В 2 О 3 + H 2 O (при нагревании) В 2 О 3 + 3 Mg = 2 B + Mg. O (при нагревании) Кристаллический бор получают электролизом расплава фтороборатов (K[BF 4] и др. ) или термическим разложением соединений BBr 3, BJ 3, B 2 H 6. 2 BBr 3 = 2 B + 3 Br 2
Бор. Получение. Аморфный бор получают из буры: Na 2 B 4 O 7 + H 2 SO 4 + 5 H 2 O = H 3 BO 3 + Na 2 SO 4 H 3 BO 3 = В 2 О 3 + H 2 O (при нагревании) В 2 О 3 + 3 Mg = 2 B + Mg. O (при нагревании) Кристаллический бор получают электролизом расплава фтороборатов (K[BF 4] и др. ) или термическим разложением соединений BBr 3, BJ 3, B 2 H 6. 2 BBr 3 = 2 B + 3 Br 2
 Бор. Химические свойства. 1. 2 В + 3 F 2 = 2 ВF 3 2. При t=400 – 600 о. С реагирует с кислородом, серой, хлором. 4 В + 3 О 2 = 2 В 2 О 3 3. С азотом реагирует при t выше 1200 о. С. 4. С металлами образует бориды нестехиометрического состава, например: Al. B 4. Взаимодействие с кислотами: B + 3 HNO 3 (конц) = H 3 BO 3 + 3 NO 2 ↑ Взаимодействие со щелочью в присутствии окислителя: 2 B + 2 Na. OH + 3 H 2 O 2 = 2 Na. BO 2 + 4 H 2 O
Бор. Химические свойства. 1. 2 В + 3 F 2 = 2 ВF 3 2. При t=400 – 600 о. С реагирует с кислородом, серой, хлором. 4 В + 3 О 2 = 2 В 2 О 3 3. С азотом реагирует при t выше 1200 о. С. 4. С металлами образует бориды нестехиометрического состава, например: Al. B 4. Взаимодействие с кислотами: B + 3 HNO 3 (конц) = H 3 BO 3 + 3 NO 2 ↑ Взаимодействие со щелочью в присутствии окислителя: 2 B + 2 Na. OH + 3 H 2 O 2 = 2 Na. BO 2 + 4 H 2 O
 Оксид и гидроксид бора B 2 O 3 Получается либо прямым синтезом или прокаливании природных соединений: 4 B + 3 O 2 = 2 B 2 O 3 Na 2 B 4 O 7 = 2 Na. BO 2 + B 2 O 3 H 3 BO 3 Оксиду бора соответствует ряд кислот общей формулы x. B 2 O 3∙y. H 2 O, которые называются полиборными. Наиболее известна ортоборная кислота: B 2 O 3 + 3 H 2 O = 2 H 3 BO 3
Оксид и гидроксид бора B 2 O 3 Получается либо прямым синтезом или прокаливании природных соединений: 4 B + 3 O 2 = 2 B 2 O 3 Na 2 B 4 O 7 = 2 Na. BO 2 + B 2 O 3 H 3 BO 3 Оксиду бора соответствует ряд кислот общей формулы x. B 2 O 3∙y. H 2 O, которые называются полиборными. Наиболее известна ортоборная кислота: B 2 O 3 + 3 H 2 O = 2 H 3 BO 3
 H 3 BO 3 Получают взаимодействием буры с кислотой: Na 2 B 4 O 7 + H 2 SO 4 + 5 H 2 O = 4 H 3 BO 3 + Na 2 SO 4 H 3 BO 3 - слабая кислота, не имеющая собственных солей. Соли метаборной – HBO 2 и тетраборной – H 2 B 4 O 7 кислоты получаются в реакции: 4 H 3 BO 3 + 2 Na. OH = Na 2 B 4 O 7 + 7 H 2 O , При избытке щелочи взаимодействие идет дальше: Na B O + 2 Na. OH = 4 Na. BO + H O
H 3 BO 3 Получают взаимодействием буры с кислотой: Na 2 B 4 O 7 + H 2 SO 4 + 5 H 2 O = 4 H 3 BO 3 + Na 2 SO 4 H 3 BO 3 - слабая кислота, не имеющая собственных солей. Соли метаборной – HBO 2 и тетраборной – H 2 B 4 O 7 кислоты получаются в реакции: 4 H 3 BO 3 + 2 Na. OH = Na 2 B 4 O 7 + 7 H 2 O , При избытке щелочи взаимодействие идет дальше: Na B O + 2 Na. OH = 4 Na. BO + H O
 Водородные соединения бора Получают из боридов металлов: Mg 3 B 2+HCl=Mg. Cl 2+B 2 H 6+B 4 H 10+B 5 H 14+. . . Получаемые соединения носят название “бораны”. Основными продуктами реакции являются диборан и тетраборан. При горении бораны выделяют большое количество тепла. На воздухе склонны самовоспламеняться. Ядовиты.
Водородные соединения бора Получают из боридов металлов: Mg 3 B 2+HCl=Mg. Cl 2+B 2 H 6+B 4 H 10+B 5 H 14+. . . Получаемые соединения носят название “бораны”. Основными продуктами реакции являются диборан и тетраборан. При горении бораны выделяют большое количество тепла. На воздухе склонны самовоспламеняться. Ядовиты.
 Алюминий. Получение. Алюминий получают электролизом раствора оксида алюминия Al 2 O 3 в расплавленном криолите 3 Na. F∙Al. F 3 при ~950 С. При этом на железном катоде выделяется алюминий, а на графитовом аноде выделяющийся кислород реагирует с графитом электрода, образуя СО.
Алюминий. Получение. Алюминий получают электролизом раствора оксида алюминия Al 2 O 3 в расплавленном криолите 3 Na. F∙Al. F 3 при ~950 С. При этом на железном катоде выделяется алюминий, а на графитовом аноде выделяющийся кислород реагирует с графитом электрода, образуя СО.
 Алюминий. Химические свойства С водой (после удаления защитной оксидной пленки, например, амальгамирование или растворами горячей щёлочи): 2 Al + 6 H 2 O = 2 Al(OH)3 + 3 H 2 С кислородом, образуя оксид алюминия: 4 Al + 3 O 2 = 2 Al 2 O 3 С галогенами: 2 Al +3 Cl 2 = 2 Al. Cl 3
Алюминий. Химические свойства С водой (после удаления защитной оксидной пленки, например, амальгамирование или растворами горячей щёлочи): 2 Al + 6 H 2 O = 2 Al(OH)3 + 3 H 2 С кислородом, образуя оксид алюминия: 4 Al + 3 O 2 = 2 Al 2 O 3 С галогенами: 2 Al +3 Cl 2 = 2 Al. Cl 3
 Алюминий. Химические свойства С серой, образуя сульфид алюминия: 2 Al + 3 S = Al 2 S 3 С азотом, образуя нитрид алюминия: 2 Al + N 2 = 2 Al. N С углеродом, образуя карбид алюминия: 4 Al + 3 С = Al 4 С 3 Сульфид, нитрид и карбид алюминия полностью гидролизуются: Al 4 C 3 + 12 H 2 O = 4 Al(OH) 3+ 3 CH 4 Al. N + 3 H 2 O = Al(OH)3 + NH 3
Алюминий. Химические свойства С серой, образуя сульфид алюминия: 2 Al + 3 S = Al 2 S 3 С азотом, образуя нитрид алюминия: 2 Al + N 2 = 2 Al. N С углеродом, образуя карбид алюминия: 4 Al + 3 С = Al 4 С 3 Сульфид, нитрид и карбид алюминия полностью гидролизуются: Al 4 C 3 + 12 H 2 O = 4 Al(OH) 3+ 3 CH 4 Al. N + 3 H 2 O = Al(OH)3 + NH 3
![>Алюминий. Амфотерные свойства. Cо щелочами: 2 Al +2 Na. OH+6 H 2 O=2 Na[Al(OH)4]+3 >Алюминий. Амфотерные свойства. Cо щелочами: 2 Al +2 Na. OH+6 H 2 O=2 Na[Al(OH)4]+3](https://present5.com/presentation/3/37562034_177393409.pdf-img/37562034_177393409.pdf-17.jpg) Алюминий. Амфотерные свойства. Cо щелочами: 2 Al +2 Na. OH+6 H 2 O=2 Na[Al(OH)4]+3 H 2 2(Na. OH∙H 2 O) + 2 Al = 2 Na. Al. O 2 + 3 H 2 С кислотами: 2 Al + 6 HCl = 2 Al. Cl 3 + 3 H 2 2 Al + 3 H 2 SO 4(разб) = Al 2(SO 4)3 + 3 H 2 При нагревании растворяется в кислотах - окислителях: 8 Al+15 H 2 SO 4(конц)=4 Al 2(SO 4)3+3 H 2 S +12 H 2 O Al +6 HNO 3(конц)=Al(NO 3)3+3 NO 2 +3 H 2 O
Алюминий. Амфотерные свойства. Cо щелочами: 2 Al +2 Na. OH+6 H 2 O=2 Na[Al(OH)4]+3 H 2 2(Na. OH∙H 2 O) + 2 Al = 2 Na. Al. O 2 + 3 H 2 С кислотами: 2 Al + 6 HCl = 2 Al. Cl 3 + 3 H 2 2 Al + 3 H 2 SO 4(разб) = Al 2(SO 4)3 + 3 H 2 При нагревании растворяется в кислотах - окислителях: 8 Al+15 H 2 SO 4(конц)=4 Al 2(SO 4)3+3 H 2 S +12 H 2 O Al +6 HNO 3(конц)=Al(NO 3)3+3 NO 2 +3 H 2 O
 Алюминий. Химические свойства Восстанавливает металлы из их оксидов 8 Al + 3 Fe 3 O 4 = 4 Al 2 O 3 + 9 Fe 2 Al + Cr 2 O 3 = Al 2 O 3 + 2 Cr Алюминий хороший комплексообразователь: Al. F 3 + 3 Na. F = Na 3[Al. F 6] Al. Cl 3 + Li. H = Li[Al. H 4] + Li. Cl С водородом алюминий не взаимодействует, но образует смешанные гидриды с другими металлами: Li[Al. H 4], Ti[Al. H 4].
Алюминий. Химические свойства Восстанавливает металлы из их оксидов 8 Al + 3 Fe 3 O 4 = 4 Al 2 O 3 + 9 Fe 2 Al + Cr 2 O 3 = Al 2 O 3 + 2 Cr Алюминий хороший комплексообразователь: Al. F 3 + 3 Na. F = Na 3[Al. F 6] Al. Cl 3 + Li. H = Li[Al. H 4] + Li. Cl С водородом алюминий не взаимодействует, но образует смешанные гидриды с другими металлами: Li[Al. H 4], Ti[Al. H 4].
 Al 2 O 3. Al(OH)3. Амфотерные свойства. В растворах, содержащих ионы Al 3+, устанавливаются равновесия: OH- [Al(H 20)6]3+ H+ [Al(H 20)3(OH)3] H+ OH- [Al(H 20)2(OH)4]- H+ [Al(0 H)6]3 -
Al 2 O 3. Al(OH)3. Амфотерные свойства. В растворах, содержащих ионы Al 3+, устанавливаются равновесия: OH- [Al(H 20)6]3+ H+ [Al(H 20)3(OH)3] H+ OH- [Al(H 20)2(OH)4]- H+ [Al(0 H)6]3 -
 Химические свойства (Ga, In, Tl) Взаимодействие со щелочами: 2 Ga + 2 Na. OH + 6 H 2 O=2 Na[Ga(OH)4] + 3 H 2 2 Ga +2 NH 4 OH+6 H 2 O=2 NH 4[Ga(OH)4] +3 H 2 Взаимодействие с кислотами 2 In + 6 HCl = 2 In. Cl 3 + 3 H 2 Tl + 2 HNO 3 = Tl. NO 3 + NO 2 + H 2 O
Химические свойства (Ga, In, Tl) Взаимодействие со щелочами: 2 Ga + 2 Na. OH + 6 H 2 O=2 Na[Ga(OH)4] + 3 H 2 2 Ga +2 NH 4 OH+6 H 2 O=2 NH 4[Ga(OH)4] +3 H 2 Взаимодействие с кислотами 2 In + 6 HCl = 2 In. Cl 3 + 3 H 2 Tl + 2 HNO 3 = Tl. NO 3 + NO 2 + H 2 O
 Оксиды и гидроксиды (Ga, In, Tl) Оксиды Ga 2 O 3, In 2 O 3, Tl 2 O получают термическим разложением гидроксидов. Оксиды галлия и индия в воде не растворимы. Амфотерны. Оксид таллия при взаимодействии с водой образует гидроксид Tl. OH - сильное основание
Оксиды и гидроксиды (Ga, In, Tl) Оксиды Ga 2 O 3, In 2 O 3, Tl 2 O получают термическим разложением гидроксидов. Оксиды галлия и индия в воде не растворимы. Амфотерны. Оксид таллия при взаимодействии с водой образует гидроксид Tl. OH - сильное основание

