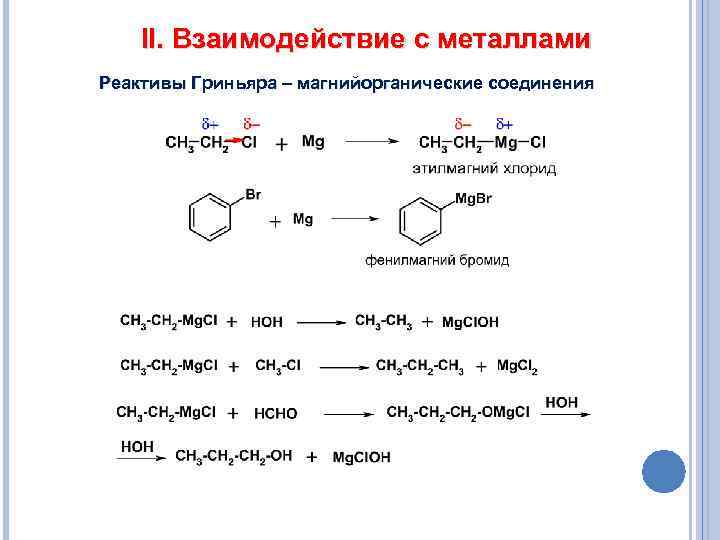
 II. Взаимодействие с металлами Реактивы Гриньяра – магнийорганические соединения
II. Взаимодействие с металлами Реактивы Гриньяра – магнийорганические соединения
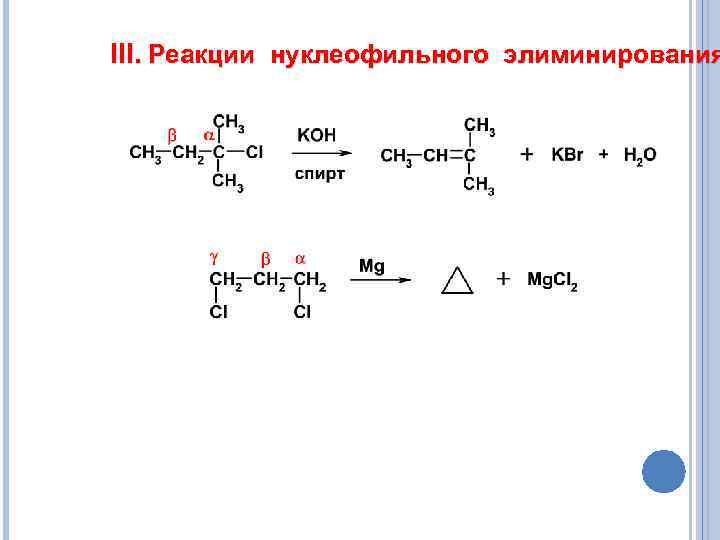 III. Реакции нуклеофильного элиминирования
III. Реакции нуклеофильного элиминирования
 ОВ ГИДРОКСИПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ: СПИРТЫ И ФЕНОЛЫ
ОВ ГИДРОКСИПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ: СПИРТЫ И ФЕНОЛЫ
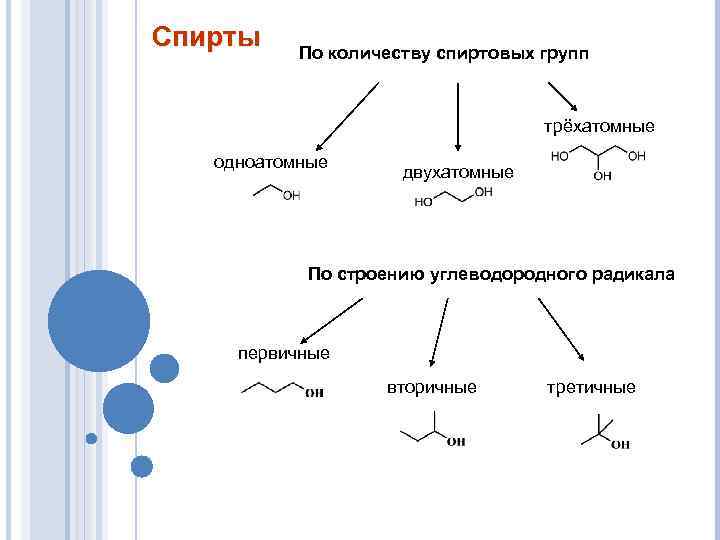 Спирты По количеству спиртовых групп трёхатомные одноатомные двухатомные По строению углеводородного радикала первичные вторичные третичные
Спирты По количеству спиртовых групп трёхатомные одноатомные двухатомные По строению углеводородного радикала первичные вторичные третичные
 Способы получения спиртов - Гидратация алкенов - Гидроксилирование алкенов (реакция Вагнера) - Гидролиз галогенпроизводных - Восстановление карбонильных соединений - С помощью реактивов Гриньяра
Способы получения спиртов - Гидратация алкенов - Гидроксилирование алкенов (реакция Вагнера) - Гидролиз галогенпроизводных - Восстановление карбонильных соединений - С помощью реактивов Гриньяра
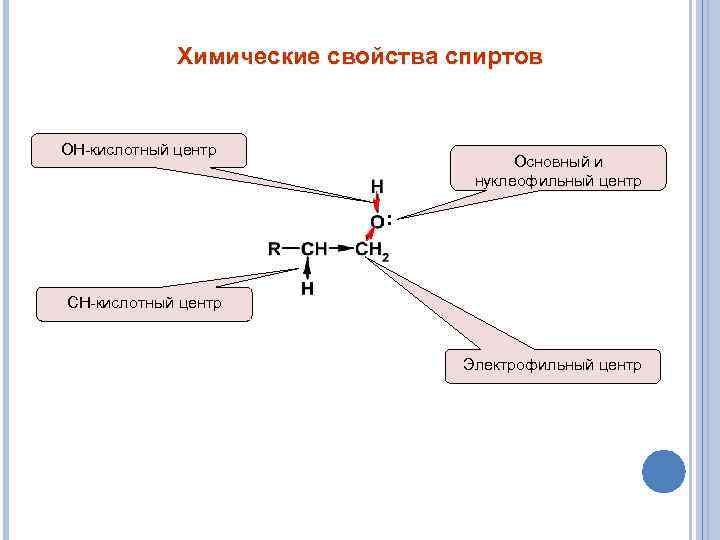 Химические свойства спиртов ОН-кислотный центр Основный и нуклеофильный центр : CH-кислотный центр Электрофильный центр
Химические свойства спиртов ОН-кислотный центр Основный и нуклеофильный центр : CH-кислотный центр Электрофильный центр
 Кислотные и основные свойства спиртов Кислотные свойства спиртов Качественная реакция на 1, 2 -диолы (вицинальные спирты)
Кислотные и основные свойства спиртов Кислотные свойства спиртов Качественная реакция на 1, 2 -диолы (вицинальные спирты)
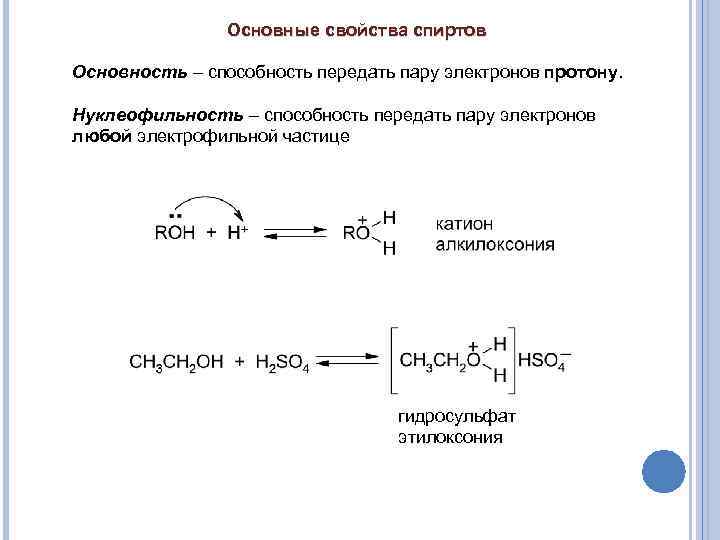 Основные свойства спиртов Основность – способность передать пару электронов протону. Нуклеофильность – способность передать пару электронов любой электрофильной частице гидросульфат этилоксония
Основные свойства спиртов Основность – способность передать пару электронов протону. Нуклеофильность – способность передать пару электронов любой электрофильной частице гидросульфат этилоксония
 Реакции с участием нуклеофильного центра О-Алкилирование – синтез простых эфиров Синтез Вильямсона
Реакции с участием нуклеофильного центра О-Алкилирование – синтез простых эфиров Синтез Вильямсона
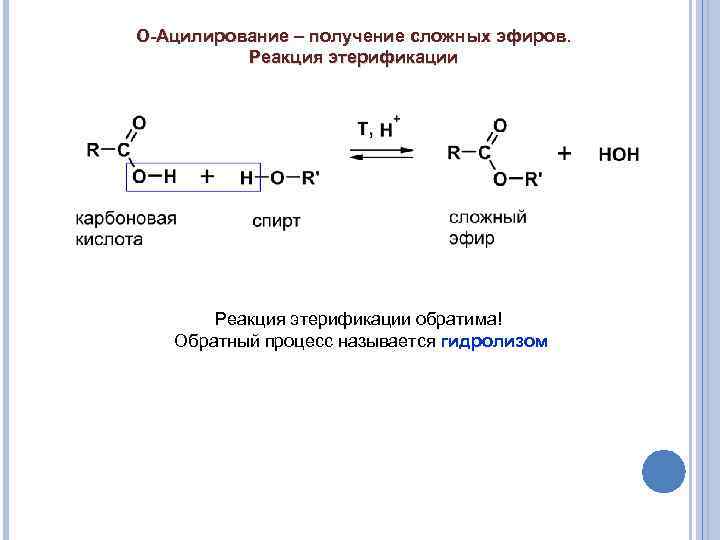 О-Ацилирование – получение сложных эфиров. Реакция этерификации обратима! Обратный процесс называется гидролизом
О-Ацилирование – получение сложных эфиров. Реакция этерификации обратима! Обратный процесс называется гидролизом
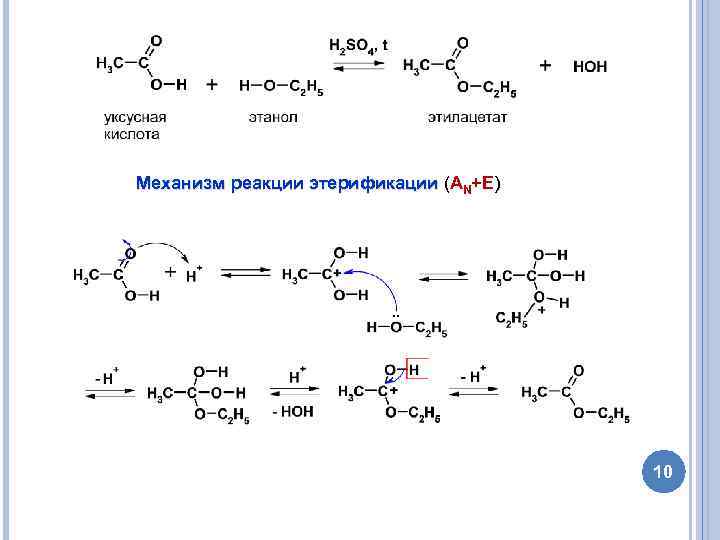 Механизм реакции этерификации (AN+E) 10
Механизм реакции этерификации (AN+E) 10
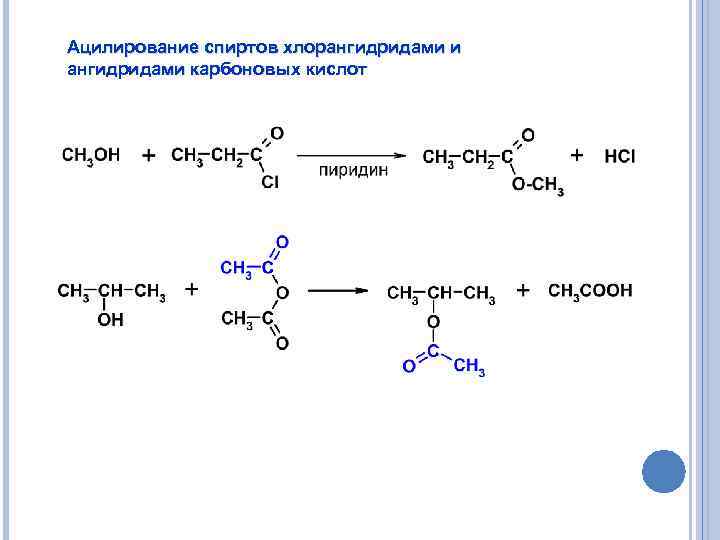 Ацилирование спиртов хлорангидридами и ангидридами карбоновых кислот
Ацилирование спиртов хлорангидридами и ангидридами карбоновых кислот
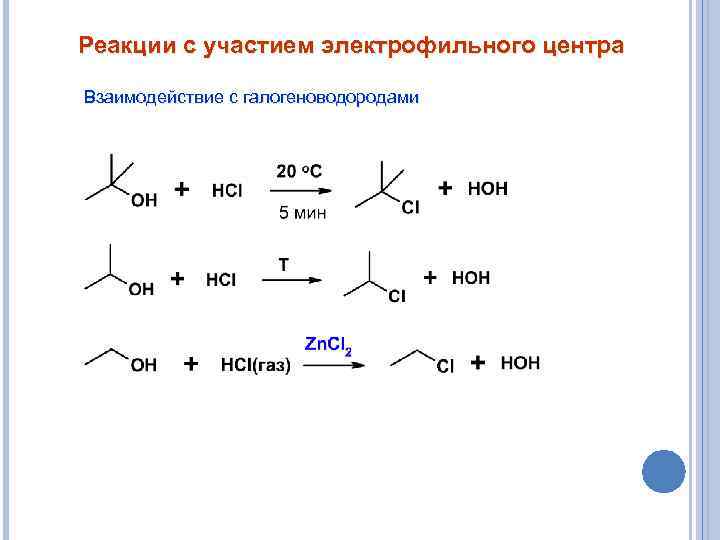 Реакции с участием электрофильного центра Взаимодействие с галогеноводородами
Реакции с участием электрофильного центра Взаимодействие с галогеноводородами
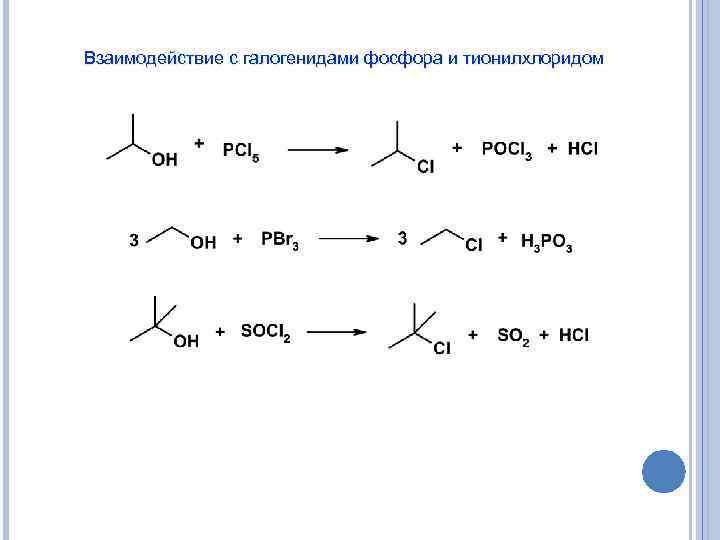 Взаимодействие с галогенидами фосфора и тионилхлоридом
Взаимодействие с галогенидами фосфора и тионилхлоридом
 Реакции с участием СН-кислотного центра (реакция элиминирования) Внутримолекулярная дегидратация (H+, T > 120 o. C) Правило Зайцева: атом водорода отщепляется от соседнего менее гидрированного атома углерода
Реакции с участием СН-кислотного центра (реакция элиминирования) Внутримолекулярная дегидратация (H+, T > 120 o. C) Правило Зайцева: атом водорода отщепляется от соседнего менее гидрированного атома углерода
![Окисление спиртов [O] = K 2 Cr 2 O 7 / H 2 SO Окисление спиртов [O] = K 2 Cr 2 O 7 / H 2 SO](https://present5.com/presentation/-42532736_169642827/image-16.jpg) Окисление спиртов [O] = K 2 Cr 2 O 7 / H 2 SO 4, KMn. O 4 / H 2 SO 4 Каталитическое дегидрирование
Окисление спиртов [O] = K 2 Cr 2 O 7 / H 2 SO 4, KMn. O 4 / H 2 SO 4 Каталитическое дегидрирование
 Фенолы Химические свойства 1. Реакции с участием гидроксильной фенольной группы 2. Реакции по ароматическому кольцу
Фенолы Химические свойства 1. Реакции с участием гидроксильной фенольной группы 2. Реакции по ароматическому кольцу
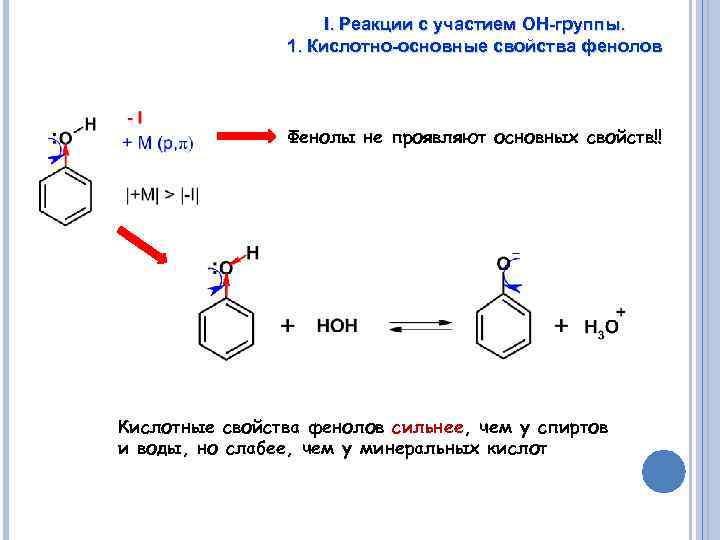 I. Реакции с участием ОН-группы. 1. Кислотно-основные свойства фенолов Фенолы не проявляют основных свойств!! Кислотные свойства фенолов сильнее, чем у спиртов и воды, но слабее, чем у минеральных кислот
I. Реакции с участием ОН-группы. 1. Кислотно-основные свойства фенолов Фенолы не проявляют основных свойств!! Кислотные свойства фенолов сильнее, чем у спиртов и воды, но слабее, чем у минеральных кислот
 На кислотность влияет природа заместителя в молекуле фенола: заместители-акцепторы повышают кислотность, заместители-доноры понижают кислотность фенолов Заместители-акцепторы, с одной стороны, способствуют большей поляризации связи О-Н в молекуле фенола, тем самым облегчая её разрыв, а с другой стороны стабилизируют образующийся фенолят-анион за счёт лучшей делокализации заряда.
На кислотность влияет природа заместителя в молекуле фенола: заместители-акцепторы повышают кислотность, заместители-доноры понижают кислотность фенолов Заместители-акцепторы, с одной стороны, способствуют большей поляризации связи О-Н в молекуле фенола, тем самым облегчая её разрыв, а с другой стороны стабилизируют образующийся фенолят-анион за счёт лучшей делокализации заряда.
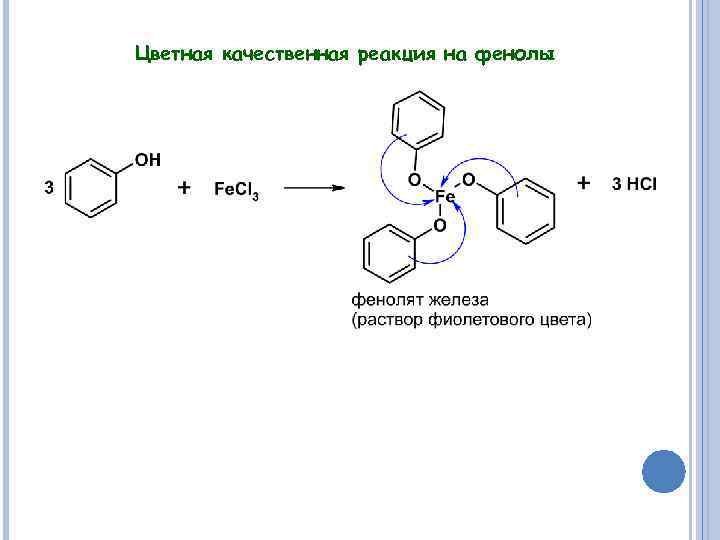 Цветная качественная реакция на фенолы
Цветная качественная реакция на фенолы
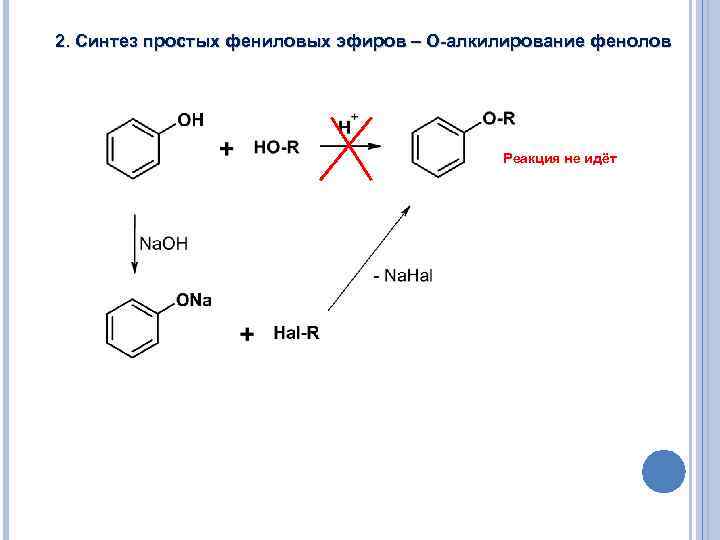 2. Синтез простых фениловых эфиров – О-алкилирование фенолов Реакция не идёт
2. Синтез простых фениловых эфиров – О-алкилирование фенолов Реакция не идёт
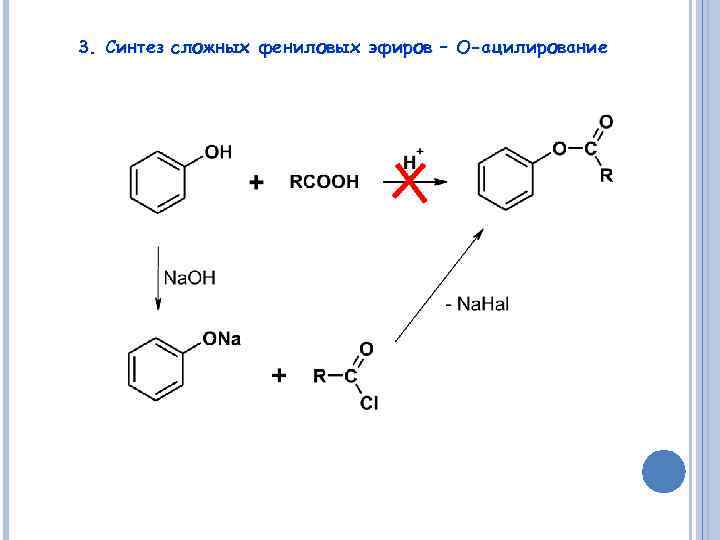 3. Синтез сложных фениловых эфиров – О-ацилирование
3. Синтез сложных фениловых эфиров – О-ацилирование
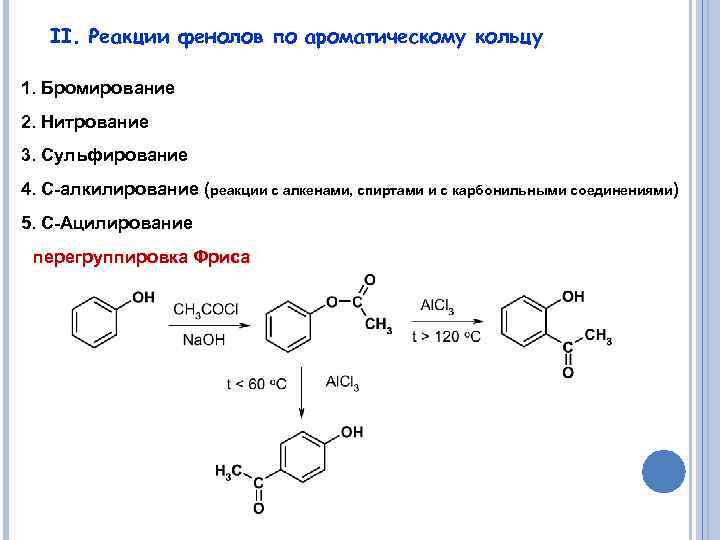 II. Реакции фенолов по ароматическому кольцу 1. Бромирование 2. Нитрование 3. Сульфирование 4. С-алкилирование (реакции с алкенами, спиртами и с карбонильными соединениями) 5. С-Ацилирование перегруппировка Фриса
II. Реакции фенолов по ароматическому кольцу 1. Бромирование 2. Нитрование 3. Сульфирование 4. С-алкилирование (реакции с алкенами, спиртами и с карбонильными соединениями) 5. С-Ацилирование перегруппировка Фриса
 Карбоксилирование фенолов. Реакция Кольбе
Карбоксилирование фенолов. Реакция Кольбе
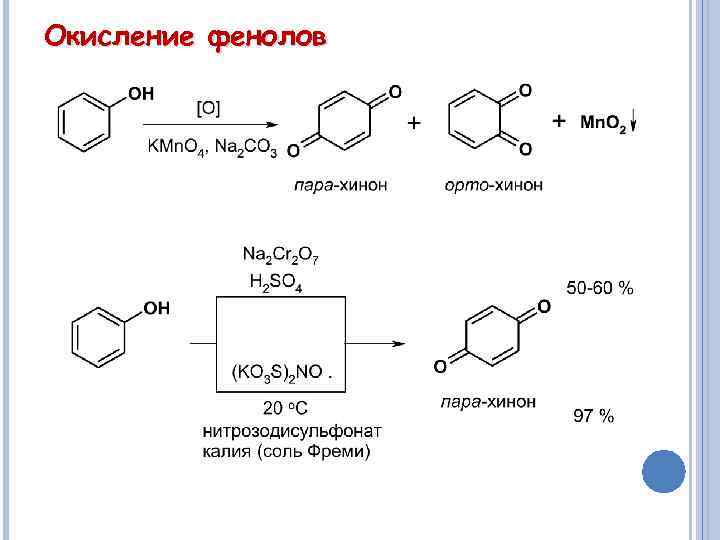 Окисление фенолов
Окисление фенолов