 ИИ КЦ ТЬ ОС ОР Я 8 К И С ЕКЦ Л ЕА Р
ИИ КЦ ТЬ ОС ОР Я 8 К И С ЕКЦ Л ЕА Р





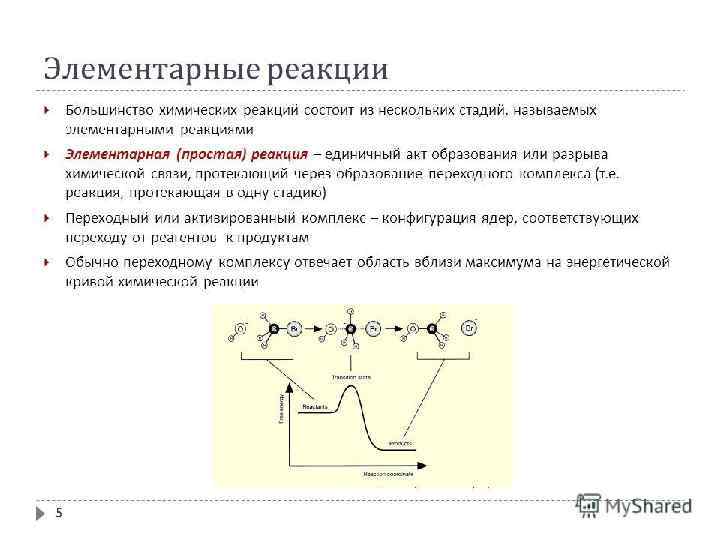

 ЭНЕРГЕТИЧЕСКИЙ ПРОФИЛЬ РЕАКЦИИ
ЭНЕРГЕТИЧЕСКИЙ ПРОФИЛЬ РЕАКЦИИ



 СРЕДНЯЯ СКОРОСТЬ РЕАКЦИИ
СРЕДНЯЯ СКОРОСТЬ РЕАКЦИИ

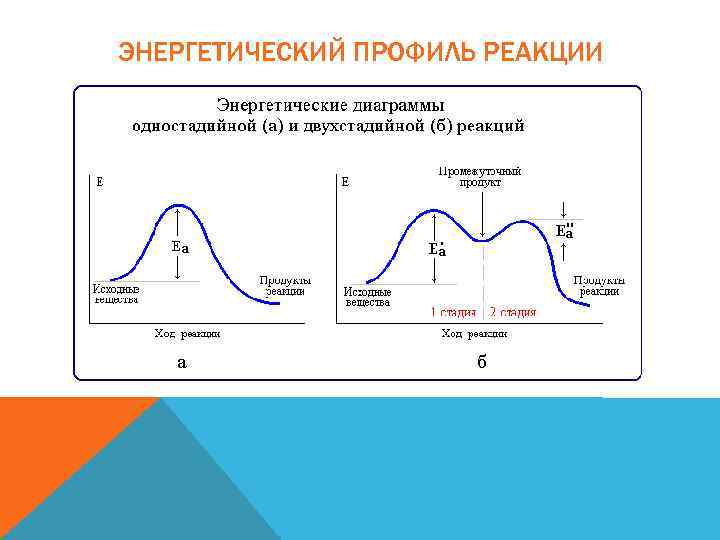
 ИЗМЕНЕНИЕ КОНЦЕНТРАЦИЙ ВЕЩЕСТВ ВО ВРЕМЕНИ
ИЗМЕНЕНИЕ КОНЦЕНТРАЦИЙ ВЕЩЕСТВ ВО ВРЕМЕНИ
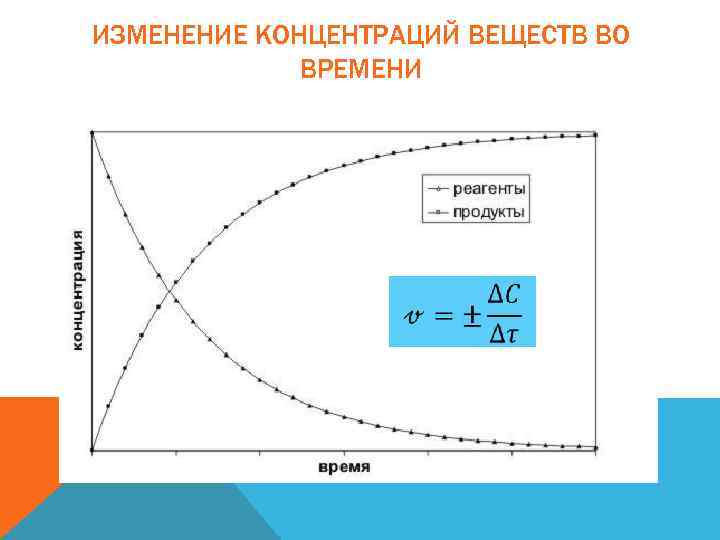
 ИЗМЕНЕНИЕ СКОРОСТИ РЕАКЦИИ
ИЗМЕНЕНИЕ СКОРОСТИ РЕАКЦИИ




 СКОРОСТЬ ГЕТЕРОГЕННОЙ РЕАКЦИИ Любые гетерогенные процессы связаны с переносом вещества, и в них можно выделить три стадии: 1) Подвод реагирующего вещества к поверхности. 2) Химическая реакция на поверхности. 3) Отвод продукта реакции от поверхности. Первая и последняя стадия осуществляется за счет диффузии. Для ускорения таких диффузионно контролируемых реакций обычно используют перемешивание. Если химическая реакция (вторая стадия) имеет высокую энергию активации, то эта стадия оказывается самой медленной, и процесс не ускоряется при перемешивании. Такие гетерогенные реакции называются кинетически контролируемыми. Для их ускорения необходимо повысить температуру. Скорость любого гетерогенного процесса возрастает при увеличении поверхности контакта фаз. Для этого используют измельчение твердой фазы.
СКОРОСТЬ ГЕТЕРОГЕННОЙ РЕАКЦИИ Любые гетерогенные процессы связаны с переносом вещества, и в них можно выделить три стадии: 1) Подвод реагирующего вещества к поверхности. 2) Химическая реакция на поверхности. 3) Отвод продукта реакции от поверхности. Первая и последняя стадия осуществляется за счет диффузии. Для ускорения таких диффузионно контролируемых реакций обычно используют перемешивание. Если химическая реакция (вторая стадия) имеет высокую энергию активации, то эта стадия оказывается самой медленной, и процесс не ускоряется при перемешивании. Такие гетерогенные реакции называются кинетически контролируемыми. Для их ускорения необходимо повысить температуру. Скорость любого гетерогенного процесса возрастает при увеличении поверхности контакта фаз. Для этого используют измельчение твердой фазы.
 СКОРОСТЬ ГЕТЕРОГЕННОЙ РЕАКЦИИ В уравнении закона действия масс для гетерогенной реакции концентрация твердой фазы не учитывается. Например, для горения углерода C(т) + O 2(г) → CO 2(г) выражение закона действия масс выглядит следующим образом: v = k·[O 2] Разумеется, характеристики твердого вещества влияют на скорость реакции, но это влияние отражается величиной константы скорости k.
СКОРОСТЬ ГЕТЕРОГЕННОЙ РЕАКЦИИ В уравнении закона действия масс для гетерогенной реакции концентрация твердой фазы не учитывается. Например, для горения углерода C(т) + O 2(г) → CO 2(г) выражение закона действия масс выглядит следующим образом: v = k·[O 2] Разумеется, характеристики твердого вещества влияют на скорость реакции, но это влияние отражается величиной константы скорости k.
 n = a + b – общий порядок реакции
n = a + b – общий порядок реакции





 ПРАВИЛО ВАНТ-ГОФФА
ПРАВИЛО ВАНТ-ГОФФА

 СТОЛКНОВЕНИЕ АКТИВНЫХ ЧАСТИЦ
СТОЛКНОВЕНИЕ АКТИВНЫХ ЧАСТИЦ
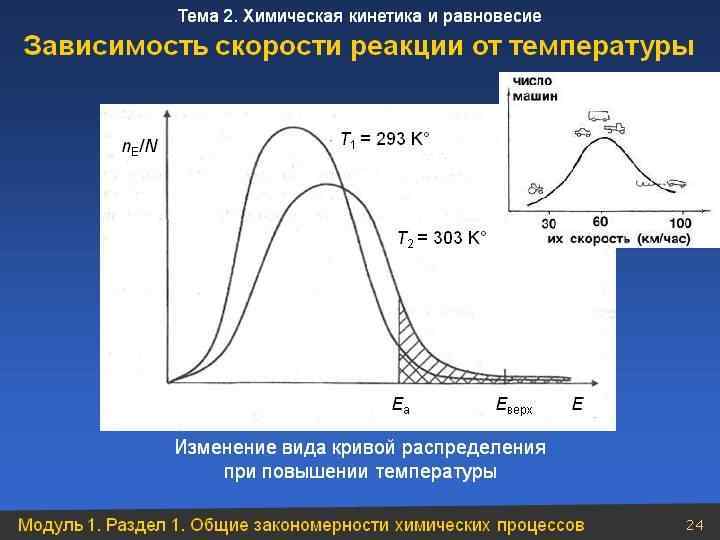
 УРАВНЕНИЕ АРРЕНИУСА
УРАВНЕНИЕ АРРЕНИУСА
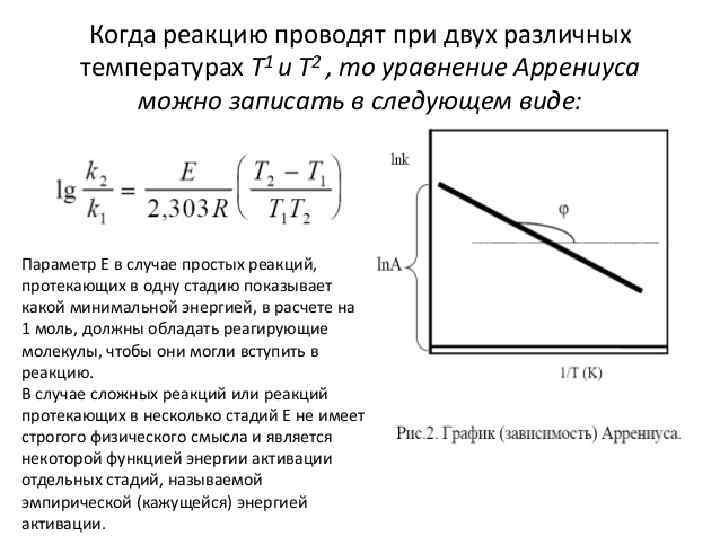
 РАСЧЕТНЫЕ ФОРМУЛЫ
РАСЧЕТНЫЕ ФОРМУЛЫ

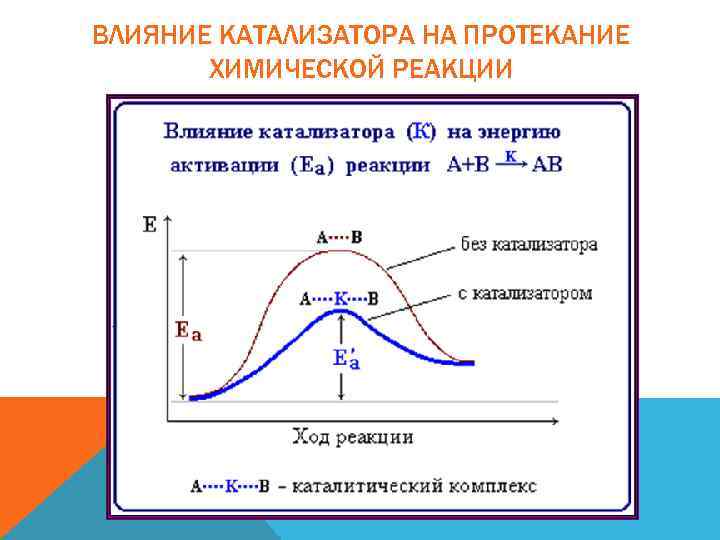 ВЛИЯНИЕ КАТАЛИЗАТОРА НА ПРОТЕКАНИЕ ХИМИЧЕСКОЙ РЕАКЦИИ
ВЛИЯНИЕ КАТАЛИЗАТОРА НА ПРОТЕКАНИЕ ХИМИЧЕСКОЙ РЕАКЦИИ





 ДОПОЛНИТЕЛЬНЫЕ ПОНЯТИЯ В синтезе аммиака применяется не чисто железный катализатор, а с добавками оксидов Al 2 O 3 и K 2 O. Эти оксиды служат промоторами. Промоторы - это вещества, сами по себе не являющиеся катализаторами данной реакции, но усиливающие действие основного катализатора. Инициаторы - вещества, в ряде случаев необходимые для возбуждения химической реакции, которая далее происходит без посторонней помощи. Инициаторы расходуются в ходе реакции, однако их требуется намного меньше, чем реагентов. Впрочем, инициирование возможно и на поверхности гетерогенного катализатора. В этом случае говорят уже не об инициаторах, а о катализаторах полимеризации - такие тоже широко применяются в химической промышленности.
ДОПОЛНИТЕЛЬНЫЕ ПОНЯТИЯ В синтезе аммиака применяется не чисто железный катализатор, а с добавками оксидов Al 2 O 3 и K 2 O. Эти оксиды служат промоторами. Промоторы - это вещества, сами по себе не являющиеся катализаторами данной реакции, но усиливающие действие основного катализатора. Инициаторы - вещества, в ряде случаев необходимые для возбуждения химической реакции, которая далее происходит без посторонней помощи. Инициаторы расходуются в ходе реакции, однако их требуется намного меньше, чем реагентов. Впрочем, инициирование возможно и на поверхности гетерогенного катализатора. В этом случае говорят уже не об инициаторах, а о катализаторах полимеризации - такие тоже широко применяются в химической промышленности.


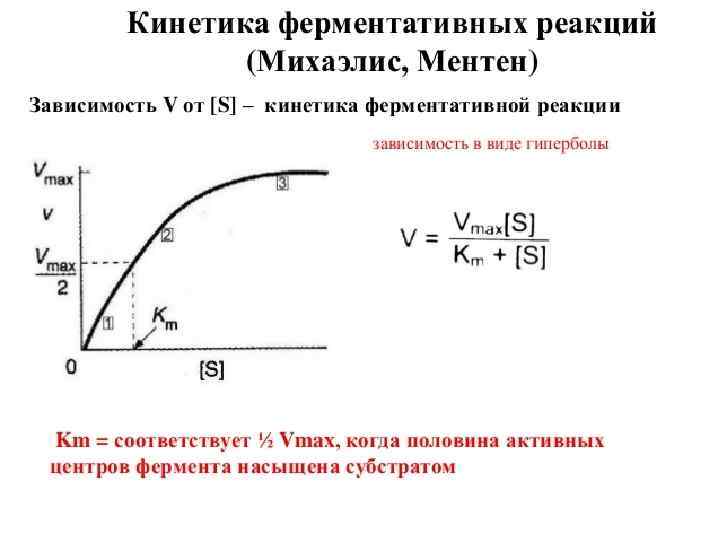

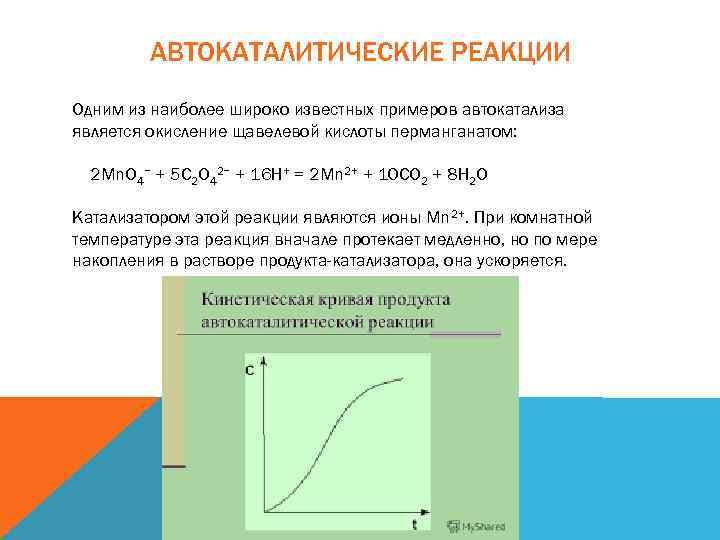 АВТОКАТАЛИТИЧЕСКИЕ РЕАКЦИИ Одним из наиболее широко известных примеров автокатализа является окисление щавелевой кислоты перманганатом: 2 Mn. O 4− + 5 C 2 O 42− + 16 H+ = 2 Mn 2+ + 10 CO 2 + 8 H 2 O Катализатором этой реакции являются ионы Mn 2+. При комнатной температуре эта реакция вначале протекает медленно, но по мере накопления в растворе продукта-катализатора, она ускоряется.
АВТОКАТАЛИТИЧЕСКИЕ РЕАКЦИИ Одним из наиболее широко известных примеров автокатализа является окисление щавелевой кислоты перманганатом: 2 Mn. O 4− + 5 C 2 O 42− + 16 H+ = 2 Mn 2+ + 10 CO 2 + 8 H 2 O Катализатором этой реакции являются ионы Mn 2+. При комнатной температуре эта реакция вначале протекает медленно, но по мере накопления в растворе продукта-катализатора, она ускоряется.

 ХИМИЧЕСКИЕ ЧАСЫ
ХИМИЧЕСКИЕ ЧАСЫ
 КОЛЬЦА ЛИЗЕГАНГА Примеры используемых химических реакций: HCl + Ag. NO 3 → Ag. Cl↓ + HNO 3; 2 KI + Pb(NO 3)2 → Pb. I 2↓ + KNO 3; Mg. SO 4 + 2 NH 3 + 2 H 2 O → Mg(OH)2↓ + (NH 4)2 SO 4. Для получения среды используются, как правило, желатин, агар-агар или силикагель.
КОЛЬЦА ЛИЗЕГАНГА Примеры используемых химических реакций: HCl + Ag. NO 3 → Ag. Cl↓ + HNO 3; 2 KI + Pb(NO 3)2 → Pb. I 2↓ + KNO 3; Mg. SO 4 + 2 NH 3 + 2 H 2 O → Mg(OH)2↓ + (NH 4)2 SO 4. Для получения среды используются, как правило, желатин, агар-агар или силикагель.
 А! К ТИ К А ЕП Т РЬ Е РА П
А! К ТИ К А ЕП Т РЬ Е РА П


