II группа главная подгруппа



![Нахождение в природе Be 3 Al 2[Si 6 O 18] – Нахождение в природе Be 3 Al 2[Si 6 O 18] –](https://present5.com/presentation/3/37562034_177393386.pdf-img/37562034_177393386.pdf-4.jpg)













 II группа главная подгруппа Ca. CO 3. Mg. CO 3 – доломит
II группа главная подгруппа Ca. CO 3. Mg. CO 3 – доломит
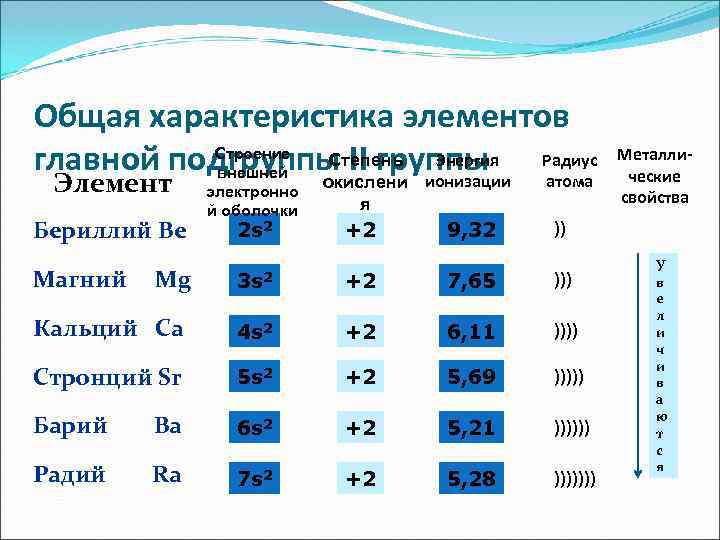
 Общая характеристика элементов главной подгруппы II группы Радиус Строение внешней Степень Энергия Металли- ческие Элемент окислени ионизации электронно атома свойства й оболочки я Бериллий Be 2 s 2 +2 9, 32 )) У Магний Mg 3 s 2 +2 7, 65 ))) в е л Кальций Ca 4 s 2 +2 6, 11 )))) и ч и Стронций Sr 5 s 2 +2 5, 69 ))))) в а ю Барий Ba 6 s 2 +2 5, 21 )))))) т с я Радий Ra 7 s 2 +2 5, 28 )))))))
Общая характеристика элементов главной подгруппы II группы Радиус Строение внешней Степень Энергия Металли- ческие Элемент окислени ионизации электронно атома свойства й оболочки я Бериллий Be 2 s 2 +2 9, 32 )) У Магний Mg 3 s 2 +2 7, 65 ))) в е л Кальций Ca 4 s 2 +2 6, 11 )))) и ч и Стронций Sr 5 s 2 +2 5, 69 ))))) в а ю Барий Ba 6 s 2 +2 5, 21 )))))) т с я Радий Ra 7 s 2 +2 5, 28 )))))))
 Нахождение в природе Ca и Mg широко распространены. За счет высокой активности в свободном Sr и Ba мало распространены. состоянии не встречаются. Be – редкий элемент. Радий содержится в урановых рудах в ничтожных количествах. Be – светло-серый, Mg – относительно Ca – твердый, пластичный твердый, хрупкий мягкий, пластичный
Нахождение в природе Ca и Mg широко распространены. За счет высокой активности в свободном Sr и Ba мало распространены. состоянии не встречаются. Be – редкий элемент. Радий содержится в урановых рудах в ничтожных количествах. Be – светло-серый, Mg – относительно Ca – твердый, пластичный твердый, хрупкий мягкий, пластичный
![> Нахождение в природе Be 3 Al 2[Si 6 O 18] – > Нахождение в природе Be 3 Al 2[Si 6 O 18] –](https://present5.com/presentation/3/37562034_177393386.pdf-img/37562034_177393386.pdf-4.jpg) Нахождение в природе Be 3 Al 2[Si 6 O 18] – берилл 3 Be. O∙Al 2 O 3∙ 6 Si. O 2
Нахождение в природе Be 3 Al 2[Si 6 O 18] – берилл 3 Be. O∙Al 2 O 3∙ 6 Si. O 2
 Берилл изумруд аквамарин
Берилл изумруд аквамарин
 Mg. O∙Al 2 O 3 – шпинель Ca. CO 3. Mg. CO 3 – доломит Mg. CO 3 – магнезит Mg. Cl 2∙KCl – карналит
Mg. O∙Al 2 O 3 – шпинель Ca. CO 3. Mg. CO 3 – доломит Mg. CO 3 – магнезит Mg. Cl 2∙KCl – карналит
 Ba. CO 3 – витерит Sr. CO 3 – стронциани т
Ba. CO 3 – витерит Sr. CO 3 – стронциани т
 Получение Получают щелочноземельные металлы и магний электролизом расплавленных солей. Получение бериллия происходит по схеме Берилл → Be. SO 4 → Be(ОН)2 → Be. О → Be. Cl 2 → Be электролиз Можно получить бериллий магнийтермическим восстановлением (1000 °C) Mg + Be. Cl 2 → Mg. Cl 2 + Be
Получение Получают щелочноземельные металлы и магний электролизом расплавленных солей. Получение бериллия происходит по схеме Берилл → Be. SO 4 → Be(ОН)2 → Be. О → Be. Cl 2 → Be электролиз Можно получить бериллий магнийтермическим восстановлением (1000 °C) Mg + Be. Cl 2 → Mg. Cl 2 + Be
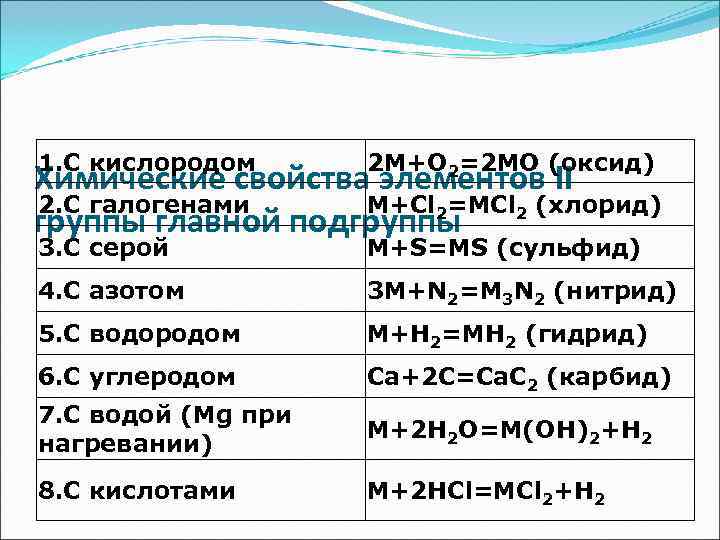
 1. С кислородом 2 M+O 2=2 MO (оксид) Химические свойства элементов II 2. С галогенами M+Cl 2=MCl 2 (хлорид) группы главной подгруппы 3. С серой M+S=MS (сульфид) 4. С азотом 3 M+N 2=M 3 N 2 (нитрид) 5. С водородом M+H 2=MH 2 (гидрид) 6. С углеродом Cа+2 C=Cа. C 2 (карбид) 7. С водой (Mg при M+2 H 2 O=M(OH)2+H 2 нагревании) 8. С кислотами M+2 HCl=MCl 2+H 2
1. С кислородом 2 M+O 2=2 MO (оксид) Химические свойства элементов II 2. С галогенами M+Cl 2=MCl 2 (хлорид) группы главной подгруппы 3. С серой M+S=MS (сульфид) 4. С азотом 3 M+N 2=M 3 N 2 (нитрид) 5. С водородом M+H 2=MH 2 (гидрид) 6. С углеродом Cа+2 C=Cа. C 2 (карбид) 7. С водой (Mg при M+2 H 2 O=M(OH)2+H 2 нагревании) 8. С кислотами M+2 HCl=MCl 2+H 2
 Химические свойства бериллия Бериллий проявляет диагональную аналогию с алюминием. Бериллий, его оксид и гидрооксид амфотерны. Вe + 2 Na. OH + 2 H 2 O= Na 2[Be(OH)4] + H 2 Be + 2 HCl = Be. Cl 2 + H 2
Химические свойства бериллия Бериллий проявляет диагональную аналогию с алюминием. Бериллий, его оксид и гидрооксид амфотерны. Вe + 2 Na. OH + 2 H 2 O= Na 2[Be(OH)4] + H 2 Be + 2 HCl = Be. Cl 2 + H 2
 Характер оксидов Be. O – амфотерный оксид Mg. O Ca. O основные оксиды Sr. O Ba. O Оксид кальция Са. О (негашеная известь)
Характер оксидов Be. O – амфотерный оксид Mg. O Ca. O основные оксиды Sr. O Ba. O Оксид кальция Са. О (негашеная известь)
 Взаимодействие оксида кальция с водой ( гашение извести) Са. О + Н 2 О = Ca(OH)2
Взаимодействие оксида кальция с водой ( гашение извести) Са. О + Н 2 О = Ca(OH)2
 Характер гидроксидов Ве(ОН)2 – амфотерный гидроксид Mg(OH)2 – нерастворимое слабое основание Ca(OH)2 – малорастворимое сильное основание Sr(OH)2 Растворимые основания Гидроксид кальция Са(ОН)2 Ba(OH)2 (щелочи) – гашеная известь
Характер гидроксидов Ве(ОН)2 – амфотерный гидроксид Mg(OH)2 – нерастворимое слабое основание Ca(OH)2 – малорастворимое сильное основание Sr(OH)2 Растворимые основания Гидроксид кальция Са(ОН)2 Ba(OH)2 (щелочи) – гашеная известь
 Химические свойства Качественная реакция на гидроксид кальция – взаимодействие с углекислым газом Ca(OH)2 + СO 2 = Ca. СO 3 + H 2 O При прокаливании с углем карбонаты щелочноземельных металлов образуют карбиды: Ca. CO 3 + 3 C = Ca. C 2 + CO 2 При взаимодействии Ca. C 2 с водой получается ацетилен: Ca. C 2 + 2 H 2 O = Ca(OH)2 + C 2 H 2 При обжиге карбонатов образуются оксиды: Ca. CO 3 = Ca. O + CO 2
Химические свойства Качественная реакция на гидроксид кальция – взаимодействие с углекислым газом Ca(OH)2 + СO 2 = Ca. СO 3 + H 2 O При прокаливании с углем карбонаты щелочноземельных металлов образуют карбиды: Ca. CO 3 + 3 C = Ca. C 2 + CO 2 При взаимодействии Ca. C 2 с водой получается ацетилен: Ca. C 2 + 2 H 2 O = Ca(OH)2 + C 2 H 2 При обжиге карбонатов образуются оксиды: Ca. CO 3 = Ca. O + CO 2
 Качественная реакция на ионы щелочноземельных металлов Катионы Ca 2+, Sr 2+, Ba 2+ при действии серной кислоты (или ее солей) образуют белые осадки различной растворимости. Наиболее растворимый – сульфат кальция в ходе анализа осаждается серной кислотой не полностью. Ca. Сl 2 + H 2 SO 4 = Ca. SO 4 + HCl Соли кальция окрашивают пламя в красно- кирпичный цвет, соли бария в зеленый, соли стронция в розовый
Качественная реакция на ионы щелочноземельных металлов Катионы Ca 2+, Sr 2+, Ba 2+ при действии серной кислоты (или ее солей) образуют белые осадки различной растворимости. Наиболее растворимый – сульфат кальция в ходе анализа осаждается серной кислотой не полностью. Ca. Сl 2 + H 2 SO 4 = Ca. SO 4 + HCl Соли кальция окрашивают пламя в красно- кирпичный цвет, соли бария в зеленый, соли стронция в розовый
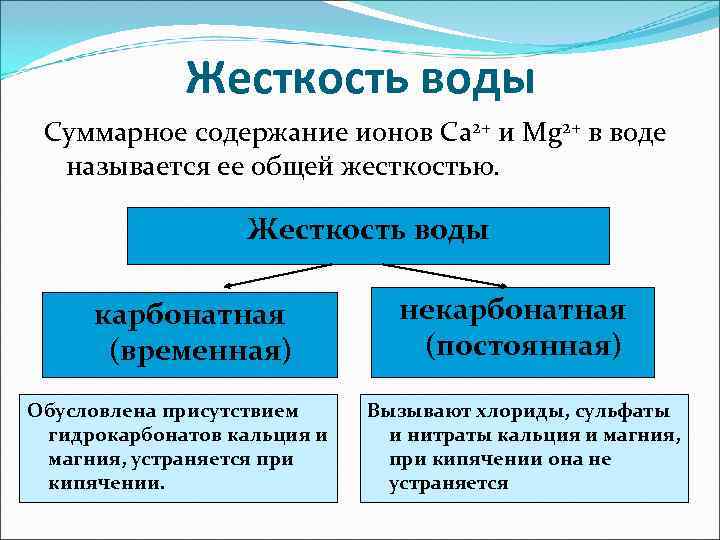
 Жесткость воды Суммарное содержание ионов Ca 2+ и Mg 2+ в воде называется ее общей жесткостью. Жесткость воды карбонатная некарбонатная (временная) (постоянная) Обусловлена присутствием Вызывают хлориды, сульфаты гидрокарбонатов кальция и и нитраты кальция и магния, устраняется при кипячении она не кипячении. устраняется
Жесткость воды Суммарное содержание ионов Ca 2+ и Mg 2+ в воде называется ее общей жесткостью. Жесткость воды карбонатная некарбонатная (временная) (постоянная) Обусловлена присутствием Вызывают хлориды, сульфаты гидрокарбонатов кальция и и нитраты кальция и магния, устраняется при кипячении она не кипячении. устраняется
 Жесткость воды выражают суммой миллимоль эквивалентов ионов Ca 2+ и Mg 2+, содержащихся в 1 л воды. Жесткость воды – это суммарная эквивалентная концентрация ионов Ca 2+ и Mg 2+. Ж = 2[Ca 2+] + 2[Mg 2+] [Ca 2+] и [Mg 2+] – молярные концентрации ионов Ca 2+ и Mg 2+, ммоль/л. [Ca 2+] и [Mg 2+] – концентрации ионов Ca 2+ и Mg 2+, мг/л.
Жесткость воды выражают суммой миллимоль эквивалентов ионов Ca 2+ и Mg 2+, содержащихся в 1 л воды. Жесткость воды – это суммарная эквивалентная концентрация ионов Ca 2+ и Mg 2+. Ж = 2[Ca 2+] + 2[Mg 2+] [Ca 2+] и [Mg 2+] – молярные концентрации ионов Ca 2+ и Mg 2+, ммоль/л. [Ca 2+] и [Mg 2+] – концентрации ионов Ca 2+ и Mg 2+, мг/л.
 Карбонатная жесткость 1) Кипячение (используется в быту): Ca(HCO 3)2 Ca. CO 3 + CO 2 + H 2 O Mg(HCO 3)2 Mg(OH)2 + 2 CO 2. 2) Действие известкового молока Ca(OH)2 или соды Na 2 CO 3 (используется в промышленности): Ca(HCO 3)2 + Ca(OH)2 = 2 Ca. CO 3 + 2 H 2 O Ca(HCO 3)2 + Na 2 CO 3 = Ca. CO 3 + 2 Na. HCO 3 Mg(HCO 3)2 + Ca(OH)2 = Mg(OH)2 + Ca. CO 3 + CO 2 + H 2 O Mg(HCO 3)2 + Na 2 CO 3 = Mg. CO 3 + 2 Na. HCO 3.
Карбонатная жесткость 1) Кипячение (используется в быту): Ca(HCO 3)2 Ca. CO 3 + CO 2 + H 2 O Mg(HCO 3)2 Mg(OH)2 + 2 CO 2. 2) Действие известкового молока Ca(OH)2 или соды Na 2 CO 3 (используется в промышленности): Ca(HCO 3)2 + Ca(OH)2 = 2 Ca. CO 3 + 2 H 2 O Ca(HCO 3)2 + Na 2 CO 3 = Ca. CO 3 + 2 Na. HCO 3 Mg(HCO 3)2 + Ca(OH)2 = Mg(OH)2 + Ca. CO 3 + CO 2 + H 2 O Mg(HCO 3)2 + Na 2 CO 3 = Mg. CO 3 + 2 Na. HCO 3.
 Постоянная жесткость 1) Постоянную жесткость устраняют добавлением соды или фосфата натрия: Ca. SO 4 + Na 2 CO 3 = Ca. CO 3 + Na 2 SO 4 3 Ca. SO 4 + 2 Na 3 PO 4 = Ca 3(PO 4)2 + 3 Na 2 SO 4 2) Метод ионного обмена: воду пропускают через слой катионита. Вещества, которые способны обменивать свои ионы на катионы из раствора, называются катионообменниками (катионитами); на анионы из раствора – анионообменниками (анионитами). Ca 2+ + Na. R = Na+ + Ca. R
Постоянная жесткость 1) Постоянную жесткость устраняют добавлением соды или фосфата натрия: Ca. SO 4 + Na 2 CO 3 = Ca. CO 3 + Na 2 SO 4 3 Ca. SO 4 + 2 Na 3 PO 4 = Ca 3(PO 4)2 + 3 Na 2 SO 4 2) Метод ионного обмена: воду пропускают через слой катионита. Вещества, которые способны обменивать свои ионы на катионы из раствора, называются катионообменниками (катионитами); на анионы из раствора – анионообменниками (анионитами). Ca 2+ + Na. R = Na+ + Ca. R

