Идеальный газ. Изопроцесс.pptx
- Количество слайдов: 45
 Идеальный газ. Основное уравнение МКТ и газовые законы Преподаватель Черткова Е. Н.
Идеальный газ. Основное уравнение МКТ и газовые законы Преподаватель Черткова Е. Н.
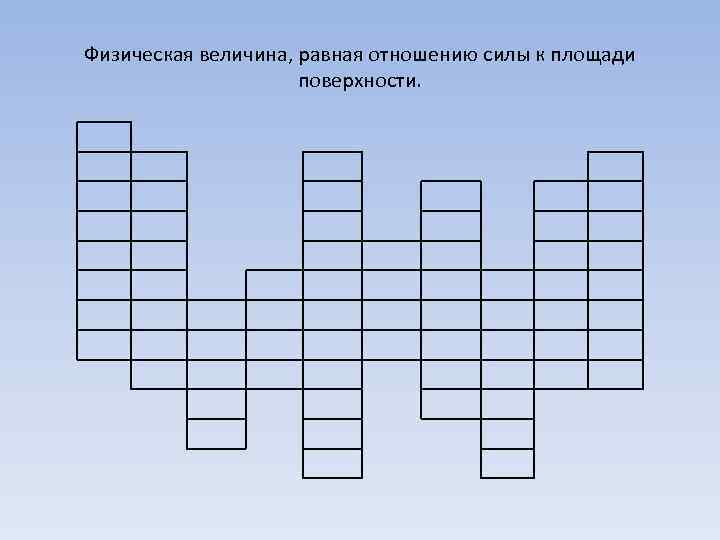 Физическая величина, равная отношению силы к площади поверхности.
Физическая величина, равная отношению силы к площади поверхности.
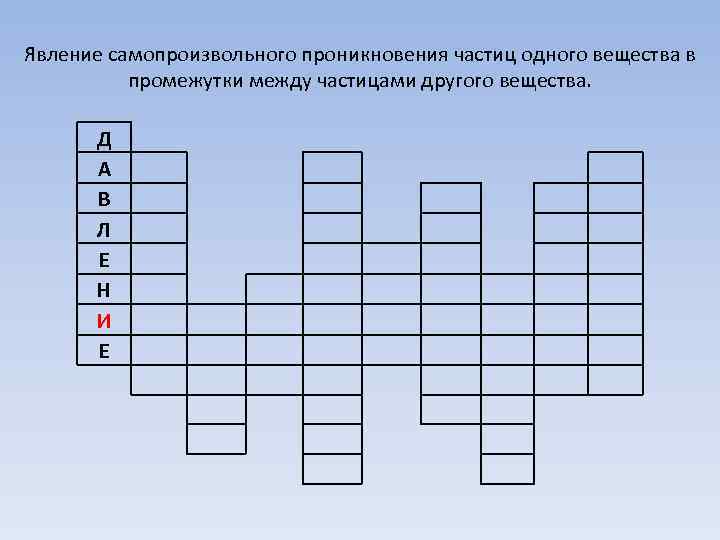 Явление самопроизвольного проникновения частиц одного вещества в промежутки между частицами другого вещества. Д А В Л Е Н И Е
Явление самопроизвольного проникновения частиц одного вещества в промежутки между частицами другого вещества. Д А В Л Е Н И Е
 Макроскопический параметр газа измеряемый в м 3 Д А В Л Е Н И Е Д И Ф Ф У З И Я
Макроскопический параметр газа измеряемый в м 3 Д А В Л Е Н И Е Д И Ф Ф У З И Я
 Для подтверждения теории физики ставят… Д А В Л Е Н И Е Д И Ф Ф У З И Я О Б Ъ Е М .
Для подтверждения теории физики ставят… Д А В Л Е Н И Е Д И Ф Ф У З И Я О Б Ъ Е М .
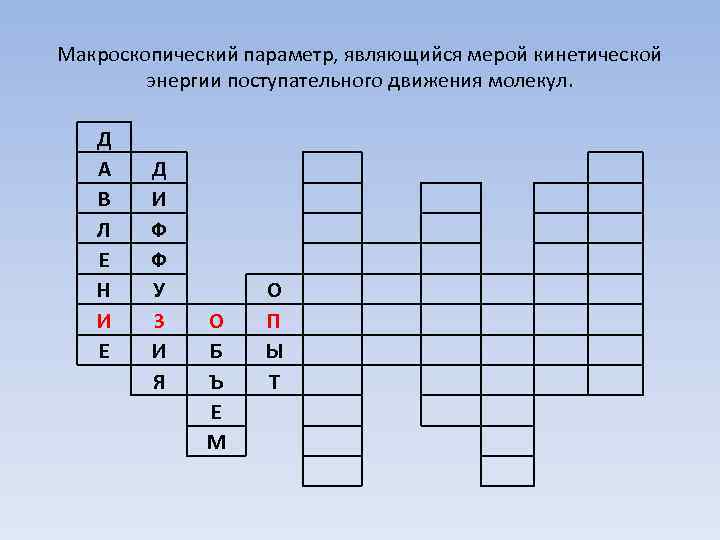 Макроскопический параметр, являющийся мерой кинетической энергии поступательного движения молекул. Д А В Л Е Н И Е Д И Ф Ф У З И Я О Б Ъ Е М О П Ы Т
Макроскопический параметр, являющийся мерой кинетической энергии поступательного движения молекул. Д А В Л Е Н И Е Д И Ф Ф У З И Я О Б Ъ Е М О П Ы Т
 Мельчайшая частица химического элемента Д А В Л Е Н И Е Д И Ф Ф У З И Я О Б Ъ Е М О П Ы Т Т Е М П Е Р А Т У Р А .
Мельчайшая частица химического элемента Д А В Л Е Н И Е Д И Ф Ф У З И Я О Б Ъ Е М О П Ы Т Т Е М П Е Р А Т У Р А .
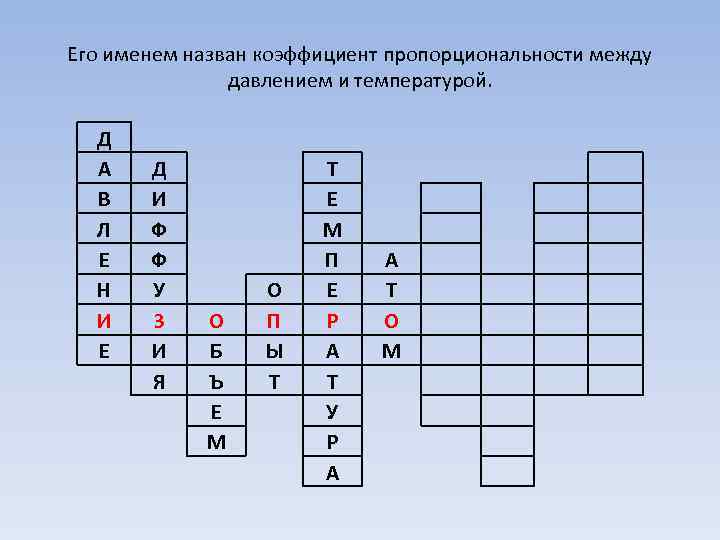 Его именем назван коэффициент пропорциональности между давлением и температурой. Д А В Л Е Н И Е Д И Ф Ф У З И Я О Б Ъ Е М О П Ы Т Т Е М П Е Р А Т У Р А А Т О М
Его именем назван коэффициент пропорциональности между давлением и температурой. Д А В Л Е Н И Е Д И Ф Ф У З И Я О Б Ъ Е М О П Ы Т Т Е М П Е Р А Т У Р А А Т О М
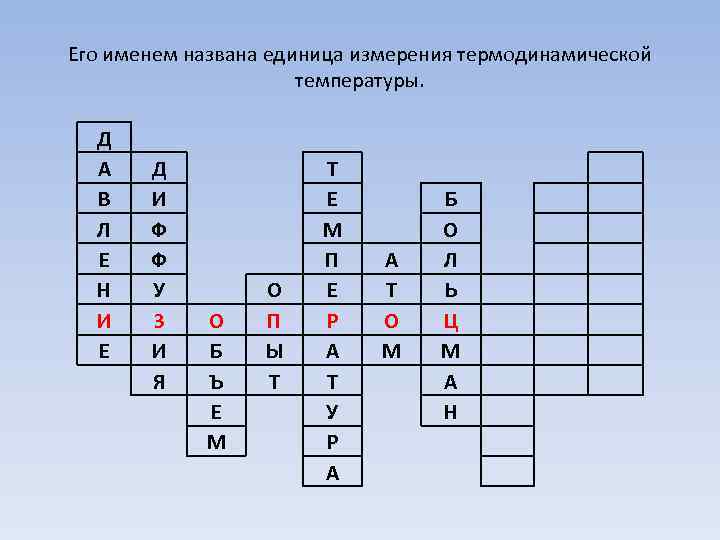 Его именем названа единица измерения термодинамической температуры. Д А В Л Е Н И Е Д И Ф Ф У З И Я О Б Ъ Е М О П Ы Т Т Е М П Е Р А Т У Р А А Т О М Б О Л Ь Ц М А Н
Его именем названа единица измерения термодинамической температуры. Д А В Л Е Н И Е Д И Ф Ф У З И Я О Б Ъ Е М О П Ы Т Т Е М П Е Р А Т У Р А А Т О М Б О Л Ь Ц М А Н
 Ученый, взявший за 00 точку плавления льда. Д А В Л Е Н И Е Д И Ф Ф У З И Я О Б Ъ Е М О П Ы Т Т Е М П Е Р А Т У Р А А Т О М Б О Л Ь Ц М А Н К Е Л Ь В И Н
Ученый, взявший за 00 точку плавления льда. Д А В Л Е Н И Е Д И Ф Ф У З И Я О Б Ъ Е М О П Ы Т Т Е М П Е Р А Т У Р А А Т О М Б О Л Ь Ц М А Н К Е Л Ь В И Н
 Микроскопический параметр, увеличивающийся с ростом температуры. Д А В Л Е Н И Е Д И Ф Ф У З И Я О Б Ъ Е М О П Ы Т Т Е М П Е Р А Т У Р А А Т О М Б О Л Ь Ц М А Н К Е Л Ь В И Н Ц Е Л Ь С И Й
Микроскопический параметр, увеличивающийся с ростом температуры. Д А В Л Е Н И Е Д И Ф Ф У З И Я О Б Ъ Е М О П Ы Т Т Е М П Е Р А Т У Р А А Т О М Б О Л Ь Ц М А Н К Е Л Ь В И Н Ц Е Л Ь С И Й
 МОЛОДЦЫ Д А В Л Е Н И Е Д И Ф Ф У З И Я О Б Ъ Е М О П Ы Т Т Е М П Е Р А Т У Р А А Т О М Б О Л Ь Ц М А Н К Е Л Ь В И Н Ц Е Л Ь С И Й С К О Р О С Т Ь
МОЛОДЦЫ Д А В Л Е Н И Е Д И Ф Ф У З И Я О Б Ъ Е М О П Ы Т Т Е М П Е Р А Т У Р А А Т О М Б О Л Ь Ц М А Н К Е Л Ь В И Н Ц Е Л Ь С И Й С К О Р О С Т Ь
 «Посев научный взойдет для жатвы народной!» (Дмитрий Иванович Менделеев)
«Посев научный взойдет для жатвы народной!» (Дмитрий Иванович Менделеев)
 Идеальный газ (модель) 1. Совокупность большого числа молекул массой m 0, размерами молекул пренебрегают (принимают молекулы за материальные точки). 2. Молекулы находятся на больших расстояниях друг от друга и движутся хаотически. 3. Молекулы взаимодействуют по законам упругих столкновений , силами притяжения между молекулами пренебрегают. 4. Скорости молекул разнообразны, но при определенной температуре средняя скорость молекул остается постоянной.
Идеальный газ (модель) 1. Совокупность большого числа молекул массой m 0, размерами молекул пренебрегают (принимают молекулы за материальные точки). 2. Молекулы находятся на больших расстояниях друг от друга и движутся хаотически. 3. Молекулы взаимодействуют по законам упругих столкновений , силами притяжения между молекулами пренебрегают. 4. Скорости молекул разнообразны, но при определенной температуре средняя скорость молекул остается постоянной.
 ПОЧЕМУ ГАЗ ОКАЗЫВАЕТ ДАВЛЕНИЕ ?
ПОЧЕМУ ГАЗ ОКАЗЫВАЕТ ДАВЛЕНИЕ ?




 Таким образом, имеем зависимость ОСНОВНОЕ УРАВНЕНИЕ МКТ Где: n – концентрация газа m 0 – масса молекулы V 2 – среднеквадратичная скорость молекулы Связь давления и абсолютной температуры
Таким образом, имеем зависимость ОСНОВНОЕ УРАВНЕНИЕ МКТ Где: n – концентрация газа m 0 – масса молекулы V 2 – среднеквадратичная скорость молекулы Связь давления и абсолютной температуры
 Каким образом можно на опыте изменять среднюю кинетическую энергию движения молекул в сосуде неизменного объема?
Каким образом можно на опыте изменять среднюю кинетическую энергию движения молекул в сосуде неизменного объема?

 Связь между макроскопическими параметрами идеального газа
Связь между макроскопическими параметрами идеального газа
 Клапейрон Бенуа Поль Эмиль • (26. I. 1799– 28. I. 1864) • Французский физик, член Парижской АН (1858). Окончил Политехническую школу в Париже (1818). В 1820– 30 работал в Петербурге в институте инженеров путей сообщения.
Клапейрон Бенуа Поль Эмиль • (26. I. 1799– 28. I. 1864) • Французский физик, член Парижской АН (1858). Окончил Политехническую школу в Париже (1818). В 1820– 30 работал в Петербурге в институте инженеров путей сообщения.
 Менделеев Дмитрий Иванович (8. II. 1834– 2. II. 1907) • Русский ученыйэнциклопедист. . В 1874 вывел общее уравнение состояния идеального газа, обобщив уравнение Клапейрона (уравнение Клапейрона– Менделеева). •
Менделеев Дмитрий Иванович (8. II. 1834– 2. II. 1907) • Русский ученыйэнциклопедист. . В 1874 вывел общее уравнение состояния идеального газа, обобщив уравнение Клапейрона (уравнение Клапейрона– Менделеева). •
 Изопроцесс, при котором один из макроскопических параметров состояния данной массы газа остается постоянным. V, p, Т
Изопроцесс, при котором один из макроскопических параметров состояния данной массы газа остается постоянным. V, p, Т
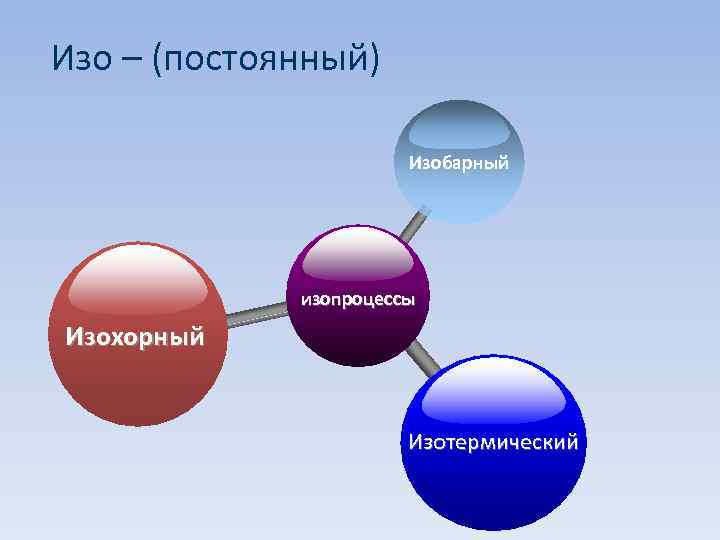 Изо – (постоянный) Изобарный изопроцессы Изохорный Изотермический
Изо – (постоянный) Изобарный изопроцессы Изохорный Изотермический
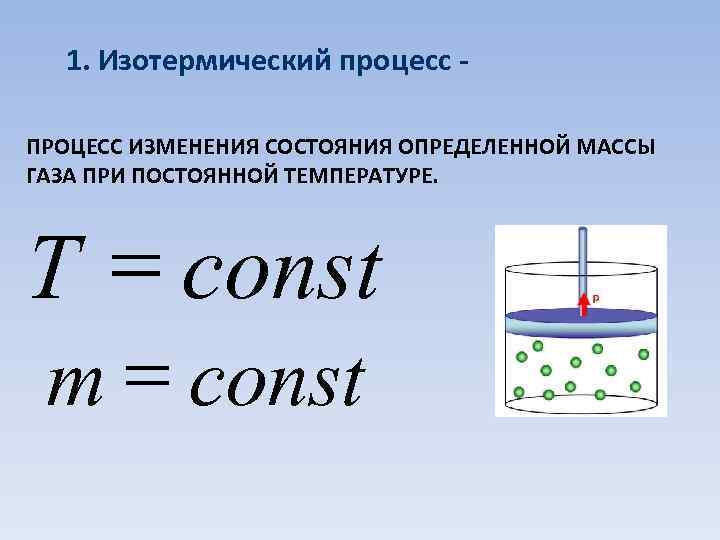 1. Изотермический процесс ПРОЦЕСС ИЗМЕНЕНИЯ СОСТОЯНИЯ ОПРЕДЕЛЕННОЙ МАССЫ ГАЗА ПРИ ПОСТОЯННОЙ ТЕМПЕРАТУРЕ. Т = const m = const
1. Изотермический процесс ПРОЦЕСС ИЗМЕНЕНИЯ СОСТОЯНИЯ ОПРЕДЕЛЕННОЙ МАССЫ ГАЗА ПРИ ПОСТОЯННОЙ ТЕМПЕРАТУРЕ. Т = const m = const
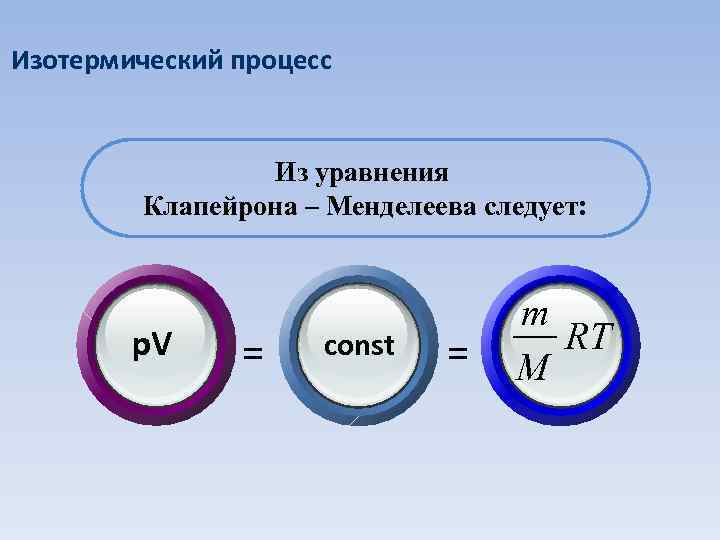 Изотермический процесс Из уравнения Клапейрона – Менделеева следует: p. V = const = m RT M
Изотермический процесс Из уравнения Клапейрона – Менделеева следует: p. V = const = m RT M
 Закон Бойля – Мариотта. Закон экспериментально получен в: • 1662 г. Р. Бойлем; • 1676 г. Э. Мариоттом. T - const Р. Бойль Для газа данной массы при постоянной температуре произведение давления газа на его объем постоянно: p 1 V 1 = p 2 V 2 Э. Мариотт
Закон Бойля – Мариотта. Закон экспериментально получен в: • 1662 г. Р. Бойлем; • 1676 г. Э. Мариоттом. T - const Р. Бойль Для газа данной массы при постоянной температуре произведение давления газа на его объем постоянно: p 1 V 1 = p 2 V 2 Э. Мариотт
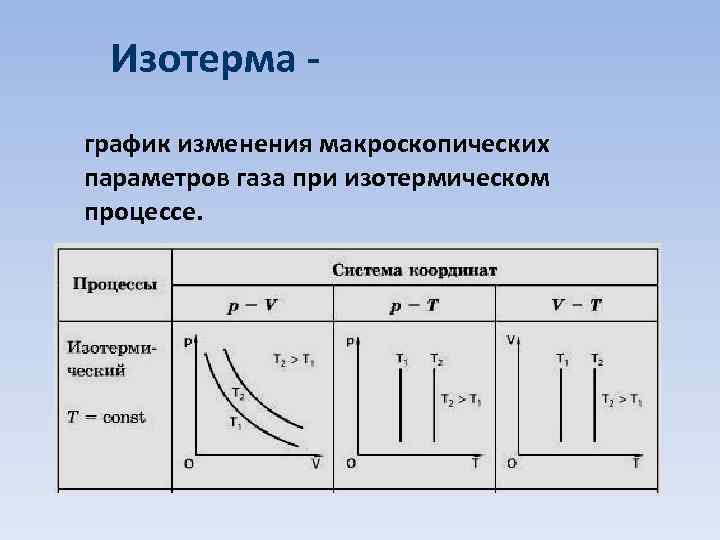 Изотерма график изменения макроскопических параметров газа при изотермическом процессе.
Изотерма график изменения макроскопических параметров газа при изотермическом процессе.
 2. Изобарный процесс ПРОЦЕСС ИЗМЕНЕНИЯ СОСТОЯНИЯ ОПРЕДЕЛЕННОЙ МАССЫ ГАЗА ПРИ ПОСТОЯННОМ ДАВЛЕНИИ. P = const m = const
2. Изобарный процесс ПРОЦЕСС ИЗМЕНЕНИЯ СОСТОЯНИЯ ОПРЕДЕЛЕННОЙ МАССЫ ГАЗА ПРИ ПОСТОЯННОМ ДАВЛЕНИИ. P = const m = const
 Изобарный процесс Из уравнения Клапейрона – Менделеева следует: V T = const = m. R Mp
Изобарный процесс Из уравнения Клапейрона – Менделеева следует: V T = const = m. R Mp
 Закон Гей-Люссака. Закон экспериментально получен в 1802 г. p - const Для газа данной массы при постоянном давлении отношение объема газа к его термодинамической температуре постоянно: V 1 / T 1 = V 2 / T 2 ГЕЙ-ЛЮССАК Жозеф Луи
Закон Гей-Люссака. Закон экспериментально получен в 1802 г. p - const Для газа данной массы при постоянном давлении отношение объема газа к его термодинамической температуре постоянно: V 1 / T 1 = V 2 / T 2 ГЕЙ-ЛЮССАК Жозеф Луи
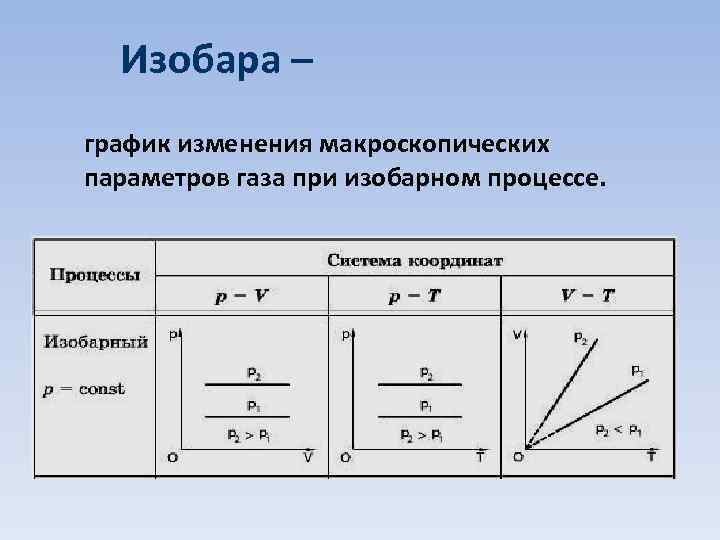 Изобара – график изменения макроскопических параметров газа при изобарном процессе.
Изобара – график изменения макроскопических параметров газа при изобарном процессе.
 3. Изохорный процесс ПРОЦЕСС ИЗМЕНЕНИЯ СОСТОЯНИЯ ОПРЕДЕЛЕННОЙ МАССЫ ГАЗА ПРИ ПОСТОЯННОМ ОБЪЕМЕ. V = const m = const
3. Изохорный процесс ПРОЦЕСС ИЗМЕНЕНИЯ СОСТОЯНИЯ ОПРЕДЕЛЕННОЙ МАССЫ ГАЗА ПРИ ПОСТОЯННОМ ОБЪЕМЕ. V = const m = const
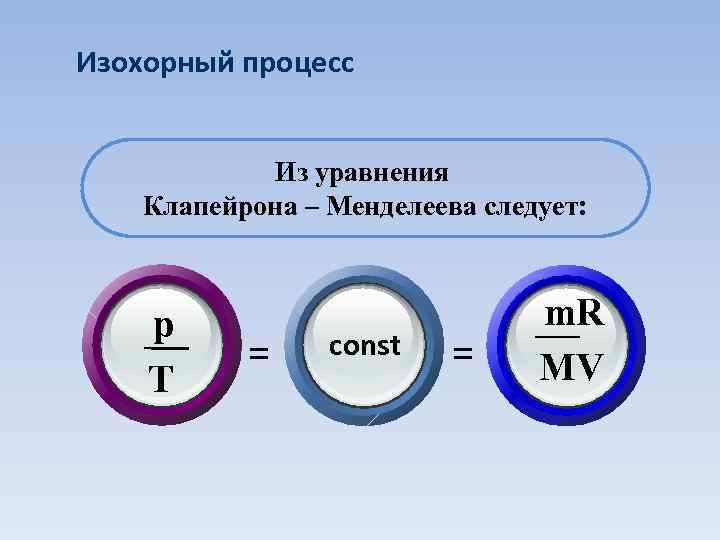 Изохорный процесс Из уравнения Клапейрона – Менделеева следует: p T = const = m. R MV
Изохорный процесс Из уравнения Клапейрона – Менделеева следует: p T = const = m. R MV
 Закон Шарля. Закон экспериментально получен в 1787 г. V - const Для газа данной массы при постоянном объеме отношение давления газа к его термодинамической температуре постоянно: p 1 / T 1 = p 2 / T 2 Ж. Шарль
Закон Шарля. Закон экспериментально получен в 1787 г. V - const Для газа данной массы при постоянном объеме отношение давления газа к его термодинамической температуре постоянно: p 1 / T 1 = p 2 / T 2 Ж. Шарль
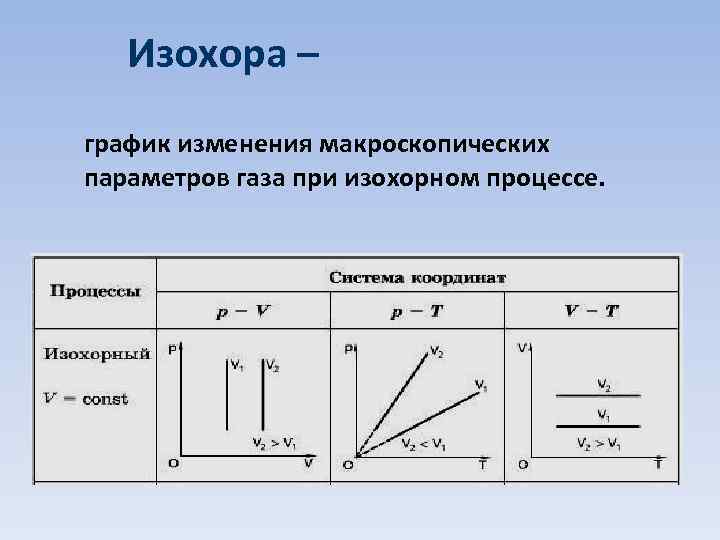 Изохора – график изменения макроскопических параметров газа при изохорном процессе.
Изохора – график изменения макроскопических параметров газа при изохорном процессе.
 Циклы.
Циклы.
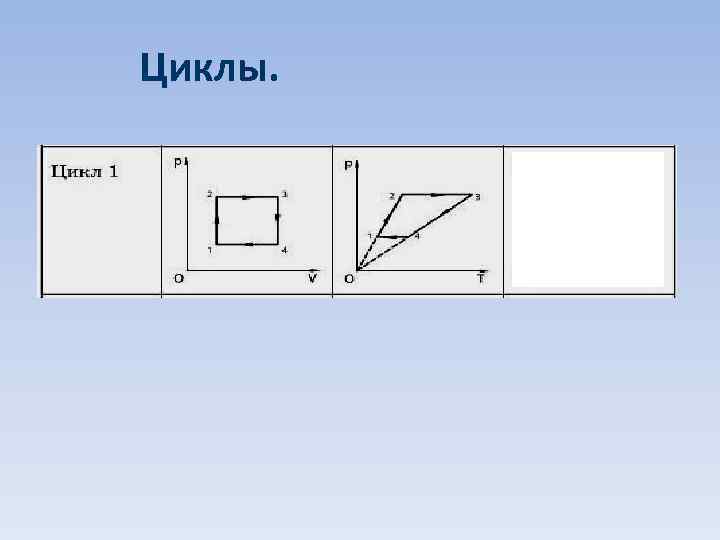 Циклы.
Циклы.
 Циклы.
Циклы.
 Циклы.
Циклы.
 Циклы.
Циклы.
 Спасибо за урок
Спасибо за урок


