2017 Чуйко Лекция 3-Биотестирование лекции.pptx
- Количество слайдов: 106

ИБВВ РАН МЕТОДЫ БИОДИАГНОСТИКИ ПРИ ЭКОТОКСИКОЛОГИЧЕСКОЙ ОЦЕНКЕ ВОДНЫХ ЭКОСИСТЕМ Курс лекций Лекция 3 Биотестирование Г. М. Чуйко Институт биологии внутренних вод им. И. Д. Папанина РАН, Борок, Россия Ярославский государственный университет им. П. Г. Демидова gchuiko@mail. ru
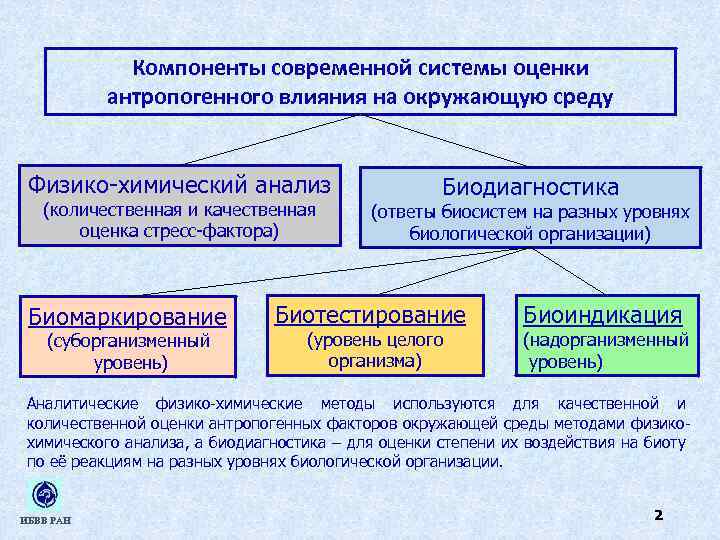
Компоненты современной системы оценки антропогенного влияния на окружающую среду Физико-химический анализ (количественная и качественная оценка стресс-фактора) Биомаркирование (суборганизменный уровень) Биодиагностика (ответы биосистем на разных уровнях биологической организации) Биотестирование (уровень целого организма) Биоиндикация (надорганизменный уровень) Аналитические физико-химические методы используются для качественной и количественной оценки антропогенных факторов окружающей среды методами физикохимического анализа, а биодиагностика – для оценки степени их воздействия на биоту по её реакциям на разных уровнях биологической организации. ИБВВ РАН 2

Биотестирование – оценка токсичности воды и донных отложений по ответным реакциям (выживаемость, размножение, рост, двигательная активность, поведение и т. п. ) тест-организмов разных экологических уровней (микроорганизмы, простейшие, одноклеточные водоросли, беспозвоночные, икра, мальки и взрослые рыбы) из лабораторных культур; ИБВВ РАН 3

Биотестирование используют для: • оценки токсичности природной воды, • оценки токсичности сточных вод, • оценки токсичности питьевой воды, • оценки токсичности водных растворов химических при разработке ПДК, • оценки токсичности донных отложений, • оценки токсичности воздуха, • при скрининге токсичности вновь синтезируемых химических веществ, • установления класса опасности отходов. ИБВВ РАН 4

С исторической точки зрения один из первых биотестов, примененных человеком – использование шахтерами в средние века (XVI-XIX вв. ) канареек для обнаружения скопления газа рудничных газов (метана, углекислого и угарного газов) в забоях при разработке угля конце. В гидробиологии биотестирование известно с начала XX в. как «рыбная проба» , когда для оценки токсичности воды начали использовать рыб. 5

Биотестирование как способ оценки качества воды вошел в практику в начале ХХ в. , когда для токсикологической характеристики широко использовали «рыбную пробу» . Первые биотесты на планктонных ракообразных – дафниях и циклопах, были выполнены в 1918 г. В дальнейшем основным тест-объектом длительное время служила Daphnia magna. С конца 30 -х годов в качестве тест-объектов стали широко использоваться гидробионты разного систематического и трофического уровня. В 1940 – 1941 гг. в систему испытаний включили простейших, ракообразных, червей и рыб. 6

Однако целенаправленная разработка и развитие методов биотестирования началось в конце 60 -х – начале 70 -х ХХ в. , что на 20 лет раньше методов биомаркирования и биоиндикации. Советский Союз (СССР), вместе с США и Германией занимал лидирующие позиции в мире в этом вопросе. Исследования проводились большим коллективом отечественных водных токсикологов при решающем участии Н. С. Строганова (МГУ), Л. А. Лесников (Гос. НОРХ), Б. А. Флеров (ИБВВ РАН), В. А. Терехова (МГУ), И. И. Томилина (ИБВВ РАН) и др. 7 ИБВВ РАН

В 1980 г. была признана необходимость использования биотестирования как показателя оперативной интегральной диагностики качества вод. В 1981 -1986 гг. методики биотестирования были апробированы и рекомендованы для определения токсичности сточных и природных вод. В 1990 г. по итогам апробации ВНИИВО было подготовлено и утверждено Госкомприрода СССР «Методическое руководство по биотестированию вод (РД 118 -02 -90). В эту документ вошли методики с использованием тест-объектов – представителей основных трофических звеньев водных экосистем: микроводорослей, ракообразных и рыб. 8 ИБВВ РАН

В 1999 г. Минприрода РФ и Госэкология РФ утвердили методики для определения токсичности: воды с использованием инфузорий и ракообразных (ПНД Ф Т 14. 1: 2: 3: 4. 2 -98; ПНД Ф Т 14. 1: 2: 3: 4. 3 -99; ПНД Ф Т 14. 1: 2: 3: 4. 4 -99); вод, почв и донных отложений с использованием ферментативной активности бактерий (ПНД Ф Т 14. 1: 2: 3: 4. 1 -96; ПНД Ф Т 16. 2: 2: 3: 1. 2 -96). В настоящее время биотесты введены в стандарты на качество воды во многих странах мира. 9 ИБВВ РАН

За биологические показатели оценки качества воды были приняты: 1. Острая летальная токсичность Выживаемость 2. Хроническая сублетальная токсичность Репродуктивная способность (размножение) Выживаемость нарождающейся молоди Темп рост Изменение массы Поведенческие реакции – двигательная активность, реакция избегания, интенсивность питания Внешнее проявление физиологических функций – частота дыхания, частота сердечных сокращений, внешний симптомокомплекс и т. д. 10

Острая летальная токсичность Токсическое действие, проявляющееся за период экспозиции к токсическому фактору не более 96 ч и заканчивающееся гибелью организма. Токсикометрический критерий: ЛК 50 (LC 50 ) – летальная (смертельная) концентрация (lethal concentration), вызывающая по сравнению с контролем гибель 50% и более тест-организмов за 96 ч экспозиции. ЛД 50 (LD 50 ) – летальная (смертельная) доза (lethal dose), вызывающая гибель 50% и более тест-организмов за 96 ч экспозиции. 11

Хроническая сублетальная токсичность Токсическое действие, проявляющееся за период экспозиции к токсическому фактору более 96 ч и проявляющееся в специфическом симптомокомплексе отравления, который включает изменение внешнего вида, нарушение поведения и внешнего проявления физиологических функций организма. Токсикометрический критерий: ЭК 20 (EC 20 ) – эффективная концентрация (effect concentration), вызывающая изменения в регистрируемых параметрах у 50% тест-организмов более чем за 96 ч экспозиции. ЭД 20 (ED 20 ) – эффективная доза (effect dose), вызывающая изменения в регистрируемых параметрах у 20% тесторганизмов за более чем 96 ч экспозиции. 12

Термины и определения Тест-реакция (функция) – изменение (ответ) какого либо показателя тест объекта под воздействием токсических веществ. Ю содержащихся в окружающей среде или тестируемом объекте. Тест-параметр – количественное выражение тест реакции. Критерий токсичности – значение тест параметра или правило, на основании которого делают вывод о токсичности исследуемой среды. 13 ИБВВ РАН

Термины и определения Измерительная система (прибор) – дает количественную характеристику ответной реакции тест объекта на воздействие внешних факторов. Воспроизводимость результатов – характеристика качества биотестирования, отражающая близость результатов, полученных по данной методике, на одном и том же эталонном веществе, но в различных условиях (разные операторы, разные лаборатории, разное время). 14 ИБВВ РАН

Термины и определения Сходимость результатов – характеристика качества биотестирования, отражающая близость результатов, полученных по одной методике, на одном и том же эталонном веществе, в одних условиях (один оператор, одна лаборатории, одно и то же время). 15 ИБВВ РАН

Биотестирование обладает меньшей оперативностью ответа, чем биомаркирование (от нескольких часов до нескольких недель), но его экологическая значимость на уровне отдельной особи более очевидна: гибель организма, снижение репродуктивной способности вплоть до прекращения воспроизводства, нарушения роста, развития, различных типов поведения и т. д. 16 ИБВВ РАН
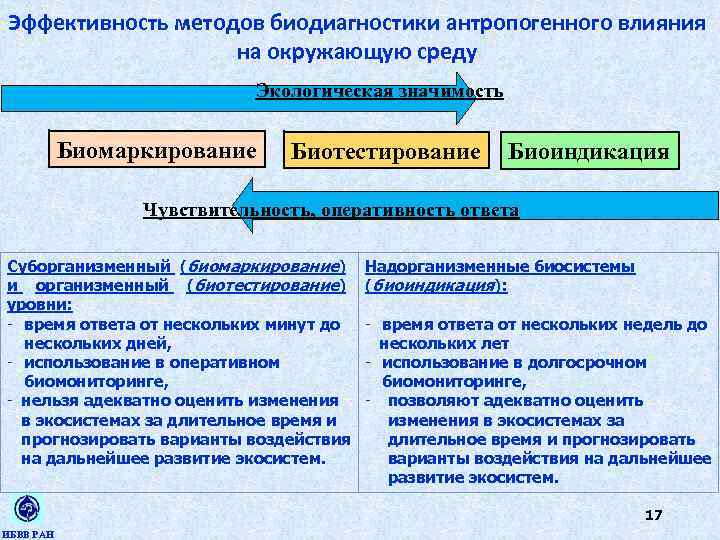
Эффективность методов биодиагностики антропогенного влияния на окружающую среду Экологическая значимость Биомаркирование Биотестирование Биоиндикация Чувствительность, оперативность ответа Суборганизменный (биомаркирование) и организменный (биотестирование) уровни: - время ответа от нескольких минут до нескольких дней, - использование в оперативном биомониторинге, - нельзя адекватно оценить изменения в экосистемах за длительное время и прогнозировать варианты воздействия на дальнейшее развитие экосистем. Надорганизменные биосистемы (биоиндикация): - время ответа от нескольких недель до нескольких лет - использование в долгосрочном биомониторинге, - позволяют адекватно оценить изменения в экосистемах за длительное время и прогнозировать варианты воздействия на дальнейшее развитие экосистем. 17 ИБВВ РАН

Биотестирование Использование нескольких тест-организмов из разных экологических групп (простейшие, микроводоросли, беспозвоночные, высшие растения, рыб) Показатели: выживаемость, рост, стадии развития, двигательная активность, репродуктивные способности, поведенческие реакции, внешние морфо-анатомические проявления 18 ИБВВ РАН
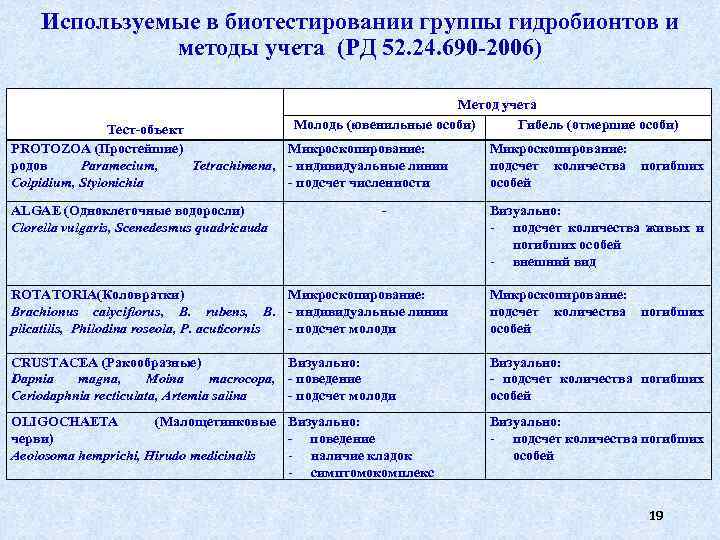
Используемые в биотестировании группы гидробионтов и методы учета (РД 52. 24. 690 -2006) Метод учета Молодь (ювенильные особи) Гибель (отмершие особи) Тест-объект PROTOZOA (Простейшие) Микроскопирование: родов Paramecium, Tetrachimena, - индивидуальные линии Colpidium, Stylonichia - подсчет численности ALGAE (Одноклеточные водоросли) Clorella vulgaris, Scenedesmus quadricauda - Микроскопирование: подсчет количества погибших особей Визуально: подсчет количества живых и погибших особей внешний вид ROTATORIA(Коловратки) Микроскопирование: Brachionus calyciflorus, B. rubens, B. - индивидуальные линии plicatilis, Philodina roseola, Р. acuticornis - подсчет молоди Микроскопирование: подсчет количества погибших особей CRUSTACEA (Ракообразные) Визуально: Dapnia magna, Moina macrocopa, - поведение Ceriodaphnia recticulata, Artemia salina - подсчет молоди Визуально: - подсчет количества погибших особей OLIGOCHAETA (Малощетинковые Визуально: черви) - поведение Aeolosoma hemprichi, Hirudo medicinalis наличие кладок симптомокомплекс Визуально: подсчет количества погибших особей 19
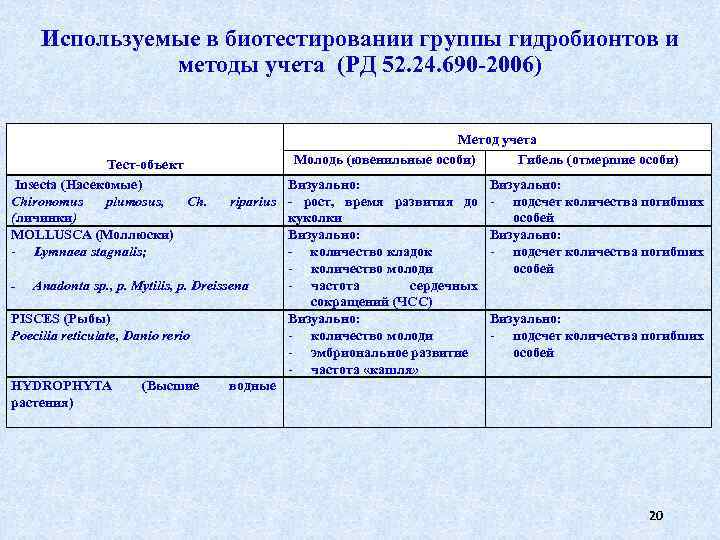
Используемые в биотестировании группы гидробионтов и методы учета (РД 52. 24. 690 -2006) Тест-объект Insecta (Насекомые) Chironomus plumosus, Ch. (личинки) МOLLUSCA (Моллюски) Lymnaea stagnalis; Метод учета Молодь (ювенильные особи) Гибель (отмершие особи) Визуально: riparius - рост, время развития до куколки Визуально: - количество кладок количество молоди - Anadonta sp. , p. Mytilis, р. Dreissena частота сердечных сокращений (ЧСС) PISCES (Рыбы) Визуально: Poecilia reticulate, Danio rerio количество молоди эмбриональное развитие частота «кашля» HYDROPHYTA (Высшие водные растения) Визуально: подсчет количества погибших особей 20
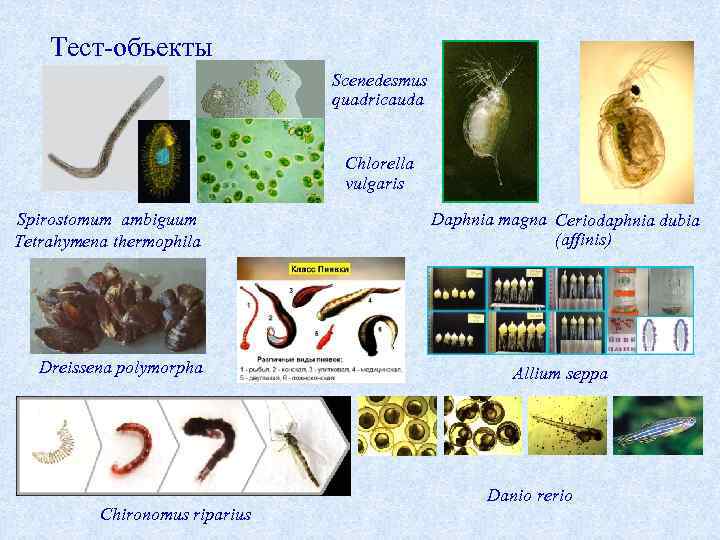
Тест объекты Scenedesmus quadricauda Chlorella vulgaris Spirostomum ambiguum Tetrahymena thermophila Dreissena polymorpha Chironomus riparius Daphnia magna Ceriodaphnia dubia (affinis) Allium seppa Danio rerio

Заслуживают внимания специализированные методы биотестирования Интенсивно развиваются биосенсорные методы выявления токсичности вод. Разрабатываются электрохимические, оптические (на основе абсорбции, флюоресценции, люминесценции), акустические и оптикоэлектронные приборы. Биосенсорами, т. е. чувствительными элементами в них, служат ферменты, антитела, нуклеиновые кислоты, микробные клетки. К числу явных преимуществ биосенсорных методов анализа можно отнести их направленность на определение конкретных загрязняющих веществ. При разработке новых биосенсорных методик биотестирования токсичности водной среды особое внимание в ряду тест-объектов занимают светящиеся бактерии. Природные штаммы этих бактерий, а также генно-инженерные конструкции, используют в качестве биологической основы биосенсоров – биоэлектронных систем, позволяющих в режиме on line регистрировать гибель, или изменение параметров метаболизма живых систем. 22

Биосе нсор — это аналитический прибор, в котором для определения химических соединений используются реакции этих соединений, катализируемые ферментами, иммунохимические реакции или реакции, проходящие в органеллах, клетках или тканях. В биосенсорах биологический компонент сочетается с физикохимическим преобразователем. В зависимости от классифицируют на: • • • типа преобразователя, биосенсоры Оптические Акустические Калориметрические Термические Электрохимические • потенциометрические, • амперометрические • кондуктометрические. 23

Биосенсоры состоят из трёх частей: • биоселективного элемента (биологический материал, например ткани, микроорганизмы, органеллы, клеточные рецепторы, ферменты, антитела, нуклеиновые кислоты, и т. д. ), материал биологического происхождения или биомимик). Чувствительный элемент может быть создан с помощью биоинженерии. • преобразователя (работает на физико-химических принципах; оптический, пьезоэлектрический, электрохимический, и т. д. ), который преобразует сигнал, появляющийся в результате взаимодействия аналита с биоселективным элементом, в другой сигнал, который проще измерить; • связанная электроника, которая отвечает в первую очередь за отображение результатов в удобном для пользователя виде; • программное обеспечение (интерфейс). 24

Самый известный пример коммерческого биосенсора — это биосенсор для измерения уровня глюкозы в крови, в котором используется фермент глюкозоксидаза для расщепления содержащейся в крови глюкозы. В процессе расщепления фермент сначала окисляет глюкозу и использует два электрона для восстановления ФАД (компонент фермента) в ФАДН 2, который, в свою очередь, окисляется в несколько ступеней электродом. Результирующий ток пропорционален концентрации глюкозы. В этом случае, электрод является преобразователем, а фермент — биоселективным элементом. 25

Биочип Микромножество либо матрица с нанесёнными молекулами белков, нуклеиновых кислот, биомакромолекул или биоструктур для одновременного проведения большого числа анализов в одном образце; или электронное устройство, содержащее биологические молекулы. Матрица с встроенными биологическими макромолекулами, которые способны избирательно связывать вещества в исследуемом растворе. Устройство представляет собой обычно стеклянную или пластиковую пластину с микротестами на основе ДНК или белков, чаще ферментативных, которые при облучении светов могут излучать люминесценцию разного цвета. Технология микрочипов нашла широкое применение в связи с высокой чувствительностью, специфичностью, простотой выполнения и широким спектром анализа, и, конечно, низкой стоимостью проведения процедуры. 26

Биочип 27
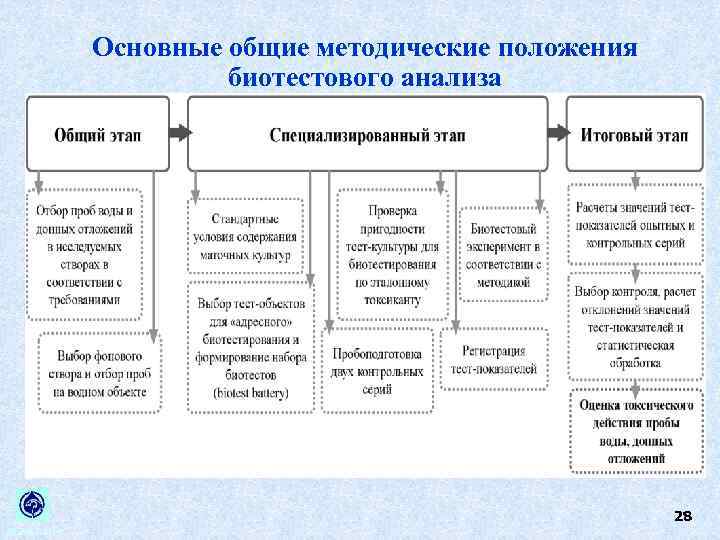
Основные общие методические положения биотестового анализа 28 ИБВВ РАН

Методы, с помощью которых дается заключение о качестве окружающей водной среды (воды, донных отложений) должны отвечать ряду требований: • Должно быть использовано не менее 2 тест организмов • Тест организмы должны систематическим группам. принадлежать к разным • Тест организмы должны принадлежать к разным трофическим уровням. Это позволит оценить возможное воздействие загрязнителей сразу на несколько звеньев водных экосистем. • Все условия проведения биотестирования (световой и температурный режимы, газообмен и состав культивационных сред) должны быть максимально стандартизированы. Это важно для получения воспроизводимых результатов, выполняемых в разных лабораториях. 29
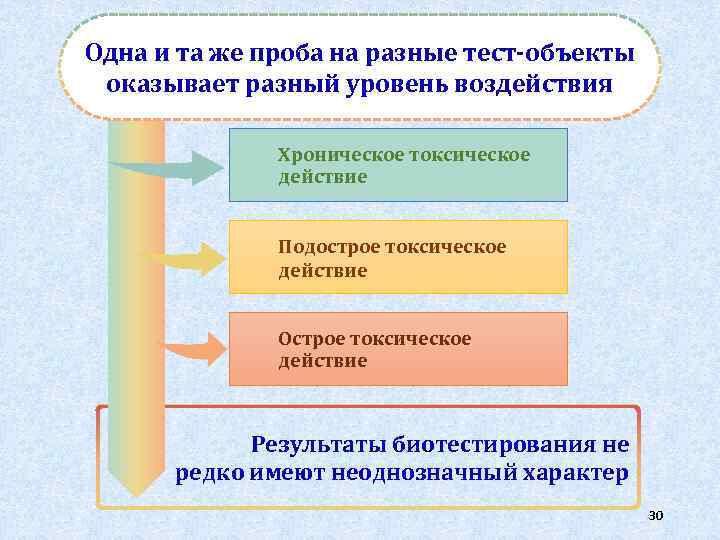
Одна и та же проба на разные тест-объекты оказывает разный уровень воздействия Хроническое токсическое действие Подострое токсическое действие Острое токсическое действие Результаты биотестирования не редко имеют неоднозначный характер 30
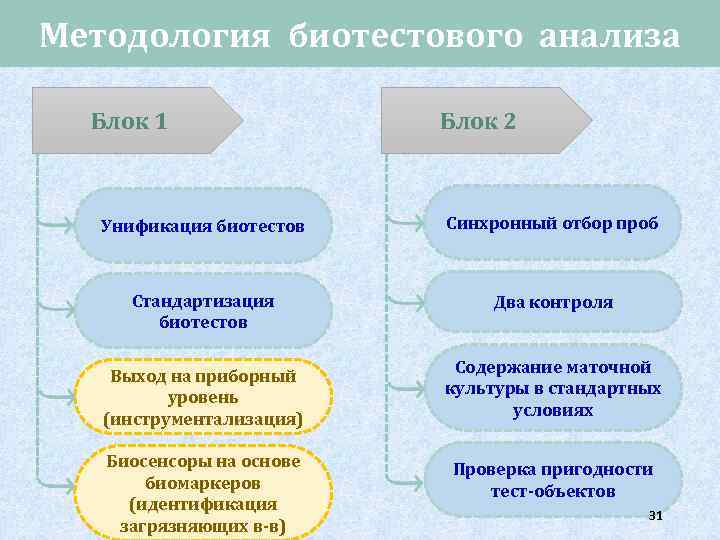
Методология биотестового анализа Блок 1 Блок 2 Унификация биотестов Синхронный отбор проб Стандартизация биотестов Два контроля Выход на приборный уровень (инструментализация) Содержание маточной культуры в стандартных условиях Биосенсоры на основе биомаркеров (идентификация загрязняющих в-в) Проверка пригодности тест-объектов 31
Методология Блок 3 Набор биотестов (biotest battery) Экспресс-биотесты Этологические биотесты Длительные биотесты (prolong test) Адресное биотестирование Знание и учет эколого-биологических особенностей тест-объектов Блок 4 Регулярность биотестовых исследований водного объекта Использование биотестирования в качестве скрининга Определение кратности разбавления в случае ОТД Итоговая оценка токсичности по набору биотестов 32
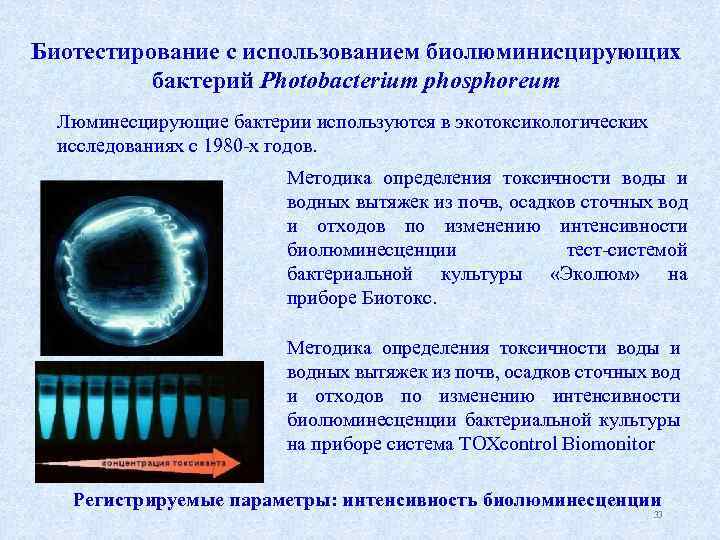
Биотестирование с использованием биолюминисцирующих бактерий Photobacterium phosphoreum Люминесцирующие бактерии используются в экотоксикологических исследованиях с 1980 х годов. Методика определения токсичности воды и водных вытяжек из почв, осадков сточных вод и отходов по изменению интенсивности биолюминесценции тест системой бактериальной культуры «Эколюм» на приборе Биотокс. Методика определения токсичности воды и водных вытяжек из почв, осадков сточных вод и отходов по изменению интенсивности биолюминесценции бактериальной культуры на приборе система TOXcontrol Biomonitor Регистрируемые параметры: интенсивность биолюминесценции 33

Прибор токсикологического контроля «Биотокс10 М» Предназначен для быстрого количественного контроля на основе биолюминесцентного анализа степени интегральной токсичности проб воды и водных вытяжек из различных объектов окружающей среды в лабораторных условиях для: • медицинских, • санитарно гигиенических, • экологических целей. Имеет сертификат Госстандарта России. 34

Методики измерений интегральной токсичности с использованием «Биотокс-10 М» : • МР№ 11 1/134 09 Определение общей токсичности почв по интенсивности биолюминесценции бактерий • МР№ 11 1/131 09 Определение токсичности химических соединений, полимеров, материалов и изделий с помощью люминесцентного бактериального теста • МР№ 11 1/132 09 Оценка токсичности воздушной среды по интенсивности биолюминесценции бактерий • МР№ 11 1/133 09 Методика экспрессного определения токсичности воды с помощью лю минесцентного бактериального теста «Эколюм » • МР№ФЦ/1859 Экспресс метод оценки токсичности спиртов и водок с использованием люминесцентных микроорганизмов. Методики измерений интегральной токсичности воды, почв, воздуха, материалов и изделий имеют свидетельство о метрологической аттестации (4/7 -93), зарегистрированы в Департаменте Госсанэпиднадзора РФ (№№ 11 -1/131 -09, 11 -1/132 -09, 11 -1/133 -09, 111/134 -09) и Госкомэкологии (сертификат Госстандарта России № 01. 19. 231/2001). 35
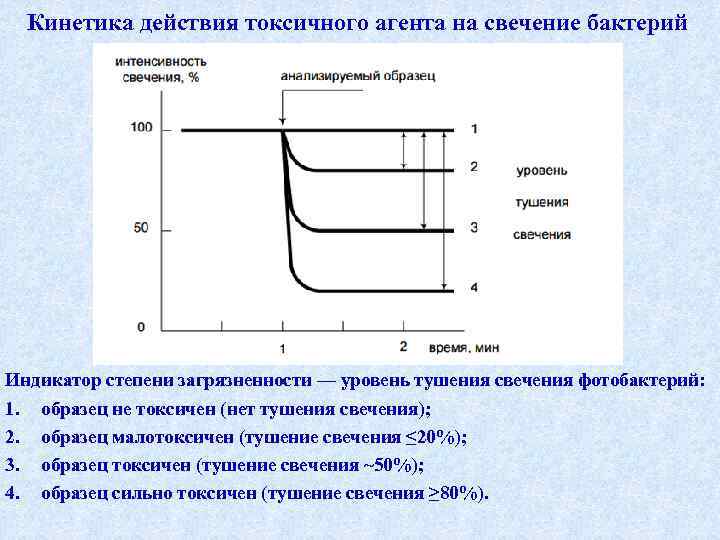
Кинетика действия токсичного агента на свечение бактерий Индикатор степени загрязненности — уровень тушения свечения фотобактерий: 1. образец не токсичен (нет тушения свечения); 2. образец малотоксичен (тушение свечения ≤ 20%); 3. образец токсичен (тушение свечения ~50%); 4. образец сильно токсичен (тушение свечения ≥ 80%).

T = 100 ( Io – I ) / Io , где Io и I – интенсивность свечения опытной и контрольной проб, соответственно при фиксированном времени экспозиции, равном 20 -30 мин. группы Значение "Т" 1 < 20 Вывод о степени токсичности пробы допустимая степень токсичности 2 3 от 20 до 50 ≥ 50 образец токсичен образец сильно токсичен 37

Преимущественные характеристики биолюминесцентного анализа: возможность прямого определения токсичности образцов; экспрессность — время единичного анализа 5‒ 15 минут; воспроизводимость — погрешность эксперимента не более 5%; стабильность биореагента — срок хранения тест системы без потери активности — до 1 года; высокая корреляция эмиссионного ответа фотобактерий с реакцией классических биотестов на высших организмах; простота и экономичность аналитической процедуры с ограниченным числом вспомогательных операций

Основные области применения В промышленности: экспресс контроль отходов и сбросов промышленных предприятий; контроль технологических процессов в режиме реального времени; определение уровня токсичности новой продукции; оценка профвредности рабочих мест на предприятиях. В экологии: исследование питьевой воды, природных водоемов, почвы и воздуха на содержание вредных веществ. В медицине и фармацевтике: контроль возможной токсичности материалов и лекарственных средств. В пищевой промышленности: контроль безопасности продуктов питания. 39

Биотестирование с использованием простейших: инфузория Spirostoma ambiguum (Сарапульцева, 2015) 250 мкм Относительно большие размеры (длина до 1 мм, ширина до 50 мкм) позволяют анализировать многие морфо функциональные характеристики этих простейших, наблюдая за ними в микроскоп типа МБС 10 с увеличением х2. Спиростомы широко распространены в природных водоемах и хорошо размножаются в лабораторных условиях. Лабораторный штамм S. ambiguum был получен на кафедре ВНД московского государственного университета им. М. В. Ломоносова и успешно содержался в лаборатории последние 14 лет. Регистрируемые параметры: двигательная активность, форма тела, темпы деления, выживаемость. 40

Биотестирование с использованием простейших: инфузория Spirostoma ambiguum (Сарапульцева, 2015) Метод открытого поля для анализа двигательной активности инфузорий S. ambiguum в специальной пластиковой камере 41
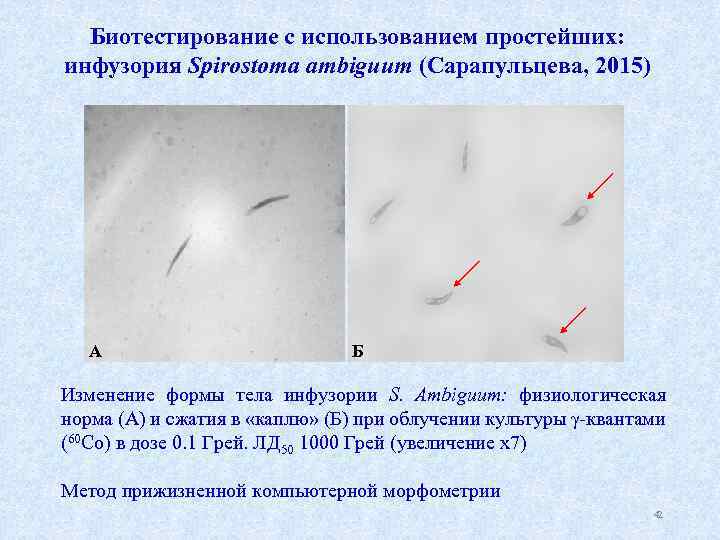
Биотестирование с использованием простейших: инфузория Spirostoma ambiguum (Сарапульцева, 2015) А Б Изменение формы тела инфузории S. Ambiguum: физиологическая норма (А) и сжатия в «каплю» (Б) при облучении культуры γ квантами (60 Со) в дозе 0. 1 Грей. ЛД 50 1000 Грей (увеличение х7) Метод прижизненной компьютерной морфометрии 42
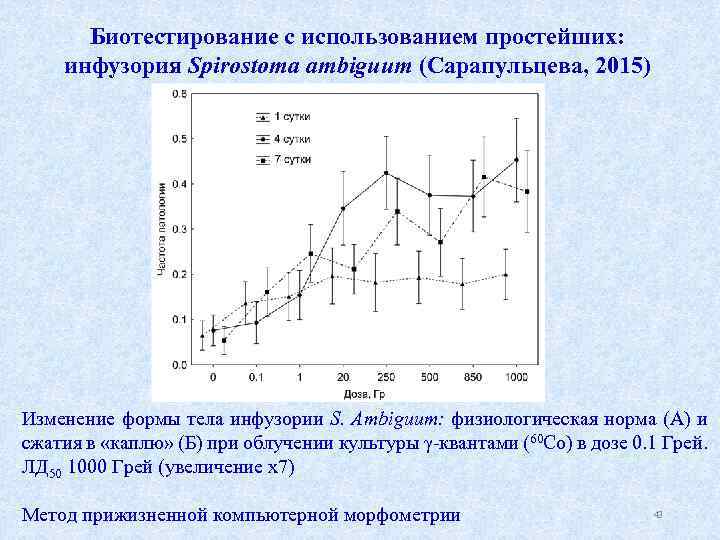
Биотестирование с использованием простейших: инфузория Spirostoma ambiguum (Сарапульцева, 2015) Изменение формы тела инфузории S. Ambiguum: физиологическая норма (А) и сжатия в «каплю» (Б) при облучении культуры γ квантами (60 Со) в дозе 0. 1 Грей. ЛД 50 1000 Грей (увеличение х7) Метод прижизненной компьютерной морфометрии 43
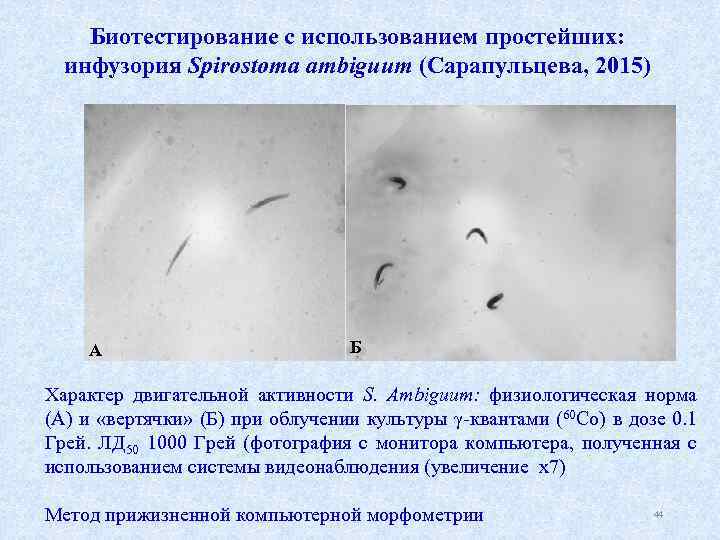
Биотестирование с использованием простейших: инфузория Spirostoma ambiguum (Сарапульцева, 2015) А Б Характер двигательной активности S. Ambiguum: физиологическая норма (А) и «вертячки» (Б) при облучении культуры γ квантами (60 Со) в дозе 0. 1 Грей. ЛД 50 1000 Грей (фотография с монитора компьютера, полученная с использованием системы видеонаблюдения (увеличение х7) Метод прижизненной компьютерной морфометрии 44
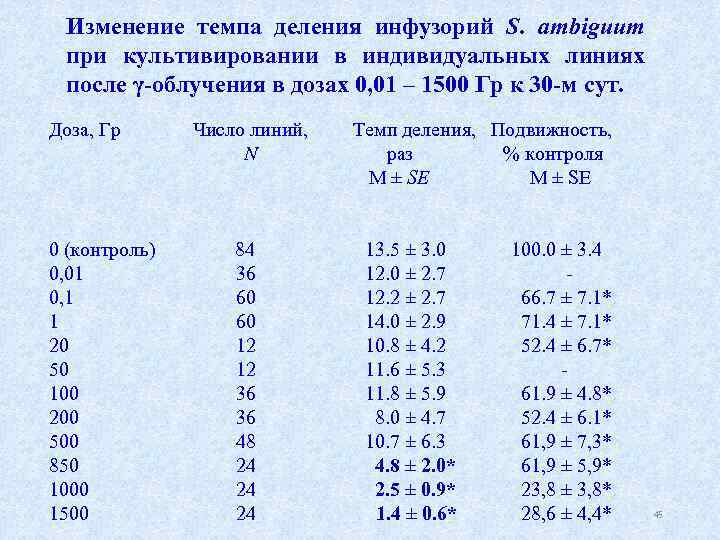
Изменение темпа деления инфузорий S. ambiguum при культивировании в индивидуальных линиях после γ-облучения в дозах 0, 01 – 1500 Гр к 30 -м сут. Доза, Гр Число линий, Темп деления, Подвижность, N раз % контроля M ± SE 0 (контроль) 84 13. 5 ± 3. 0 100. 0 ± 3. 4 0, 01 36 12. 0 ± 2. 7 0, 1 60 12. 2 ± 2. 7 66. 7 ± 7. 1* 1 60 14. 0 ± 2. 9 71. 4 ± 7. 1* 20 12 10. 8 ± 4. 2 52. 4 ± 6. 7* 50 12 11. 6 ± 5. 3 100 36 11. 8 ± 5. 9 61. 9 ± 4. 8* 200 36 8. 0 ± 4. 7 52. 4 ± 6. 1* 500 48 10. 7 ± 6. 3 61, 9 ± 7, 3* 850 24 4. 8 ± 2. 0* 61, 9 ± 5, 9* 1000 24 2. 5 ± 0. 9* 23, 8 ± 3, 8* 1500 24 1. 4 ± 0. 6* 28, 6 ± 4, 4* 45

Биотестирование с использованием водорослей: хлорелла Chlorella vulgaris и Scenedesmus quadricauda Регистрируемые параметры: численность клеток, оптическая плотность суспензии клеток, уровня флуоресценции хлорофилла. 46

Климатостат В-2 для проведения биотестирования различных водных сред на водорослях сценедесмус Климатостат обеспечивает поддержание заданных условий по: • Температуре (25 о. С) • Интенсивности света (2500 3000 Люкс) • Фотопериоду (24: 0 день: ночь) • Насыщенности тест среды растворенным О 2 (9 мг/л) Необходимы для содержания маточных и синхронных культур водорослей, а также для создания равных условий для всех экспонируемых проб при биотестировании. Разработчик: к. б. н. Григорьев Ю. С. (СФУ, Красноярск, Россия) Производитель: ЗАО «СПЕЦКОМПЛЕКТРЕСУРС 2001» в составе 47 группы компаний «ЭНЕРГОЛАБ»

Комплект оборудования для проведения биотестирования различных водных сред на водорослях по показателю «прирост численности» 2 4 1 1. 2. 3. 4. Камера Горяева для подсчета числа клеток 3 Устройство для наращивания культуры водорослей в стандартных температурных и световых условиях (КВ 05) Измеритель оптической плотности суспензии водорослей (ИПС 03) Штатив с тест кюветами для культивации водорослей Культиватор водорослей многокюветный (КВМ 05) Разработчик: к. б. н. Григорьев Ю. С. (СФУ, Красноярск, Россия) Производитель: ЗАО «СПЕЦКОМПЛЕКТРЕСУРС 2001» в составе 48 группы компаний «ЭНЕРГОЛАБ»
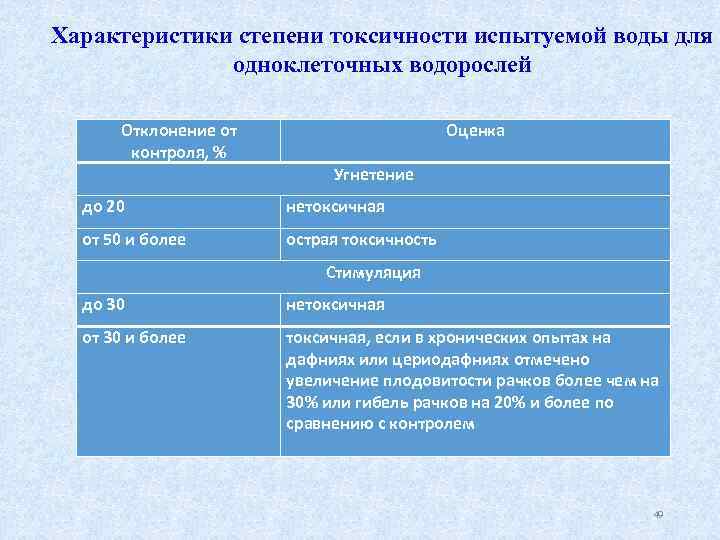
Характеристики степени токсичности испытуемой воды для одноклеточных водорослей Отклонение от контроля, % Оценка Угнетение до 20 нетоксичная от 50 и более острая токсичность Стимуляция до 30 нетоксичная от 30 и более токсичная, если в хронических опытах на дафниях или цериодафниях отмечено увеличение плодовитости рачков более чем на 30% или гибель рачков на 20% и более по сравнению с контролем 49
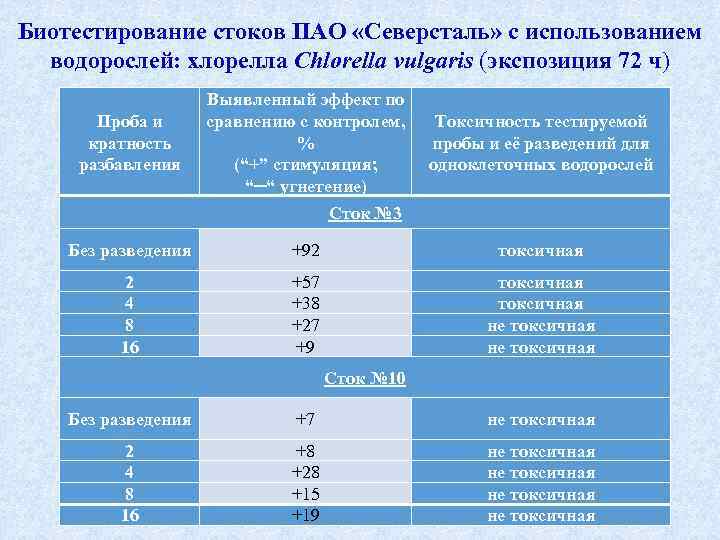
Биотестирование стоков ПАО «Северсталь» с использованием водорослей: хлорелла Chlorella vulgaris (экспозиция 72 ч) Проба и кратность разбавления Выявленный эффект по сравнению с контролем, % (“+” стимуляция; “─“ угнетение) Токсичность тестируемой пробы и её разведений для одноклеточных водорослей Сток № 3 Без разведения +92 токсичная 2 4 8 16 +57 +38 +27 +9 токсичная не токсичная Сток № 10 Без разведения +7 не токсичная 2 4 8 16 +8 +28 +15 +19 не токсичная 50
Биотестирование с использованием планктонных рачков Daphnia magna и D. affinis (dubia) Daphnia magna Ceriodaphnia affinis (dubia) 51

Биотестирование с использованием планктонных ракообразных: дафния Ceriodaphnia affinis (Томилина и др. , 2015) Цериодафний культивируют по 1 особи в бакпечатках объемом 50 мл с 30 мл отстоянной водопроводной дехлорированной воды (р. Н 7. 5 – 8. 2, О 2 ~10. 0 мг/л; жесткость ~ 6. 8 мг/л, соотношение Ca: Mg 4: 1, Fe менее 0, 3 мг/л, Mn 0, 1 мг/л, хлоридов – до 12 мг/мл, фосфатов – менее 0, 05 мг/мл, сульфатов около 44 – 50 мг/мл, взвешенных веществ – менее 3 мг/мл) в режиме день ночь 12: 12 ч при оптимальной температуре 20 − 21 о. С, поддерживаемой терморегулятором. Регистрируемые параметры: выживаемость, репродуктивная функция – количество молоди на 1 самку, общее число молоди, число пометов 52

Климатостат Р-2 для проведения биотестирования различных водных сред на рачках дафниях или цериодафниях Климатостат обеспечивает поддержание заданных условий по: • Температуре (25 о. С) • Интенсивности света (500 1000 Люкс) • Фотопериоду (12: 12 – день : ночь) • Насыщенности тест среды растворенным О 2 (8 мг/л) Необходимы для содержания маточных и синхронных культур рачков, а также для создания равных условий для всех экспонируемых проб при биотестировании. Разработчик: к. б. н. Григорьев Ю. С. (СФУ, Красноярск, Россия) Производитель: ЗАО «СПЕЦКОМПЛЕКТРЕСУРС 2001» в составе 53 группы компаний «ЭНЕРГОЛАБ»

Устройство для экспонирования рачков УЭР-03 и УЭР-04 для проведения биотестирования различных водных сред УЭР-03 УЭР-04 Регулируемое вращение ротора обеспечивает поддержание заданных условий в культивационных емкостях по: • Температуре • Освещенности • Аэрации • Гидрохимическому составу Приборы включают тест кюветы на 20 мл: УЭР 03 − 18 шт. УЭР 04 − 40 шт. Разработчик: к. б. н. Григорьев Ю. С. (СФУ, Красноярск, Россия) Производитель: ЗАО «СПЕЦКОМПЛЕКТРЕСУРС 2001» в составе 54 группы компаний «ЭНЕРГОЛАБ»

Биотестирование природной воды с использованием цериодафний С. affinis Планшеты с бакпечатками для культивирования рачков Оптико цифровой электронный комплекс на основе микроскопа MC 2 ZOOM и цифровой фото видеокамерой 55
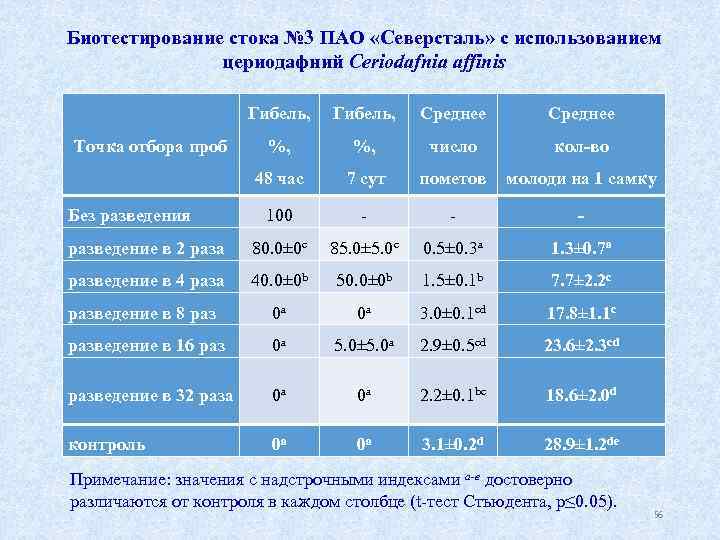
Биотестирование стока № 3 ПАО «Северсталь» с использованием цериодафний Ceriodafnia affinis Гибель, Среднее Точка отбора проб %, число кол-во 48 час 7 сут пометов молоди на 1 самку 100 - разведение в 2 раза 80. 0± 0 c 85. 0± 5. 0 c 0. 5± 0. 3 a 1. 3± 0. 7 a разведение в 4 раза 40. 0± 0 b 50. 0± 0 b 1. 5± 0. 1 b 7. 7± 2. 2 c разведение в 8 раз 0 a 0 a 3. 0± 0. 1 cd 17. 8± 1. 1 c разведение в 16 раз 0 a 5. 0± 5. 0 a 2. 9± 0. 5 cd 23. 6± 2. 3 cd разведение в 32 раза 0 a 0 a 2. 2± 0. 1 bc 18. 6± 2. 0 d контроль 0 a 0 a 3. 1± 0. 2 d 28. 9± 1. 2 de Без разведения Примечание: значения с надстрочными индексами a-е достоверно различаются от контроля в каждом столбце (t тест Стьюдента, р≤ 0. 05). 56

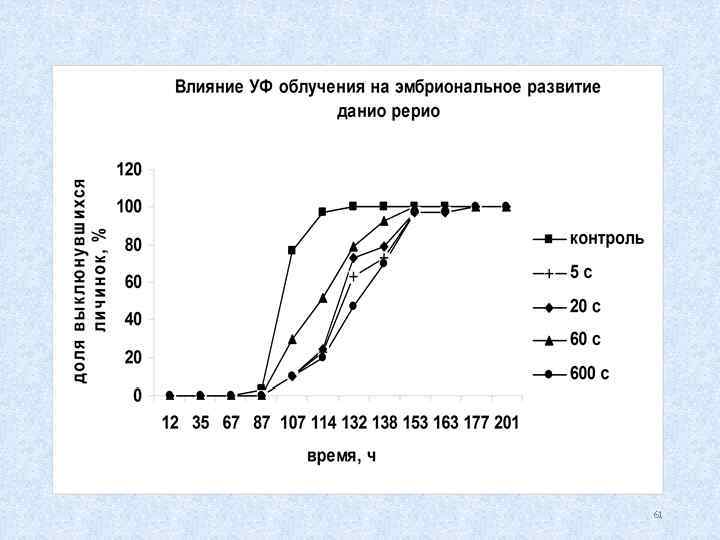
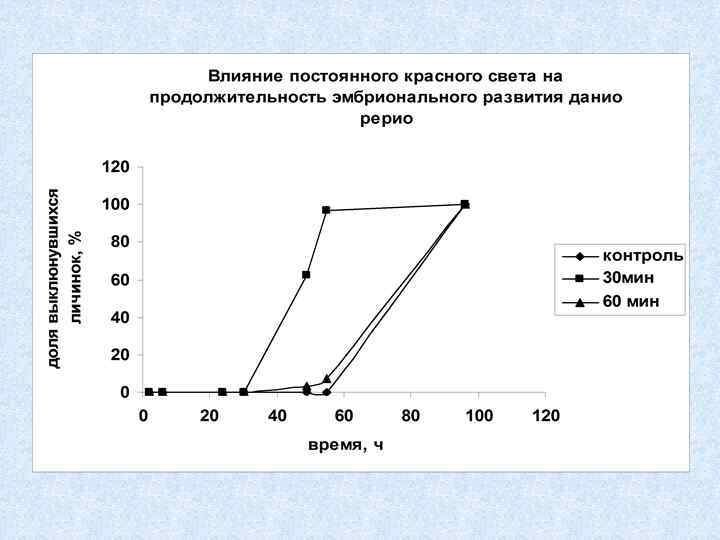
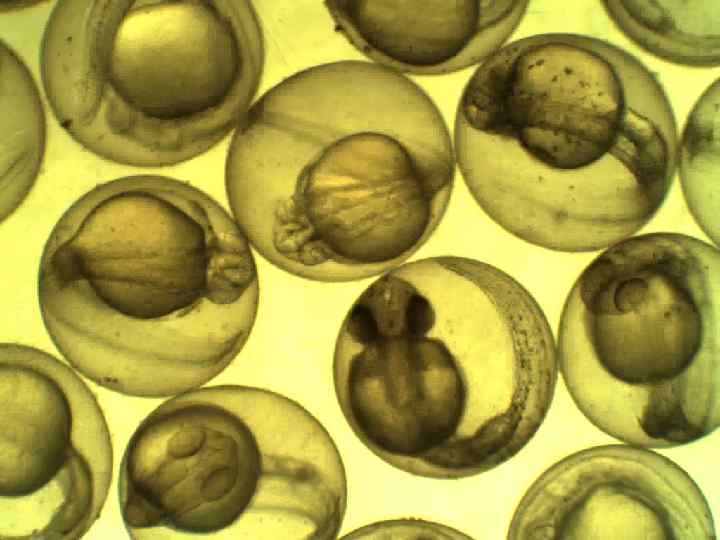
Биотестирование с использованием икры рыб: данио Danio rerio Регистрируемые параметры: выживаемость, продолжительность развития до выклева, число уродств 57

Культивирование данио Danio rerio 58
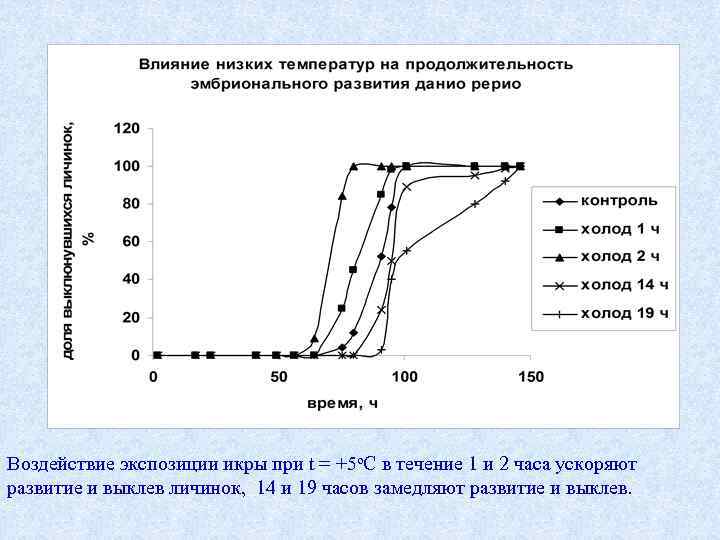
Воздействие экспозиции икры при t = +5 о. С в течение 1 и 2 часа ускоряют развитие и выклев личинок, 14 и 19 часов замедляют развитие и выклев.

Виды уродств личинок данио Danio rerio при экспозиции икры в течение 14 и 19 ч при t = +5 о. С норма патология (уродства) 60
61
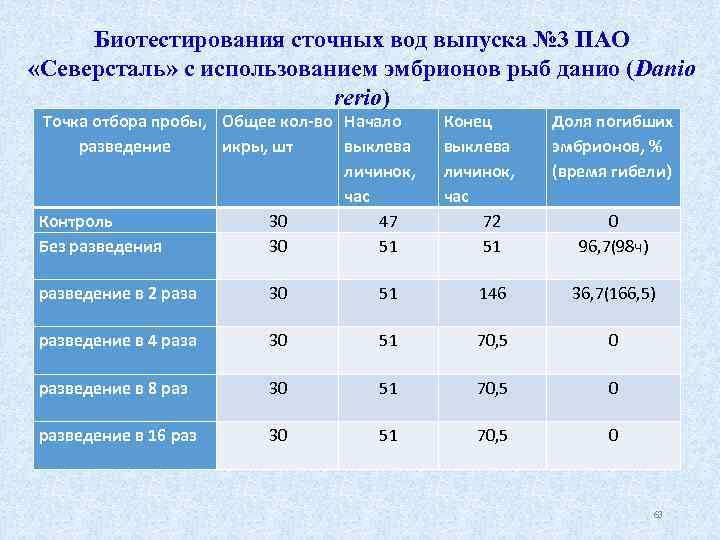
Биотестирования сточных вод выпуска № 3 ПАО «Северсталь» с использованием эмбрионов рыб данио (Danio rerio) Точка отбора пробы, Общее кол-во Начало разведение икры, шт выклева личинок, час Контроль 30 47 Без разведения 30 51 Конец выклева личинок, час 72 51 Доля погибших эмбрионов, % (время гибели) 0 96, 7(98 ч) разведение в 2 раза 30 51 146 36, 7(166, 5) разведение в 4 раза 30 51 70, 5 0 разведение в 8 раз 30 51 70, 5 0 разведение в 16 раз 30 51 70, 5 0 63

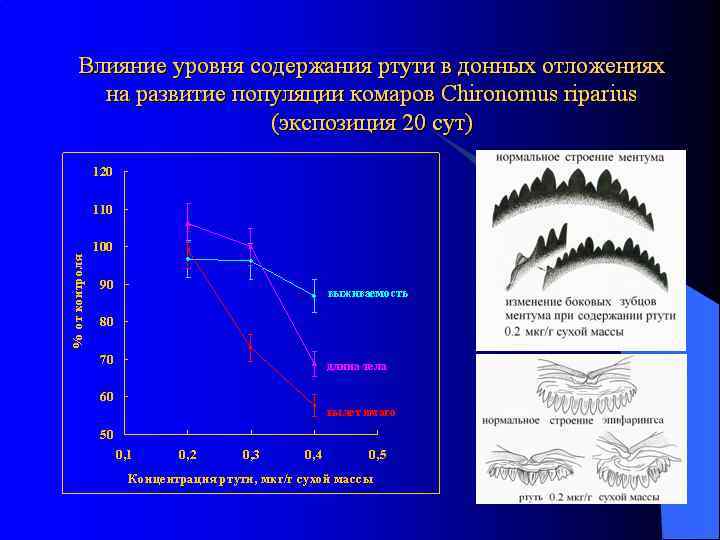
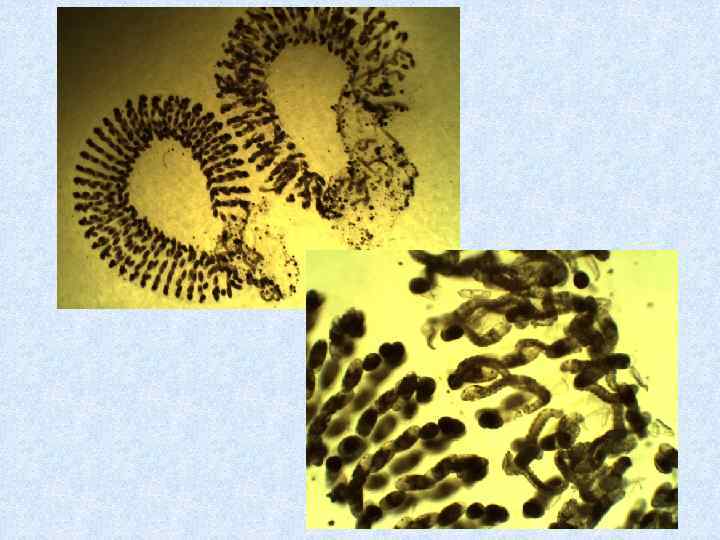
Биотестирование с использованием личинок насекомых: комары хирономиды Chironomus ripariuss (Томилина и др. , 2015) Регистрируемые параметры: выживаемость, продолжительность развития 64 до окукливания, линейный рост, деформации элементов головной
65
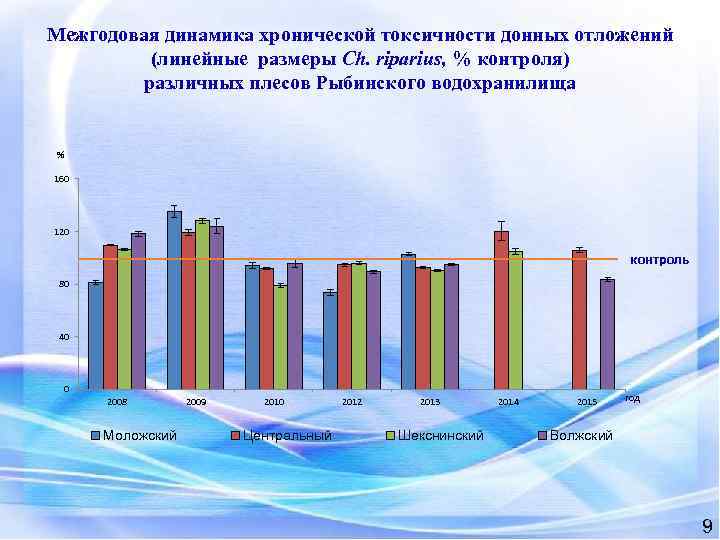
Межгодовая динамика хронической токсичности донных отложений (линейные размеры Ch. riparius, % контроля) различных плесов Рыбинского водохранилища % 160 120 контроль 80 40 0 2008 Моложский 2009 2010 Центральный 2012 2013 Шекснинский 2014 2015 год Волжский 9

67

Биотестирование с использованием высших растений: лук Allium sp. , салат латук Lactuca sativa и ряска Lemna minor. Регистрируемые параметры: длина корешков, биомасса 68

Установка для биотестирования вод, суспензий почв и отходов на проростах семян растений Разработчик: к. б. н. Григорьев Ю. С. (СФУ, Красноярск, Россия) Производитель: ЗАО «СПЕЦКОМПЛЕКТРЕСУРС 2001» в составе 69 группы компаний «ЭНЕРГОЛАБ»

Биотестирование водных растворов Na. Cl с использованием семян овса контроль 1 г/дм 3 5 г/дм 3 25 г/дм 3 Длина корней семян овса после 5 суток прорастания в среде с различной концентрацией Na. Cl 70

Современные биологические системы раннего предупреждения БСРП (активный биомониторинг on line): • Microtox (Microbics Corporation, California) and Toxcontrol Biomonitor • Algae Toximeter • Daphnia Toximeter • Fish Toximeter • CAPMON (Continuous Automated Permanent Monitoring), cardiac activity of crustacean and mollusks • Mossel. Monitor®, Dreissena Monitor®, движение створок • Optic-fiber system for оn-line cardiac activity monitoring, cardiac activity of crustacean and mollusks

Преимущественные характеристики биолюминесцентного анализа: возможность прямого определения токсичности образцов; экспрессность — время единичного анализа 5‒ 15 минут; воспроизводимость — погрешность эксперимента не более 5%; стабильность биореагента — срок хранения тест системы без потери активности — до 1 года; высокая корреляция эмиссионного ответа фотобактерий с реакцией классических биотестов на высших организмах; простота и экономичность аналитической процедуры с ограниченным числом вспомогательных операций

Биомониторинг природных и очищенных сточных вод с использованием фитопланктона 1. В системе Algae Toximeter образец тестируемой воды практически постоянно накачивается в тестовую камеру, где концентрация и активность живущих в природе водорослей – таким образом, смеси разных видов – определяется с помощью фотосинтетической активности хлорофилла в зеленых водорослях. Затем точно определенное количество водорослей из ферментера добавляется в тестовую камеру. Активность добавленных водорослей остается постоянной до тех пор, пока в воде не появятся вредные вещества. В случае наличия вредного соединения, его взаимодействие с центрами фотосинтеза приводит к подавлению активности водорослей (и продукции кислорода). Это подавление измеряется количественно и после превышения заранее выбранного порога срабатывает сигнал тревоги. Частота обслуживания системы составляет более 7 дней. Заявленные применения включают системы водоснабжения, мониторинг поверхностных вод, а также мониторинг очищенных сточных вод.

2. Основы технологии автоматизированного биомониторинга водных ресурсов с использованием флуориметрии хлорофилла фитопланктона Наличие у фитопланктона флуоресценции, которая связана с фотосинтетическим аппаратом (ФСА), позволяет рекомендовать данный показатель как биоиндикационный и регистрировать его с помощью хорошо разработанных методов флуориметрии. К преимуществам данного метода биомониторинга относится: высокая чувствительность. возможность автоматизации метод основан на молекулярном уровне реагирования на факторы стресса, при этом регистрация на надорганизменном уровне дает возможность интегрировать малые воздействия по времени. возможность дифференциации разных групп фитопланктона и, следовательно, отслеживания динамики биоразнообразия. возможность оценки концентрации хлорофилла фитопланктона и состояния ФСА, выделения периодов «цветения» .

Daphnia Toximeter – система биомониторинга на основе «динамического дафния-теста» Системы раннего оповещения, включающие плавательное поведение водных рачков (daphnia), использовалась многие годы для мониторинга поверхностных вод. В последние годы была разработана улучшенная система, использующая анализ видео изображения: Daphnia Toximeter. Тестируемая вода постоянно проходит через камеру с дафниями. Фотоснимки, записанные вэб камерой, обрабатываются в реальном времени. При этом проводится анализ следующих изменений в поведении тест организмов: статистически значимых изменений скорости (средней скорости, распределения по скоростям), расположения рачков в колонне, фрактальной размерности (измерения поворотов и круговых движений, закручиваний) и определение размера дафний (рост). Сигнал тревоги вырабатывается только, если более двух измеряемых величин одновременно демонстрируют необычное поведение. Частота обслуживания составляет 7 дней и более.

Fish Toximeter – системы биомониторинга на основе использования рыб в качестве тест-организмов В 70 е годы рыбы стали первыми организмами, которые стали использоваться в БСРП. Первоначально хемотаксис или эффект избегания были теми изменениями в поведении, которые использовались, как индикаторы наличия токсикантов в воде. В этих системах рыбам позволялось выбирать между водой из чистого источника и тестируемой водой. Параллельно, положительный реотаксис (свойство плыть против течения) был использован, как биологический ответ (Juhnke and Besch, 1971), и нашел применение, например, в системе Aqua-Tox-Control. С начала 80 х годов стала использоваться дыхательная активность рыб (Gruber and Cairns, 1981). У рыб, которые также находились в проточной воде, измерялась частота дыхания. В Европе для этого чаще использовалась радужная форель (Oncorhynchus mykiss), а в нескольких больших городах США (Вашингтон, Нью Йорк, Сан Франциско) – синежаберник (Lepomis macrochyrus).

Синежаберный солнечник (Lepomis macrochyrus), с одной стороны, чрезвычайно чувствителен к быстрым изменениям качества воды, а с другой ведет вполне оседлый образ жизни, что делает его идеальным кандидатом для системы раннего предупреждения БСРП

В этих системах 8 рыб находятся в 8 проточных аквариумах с водой из близлежащей системы водоснабжения. В присутствии в воде опасных для их жизнедеятельности загрязняющих веществ рыбы меняют характер поведения и дыхания. Синежаберный солнечник в аквариуме 8 канальной системе БСРП
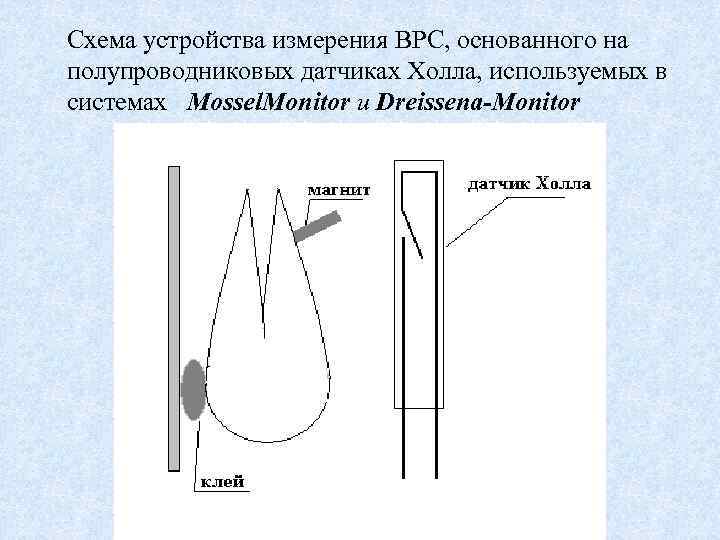
Схема устройства измерения ВРС, основанного на полупроводниковых датчиках Холла, используемых в системах Mossel. Monitor и Dreissena-Monitor

Принцип работы этой инструментальной системы биомониторинга качества воды, как среды обитания гидробионтов, впервые примененной в 1980 -е (Kramer et al. , 1989), заключается в том, что при дыхании и питании створки раковин моллюсков открыты. При стрессе они закрывают створки, и это рассматривается, как поведение избегания. Кроме того, при стрессе, вызванном химическим загрязнением воды, они могут значительно изменять частоту открытий-закрытий, еще одно поведенческое изменение, которое регистрируется. При измерении текущее поведение створок сравнивается с поведением створок того же моллюска примерно за 1 час до этого. Значительные изменения, когда, например, 5 из 8 моллюсков закрыты в течение 5 минут, приводит к выработке сигнала тревоги (de Zwart et al. , 1995). Обслуживание этой системы включает еженедельную чистку проточных аквариумов. Замену моллюсков необходимо проводить только раз в три месяца. Кормление не требуется, так как моллюски питаются детритом, находящимися в контролируемой воде.

Фотография образца системы Mossel. Monitor

Общий вид 16 -канальной системы для одновременного измерения движения створок у 16 моллюсков

Моллюски с датчиками движения створок и прикрепленными волоконно-оптическими датчиками кардиоактивности
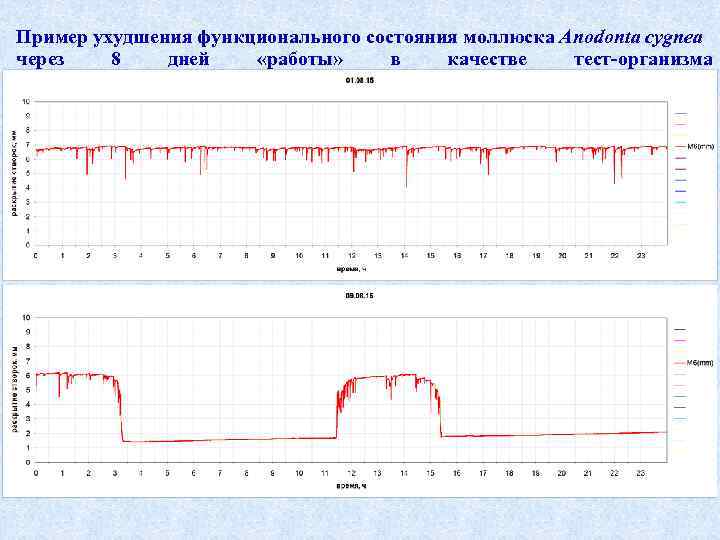
Пример ухудшения функционального состояния моллюска Anodonta cygnea через 8 дней «работы» в качестве тест-организма

Моллюски с датчиками движения створок и прикрепленными волоконно-оптическими датчиками кардиоактивности

Мы рассмотрим два типа технологий мониторинга общей токсичности воды, основанных на использовании одной и той же биоэлектронной системы. К первому типу относятся технологии, разработанные для задач диагностики (непрерывный в on-line) острой токсичности воды, обусловленной, например, чрезвычайными ситуациями (аварии, экологическая преступность, терроризм). Второй тип – для диагностики биологических эффектов хронического загрязнения воды, в том числе малыми концентрациями продолжительное время. загрязняющих веществ

Система непрерывного биологического мониторинга качества сырой воды источника водоснабжения, находящаяся с декабря 2005 года в производственной эксплуатации на одной из водопроводных станций Санкт-Петербурга.
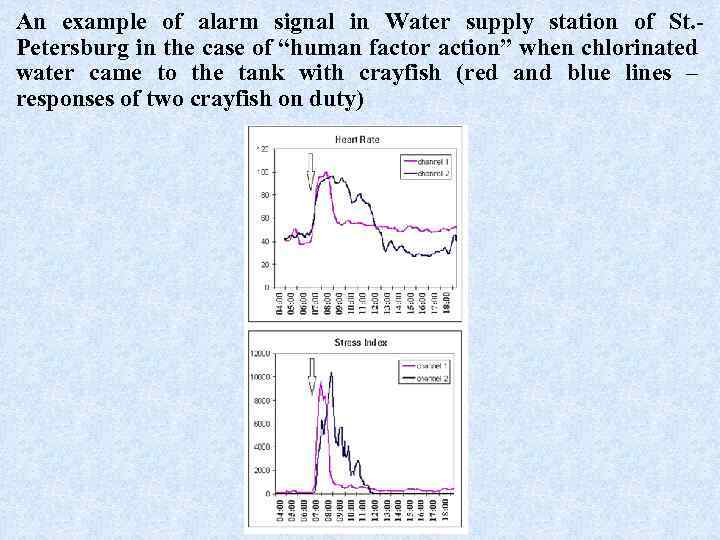
An example of alarm signal in Water supply station of St. Petersburg in the case of “human factor action” when chlorinated water came to the tank with crayfish (red and blue lines – responses of two crayfish on duty)
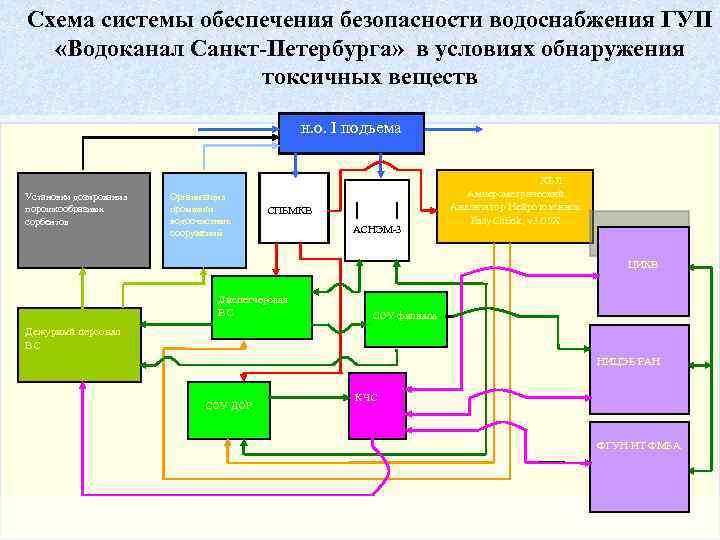
Схема системы обеспечения безопасности водоснабжения ГУП «Водоканал Санкт-Петербурга» в условиях обнаружения токсичных веществ н. о. I подъема Установки дозирования порошкообразных сорбентов Организация промывки водоочистных сооружений ХБЛ Амперометрический Анализатор Нейротоксинов Easy. Ch. Eck, v 3. 05 X СПБМКВ АСНЭМ 3 ЦИКВ Дежурный персонал ВС Диспетчерская ВС СОУ филиала НИЦЭБ РАН СОУ ДОР КЧС ФГУН ИТ ФМБА
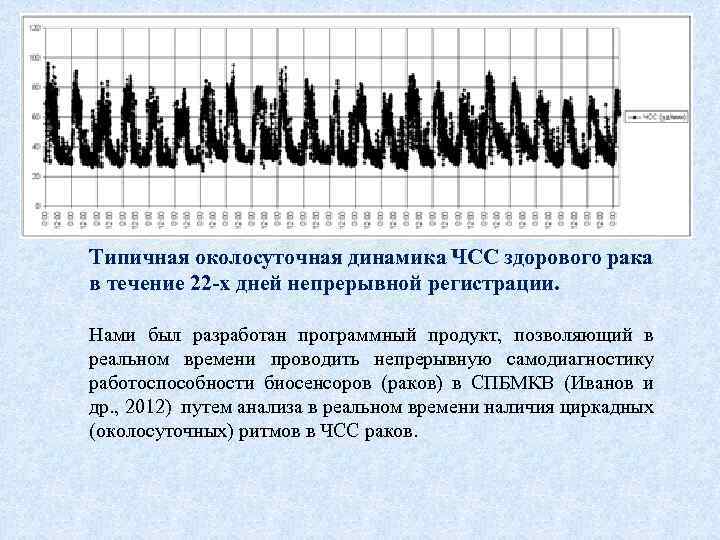
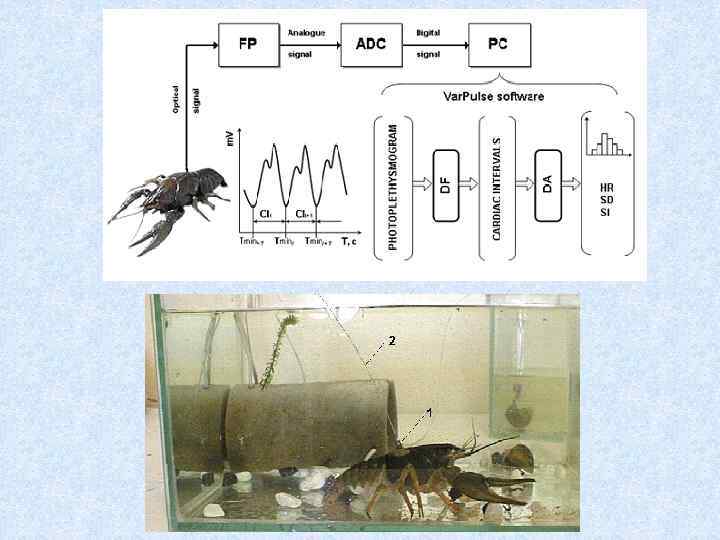
Типичная околосуточная динамика ЧСС здорового рака в течение 22 -х дней непрерывной регистрации. Нами был разработан программный продукт, позволяющий в реальном времени проводить непрерывную самодиагностику работоспособности биосенсоров (раков) в СПБМКВ (Иванов и др. , 2012) путем анализа в реальном времени наличия циркадных (околосуточных) ритмов в ЧСС раков.

Исходные положения метода активной биоиндикации в задачах оценки состояния (здоровья) экосистем с использованием СРБП Хроническое загрязнение среды обитания гидробионтов отражается на их адаптивных возможностях (здоровье). Беспозвоночные имеют достаточно высокую чувствительность к химическому стрессу в своей водной среде обитания Здоровье животных из разных по уровню антропогенной нагрузки мест обитания можно оценивать с помощью стандартизованных тест-воздействий, основанных на анализе времени восстановления измеряемых физиологических и/или поведенческих характеристик тестируемых организмов после кратковременных функциональных нагрузок в пределах толерантности вида гидробионтов данной микропопуляции. В ходе выполнения ряда исследований было обнаружено, что моллюски и ракообразные, взятые из относительно чистых мест отличаются от животных из загрязненных акваторий временем восстановления паттернов кардиоактивности и поведения после стандартизованных тест-воздействий.
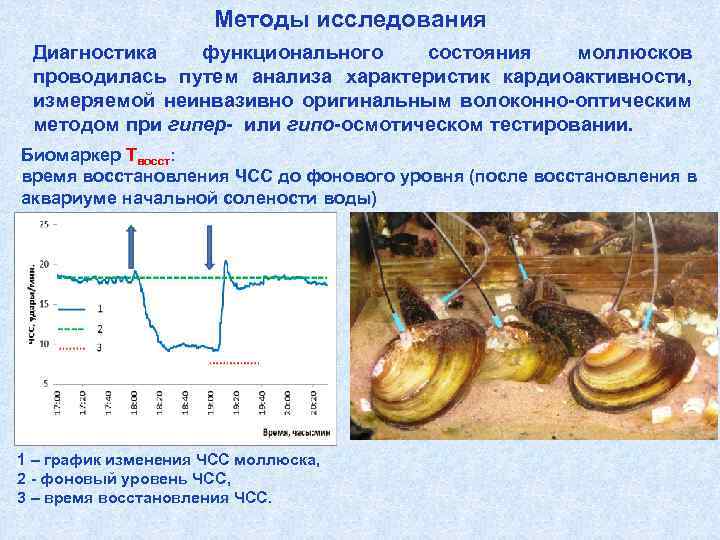
Методы исследования Диагностика функционального состояния моллюсков проводилась путем анализа характеристик кардиоактивности, измеряемой неинвазивно оригинальным волоконно-оптическим методом при гипер- или гипо-осмотическом тестировании. Биомаркер Твосст: время восстановления ЧСС до фонового уровня (после восстановления в аквариуме начальной солености воды) 1 – график изменения ЧСС моллюска, 2 - фоновый уровень ЧСС, 3 – время восстановления ЧСС.
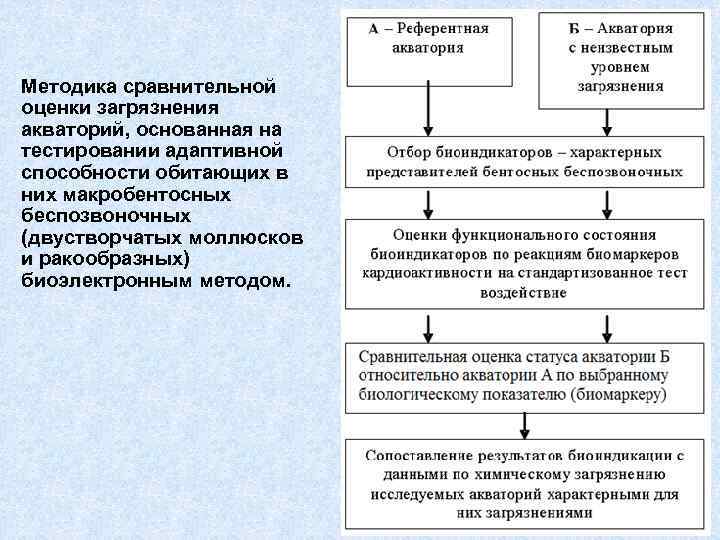
Методика сравнительной оценки загрязнения акваторий, основанная на тестировании адаптивной способности обитающих в них макробентосных беспозвоночных (двустворчатых моллюсков и ракообразных) биоэлектронным методом.
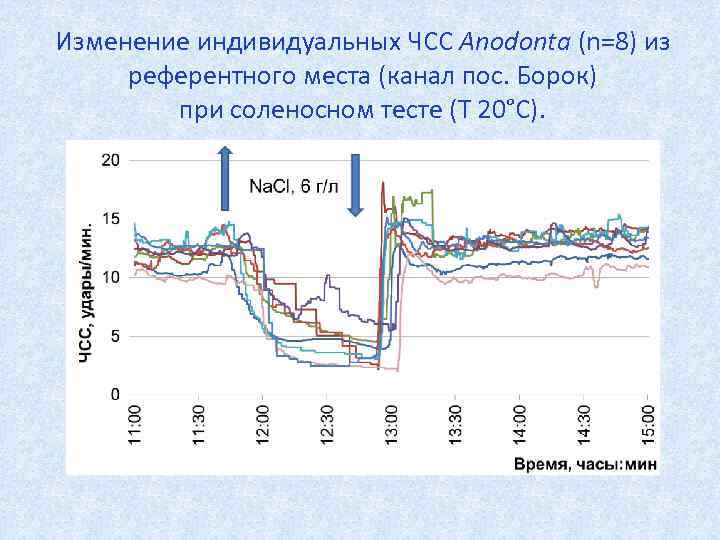
Изменение индивидуальных ЧСС Anodonta (n=8) из референтного места (канал пос. Борок) при соленосном тесте (Т 20°С).
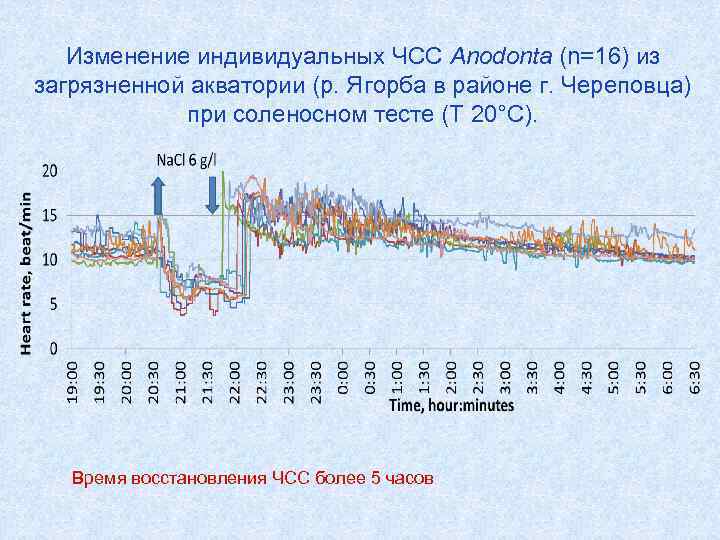
Изменение индивидуальных ЧСС Anodonta (n=16) из загрязненной акватории (р. Ягорба в районе г. Череповца) при соленосном тесте (Т 20°С). Время восстановления ЧСС более 5 часов
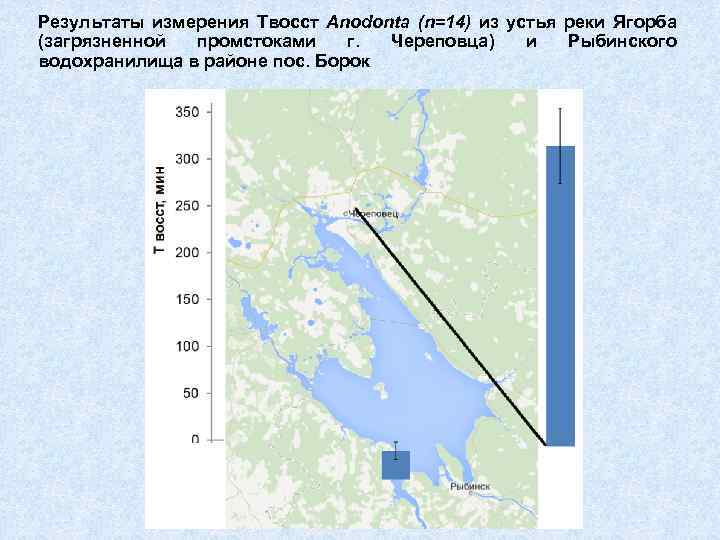
Результаты измерения Твосст Anodonta (n=14) из устья реки Ягорба (загрязненной промстоками г. Череповца) и Рыбинского водохранилища в районе пос. Борок

… в процессе тестирования функционального состояния одновременно 16 мидий Таллиннского залива (май 2014 года).
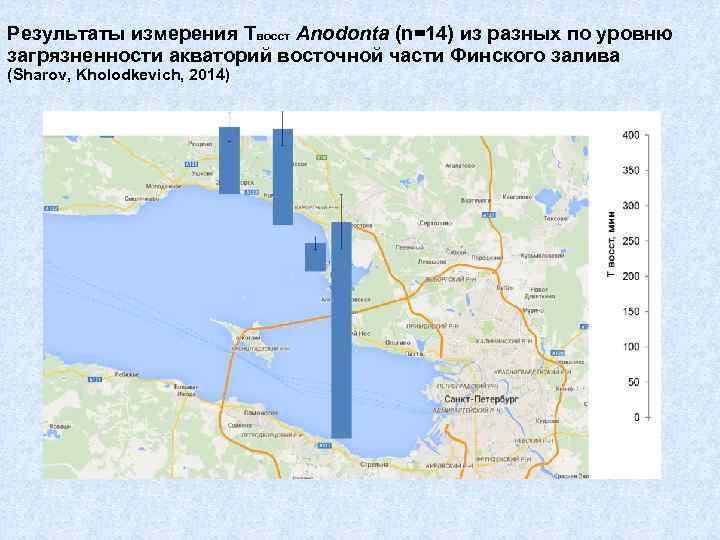
Результаты измерения Твосст Anodonta (n=14) из разных по уровню загрязненности акваторий восточной части Финского залива (Sharov, Kholodkevich, 2014)
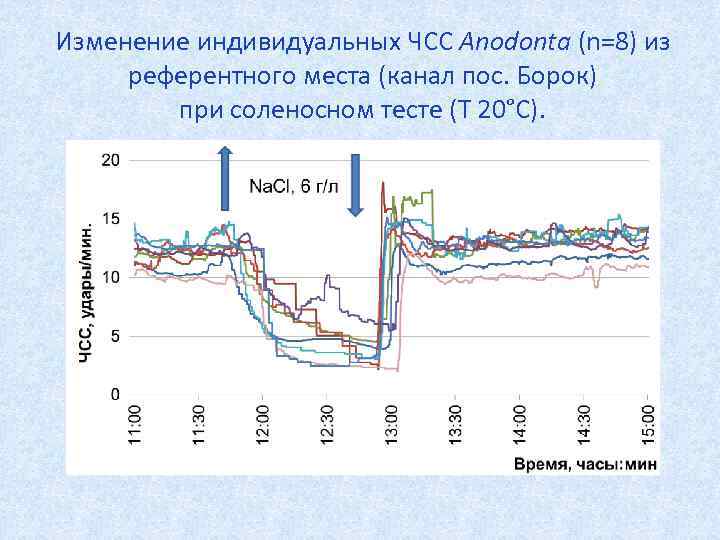
Изменение индивидуальных ЧСС Anodonta (n=8) из референтного места (канал пос. Борок) при соленосном тесте (Т 20°С).
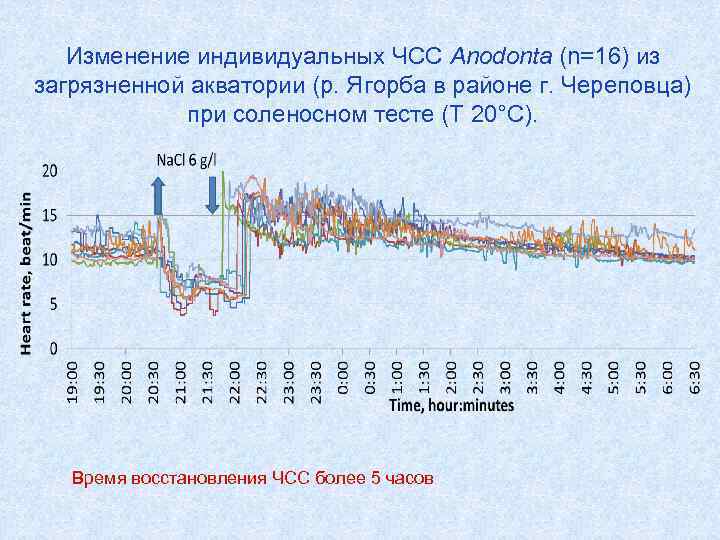
Изменение индивидуальных ЧСС Anodonta (n=16) из загрязненной акватории (р. Ягорба в районе г. Череповца) при соленосном тесте (Т 20°С). Время восстановления ЧСС более 5 часов
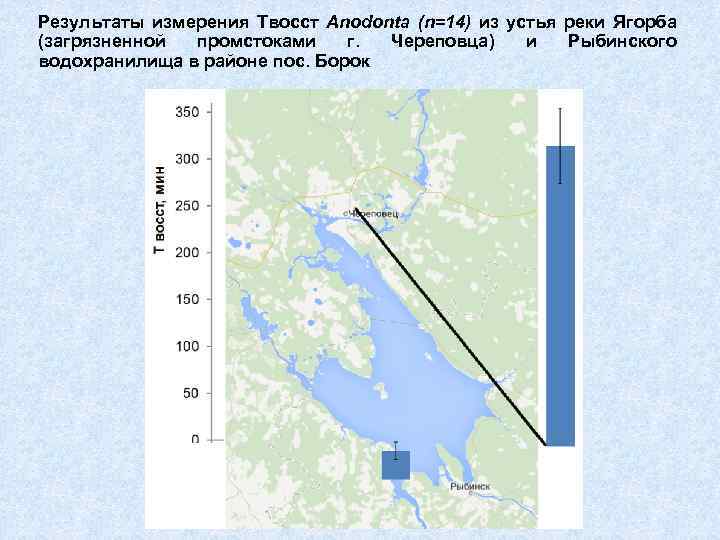
Результаты измерения Твосст Anodonta (n=14) из устья реки Ягорба (загрязненной промстоками г. Череповца) и Рыбинского водохранилища в районе пос. Борок

… в процессе тестирования функционального состояния одновременно 16 мидий Таллиннского залива (май 2014 года).
104
105
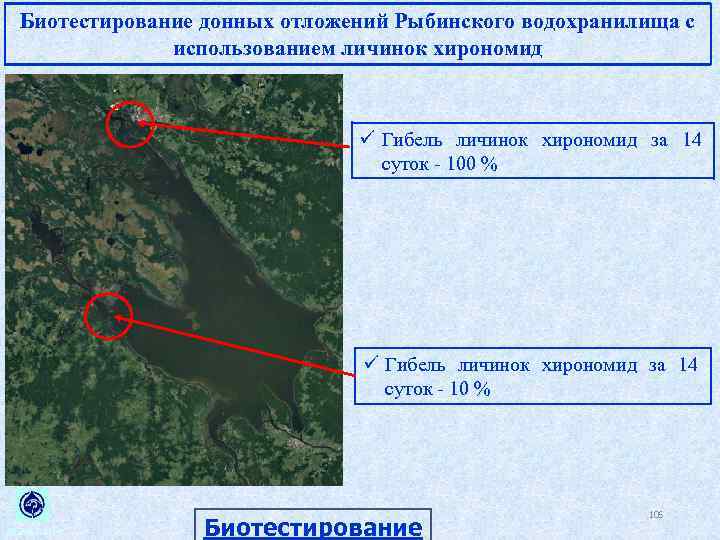
Биотестирование донных отложений Рыбинского водохранилища с использованием личинок хирономид ü Гибель личинок хирономид за 14 суток 100 % ü Гибель личинок хирономид за 14 суток 10 % ИБВВ РАН Биотестирование 106
2017 Чуйко Лекция 3-Биотестирование лекции.pptx