 И ЗЬ А ВЯ ТВ С С Я Е КА ЕЩ ЕС Е В ИЧ НИ М Е ХИ РОИ Я 4 СТ К Ц Л Е
И ЗЬ А ВЯ ТВ С С Я Е КА ЕЩ ЕС Е В ИЧ НИ М Е ХИ РОИ Я 4 СТ К Ц Л Е
 ХИМИЧЕСКАЯ СВЯЗЬ Химическая связь – это взаимодействие атомов, осуществляемое путем обмена электронами или перехода электрона от одного атома к другому. o Ковалентная o Ионная o Металлическая o Водородная o Межмолекулярные взаимодействия Любая химическая связь имеет электростатическую природу.
ХИМИЧЕСКАЯ СВЯЗЬ Химическая связь – это взаимодействие атомов, осуществляемое путем обмена электронами или перехода электрона от одного атома к другому. o Ковалентная o Ионная o Металлическая o Водородная o Межмолекулярные взаимодействия Любая химическая связь имеет электростатическую природу.

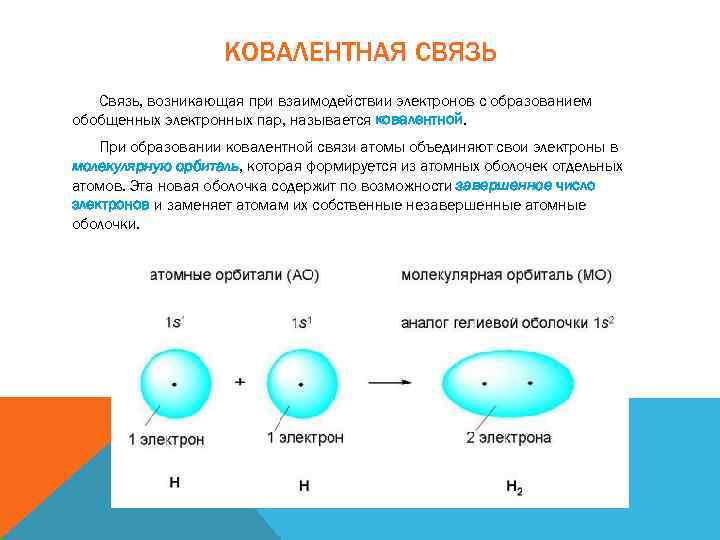 КОВАЛЕНТНАЯ СВЯЗЬ Связь, возникающая при взаимодействии электронов с образованием обобщенных электронных пар, называется ковалентной. При образовании ковалентной связи атомы объединяют свои электроны в молекулярную орбиталь, которая формируется из атомных оболочек отдельных атомов. Эта новая оболочка содержит по возможности завершенное число электронов и заменяет атомам их собственные незавершенные атомные оболочки.
КОВАЛЕНТНАЯ СВЯЗЬ Связь, возникающая при взаимодействии электронов с образованием обобщенных электронных пар, называется ковалентной. При образовании ковалентной связи атомы объединяют свои электроны в молекулярную орбиталь, которая формируется из атомных оболочек отдельных атомов. Эта новая оболочка содержит по возможности завершенное число электронов и заменяет атомам их собственные незавершенные атомные оболочки.
 ЭЛЕКТРОНЫ В АТОМАХ И МОЛЕКУЛАХ Атомы образуют химические связи в результате обобществления такого количества электронов, чтобы приобрести электронную конфигурацию, подобную завершенной электронной конфигурации атомов благородных элементов. Формулы Льюиса:
ЭЛЕКТРОНЫ В АТОМАХ И МОЛЕКУЛАХ Атомы образуют химические связи в результате обобществления такого количества электронов, чтобы приобрести электронную конфигурацию, подобную завершенной электронной конфигурации атомов благородных элементов. Формулы Льюиса:

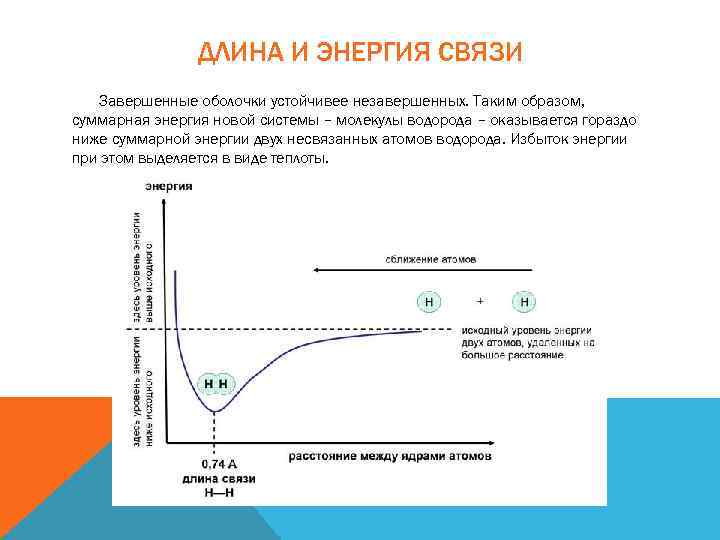 ДЛИНА И ЭНЕРГИЯ СВЯЗИ Завершенные оболочки устойчивее незавершенных. Таким образом, суммарная энергия новой системы – молекулы водорода – оказывается гораздо ниже суммарной энергии двух несвязанных атомов водорода. Избыток энергии при этом выделяется в виде теплоты.
ДЛИНА И ЭНЕРГИЯ СВЯЗИ Завершенные оболочки устойчивее незавершенных. Таким образом, суммарная энергия новой системы – молекулы водорода – оказывается гораздо ниже суммарной энергии двух несвязанных атомов водорода. Избыток энергии при этом выделяется в виде теплоты.
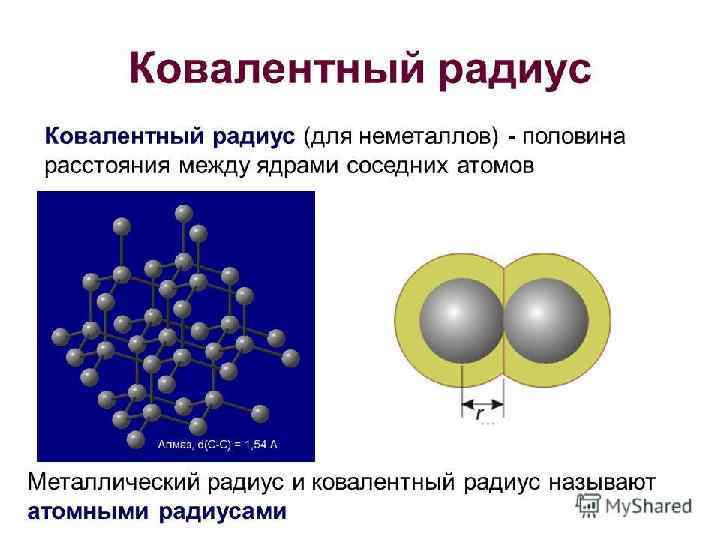
 КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ СВЯЗЬ Если взаимодействующие атомы имеют одинаковые значения электроотрицательности, общая электронная пара в равной степени принадлежит обоим атомам, т. е. находится на равном расстоянии от их ядер. Такая ковалентная связь называется неполярной. Н: Н
КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ СВЯЗЬ Если взаимодействующие атомы имеют одинаковые значения электроотрицательности, общая электронная пара в равной степени принадлежит обоим атомам, т. е. находится на равном расстоянии от их ядер. Такая ковалентная связь называется неполярной. Н: Н
 КОВАЛЕНТНАЯ ПОЛЯРНАЯ СВЯЗЬ При взаимодействии атомов, имеющих различные значения электроотрицательности, общая электронная пара оказывается смещенной в сторону атома с большей электроотрицательностью. Н : Cl Дипольный момент: q – заряд l – расстояние между зарядами Вектор дипольного момента направлен от положительного заряда к отрицательному.
КОВАЛЕНТНАЯ ПОЛЯРНАЯ СВЯЗЬ При взаимодействии атомов, имеющих различные значения электроотрицательности, общая электронная пара оказывается смещенной в сторону атома с большей электроотрицательностью. Н : Cl Дипольный момент: q – заряд l – расстояние между зарядами Вектор дипольного момента направлен от положительного заряда к отрицательному.
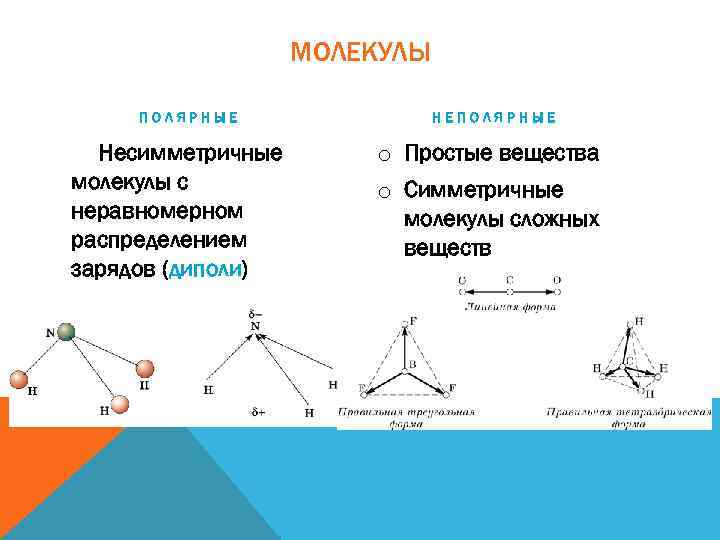 МОЛЕКУЛЫ ПОЛЯРНЫЕ Несимметричные молекулы с неравномерном распределением зарядов (диполи) НЕПОЛЯРНЫЕ o Простые вещества o Симметричные молекулы сложных веществ
МОЛЕКУЛЫ ПОЛЯРНЫЕ Несимметричные молекулы с неравномерном распределением зарядов (диполи) НЕПОЛЯРНЫЕ o Простые вещества o Симметричные молекулы сложных веществ
 ПОЛЯРИЗУЕМОСТЬ СВЯЗИ Поляризуемость ковалентной связи заключается в способности молекул (и отдельных связей в них) изменять свою полярность под действием внешнего электрического поля, т. е. поляризоваться.
ПОЛЯРИЗУЕМОСТЬ СВЯЗИ Поляризуемость ковалентной связи заключается в способности молекул (и отдельных связей в них) изменять свою полярность под действием внешнего электрического поля, т. е. поляризоваться.
 КРАТНОСТЬ СВЯЗИ Порядок (кратность) связи – это число обобществленных поделенных пар между двумя связанными атомами. Чем выше порядок связи, тем прочнее связаны между собой атомы и тем короче сама связь.
КРАТНОСТЬ СВЯЗИ Порядок (кратность) связи – это число обобществленных поделенных пар между двумя связанными атомами. Чем выше порядок связи, тем прочнее связаны между собой атомы и тем короче сама связь.
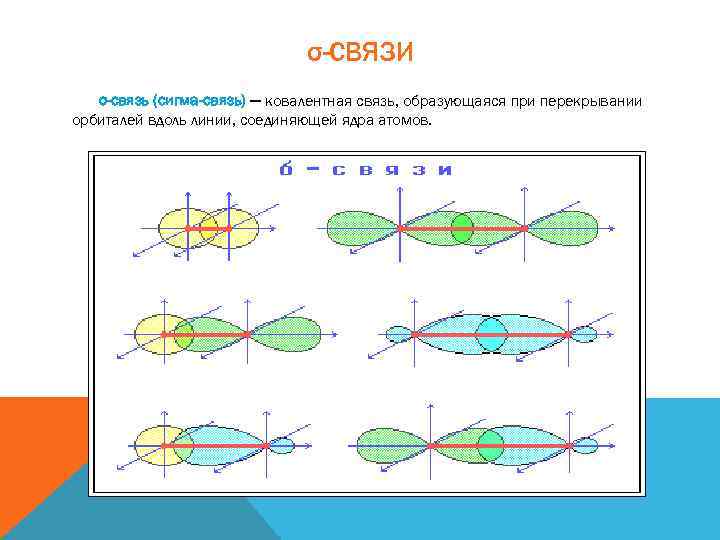 σ-СВЯЗИ σ-связь (сигма-связь) — ковалентная связь, образующаяся при перекрывании орбиталей вдоль линии, соединяющей ядра атомов.
σ-СВЯЗИ σ-связь (сигма-связь) — ковалентная связь, образующаяся при перекрывании орбиталей вдоль линии, соединяющей ядра атомов.
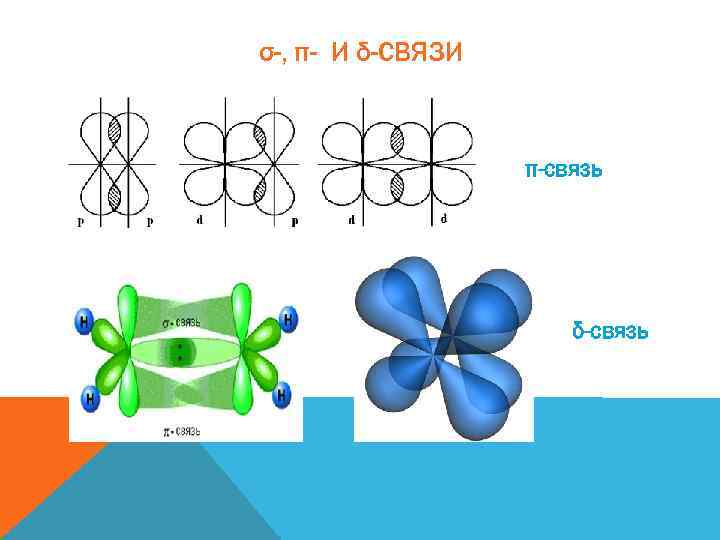 σ-, π- И δ-СВЯЗИ π-связь δ-связь
σ-, π- И δ-СВЯЗИ π-связь δ-связь
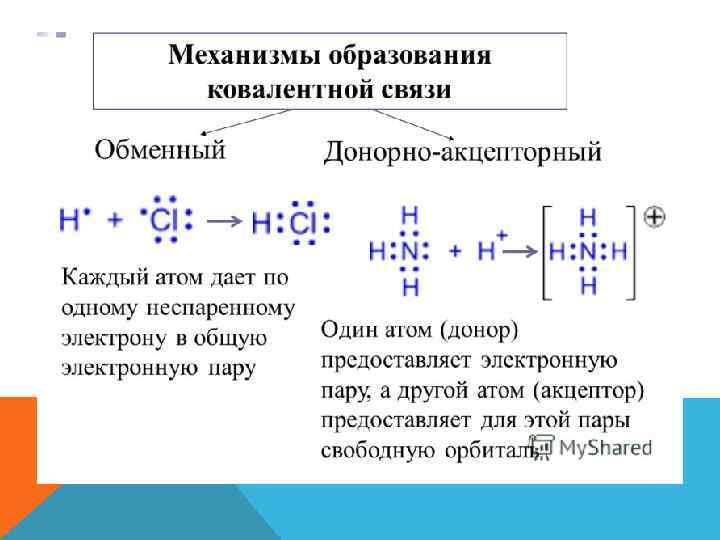
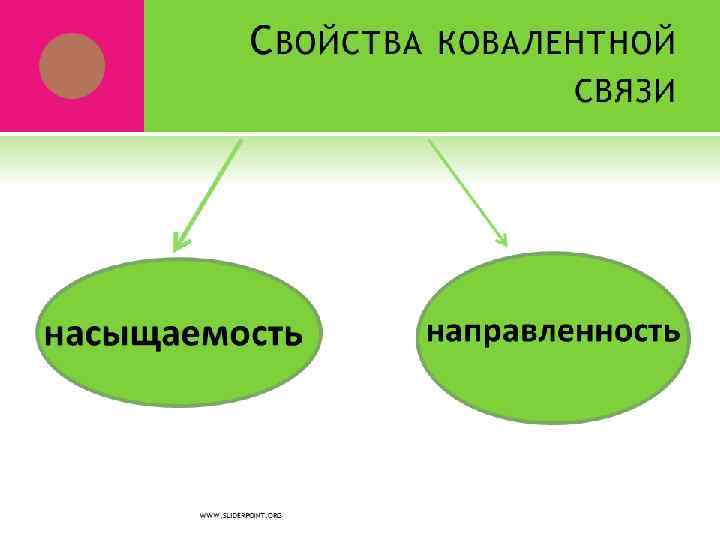


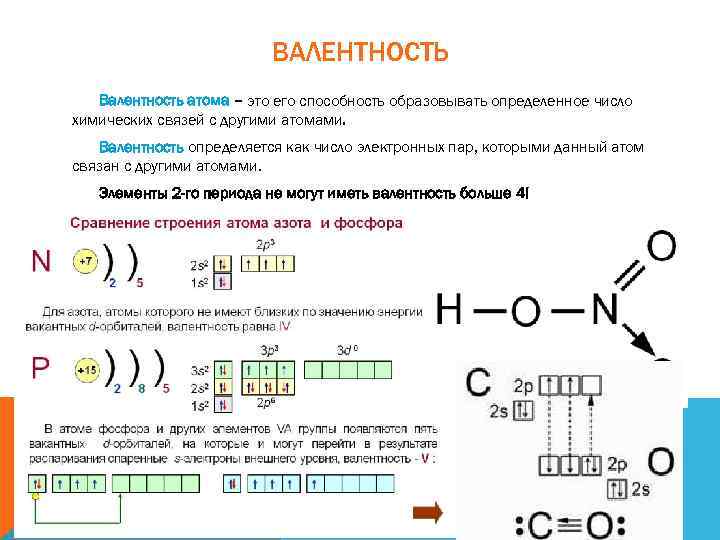 ВАЛЕНТНОСТЬ Валентность атома – это его способность образовывать определенное число химических связей с другими атомами. Валентность определяется как число электронных пар, которыми данный атом связан с другими атомами. Элементы 2 -го периода не могут иметь валентность больше 4!
ВАЛЕНТНОСТЬ Валентность атома – это его способность образовывать определенное число химических связей с другими атомами. Валентность определяется как число электронных пар, которыми данный атом связан с другими атомами. Элементы 2 -го периода не могут иметь валентность больше 4!
 РЕЗОНАНСНЫЕ ФОРМУЛЫ Строение некоторых формул нельзя описать единственной структурой. Такие молекулы представляют в виде нескольких резонансных структур. На самом деле молекула озона симметрична, а электроны π-связи делокализованы (размыты):
РЕЗОНАНСНЫЕ ФОРМУЛЫ Строение некоторых формул нельзя описать единственной структурой. Такие молекулы представляют в виде нескольких резонансных структур. На самом деле молекула озона симметрична, а электроны π-связи делокализованы (размыты):
 ПРОСТРАНСТВЕННАЯ ФОРМА МОЛЕКУЛ Теория отталкивания валентных электронных пар (ОВЭП) химические связи и неподеленные электронные пары в молекулах стремятся расположиться как можно дальше друг от друга.
ПРОСТРАНСТВЕННАЯ ФОРМА МОЛЕКУЛ Теория отталкивания валентных электронных пар (ОВЭП) химические связи и неподеленные электронные пары в молекулах стремятся расположиться как можно дальше друг от друга.
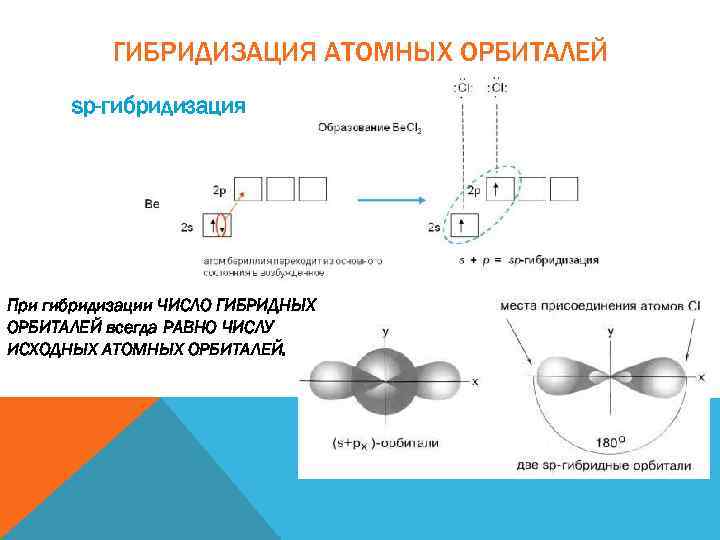 ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛЕЙ sp-гибридизация При гибридизации ЧИСЛО ГИБРИДНЫХ ОРБИТАЛЕЙ всегда РАВНО ЧИСЛУ ИСХОДНЫХ АТОМНЫХ ОРБИТАЛЕЙ.
ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛЕЙ sp-гибридизация При гибридизации ЧИСЛО ГИБРИДНЫХ ОРБИТАЛЕЙ всегда РАВНО ЧИСЛУ ИСХОДНЫХ АТОМНЫХ ОРБИТАЛЕЙ.
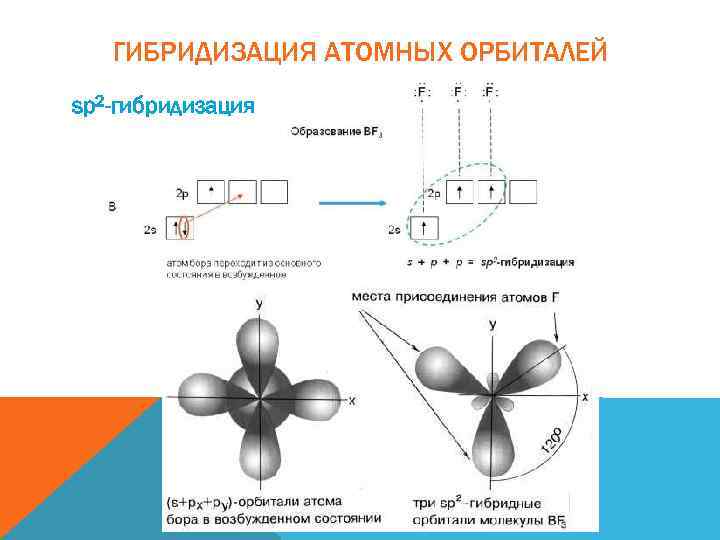 ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛЕЙ sp 2 -гибридизация
ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛЕЙ sp 2 -гибридизация
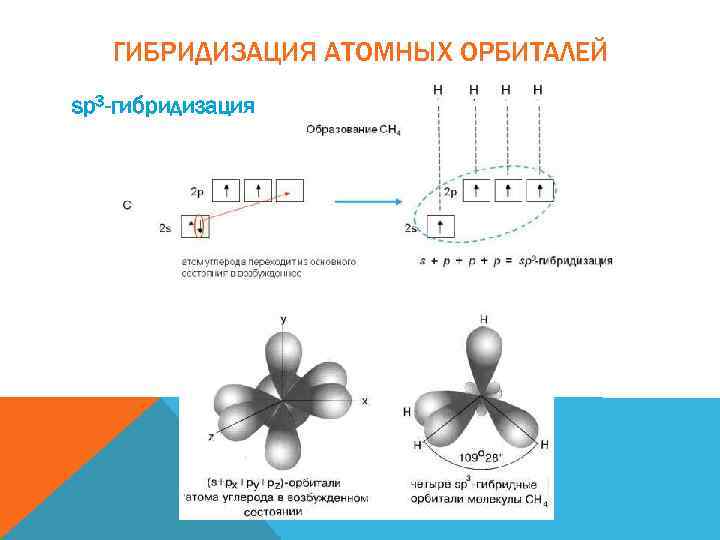 ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛЕЙ sp 3 -гибридизация
ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛЕЙ sp 3 -гибридизация
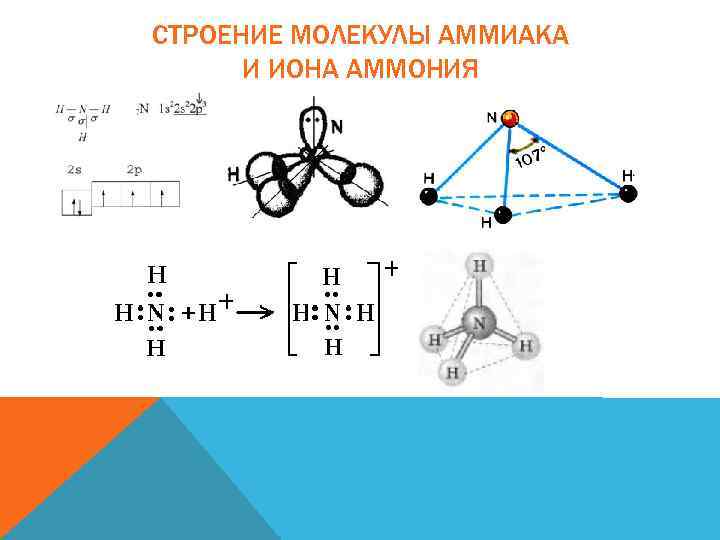 СТРОЕНИЕ МОЛЕКУЛЫ АММИАКА И ИОНА АММОНИЯ
СТРОЕНИЕ МОЛЕКУЛЫ АММИАКА И ИОНА АММОНИЯ
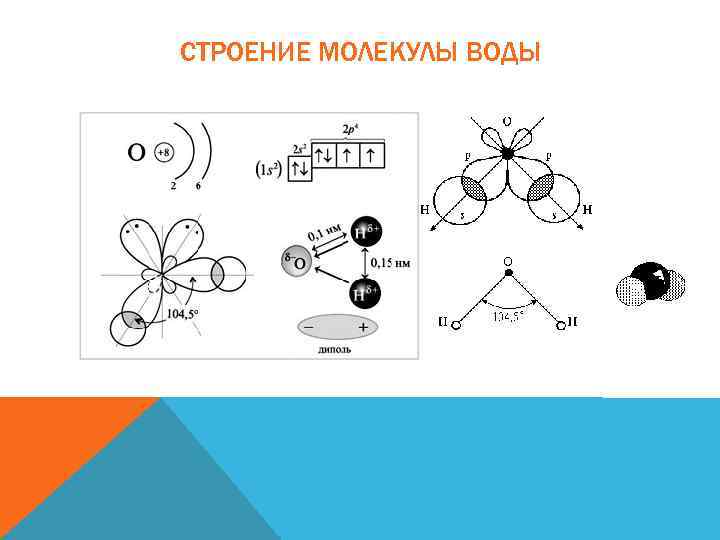 СТРОЕНИЕ МОЛЕКУЛЫ ВОДЫ
СТРОЕНИЕ МОЛЕКУЛЫ ВОДЫ
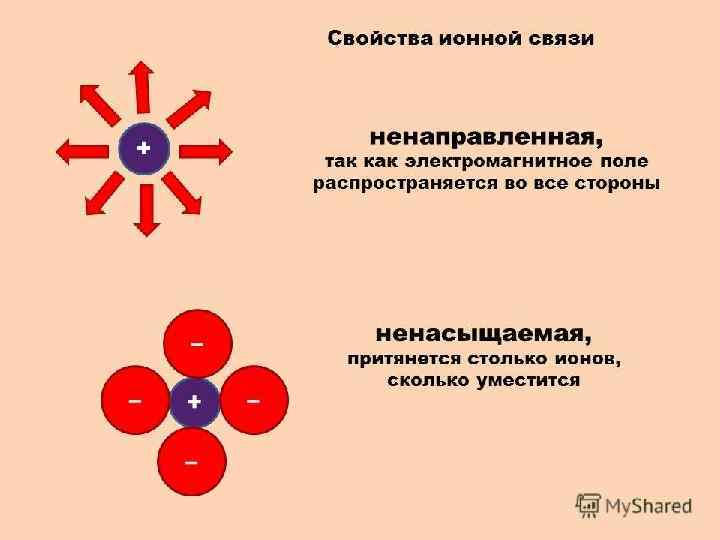
 ИОННАЯ СВЯЗЬ Ионная связь – это химическая связь, возникающая в результате кулоновского притяжения противоположно заряженных ионов. Ионную связь можно рассматривать как предельный случай полярной ковалентной связи. Чем больше разность электроотрицательностей, тем больше доля ионности связи. При разности электроотрицательностей от 0, 4 до 2, 0 связь называют полярной ковалентной, например: связь H—F в молекуле фтороводорода HF: Δ X = (3, 98 - 2, 20) = 1, 78 (полярная ковалентная связь). Связи с разностью электроотрицательностей больше 2, 0 считаются ионными. Например: связь Na—Cl в соединении Na. Cl: Δ X = (3, 16 - 0, 93) = 2, 23 (ионная связь).
ИОННАЯ СВЯЗЬ Ионная связь – это химическая связь, возникающая в результате кулоновского притяжения противоположно заряженных ионов. Ионную связь можно рассматривать как предельный случай полярной ковалентной связи. Чем больше разность электроотрицательностей, тем больше доля ионности связи. При разности электроотрицательностей от 0, 4 до 2, 0 связь называют полярной ковалентной, например: связь H—F в молекуле фтороводорода HF: Δ X = (3, 98 - 2, 20) = 1, 78 (полярная ковалентная связь). Связи с разностью электроотрицательностей больше 2, 0 считаются ионными. Например: связь Na—Cl в соединении Na. Cl: Δ X = (3, 16 - 0, 93) = 2, 23 (ионная связь).
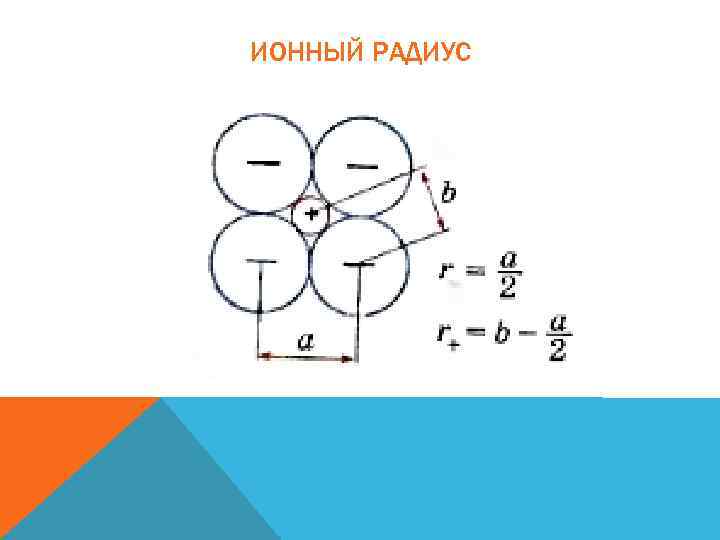 ИОННЫЙ РАДИУС
ИОННЫЙ РАДИУС

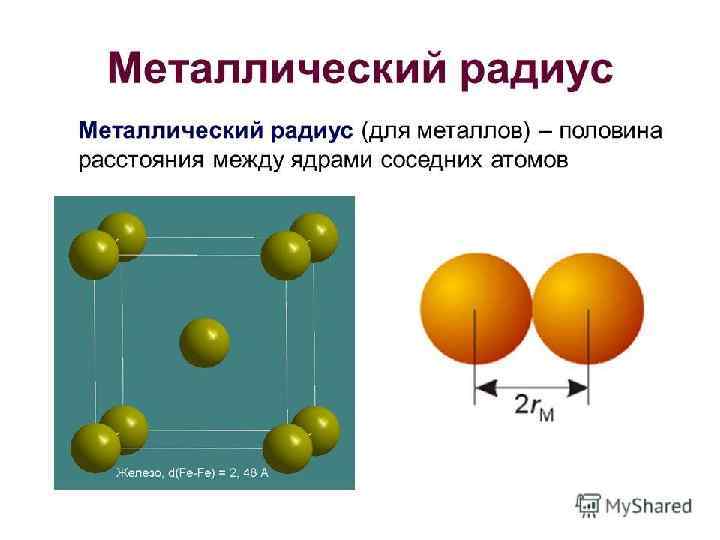
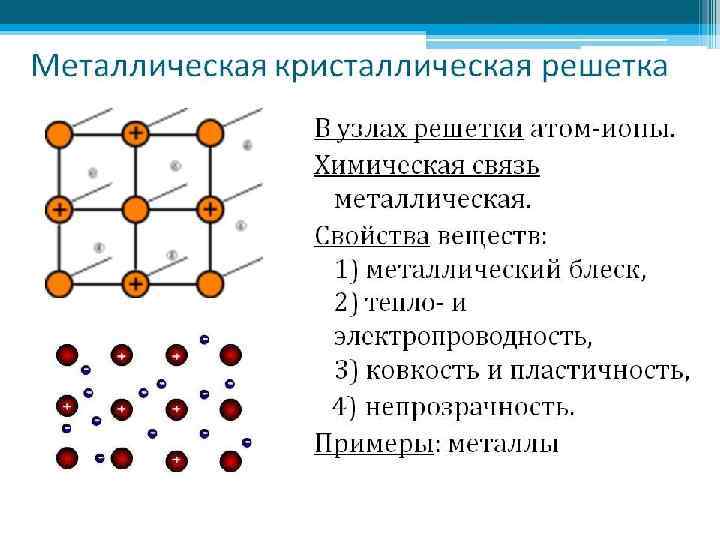
 МЕТАЛЛИЧЕСКАЯ СВЯЗЬ Часть атомов металла в образующемся кристалле отдают в пространство между атомами свои валентные электроны, превращаясь в ионы. Часть электронов при этом всегда оказывается в пространстве между атомами в виде "электронного газа". Металлическая связь – связь между положительными ионами в кристаллах металлов, осуществляемая с помощью свободно движущихся общих электронов.
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ Часть атомов металла в образующемся кристалле отдают в пространство между атомами свои валентные электроны, превращаясь в ионы. Часть электронов при этом всегда оказывается в пространстве между атомами в виде "электронного газа". Металлическая связь – связь между положительными ионами в кристаллах металлов, осуществляемая с помощью свободно движущихся общих электронов.

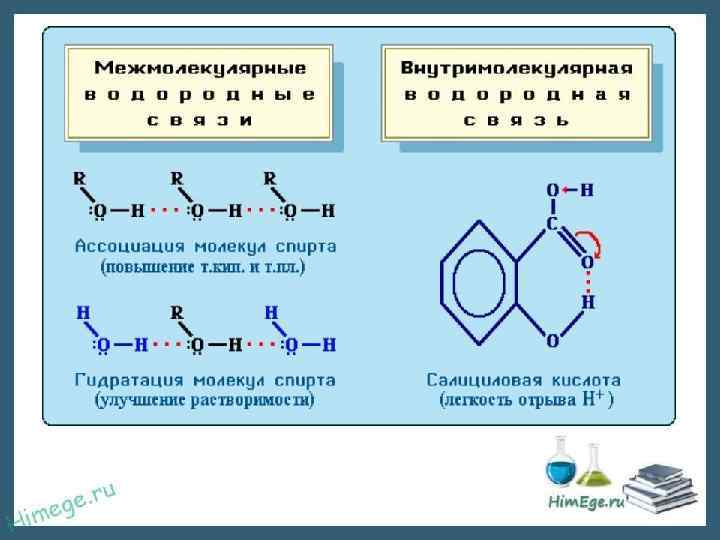
 ВОДОРОДНАЯ СВЯЗЬ
ВОДОРОДНАЯ СВЯЗЬ

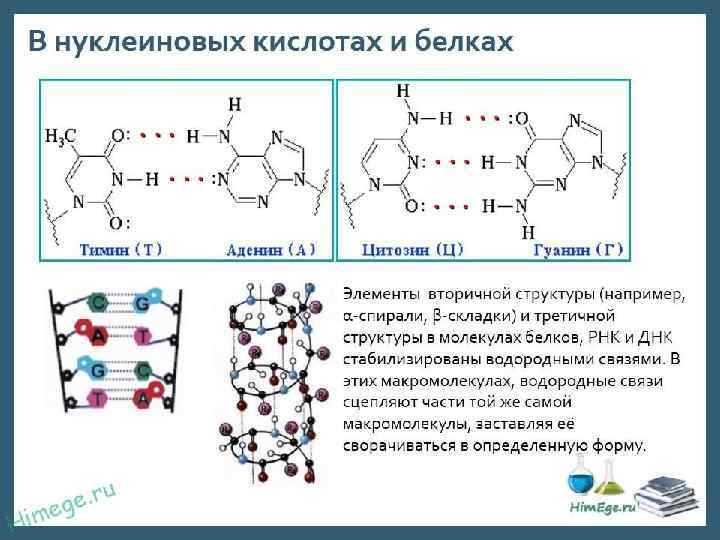
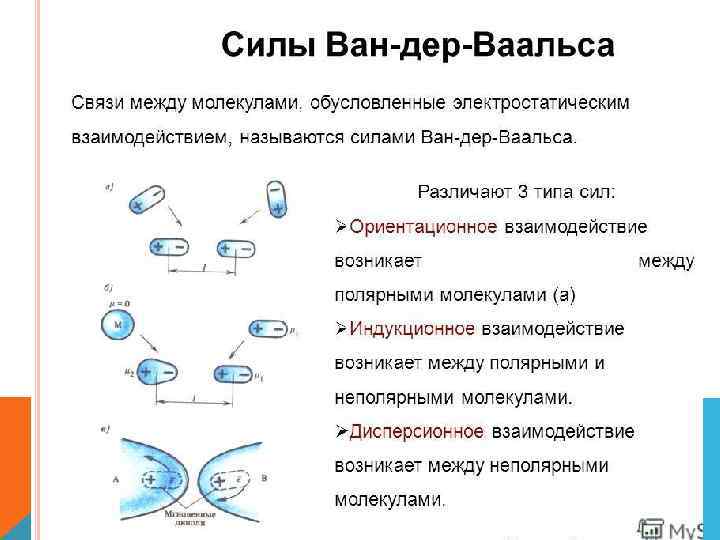 МЕЖМОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ
МЕЖМОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ
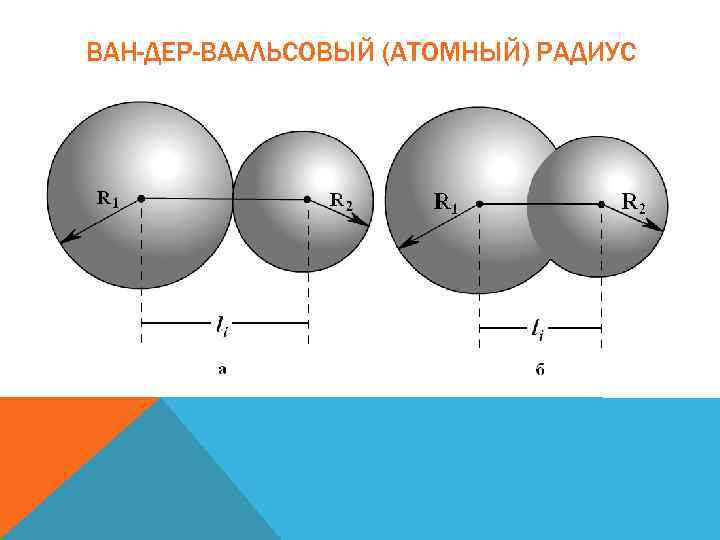 ВАН-ДЕР-ВААЛЬСОВЫЙ (АТОМНЫЙ) РАДИУС
ВАН-ДЕР-ВААЛЬСОВЫЙ (АТОМНЫЙ) РАДИУС
 ВА Т ЕС С ЕН О ТР Е И ЕЩ В
ВА Т ЕС С ЕН О ТР Е И ЕЩ В
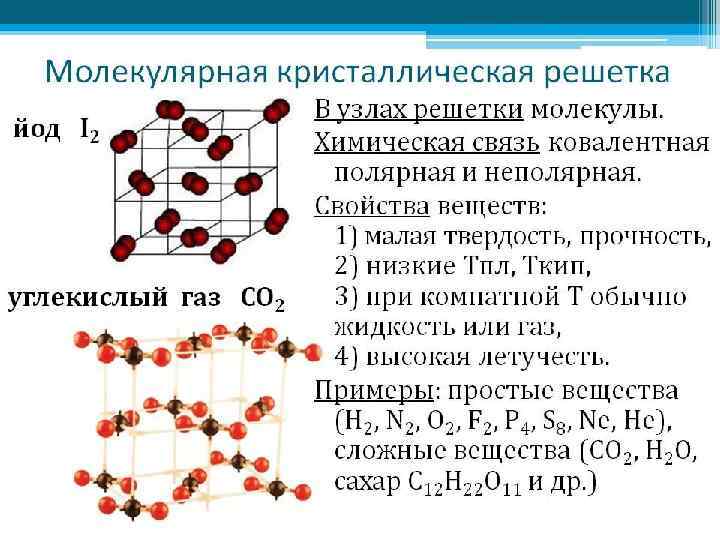
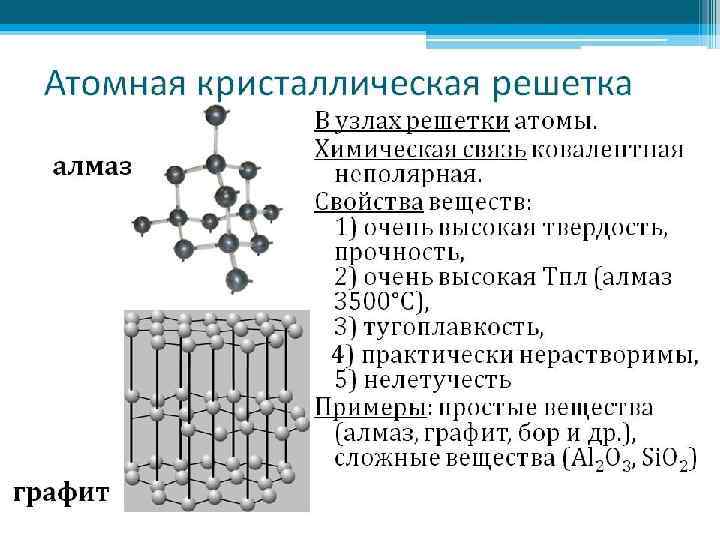
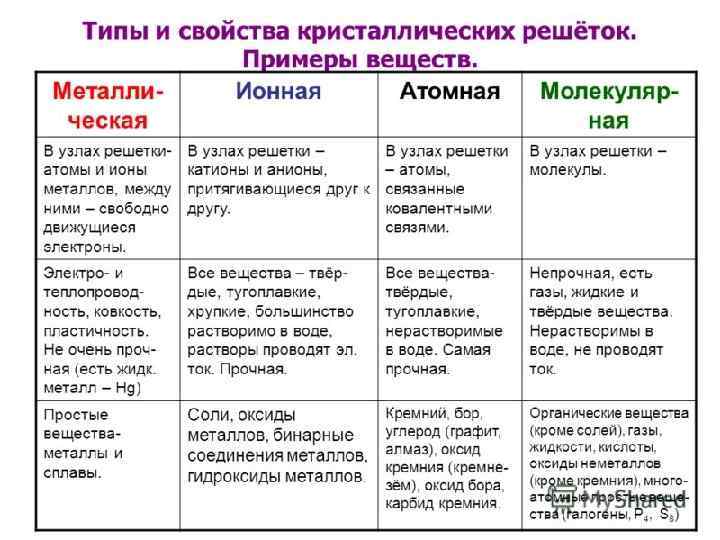
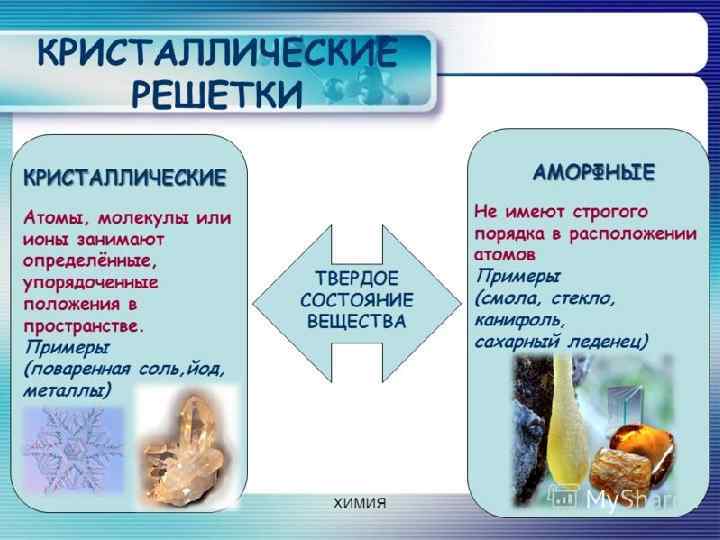
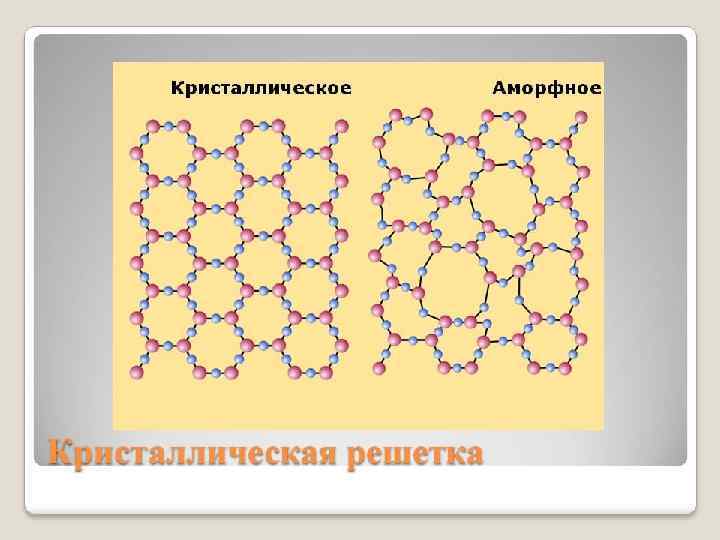
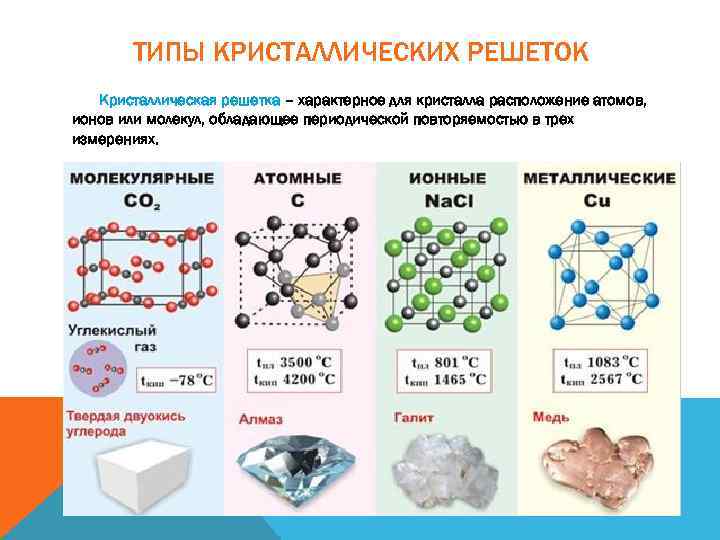 ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЕТОК Кристаллическая решетка – характерное для кристалла расположение атомов, ионов или молекул, обладающее периодической повторяемостью в трех измерениях.
ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЕТОК Кристаллическая решетка – характерное для кристалла расположение атомов, ионов или молекул, обладающее периодической повторяемостью в трех измерениях.

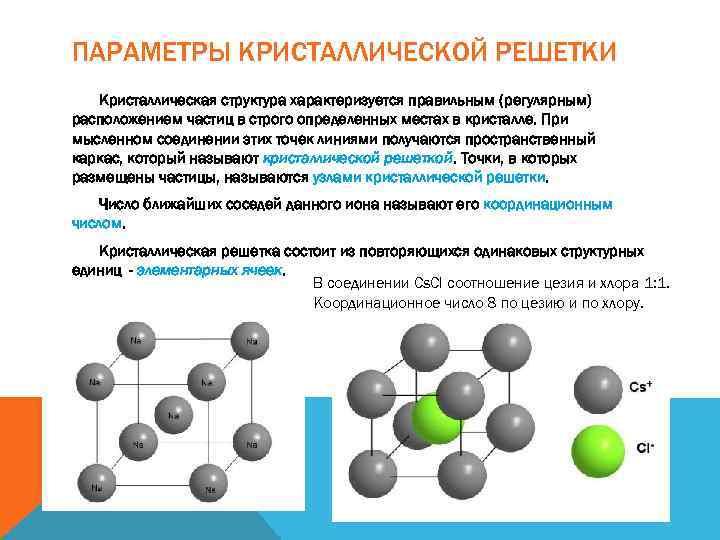 ПАРАМЕТРЫ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ Кристаллическая структура характеризуется правильным (регулярным) расположением частиц в строго определенных местах в кристалле. При мысленном соединении этих точек линиями получаются пространственный каркас, который называют кристаллической решеткой. Точки, в которых размещены частицы, называются узлами кристаллической решетки. Число ближайших соседей данного иона называют его координационным числом. Кристаллическая решетка состоит из повторяющихся одинаковых структурных единиц - элементарных ячеек. В соединении Cs. Cl соотношение цезия и хлора 1: 1. Координационное число 8 по цезию и по хлору.
ПАРАМЕТРЫ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ Кристаллическая структура характеризуется правильным (регулярным) расположением частиц в строго определенных местах в кристалле. При мысленном соединении этих точек линиями получаются пространственный каркас, который называют кристаллической решеткой. Точки, в которых размещены частицы, называются узлами кристаллической решетки. Число ближайших соседей данного иона называют его координационным числом. Кристаллическая решетка состоит из повторяющихся одинаковых структурных единиц - элементарных ячеек. В соединении Cs. Cl соотношение цезия и хлора 1: 1. Координационное число 8 по цезию и по хлору.
 ОСНОВНЫЕ ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЕТОК Примитивная кубическая решетка Характерна для полония.
ОСНОВНЫЕ ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЕТОК Примитивная кубическая решетка Характерна для полония.

 КЧ = 6
КЧ = 6

 ЭНЕРГИЯ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ
ЭНЕРГИЯ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ
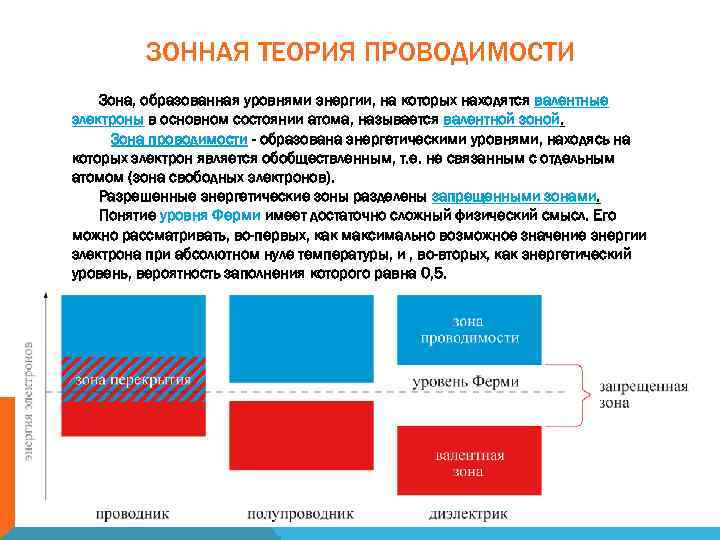 ЗОННАЯ ТЕОРИЯ ПРОВОДИМОСТИ Зона, образованная уровнями энергии, на которых находятся валентные электроны в основном состоянии атома, называется валентной зоной. Зона проводимости - образована энергетическими уровнями, находясь на которых электрон является обобществленным, т. е. не связанным с отдельным атомом (зона свободных электронов). Разрешенные энергетические зоны разделены запрещенными зонами. Понятие уровня Ферми имеет достаточно сложный физический смысл. Его можно рассматривать, во-первых, как максимально возможное значение энергии электрона при абсолютном нуле температуры, и , во-вторых, как энергетический уровень, вероятность заполнения которого равна 0, 5.
ЗОННАЯ ТЕОРИЯ ПРОВОДИМОСТИ Зона, образованная уровнями энергии, на которых находятся валентные электроны в основном состоянии атома, называется валентной зоной. Зона проводимости - образована энергетическими уровнями, находясь на которых электрон является обобществленным, т. е. не связанным с отдельным атомом (зона свободных электронов). Разрешенные энергетические зоны разделены запрещенными зонами. Понятие уровня Ферми имеет достаточно сложный физический смысл. Его можно рассматривать, во-первых, как максимально возможное значение энергии электрона при абсолютном нуле температуры, и , во-вторых, как энергетический уровень, вероятность заполнения которого равна 0, 5.
 ПОЛИМОРФИЗМ Многие твердые вещества могут образовывать несколько кристаллических структур. Это явление называют полиморфизмом, а сами кристаллические структуры – полиморфными модификациями. Оксид кремния – Si. O 2
ПОЛИМОРФИЗМ Многие твердые вещества могут образовывать несколько кристаллических структур. Это явление называют полиморфизмом, а сами кристаллические структуры – полиморфными модификациями. Оксид кремния – Si. O 2
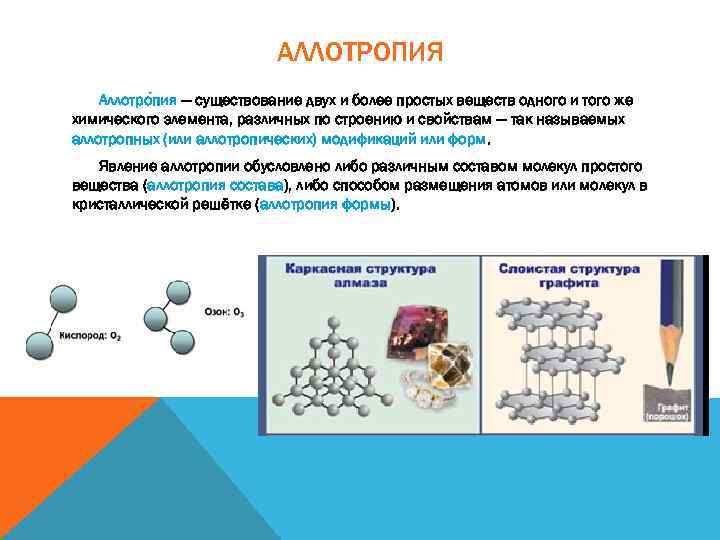 АЛЛОТРОПИЯ Аллотро пия — существование двух и более простых веществ одного и того же химического элемента, различных по строению и свойствам — так называемых аллотропных (или аллотропических) модификаций или форм. Явление аллотропии обусловлено либо различным составом молекул простого вещества (аллотропия состава), либо способом размещения атомов или молекул в кристаллической решётке (аллотропия формы).
АЛЛОТРОПИЯ Аллотро пия — существование двух и более простых веществ одного и того же химического элемента, различных по строению и свойствам — так называемых аллотропных (или аллотропических) модификаций или форм. Явление аллотропии обусловлено либо различным составом молекул простого вещества (аллотропия состава), либо способом размещения атомов или молекул в кристаллической решётке (аллотропия формы).
 ИЗОМОРФИЗМ
ИЗОМОРФИЗМ
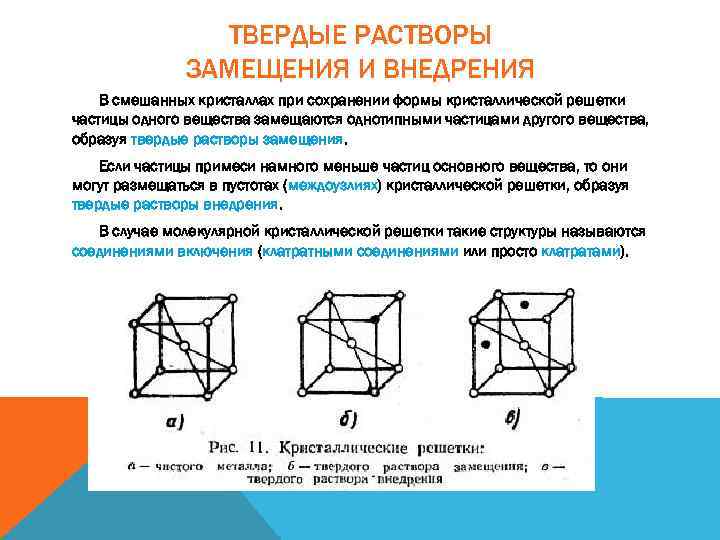 ТВЕРДЫЕ РАСТВОРЫ ЗАМЕЩЕНИЯ И ВНЕДРЕНИЯ В смешанных кристаллах при сохранении формы кристаллической решетки частицы одного вещества замещаются однотипными частицами другого вещества, образуя твердые растворы замещения. Если частицы примеси намного меньше частиц основного вещества, то они могут размещаться в пустотах (междоузлиях) кристаллической решетки, образуя твердые растворы внедрения. В случае молекулярной кристаллической решетки такие структуры называются соединениями включения (клатратными соединениями или просто клатратами).
ТВЕРДЫЕ РАСТВОРЫ ЗАМЕЩЕНИЯ И ВНЕДРЕНИЯ В смешанных кристаллах при сохранении формы кристаллической решетки частицы одного вещества замещаются однотипными частицами другого вещества, образуя твердые растворы замещения. Если частицы примеси намного меньше частиц основного вещества, то они могут размещаться в пустотах (междоузлиях) кристаллической решетки, образуя твердые растворы внедрения. В случае молекулярной кристаллической решетки такие структуры называются соединениями включения (клатратными соединениями или просто клатратами).
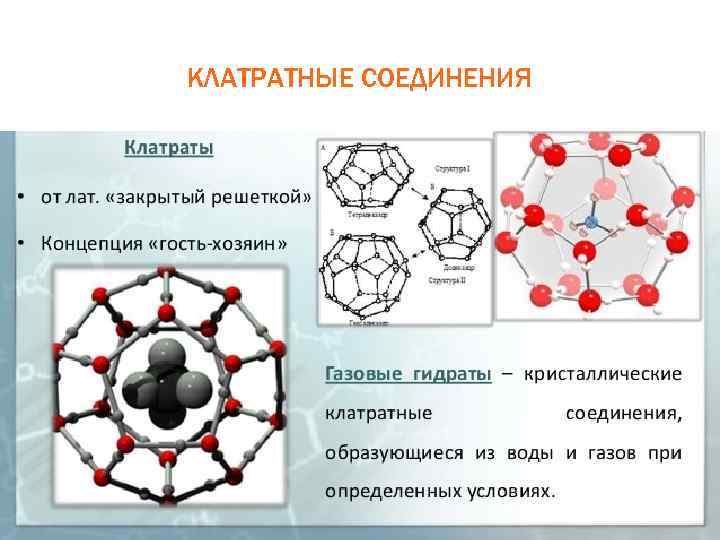 КЛАТРАТНЫЕ СОЕДИНЕНИЯ
КЛАТРАТНЫЕ СОЕДИНЕНИЯ






 А! К ТИ К А ЕП Т РЬ Е РА П
А! К ТИ К А ЕП Т РЬ Е РА П


