 И. В. Александрова, С. И. Рей, Э. И. Первакова ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ У БОЛЬНЫХ В КРИТИЧЕСКОМ СОСТОЯНИИ Научно исследовательский институт скорой помощи им. Н. Б. Склифосовского, Москва Анестезиология и реаниматология 2007 № 4 С 72 -76
И. В. Александрова, С. И. Рей, Э. И. Первакова ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ У БОЛЬНЫХ В КРИТИЧЕСКОМ СОСТОЯНИИ Научно исследовательский институт скорой помощи им. Н. Б. Склифосовского, Москва Анестезиология и реаниматология 2007 № 4 С 72 -76
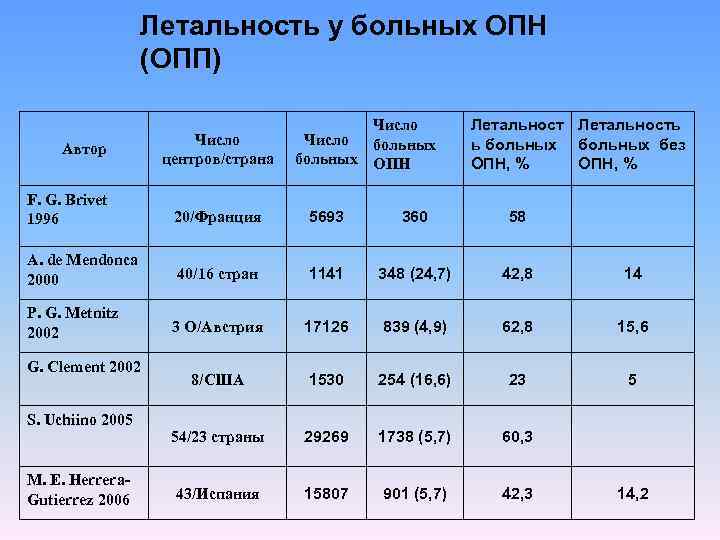 Летальность у больных ОПН (ОПП) Автор Число центров/страна Число больных ОПН Летальность ь больных без ОПН, % F. G. Brivet 1996 20/Франция 5693 360 58 A. de Mendonca 2000 40/16 стран 1141 348 (24, 7) 42, 8 14 P. G. Metnitz 2002 3 О/Австрия 17126 839 (4, 9) 62, 8 15, 6 8/США 1530 254 (16, 6) 23 5 54/23 страны 29269 1738 (5, 7) 60, 3 43/Испания 15807 901 (5, 7) 42, 3 G. Clement 2002 S. Uchiino 2005 M. E. Herrera Gutierrez 2006 14, 2
Летальность у больных ОПН (ОПП) Автор Число центров/страна Число больных ОПН Летальность ь больных без ОПН, % F. G. Brivet 1996 20/Франция 5693 360 58 A. de Mendonca 2000 40/16 стран 1141 348 (24, 7) 42, 8 14 P. G. Metnitz 2002 3 О/Австрия 17126 839 (4, 9) 62, 8 15, 6 8/США 1530 254 (16, 6) 23 5 54/23 страны 29269 1738 (5, 7) 60, 3 43/Испания 15807 901 (5, 7) 42, 3 G. Clement 2002 S. Uchiino 2005 M. E. Herrera Gutierrez 2006 14, 2
 В почках синтезируются: Ренин — участвует в регуляции объема циркулирующей крови и кровяного давления, влияя на обмен воды и натрия Эритропоэтин — высвобождается в ответ на дефицит кислорода в ткани почек; он стимулирует образование эритроцитов в костном мозге Активная форма витамина О — увеличивает всасывание кальция, фосфора и магния в кишечнике; стимулирует процессы резорбции костной ткани (вымывание кальция и фосфора) и повышает реабсорбцию (сохранение в организме) кальция и фосфора в почках. Все это способствует поддержанию концентрации кальция, фосфора и магния в пределах нормы Простагландины — оказывают преимущественно сосудорасширяющее действие, влияют на кровоток к почкам и в почечной ткани, увеличивают чувствительность почечной ткани к действию антидиуретического гормона и альдостерона
В почках синтезируются: Ренин — участвует в регуляции объема циркулирующей крови и кровяного давления, влияя на обмен воды и натрия Эритропоэтин — высвобождается в ответ на дефицит кислорода в ткани почек; он стимулирует образование эритроцитов в костном мозге Активная форма витамина О — увеличивает всасывание кальция, фосфора и магния в кишечнике; стимулирует процессы резорбции костной ткани (вымывание кальция и фосфора) и повышает реабсорбцию (сохранение в организме) кальция и фосфора в почках. Все это способствует поддержанию концентрации кальция, фосфора и магния в пределах нормы Простагландины — оказывают преимущественно сосудорасширяющее действие, влияют на кровоток к почкам и в почечной ткани, увеличивают чувствительность почечной ткани к действию антидиуретического гормона и альдостерона
 В периоде стресса любого происхождения и немедленно после него повышается уровень практически всех гормонов надпочечников глюкокортикоидов и минералокортикоидов. Существенно возрастает содержание свободного кортизола в плазме. Эта реакция совпадает с уменьшением экскреции натрия и воды
В периоде стресса любого происхождения и немедленно после него повышается уровень практически всех гормонов надпочечников глюкокортикоидов и минералокортикоидов. Существенно возрастает содержание свободного кортизола в плазме. Эта реакция совпадает с уменьшением экскреции натрия и воды
 • В том же периоде можно отметить исключительно высокое содержание альдостерона в крови. Вопрос о первичной роли альдостерона в регуляции натрийуреза в послеоперационном периоде окончательно не решен. • У больных, перенесших адреналэктомию и поддерживаемых только введением расчетных доз глюкокортикоидов, задержка натрия в послеоперационом периоде невелика.
• В том же периоде можно отметить исключительно высокое содержание альдостерона в крови. Вопрос о первичной роли альдостерона в регуляции натрийуреза в послеоперационном периоде окончательно не решен. • У больных, перенесших адреналэктомию и поддерживаемых только введением расчетных доз глюкокортикоидов, задержка натрия в послеоперационом периоде невелика.
 • Альдостерон является одним из главных факторов задержки натрия после стрессовых ситуаций, в том числе после операций и травмы. Однако нельзя исключить, что при его отсутствии эта роль переходит к каким то другим факторам. • В регуляции экскреции натрия после солевой нагрузки принимают участие так называемые натрийуретические гормоны или пептиды, которые могут вырабатываться в мозге и в предсердиях.
• Альдостерон является одним из главных факторов задержки натрия после стрессовых ситуаций, в том числе после операций и травмы. Однако нельзя исключить, что при его отсутствии эта роль переходит к каким то другим факторам. • В регуляции экскреции натрия после солевой нагрузки принимают участие так называемые натрийуретические гормоны или пептиды, которые могут вырабатываться в мозге и в предсердиях.
 • Выраженность натрийуреза зависит от интенсивности почечного кровотока. Периодические окклюзии почечных вен могут усилить экскрецию натрия. Механизм, регулирующий натрийурез, обусловлен также характером распределения кровотока между поверхностными и глубокими кортикальными нефронами. • Почки под влиянием стресса, травмы и операции способны выделять ряд других вазоактивных веществ, которые можно отнести к гормональным.
• Выраженность натрийуреза зависит от интенсивности почечного кровотока. Периодические окклюзии почечных вен могут усилить экскрецию натрия. Механизм, регулирующий натрийурез, обусловлен также характером распределения кровотока между поверхностными и глубокими кортикальными нефронами. • Почки под влиянием стресса, травмы и операции способны выделять ряд других вазоактивных веществ, которые можно отнести к гормональным.
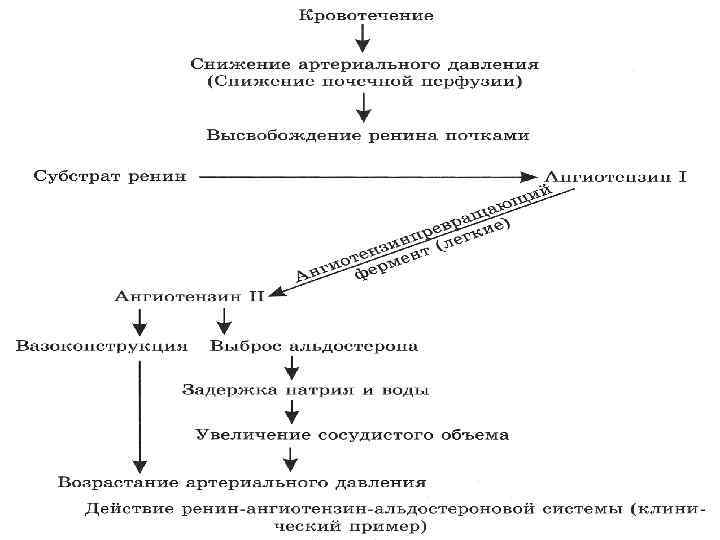
 Среди них одно из первых мест по значимости занимает ренин, высвобождающийся при нарушении почечного кровообращения. Ангиотензин II. другой важнейший гормон, высвобождаемый корковым веществом почки и оказывающий воздействие непосредственно на сосудистую систему почек. Основными функциями этого гормона, физиологическая активность которого связана с ренином, являются регуляция распределения кровотока между поверхностными и юкстамедуллярными нефронами и, следовательно, регуляция натрийуреза.
Среди них одно из первых мест по значимости занимает ренин, высвобождающийся при нарушении почечного кровообращения. Ангиотензин II. другой важнейший гормон, высвобождаемый корковым веществом почки и оказывающий воздействие непосредственно на сосудистую систему почек. Основными функциями этого гормона, физиологическая активность которого связана с ренином, являются регуляция распределения кровотока между поверхностными и юкстамедуллярными нефронами и, следовательно, регуляция натрийуреза.
 • Продукция этих гормонов, как установлено в многочисленных клинических исследованиях, значительно повышается у больных в критических состояниях. • Наряду с этими гормонами одним из важнейших факторов регуляции концентрационной и экскреторной функции почек является антидиуретический гормон (АДГ), выделяемый задней долей гипофиза.
• Продукция этих гормонов, как установлено в многочисленных клинических исследованиях, значительно повышается у больных в критических состояниях. • Наряду с этими гормонами одним из важнейших факторов регуляции концентрационной и экскреторной функции почек является антидиуретический гормон (АДГ), выделяемый задней долей гипофиза.
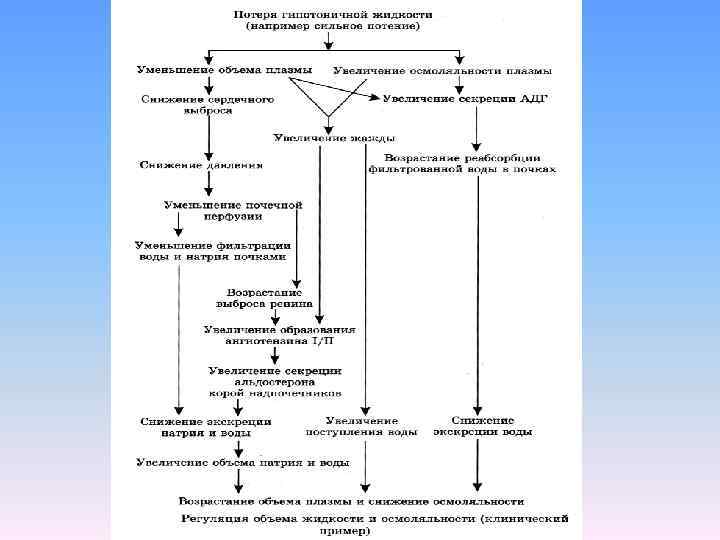
 • Концентрация АДГ, равная в норме 0. 05 6 мкг/мл, под влиянием травмы повышается в 10 100 раз. Основной механизм действия АДГ заключается в задержке выведения водной фракции мочи, называемой свободной водой. В норме концентрация поваренной соли в моче составляет 0, 18%, т. е. тоничность мочи в 5 раз ниже тоничности плазмы.
• Концентрация АДГ, равная в норме 0. 05 6 мкг/мл, под влиянием травмы повышается в 10 100 раз. Основной механизм действия АДГ заключается в задержке выведения водной фракции мочи, называемой свободной водой. В норме концентрация поваренной соли в моче составляет 0, 18%, т. е. тоничность мочи в 5 раз ниже тоничности плазмы.
 • Тормозящее влияние АДГ распространяется главным образом на выделение именно водной фракции мочи. Таким образом, метаболическая реакция на травму или любое вмешательство выражается прежде всего в снижении способности организма выводить свободную воду в связи с повышением уровня АДГ в крови.
• Тормозящее влияние АДГ распространяется главным образом на выделение именно водной фракции мочи. Таким образом, метаболическая реакция на травму или любое вмешательство выражается прежде всего в снижении способности организма выводить свободную воду в связи с повышением уровня АДГ в крови.
 • Пусковым моментом повышения секреции АДГ является раздражение гипоталамических осморецепторов при повышении осмоляльности плазмы, обычно возникающем при травме и операции. После операции повышенный уровень АДГ сохраняется в течение нескольких дней и начинает постепенно падать на З и 4 е сутки.
• Пусковым моментом повышения секреции АДГ является раздражение гипоталамических осморецепторов при повышении осмоляльности плазмы, обычно возникающем при травме и операции. После операции повышенный уровень АДГ сохраняется в течение нескольких дней и начинает постепенно падать на З и 4 е сутки.
 • Как показывает практика, в послеоперационном периоде антидиуретический эффект значительно снижается, если больной получает жидкости примерно на 2 л больше измеренных потерь.
• Как показывает практика, в послеоперационном периоде антидиуретический эффект значительно снижается, если больной получает жидкости примерно на 2 л больше измеренных потерь.
 • Действие АДГ в послеоперационном периоде в ряде случаев проявляется длительно, несмотря на то, что развивается гипотоничность плазмы в связи с увеличением объема внеклеточного пространства и перераспределением натрия Этот эффект, пока еще не вполне объяснимый теоретически, наиболее отчетливо проявляется в течение 2 3 суток после операции. В фазе восстановления возобновляется осморецепторный контроль секреции АДГ и вновь налаживается адекватный диурез.
• Действие АДГ в послеоперационном периоде в ряде случаев проявляется длительно, несмотря на то, что развивается гипотоничность плазмы в связи с увеличением объема внеклеточного пространства и перераспределением натрия Этот эффект, пока еще не вполне объяснимый теоретически, наиболее отчетливо проявляется в течение 2 3 суток после операции. В фазе восстановления возобновляется осморецепторный контроль секреции АДГ и вновь налаживается адекватный диурез.
 • В первой фазе критического состояния повышается секреция глюкокортикоидов в плазме (в течение 24 48 часов), а также увеличивается экскреция 17 оксикорти коидов (при неизменном обмене тестостерона, т. к. 17 кетостероиды являются конечным продуктом преобразований тестостерона) с мочой в течение нескольких дней и внезапным снижением числа эозинофилов в крови в течение 2 4 суток после операции. ( привести пример)
• В первой фазе критического состояния повышается секреция глюкокортикоидов в плазме (в течение 24 48 часов), а также увеличивается экскреция 17 оксикорти коидов (при неизменном обмене тестостерона, т. к. 17 кетостероиды являются конечным продуктом преобразований тестостерона) с мочой в течение нескольких дней и внезапным снижением числа эозинофилов в крови в течение 2 4 суток после операции. ( привести пример)
 Алъдостерон Альдостерон — минералокортикоидный гормон, выделяемый корой надпочечников, — действует на дистальную часть почечных канальцев, увеличивая реабсорбцию (сохранение) натрия, секрецию и экскрецию калия и ионов водорода. Задержка натрия ведет к задержке воды, поэтому альдостерон можно рассматривать как регулятор объема жидкости. К факторам, увеличивающим выброс альдостерона, относятся: 1. Увеличение содержания ангиотензина II. 2. Возрастание содержания калия в плазме. 3. Снижение содержания натрия в плазме. 4. Увеличение содержания адренокортикотропного гормона.
Алъдостерон Альдостерон — минералокортикоидный гормон, выделяемый корой надпочечников, — действует на дистальную часть почечных канальцев, увеличивая реабсорбцию (сохранение) натрия, секрецию и экскрецию калия и ионов водорода. Задержка натрия ведет к задержке воды, поэтому альдостерон можно рассматривать как регулятор объема жидкости. К факторам, увеличивающим выброс альдостерона, относятся: 1. Увеличение содержания ангиотензина II. 2. Возрастание содержания калия в плазме. 3. Снижение содержания натрия в плазме. 4. Увеличение содержания адренокортикотропного гормона.
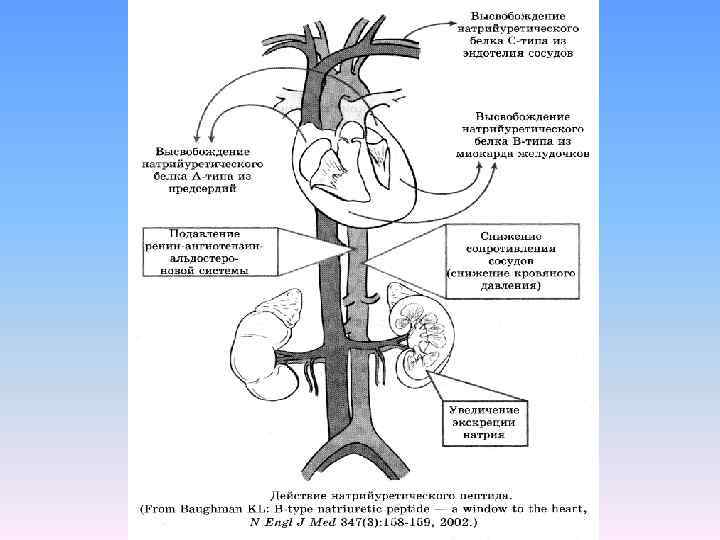
 Антидиуретический гормон синтезируется в гипоталамусе и выделяется в кровь задней долей гипофиза. Он воздействует на собирательные трубочки нефронов, приводя к увеличению резорбции (сохранения) воды и выделения более концентрированной мочи. АДГ также является артериальным вазокон стриктором, который повышает кровяное давление путем увеличения сосудистого сопротивления.
Антидиуретический гормон синтезируется в гипоталамусе и выделяется в кровь задней долей гипофиза. Он воздействует на собирательные трубочки нефронов, приводя к увеличению резорбции (сохранения) воды и выделения более концентрированной мочи. АДГ также является артериальным вазокон стриктором, который повышает кровяное давление путем увеличения сосудистого сопротивления.


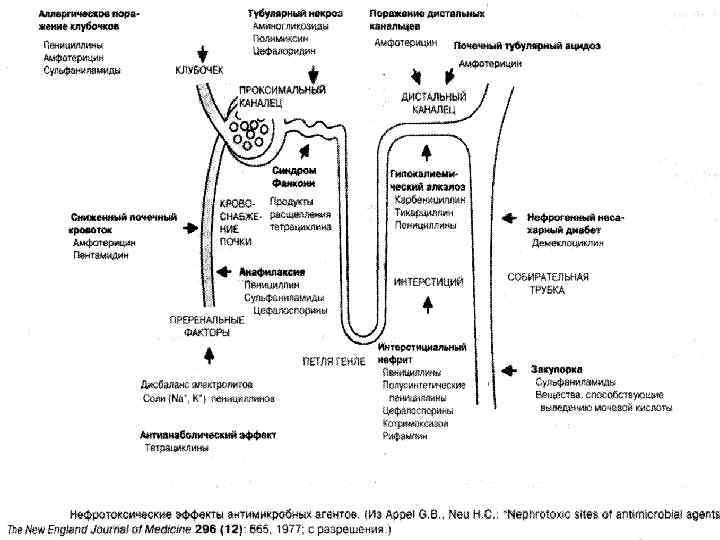
 Рис. 1. Схема транспорта натрия в асимметричной клетке осморегулирующего эпителия 1 апикальная плазматическая мембрана, 2 базальная плазматическая мембрана, 3 - митохондрия, 4 цитоплазма, 5 натриевый канал, 6 натриевый насос, 7 - зона межкле точногосоединения; стрелки указывают направление пото ка ионов в зависимости от градиента их концентрации (Ю. В. Наточин, 2007)
Рис. 1. Схема транспорта натрия в асимметричной клетке осморегулирующего эпителия 1 апикальная плазматическая мембрана, 2 базальная плазматическая мембрана, 3 - митохондрия, 4 цитоплазма, 5 натриевый канал, 6 натриевый насос, 7 - зона межкле точногосоединения; стрелки указывают направление пото ка ионов в зависимости от градиента их концентрации (Ю. В. Наточин, 2007)

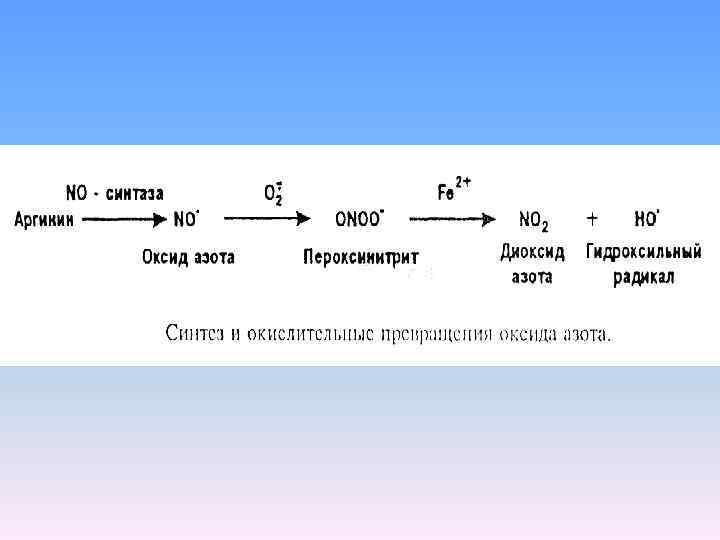
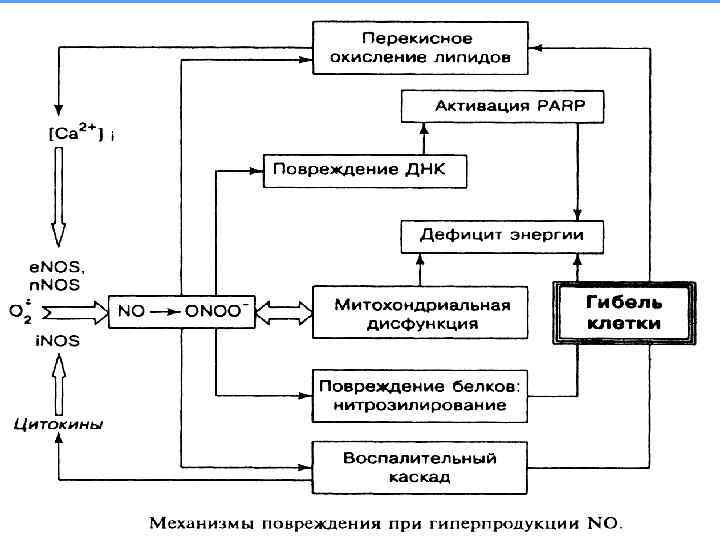
 Присоединение одного электрона к молекуле кислорода с помощью фермента НАDPH оксидазы приводит к образованию супероксидного анион радикала О 2 , его роль в значительной мере регуляторная. Пероксид водорода не является радикалом – «дальнобойное оружие» . В нейтрофилах – миелопероксидаза – пероксид водорода присоединяет ион хлора – гипохлорная кислота – НОСl. Анион гипохлорной кислоты –ОСl – гипохлорит – сильный окислитель, активная бактерицидная функция.
Присоединение одного электрона к молекуле кислорода с помощью фермента НАDPH оксидазы приводит к образованию супероксидного анион радикала О 2 , его роль в значительной мере регуляторная. Пероксид водорода не является радикалом – «дальнобойное оружие» . В нейтрофилах – миелопероксидаза – пероксид водорода присоединяет ион хлора – гипохлорная кислота – НОСl. Анион гипохлорной кислоты –ОСl – гипохлорит – сильный окислитель, активная бактерицидная функция.
 Пероксид водорода образуется не только ферментом СОД, но и некоторыми другими ферментами, например, циклоксигеназой. Избыток пероксида водорода «выключает» синтез простагландинов, когда влияния этих физиологически активных соединений организму больше не требуется. Подобным свойством обладает монооксигеназа (цитохром Р 450), которая в процессе метаболизма ксенобиотиков также продуцирует пероксид водорода. Исчерпав субстрат окисления, пероксид водорода инактивирует фермент и прекращает его деятельность.
Пероксид водорода образуется не только ферментом СОД, но и некоторыми другими ферментами, например, циклоксигеназой. Избыток пероксида водорода «выключает» синтез простагландинов, когда влияния этих физиологически активных соединений организму больше не требуется. Подобным свойством обладает монооксигеназа (цитохром Р 450), которая в процессе метаболизма ксенобиотиков также продуцирует пероксид водорода. Исчерпав субстрат окисления, пероксид водорода инактивирует фермент и прекращает его деятельность.
 Таким образом, инактивация ряда ферментов пероксидом водорода представляет собой физиологический механизм регуляции их деятельности. Однако под влиянием факторов окружающей среды образование пероксида водорода может оказаться чрезмерным. В этих условиях инактивация того или иного фермента пероксидом водорода становится важным звеном патогенеза ряда заболеваний, например, ХНЗЛ с обструктивным синдромом.
Таким образом, инактивация ряда ферментов пероксидом водорода представляет собой физиологический механизм регуляции их деятельности. Однако под влиянием факторов окружающей среды образование пероксида водорода может оказаться чрезмерным. В этих условиях инактивация того или иного фермента пероксидом водорода становится важным звеном патогенеза ряда заболеваний, например, ХНЗЛ с обструктивным синдромом.
 Продуктом третьей стадии восстановления молекулы кислорода является гидроксильный радикал НО. , отличающийся высоким окислительным потенциалом. Вступает в химические реакции практически на месте и в момент своего образования. Максимальное расстояние, на которое способен диффундировать в клетке этот радикал, не превышает двух диаметров его молекулы. Ферментативное регулирование его не существует, но есть система из трех ферментов превращающая пероксид водорода в молекулярный кислород и воду без образования свободных радикалов (каталаза, пероксидаза, глутатион пероксидаза).
Продуктом третьей стадии восстановления молекулы кислорода является гидроксильный радикал НО. , отличающийся высоким окислительным потенциалом. Вступает в химические реакции практически на месте и в момент своего образования. Максимальное расстояние, на которое способен диффундировать в клетке этот радикал, не превышает двух диаметров его молекулы. Ферментативное регулирование его не существует, но есть система из трех ферментов превращающая пероксид водорода в молекулярный кислород и воду без образования свободных радикалов (каталаза, пероксидаза, глутатион пероксидаза).
 Факторы риска развития ОПН 1. Предрасполагающие факторы и предшествующие заболевания. К этой группе относится мужской пол, пожилой возраст, гипоальбуминемия. Наличие в анамнезе сахарного диабета, хронической почечной недостаточности, печеночной недостаточности, сердечной недостаточности и сосудистой патологии также является факторами риска развития ОПН. В то же время в работе S. Bagshaw и соавт. [2005] указывается, что мужской пол является предрасполагающим фак тором развития ОПН только у лиц старше 65 лет.
Факторы риска развития ОПН 1. Предрасполагающие факторы и предшествующие заболевания. К этой группе относится мужской пол, пожилой возраст, гипоальбуминемия. Наличие в анамнезе сахарного диабета, хронической почечной недостаточности, печеночной недостаточности, сердечной недостаточности и сосудистой патологии также является факторами риска развития ОПН. В то же время в работе S. Bagshaw и соавт. [2005] указывается, что мужской пол является предрасполагающим фак тором развития ОПН только у лиц старше 65 лет.
 2. Факторы, обусловленные критическим состоянием. Явления гиповолемии, гипотензии и шока приводят к изменениям внутрипочечной гемодинамики с развитием ишемии коркового слоя и прогрессированием ишемического и/или реперфузионного повреждения за счет оксидантного тканевого повреждения. Происходит повреждение тубулогломерулярного регуляторного механизма. При наличии сепсиса медиаторы воспаления инициируют эндотелиальную дисфункцию. Происходит апоптоз и некроз клеток, в конечном счете приводящий к канальцевому повреждению и обструкции. К факторам риска развития ОПН также относятся ОРДС и ИВЛ, печеночная недостаточность, коагулопатия, сердечно сосуди стые операции и операции в трансплантологии.
2. Факторы, обусловленные критическим состоянием. Явления гиповолемии, гипотензии и шока приводят к изменениям внутрипочечной гемодинамики с развитием ишемии коркового слоя и прогрессированием ишемического и/или реперфузионного повреждения за счет оксидантного тканевого повреждения. Происходит повреждение тубулогломерулярного регуляторного механизма. При наличии сепсиса медиаторы воспаления инициируют эндотелиальную дисфункцию. Происходит апоптоз и некроз клеток, в конечном счете приводящий к канальцевому повреждению и обструкции. К факторам риска развития ОПН также относятся ОРДС и ИВЛ, печеночная недостаточность, коагулопатия, сердечно сосуди стые операции и операции в трансплантологии.
 В предоперационный период у 29 40% экстренных больных, выявляется повышение внутрибрюшного давления различной степени выраженности. У 65% больных с ПВД обнаружены признаки поражения почек (на 1 ом органы дыхания – 91%, на 2 ом – органы ССС – 84%).
В предоперационный период у 29 40% экстренных больных, выявляется повышение внутрибрюшного давления различной степени выраженности. У 65% больных с ПВД обнаружены признаки поражения почек (на 1 ом органы дыхания – 91%, на 2 ом – органы ССС – 84%).
 Применение эпидуральной анестезии в предоперационный период По сравнению с промедолом (20 мг. в/м), в 1, 5 раза снижает степень выраженности болевого напряжения мышц передней брюшной стенки. В 1, 6 раза снизилась тяжесть состояния пациентов по шкале SOFA. Б. М. Фадеев с соавт. Предоперационная коррекция органной недостаточности при синдроме интраабдоминальной гипертензии у пациентов с экстренной хирургической патологией. Ульяновский ОКЦ спец. видов мед. пом. , V съезд ПФО / Вестник интенсив. терап. 2012 № 6 Стр. 115 117
Применение эпидуральной анестезии в предоперационный период По сравнению с промедолом (20 мг. в/м), в 1, 5 раза снижает степень выраженности болевого напряжения мышц передней брюшной стенки. В 1, 6 раза снизилась тяжесть состояния пациентов по шкале SOFA. Б. М. Фадеев с соавт. Предоперационная коррекция органной недостаточности при синдроме интраабдоминальной гипертензии у пациентов с экстренной хирургической патологией. Ульяновский ОКЦ спец. видов мед. пом. , V съезд ПФО / Вестник интенсив. терап. 2012 № 6 Стр. 115 117
 Мониторинг и коррекция реакции почек на малообъемное восстановление гемодинамики и при политравме Ганерт А. Н. Медицинская академия, Ярославль Информационный сборник ВИНИТИ Новости анестезиологии и реаниматологии 2009 № 1 С 106
Мониторинг и коррекция реакции почек на малообъемное восстановление гемодинамики и при политравме Ганерт А. Н. Медицинская академия, Ярославль Информационный сборник ВИНИТИ Новости анестезиологии и реаниматологии 2009 № 1 С 106
 40 больным (SAPS II 49, 2± 8, 32 баллов) с тяжелой сочетанной травмой для достижения целевых значений гемодинамики, насыщения крови кислородом в центральной вене (Scv. O 2) и диуреза внутривенно вводилось 4 мл/кг 7, 5% раствора хлорида натрия и Венофундина, или Гипер. ХАЕС, с последующей инфузионной и, по показаниям, инотропной поддержкой на протяжении 6 часов.
40 больным (SAPS II 49, 2± 8, 32 баллов) с тяжелой сочетанной травмой для достижения целевых значений гемодинамики, насыщения крови кислородом в центральной вене (Scv. O 2) и диуреза внутривенно вводилось 4 мл/кг 7, 5% раствора хлорида натрия и Венофундина, или Гипер. ХАЕС, с последующей инфузионной и, по показаниям, инотропной поддержкой на протяжении 6 часов.
 Мониторировались Scv. O 2, плазменная концентрация натрия, хлора, лактата, кислотно основное состояние и осмотическое давление крови, диурез, скорость клубочковой фильтрации (СКФ), определялась суточная экскреция натрия и хлора с мочой. Функция почек оценивалась по шкале RIFLE.
Мониторировались Scv. O 2, плазменная концентрация натрия, хлора, лактата, кислотно основное состояние и осмотическое давление крови, диурез, скорость клубочковой фильтрации (СКФ), определялась суточная экскреция натрия и хлора с мочой. Функция почек оценивалась по шкале RIFLE.
 До малообъемного восстановления гемодинамики у больных отмечалась критическая артериальная гипотензия, рефрактерная к проводимой инфузионной терапии, низкая Scv. O 2, гиперлактатемия, олигурия, снижение СКФ, с почечной дисфункцией степени R (риск) у 26 больных, I (повреждение) у 10 больных, F (недостаточность) у 4 пациентов. ГР (гипер. р р) приводил у 38 больных к быстрому подъему АД, нормализации Scv. O 2 и уровня лактата.
До малообъемного восстановления гемодинамики у больных отмечалась критическая артериальная гипотензия, рефрактерная к проводимой инфузионной терапии, низкая Scv. O 2, гиперлактатемия, олигурия, снижение СКФ, с почечной дисфункцией степени R (риск) у 26 больных, I (повреждение) у 10 больных, F (недостаточность) у 4 пациентов. ГР (гипер. р р) приводил у 38 больных к быстрому подъему АД, нормализации Scv. O 2 и уровня лактата.
 Малообъемное восстановление гемодинамики вызывало 2 вида реакции почек. У 22 больных отмечалось значительное увеличение диуреза (полиурия) и СКФ в первые 2 часа с последующей их нормализацией, адекватной экскрецией натрия и хлора, транзиторным характером гипернатриемии и гиперхлоремии.
Малообъемное восстановление гемодинамики вызывало 2 вида реакции почек. У 22 больных отмечалось значительное увеличение диуреза (полиурия) и СКФ в первые 2 часа с последующей их нормализацией, адекватной экскрецией натрия и хлора, транзиторным характером гипернатриемии и гиперхлоремии.
 У остальных 16 больных наблюдалось замедленное возрастание скорости клубочковой фильтрации и диуреза с их нормализацией к 4 6 часам, но данная экскреторная способность почек не обеспечивала восстановление электролитного баланса, сохранялись высокая гипернатриемия/хлоремия.
У остальных 16 больных наблюдалось замедленное возрастание скорости клубочковой фильтрации и диуреза с их нормализацией к 4 6 часам, но данная экскреторная способность почек не обеспечивала восстановление электролитного баланса, сохранялись высокая гипернатриемия/хлоремия.
 Этим больным в дальнейшем инфузировалось 1000 мл Нормофундина Г 5, что привело к увеличению диуреза с нормализацией натрия и хлора плазмы. У 4 больных при недостаточном его увеличении на нормофундин дополнительно вводилось 40 мг фуросемида с положительным эффектом.
Этим больным в дальнейшем инфузировалось 1000 мл Нормофундина Г 5, что привело к увеличению диуреза с нормализацией натрия и хлора плазмы. У 4 больных при недостаточном его увеличении на нормофундин дополнительно вводилось 40 мг фуросемида с положительным эффектом.
 Малообъемное восстановление гемодинамики сопровождается острой нагрузкой организма натрием и хлором. Это требует мониторинга суточного диуреза и коррекции при недостаточном его увеличении. Возможными вариантами такой коррекции являются инфузия нормофундина и введение фуросемида.
Малообъемное восстановление гемодинамики сопровождается острой нагрузкой организма натрием и хлором. Это требует мониторинга суточного диуреза и коррекции при недостаточном его увеличении. Возможными вариантами такой коррекции являются инфузия нормофундина и введение фуросемида.
 Заречнова Н. В. , Вельский В А. , Фролова ГА, Горохов ГД Загайнов ВЕ. ГИДРОБАЛАНС И БЕЛКОВЫЙ СТАТУС У БОЛЬНЫХ ПОСЛЕ ОБШИРНЫХ РЕЗЕКЦИЙ ПЕЧЕНИ ПРИ РАЗЛИЧНОЙ ТАКТИКЕ ПЕРИОПЕРАЦИОННОЙ ИНФУЗИОННОЙ ТЕРАПИИ ФГУ «Приволжский окружной медицинский центр ФМБА России» , Нижний Новгород, России Современные технологии в медицине 2010, 1(2), С. 114 -117
Заречнова Н. В. , Вельский В А. , Фролова ГА, Горохов ГД Загайнов ВЕ. ГИДРОБАЛАНС И БЕЛКОВЫЙ СТАТУС У БОЛЬНЫХ ПОСЛЕ ОБШИРНЫХ РЕЗЕКЦИЙ ПЕЧЕНИ ПРИ РАЗЛИЧНОЙ ТАКТИКЕ ПЕРИОПЕРАЦИОННОЙ ИНФУЗИОННОЙ ТЕРАПИИ ФГУ «Приволжский окружной медицинский центр ФМБА России» , Нижний Новгород, России Современные технологии в медицине 2010, 1(2), С. 114 -117
 ЖУРАВЕЛЬ СБ. , ДОРОФЕЕВА ЕЛ. , ЧЖАО АВ. ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ ПОСЛЕ ТРАНСПЛАНТАЦИИ ПЕЧЕНИ НИИ СП им. И. В. Склифосовского Кафедра трансплантологии МГСМУ Современные технологии в медицине 2010, 1(2), С. 109 -110
ЖУРАВЕЛЬ СБ. , ДОРОФЕЕВА ЕЛ. , ЧЖАО АВ. ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ ПОСЛЕ ТРАНСПЛАНТАЦИИ ПЕЧЕНИ НИИ СП им. И. В. Склифосовского Кафедра трансплантологии МГСМУ Современные технологии в медицине 2010, 1(2), С. 109 -110
 Основным показанием к началу заместительной почечной терапии была гипергидратация (у 83, 3% пациентов). Гиперазотемия была вторым по частоте показателем к проведению активных методов, чаще она сочеталась с гипергидратацией. Изолированная гиперазотемия была показанием к диализу в 14. 8% случаев. Нарушения кислотно основного состояния и электролитные расстройства служили показанием к проведению ЗПТ в 11, 1% случаев. Из 54 пациентов с развившейся ОПН выжило 39 (72, 2 %). Среднее количество проведенных процедур необходимых для восстановления функции почек составило 6 (от 2 до 50).
Основным показанием к началу заместительной почечной терапии была гипергидратация (у 83, 3% пациентов). Гиперазотемия была вторым по частоте показателем к проведению активных методов, чаще она сочеталась с гипергидратацией. Изолированная гиперазотемия была показанием к диализу в 14. 8% случаев. Нарушения кислотно основного состояния и электролитные расстройства служили показанием к проведению ЗПТ в 11, 1% случаев. Из 54 пациентов с развившейся ОПН выжило 39 (72, 2 %). Среднее количество проведенных процедур необходимых для восстановления функции почек составило 6 (от 2 до 50).
 ГРС, сахарный диабет и цирроз С этиологии до операции являются факторами риска развития ОПН в послеоперационном периоде ОПН имеет благоприятный прогноз при условии хорошо функционирующего трансплантата и своевременном начале заместительной почечной терапии.
ГРС, сахарный диабет и цирроз С этиологии до операции являются факторами риска развития ОПН в послеоперационном периоде ОПН имеет благоприятный прогноз при условии хорошо функционирующего трансплантата и своевременном начале заместительной почечной терапии.
 У больных, которым выполнена операция реваскуляризации миокарда в крови определяли уровень тропонина Т (Tp. T, мкг/л), тропонина I (Tp. I, мкг/л), МВ фракции креатинфосфокиназы (МВ КФК, мкг/л) и миоглобина (Mr, мкг/л). Почечной дисфункцией (ПД) считали снижение СКФ на первые сутки после операции на 33% и более от исходных значений. Наличие почечной дисфункции значительно увеличивает период полувыведения МВ КФК и миоглобина, а также нарушает кинетику тропонина I, но не тропонина Т. Функция почек и кинетика сердечных биомаркеров Дементьева И. И. , Морозов Ю. А. , Чарная М. А. , Гладышева Е. Г. Российский научный центр хирургии им. акад. Б. В. Петровского РАМН, Москва XII съезд Федерации анестезиологов и реаниматологов 2010, Москва, стр. 132 133
У больных, которым выполнена операция реваскуляризации миокарда в крови определяли уровень тропонина Т (Tp. T, мкг/л), тропонина I (Tp. I, мкг/л), МВ фракции креатинфосфокиназы (МВ КФК, мкг/л) и миоглобина (Mr, мкг/л). Почечной дисфункцией (ПД) считали снижение СКФ на первые сутки после операции на 33% и более от исходных значений. Наличие почечной дисфункции значительно увеличивает период полувыведения МВ КФК и миоглобина, а также нарушает кинетику тропонина I, но не тропонина Т. Функция почек и кинетика сердечных биомаркеров Дементьева И. И. , Морозов Ю. А. , Чарная М. А. , Гладышева Е. Г. Российский научный центр хирургии им. акад. Б. В. Петровского РАМН, Москва XII съезд Федерации анестезиологов и реаниматологов 2010, Москва, стр. 132 133
 В настоящее время хорошо известны повреждения скелетных мышц, связанные с механической травмой, такие как краш синдром, синдром позиционной ишемии и синдром фасциальных пространств. Возникающая при этом эндотоксинемия продуктами миолиза может привести к развитию острой почечной недостаточности (ОПН)). У 18 больных сформировалась ОПН и была рассмотрена нами как вторичное органное повреждение, возникшее вследствие нетравматического миолиза. Применение гемодиализа как патогенетического метода лечения в комплексе с другой терапией не привело к достоверному снижению МГ и КФК в сыворотке крови. Нетравматический рабдомиолиз у больных хирургического профиля Заугольников В. С. , Теплова Н. Н. , Теплова Т. А. XII съезд Федерации анестезиологов и реаниматологов 2010, Москва, стр. 172 173
В настоящее время хорошо известны повреждения скелетных мышц, связанные с механической травмой, такие как краш синдром, синдром позиционной ишемии и синдром фасциальных пространств. Возникающая при этом эндотоксинемия продуктами миолиза может привести к развитию острой почечной недостаточности (ОПН)). У 18 больных сформировалась ОПН и была рассмотрена нами как вторичное органное повреждение, возникшее вследствие нетравматического миолиза. Применение гемодиализа как патогенетического метода лечения в комплексе с другой терапией не привело к достоверному снижению МГ и КФК в сыворотке крови. Нетравматический рабдомиолиз у больных хирургического профиля Заугольников В. С. , Теплова Н. Н. , Теплова Т. А. XII съезд Федерации анестезиологов и реаниматологов 2010, Москва, стр. 172 173
 Однако, азотовыделительная функция почек оставалась не скорригированной и у 8 больных с обтурационной кишечной непроходимостью прогрессировала, т. е. почасовой диурез оставался менее 25 мл/час, креатинин и мочевина выросли на 15 30%. Это вынудило нас на вторые или третьи сутки после операции провести сеанс заместительной почечной терапии пролонгированной венозной гемодиафильтрации. Длительность сеанса колебалась от 12 до 24 часов, что позволило существенно стабилизировать состояние всех больных, диурез вырос до 40 50 мл/час, снизился и креатин и мочевина на 30 35% от исходного состояния. Острая почечная недостаточность у больных пожилого и старческого возраста с острой кишечной непроходимостью Киреев С. С. , Гургенидзе В. Н. , Серова Н. Т. Мед. ин т, Тул. ГУ, г. Тула • XII съезд Федерации анестезиологов и реаниматологов 2010, Москва, стр. 196 197
Однако, азотовыделительная функция почек оставалась не скорригированной и у 8 больных с обтурационной кишечной непроходимостью прогрессировала, т. е. почасовой диурез оставался менее 25 мл/час, креатинин и мочевина выросли на 15 30%. Это вынудило нас на вторые или третьи сутки после операции провести сеанс заместительной почечной терапии пролонгированной венозной гемодиафильтрации. Длительность сеанса колебалась от 12 до 24 часов, что позволило существенно стабилизировать состояние всех больных, диурез вырос до 40 50 мл/час, снизился и креатин и мочевина на 30 35% от исходного состояния. Острая почечная недостаточность у больных пожилого и старческого возраста с острой кишечной непроходимостью Киреев С. С. , Гургенидзе В. Н. , Серова Н. Т. Мед. ин т, Тул. ГУ, г. Тула • XII съезд Федерации анестезиологов и реаниматологов 2010, Москва, стр. 196 197
 В исследование включено 11 пациентов (7 мужчин, 4 женщины: возраст 51± 15 лет) с ПОН после обширных кардиохирургических вмешательств с искусственным кровообращением или на фоне тяжелого сепсиса. Показанием к проведению высокообъемной гемофильтрации (ВОГФ) служили признаки острого повреждения почек (ОПП), диагностированные в соответствии с международными критериями (RIFLE) Все пациенты находились на ИВЛ, при этом скорость ультрафильтрации подбиралась на основании нормализации индекса внесосудистой воды легких (ИВСВЛ), с учетом темпа диуреза и значения сердечного индекса (СИ). Волюметрический мониторинг при целенаправленной высокообъемной гемофильтрации у пациентов на ИВЛ Кузьков В. В. , Низовцев Н. В. , Лëнькин А. И. , Зеленин К. Н. , Киров М. В. Северный гос. мед. унив т, г. Архангельск; МУЗ «Первая гор. клин. б ца скорой мед. помощи им. Е. Е. Волосевич» г, Архангельск • XII съезд Федерации анестезиологов и реаниматологов 2010, Москва, стр. 227 228
В исследование включено 11 пациентов (7 мужчин, 4 женщины: возраст 51± 15 лет) с ПОН после обширных кардиохирургических вмешательств с искусственным кровообращением или на фоне тяжелого сепсиса. Показанием к проведению высокообъемной гемофильтрации (ВОГФ) служили признаки острого повреждения почек (ОПП), диагностированные в соответствии с международными критериями (RIFLE) Все пациенты находились на ИВЛ, при этом скорость ультрафильтрации подбиралась на основании нормализации индекса внесосудистой воды легких (ИВСВЛ), с учетом темпа диуреза и значения сердечного индекса (СИ). Волюметрический мониторинг при целенаправленной высокообъемной гемофильтрации у пациентов на ИВЛ Кузьков В. В. , Низовцев Н. В. , Лëнькин А. И. , Зеленин К. Н. , Киров М. В. Северный гос. мед. унив т, г. Архангельск; МУЗ «Первая гор. клин. б ца скорой мед. помощи им. Е. Е. Волосевич» г, Архангельск • XII съезд Федерации анестезиологов и реаниматологов 2010, Москва, стр. 227 228
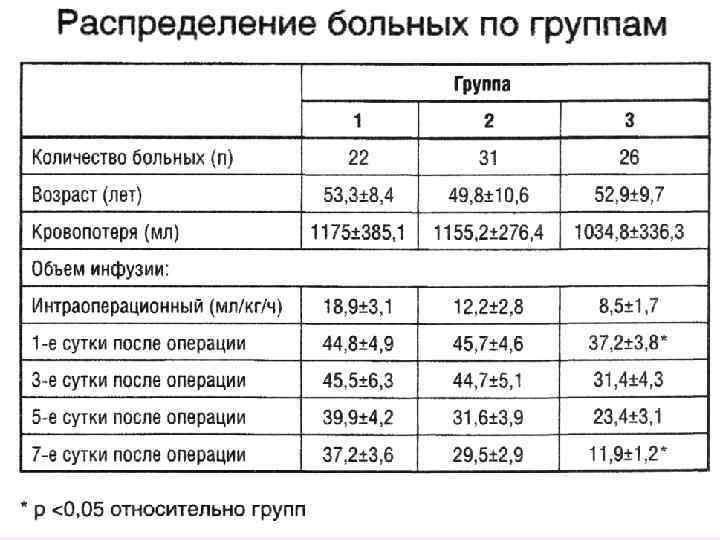
 Объем хирургических вмешательств: резекция желудка, экстирпация пищевода, резекция кишечника, панкреатодуоденальная резекция, резекция печени, реконструктивные операции в гепатобиллиарной зоне. Продолжительность оперативного вмешательства составила 3, 84± 0, 94 ч. В контрольной группе и 4, 06 ± 1, 15 ч в основной. Состав и объем инфузионной терапии представлен растворами: интраоперационно – раствор натрия хлорида 0, 9% 2834, 28 ± 853, 60 мл; 6% ГЭК 130/0, 42 (Венофундин, Bbraun) – 842, 85 ± 416, 06 мл. В послеоперационном периоде – изотонический раствор натрия хлорида – 1720, 0 ± 497, 51 мл; 6% ГЭК 130/0, 42 – 482, 85± 175, 70 мл. По показаниям использовалась свежезамороженная плазма и эритроцитарная масса. Общий объем инфузии составил – 6300. 12± 994, 50 мл или 90 мл/кг/сутки при диурезе – 2063, 32± 838, 65 мл или 85 мл/час. Суммарная кровопотеря составила 581, 40± 403, 5 мл.
Объем хирургических вмешательств: резекция желудка, экстирпация пищевода, резекция кишечника, панкреатодуоденальная резекция, резекция печени, реконструктивные операции в гепатобиллиарной зоне. Продолжительность оперативного вмешательства составила 3, 84± 0, 94 ч. В контрольной группе и 4, 06 ± 1, 15 ч в основной. Состав и объем инфузионной терапии представлен растворами: интраоперационно – раствор натрия хлорида 0, 9% 2834, 28 ± 853, 60 мл; 6% ГЭК 130/0, 42 (Венофундин, Bbraun) – 842, 85 ± 416, 06 мл. В послеоперационном периоде – изотонический раствор натрия хлорида – 1720, 0 ± 497, 51 мл; 6% ГЭК 130/0, 42 – 482, 85± 175, 70 мл. По показаниям использовалась свежезамороженная плазма и эритроцитарная масса. Общий объем инфузии составил – 6300. 12± 994, 50 мл или 90 мл/кг/сутки при диурезе – 2063, 32± 838, 65 мл или 85 мл/час. Суммарная кровопотеря составила 581, 40± 403, 5 мл.
 Интраоперационная инфузия : сбалансированный электролитный раствор (Стерофундин изотонический , Bbraun) – 2971, 42 мл, 6% ГЭК 130/0, 42 (Венофундин, Bbraun) – 750 мл± 560 мл. В послеоперационном периоде сбалансированный электролитный раствор 1700 мл 6% ГЭК 130/0, 42 – 500 мл. По показаниям использовалась свежезамороженная плазма и эритроцитарная масса. Общий объем инфузии составил – 6292± 1050 мл или 89, 8 мл/кг/сутки при диурезе – 2589± 940 мл или 107, 9 мл/час. Суммарная кровопотеря составила 705, 7± 850 мл. Iгр. р. Н IIгр. p. H 7, 36 7, 43 ВЕ « » 4, 6 ВЕ + 1, 5 Cl 113, 7 ммоль/л Cl 106 ммоль/л р<0, 05 Сбалансированная инфузионная терапия периоперационного периода в абдоминальной хирургии С. Г. Решетников, Бабаянц А. В. , Проценко Д. Н. , Гельфанд Б. Р. Каф. анестезиологии и реаниматологии ФУВ, гор. клинич. Б ца № 7, Москва XII съезд Федерации анестезиологов и реаниматологов 2010, Москва, стр. 363 364
Интраоперационная инфузия : сбалансированный электролитный раствор (Стерофундин изотонический , Bbraun) – 2971, 42 мл, 6% ГЭК 130/0, 42 (Венофундин, Bbraun) – 750 мл± 560 мл. В послеоперационном периоде сбалансированный электролитный раствор 1700 мл 6% ГЭК 130/0, 42 – 500 мл. По показаниям использовалась свежезамороженная плазма и эритроцитарная масса. Общий объем инфузии составил – 6292± 1050 мл или 89, 8 мл/кг/сутки при диурезе – 2589± 940 мл или 107, 9 мл/час. Суммарная кровопотеря составила 705, 7± 850 мл. Iгр. р. Н IIгр. p. H 7, 36 7, 43 ВЕ « » 4, 6 ВЕ + 1, 5 Cl 113, 7 ммоль/л Cl 106 ммоль/л р<0, 05 Сбалансированная инфузионная терапия периоперационного периода в абдоминальной хирургии С. Г. Решетников, Бабаянц А. В. , Проценко Д. Н. , Гельфанд Б. Р. Каф. анестезиологии и реаниматологии ФУВ, гор. клинич. Б ца № 7, Москва XII съезд Федерации анестезиологов и реаниматологов 2010, Москва, стр. 363 364
 При рабдомиолизе из внутриклеточного пространства миоцитов во внеклеточное попадают миоглобин, калий, фосфор, продукты клеточного метаболизма, а во внутриклеточное пространство натрий хлорид, кальций и вода. Происходит избыточная активация кальцийзависимой протеазы и фосфолипаз, ведущая к деструкции миофибрилл и мембран, в конечном итоге приводящая к лизису клеток. Развивается массивный отек тканей, сопровождающийся гиповолемией. Имеют место канальцевая обструкция миоглобиновыми цилиндрами и прямое цитотоксическое действие миоглобина, фосфатов и пуринов. Все эти факторы приводят к развитию ОПН в 15 33% случаев.
При рабдомиолизе из внутриклеточного пространства миоцитов во внеклеточное попадают миоглобин, калий, фосфор, продукты клеточного метаболизма, а во внутриклеточное пространство натрий хлорид, кальций и вода. Происходит избыточная активация кальцийзависимой протеазы и фосфолипаз, ведущая к деструкции миофибрилл и мембран, в конечном итоге приводящая к лизису клеток. Развивается массивный отек тканей, сопровождающийся гиповолемией. Имеют место канальцевая обструкция миоглобиновыми цилиндрами и прямое цитотоксическое действие миоглобина, фосфатов и пуринов. Все эти факторы приводят к развитию ОПН в 15 33% случаев.
 К третьей группе факторов относится применение нефротоксичных препаратов, таких как рентгеноконтрастные вещества, антибиотики, противовирусные и химиотерапевтические препараты, анестезиологические средства. Патологические механизмы, связанные с последствиями острого уремического состояния: уремическая интоксикация метаболические нарушения (углеводного, жирового, белкового обмена), эндокринные нарушения, проявляющиеся развитием инсулинорезистентности и гиперпаратиреоза, метаболический ацидоз.
К третьей группе факторов относится применение нефротоксичных препаратов, таких как рентгеноконтрастные вещества, антибиотики, противовирусные и химиотерапевтические препараты, анестезиологические средства. Патологические механизмы, связанные с последствиями острого уремического состояния: уремическая интоксикация метаболические нарушения (углеводного, жирового, белкового обмена), эндокринные нарушения, проявляющиеся развитием инсулинорезистентности и гиперпаратиреоза, метаболический ацидоз.
 Повреждения почек, приводят к активации провоспалителышх факторов: увеличивается высвобождение и снижается катаболизм цитокинов, происходит активация иммунокомпетентных клеток, высвобождаются гуморальные факторы, запускающие органные нарушения.
Повреждения почек, приводят к активации провоспалителышх факторов: увеличивается высвобождение и снижается катаболизм цитокинов, происходит активация иммунокомпетентных клеток, высвобождаются гуморальные факторы, запускающие органные нарушения.

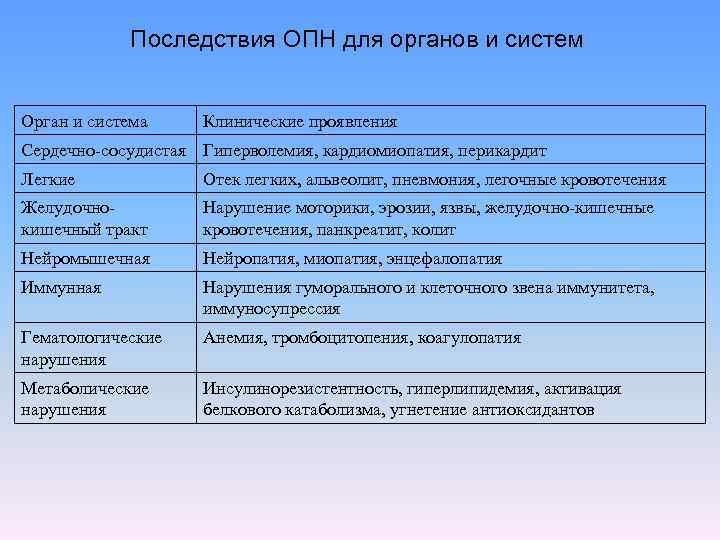 Последствия ОПН для органов и систем Орган и система Клинические проявления Сердечно сосудистая Гиперволемия, кардиомиопатия, перикардит Легкие Отек легких, альвеолит, пневмония, легочные кровотечения Желудочно кишечный тракт Нарушение моторики, эрозии, язвы, желудочно кишечные кровотечения, панкреатит, колит Нейромышечная Нейропатия, миопатия, энцефалопатия Иммунная Нарушения гуморального и клеточного звена иммунитета, иммуносупрессия Гематологические нарушения Анемия, тромбоцитопения, коагулопатия Метаболические нарушения Инсулинорезистентность, гиперлипидемия, активация белкового катаболизма, угнетение антиоксидантов
Последствия ОПН для органов и систем Орган и система Клинические проявления Сердечно сосудистая Гиперволемия, кардиомиопатия, перикардит Легкие Отек легких, альвеолит, пневмония, легочные кровотечения Желудочно кишечный тракт Нарушение моторики, эрозии, язвы, желудочно кишечные кровотечения, панкреатит, колит Нейромышечная Нейропатия, миопатия, энцефалопатия Иммунная Нарушения гуморального и клеточного звена иммунитета, иммуносупрессия Гематологические нарушения Анемия, тромбоцитопения, коагулопатия Метаболические нарушения Инсулинорезистентность, гиперлипидемия, активация белкового катаболизма, угнетение антиоксидантов
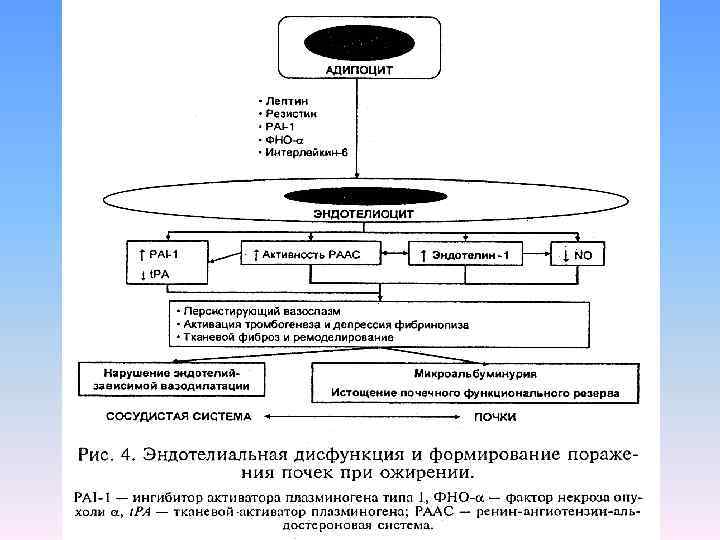
 Ожирение – один из наиболее важных популяционных факторов риска микроальбуминурии и стойкого ухудшения функции почек; эта связь доказана и для лиц, не страдающих диабетической уратной нефропатией, а также гипертоническим нефроангеосклерозом [A. D. Liese at al. , 2001]. Микроальбуминурия – маркер генерализованной эндотелиальной дисфункции.
Ожирение – один из наиболее важных популяционных факторов риска микроальбуминурии и стойкого ухудшения функции почек; эта связь доказана и для лиц, не страдающих диабетической уратной нефропатией, а также гипертоническим нефроангеосклерозом [A. D. Liese at al. , 2001]. Микроальбуминурия – маркер генерализованной эндотелиальной дисфункции.
 Данные обследования молодых мужчин (21 50 лет) с висцеральным ожирением (окруж. талии > 102 см): по мере роста концентрации лептина в сыворотке крови, существенно возрастала частота микоальбуминурии, отражающая формирующиеся поражения почек [Н. А. Мухин с соавт. , 2006]. При ожирении происходит локальная активация АПФ в почках, не отмеченная в других органах (легкие, печень) и частично устранявшаяся при введении антагониста эндотелина 1.
Данные обследования молодых мужчин (21 50 лет) с висцеральным ожирением (окруж. талии > 102 см): по мере роста концентрации лептина в сыворотке крови, существенно возрастала частота микоальбуминурии, отражающая формирующиеся поражения почек [Н. А. Мухин с соавт. , 2006]. При ожирении происходит локальная активация АПФ в почках, не отмеченная в других органах (легкие, печень) и частично устранявшаяся при введении антагониста эндотелина 1.
 Последнее обстоятельство может рассматриваться как аргумент в пользу участия эндотелина 1 в регуляции активности РААС в почечной ткани у больных ожирением. По видимому, повышение экспрессии компонентов РААС и эндотелина 1 в почечной ткани приводит к значительному усилению повреждения ее структур [M. Barton at al. , 2003]. Поэтому ингибиторы АПФ и блокаторы рецепторов ангеотензина II считают предпочтительными для лечения АГ, ассоциированной с ожирением. [A. M. Sharma, 2004].
Последнее обстоятельство может рассматриваться как аргумент в пользу участия эндотелина 1 в регуляции активности РААС в почечной ткани у больных ожирением. По видимому, повышение экспрессии компонентов РААС и эндотелина 1 в почечной ткани приводит к значительному усилению повреждения ее структур [M. Barton at al. , 2003]. Поэтому ингибиторы АПФ и блокаторы рецепторов ангеотензина II считают предпочтительными для лечения АГ, ассоциированной с ожирением. [A. M. Sharma, 2004].

 Ю. А. Васюк, И. А. Садулаева, Е. N. Ющук, О. С. Трофименко, М. В. Чирков, В. С. Федосеева, К. Г. Куликов ИНГИБИТОРЫ РЕНИНА НОВОЕ НАПРАВЛЕНИЕ В ЛЕЧЕНИИ АРТЕРИАЛЬНОЙ ГИПЕРТОНИИ Кафедра клинической функциональной диагностики ФПДО МГМСУ, 103477, Москва, Делегатская ул. , д. 20/1; Москва, Стромынка, д. 7, ГКБ № 33 им. проф. А. А. Остроумова Терапевтический архив, 2010, № 9, С. 53— 59
Ю. А. Васюк, И. А. Садулаева, Е. N. Ющук, О. С. Трофименко, М. В. Чирков, В. С. Федосеева, К. Г. Куликов ИНГИБИТОРЫ РЕНИНА НОВОЕ НАПРАВЛЕНИЕ В ЛЕЧЕНИИ АРТЕРИАЛЬНОЙ ГИПЕРТОНИИ Кафедра клинической функциональной диагностики ФПДО МГМСУ, 103477, Москва, Делегатская ул. , д. 20/1; Москва, Стромынка, д. 7, ГКБ № 33 им. проф. А. А. Остроумова Терапевтический архив, 2010, № 9, С. 53— 59
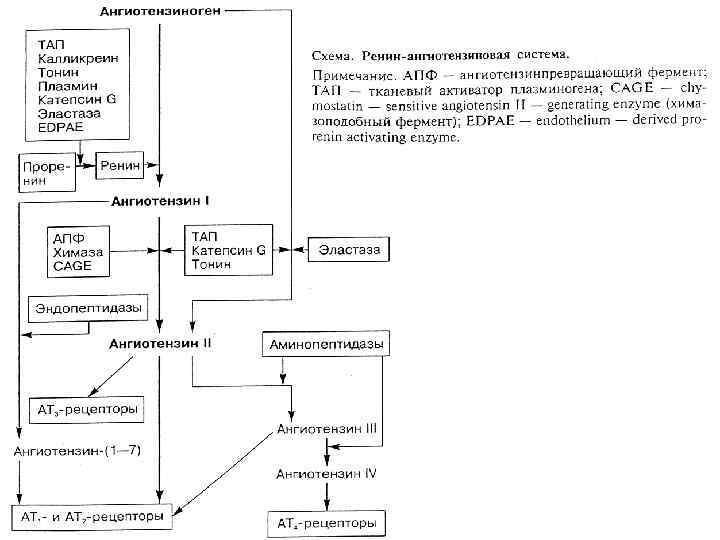
 Многолетние поиски ингибиторов ренина увенчались успехом — были синтезированы несколько молекул, одна из которых — алискирен в 2007 г. уже появилась в арсенале американских врачей. Препарат – Расилез.
Многолетние поиски ингибиторов ренина увенчались успехом — были синтезированы несколько молекул, одна из которых — алискирен в 2007 г. уже появилась в арсенале американских врачей. Препарат – Расилез.
 У алискирена длительный период полувыведения (около 40 ч при однократном приеме), что позволяет поддерживать его стабильную концентрацию в крови и продолжительный клинический эффект. Препарат не оказывает негативного влияния на функцию почек и печени, поэтому коррекция дозы при почечной или печеночной недостаточности не требуется.
У алискирена длительный период полувыведения (около 40 ч при однократном приеме), что позволяет поддерживать его стабильную концентрацию в крови и продолжительный клинический эффект. Препарат не оказывает негативного влияния на функцию почек и печени, поэтому коррекция дозы при почечной или печеночной недостаточности не требуется.
 Тигацил – оптимальный выбор для отягощенных пациентов • Для пациентов с аллергией на пенициллины • Низкий потенциал лекарственных взаимодействий • Не требуется коррекции дозы у больных с почечной недостаточностью XII съезд Федерации анестезиологов и реаниматологов 2010, Москва, стр. 168 а
Тигацил – оптимальный выбор для отягощенных пациентов • Для пациентов с аллергией на пенициллины • Низкий потенциал лекарственных взаимодействий • Не требуется коррекции дозы у больных с почечной недостаточностью XII съезд Федерации анестезиологов и реаниматологов 2010, Москва, стр. 168 а
 Фармакокинетическое исследование показало, что при внутривенном введении аноцептин быстро покидает системный кровоток. Распределение препарата характеризуется 2 х или 3 х экспоненциальной зависимостью. Среднее время присутствия препарата в организме лежит в диапазоне от 0, 5 до 1, 0 час, клиренс – около 1000 мл/кг/ч. Основная часть препарата, не выводится, а метаболизируется и утилизируется в самом организме, поэтому он может быть рекомендован пациентам с почечной и печеночной недостаточностью. Новый отечественный синтетический ненаркотический аналгетик «Аноцептин» Лопатина Е. В. , Поляков Ю. И. , Крылов Б. В. , Корячкин В. А. , Трофимов А. И. ФГУ «Федеральный центр сердца, крови и эндокринологии им. В. А. Алмазова» ; Ин т мозга человека РАН, Ин т физиологии им. И. П. Павлова РАН; СПб. ГМУ им. акад. И. П. Павлова, Санкт Петербург, Россия XII съезд Федерации анестезиологов и реаниматологов 2010, Москва, стр. 264
Фармакокинетическое исследование показало, что при внутривенном введении аноцептин быстро покидает системный кровоток. Распределение препарата характеризуется 2 х или 3 х экспоненциальной зависимостью. Среднее время присутствия препарата в организме лежит в диапазоне от 0, 5 до 1, 0 час, клиренс – около 1000 мл/кг/ч. Основная часть препарата, не выводится, а метаболизируется и утилизируется в самом организме, поэтому он может быть рекомендован пациентам с почечной и печеночной недостаточностью. Новый отечественный синтетический ненаркотический аналгетик «Аноцептин» Лопатина Е. В. , Поляков Ю. И. , Крылов Б. В. , Корячкин В. А. , Трофимов А. И. ФГУ «Федеральный центр сердца, крови и эндокринологии им. В. А. Алмазова» ; Ин т мозга человека РАН, Ин т физиологии им. И. П. Павлова РАН; СПб. ГМУ им. акад. И. П. Павлова, Санкт Петербург, Россия XII съезд Федерации анестезиологов и реаниматологов 2010, Москва, стр. 264
 В назначении антибиотиков следует придерживаться следующих принципов: в/в введения, максимальные дозы, учет кратности назначения и особенности препарата проникать в очаг инфекции. У больных с компрометированной функцией почек необходимо учитывать клиренс креатинина (с коррекцией дозы по клиренсу: более 50 мл/мин, от 10 до 50 мл/мин и менее 10 мл/мин), а также возможную гепато и нефротоксичность каждого из антибактериальных препаратов. ВИТ, 2008, № 2, С. 28 32. РОНЦ РАМН им. Н. Н. Блохина
В назначении антибиотиков следует придерживаться следующих принципов: в/в введения, максимальные дозы, учет кратности назначения и особенности препарата проникать в очаг инфекции. У больных с компрометированной функцией почек необходимо учитывать клиренс креатинина (с коррекцией дозы по клиренсу: более 50 мл/мин, от 10 до 50 мл/мин и менее 10 мл/мин), а также возможную гепато и нефротоксичность каждого из антибактериальных препаратов. ВИТ, 2008, № 2, С. 28 32. РОНЦ РАМН им. Н. Н. Блохина
 Торасемид –петлевой диуретик, был синтезирован (середина 80 х) с целью получения превосходящий фуросемид препарата при трудных вариантах отеков сочетающихся с гипоальбуминемией и снижением СКФ. Транспорт фуросемида к клеткам восходящего (толстого) сегмента петли Генле осуществляется в ассоциации с альбумином, сродство которому у данного препарата очень велико. При снижении концентрации альбумина эффективность фуросемида уменьшается и его назначают в очень высоких дозах. При «большой» протеинурии значительная часть фуросемида экскретируется с мочой без взаимодействия с апикальным полюсом эпителиоцитов толстого восходящего сегмента петли Генле.
Торасемид –петлевой диуретик, был синтезирован (середина 80 х) с целью получения превосходящий фуросемид препарата при трудных вариантах отеков сочетающихся с гипоальбуминемией и снижением СКФ. Транспорт фуросемида к клеткам восходящего (толстого) сегмента петли Генле осуществляется в ассоциации с альбумином, сродство которому у данного препарата очень велико. При снижении концентрации альбумина эффективность фуросемида уменьшается и его назначают в очень высоких дозах. При «большой» протеинурии значительная часть фуросемида экскретируется с мочой без взаимодействия с апикальным полюсом эпителиоцитов толстого восходящего сегмента петли Генле.
 Стабильная биодоступность торасемида, меньшая вероятность провокации нарушений обмена электролитов при его применении предопределяют реальные преимущества этого препарата заметные в клинической практике при сравнении с другими диуретиками, в том числе с фуросемидом В. В. Фомин, С. В. Моисеев, А. В. Русских Петлевые диуретики в лечении отечного синдрома: возможности торасемида Кафедра нефрологии им. Е. М. Тареева, ММА им. И. М. Сеченова Терапевтич. Архив 2008, № 6, С. 77 80
Стабильная биодоступность торасемида, меньшая вероятность провокации нарушений обмена электролитов при его применении предопределяют реальные преимущества этого препарата заметные в клинической практике при сравнении с другими диуретиками, в том числе с фуросемидом В. В. Фомин, С. В. Моисеев, А. В. Русских Петлевые диуретики в лечении отечного синдрома: возможности торасемида Кафедра нефрологии им. Е. М. Тареева, ММА им. И. М. Сеченова Терапевтич. Архив 2008, № 6, С. 77 80
 С. В. Кольцова, М. Б. Баскаков, С. Н. Орлов Миогенный тонус сосудов в норме и патологии: роль пуринергической сигнальной системы и Nа+, K+, 2 Сl котранспорта УРАМН НИИ общей патологии и патофизиологии РАМН, 125430, Москва, ул. Балтийская д. 8 ГОУ ВПО Сибирский государственный медицинский университет, 634050, Томск, Московский тракт д. 1 Научно исследовательский центр госпиталя университета г. Монреаль, Канада Биологический факультет МГУ им. М. В. Ломоносова, 119991, Москва, Воробьевы горы, к. 8 ПАТОЛОГИЧЕСКАЯ ФИЗИОЛОГИЯ И ЭКСПЕРИМЕНТАЛЬНАЯ ТЕРАПИЯ. — 2010. — № 4. C. 3 10
С. В. Кольцова, М. Б. Баскаков, С. Н. Орлов Миогенный тонус сосудов в норме и патологии: роль пуринергической сигнальной системы и Nа+, K+, 2 Сl котранспорта УРАМН НИИ общей патологии и патофизиологии РАМН, 125430, Москва, ул. Балтийская д. 8 ГОУ ВПО Сибирский государственный медицинский университет, 634050, Томск, Московский тракт д. 1 Научно исследовательский центр госпиталя университета г. Монреаль, Канада Биологический факультет МГУ им. М. В. Ломоносова, 119991, Москва, Воробьевы горы, к. 8 ПАТОЛОГИЧЕСКАЯ ФИЗИОЛОГИЯ И ЭКСПЕРИМЕНТАЛЬНАЯ ТЕРАПИЯ. — 2010. — № 4. C. 3 10
 Сужение и расширение сосудов с диаметром <200 мкм в ответ на увеличение и уменьшение внутрисосудистого давления, получившее название миогенного ответа (МО) — уникальное свойство гладкомышечных клеток (ГМК), которое не опосредовано каким либо нейрогуморальными или эндотелиальными факторами.
Сужение и расширение сосудов с диаметром <200 мкм в ответ на увеличение и уменьшение внутрисосудистого давления, получившее название миогенного ответа (МО) — уникальное свойство гладкомышечных клеток (ГМК), которое не опосредовано каким либо нейрогуморальными или эндотелиальными факторами.
 Петлевые диуретики подавляют сокращение ГМК, действуя на мишени, отличные от NК 2 Сl. В самом деле, в сравнимом концентрационном диапазоне фуросемид частично инактивирует анионный обменник, Сl каналы и Nа+ независимый К+, Сl котранспорт. В ГМК фуросемид также блокирует тромбоксановые А 2 рецепторы и активирует фосфодиэстеразу циклических нуклеотидов
Петлевые диуретики подавляют сокращение ГМК, действуя на мишени, отличные от NК 2 Сl. В самом деле, в сравнимом концентрационном диапазоне фуросемид частично инактивирует анионный обменник, Сl каналы и Nа+ независимый К+, Сl котранспорт. В ГМК фуросемид также блокирует тромбоксановые А 2 рецепторы и активирует фосфодиэстеразу циклических нуклеотидов
 Твердо установлено, что МО выполняет ключевую роль в развитии внутреннего эутрофическрго ремоделирования, т. е. такого изменения геометрии сосудов, когда наружный диаметр и просвет уменьшены, а толщина медиального слоя не изменена. Этот вариант ре моделирования характеризуется увеличением отношения толщины медиального слоя к просвету сосуда без повышения жесткости сосудистой стенки и описан в резистивных артериях при мягком течении гипертонической болезни
Твердо установлено, что МО выполняет ключевую роль в развитии внутреннего эутрофическрго ремоделирования, т. е. такого изменения геометрии сосудов, когда наружный диаметр и просвет уменьшены, а толщина медиального слоя не изменена. Этот вариант ре моделирования характеризуется увеличением отношения толщины медиального слоя к просвету сосуда без повышения жесткости сосудистой стенки и описан в резистивных артериях при мягком течении гипертонической болезни
 У животных эутрофическое ремоделирование устранялось при действии верапамила и других лекарств, подавляющих МО, что косвенно свидетельствует о том, что эутрофическое ремоделирование является физиологическим ответом сосудов с сохраненным МО на долгосрочное повышение системного АД.
У животных эутрофическое ремоделирование устранялось при действии верапамила и других лекарств, подавляющих МО, что косвенно свидетельствует о том, что эутрофическое ремоделирование является физиологическим ответом сосудов с сохраненным МО на долгосрочное повышение системного АД.
 Если же МО по той или иной причине нарушен, то эутрофическое ремоделирование сосудов сопровождается гипертрофией сосудистой стенки. Гипертрофированные сосуды не способны отвечать на повышение системного АД полномасштабным МО, в результате чего повышенное давление передается в микроциркуляцию
Если же МО по той или иной причине нарушен, то эутрофическое ремоделирование сосудов сопровождается гипертрофией сосудистой стенки. Гипертрофированные сосуды не способны отвечать на повышение системного АД полномасштабным МО, в результате чего повышенное давление передается в микроциркуляцию
 Таким образом, МО является основным механизмом защиты дистальных сосудов от резкого колебания системного АД, что особенно важно в инкапсулированных органах, таких, как мозг, сетчатка, сердце и почки, где быстрое изменение объема и/или развитие отека могли бы иметь гибельные последствия.
Таким образом, МО является основным механизмом защиты дистальных сосудов от резкого колебания системного АД, что особенно важно в инкапсулированных органах, таких, как мозг, сетчатка, сердце и почки, где быстрое изменение объема и/или развитие отека могли бы иметь гибельные последствия.
 Кроме некоторых экспериментальных моделей хронической гипертензий человека, снижение МО и гипертрофия сосудистой стенки обнаружены у больных с диабетом 2 го типа, что, по видимому, и является непосредственной причиной повреждения органов мишеней в том числе микроальбуминурии и отслоения сетчатки
Кроме некоторых экспериментальных моделей хронической гипертензий человека, снижение МО и гипертрофия сосудистой стенки обнаружены у больных с диабетом 2 го типа, что, по видимому, и является непосредственной причиной повреждения органов мишеней в том числе микроальбуминурии и отслоения сетчатки
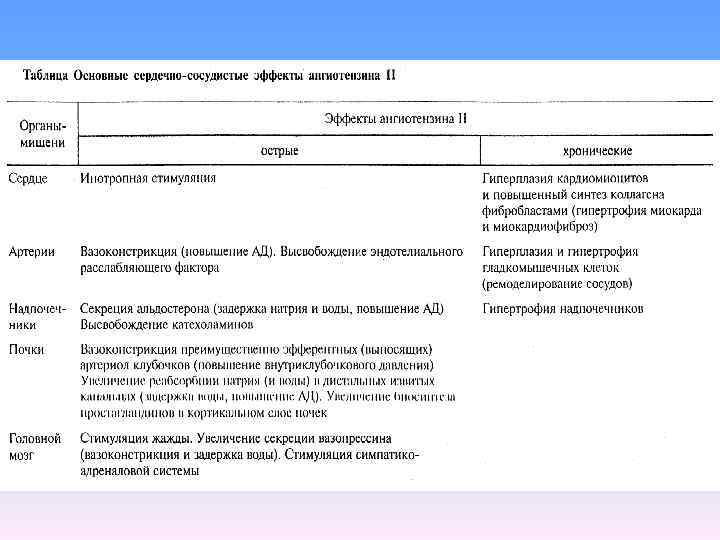
 В многочисленных исследованиях было показано, что несмотря на выраженный антигипертензивный эффект блокаторы Са 2+ каналов L типа оказывают существенно меньшее защитное действие от развития почечной недостаточности и даже ускоряют течение этой болезни по отношению к таким антигипертензивным лекарствам как ингибиторы ангиотензинпревращающего фермента и блокатрры рецепторов ангиотензина II.
В многочисленных исследованиях было показано, что несмотря на выраженный антигипертензивный эффект блокаторы Са 2+ каналов L типа оказывают существенно меньшее защитное действие от развития почечной недостаточности и даже ускоряют течение этой болезни по отношению к таким антигипертензивным лекарствам как ингибиторы ангиотензинпревращающего фермента и блокатрры рецепторов ангиотензина II.
 Было установлено, что в основе этого лежит избирательная блокада МО афферентной артериолы, при отсутствии расслабляющего действия на эфферентную артериолу, где эти каналы не обнаружены. Это и является непосредственной причиной нарушения Са 2+ блокаторами ауторегуляции почечного кровообращения и последующей деструкции почечного эпителия при систолическом АД>100 мм рт. ст.
Было установлено, что в основе этого лежит избирательная блокада МО афферентной артериолы, при отсутствии расслабляющего действия на эфферентную артериолу, где эти каналы не обнаружены. Это и является непосредственной причиной нарушения Са 2+ блокаторами ауторегуляции почечного кровообращения и последующей деструкции почечного эпителия при систолическом АД>100 мм рт. ст.
 Данный вывод согласуется с экспериментальными исследованиями, установившими, что частота склеротических нарушений в гломерулах крыс с хронической почечной недостаточностью и повышенным АД резко увеличивается при длительном использовании блокаторов Са 2+ каналов L типа по отношению к ингибиторам системы ренин ангиотензин альдостерон и плацебо.
Данный вывод согласуется с экспериментальными исследованиями, установившими, что частота склеротических нарушений в гломерулах крыс с хронической почечной недостаточностью и повышенным АД резко увеличивается при длительном использовании блокаторов Са 2+ каналов L типа по отношению к ингибиторам системы ренин ангиотензин альдостерон и плацебо.
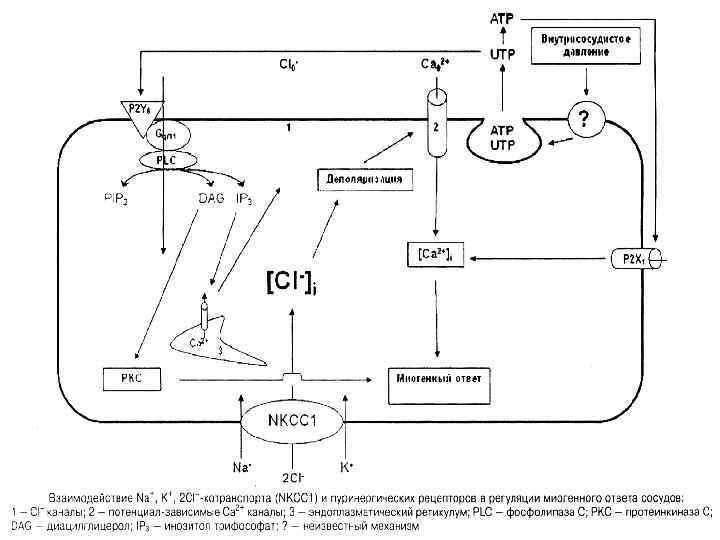
 МО почечной афферентной артериолы крысы полностью подавляется петлевыми диуретиками, что обусловлено ингибированием NКССl. При анализе этих данных мы предположили, что сниженная активность NКССl, обнаруженная в эритроцитах лиц негроидной расы [38], лежит в основе ~4 кратного увеличения частоты болезни почек, отмеченного в Северной Америке у больных гипертонией африканского происхождения по отношению к больным Кавказской расы
МО почечной афферентной артериолы крысы полностью подавляется петлевыми диуретиками, что обусловлено ингибированием NКССl. При анализе этих данных мы предположили, что сниженная активность NКССl, обнаруженная в эритроцитах лиц негроидной расы [38], лежит в основе ~4 кратного увеличения частоты болезни почек, отмеченного в Северной Америке у больных гипертонией африканского происхождения по отношению к больным Кавказской расы
 Дальнейшие исследования должны уточнить относительный вклад NКССl в формировании МО афферентной и эфферентной артериол почек человека и определить спектр побочных эффектов петлевых диуретиков при лечении отечных состояний у больных артериальной гипертензией.
Дальнейшие исследования должны уточнить относительный вклад NКССl в формировании МО афферентной и эфферентной артериол почек человека и определить спектр побочных эффектов петлевых диуретиков при лечении отечных состояний у больных артериальной гипертензией.
 Так как тонус афферентных артериол составляет от 80 до 90% сосудистого сопротивления почек, именно ГМК этих сосудов вносят основной вклад в регуляцию гломерулярного тока крови, фильтрационного давления и скорости клубочковой фильтрации, причем АТР и аденозин рассматриваются как основные медиаторы этой тубуло гломерулярной обратной связи (TGF)
Так как тонус афферентных артериол составляет от 80 до 90% сосудистого сопротивления почек, именно ГМК этих сосудов вносят основной вклад в регуляцию гломерулярного тока крови, фильтрационного давления и скорости клубочковой фильтрации, причем АТР и аденозин рассматриваются как основные медиаторы этой тубуло гломерулярной обратной связи (TGF)
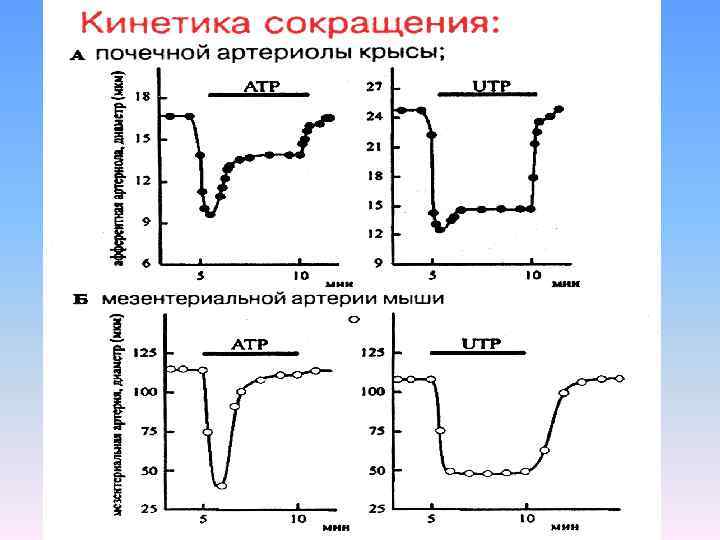
 Длительное АТР индуцированное сокращение — уникальное свойство афферентных артериол (рис. 2 А) В самом деле, транзиторное сокращение наблюдается в дугообразных, междолевых, и мезентериальных артериях (рис. 2 Б), а эфферентные артериолы вовсе не отвечают на АТР
Длительное АТР индуцированное сокращение — уникальное свойство афферентных артериол (рис. 2 А) В самом деле, транзиторное сокращение наблюдается в дугообразных, междолевых, и мезентериальных артериях (рис. 2 Б), а эфферентные артериолы вовсе не отвечают на АТР
 А. Е. Карелов, Ю. М. Боробов ПУРИНОВАЯ И ОПИОИДНАЯ АНАЛЬГЕЗИЯ: ПРЕДПОСЫЛКИ СОЧЕТАЕМОГО ПРИМЕНЕНИЯ Медицинская академия последипломного образования, Санкт Петербург Клиническая больница № 122 им. Л. Г. Соколова ФМБА России, Санкт Петербург СЪЕЗД ФЕДЕРАЦИИ АНЕСТЕЗИОЛОГОВ И РЕАНИМАТОЛОГОВ Москва 2010 С. 189 191
А. Е. Карелов, Ю. М. Боробов ПУРИНОВАЯ И ОПИОИДНАЯ АНАЛЬГЕЗИЯ: ПРЕДПОСЫЛКИ СОЧЕТАЕМОГО ПРИМЕНЕНИЯ Медицинская академия последипломного образования, Санкт Петербург Клиническая больница № 122 им. Л. Г. Соколова ФМБА России, Санкт Петербург СЪЕЗД ФЕДЕРАЦИИ АНЕСТЕЗИОЛОГОВ И РЕАНИМАТОЛОГОВ Москва 2010 С. 189 191
 Результатом действия и опиоидов, и пуринов может оказаться отрицательный хронотропный эффект посредством активации блуждающего нерва первыми и за счет прямого тормозного влияния на клетки проводящей системы сердца стимуляцией А 1 пуринорецепторов вторыми. В отличие от наркотических анальгетиков, введение препарата НАПР сопровождается развитием значимой вазодилатации как в большом, так и в малом круге кровообращения.
Результатом действия и опиоидов, и пуринов может оказаться отрицательный хронотропный эффект посредством активации блуждающего нерва первыми и за счет прямого тормозного влияния на клетки проводящей системы сердца стимуляцией А 1 пуринорецепторов вторыми. В отличие от наркотических анальгетиков, введение препарата НАПР сопровождается развитием значимой вазодилатации как в большом, так и в малом круге кровообращения.
 Противовоспалительный эффект отмечен только у препаратов НАПР и проявляется снижением образования свободных реактивных радикалов кислорода, плазменного уровня интерлейкина 6 и др. Эффект прекондиционирования развивается после введения и опиоида, и пуринового агониста, но развитие феномена посткондиционирования отмечено лишь на фоне действия препаратов НАПР.
Противовоспалительный эффект отмечен только у препаратов НАПР и проявляется снижением образования свободных реактивных радикалов кислорода, плазменного уровня интерлейкина 6 и др. Эффект прекондиционирования развивается после введения и опиоида, и пуринового агониста, но развитие феномена посткондиционирования отмечено лишь на фоне действия препаратов НАПР.
 Таким образом, имеются достаточные теоретические предпосылки для того, чтобы ожидать от сочетанного применения полных опиоидов и НАПР периоперационного обезболивания на новом, более высоком уровне.
Таким образом, имеются достаточные теоретические предпосылки для того, чтобы ожидать от сочетанного применения полных опиоидов и НАПР периоперационного обезболивания на новом, более высоком уровне.
 А. Е. Карелов, Ю. М. Боробов НОВЫЕ ТЕХНОЛОГИИ СИСТЕМНОГО ОБЕЗБОЛИВАНИЯ: КАК СНИЗИТЬ ДОЗУ ОПИОИДНЫХ АГОНИСТОВ В ПЕРИОПЕРАЦИОННОМ ПЕРИОДЕ? Медицинская академия последипломного образования, Санкт Петербург СЪЕЗД ФЕДЕРАЦИИ АНЕСТЕЗИОЛОГОВ И РЕАНИМАТОЛОГОВ Москва 2010 С. 189 191
А. Е. Карелов, Ю. М. Боробов НОВЫЕ ТЕХНОЛОГИИ СИСТЕМНОГО ОБЕЗБОЛИВАНИЯ: КАК СНИЗИТЬ ДОЗУ ОПИОИДНЫХ АГОНИСТОВ В ПЕРИОПЕРАЦИОННОМ ПЕРИОДЕ? Медицинская академия последипломного образования, Санкт Петербург СЪЕЗД ФЕДЕРАЦИИ АНЕСТЕЗИОЛОГОВ И РЕАНИМАТОЛОГОВ Москва 2010 С. 189 191
 Наш опыт включает использование препарата НАПР аденозинтрифосфата натрия (АТФ Nа) в качестве интраоперационного анальгетика. За десять лет изучения пуриновой анальгезии было выявлено, что периоперационная инфузия АТФ Nа может сочетаться с опиоидными агонистами и значительно снижать дозу последних в периоперационном периоде, улучшая качество послеоперационного периода (Карелов А. Е. с соавт. , 2010).
Наш опыт включает использование препарата НАПР аденозинтрифосфата натрия (АТФ Nа) в качестве интраоперационного анальгетика. За десять лет изучения пуриновой анальгезии было выявлено, что периоперационная инфузия АТФ Nа может сочетаться с опиоидными агонистами и значительно снижать дозу последних в периоперационном периоде, улучшая качество послеоперационного периода (Карелов А. Е. с соавт. , 2010).
 Таким образом, современные возможности терапии периоперационной боли можно значительно расширить включением препаратов НАПР, в частности, АТФ Nа, в схему анальгезии. В то же время пока все результаты клинического применения пуриновой анальгезии шведскими, американскими, японскими и российскими исследователями получены в рамках программ, санкционированных локальными этическими комитетами (в т. ч. нашей академии), тогда как отсутствие обезболивания в «официальных» списках показаний к применению НАПР сдерживает широкое распространение этой методики. Обнадеживает то, что официальная процедура внесения такого показания в инструкцию по применению АТФ Nа в Российской Федерации уже запущена производителем.
Таким образом, современные возможности терапии периоперационной боли можно значительно расширить включением препаратов НАПР, в частности, АТФ Nа, в схему анальгезии. В то же время пока все результаты клинического применения пуриновой анальгезии шведскими, американскими, японскими и российскими исследователями получены в рамках программ, санкционированных локальными этическими комитетами (в т. ч. нашей академии), тогда как отсутствие обезболивания в «официальных» списках показаний к применению НАПР сдерживает широкое распространение этой методики. Обнадеживает то, что официальная процедура внесения такого показания в инструкцию по применению АТФ Nа в Российской Федерации уже запущена производителем.
 Эффективной коррекции эндотелиальной дисфункции и предупреждения связанного с ней поражения органов мишений, в том числе почек, при ожирении можно ожидать только при нормализации или, по крайней мере, снижения массы тела. У подавляющего большинства больных ожирением нормализация количества жировой ткани в организме в ближайшем будущем, по видимому, недостижима. Н. А. Мухин с соавт. Эндотелиальная дисфункция и поражение почек при ожирении (ММА им. И. М. Сеченова, МГУ им. М. В. Ломоносова) Вестник РАМН, 2006, № 12, стр. 25 31.
Эффективной коррекции эндотелиальной дисфункции и предупреждения связанного с ней поражения органов мишений, в том числе почек, при ожирении можно ожидать только при нормализации или, по крайней мере, снижения массы тела. У подавляющего большинства больных ожирением нормализация количества жировой ткани в организме в ближайшем будущем, по видимому, недостижима. Н. А. Мухин с соавт. Эндотелиальная дисфункция и поражение почек при ожирении (ММА им. И. М. Сеченова, МГУ им. М. В. Ломоносова) Вестник РАМН, 2006, № 12, стр. 25 31.
 Все рентгеноконтрастные агенты в некоторой степени нефро токсичны, особенно при внутриартериальном введении. К предрасполагающим факторам риска (помимо частого использования этих веществ) относятся тканевая гипоперфузия, уменьшение объема внеклеточной жидкости, почечная недостаточность, возраст старше 60 лет, единственная почка, диабет, миелома, гиперурикемия и сердечная недостаточность. Нефропатия, связанная с приемом анальгетиков, бывает причиной примерно 2% почечных поражений в конечной стадии в США и 20% или более в Австралии и Южной Африке. В целом фактически все антивоспалительные болеутоляющие средства периферического действия потенциально нефротоксичны, а большинство центральных анальгетиков – нет. Салицилаты оказывают прямое нефротоксичное действие и выступают в роли синергистов при смешанных анальгетических нефропатиях. Трудно оценить, насколько широко они применяются в обычной практике. Почти все нестероидные противовоспалительные анальгетики (они представляют собой ингибиторы циклоксигеназы разной эффективности) могут вызывать поражение канальцев.
Все рентгеноконтрастные агенты в некоторой степени нефро токсичны, особенно при внутриартериальном введении. К предрасполагающим факторам риска (помимо частого использования этих веществ) относятся тканевая гипоперфузия, уменьшение объема внеклеточной жидкости, почечная недостаточность, возраст старше 60 лет, единственная почка, диабет, миелома, гиперурикемия и сердечная недостаточность. Нефропатия, связанная с приемом анальгетиков, бывает причиной примерно 2% почечных поражений в конечной стадии в США и 20% или более в Австралии и Южной Африке. В целом фактически все антивоспалительные болеутоляющие средства периферического действия потенциально нефротоксичны, а большинство центральных анальгетиков – нет. Салицилаты оказывают прямое нефротоксичное действие и выступают в роли синергистов при смешанных анальгетических нефропатиях. Трудно оценить, насколько широко они применяются в обычной практике. Почти все нестероидные противовоспалительные анальгетики (они представляют собой ингибиторы циклоксигеназы разной эффективности) могут вызывать поражение канальцев.
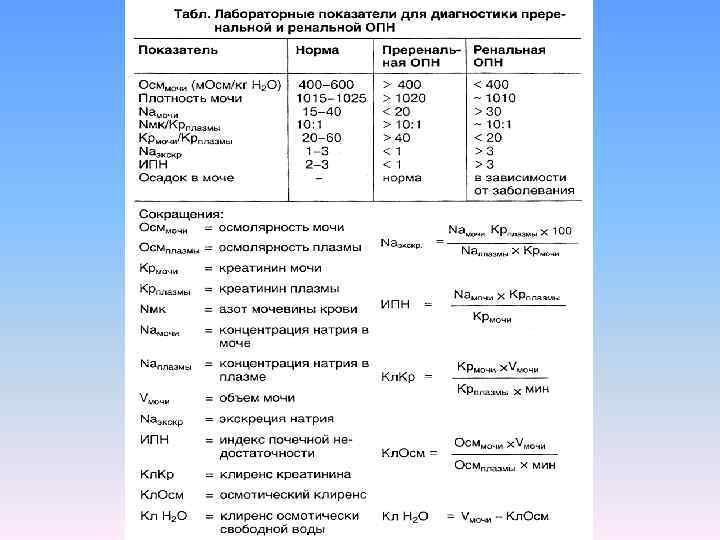
 Преренальные факторы, приводящие к нарушению кровоснабжения почек: первичное снижение сердечного выброса, снижение ОЦК, перераспределение объема внеклеточной жидкости. Ренальные причины связаны с поражением канальцевого аппарата (острый канальцевый некроз), сосудов почки (васкулит), интерстициального пространства (острый интерстициальный нефрит), клубочкового аппарата (острый и быстропрогрессирующий гломерулонефрит). Постренальная ОПН связана с обструкцией мочевыводящих путей на уровне мочеточников, мочевого пузыря или уретры. Наиболее частым вариантом поражения является острый канальцевый некроз, по данным F. Liano с соавт. (1996) он составляет 58% (вместе с ОПН на фоне ХПН), преренальные поражения, не успевшие перейти в острый канальцевый некроз, встречаются в 21%, постренальные в 10%, на гломерулонефриты, васкулиты и интерстициальные нефриты приходится 7% ОПН. Летальность больных с острым канальцевым некрозом составляет 40 60% и, к сожалению, не уменьшилась за последние 15 лет.
Преренальные факторы, приводящие к нарушению кровоснабжения почек: первичное снижение сердечного выброса, снижение ОЦК, перераспределение объема внеклеточной жидкости. Ренальные причины связаны с поражением канальцевого аппарата (острый канальцевый некроз), сосудов почки (васкулит), интерстициального пространства (острый интерстициальный нефрит), клубочкового аппарата (острый и быстропрогрессирующий гломерулонефрит). Постренальная ОПН связана с обструкцией мочевыводящих путей на уровне мочеточников, мочевого пузыря или уретры. Наиболее частым вариантом поражения является острый канальцевый некроз, по данным F. Liano с соавт. (1996) он составляет 58% (вместе с ОПН на фоне ХПН), преренальные поражения, не успевшие перейти в острый канальцевый некроз, встречаются в 21%, постренальные в 10%, на гломерулонефриты, васкулиты и интерстициальные нефриты приходится 7% ОПН. Летальность больных с острым канальцевым некрозом составляет 40 60% и, к сожалению, не уменьшилась за последние 15 лет.
 В августе 2000 г. в Нью Йорке под эгидой Американского общества нефрологии (American Society of Nephrology) и Об щества специалистов интенсивной терапии (Society of Critical Саге Medicine) прошла Первая международная согласительная конференция «Инициатива качества заместительной почечной терапии у больных ОПН» (Acute Dialysis Quality Initiative (ADQI)).
В августе 2000 г. в Нью Йорке под эгидой Американского общества нефрологии (American Society of Nephrology) и Об щества специалистов интенсивной терапии (Society of Critical Саге Medicine) прошла Первая международная согласительная конференция «Инициатива качества заместительной почечной терапии у больных ОПН» (Acute Dialysis Quality Initiative (ADQI)).
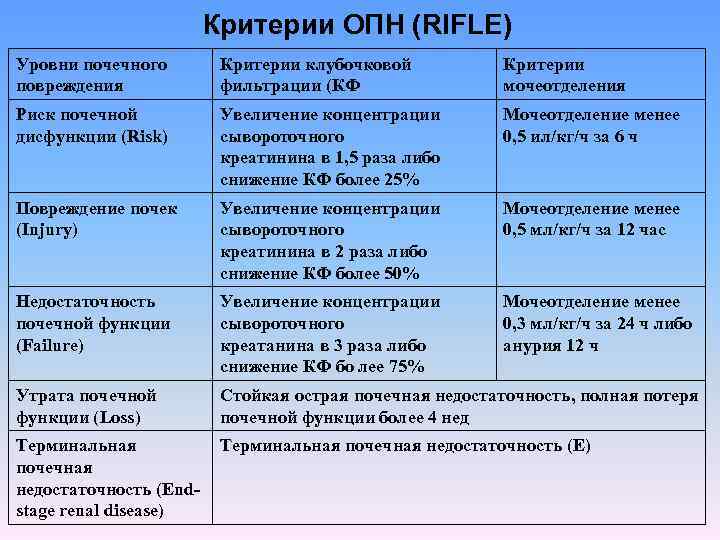 Критерии ОПН (RIFLE) Уровни почечного повреждения Критерии клубочковой фильтрации (КФ Критерии мочеотделения Риск почечной дисфункции (Risk) Увеличение концентрации сывороточного креатинина в 1, 5 раза либо снижение КФ более 25% Мочеотделение менее 0, 5 ил/кг/ч за 6 ч Повреждение почек (Injury) Увеличение концентрации сывороточного креатинина в 2 раза либо снижение КФ более 50% Мочеотделение менее 0, 5 мл/кг/ч за 12 час Недостаточность почечной функции (Failure) Увеличение концентрации сывороточного креатанина в 3 раза либо снижение КФ бо лее 75% Мочеотделение менее 0, 3 мл/кг/ч за 24 ч либо анурия 12 ч Утрата почечной функции (Loss) Стойкая острая почечная недостаточность, полная потеря почечной функции более 4 нед Терминальная почечная недостаточность (Еnd stage renal disease) Терминальная почечная недостаточность (Е)
Критерии ОПН (RIFLE) Уровни почечного повреждения Критерии клубочковой фильтрации (КФ Критерии мочеотделения Риск почечной дисфункции (Risk) Увеличение концентрации сывороточного креатинина в 1, 5 раза либо снижение КФ более 25% Мочеотделение менее 0, 5 ил/кг/ч за 6 ч Повреждение почек (Injury) Увеличение концентрации сывороточного креатинина в 2 раза либо снижение КФ более 50% Мочеотделение менее 0, 5 мл/кг/ч за 12 час Недостаточность почечной функции (Failure) Увеличение концентрации сывороточного креатанина в 3 раза либо снижение КФ бо лее 75% Мочеотделение менее 0, 3 мл/кг/ч за 24 ч либо анурия 12 ч Утрата почечной функции (Loss) Стойкая острая почечная недостаточность, полная потеря почечной функции более 4 нед Терминальная почечная недостаточность (Еnd stage renal disease) Терминальная почечная недостаточность (Е)
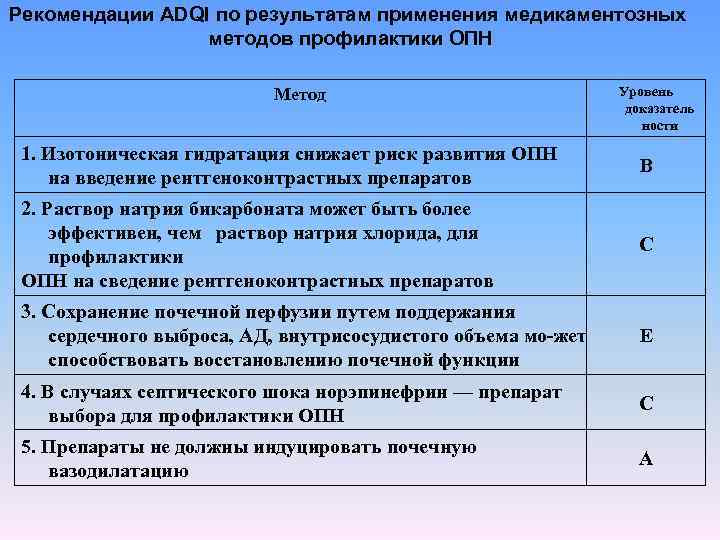 Рекомендации ADQI по результатам применения медикаментозных методов профилактики ОПН Метод Уровень доказатель ности 1. Изотоническая гидратация снижает риск развития ОПН на введение рентгеноконтрастных препаратов В 2. Раствор натрия бикарбоната может быть более эффективен, чем раствор натрия хлорида, для профилактики ОПН на сведение рентгеноконтрастных препаратов С 3. Сохранение почечной перфузии путем поддержания сердечного выброса, АД, внутрисосудистого объема мо жет способствовать восстановлению почечной функции Е 4. В случаях септического шока норэпинефрин — препарат выбора для профилактики ОПН С 5. Препараты не должны индуцировать почечную вазодилатацию А
Рекомендации ADQI по результатам применения медикаментозных методов профилактики ОПН Метод Уровень доказатель ности 1. Изотоническая гидратация снижает риск развития ОПН на введение рентгеноконтрастных препаратов В 2. Раствор натрия бикарбоната может быть более эффективен, чем раствор натрия хлорида, для профилактики ОПН на сведение рентгеноконтрастных препаратов С 3. Сохранение почечной перфузии путем поддержания сердечного выброса, АД, внутрисосудистого объема мо жет способствовать восстановлению почечной функции Е 4. В случаях септического шока норэпинефрин — препарат выбора для профилактики ОПН С 5. Препараты не должны индуцировать почечную вазодилатацию А
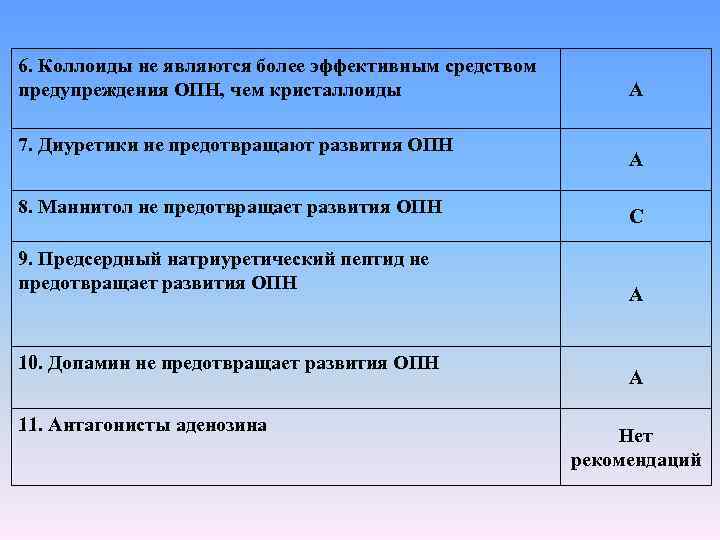 6. Коллоиды не являются более эффективным средством предупреждения ОПН, чем кристаллоиды 7. Диуретики не предотвращают развития ОПН 8. Маннитол не предотвращает развития ОПН 9. Предсердный натриуретический пептид не предотвращает развития ОПН 10. Допамин не предотвращает развития ОПН 11. Антагонисты аденозина А А С А А Нет рекомендаций
6. Коллоиды не являются более эффективным средством предупреждения ОПН, чем кристаллоиды 7. Диуретики не предотвращают развития ОПН 8. Маннитол не предотвращает развития ОПН 9. Предсердный натриуретический пептид не предотвращает развития ОПН 10. Допамин не предотвращает развития ОПН 11. Антагонисты аденозина А А С А А Нет рекомендаций
 Предметом научных дискуссий до сих пор остаются вопросы оптимизации и выработки четких критериев использования ЗПТ у больных в критическом состоянии. Это прежде всего сроки и критерии начала ЗПТ, выбора метода, режимов и дозы проведения ЗПТ, выбор режима антикоагулянтной терапии, а также критерии окончания ЗПТ.
Предметом научных дискуссий до сих пор остаются вопросы оптимизации и выработки четких критериев использования ЗПТ у больных в критическом состоянии. Это прежде всего сроки и критерии начала ЗПТ, выбора метода, режимов и дозы проведения ЗПТ, выбор режима антикоагулянтной терапии, а также критерии окончания ЗПТ.
 Критерии начала ЗПТ Существуют общепринятые показания для начала диализной терапии: острая гиперкалиемия, выраженная гипергидратация (отек легких), метаболический ацидоз, необструктивная олигоанурия или анурия, уремические осложнения (перикардит). В по следнее время предметом обсуждения становятся показания к раннему, или "профилактическому", началу ЗПТ для предотвращения органных нарушений, коррекции системной воспалитель ной реакции при сепсисе, тяжелом остром панкреатите, синдроме острого легочного повреждения. Открытым остается вопрос об использовании критериев RIFLE для определения времени начала ЗПТ. В то же время конкретные критерии раннего начала ЗПТ к настоящему времени не сформулированы.
Критерии начала ЗПТ Существуют общепринятые показания для начала диализной терапии: острая гиперкалиемия, выраженная гипергидратация (отек легких), метаболический ацидоз, необструктивная олигоанурия или анурия, уремические осложнения (перикардит). В по следнее время предметом обсуждения становятся показания к раннему, или "профилактическому", началу ЗПТ для предотвращения органных нарушений, коррекции системной воспалитель ной реакции при сепсисе, тяжелом остром панкреатите, синдроме острого легочного повреждения. Открытым остается вопрос об использовании критериев RIFLE для определения времени начала ЗПТ. В то же время конкретные критерии раннего начала ЗПТ к настоящему времени не сформулированы.
 Выбор метода ЗПТ у больных ОПН в критическом состоя нии, использование интермиттирующих постоянных или гибридных методик в последнее время является предметом многочисленных исследований и научных дискуссий. По данным исследования BEST' [2005], у 80% пациентов в отделениях реанимации ЗПТ начинается с постоянной ЗПТ (путем постоян ной венозной гемофильтрации ПВВГФ или постоянной венозной гемодиафильтрации — ПВВГДФ), у 16, 9% — с интермиттирующего гемодиализа (ИГД) или гемодиафильтрации (ГДФ), в 3, 1% случаев ЗПТ начинается с исполь зования перитонеального диализа, гибридных технологий (SLED) или высокообъемной гемофильтрации.
Выбор метода ЗПТ у больных ОПН в критическом состоя нии, использование интермиттирующих постоянных или гибридных методик в последнее время является предметом многочисленных исследований и научных дискуссий. По данным исследования BEST' [2005], у 80% пациентов в отделениях реанимации ЗПТ начинается с постоянной ЗПТ (путем постоян ной венозной гемофильтрации ПВВГФ или постоянной венозной гемодиафильтрации — ПВВГДФ), у 16, 9% — с интермиттирующего гемодиализа (ИГД) или гемодиафильтрации (ГДФ), в 3, 1% случаев ЗПТ начинается с исполь зования перитонеального диализа, гибридных технологий (SLED) или высокообъемной гемофильтрации.
 В работах 90 х годов сообщалось о лучшем контроле азотемии, большей гемодинамической стабильности и лучшей выживаемости больных, получивших постоянную ЗПТ по сравнению с ИГД. Но в 2001 г. R. L. Mehta и со авт. опубликовали мультицентровое рандомизированное контролируемое исследование согласно которому при сравнении групп, получивших ПВВГДФ или ИГД терапию, госпитальная летальность при ИГД была достоверно ниже, чем в результате ПВВГФ (47, 6 и 65, 5%; р < 0, 02). На сегодняшний день нет убедительных данных о преимуществе какого либо метода ЗПТ.
В работах 90 х годов сообщалось о лучшем контроле азотемии, большей гемодинамической стабильности и лучшей выживаемости больных, получивших постоянную ЗПТ по сравнению с ИГД. Но в 2001 г. R. L. Mehta и со авт. опубликовали мультицентровое рандомизированное контролируемое исследование согласно которому при сравнении групп, получивших ПВВГДФ или ИГД терапию, госпитальная летальность при ИГД была достоверно ниже, чем в результате ПВВГФ (47, 6 и 65, 5%; р < 0, 02). На сегодняшний день нет убедительных данных о преимуществе какого либо метода ЗПТ.
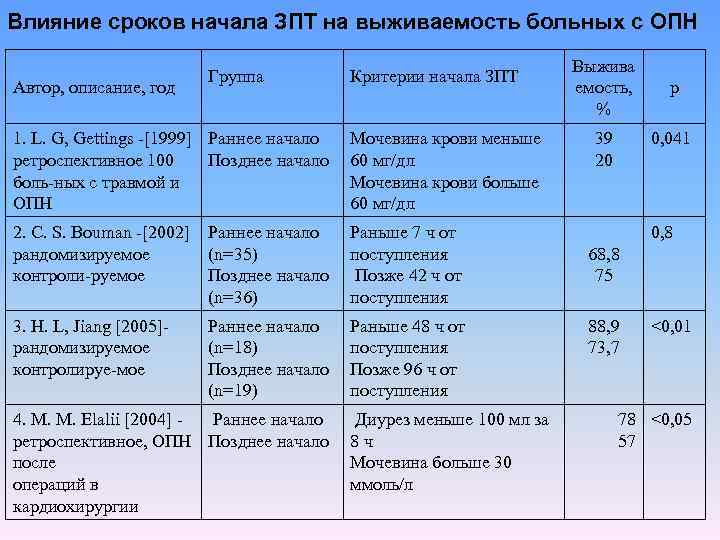 Влияние сроков начала ЗПТ на выживаемость больных с ОПН Автор, описание, год Группа Критерии начала ЗПТ 1. L. G, Gettings [1999] Раннее начало ретроспективное 100 Позднее начало боль ных с травмой и ОПН Мочевина крови меньше 60 мг/дл Мочевина крови больше 60 мг/дл 2. С. S. Bouman [2002] рандомизируемое контроли руемое Раннее начало (n=35) Позднее начало (n=36) Раньше 7 ч от поступления Позже 42 ч от поступления 3. Н. L, Jiang [2005] рандомизируемое контролируе мое Раннее начало (n=18) Позднее начало (n=19) Раньше 48 ч от поступления Позже 96 ч от поступления 4. М. М. Elalii [2004] Раннее начало ретроспективное, ОПН Позднее начало после операций в кардиохирургии Диурез меньше 100 мл за 8 ч Мочевина больше 30 ммоль/л Выжива емость, % 39 20 р 0, 041 0, 8 68, 8 75 88, 9 73, 7 <0, 01 78 <0, 05 57
Влияние сроков начала ЗПТ на выживаемость больных с ОПН Автор, описание, год Группа Критерии начала ЗПТ 1. L. G, Gettings [1999] Раннее начало ретроспективное 100 Позднее начало боль ных с травмой и ОПН Мочевина крови меньше 60 мг/дл Мочевина крови больше 60 мг/дл 2. С. S. Bouman [2002] рандомизируемое контроли руемое Раннее начало (n=35) Позднее начало (n=36) Раньше 7 ч от поступления Позже 42 ч от поступления 3. Н. L, Jiang [2005] рандомизируемое контролируе мое Раннее начало (n=18) Позднее начало (n=19) Раньше 48 ч от поступления Позже 96 ч от поступления 4. М. М. Elalii [2004] Раннее начало ретроспективное, ОПН Позднее начало после операций в кардиохирургии Диурез меньше 100 мл за 8 ч Мочевина больше 30 ммоль/л Выжива емость, % 39 20 р 0, 041 0, 8 68, 8 75 88, 9 73, 7 <0, 01 78 <0, 05 57
 Наряду с классическими клиническими и лабораторными критериями мы оцениваем степень тяжести ОПН по двум простейшим параметрам: длительности стадии олигоанурии и суточному приросту мочевины плазмы. При этом при длительности периода олигоанурии до 5 сут. и приросте мочевины до 3 ммоль/л ОПН считается умеренной по степени тяжести, соответственно, 5 8 сут. и 3 7 ммоль/л значительной, более 8 сут. и 7 ммоль/л предельной.
Наряду с классическими клиническими и лабораторными критериями мы оцениваем степень тяжести ОПН по двум простейшим параметрам: длительности стадии олигоанурии и суточному приросту мочевины плазмы. При этом при длительности периода олигоанурии до 5 сут. и приросте мочевины до 3 ммоль/л ОПН считается умеренной по степени тяжести, соответственно, 5 8 сут. и 3 7 ммоль/л значительной, более 8 сут. и 7 ммоль/л предельной.
 Уровень концентрации плазменного калия и маркеров уремической интоксикации как показания к экстракорпоральной диализной терапии Алексеева М. П. , Мильцын А. С. ГМУ «Саратовская областная клиническая больница» , Саратов, Россия Информационный сборник ВИНИТИ Новости анестезиологии и реаниматологии 2009 № 1 С 93 -94
Уровень концентрации плазменного калия и маркеров уремической интоксикации как показания к экстракорпоральной диализной терапии Алексеева М. П. , Мильцын А. С. ГМУ «Саратовская областная клиническая больница» , Саратов, Россия Информационный сборник ВИНИТИ Новости анестезиологии и реаниматологии 2009 № 1 С 93 -94
 Проведен анализ 88 опубликованных данных по показаниям к гемодиализу у больных острой почечной недостаточностью и их статистическая обработка. Концентрацию плазменного калия рассматривают как одно из показаний к заместительной почечной терапии в 47 работах (53, 4%), при этом только 5 авторов (5, 68%) указывают два предельных значения.
Проведен анализ 88 опубликованных данных по показаниям к гемодиализу у больных острой почечной недостаточностью и их статистическая обработка. Концентрацию плазменного калия рассматривают как одно из показаний к заместительной почечной терапии в 47 работах (53, 4%), при этом только 5 авторов (5, 68%) указывают два предельных значения.
 В остальных работах указан один критический уровень. При этом 3 (3, 41%) автора рекомендуют обязательное подтверждение калиевой интоксикации методом электрокардиографии. Общий референтный разброс в полной совокупности составляет 5, 0÷ 8, 0 ммоль/л
В остальных работах указан один критический уровень. При этом 3 (3, 41%) автора рекомендуют обязательное подтверждение калиевой интоксикации методом электрокардиографии. Общий референтный разброс в полной совокупности составляет 5, 0÷ 8, 0 ммоль/л
 Минимально указанный референтный предел составляет 6, 0÷ 6, 5 ммоль/л, максимальный (критический) 5, 0÷ 8, 0 ммоль/л. При рассмотрении разницы референтных значений в пяти наблюдениях установлено, что она составляет 0, 5÷ 1, 5 ммоль/л
Минимально указанный референтный предел составляет 6, 0÷ 6, 5 ммоль/л, максимальный (критический) 5, 0÷ 8, 0 ммоль/л. При рассмотрении разницы референтных значений в пяти наблюдениях установлено, что она составляет 0, 5÷ 1, 5 ммоль/л
 Креатинин указан в 25 источниках (28, 4%) то есть на треть реже, чем мочевина. При этом минимальные значения указаны у 11 авторов, что составляет 12, 5% от общего числа. Общие референтные значения указаны в переделах 220, 0÷ 1700, 0 мкмоль/л. Минимальные составляют 220, 0÷ 707, 22 мкмоль/л, максимальные 350, 0÷ 1700, 0 мкмоль/л. Размах 88, 4÷ 800, 0
Креатинин указан в 25 источниках (28, 4%) то есть на треть реже, чем мочевина. При этом минимальные значения указаны у 11 авторов, что составляет 12, 5% от общего числа. Общие референтные значения указаны в переделах 220, 0÷ 1700, 0 мкмоль/л. Минимальные составляют 220, 0÷ 707, 22 мкмоль/л, максимальные 350, 0÷ 1700, 0 мкмоль/л. Размах 88, 4÷ 800, 0
 Мочевина как показание к применению заместительной почечной терапии указана у 54 исследователей (61, 4%), а уровень ее суточного прироста у 13 (14, 8%). Общие референтные значения колеблются в очень широких пределах: 16, 65÷ 80, 0 ммоль/л. Минимальный уровень указан в 9 источниках (10, 2%) и составляет 16, 65÷ 40, 0 ммоль/л; максимальный 16, 65÷ 80, 0 ммоль/л. Разница внутри референтных значений составила 3, 33÷ 50, 0 ммоль/л.
Мочевина как показание к применению заместительной почечной терапии указана у 54 исследователей (61, 4%), а уровень ее суточного прироста у 13 (14, 8%). Общие референтные значения колеблются в очень широких пределах: 16, 65÷ 80, 0 ммоль/л. Минимальный уровень указан в 9 источниках (10, 2%) и составляет 16, 65÷ 40, 0 ммоль/л; максимальный 16, 65÷ 80, 0 ммоль/л. Разница внутри референтных значений составила 3, 33÷ 50, 0 ммоль/л.
 Полученные в ходе рассмотрения и анализа данные о референтных и критических значениях мочевины, креатинина и калия плазмы крови, используемые в качестве показания к началу острого гемодиализа, показывают многообразие мнений различных авторов в рассматриваемом вопросе. Это обстоятельство, безусловно, подтверждает настоятельную необходимость продолжения исследований в указанном направлении.
Полученные в ходе рассмотрения и анализа данные о референтных и критических значениях мочевины, креатинина и калия плазмы крови, используемые в качестве показания к началу острого гемодиализа, показывают многообразие мнений различных авторов в рассматриваемом вопросе. Это обстоятельство, безусловно, подтверждает настоятельную необходимость продолжения исследований в указанном направлении.
 Современная доктрина лечения острой почечной недостаточности (ОПН) состоит в раннем и достаточно частом проведении сеансов экстракорпорального очищения крови, как только диагноз ОПН выраженной или предельной степени тяжести становится несомненным. Проведение таких операций позволяет корригировать гиперкалиемию, уменьшить гипергидратацию, метаболический ацидоз, легочные изменения, ликвидировать проявления уремического перикардита, снять проявления уремической интоксикации и уремической энтеропатии. Активное лечение позволяет расширить водный и пищевой режим у таких пациентов, проводить адекватную инфузионно трансфузионную терапию, свободно назначать антибиотики. Продолжительность заместительной экстракорпоральной терапии зависит от выраженности расстройств гомеостаза и длительности периода восстановления мочевыделительной и азотовыделительной функции почек.
Современная доктрина лечения острой почечной недостаточности (ОПН) состоит в раннем и достаточно частом проведении сеансов экстракорпорального очищения крови, как только диагноз ОПН выраженной или предельной степени тяжести становится несомненным. Проведение таких операций позволяет корригировать гиперкалиемию, уменьшить гипергидратацию, метаболический ацидоз, легочные изменения, ликвидировать проявления уремического перикардита, снять проявления уремической интоксикации и уремической энтеропатии. Активное лечение позволяет расширить водный и пищевой режим у таких пациентов, проводить адекватную инфузионно трансфузионную терапию, свободно назначать антибиотики. Продолжительность заместительной экстракорпоральной терапии зависит от выраженности расстройств гомеостаза и длительности периода восстановления мочевыделительной и азотовыделительной функции почек.
 При постановке показаний к замещению почечной функции при ОПН и определении метода ее проведения оцениваются продолжительность олигоанурии, выраженность гипергидратации (периферические, полостные отеки, водяное легкое), особенности дизэлектролитемии и азотемии, наличие эрозивных изменений слизистой оболочки желудочно кишечного тракта. Требующими немедленного замещения почечных функций считаются больные, имеющие следующие клинические и лабораторные показатели: олигоанурия в течение более 5 сут. ; развивающийся отек легкого или головного мозга; выраженный уремический синдром; гиперкалиемия более 6, 5 ммоль/л плазмы крови; концентрация мочевины плазмы 50 ммоль/л с приростом более 5 ммоль/л в сутки; снижение уровня стандартного бикарбоната до 8 10 ммоль/л плазмы или ВЕ более 14 16 ммоль/л;
При постановке показаний к замещению почечной функции при ОПН и определении метода ее проведения оцениваются продолжительность олигоанурии, выраженность гипергидратации (периферические, полостные отеки, водяное легкое), особенности дизэлектролитемии и азотемии, наличие эрозивных изменений слизистой оболочки желудочно кишечного тракта. Требующими немедленного замещения почечных функций считаются больные, имеющие следующие клинические и лабораторные показатели: олигоанурия в течение более 5 сут. ; развивающийся отек легкого или головного мозга; выраженный уремический синдром; гиперкалиемия более 6, 5 ммоль/л плазмы крови; концентрация мочевины плазмы 50 ммоль/л с приростом более 5 ммоль/л в сутки; снижение уровня стандартного бикарбоната до 8 10 ммоль/л плазмы или ВЕ более 14 16 ммоль/л;
 Методы заместительной терапии при ОПН, имеющиеся сегодня в арсенале врача, можно разделить на прерывистые и непрерывные продолжительные. К прерывистым относятся гемодиализ, гемофильтрация, гемодиафильтрация, комбинация изолированной ультрафильтрации с гемосорбцией. Непрерывные продолжительные представлены продолжителыной венозной (артерио венозной) гемофильтрацией, продолжительным венозным (артерио венозным) гемодиализом, продолжительной венозной (артерио венозной) гемодиафильтрацией, медленной продолжительной венозной (артерио венозной) ультрафильтрацией и продолжительным равновесным перитонеальным диализом. Особенностью прерывистых методов является высокая скорость выведения токсических веществ и жидкости. Непрерывные продолжительные методы, уступая в скорости, обеспечивают медленное, но постоянное поддержание гомеостаза.
Методы заместительной терапии при ОПН, имеющиеся сегодня в арсенале врача, можно разделить на прерывистые и непрерывные продолжительные. К прерывистым относятся гемодиализ, гемофильтрация, гемодиафильтрация, комбинация изолированной ультрафильтрации с гемосорбцией. Непрерывные продолжительные представлены продолжителыной венозной (артерио венозной) гемофильтрацией, продолжительным венозным (артерио венозным) гемодиализом, продолжительной венозной (артерио венозной) гемодиафильтрацией, медленной продолжительной венозной (артерио венозной) ультрафильтрацией и продолжительным равновесным перитонеальным диализом. Особенностью прерывистых методов является высокая скорость выведения токсических веществ и жидкости. Непрерывные продолжительные методы, уступая в скорости, обеспечивают медленное, но постоянное поддержание гомеостаза.
 При выборе замещения почечных функций при ОПН исходят из патогенеза этого патологического состояния: является ли поражение почек практически начальным в цепи патологических событий, а остальная органная патология это следствие уремии, или ОПН трактуют как один из этапов развития синдрома полиорганной несостоятельности, тогда как первой или предшествующей патологией является несостоятельность другого органа жизнеобеспечения, например, легких. Если в первом случае методом выбора могут быть прерывистые методы, то во втором, при выраженных признаках синдрома остро легочного повреждения, предпочтение должно быть отдано продолжительным процедурам.
При выборе замещения почечных функций при ОПН исходят из патогенеза этого патологического состояния: является ли поражение почек практически начальным в цепи патологических событий, а остальная органная патология это следствие уремии, или ОПН трактуют как один из этапов развития синдрома полиорганной несостоятельности, тогда как первой или предшествующей патологией является несостоятельность другого органа жизнеобеспечения, например, легких. Если в первом случае методом выбора могут быть прерывистые методы, то во втором, при выраженных признаках синдрома остро легочного повреждения, предпочтение должно быть отдано продолжительным процедурам.
 Гемодиализ на сегодняшний день является наиболее распространенным методом, он достаточно быстро приводит к дегидратации и детоксикации, а также быстро корригирует нарушения кислотно основного равновесия и электролитного баланса через диффузионный и ультрафильтрационный механизм изменения состава крови. При гемофильтрации за счет конвекционного транспорта из крови выводится более широкий по молекулярной массе спектр субстанций, а объем выводимой жидкости может достигать 10 12 л/час, что требует адекватного по темпу и объему инфузионного замещения. Гемодиафильтрация сочетает в себе преимущества гемодиализа и гемофильтрации, позволяет интенсивно выводить низкомолекулярные вещества и корригировать нарушения кислотно основного равновесия (как и гемодиализ), а также обладает мощными детоксикационными и дегидратационными свойствами гемофильтрации.
Гемодиализ на сегодняшний день является наиболее распространенным методом, он достаточно быстро приводит к дегидратации и детоксикации, а также быстро корригирует нарушения кислотно основного равновесия и электролитного баланса через диффузионный и ультрафильтрационный механизм изменения состава крови. При гемофильтрации за счет конвекционного транспорта из крови выводится более широкий по молекулярной массе спектр субстанций, а объем выводимой жидкости может достигать 10 12 л/час, что требует адекватного по темпу и объему инфузионного замещения. Гемодиафильтрация сочетает в себе преимущества гемодиализа и гемофильтрации, позволяет интенсивно выводить низкомолекулярные вещества и корригировать нарушения кислотно основного равновесия (как и гемодиализ), а также обладает мощными детоксикационными и дегидратационными свойствами гемофильтрации.
 К преимуществам гемофильтрации и гемодиафильтрации перед гемодиализом относят их лучшую переносимость, более стабильные показатели гемодинамики до и после процедур, лучшее выведение среднемолекулярных субстанций. Однако гемофильтрация и гемодиафильтрация дорогие процедуры, требующие специального оборудования, более дорогих массо обменных устройств, магистралей, высокого расхода инфузионных сред. В связи с этим основными показаниями к применению этих процедур вместо гемодиализа могут быть плохая переносимость гемодиализа, сердечнососудистая дисфункция, гипотензивные осложнения.
К преимуществам гемофильтрации и гемодиафильтрации перед гемодиализом относят их лучшую переносимость, более стабильные показатели гемодинамики до и после процедур, лучшее выведение среднемолекулярных субстанций. Однако гемофильтрация и гемодиафильтрация дорогие процедуры, требующие специального оборудования, более дорогих массо обменных устройств, магистралей, высокого расхода инфузионных сред. В связи с этим основными показаниями к применению этих процедур вместо гемодиализа могут быть плохая переносимость гемодиализа, сердечнососудистая дисфункция, гипотензивные осложнения.

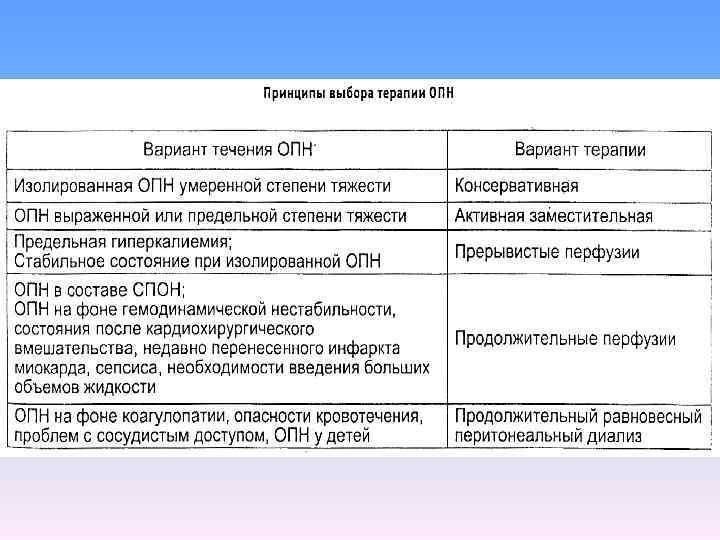
 • Последствия ЗПТ: • гипотония или гипертензия, • потери нутриентов (аминокислот, антиоксидантов), • активация белкового катаболизма, • активация воспалительной реакции
• Последствия ЗПТ: • гипотония или гипертензия, • потери нутриентов (аминокислот, антиоксидантов), • активация белкового катаболизма, • активация воспалительной реакции
 ПЕРСПЕКТИВЫ ИСПОЛЬЗОВАНИЯ СТВОЛОВЫХ КЛЕТОК В ЛЕЧЕНИИ ОСТРОЙ И ХРОНИЧЕСКОЙ ПОЧЕЧНОЙ НЕДОСТАТОЧНОСТИ В. И. Кирпатовский, А. В. Казаченко, О. Н. Надточий (НИИ Урологии Росздрава, Москва) Урология, 2007, № 6, стр. 82 87
ПЕРСПЕКТИВЫ ИСПОЛЬЗОВАНИЯ СТВОЛОВЫХ КЛЕТОК В ЛЕЧЕНИИ ОСТРОЙ И ХРОНИЧЕСКОЙ ПОЧЕЧНОЙ НЕДОСТАТОЧНОСТИ В. И. Кирпатовский, А. В. Казаченко, О. Н. Надточий (НИИ Урологии Росздрава, Москва) Урология, 2007, № 6, стр. 82 87
 При ОПН восстановление функции поврежденного органа связано с замещением необратимо поврежденных структур (элементов нефрона) регенерирующими клетками, имеющими разные источники (резидентные клетки предшественники, ко стномозговые полипотентные клетки). Задача терапии в этих условиях ускорить процесс регенерации до того, как в организме не разовьются чрезмерные нарушения гомеостаза. Введение СК, выделенных из костного мозга взрослого ор ганизма (как гемопоэтических, так и стромальных), уменьшает выраженность постишемической ОПН и ускоряет процесс вос становления функции поврежденной почки.
При ОПН восстановление функции поврежденного органа связано с замещением необратимо поврежденных структур (элементов нефрона) регенерирующими клетками, имеющими разные источники (резидентные клетки предшественники, ко стномозговые полипотентные клетки). Задача терапии в этих условиях ускорить процесс регенерации до того, как в организме не разовьются чрезмерные нарушения гомеостаза. Введение СК, выделенных из костного мозга взрослого ор ганизма (как гемопоэтических, так и стромальных), уменьшает выраженность постишемической ОПН и ускоряет процесс вос становления функции поврежденной почки.
 Введение костномозговых мезенхимальных СК плода человека в почку крыс с тяжелой ОПН, вызванной 90 минутной тепловой ишемией, давало четкий положительный эффект, повы шая выживаемость животных с 0 до 80% при нормализации функциональных показателей (креатинин крови, клиренс креатинина) к 20 21 му дню. Нормальные показатели функции почки сохранялись весь срок наблюдения (80 дней). Введение суммарной культуры клеток плодной почки оказалось значительно менее эффективным от ОПН погибли 83% животных [В. И. Кирпатовский с соавт. , 2006]. Авторы связывают выраженный терапевтический эффект костномозговых СК преимущественно с их паракринным действием на ткань поврежденной почки.
Введение костномозговых мезенхимальных СК плода человека в почку крыс с тяжелой ОПН, вызванной 90 минутной тепловой ишемией, давало четкий положительный эффект, повы шая выживаемость животных с 0 до 80% при нормализации функциональных показателей (креатинин крови, клиренс креатинина) к 20 21 му дню. Нормальные показатели функции почки сохранялись весь срок наблюдения (80 дней). Введение суммарной культуры клеток плодной почки оказалось значительно менее эффективным от ОПН погибли 83% животных [В. И. Кирпатовский с соавт. , 2006]. Авторы связывают выраженный терапевтический эффект костномозговых СК преимущественно с их паракринным действием на ткань поврежденной почки.
 В то же время имеются данные, что введенные костномоз говые мезенхимальныс СК при определенных условиях могут трансформироваться в клетки канальцевого эпителия и за счет этого способствовать регенерации канальцев Введение крысам с ОПН, вызванной 45 минутной тепловой ишемией, мезенхимальных и гемопоэтических костномозговых СК приводило к уменьшению летальности с 40 до 5%, причем наиболее выраженный эффект улучшения функции почек на блюдался при совместном введении мезенхимальных и гемопоэтических клеток, в соотношении 1: 5 [C. Westenfelder, 2004].
В то же время имеются данные, что введенные костномоз говые мезенхимальныс СК при определенных условиях могут трансформироваться в клетки канальцевого эпителия и за счет этого способствовать регенерации канальцев Введение крысам с ОПН, вызванной 45 минутной тепловой ишемией, мезенхимальных и гемопоэтических костномозговых СК приводило к уменьшению летальности с 40 до 5%, причем наиболее выраженный эффект улучшения функции почек на блюдался при совместном введении мезенхимальных и гемопоэтических клеток, в соотношении 1: 5 [C. Westenfelder, 2004].
 Была также исследована возможность терапии ОПН путем фармакологической мобилизации СК из костного мозга и их выхода в системную циркуляцию. Введение крысам с ОПН гранулоцитарного или гранулоцитарно макрофагального колониестимулирующего фактора, факторов стимуляции СК, интерлейкинов или эритропоэтина ускоряло восстановление функции почек [C. Westenfelder, 2004]. Однако в другой работе авторы указывают, что такая терапия не только не улучшала функцию почки, но и утяжеляла степень ОПН и повышала летальность животных [F. Togel, C. Westenfelder]. По мнению этих авторов, негативный эффект связан с сопутствующим повышением количества гранулоцитов в периферической крови и для получения терапевтического эффекта необходимо разработать протокол мобилизации костномозговых СК без сопутствующего гранулоцитоза.
Была также исследована возможность терапии ОПН путем фармакологической мобилизации СК из костного мозга и их выхода в системную циркуляцию. Введение крысам с ОПН гранулоцитарного или гранулоцитарно макрофагального колониестимулирующего фактора, факторов стимуляции СК, интерлейкинов или эритропоэтина ускоряло восстановление функции почек [C. Westenfelder, 2004]. Однако в другой работе авторы указывают, что такая терапия не только не улучшала функцию почки, но и утяжеляла степень ОПН и повышала летальность животных [F. Togel, C. Westenfelder]. По мнению этих авторов, негативный эффект связан с сопутствующим повышением количества гранулоцитов в периферической крови и для получения терапевтического эффекта необходимо разработать протокол мобилизации костномозговых СК без сопутствующего гранулоцитоза.
 Острая почечная недостаточность у больных в критическом состоянии резко утяжеляет прогноз, является независимым, фактором риска смерти и сопровождается высокой летальностью, так как способствует поражению различных систем и органов дисфункции. Нет убедительных данных о возможности эффективной медикаментозной профилактики ОПН у больных в критическом состоянии. Критерии RIFLE — высокочувствительный метод диагностики острого почечного повреждения. Данные критерии достоверно коррелируют с высокой госпитальной легальностью и являются независимыми факторами риска смерти. Анализ многих опубликованных работ позволяет предположить необходимость более раннего начала ЗПТ. В то же время, конкретные критерии раннего начала ЗПТ к настоящему времени не сформулированы. Нет убедительных данных о преимуществе какого либо метода ЗПТ.
Острая почечная недостаточность у больных в критическом состоянии резко утяжеляет прогноз, является независимым, фактором риска смерти и сопровождается высокой летальностью, так как способствует поражению различных систем и органов дисфункции. Нет убедительных данных о возможности эффективной медикаментозной профилактики ОПН у больных в критическом состоянии. Критерии RIFLE — высокочувствительный метод диагностики острого почечного повреждения. Данные критерии достоверно коррелируют с высокой госпитальной легальностью и являются независимыми факторами риска смерти. Анализ многих опубликованных работ позволяет предположить необходимость более раннего начала ЗПТ. В то же время, конкретные критерии раннего начала ЗПТ к настоящему времени не сформулированы. Нет убедительных данных о преимуществе какого либо метода ЗПТ.


 Cкорость КФ(90 140 мл/мин – N ) Формула Кокрофта Голта (140 возраст) * масса тела(кг)/ [креатинина] в сыворотке крови(мкмоль/л). Для мужчин полученный результат умножить на 1, 23. Формула MDRD (Modification Diet in Renal Disease) 186 * [креатинина] / 1, 154 * (возраст) / 0, 203 * 0, 742 (для женщин). Формула Шварца (для детей) 0, 55 * рост / [креатинина]. Интенсивная терапия: национальное руководство: в 2 т. / под ред. Б. Р. Гельфанда, А. И. Салтанова. М. : ГЭОТАР – Медиа, 2011. –Т. I. С. 876.
Cкорость КФ(90 140 мл/мин – N ) Формула Кокрофта Голта (140 возраст) * масса тела(кг)/ [креатинина] в сыворотке крови(мкмоль/л). Для мужчин полученный результат умножить на 1, 23. Формула MDRD (Modification Diet in Renal Disease) 186 * [креатинина] / 1, 154 * (возраст) / 0, 203 * 0, 742 (для женщин). Формула Шварца (для детей) 0, 55 * рост / [креатинина]. Интенсивная терапия: национальное руководство: в 2 т. / под ред. Б. Р. Гельфанда, А. И. Салтанова. М. : ГЭОТАР – Медиа, 2011. –Т. I. С. 876.
 Влияние инфузионной терапии коллоидами на функцию почек: сравнительный обзор I. J. Davidson Статья опубликована в журнале European Journal of Anaesiology 2006; 23: 721 -738
Влияние инфузионной терапии коллоидами на функцию почек: сравнительный обзор I. J. Davidson Статья опубликована в журнале European Journal of Anaesiology 2006; 23: 721 -738
 • В обзор были включены 92 исследования: 23 рандомизированных клинических исследования; 17 нерандомизированных контролируемых клинических исследований; 16 неконтролируемых когортных клинических исследований; 26 клинических случаев или небольшие серии случаев; 10 исследований на модели животных или культуры клеток. • Общее число пациентов в рандомизированных исследованиях составило 1377.
• В обзор были включены 92 исследования: 23 рандомизированных клинических исследования; 17 нерандомизированных контролируемых клинических исследований; 16 неконтролируемых когортных клинических исследований; 26 клинических случаев или небольшие серии случаев; 10 исследований на модели животных или культуры клеток. • Общее число пациентов в рандомизированных исследованиях составило 1377.
 Гидроксиэтилированный крахмал • ГЭК синтезирован путем парциального гидролиза из амилопектина кукурузного крахмала. Составляющие молекулы глюкозы гидроксиэтилированы в положении C 2, C 3 и C 6, чтобы замедлить почечный клиренс и увеличить продолжительность действия. Растворы ГЭК с бoльшим общим замещением и более высоким соотношением замещения C 2 C 6 обычно метаболизируются медленнее.
Гидроксиэтилированный крахмал • ГЭК синтезирован путем парциального гидролиза из амилопектина кукурузного крахмала. Составляющие молекулы глюкозы гидроксиэтилированы в положении C 2, C 3 и C 6, чтобы замедлить почечный клиренс и увеличить продолжительность действия. Растворы ГЭК с бoльшим общим замещением и более высоким соотношением замещения C 2 C 6 обычно метаболизируются медленнее.
 • Примерно 1/3 2/3, введенного ГЭК выделяется с мочой в течение первых 24 часов после инфузии. В течение отсроченного периода немного ГЭК остается в кровотоке, а основная часть накапливается и сохраняется во многих тканях, включая почки. У собак осаждение ГЭК было подтверждено гистопатологией во внутрисосудистом и в интерстициальном пространстве, в паренхиматозных клетках печени, в проксимальных тубулярных клетках почек и в фагоцитах печени, селезенки, лимфатических узлов и в других органах. У крыс период полувыведения ГЭК был определен как равный 7, 2 дня в плазме, 18, 9 дней в почках, 95, 2 дня в сердце, 132 дня в печени, 64 дня в селезенке и 50 дней в мышцах.
• Примерно 1/3 2/3, введенного ГЭК выделяется с мочой в течение первых 24 часов после инфузии. В течение отсроченного периода немного ГЭК остается в кровотоке, а основная часть накапливается и сохраняется во многих тканях, включая почки. У собак осаждение ГЭК было подтверждено гистопатологией во внутрисосудистом и в интерстициальном пространстве, в паренхиматозных клетках печени, в проксимальных тубулярных клетках почек и в фагоцитах печени, селезенки, лимфатических узлов и в других органах. У крыс период полувыведения ГЭК был определен как равный 7, 2 дня в плазме, 18, 9 дней в почках, 95, 2 дня в сердце, 132 дня в печени, 64 дня в селезенке и 50 дней в мышцах.
 • Есть сообщение о случае почечной недостаточности с доказанным при биопсии осмотическим нефрозоподобным нарушением, связанным с введением ГЭК у 20 летнего мужчины с полиомиозитом и циррозом печени. 2002. • Риск осложнений может повышаться при повторных дозах ГЭК, что приводит к замедленному клиренсу ГЭК. После повторяющихся инфузий период полувыведения ГЭК замедляется, базисная концентрация ГЭК в плазме растет.
• Есть сообщение о случае почечной недостаточности с доказанным при биопсии осмотическим нефрозоподобным нарушением, связанным с введением ГЭК у 20 летнего мужчины с полиомиозитом и циррозом печени. 2002. • Риск осложнений может повышаться при повторных дозах ГЭК, что приводит к замедленному клиренсу ГЭК. После повторяющихся инфузий период полувыведения ГЭК замедляется, базисная концентрация ГЭК в плазме растет.
 • Острая почечная недостаточность развилась после эпидуральной анестезии в родах и после кесарева сечения у 2 женщин. Одна из женщин получила 500 мл ГЭК 70/0, 5 с низкой молекулярной массой интраоперационно, в то время как объем введенного раствора у второй женщины составил 1000 мл.
• Острая почечная недостаточность развилась после эпидуральной анестезии в родах и после кесарева сечения у 2 женщин. Одна из женщин получила 500 мл ГЭК 70/0, 5 с низкой молекулярной массой интраоперационно, в то время как объем введенного раствора у второй женщины составил 1000 мл.
 • Французская группа исследователей сообщила о доказательствах, что применение ГЭК у доноров «со смертью мозга» связано с осмотически подобными повреждениями как в проксимальных, так и в дистальных почечных канальцах.
• Французская группа исследователей сообщила о доказательствах, что применение ГЭК у доноров «со смертью мозга» связано с осмотически подобными повреждениями как в проксимальных, так и в дистальных почечных канальцах.
 • Более высокие послеоперационные уровни креатинина после трансплантации почек были показаны применении ГЭК с высокой, по сравнению со средней, молекулярной массой ГЭК. С другой стороны, доказательства ранней почечной недостаточности после большой абдоминальной операции отмечались у реципиентов низкой, а не средней молекулярной массы ГЭК. Более того, неблагоприятное влияние на функцию почек отмечалось у больных, получавших ГЭК с молекулярной массой 70, 130, 200, 450 и 670 к. Да, замещениями 0, 4, 0, 5, 0, 62, 0, 7 и 0, 75, соотношением C 2/C 6 4, 4, 6, 5 и 9. Таким образом, уже описаны неблагоприятные эффекты ГЭК на почки для всего спектра имеющейся молекулярной массы, замещения и соотношения C 2/C 6. Следовательно, эмпирические данные поддерживают спор Riou и Cittanova, что «новые крахмалы есть и будут предлагаться в будущем, но сейчас нет доказательств, что они будут лишены таких же эффектов на почки» .
• Более высокие послеоперационные уровни креатинина после трансплантации почек были показаны применении ГЭК с высокой, по сравнению со средней, молекулярной массой ГЭК. С другой стороны, доказательства ранней почечной недостаточности после большой абдоминальной операции отмечались у реципиентов низкой, а не средней молекулярной массы ГЭК. Более того, неблагоприятное влияние на функцию почек отмечалось у больных, получавших ГЭК с молекулярной массой 70, 130, 200, 450 и 670 к. Да, замещениями 0, 4, 0, 5, 0, 62, 0, 7 и 0, 75, соотношением C 2/C 6 4, 4, 6, 5 и 9. Таким образом, уже описаны неблагоприятные эффекты ГЭК на почки для всего спектра имеющейся молекулярной массы, замещения и соотношения C 2/C 6. Следовательно, эмпирические данные поддерживают спор Riou и Cittanova, что «новые крахмалы есть и будут предлагаться в будущем, но сейчас нет доказательств, что они будут лишены таких же эффектов на почки» .
 Желатин • Имеющиеся в клинической практике растворы желатина готовятся путем гидролиза бычьего коллагена с последующим сукцинилированием или связыванием с мочевиной.
Желатин • Имеющиеся в клинической практике растворы желатина готовятся путем гидролиза бычьего коллагена с последующим сукцинилированием или связыванием с мочевиной.
 • Назначение 2 л желатина после операции аорто бифеморального шунтирования было связано с развитием длительной почечной недостаточности. При исследовании 112 больных из отделения ИТ, частота острой почечной недостаточности у пациентов случайно отобранных для внутривенной инфузии желатина составила 18, 6% при сравнении с 9, 4% в группе, получившей 4, 5% альбумин, хотя различие не имело статистической значимости ( P = 0, 19).
• Назначение 2 л желатина после операции аорто бифеморального шунтирования было связано с развитием длительной почечной недостаточности. При исследовании 112 больных из отделения ИТ, частота острой почечной недостаточности у пациентов случайно отобранных для внутривенной инфузии желатина составила 18, 6% при сравнении с 9, 4% в группе, получившей 4, 5% альбумин, хотя различие не имело статистической значимости ( P = 0, 19).
 • Применение желатина в качестве наполняющего раствора искусственного круга кровообращения во время ОШКА снижало интраоперационный диурез ( P < 0, 05) и повышало послеоперационный уровень креатинина сыворотки ( P < 0, 05) по сравнению с наполнением альбумином в рандомизированном исследовании 105 пациентов.
• Применение желатина в качестве наполняющего раствора искусственного круга кровообращения во время ОШКА снижало интраоперационный диурез ( P < 0, 05) и повышало послеоперационный уровень креатинина сыворотки ( P < 0, 05) по сравнению с наполнением альбумином в рандомизированном исследовании 105 пациентов.
 Декстран • Состоящий из природных полимеров глюкозы , декстран синтезируется бактерией Leuconostoc mesenteroides растущей в средней оболочке , которая содержит сахарозу. Сообщения о случаях описывают более чем 60 больных, у которых после применения декстрана 40 развилась острая почечная недостаточность. Острая почечная недостаточность, связанная с инфузией декстрана 40, встречалась в 4, 7% из 211 больных с острым ишемическим инсультом. Для устранения эффектов декстрана мог потребоваться плазмаферез.
Декстран • Состоящий из природных полимеров глюкозы , декстран синтезируется бактерией Leuconostoc mesenteroides растущей в средней оболочке , которая содержит сахарозу. Сообщения о случаях описывают более чем 60 больных, у которых после применения декстрана 40 развилась острая почечная недостаточность. Острая почечная недостаточность, связанная с инфузией декстрана 40, встречалась в 4, 7% из 211 больных с острым ишемическим инсультом. Для устранения эффектов декстрана мог потребоваться плазмаферез.
 • В исследовании по данным наблюдений 15 пациентов после абдоминальной операции инфузия желатина привела к протеинурии ( P < 0, 05) и β 2 микроглобулинурии ( P < 0, 05).
• В исследовании по данным наблюдений 15 пациентов после абдоминальной операции инфузия желатина привела к протеинурии ( P < 0, 05) и β 2 микроглобулинурии ( P < 0, 05).
 • Острая анурия может быть результатом осаждения декстрана или гипервязкости в канальцевом фильтрате с последующим удлинением периода полувыведения декстрана и дальнейшим усилением эффекта.
• Острая анурия может быть результатом осаждения декстрана или гипервязкости в канальцевом фильтрате с последующим удлинением периода полувыведения декстрана и дальнейшим усилением эффекта.
 Альбумин • Процесс фракционирования охлажденным этанолом по Cohn используется для очищения альбумина от плазмы. Фракционат пастеризуется для инактивации инфекционных веществ. Инфузия альбумина увеличивает объем крови, почечный кровоток и скорость клубочковой фильтрации. • В норме почки постоянно перфузируются кровью, содержащей среднюю концентрацию 42 г / л альбумина.
Альбумин • Процесс фракционирования охлажденным этанолом по Cohn используется для очищения альбумина от плазмы. Фракционат пастеризуется для инактивации инфекционных веществ. Инфузия альбумина увеличивает объем крови, почечный кровоток и скорость клубочковой фильтрации. • В норме почки постоянно перфузируются кровью, содержащей среднюю концентрацию 42 г / л альбумина.
 • Имеются доказательства безопасности альбумина, особенно у пациентов с предшествующей почечной дисфункцией, включая подтверждения при трансплантации почек. Например, инфузия альбумина у больных с поражением гломерулярного аппарата почек и протеинурией не влияет на экскрецию β 2 MG , чувствительного маркера канальцевого повреждения.
• Имеются доказательства безопасности альбумина, особенно у пациентов с предшествующей почечной дисфункцией, включая подтверждения при трансплантации почек. Например, инфузия альбумина у больных с поражением гломерулярного аппарата почек и протеинурией не влияет на экскрецию β 2 MG , чувствительного маркера канальцевого повреждения.
 • Исключая передозировку, альбумин, как оказалось, лишен неблагоприятных почечных эффектов. • У пациентов с предшествующей почечной дисфункцией эндогенный сывороточный альбумин играет защитную роль. Таким образом, при мета анализе 37 клинических исследований, охватывающих в общей сложности 158795 больных с почечной дисфункцией, сниженный уровень альбумина сыворотки был независимым прогностическим критерием как смертности, так и заболеваемости.
• Исключая передозировку, альбумин, как оказалось, лишен неблагоприятных почечных эффектов. • У пациентов с предшествующей почечной дисфункцией эндогенный сывороточный альбумин играет защитную роль. Таким образом, при мета анализе 37 клинических исследований, охватывающих в общей сложности 158795 больных с почечной дисфункцией, сниженный уровень альбумина сыворотки был независимым прогностическим критерием как смертности, так и заболеваемости.
 • Наиболее убедительные доказательства благоприятных почечных эффектов вследствие назначения альбумина были найдены в условиях трансплантации почек. • В исследовании 100 последовательных пациентов с трансплантатом почки, получавших во время операции альбумин и солевой раствор для поддержания давления на легочных артериях на уровне 25 28 мм. рт. ст. , ранний диурез был достигнут в 95% случаев.
• Наиболее убедительные доказательства благоприятных почечных эффектов вследствие назначения альбумина были найдены в условиях трансплантации почек. • В исследовании 100 последовательных пациентов с трансплантатом почки, получавших во время операции альбумин и солевой раствор для поддержания давления на легочных артериях на уровне 25 28 мм. рт. ст. , ранний диурез был достигнут в 95% случаев.
 • Как и альбумин, блокатор кальциевых каналов верапамил может усиливать кровоток в почках, улучшать выживаемость трансплантата и повышать частоту раннего восстановления функции трансплантата. • В рандомизированных исследованиях было выявлено, что альбумин лучше сохраняет почечную функцию, чем растворы кристаллоидов, ГЭК и желатина.
• Как и альбумин, блокатор кальциевых каналов верапамил может усиливать кровоток в почках, улучшать выживаемость трансплантата и повышать частоту раннего восстановления функции трансплантата. • В рандомизированных исследованиях было выявлено, что альбумин лучше сохраняет почечную функцию, чем растворы кристаллоидов, ГЭК и желатина.
 • Почечная безопасность альбумина подтверждена даже у больных с предшествующим нарушением функции почек длительным успешным применением этого естественного коллоида при нефротическом синдроме. Тем не менее, следует избегать передозировку альбумина.
• Почечная безопасность альбумина подтверждена даже у больных с предшествующим нарушением функции почек длительным успешным применением этого естественного коллоида при нефротическом синдроме. Тем не менее, следует избегать передозировку альбумина.


