Крист.белков_1.ppt
- Количество слайдов: 69

http: //www. ruppweb. org/Xray/101 index. html http: //www-structmed. cimr. cam. ac. uk/Course/ http: //nanoschool. jinr. ru/2008/inc/pdf/Melik-Adamyan. pdf

Рентгеноструктурный анализ белков
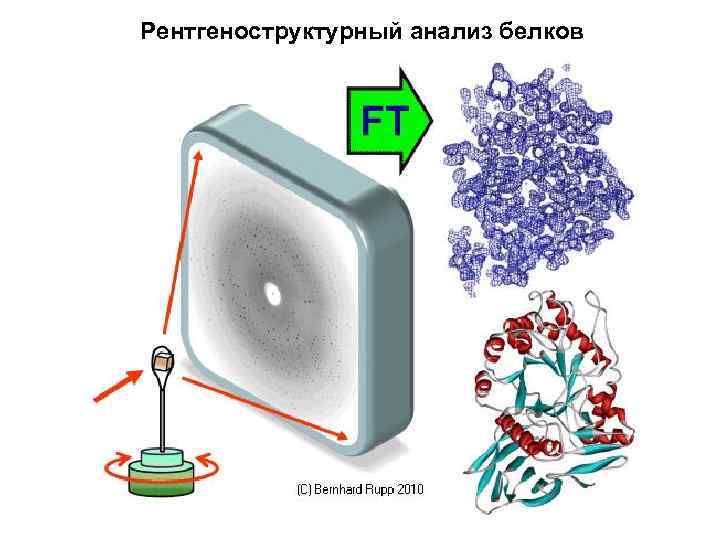
Рентгеноструктурный анализ белков

A THREE-DIMENSIONAL MODEL OF THE MYOGLOBIN MOLECULE OBTAINED BY X-RAY ANALYSYS Nature 181 (4610) 662 -6, 1958 Mar 8 Джон Кендрью с моделью молекулы миоглобина
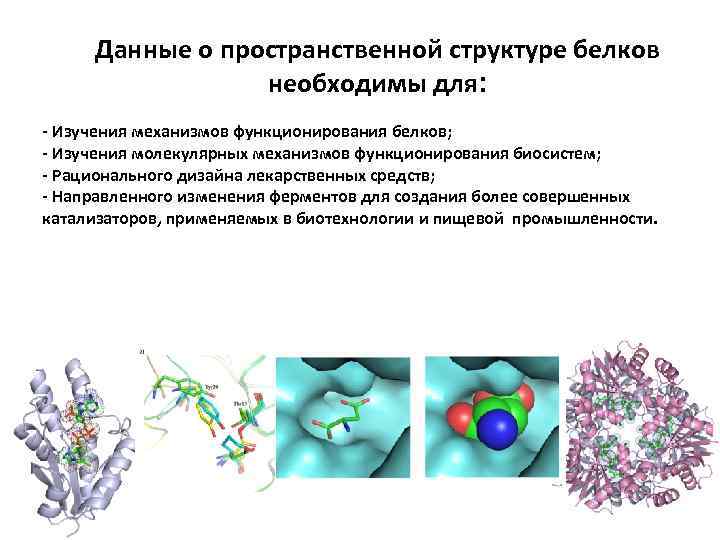
Данные о пространственной структуре белков необходимы для: - Изучения механизмов функционирования белков; - Изучения молекулярных механизмов функционирования биосистем; - Рационального дизайна лекарственных средств; - Направленного изменения ферментов для создания более совершенных катализаторов, применяемых в биотехнологии и пищевой промышленности.
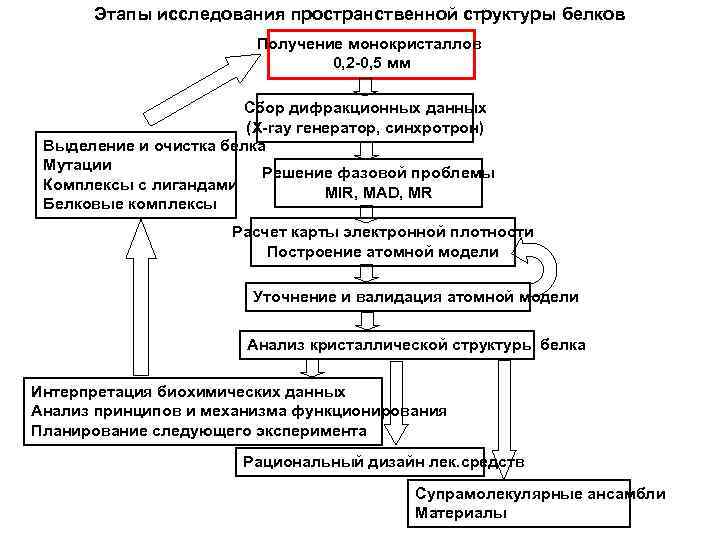
Этапы исследования пространственной структуры белков Получение монокристаллов 0, 2 -0, 5 мм Сбор дифракционных данных (X-ray генератор, синхротрон) Выделение и очистка белка Мутации Решение фазовой проблемы Комплексы с лигандами MIR, MAD, MR Белковые комплексы Расчет карты электронной плотности Построение атомной модели Уточнение и валидация атомной модели Анализ кристаллической структуры белка Интерпретация биохимических данных Анализ принципов и механизма функционирования Планирование следующего эксперимента Рациональный дизайн лек. средств Супрамолекулярные ансамбли Материалы

ЛЕКЦИЯ 1. КРИСТАЛЛИЗАЦИЯ БЕЛКОВ Кристаллы белков, особенности их строения и роста. Методы получения белковых кристаллов

. Первые кристаллы белков: А. Хунфельд, 1840 год – кристаллы гемоглобина червя Дж. Самнер, 1926 год Кристаллы уреазы Дж. Бернал, Д. Кроуфорд-Хочкин, 1934 год Кристаллы пепсина М. Перутц, 1954 год Решение фазовой проблемы в белках Дж. Кендрью, 1958 год Решение пространственной структуры миоглобина.
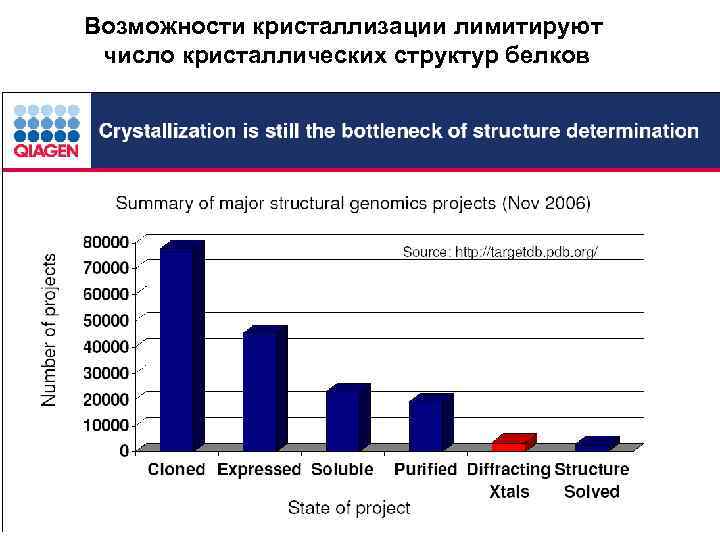
Возможности кристаллизации лимитируют число кристаллических структур белков


http: //nanoschool. jinr. ru/2008/inc/pdf/Melik-Adamyan. pdf

ОСОБЕННОСТИ БЕЛКОВЫХ МОЛЕКУЛ, усложняющие их кристаллизацию - Доступны в малых количествах - Высокий молекулярный вес ( 5 -100 к. Dа) - Ограниченная стабильность (устойчивость только в водносолевых растворах в ограниченном интервале р. Н и температур) - Геометрически и электростатически сложный рельеф поверхности с переменной величиной заряда - Склонность к агрегации при концентрировании - Денатурация под действием реагентов, разрушающих водородные связи или гидрофобные взаимодействия. - Молекулы конформационно подвижны - Способность образовывать не только кристаллические, но и аморфные осадки - Доменное строение
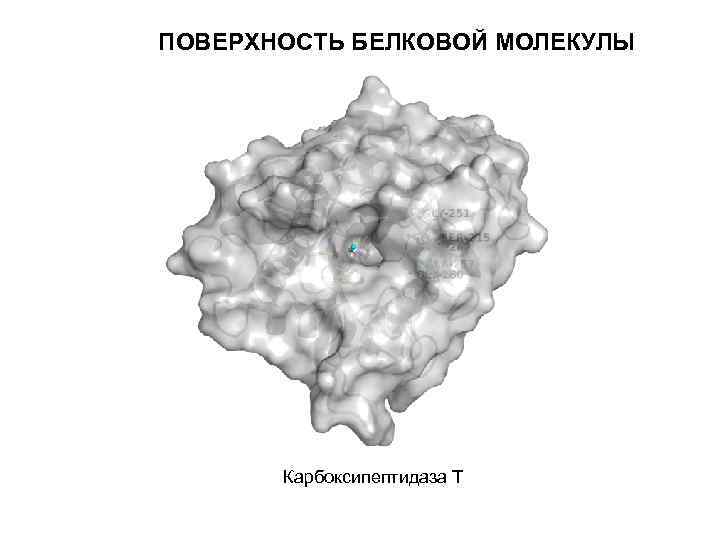
ПОВЕРХНОСТЬ БЕЛКОВОЙ МОЛЕКУЛЫ Карбоксипептидаза Т
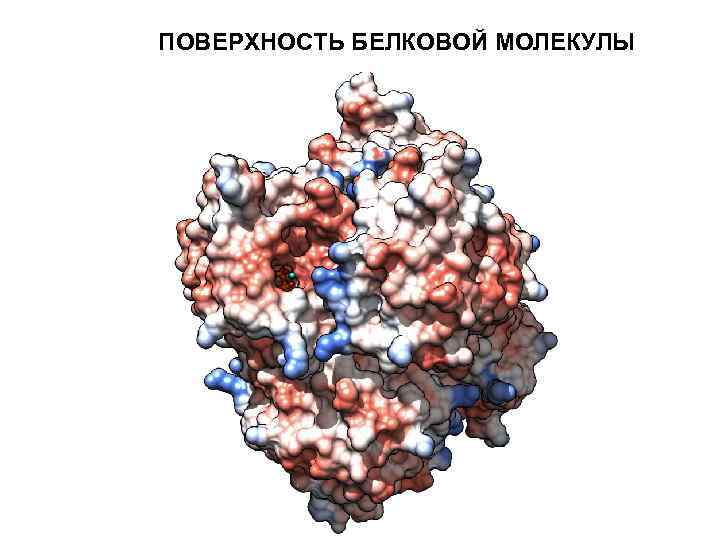
ПОВЕРХНОСТЬ БЕЛКОВОЙ МОЛЕКУЛЫ

Кристаллическое состояние белка: 1. Кристаллы белков – массивы биологических молекул, которые характеризуются упорядоченностью и периодичностью в трехмерном пространстве. Кристалл построен из периодически повторяющихся единиц. Периодически повторяющаяся структура построена путем размножения некой элементарной единицы посредством операций кристаллографической симметрии. 2. Симметрия является наиболее характерным признаком кристалла. Внешнее отражение симметрии – огранка кристалла. 1. Кристалл имеет хорошо выраженные ребра и грани, расположение которых подчиняется определенной симметрии. Плоские грани кристалла – следствие послойного периодического расположения молекул в кристалле. 2. 3. Белковый кристалл как материал имеет молекулярную природу. 3. ! Белок в кристалле имеет (нативную) укладку! (т. е. не денатурирован). 4. Молекулы белков в кристалле взаимодействуют нековалентно (ионные, гидрофобные, водородные, Ван-дер-Ваальсовы связи,
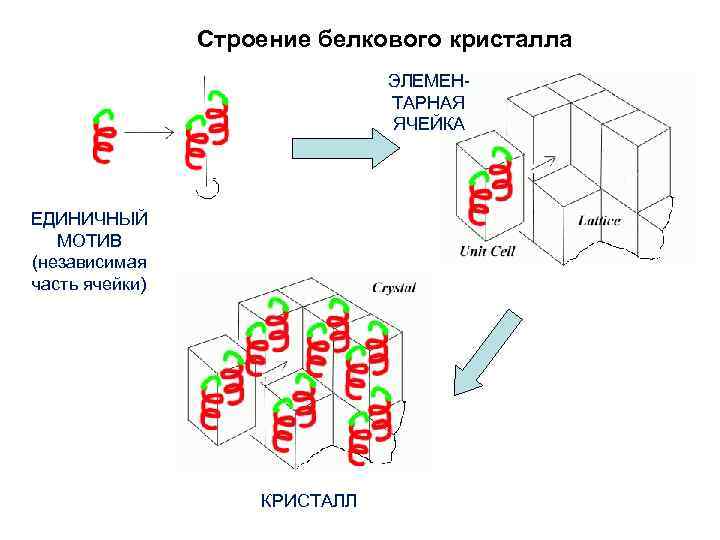
Строение белкового кристалла ЭЛЕМЕНТАРНАЯ ЯЧЕЙКА ЕДИНИЧНЫЙ МОТИВ (независимая часть ячейки) КРИСТАЛЛ
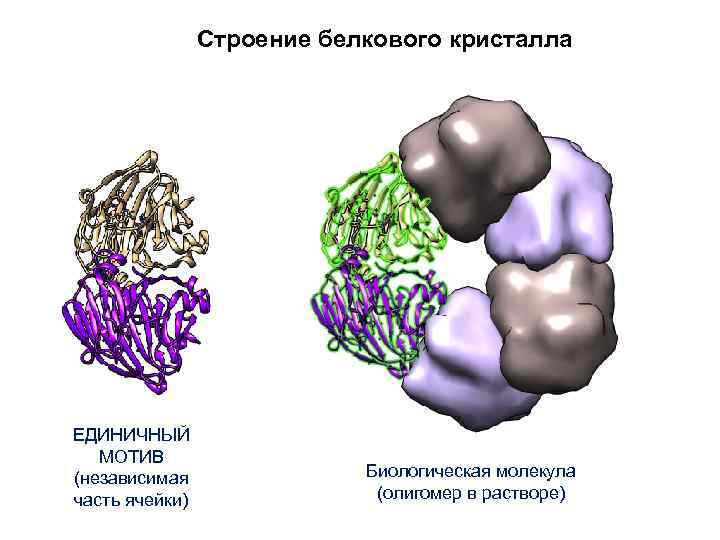
Строение белкового кристалла ЕДИНИЧНЫЙ МОТИВ (независимая часть ячейки) Биологическая молекула (олигомер в растворе)
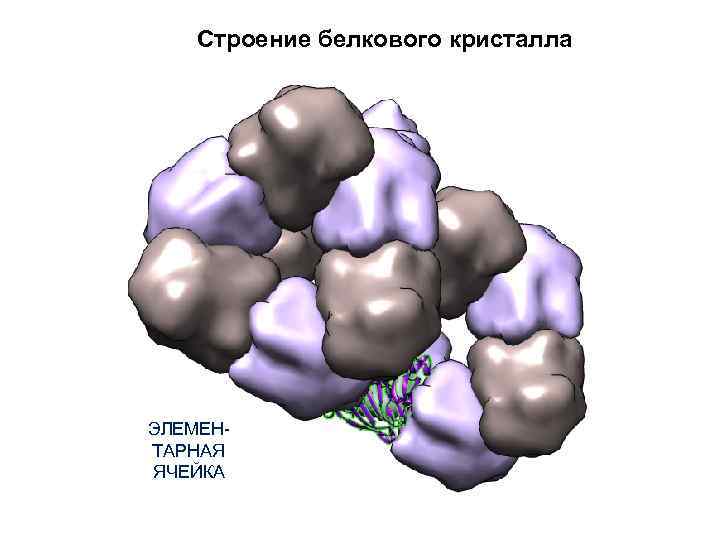
Строение белкового кристалла ЭЛЕМЕНТАРНАЯ ЯЧЕЙКА
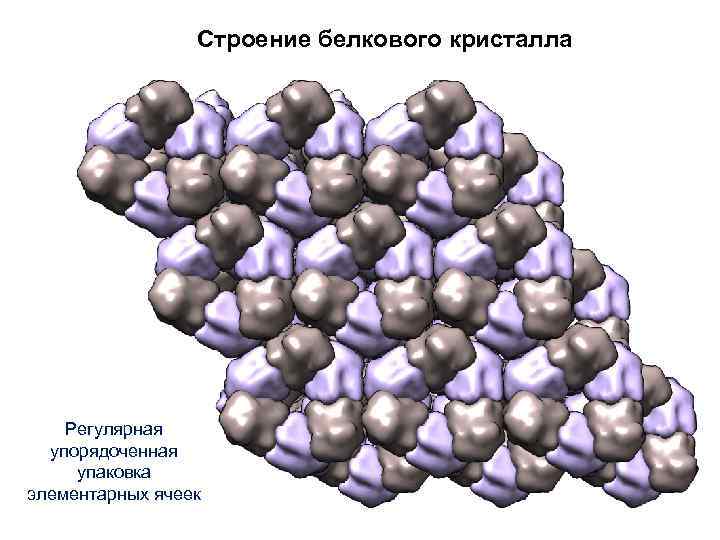
Строение белкового кристалла Регулярная упорядоченная упаковка элементарных ячеек

Строение белкового кристалла КРИСТАЛЛ
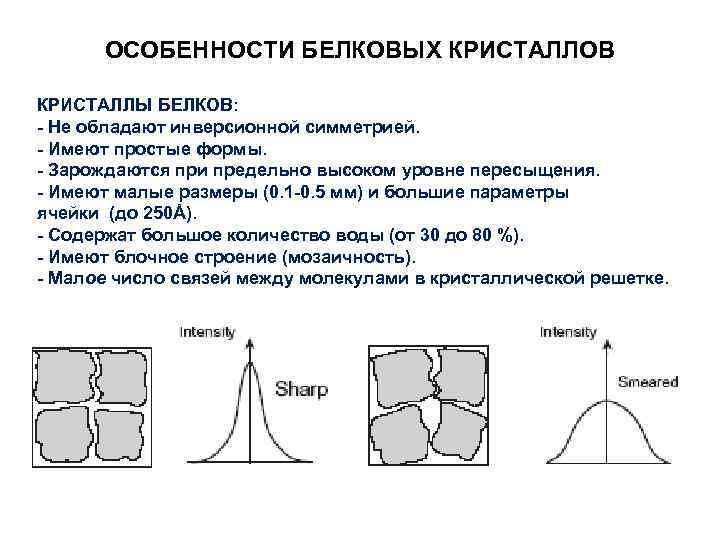
ОСОБЕННОСТИ БЕЛКОВЫХ КРИСТАЛЛОВ КРИСТАЛЛЫ БЕЛКОВ: - Не обладают инверсионной симметрией. - Имеют простые формы. - Зарождаются при предельно высоком уровне пересыщения. - Имеют малые размеры (0. 1 -0. 5 мм) и большие параметры ячейки (до 250Å). - Содержат большое количество воды (от 30 до 80 %). - Имеют блочное строение (мозаичность). - Малое число связей между молекулами в кристаллической решетке.
Строение белкового кристалла
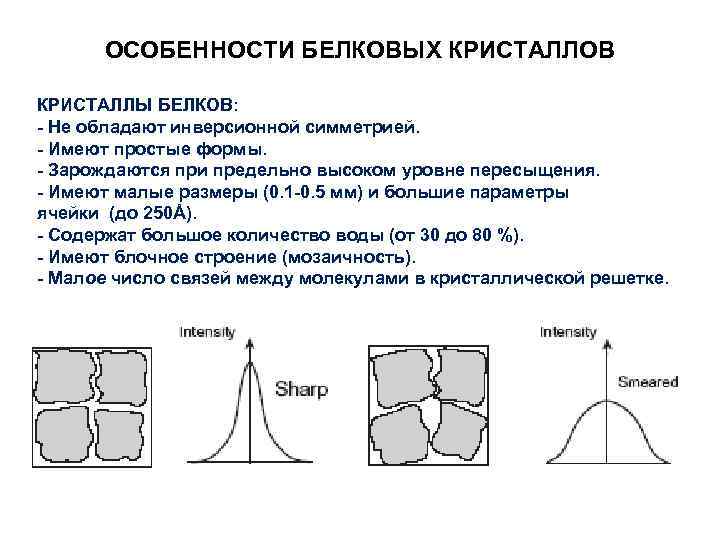
ОСОБЕННОСТИ БЕЛКОВЫХ КРИСТАЛЛОВ КРИСТАЛЛЫ БЕЛКОВ: - Не обладают инверсионной симметрией. - Имеют простые формы. - Зарождаются при предельно высоком уровне пересыщения. - Имеют малые размеры (0. 1 -0. 5 мм) и большие параметры ячейки (до 250Å). - Содержат большое количество воды (от 30 до 80 %). - Имеют блочное строение (мозаичность). - Малое число связей между молекулами в кристаллической решетке.

Кристаллы разной формы для одного белка
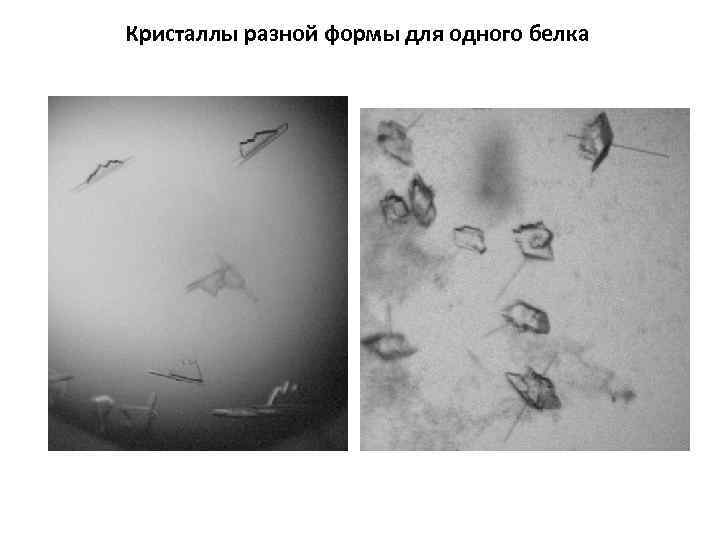
Кристаллы разной формы для одного белка
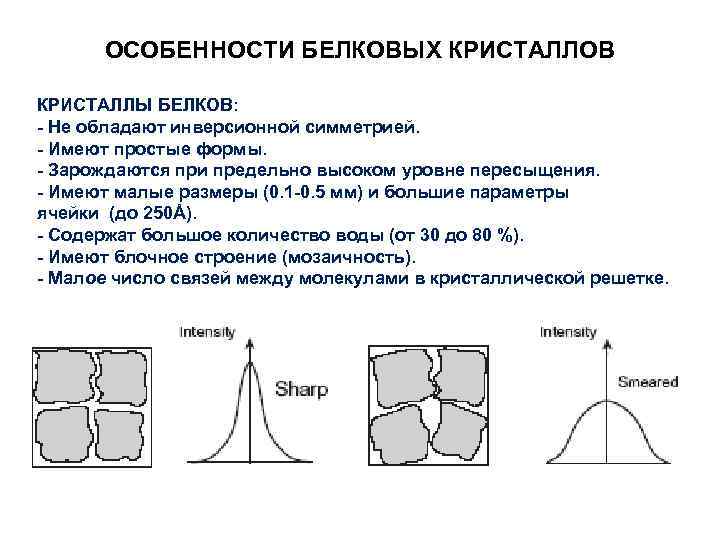
ОСОБЕННОСТИ БЕЛКОВЫХ КРИСТАЛЛОВ КРИСТАЛЛЫ БЕЛКОВ: - Не обладают инверсионной симметрией. - Имеют простые формы. - Зарождаются при предельно высоком уровне пересыщения. - Имеют малые размеры (0. 1 -0. 5 мм) и большие параметры ячейки (до 250Å). - Содержат большое количество воды (от 30 до 80 %). - Имеют блочное строение (мозаичность). - Малое число связей между молекулами в кристаллической решетке.
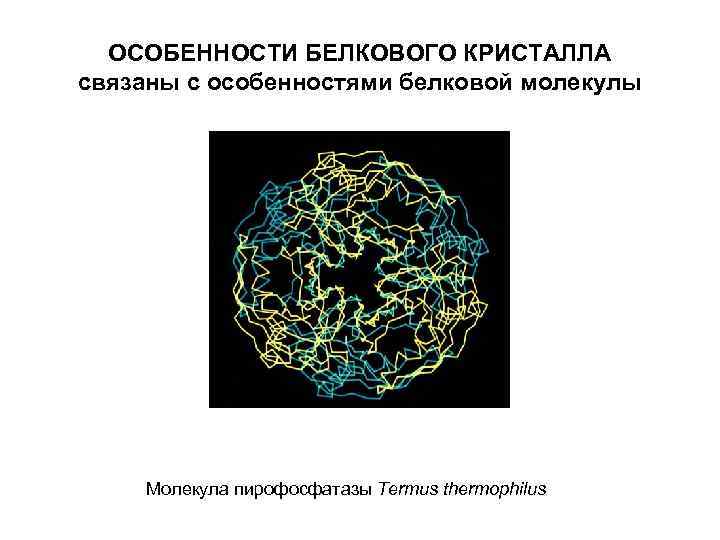
ОСОБЕННОСТИ БЕЛКОВОГО КРИСТАЛЛА связаны с особенностями белковой молекулы Молекула пирофосфатазы Тermus thermophilus

ОСОБЕННОСТИ БЕЛКОВОГО КРИСТАЛЛА связаны с особенностями белковой молекулы Кристаллы пирофосфатазы Тermus thermophilus

ДВИЖУЩИЕ СИЛЫ КРИСТАЛЛИЗАЦИИ С/Сs – cтепень пересыщения, где С – текущая концентрация вещества; Сs – растворимость. При С/Сs > 1 – пересыщение (неравновесные условия). Фазовое разделение, динамическое равновесие между белком в растворе и твердой фазе. При кристаллизации происходит: потеря вращательных и поступательных степеней свободы Суммарный эффект - появление новых связей свободной энергии системы

КРИСТАЛЛИЗАЦИЯ – ЭТО КИНЕТИЧЕСКИ КОНТРОЛИРУЕМОЕ ОБРАТИМОЕ ОСАЖДЕНИЕ БЕЛКА. ОСНОВНОЕ УСЛОВИЕ ОСАЖДЕНИЯ: ПЕРЕСЫЩЕНИЕ РАСТВОРА ПО БЕЛКУ. ОСНОВНОЙ ПРИЕМ КРИСТАЛЛИЗАЦИИ: постепенное изменение параметров раствора от недосыщенного к пересыщенному. ОСНОВНЫЕ ПАРАМЕТРЫ, ОПРЕДЕЛЯЮЩИЕ РАСТВОРИМОСТЬ БЕЛКОВ: - температура - р. Н - концентрация осадителя (солевого или органического) СТАНДАРТНЫЙ СОСТАВ КРИСТАЛЛИЗАЦИОННОЙ СМЕСИ: Белок + буфер + осадитель + добавки Между кристаллом и крист. смесью существует гетерогенное равновесие. Белок должен быть стабилен в кристаллизационной смеси (без агрегации, денатурации, деградации и пр. )

ОСНОВНЫЕ ОСАДИТЕЛИ ДЛЯ БЕЛКОВ Соли Органические растворители Сульфат аммония Сульфат лития Хлорид натрия Формиат натрия Хлорид магния Хлорид аммония Ацетат натрия И Т. Д. Органические полимеры МПД Полиэтиленгликоли Диоксан разного молекулярного Изопропанол веса Этанол Ацетонитрил Диметилсульфоксид Низкомолекулярные добавки при кристаллизации Ионы металлов, аналоги субстратов, коферменты, ингибиторы, полиамины и др.
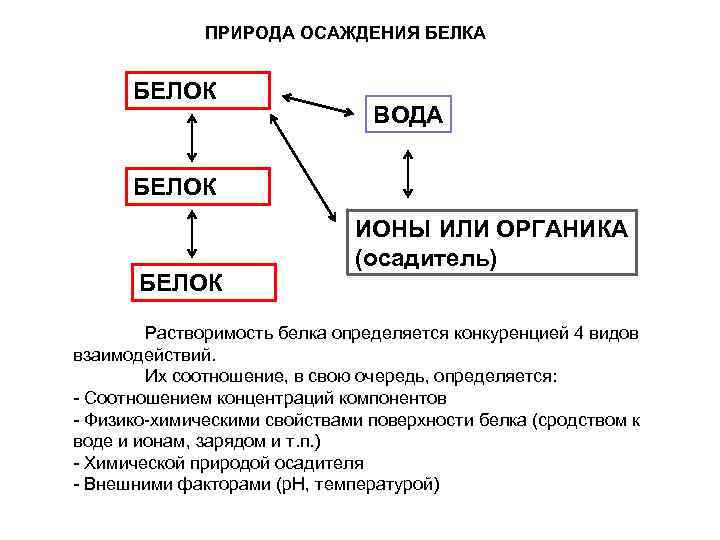
ПРИРОДА ОСАЖДЕНИЯ БЕЛКА БЕЛОК ВОДА БЕЛОК ИОНЫ ИЛИ ОРГАНИКА (осадитель) Растворимость белка определяется конкуренцией 4 видов взаимодействий. Их соотношение, в свою очередь, определяется: - Соотношением концентраций компонентов - Физико-химическими свойствами поверхности белка (сродством к воде и ионам, зарядом и т. п. ) - Химической природой осадителя - Внешними факторами (р. Н, температурой)

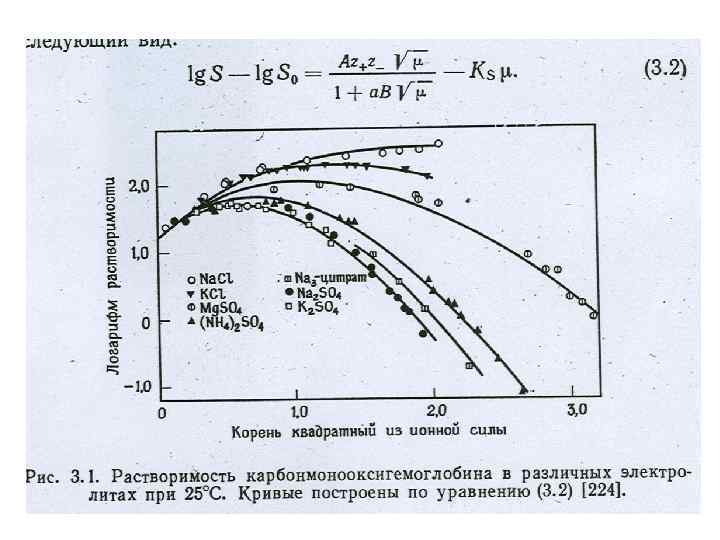
ПРИРОДА ОСАЖДЕНИЯ БЕЛКА ИОННАЯ СИЛА раствора: μ= ½ ΣСj. Zj 2 ПРИ НИЗКОЙ ИОННОЙ СИЛЕ – УВЕЛИЧЕНИЕ РАСТВОРИМОСТИ (ЭФФЕКТ ВСАЛИВАНИЯ) ПОЧЕМУ ? ПРИ ВЫСОКОЙ ИОННОЙ СИЛЕ – УМЕНЬШЕНИЕ РАСТВОРИМОСТИ (ЭФФЕКТ ВЫСАЛИВАНИЯ) РЯД ХОФМЕЙСТЕРА: PO 43 - > SO 42 - > COO- > Cl-+ Li+ > NH 4 > Na+ > K+
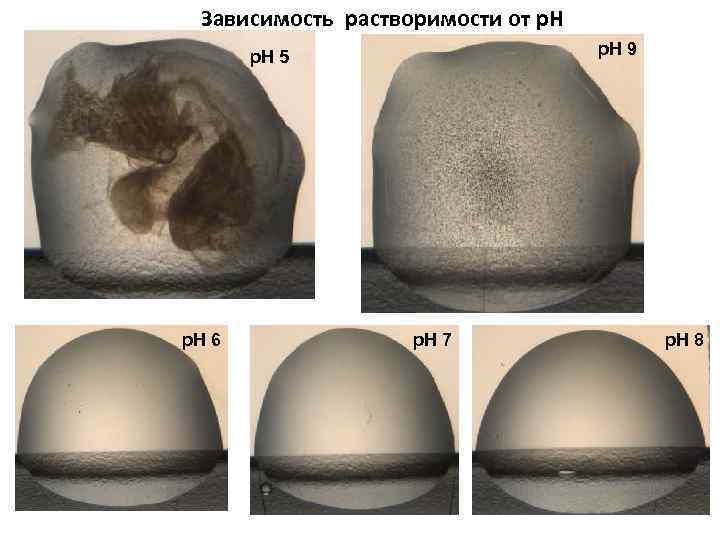
Зависимость растворимости от р. Н p. H 9 p. H 5 p. H 6 p. H 7 p. H 8

НАБОРЫ РЕАГЕНТОВ ДЛЯ КРИСТАЛЛИЗАЦИИ БЕЛКОВ (СКРИНЫ)

РОБОТЫ ДЛЯ КРИСТАЛЛИЗАЦИИ БЕЛКОВ Робот для скрининга условий кристаллизации, просмотра и отбора кристаллов белков Лабораторный робот для скрининга условий кристаллизации

МЕХАНИЗМ КРИСТАЛЛИЗАЦИИ 1. НУКЛЕАЦИЯ С>>Сs 2. ПОСТНУКЛЕАЦИОННЫЙ РОСТ С>Сs 3. ОСТАНОВКА РОСТА С=Сs
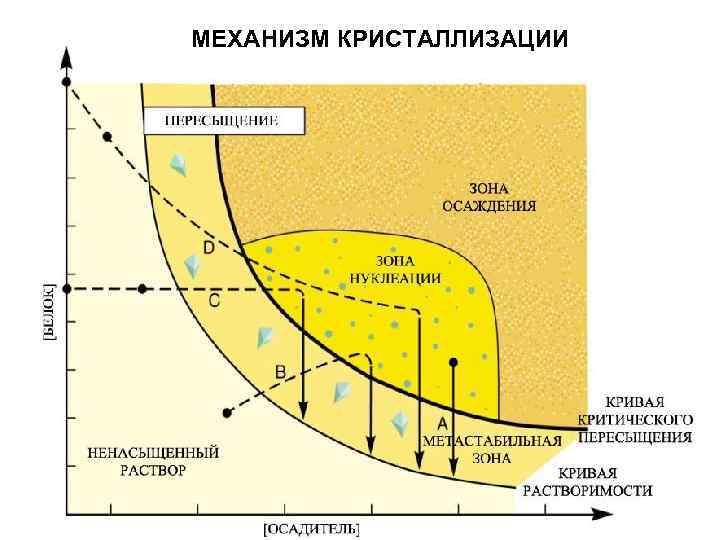
МЕХАНИЗМ КРИСТАЛЛИЗАЦИИ

МЕХАНИЗМ РОСТА КРИСТАЛЛОВ МЕХАНИЗМ РОСТА ПОСРЕДСТВОМ СПИРАЛЬНЫХ ДИСЛОКАЦИЙ Рост происходит путем образования молекулярных слоев, параллельных граням кристалла, имеющим наибольшую плотность заселения молекулами

МЕХАНИЗМ РОСТА КРИСТАЛЛОВ Механизм роста посредством двумерной нуклеации Преобладающий механизм – образование двумерных зародышей и их латеральное распространение

МЕХАНИЗМ РОСТА КРИСТАЛЛОВ Механизм роста добавлением трехмерных зародышей Кристаллик включается в большой кристалл, сливаясь с ним без образования дефектов. Такой механизм не наблюдается для обычных молекул – рост добавлением трехмерных зародышей.

МЕТОДЫ ПОЛУЧЕНИЯ БЕЛКОВЫХ КРИСТАЛЛОВ
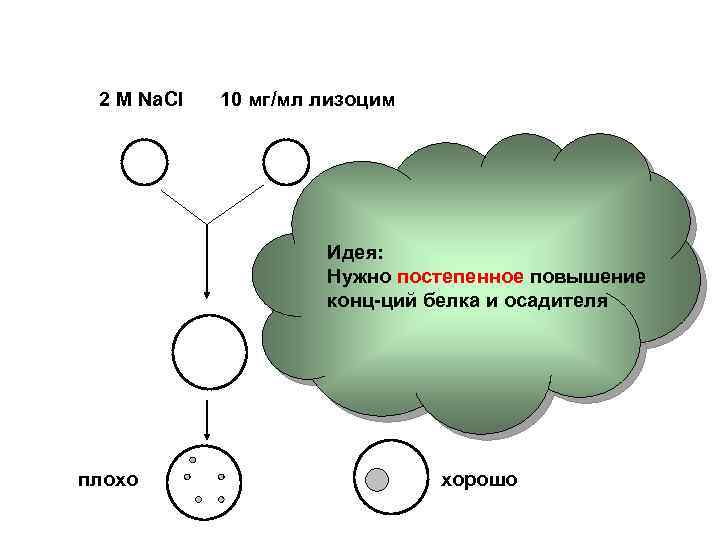
2 M Na. Cl 10 мг/мл лизоцим Идея: Нужно постепенное повышение конц-ций белка и осадителя плохо хорошо

ОСНОВНЫЕ МЕТОДЫ КРИСТАЛЛИЗАЦИИ БЕЛКОВ: • КРИСТАЛЛИЗАЦИЯ ПОРЦИЯМИ В ОБЪЕМЕ • ДИФФУЗИЯ ПАРОВ РАСТВОРИТЕЛЯ • СВОБОДНАЯ ДИФФУЗИЯ ЧЕРЕЗ ПОВЕРХНОСТЬ РАЗДЕЛА РАСТВОР БЕЛКА/РАСТВОР ОСАДИТЕЛЯ • ДИАЛИЗ ЧЕРЕЗ МЕМБРАНУ МЕЖДУ РАСТВОРОМ БЕЛКА И РАСТВОРОМ ОСАДИТЕЛЯ • КРИСТАЛЛИЗАЦИЯ ПОД СЛОЕМ МАСЛА • КРИСТАЛЛИЗАЦИЯ В УСЛОВИЯХ МИКРОГРАВИТАЦИИ • КРИСТАЛЛИЗАЦИЯ В ГЕЛЕ МЕТОДОМ ВСТРЕЧНОЙ ДИФФУЗИИ • КРИСТАЛЛИЗАЦИЯ С ИСПОЛЬЗОВАНИЕМ МИКРОФЛУИДНОЙ ТЕХНИКИ В ЧИПАХ • КРИСТАЛЛИЗАЦИЯ В ЦЕНТРИФУГЕ • КРИСТАЛЛИЗАЦИЯ НА ПОВЕРХНОСТИ ПЛЕНКИ
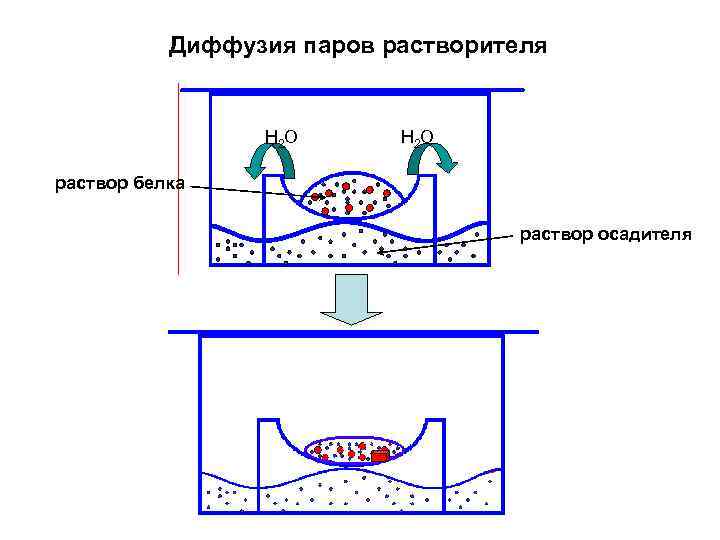
Диффузия паров растворителя H 2 O раствор белка раствор осадителя
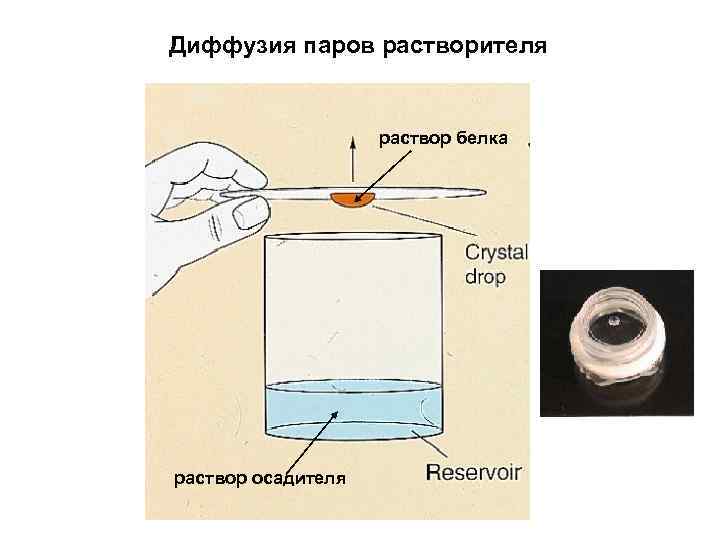
Диффузия паров растворителя раствор белка раствор осадителя
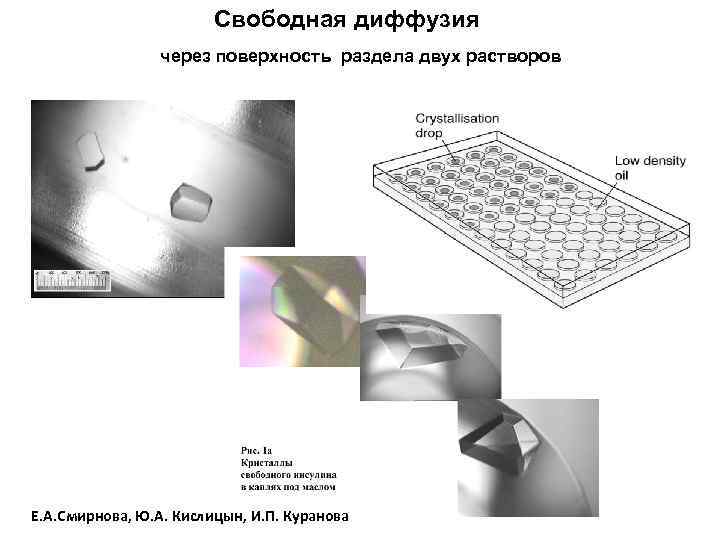
Свободная диффузия через поверхность раздела двух растворов Е. А. Cмирнова, Ю. А. Кислицын, И. П. Куранова
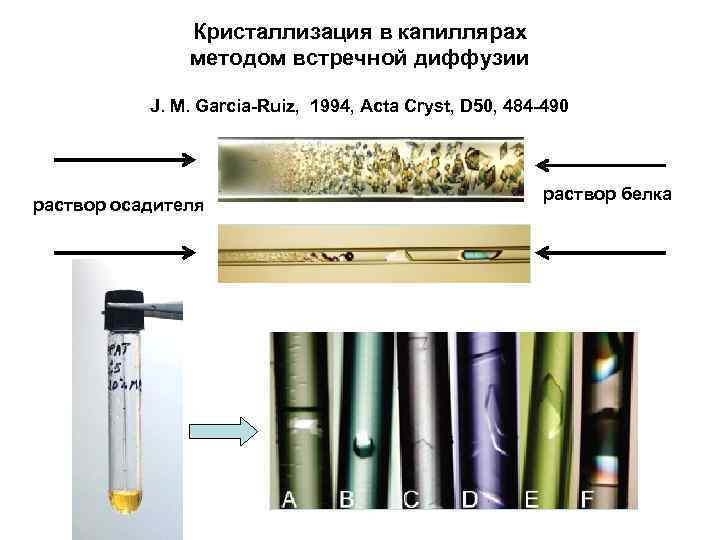
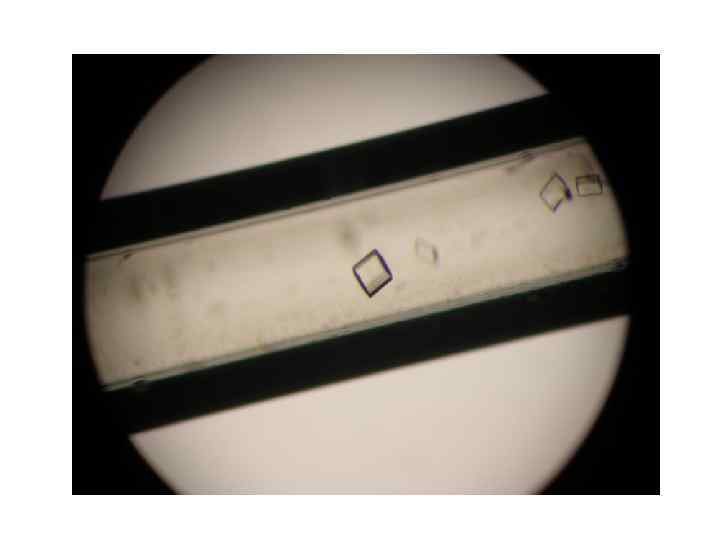
Кристаллизация в капиллярах методом встречной диффузии J. M. Garcia-Ruiz, 1994, Acta Cryst, D 50, 484 -490 раствор осадителя раствор белка
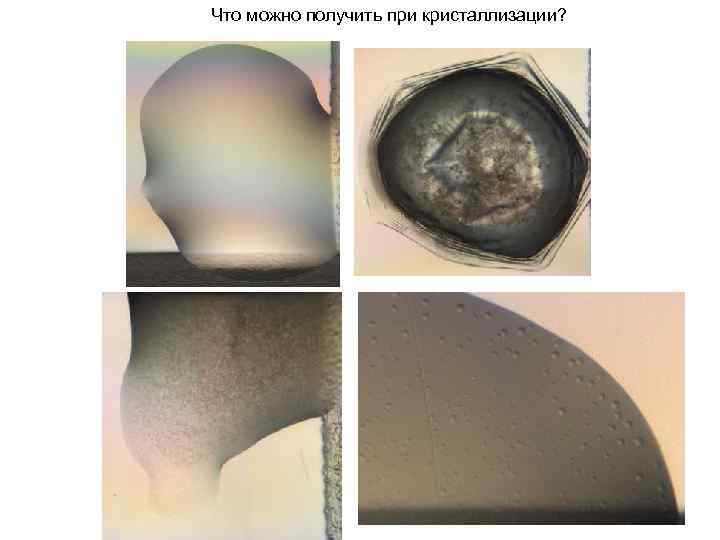
Что можно получить при кристаллизации?

Кристаллические осадки и кристаллы

Микробы, живущие в рстворах, процветают в присутствии белков

Соли тоже кристаллизуются
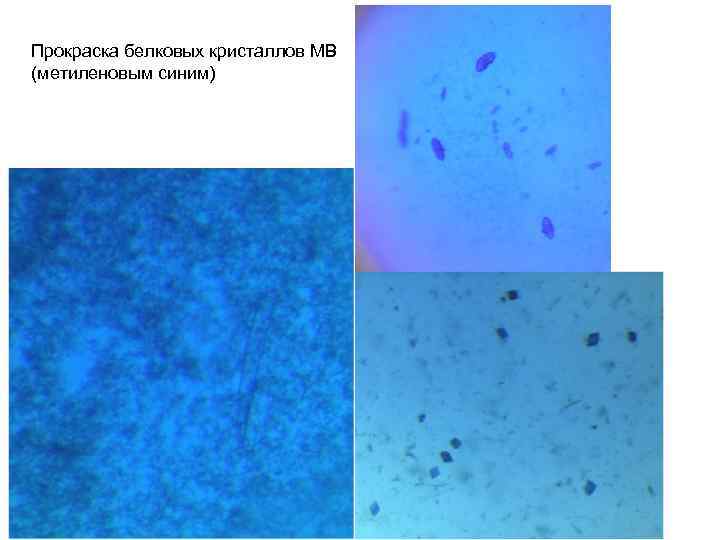
Прокраска белковых кристаллов МВ (метиленовым синим)

Оптимизация условий кристаллизации
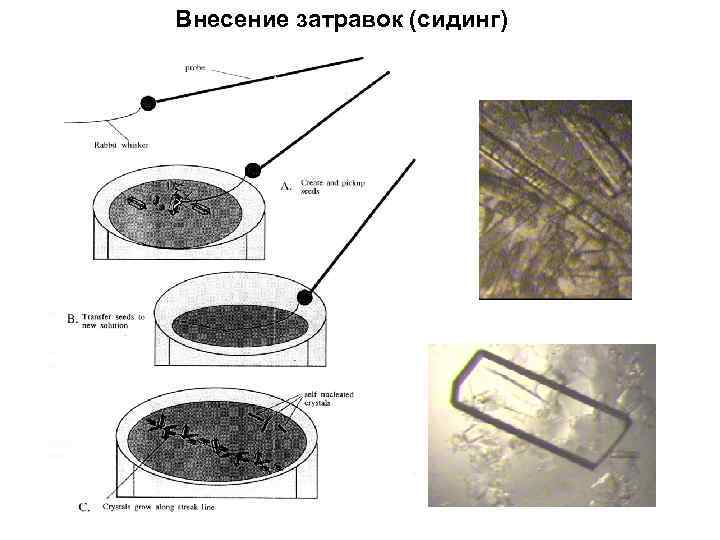
Внесение затравок (сидинг)

Кошка Реджи
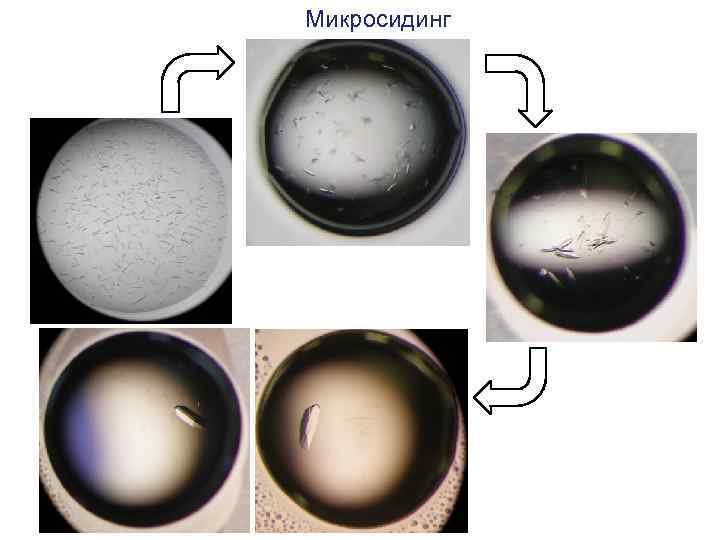
Mикросидинг

Кристаллы, полученные методом микросидинга

ПРАКТИЧЕСКОЕ ЗАНЯТИЕ № 1 Организация координатного файла

Домашнее задание #1 Фамилия Код PDB Название белка Источник (организм, система экспрессии) Разрешение стр-ры Биологическая роль белка Класс ферментов по ЕС (если фермент) Пространственная группа Количество белковых цепей в независимой части ячейки Гетерогруппы и/или низкомолекулярные лиганды SS-мостики (номера остатков) Цис-пептидные связи (номера остатков) Условия кристаллизации (если указаны) 62
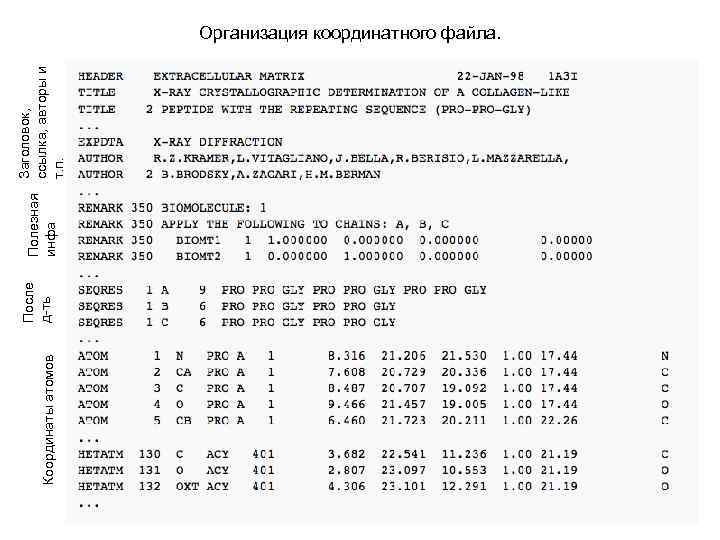
Координаты атомов После д-ть Полезная инфа Заголовок, ссылка, авторы и т. п. Организация координатного файла.
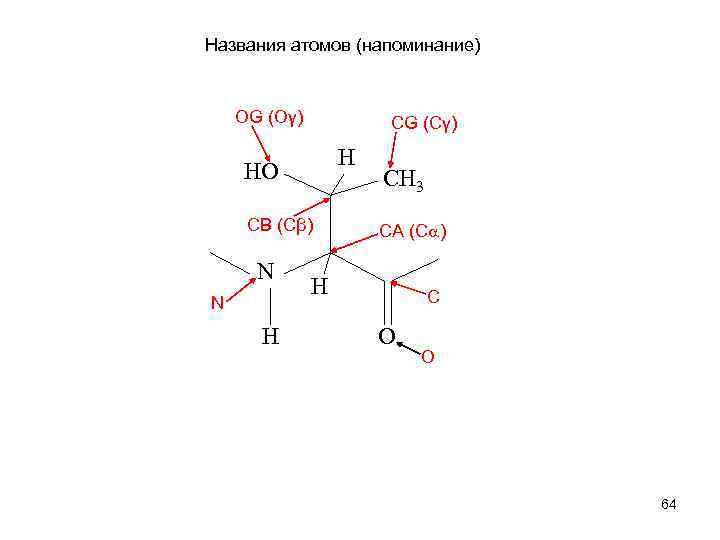
Названия атомов (напоминание) OG (Oγ) СG (Cγ) H HO СВ (Cβ) N N H CH 3 СА (C ) H С O O 64

Организация координатного файла. ремарки координаты заселенность В-фактор # атома # остатка 65 координаты
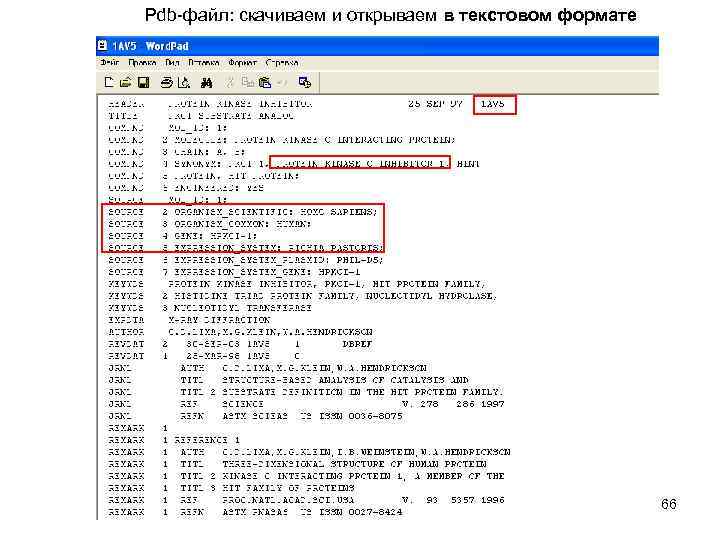
Pdb-файл: скачиваем и открываем в текстовом формате 66

Параметры структуры: находим из Structure Summary… …или из pdb-файла 67

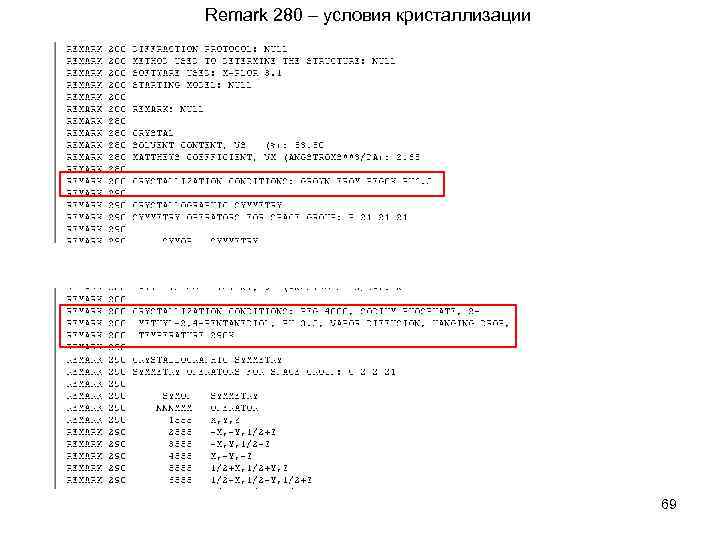
Remark 280 – условия кристаллизации 69
Крист.белков_1.ppt