 HCl + Na. OH = Na. Cl + H 2 O HCl + Ag. NO 3 = Ag. Cl↓ + HNO 3 Cu. SO 4 + 2 Na. OH = Na 2 SO 4 + Cu(OH)2↓ Ca. O + SO 2 = Ca. SO 3 O 2 + SO 2 = SO 3 Cu + 2 Ag. NO 3 = 2 Ag↓ + Cu(NO 3)2 Fe + 2 HCl = Fe. Cl 2 + H 2↑ 2 KMn. O 4 + 5 K 2 SO 3 + 3 H 2 SO 4 = 6 K 2 SO 4 + 2 Mn. SO 4 +
HCl + Na. OH = Na. Cl + H 2 O HCl + Ag. NO 3 = Ag. Cl↓ + HNO 3 Cu. SO 4 + 2 Na. OH = Na 2 SO 4 + Cu(OH)2↓ Ca. O + SO 2 = Ca. SO 3 O 2 + SO 2 = SO 3 Cu + 2 Ag. NO 3 = 2 Ag↓ + Cu(NO 3)2 Fe + 2 HCl = Fe. Cl 2 + H 2↑ 2 KMn. O 4 + 5 K 2 SO 3 + 3 H 2 SO 4 = 6 K 2 SO 4 + 2 Mn. SO 4 +
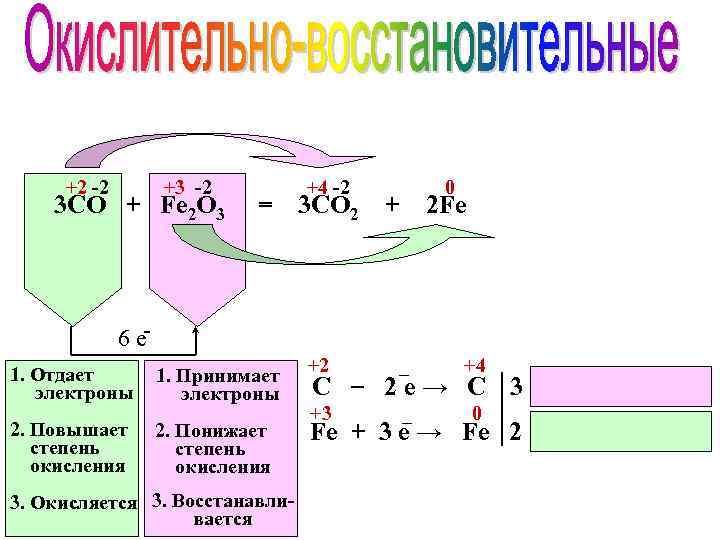 +2 -2 +3 -2 3 СО + Fe 2 O 3 = +4 -2 0 3 CO 2 + 2 Fe 6 e 1. Отдает электроны 1. Принимает электроны +2 _ +4 2. Повышает степень окисления 2. Понижает степень окисления +3 _ 0 Fe + 3 е → Fe 2 3. Окисляется 3. Восстанавливается С − 2 е→ C 3
+2 -2 +3 -2 3 СО + Fe 2 O 3 = +4 -2 0 3 CO 2 + 2 Fe 6 e 1. Отдает электроны 1. Принимает электроны +2 _ +4 2. Повышает степень окисления 2. Понижает степень окисления +3 _ 0 Fe + 3 е → Fe 2 3. Окисляется 3. Восстанавливается С − 2 е→ C 3
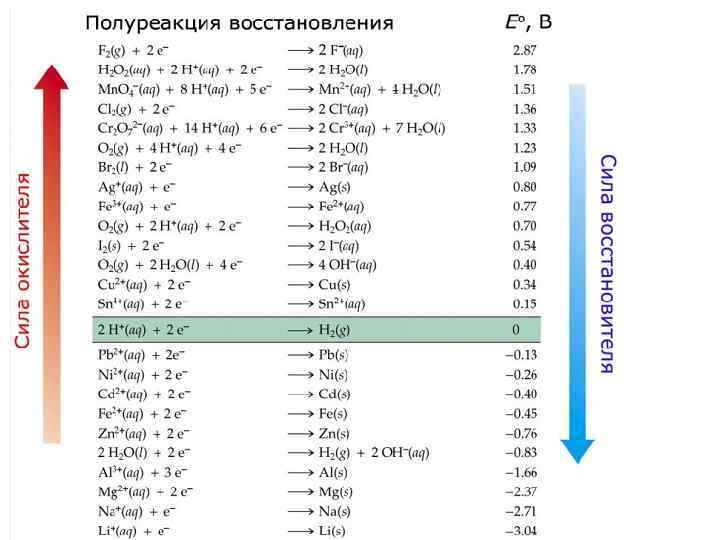
 Окислители - кислоты (HCl, H 2 SO 4(разб. ), H 2 SO 4(конц. ), HNO 3) - H 2 O 2, KCl. O 3, KCl. O 4 и др. K 2 Cr 2 O 7, K 2 Cr. O 4, KMn. O 4, Mn. O 2, Pb. O 2, Fe. Cl 3, Hg. Cl 2, [Ag(NH 3)2]OH и др. Ox
Окислители - кислоты (HCl, H 2 SO 4(разб. ), H 2 SO 4(конц. ), HNO 3) - H 2 O 2, KCl. O 3, KCl. O 4 и др. K 2 Cr 2 O 7, K 2 Cr. O 4, KMn. O 4, Mn. O 2, Pb. O 2, Fe. Cl 3, Hg. Cl 2, [Ag(NH 3)2]OH и др. Ox
 Восстановители - свободные металлы (Na, K, Mg, Al, Zn - соединения металлов в низших OS Fe(II), Sn(II), Cr(II), Cu(I) и др. - свободные неметаллы с невысокой ЭО ( Н 2, С, Si и др. ) - соединения неметаллов в низших OS CO, H 2 S, Cl- и др. ) Red
Восстановители - свободные металлы (Na, K, Mg, Al, Zn - соединения металлов в низших OS Fe(II), Sn(II), Cr(II), Cu(I) и др. - свободные неметаллы с невысокой ЭО ( Н 2, С, Si и др. ) - соединения неметаллов в низших OS CO, H 2 S, Cl- и др. ) Red
 Соединения с окислительно-восстановительной двойственностью
Соединения с окислительно-восстановительной двойственностью
 Основные ТИПЫ окислительно-восстановительных реакций -2 H 2 S + 0 0 P(кр. ) + 0 Cl 2 +5 6 HNO 3 (конц. ) +5 5 HNO 3 (конц. ) 0 → S↓ -1 + 2 HCl +6 +4 +5 +4 → H 2 SO 4 + 6 NO 2↑ + 2 H 2 O → H 3 PO 4 + 5 NO 2↑ + H 2 O
Основные ТИПЫ окислительно-восстановительных реакций -2 H 2 S + 0 0 P(кр. ) + 0 Cl 2 +5 6 HNO 3 (конц. ) +5 5 HNO 3 (конц. ) 0 → S↓ -1 + 2 HCl +6 +4 +5 +4 → H 2 SO 4 + 6 NO 2↑ + 2 H 2 O → H 3 PO 4 + 5 NO 2↑ + H 2 O
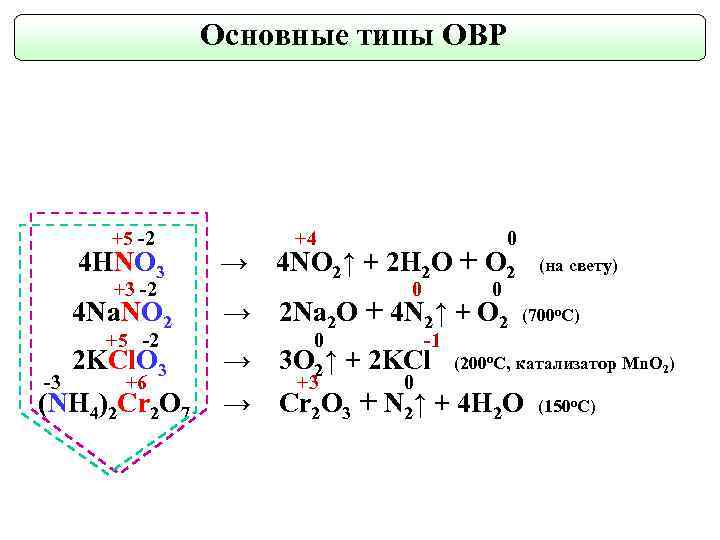 Основные типы ОВР +5 -2 +4 0 4 NO 2↑ + 2 H 2 O + O 2 4 HNO 3 → 4 Na. NO 2 → 2 KCl. O 3 → 3 O 2↑ + 2 KCl (NH 4)2 Cr 2 O 7 → Cr 2 O 3 + N 2↑ + 4 H 2 O +3 -2 +5 -2 -3 +6 0 0 2 Na 2 O + 4 N 2↑ + O 2 0 +3 (на свету) (700 о. С) -1 0 (200 o. C, катализатор Mn. O 2) (150 о. С)
Основные типы ОВР +5 -2 +4 0 4 NO 2↑ + 2 H 2 O + O 2 4 HNO 3 → 4 Na. NO 2 → 2 KCl. O 3 → 3 O 2↑ + 2 KCl (NH 4)2 Cr 2 O 7 → Cr 2 O 3 + N 2↑ + 4 H 2 O +3 -2 +5 -2 -3 +6 0 0 2 Na 2 O + 4 N 2↑ + O 2 0 +3 (на свету) (700 о. С) -1 0 (200 o. C, катализатор Mn. O 2) (150 о. С)
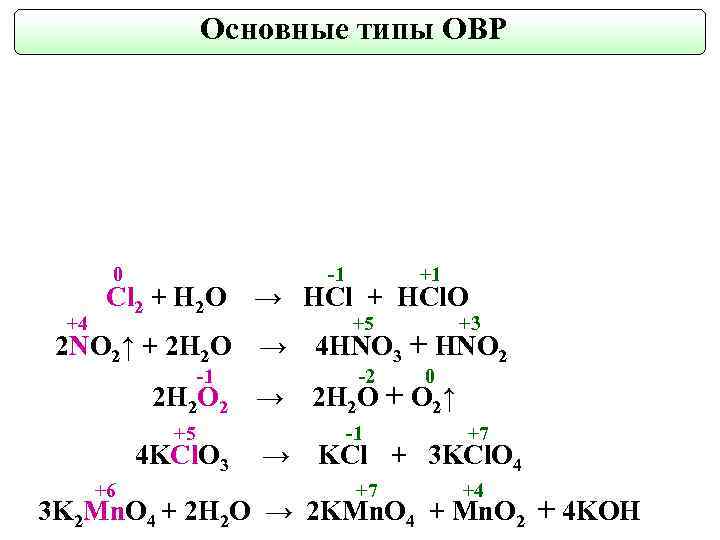 Основные типы ОВР 0 +4 Cl 2 + H 2 O 2 NO 2↑ + 2 H 2 O -1 -1 +1 → HCl + HCl. O +5 +3 → 4 HNO 3 + HNO 2 -2 0 2 H 2 O 2 → 2 H 2 O + O 2↑ +5 4 KCl. O 3 +6 → -1 +7 KCl + 3 KCl. O 4 +7 +4 3 K 2 Mn. O 4 + 2 H 2 O → 2 KMn. O 4 + Mn. O 2 + 4 KOH
Основные типы ОВР 0 +4 Cl 2 + H 2 O 2 NO 2↑ + 2 H 2 O -1 -1 +1 → HCl + HCl. O +5 +3 → 4 HNO 3 + HNO 2 -2 0 2 H 2 O 2 → 2 H 2 O + O 2↑ +5 4 KCl. O 3 +6 → -1 +7 KCl + 3 KCl. O 4 +7 +4 3 K 2 Mn. O 4 + 2 H 2 O → 2 KMn. O 4 + Mn. O 2 + 4 KOH
 Основные типы ОВР +6 -2 +4 3 H 2 SO 4 + H 2 S → 4 SO 2↑ + 4 H 2 O +7 +2 +4 2 KMn. O 4+ 3 Mn. SO 4 + 2 H 2 O → 5 Mn. O 2 + K 2 SO 4+ 2 H 2 SO 4 +5 -1 0 2 KIO 3+ 10 KI + 6 H 2 SO 4 → 6 I 2 + 6 K 2 SO 4+ 6 H 2 O
Основные типы ОВР +6 -2 +4 3 H 2 SO 4 + H 2 S → 4 SO 2↑ + 4 H 2 O +7 +2 +4 2 KMn. O 4+ 3 Mn. SO 4 + 2 H 2 O → 5 Mn. O 2 + K 2 SO 4+ 2 H 2 SO 4 +5 -1 0 2 KIO 3+ 10 KI + 6 H 2 SO 4 → 6 I 2 + 6 K 2 SO 4+ 6 H 2 O
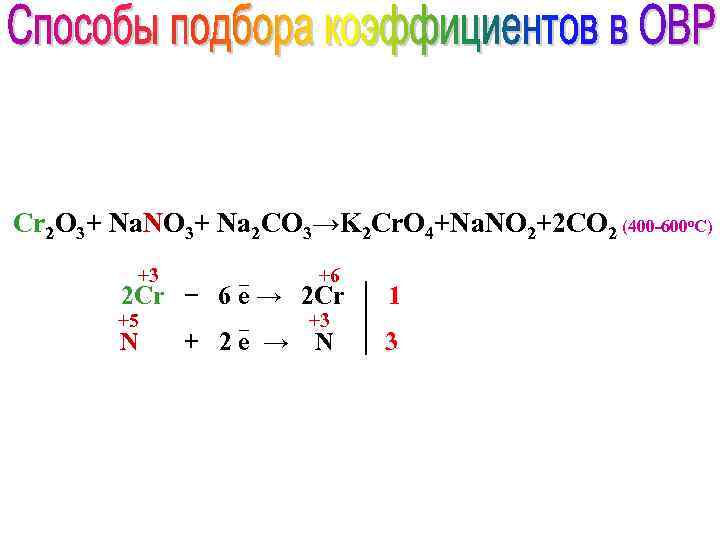 Cr 2 O 3+ Na. NO 3+ Na 2 CO 3→K 2 Cr. O 4+Na. NO 2+2 CO 2 (400 -600 о. С) +3 _ +6 2 Сr − 6 е → 2 Cr 1 N 3 +5 _ + 2 е → +3 N
Cr 2 O 3+ Na. NO 3+ Na 2 CO 3→K 2 Cr. O 4+Na. NO 2+2 CO 2 (400 -600 о. С) +3 _ +6 2 Сr − 6 е → 2 Cr 1 N 3 +5 _ + 2 е → +3 N
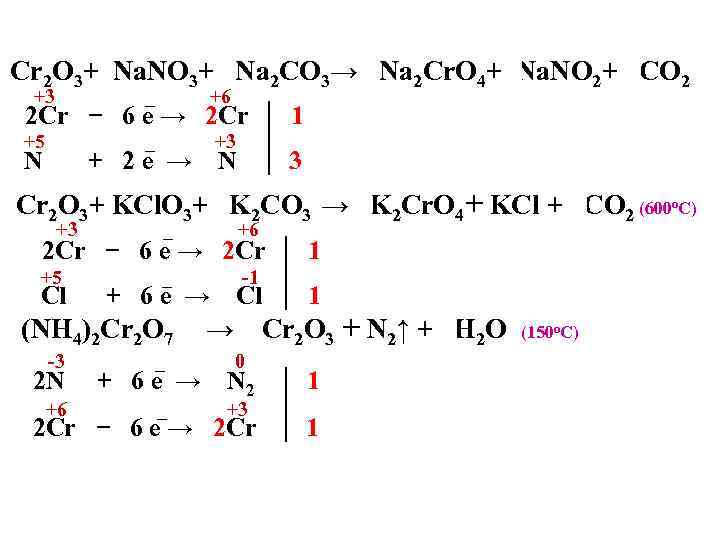 Cr 2 O 3+3 Na. NO 3+ 2 Na 2 CO 3→ 2 Na 2 Cr. O 4+3 Na. NO 2+ 2 CO 2 +3 _ +6 _ +3 2 Сr − 6 е → 2 Cr +5 N + 2 е → 1 N 3 Cr 2 O 3+ KCl. O 3+ 2 K 2 CO 3 → 2 K 2 Cr. O 4+ KCl + 2 CO 2 (600 о. С) +3 _ +6 _ -1 2 Сr − 6 е → 2 Cr +5 Cl + 6 е → (NH 4)2 Cr 2 O 7 -3 2 N _ 1 Cr 2 O 3 + N 2↑ + 4 H 2 O → 0 N 2 1 2 Сr − 6 е → 2 Cr 1 +6 + 6 е → Cl 1 _ +3 (150 о. С)
Cr 2 O 3+3 Na. NO 3+ 2 Na 2 CO 3→ 2 Na 2 Cr. O 4+3 Na. NO 2+ 2 CO 2 +3 _ +6 _ +3 2 Сr − 6 е → 2 Cr +5 N + 2 е → 1 N 3 Cr 2 O 3+ KCl. O 3+ 2 K 2 CO 3 → 2 K 2 Cr. O 4+ KCl + 2 CO 2 (600 о. С) +3 _ +6 _ -1 2 Сr − 6 е → 2 Cr +5 Cl + 6 е → (NH 4)2 Cr 2 O 7 -3 2 N _ 1 Cr 2 O 3 + N 2↑ + 4 H 2 O → 0 N 2 1 2 Сr − 6 е → 2 Cr 1 +6 + 6 е → Cl 1 _ +3 (150 о. С)
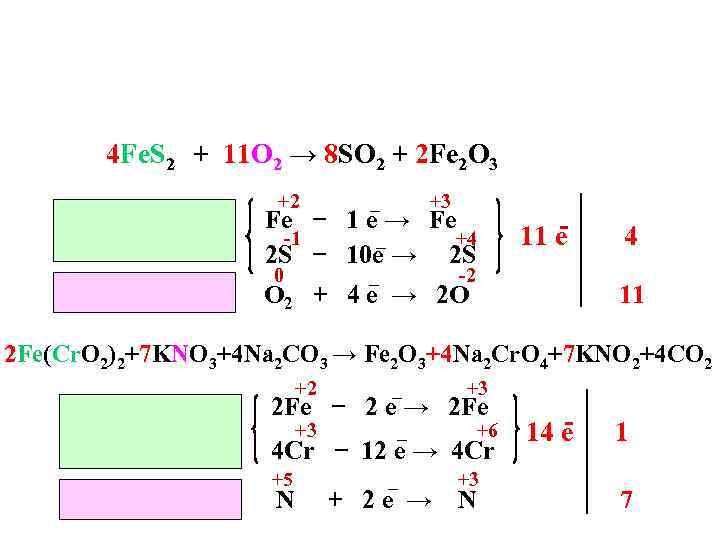 4 Fe. S 2 + 11 O 2 → 8 SO 2 + 2 Fe 2 O 3 +2 _ +3 Fe − 1 е → Fe -1 _ +4 2 S − 10 е → 2 S 0 _ 11 e -2 O 2 + 4 е → 2 O 4 11 2 Fe(Cr. O 2)2+7 KNO 3+4 Na 2 CO 3 → Fe 2 O 3+4 Na 2 Cr. O 4+7 KNO 2+4 CO 2 +2 _ +3 2 Fe − 2 е → 2 Fe +6 4 Cr − 12 е → 4 Cr +5 N _ + 2 е → +3 N 14 e 1 7
4 Fe. S 2 + 11 O 2 → 8 SO 2 + 2 Fe 2 O 3 +2 _ +3 Fe − 1 е → Fe -1 _ +4 2 S − 10 е → 2 S 0 _ 11 e -2 O 2 + 4 е → 2 O 4 11 2 Fe(Cr. O 2)2+7 KNO 3+4 Na 2 CO 3 → Fe 2 O 3+4 Na 2 Cr. O 4+7 KNO 2+4 CO 2 +2 _ +3 2 Fe − 2 е → 2 Fe +6 4 Cr − 12 е → 4 Cr +5 N _ + 2 е → +3 N 14 e 1 7
 7 P 4 + 6 I 2 + 48 H 2 O → 12 PH 4 I + 16 H 3 PO 3 0 _ +3 P 4 - 12 е → 4 P 12 e 4 0 _ -3 P 4 + 12 е → 2 I 2 + 4 е → 4 I 0 _ 4 P -1 16 e 3 2 Cr. O 5+ 14 KI +10 H 2 SO 4→ 7 I 2+ Cr 2(SO 4)3+7 K 2 SO 4 +10 H 2 O -1 _ 0 +6 _ +3 -1 _ -2 2 I - 2 е → I 2 2 Cr + 6 е → 2 Cr 8 O + 8 е → 8 O 2 e 7 14 e 1
7 P 4 + 6 I 2 + 48 H 2 O → 12 PH 4 I + 16 H 3 PO 3 0 _ +3 P 4 - 12 е → 4 P 12 e 4 0 _ -3 P 4 + 12 е → 2 I 2 + 4 е → 4 I 0 _ 4 P -1 16 e 3 2 Cr. O 5+ 14 KI +10 H 2 SO 4→ 7 I 2+ Cr 2(SO 4)3+7 K 2 SO 4 +10 H 2 O -1 _ 0 +6 _ +3 -1 _ -2 2 I - 2 е → I 2 2 Cr + 6 е → 2 Cr 8 O + 8 е → 8 O 2 e 7 14 e 1
 Метод полуреакций
Метод полуреакций
 NO 3 - → NO 2 - 3 атома кислорода 2 атома кислорода NO 3 - + 2 Н+ + 2 e- → NO 2 - + Н 2 О Mn. O 4 - → Mn 2+ 4 атома кислорода 0 атомов кислорода Mn. O 4 - + 8 H+ + 5 е- → Mn 2+ + 4 H 2 O Cr 2 O 72 - → Cr 3+ 7 атомов кислорода 0 атомов кислорода Cr 2 O 72 - + 14 H+ + 6 е- → 2 Cr 3+ + 7 H 2 O
NO 3 - → NO 2 - 3 атома кислорода 2 атома кислорода NO 3 - + 2 Н+ + 2 e- → NO 2 - + Н 2 О Mn. O 4 - → Mn 2+ 4 атома кислорода 0 атомов кислорода Mn. O 4 - + 8 H+ + 5 е- → Mn 2+ + 4 H 2 O Cr 2 O 72 - → Cr 3+ 7 атомов кислорода 0 атомов кислорода Cr 2 O 72 - + 14 H+ + 6 е- → 2 Cr 3+ + 7 H 2 O
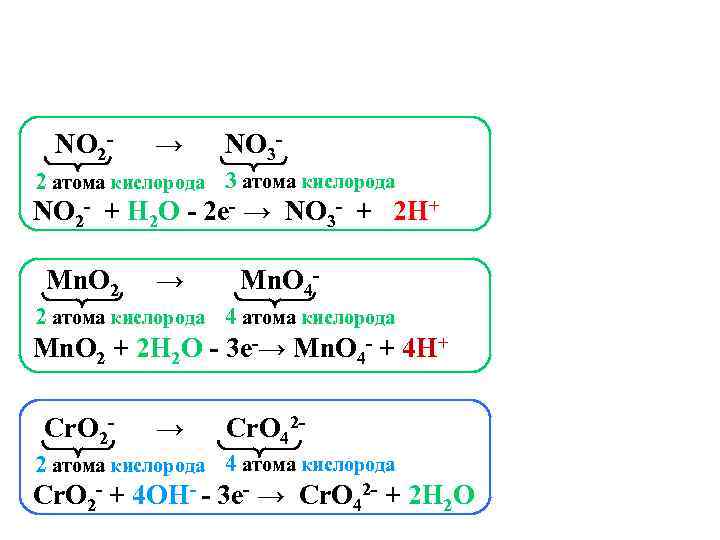 NO 2 - → NO 3 - 2 атома кислорода 3 атома кислорода NO 2 - + Н 2 О - 2 e- → NO 3 - + 2 Н+ Mn. O 2 → Mn. O 4 - 2 атома кислорода 4 атома кислорода Mn. O 2 + 2 Н 2 О - 3 e-→ Mn. O 4 - + 4 Н+ Cr. O 2 - → Cr. O 42 - 2 атома кислорода 4 атома кислорода Cr. O 2 - + 4 OН- - 3 e- → Cr. O 42 - + 2 Н 2 О
NO 2 - → NO 3 - 2 атома кислорода 3 атома кислорода NO 2 - + Н 2 О - 2 e- → NO 3 - + 2 Н+ Mn. O 2 → Mn. O 4 - 2 атома кислорода 4 атома кислорода Mn. O 2 + 2 Н 2 О - 3 e-→ Mn. O 4 - + 4 Н+ Cr. O 2 - → Cr. O 42 - 2 атома кислорода 4 атома кислорода Cr. O 2 - + 4 OН- - 3 e- → Cr. O 42 - + 2 Н 2 О
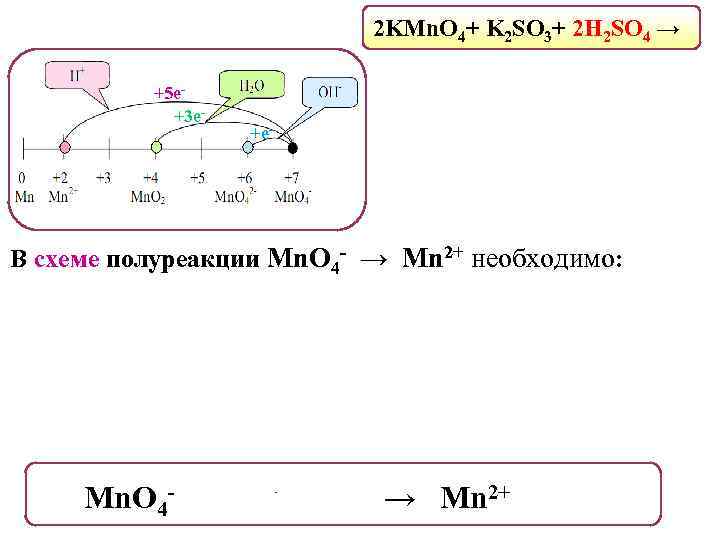 2 KMn. O 4+ K 2 SO 3+ 2 H 2 SO 4 → +5 е+3 е- +е- В схеме полуреакции Mn. O 4 - → Mn 2+ необходимо: Mn. O 4 - + 8 H+ + 5 е- → Mn 2+ + 4 H 2 O
2 KMn. O 4+ K 2 SO 3+ 2 H 2 SO 4 → +5 е+3 е- +е- В схеме полуреакции Mn. O 4 - → Mn 2+ необходимо: Mn. O 4 - + 8 H+ + 5 е- → Mn 2+ + 4 H 2 O
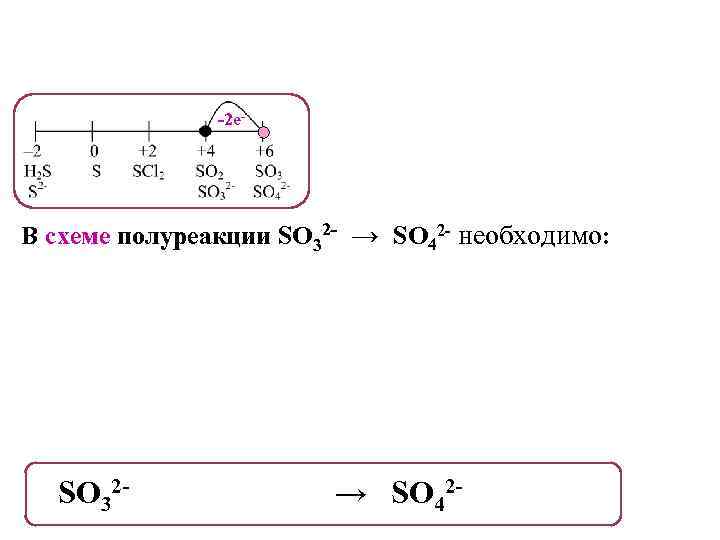 -2 е- В схеме полуреакции SO 32 - → SO 42 - необходимо: SO 32 - + H 2 O - 2 е- → SO 42 - + 2 H+
-2 е- В схеме полуреакции SO 32 - → SO 42 - необходимо: SO 32 - + H 2 O - 2 е- → SO 42 - + 2 H+
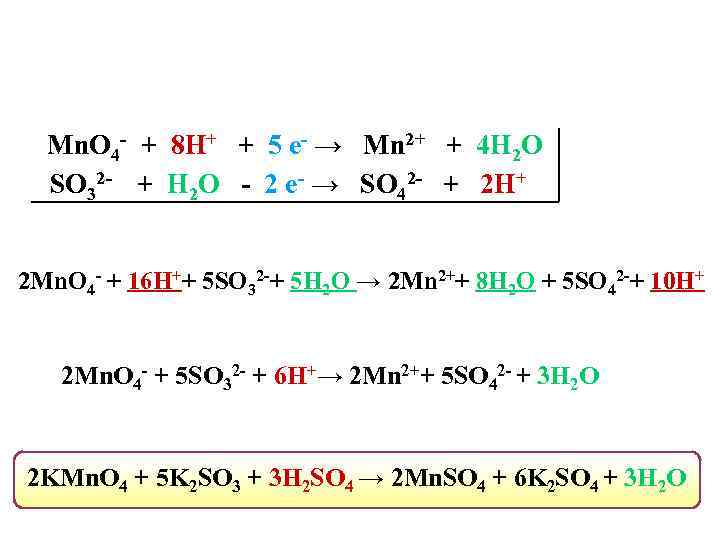 Mn. O 4 - + 8 H+ + 5 е- → Mn 2+ + 4 H 2 О SO 32 - + H 2 O - 2 е- → SO 42 - + 2 H+ 2 Mn. O 4 - + 16 H++ 5 SO 32 -+ 5 H 2 O → 2 Mn 2++ 8 H 2 О + 5 SO 42 -+ 10 H+ 2 Mn. O 4 - + 5 SO 32 - + 6 H+→ 2 Mn 2++ 5 SO 42 - + 3 H 2 О 2 KMn. O 4 + 5 K 2 SO 3 + 3 H 2 SO 4 → 2 Mn. SO 4 + 6 K 2 SO 4 + 3 H 2 О
Mn. O 4 - + 8 H+ + 5 е- → Mn 2+ + 4 H 2 О SO 32 - + H 2 O - 2 е- → SO 42 - + 2 H+ 2 Mn. O 4 - + 16 H++ 5 SO 32 -+ 5 H 2 O → 2 Mn 2++ 8 H 2 О + 5 SO 42 -+ 10 H+ 2 Mn. O 4 - + 5 SO 32 - + 6 H+→ 2 Mn 2++ 5 SO 42 - + 3 H 2 О 2 KMn. O 4 + 5 K 2 SO 3 + 3 H 2 SO 4 → 2 Mn. SO 4 + 6 K 2 SO 4 + 3 H 2 О
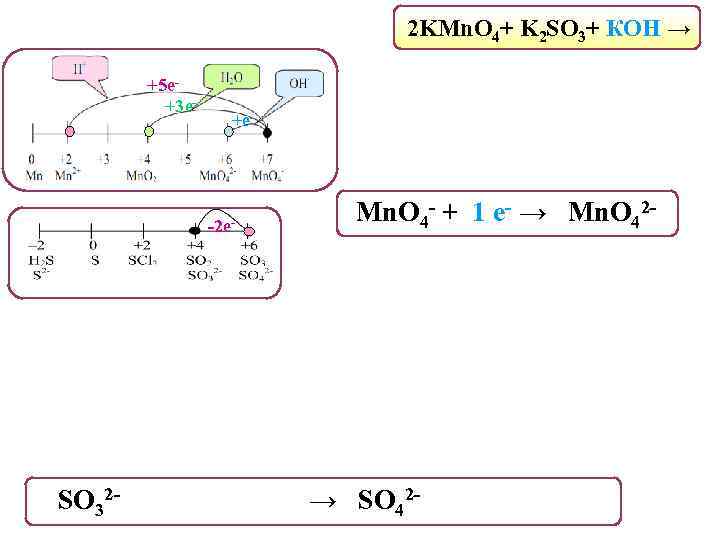 2 KMn. O 4+ K 2 SO 3+ КОН → +5 е+3 е- +е- -2 е- Mn. O 4 - + 1 е- → Mn. O 42 - SO 32 - + 2 OH- - 2 е- → SO 42 - + H 2 О
2 KMn. O 4+ K 2 SO 3+ КОН → +5 е+3 е- +е- -2 е- Mn. O 4 - + 1 е- → Mn. O 42 - SO 32 - + 2 OH- - 2 е- → SO 42 - + H 2 О
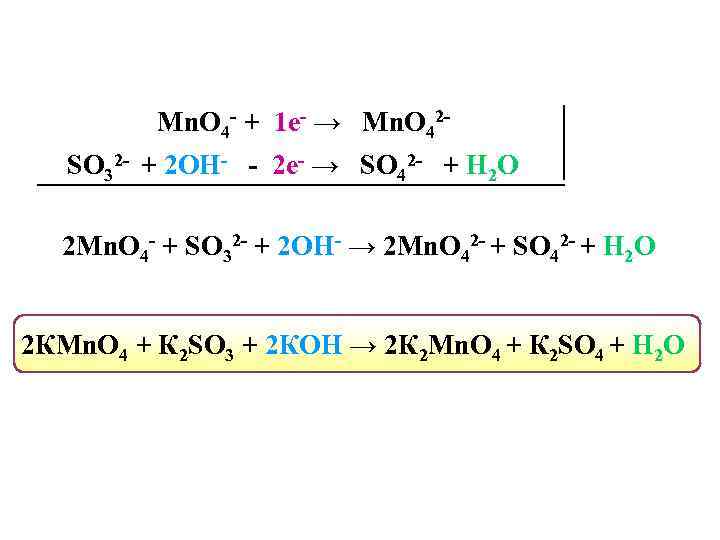 Mn. O 4 - + 1 е- → Mn. O 42 SO 32 - + 2 OH- - 2 е- → SO 42 - + H 2 О 2 Mn. O 4 - + SO 32 - + 2 ОН- → 2 Mn. О 42 - + SO 42 - + H 2 О 2 КMn. O 4 + К 2 SO 3 + 2 КОН → 2 К 2 Mn. О 4 + К 2 SO 4 + H 2 О
Mn. O 4 - + 1 е- → Mn. O 42 SO 32 - + 2 OH- - 2 е- → SO 42 - + H 2 О 2 Mn. O 4 - + SO 32 - + 2 ОН- → 2 Mn. О 42 - + SO 42 - + H 2 О 2 КMn. O 4 + К 2 SO 3 + 2 КОН → 2 К 2 Mn. О 4 + К 2 SO 4 + H 2 О
 Электродные потенциалы Zn + Cu 2+ = Zn 2+ + Cu Zn – 2 e- = Zn 2+ Cu 2+ + 2 e- = Cu
Электродные потенциалы Zn + Cu 2+ = Zn 2+ + Cu Zn – 2 e- = Zn 2+ Cu 2+ + 2 e- = Cu
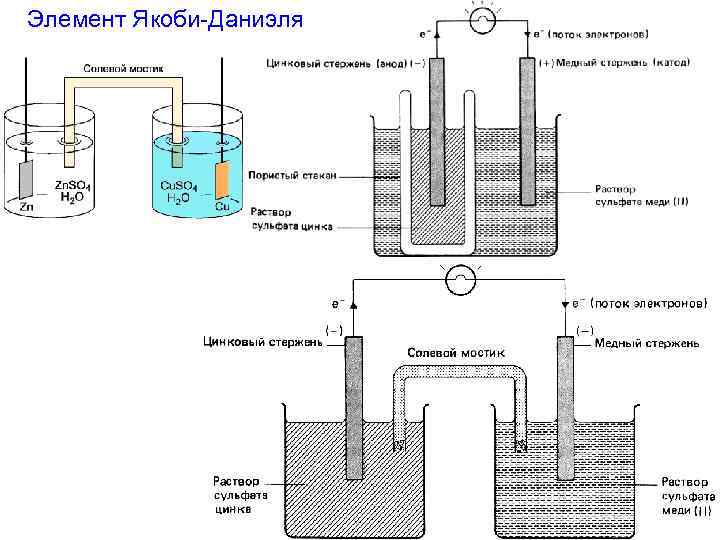 Элемент Якоби-Даниэля
Элемент Якоби-Даниэля
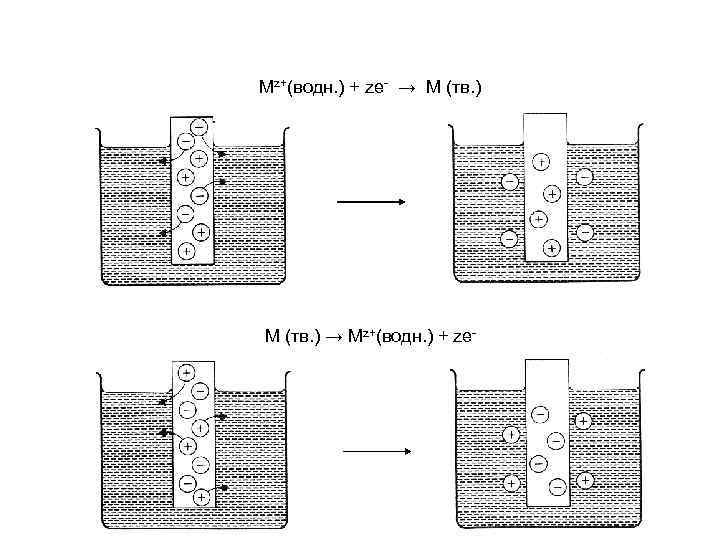 Mz+(водн. ) + ze- → M (тв. ) → Mz+(водн. ) + ze-
Mz+(водн. ) + ze- → M (тв. ) → Mz+(водн. ) + ze-
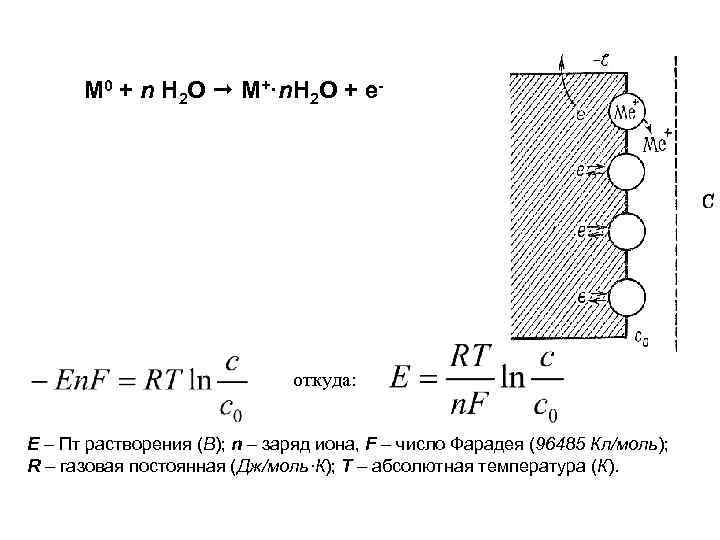 M 0 + n H 2 O M+·n. H 2 O + e- откуда: Е – Пт растворения (В); n – заряд иона, F – число Фарадея (96485 Кл/моль); R – газовая постоянная (Дж/моль·К); T – абсолютная температура (К).
M 0 + n H 2 O M+·n. H 2 O + e- откуда: Е – Пт растворения (В); n – заряд иона, F – число Фарадея (96485 Кл/моль); R – газовая постоянная (Дж/моль·К); T – абсолютная температура (К).
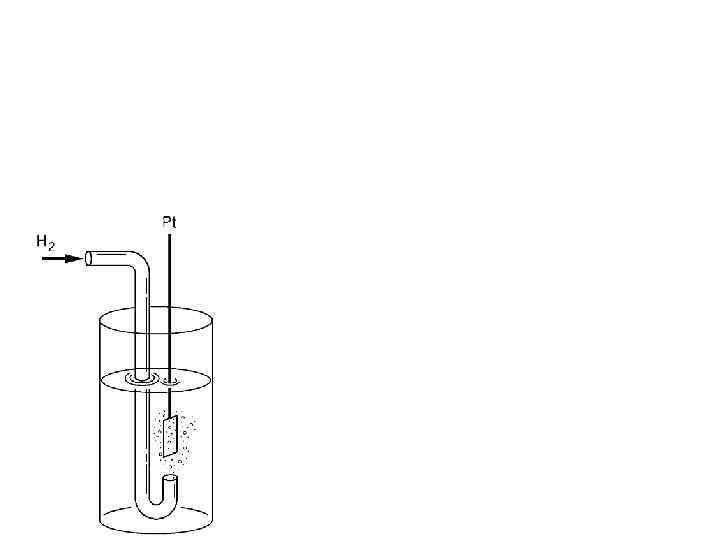
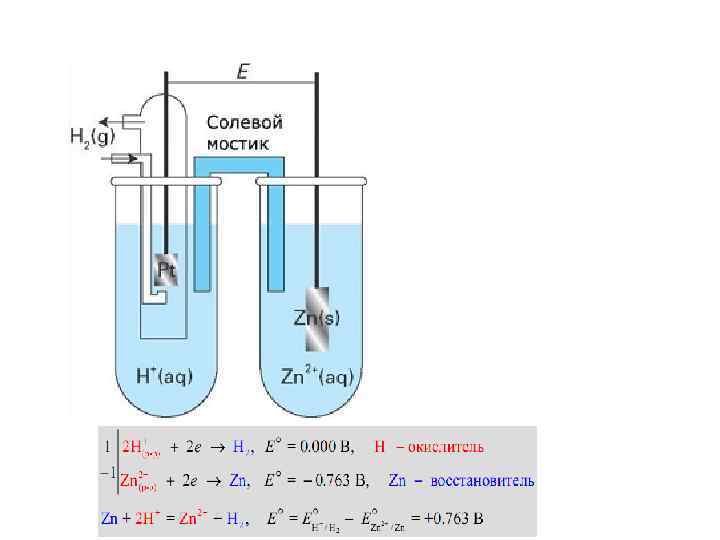
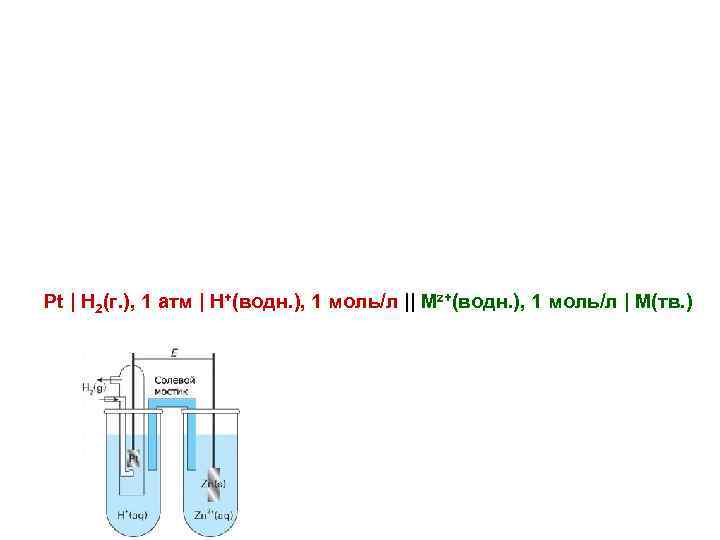 Pt | H 2(г. ), 1 атм | H+(водн. ), 1 моль/л || Mz+(водн. ), 1 моль/л | M(тв. )
Pt | H 2(г. ), 1 атм | H+(водн. ), 1 моль/л || Mz+(водн. ), 1 моль/л | M(тв. )
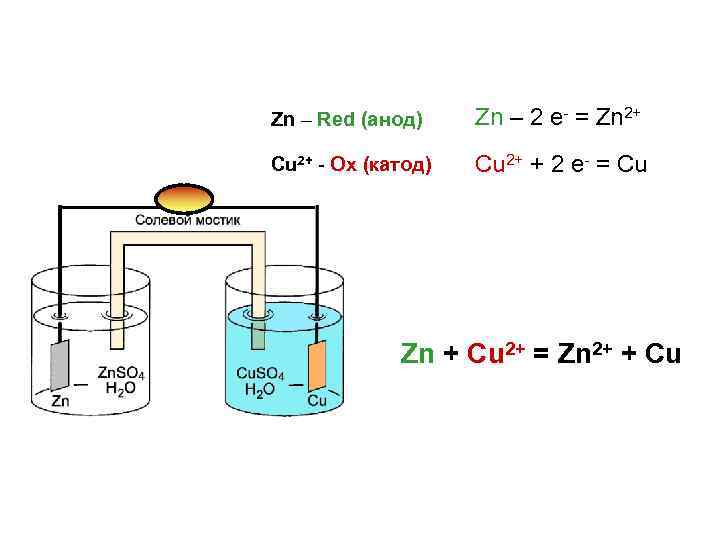 Zn – Red (анод) Zn – 2 e- = Zn 2+ Cu 2+ - Ox (катод) Cu 2+ + 2 e- = Cu Zn + Cu 2+ = Zn 2+ + Cu
Zn – Red (анод) Zn – 2 e- = Zn 2+ Cu 2+ - Ox (катод) Cu 2+ + 2 e- = Cu Zn + Cu 2+ = Zn 2+ + Cu
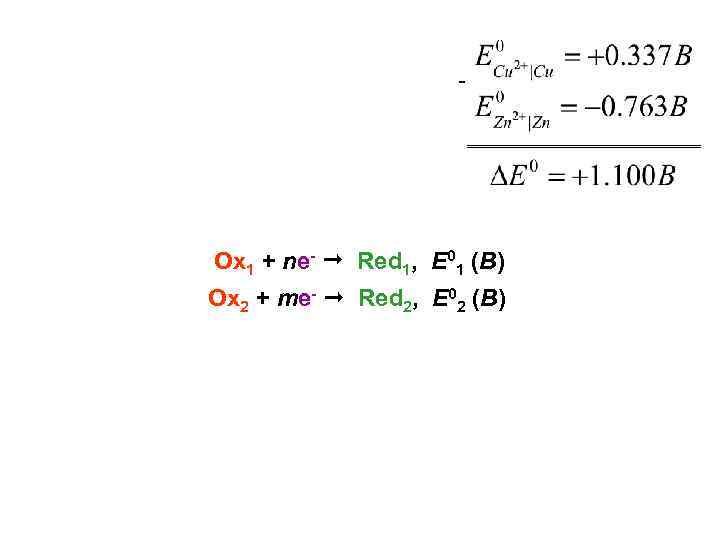 - Ox 1 + ne- Red 1, E 01 (В) Ox 2 + me- Red 2, E 02 (В)
- Ox 1 + ne- Red 1, E 01 (В) Ox 2 + me- Red 2, E 02 (В)
 Mn. O 2 + 4 ОН- - 3 e- → Mn. O 4 - + 2 Н 2 О Еo = 0. 60 B Br. O- + Н 2 О + 2 e-→ Br- + 2 ОН- Еo = 0. 76 B Cl 2 + 2 e-→ 2 Cl. S 2 O 82 - + 2 e-→ 2 SO 42 - Еo = 1. 36 B Еo = 2. 01 B
Mn. O 2 + 4 ОН- - 3 e- → Mn. O 4 - + 2 Н 2 О Еo = 0. 60 B Br. O- + Н 2 О + 2 e-→ Br- + 2 ОН- Еo = 0. 76 B Cl 2 + 2 e-→ 2 Cl. S 2 O 82 - + 2 e-→ 2 SO 42 - Еo = 1. 36 B Еo = 2. 01 B
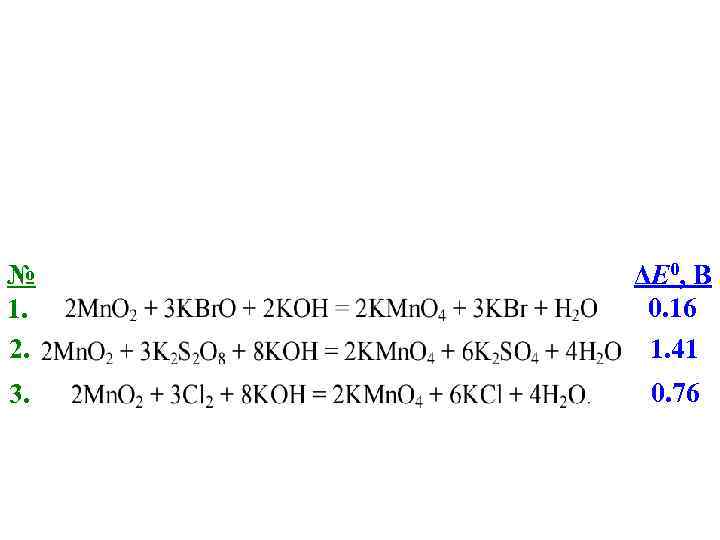 № 1. 2. ΔE 0, B 0. 16 1. 41 3. 0. 76
№ 1. 2. ΔE 0, B 0. 16 1. 41 3. 0. 76
 Pb 2+ + Sn = Pb + Sn 2+ ΔЕ 0 = 0, 01 В (ΔG 0 = -4 к. Дж),
Pb 2+ + Sn = Pb + Sn 2+ ΔЕ 0 = 0, 01 В (ΔG 0 = -4 к. Дж),
 Формы представления стандартных электродных потенциалов У. М. Латимер, 1938 -1952 г. г. США А. А. Фрост, 1951 г. США М. Пурбе, 1963 г. Бельгия Диаграммы Латимера Диаграммы Фроста Диаграммы Пурбе
Формы представления стандартных электродных потенциалов У. М. Латимер, 1938 -1952 г. г. США А. А. Фрост, 1951 г. США М. Пурбе, 1963 г. Бельгия Диаграммы Латимера Диаграммы Фроста Диаграммы Пурбе
 Диаграммы Латимера Пример: Диаграммы Латимера для марганца р. Н = 0 +0. 564 B Mn. O 4− → Mn. O 4 +2. 26 B 2− +0. 95 B → Mn. O 2 → +1. 51 B Mn 3+ → -1. 18 B → Mn 0 Mn 2+ р. Н = 14 +0. 564 B Mn. O 4−→ Mn. O 4 -0. 23 B -1. 56 B 0 Mn. O 2 → Mn 2 О 3 → Mn(ОН)2 → Mn +0. 60 B 2−→ +0. 15 B
Диаграммы Латимера Пример: Диаграммы Латимера для марганца р. Н = 0 +0. 564 B Mn. O 4− → Mn. O 4 +2. 26 B 2− +0. 95 B → Mn. O 2 → +1. 51 B Mn 3+ → -1. 18 B → Mn 0 Mn 2+ р. Н = 14 +0. 564 B Mn. O 4−→ Mn. O 4 -0. 23 B -1. 56 B 0 Mn. O 2 → Mn 2 О 3 → Mn(ОН)2 → Mn +0. 60 B 2−→ +0. 15 B
 +0. 564 B +2. 26 B +0. 95 B +1. 51 B -1. 18 B Mn. O 4− → Mn. O 42− → Mn. O 2 → Mn 3+ → Mn 2+ → Mn 0 +0. 564 B Mn. O 4− → Mn. O 42− Mn. O 4− + ē → Mn. O 42− -1. 18 B Mn 2+ → Mn 0 Mn 2+ + 2ē → Mn 0 ,
+0. 564 B +2. 26 B +0. 95 B +1. 51 B -1. 18 B Mn. O 4− → Mn. O 42− → Mn. O 2 → Mn 3+ → Mn 2+ → Mn 0 +0. 564 B Mn. O 4− → Mn. O 42− Mn. O 4− + ē → Mn. O 42− -1. 18 B Mn 2+ → Mn 0 Mn 2+ + 2ē → Mn 0 ,
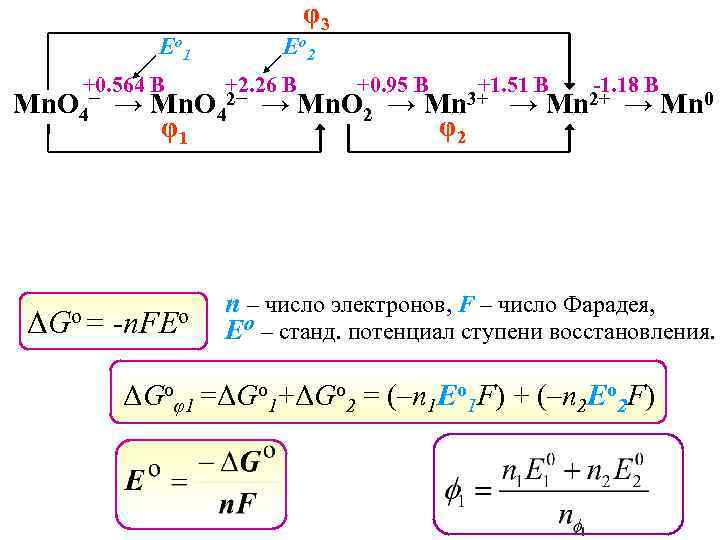 φ3 Е o 1 +0. 564 B Mn. O 4− ΔGo = Е o 2 +2. 26 B → Mn. O 4 φ1 -n. FEo 2− +0. 95 B → Mn. O 2 → +1. 51 B Mn 3+ φ2 → -1. 18 B Mn 2+ → Mn 0 n – число электронов, F – число Фарадея, Eo – станд. потенциал ступени восстановления. ΔGoφ1 =ΔGo 1+ΔGo 2 = (–n 1 Eo 1 F) + (–n 2 Eo 2 F)
φ3 Е o 1 +0. 564 B Mn. O 4− ΔGo = Е o 2 +2. 26 B → Mn. O 4 φ1 -n. FEo 2− +0. 95 B → Mn. O 2 → +1. 51 B Mn 3+ φ2 → -1. 18 B Mn 2+ → Mn 0 n – число электронов, F – число Фарадея, Eo – станд. потенциал ступени восстановления. ΔGoφ1 =ΔGo 1+ΔGo 2 = (–n 1 Eo 1 F) + (–n 2 Eo 2 F)
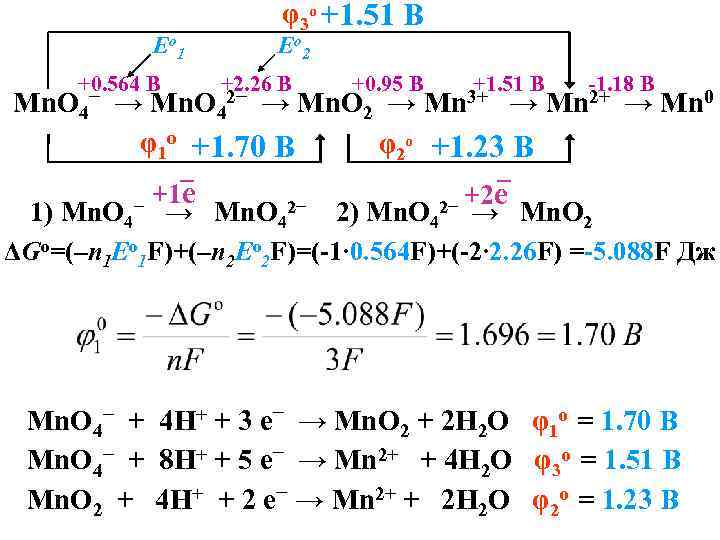 φ3 o +1. 51 B Е o 1 +0. 564 B Mn. O 4− Е o 2 +2. 26 B +0. 95 B +1. 51 B Mn 3+ -1. 18 B → Mn. O 4 → Mn. O 2 → → Mn 2+ → Mn 0 φ1 o +1. 70 B φ2 o +1. 23 B _ _ +1 е − → Mn. O 2− 2− +2 е Mn. O 1) Mn. O 4 2) Mn. O 4 → 4 2 2− ΔGo=(–n 1 Eo 1 F)+(–n 2 Eo 2 F)=(-1∙ 0. 564 F)+(-2∙ 2. 26 F) =-5. 088 F Дж Mn. O 4− + 4 H+ + 3 e− → Mn. О 2 + 2 H 2 O φ1 o = 1. 70 В Mn. O 4− + 8 H+ + 5 e− → Mn 2+ + 4 H 2 O φ3 o = 1. 51 В Mn. O 2 + 4 H+ + 2 e− → Mn 2+ + 2 H 2 O φ2 o = 1. 23 В
φ3 o +1. 51 B Е o 1 +0. 564 B Mn. O 4− Е o 2 +2. 26 B +0. 95 B +1. 51 B Mn 3+ -1. 18 B → Mn. O 4 → Mn. O 2 → → Mn 2+ → Mn 0 φ1 o +1. 70 B φ2 o +1. 23 B _ _ +1 е − → Mn. O 2− 2− +2 е Mn. O 1) Mn. O 4 2) Mn. O 4 → 4 2 2− ΔGo=(–n 1 Eo 1 F)+(–n 2 Eo 2 F)=(-1∙ 0. 564 F)+(-2∙ 2. 26 F) =-5. 088 F Дж Mn. O 4− + 4 H+ + 3 e− → Mn. О 2 + 2 H 2 O φ1 o = 1. 70 В Mn. O 4− + 8 H+ + 5 e− → Mn 2+ + 4 H 2 O φ3 o = 1. 51 В Mn. O 2 + 4 H+ + 2 e− → Mn 2+ + 2 H 2 O φ2 o = 1. 23 В
 р. Н = 0 (кислая среда) +0. 564 B +2. 26 B +0. 95 B +1. 51 B - 1. 18 B (!) Mn. O 4− → Mn. O 42− → Mn. O 2 → Mn 3+ → Mn 2+ → Mn 0
р. Н = 0 (кислая среда) +0. 564 B +2. 26 B +0. 95 B +1. 51 B - 1. 18 B (!) Mn. O 4− → Mn. O 42− → Mn. O 2 → Mn 3+ → Mn 2+ → Mn 0
 р. Н = 0 +0. 564 B +2. 26 B +0. 95 B +1. 51 B - 1. 18 B Mn. O 4− → Mn. O 42− → Mn. O 2 → Mn 3+ → Mn 2+ → Mn 0
р. Н = 0 +0. 564 B +2. 26 B +0. 95 B +1. 51 B - 1. 18 B Mn. O 4− → Mn. O 42− → Mn. O 2 → Mn 3+ → Mn 2+ → Mn 0
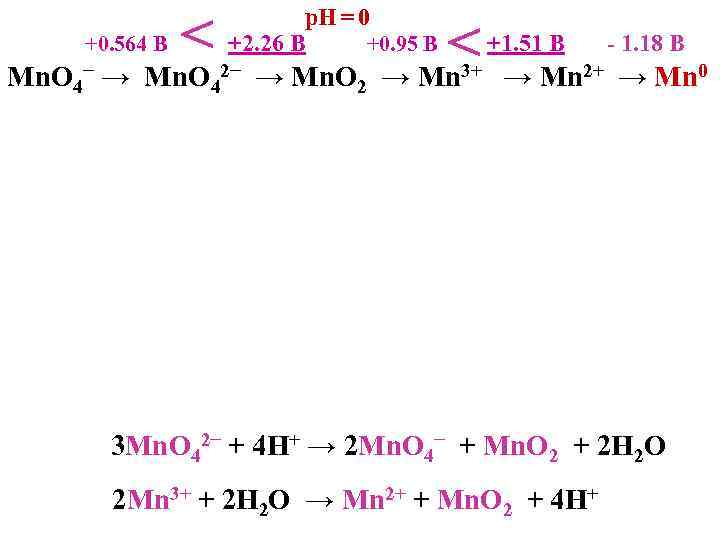 +0. 564 B < р. Н = 0 +2. 26 B +0. 95 B Mn. O 4− → Mn. O 42− → Mn. O 2 < → Mn 3+ +1. 51 B - 1. 18 B → Mn 2+ → Mn 0 3 Mn. O 42− + 4 Н+ → 2 Mn. O 4− + Mn. O 2 + 2 Н 2 О 2 Mn 3+ + 2 Н 2 О → Mn 2+ + Mn. O 2 + 4 Н+
+0. 564 B < р. Н = 0 +2. 26 B +0. 95 B Mn. O 4− → Mn. O 42− → Mn. O 2 < → Mn 3+ +1. 51 B - 1. 18 B → Mn 2+ → Mn 0 3 Mn. O 42− + 4 Н+ → 2 Mn. O 4− + Mn. O 2 + 2 Н 2 О 2 Mn 3+ + 2 Н 2 О → Mn 2+ + Mn. O 2 + 4 Н+
 Диаграммы Фроста Значения вольт-эквивалентов для окислительных форм марганца
Диаграммы Фроста Значения вольт-эквивалентов для окислительных форм марганца
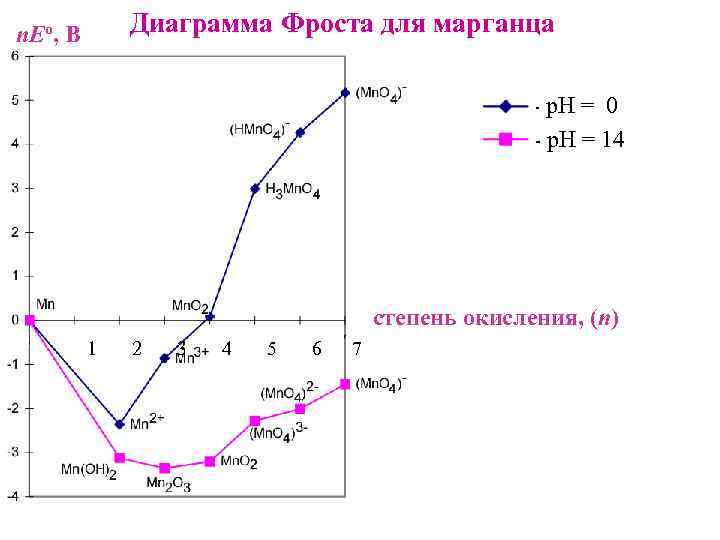 Диаграмма Фроста для марганца n. Eо, В - р. Н = 0 - р. Н = 14 степень окисления, (n) 1 2 3 4 5 6 7
Диаграмма Фроста для марганца n. Eо, В - р. Н = 0 - р. Н = 14 степень окисления, (n) 1 2 3 4 5 6 7
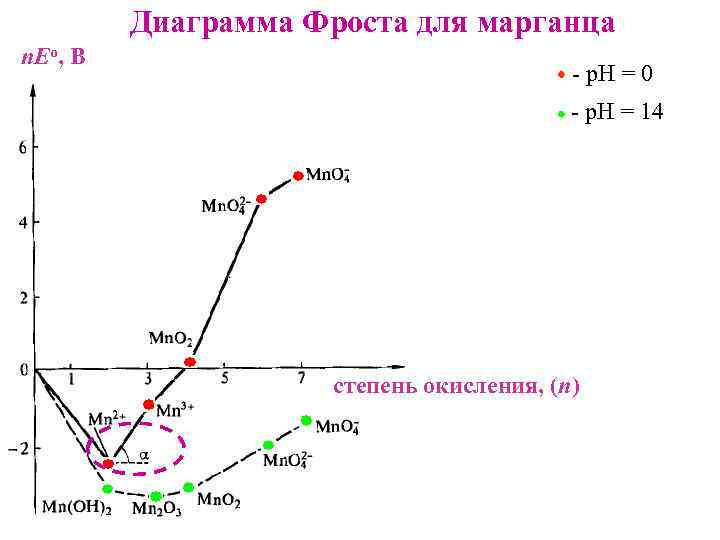 Диаграмма Фроста для марганца n. Eо, В - р. Н = 0 - р. Н = 14 степень окисления, (n)
Диаграмма Фроста для марганца n. Eо, В - р. Н = 0 - р. Н = 14 степень окисления, (n)
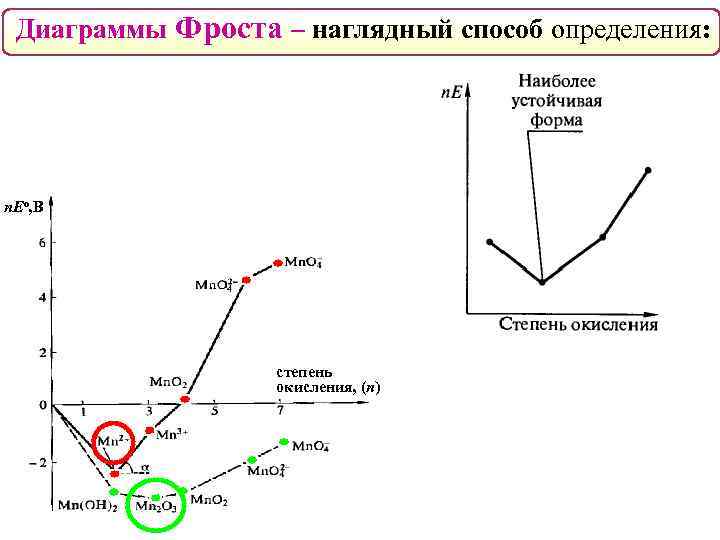 Диаграммы Фроста – наглядный способ определения: n. Eо, В степень окисления, (n)
Диаграммы Фроста – наглядный способ определения: n. Eо, В степень окисления, (n)
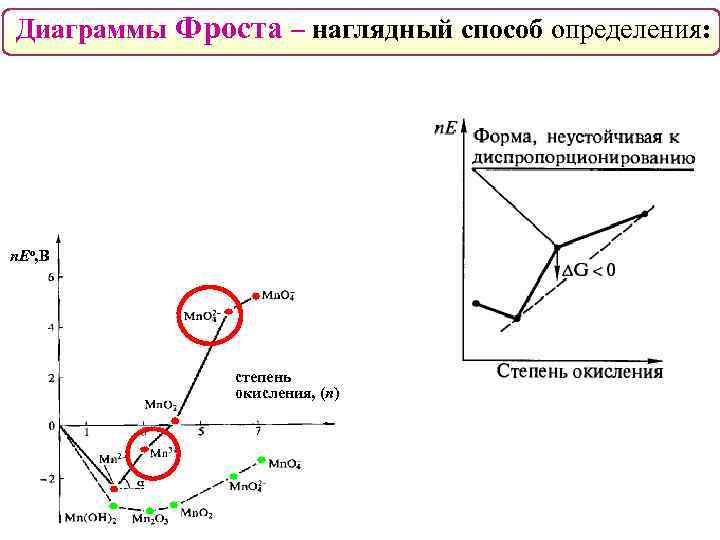 Диаграммы Фроста – наглядный способ определения: n. Eо, В степень окисления, (n)
Диаграммы Фроста – наглядный способ определения: n. Eо, В степень окисления, (n)
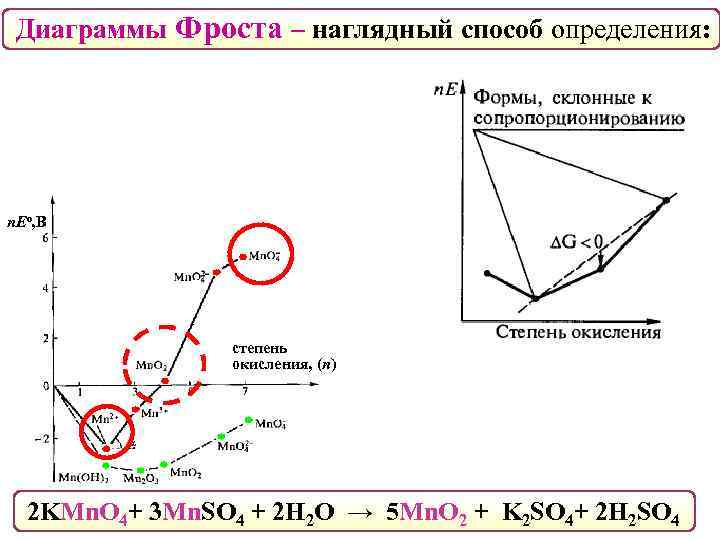 Диаграммы Фроста – наглядный способ определения: n. Eо, В степень окисления, (n) 2 KMn. O 4+ 3 Mn. SO 4 + 2 H 2 O → 5 Mn. O 2 + K 2 SO 4+ 2 H 2 SO 4
Диаграммы Фроста – наглядный способ определения: n. Eо, В степень окисления, (n) 2 KMn. O 4+ 3 Mn. SO 4 + 2 H 2 O → 5 Mn. O 2 + K 2 SO 4+ 2 H 2 SO 4
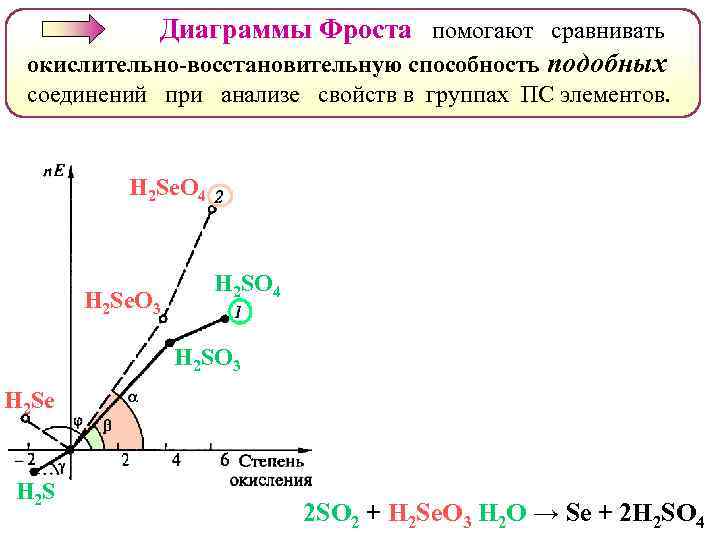 Диаграммы Фроста помогают сравнивать окислительно-восстановительную способность подобных соединений при анализе свойств в группах ПС элементов. H 2 Se. O 4 H 2 Se. O 3 H 2 SO 4 H 2 SO 3 H 2 Se H 2 S 2 SO 2 + H 2 Se. O 3 Н 2 О → Se + 2 Н 2 SO 4
Диаграммы Фроста помогают сравнивать окислительно-восстановительную способность подобных соединений при анализе свойств в группах ПС элементов. H 2 Se. O 4 H 2 Se. O 3 H 2 SO 4 H 2 SO 3 H 2 Se H 2 S 2 SO 2 + H 2 Se. O 3 Н 2 О → Se + 2 Н 2 SO 4
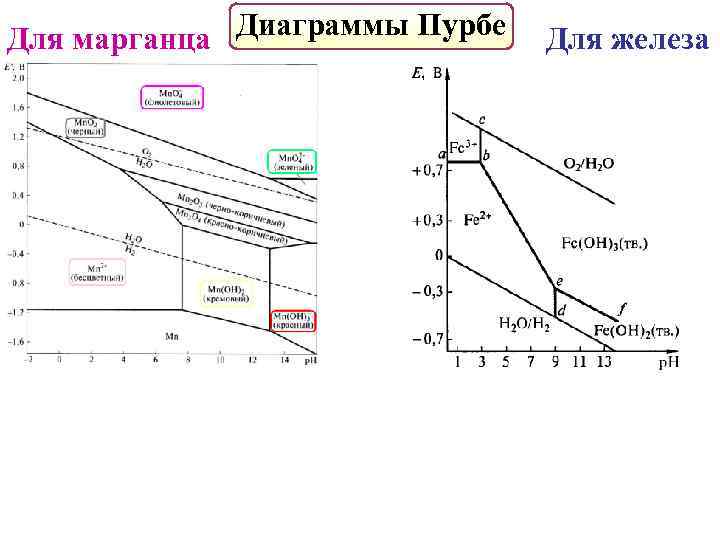 Диаграммы Пурбе Для марганца Для железа
Диаграммы Пурбе Для марганца Для железа
 Ряд напряжений металлов Zn + Cu. SO 4 = Zn. SO 4 + Cu Zn + Pb(NO 3)2 = Zn(NO 3)2 + Pb Pb + Cu(NO 3)2 = Pb(NO 3)2 + Cu Zn + 2 H+ = Zn 2+ + H 2↑ Pb + 2 H+ = Pb 2+ + H 2↑ Zn. . . Pb. . . H. . . Cu Zn. Cl 2 + Mg + 2 H 2 O Zn(OH)Cl↓ + Mg(OH)Cl↓ + H 2↑
Ряд напряжений металлов Zn + Cu. SO 4 = Zn. SO 4 + Cu Zn + Pb(NO 3)2 = Zn(NO 3)2 + Pb Pb + Cu(NO 3)2 = Pb(NO 3)2 + Cu Zn + 2 H+ = Zn 2+ + H 2↑ Pb + 2 H+ = Pb 2+ + H 2↑ Zn. . . Pb. . . H. . . Cu Zn. Cl 2 + Mg + 2 H 2 O Zn(OH)Cl↓ + Mg(OH)Cl↓ + H 2↑
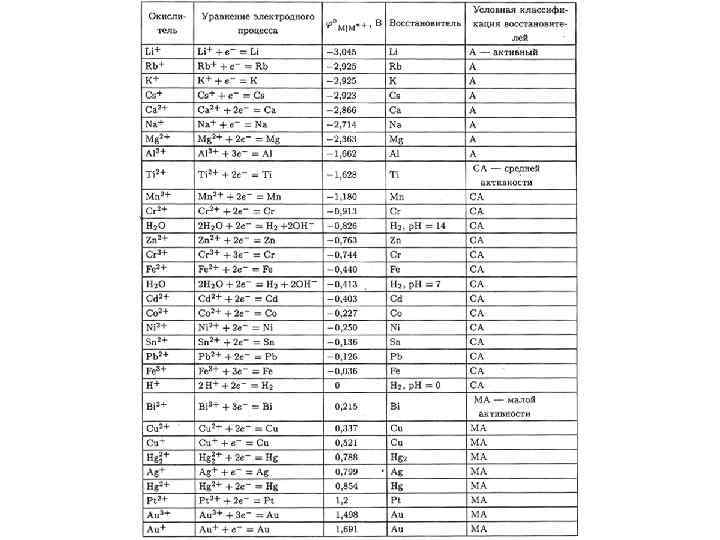
 Как связаны между собой положение металла в Ряду ряд активности РН ПС Zn > Cu Zn ≈ Cu Напряжений и в ПС ? Li > K > Na > Li
Как связаны между собой положение металла в Ряду ряд активности РН ПС Zn > Cu Zn ≈ Cu Напряжений и в ПС ? Li > K > Na > Li
 В зависимости от положения в РН металлы делят на три условные группы Активные Средней активности Малоактивные Li - Al Al – (H 2) - Au Активные Средней активности реагируют Малоактивные реагируют, пассивируются: не реагируют (вытесняют Н 2) (Al, Ti, Cr, Fe, Co, Ni, Zn, Sn, Pb) Ca + H 2 O = Ca(OH)2 + H 2↑
В зависимости от положения в РН металлы делят на три условные группы Активные Средней активности Малоактивные Li - Al Al – (H 2) - Au Активные Средней активности реагируют Малоактивные реагируют, пассивируются: не реагируют (вытесняют Н 2) (Al, Ti, Cr, Fe, Co, Ni, Zn, Sn, Pb) Ca + H 2 O = Ca(OH)2 + H 2↑
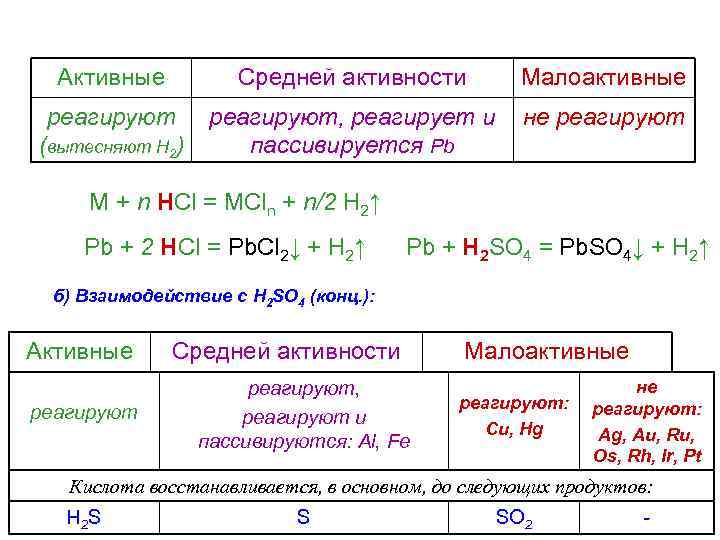 Активные Средней активности Малоактивные реагируют, реагирует и пассивируется Pb не реагируют (вытесняют Н 2) M + n HCl = MCln + n/2 H 2↑ Pb + 2 HCl = Pb. Cl 2↓ + H 2↑ Pb + H 2 SO 4 = Pb. SO 4↓ + H 2↑ б) Взаимодействие с H 2 SO 4 (конц. ): Активные реагируют Средней активности реагируют, реагируют и пассивируются: Al, Fe Малоактивные реагируют: Cu, Hg не реагируют: Ag, Au, Ru, Os, Rh, Ir, Pt Кислота восстанавливается, в основном, до следующих продуктов: H 2 S S SO 2 -
Активные Средней активности Малоактивные реагируют, реагирует и пассивируется Pb не реагируют (вытесняют Н 2) M + n HCl = MCln + n/2 H 2↑ Pb + 2 HCl = Pb. Cl 2↓ + H 2↑ Pb + H 2 SO 4 = Pb. SO 4↓ + H 2↑ б) Взаимодействие с H 2 SO 4 (конц. ): Активные реагируют Средней активности реагируют, реагируют и пассивируются: Al, Fe Малоактивные реагируют: Cu, Hg не реагируют: Ag, Au, Ru, Os, Rh, Ir, Pt Кислота восстанавливается, в основном, до следующих продуктов: H 2 S S SO 2 -
 Активные реагируют Средней активности реагируют, пассивируется Ti Малоактивные реагируют: Cu, Hg, Ag не реагируют: Au, Ru, Os, Rh, Ir, Pt Кислота восстанавливается, в основном, до следующих продуктов: NH 4 NO 3 N 2 , N 2 O NO Активные Средней активности реагируют, реагируют: реагируют и Cu, Hg, Ag пассивируются: Al, Ti, Cr, Fe - Малоактивные Кислота восстанавливается, в основном, до NO 2 не реагируют: Au, Ru, Os, Rh, Ir, Pt
Активные реагируют Средней активности реагируют, пассивируется Ti Малоактивные реагируют: Cu, Hg, Ag не реагируют: Au, Ru, Os, Rh, Ir, Pt Кислота восстанавливается, в основном, до следующих продуктов: NH 4 NO 3 N 2 , N 2 O NO Активные Средней активности реагируют, реагируют: реагируют и Cu, Hg, Ag пассивируются: Al, Ti, Cr, Fe - Малоактивные Кислота восстанавливается, в основном, до NO 2 не реагируют: Au, Ru, Os, Rh, Ir, Pt
 Особенность реакции с конц. HNO 3: Sn + 4 HNO 3(конц. ) = H 2 Sn. O 3 + 4 NO 2 + H 2 O Активные Средней активности Малоактивные реагирует только Be реагируют: Al, Zn, Sn, Pb не реагируют Zn + 2 HOH = Zn(OH)2↓ + H 2↑ Zn(OH)2 + 2 Na. OH = Na 2[Zn(OH)4] Zn + 2 HOH + 2 Na. OH = Na 2[Zn(OH)4] + H 2↑
Особенность реакции с конц. HNO 3: Sn + 4 HNO 3(конц. ) = H 2 Sn. O 3 + 4 NO 2 + H 2 O Активные Средней активности Малоактивные реагирует только Be реагируют: Al, Zn, Sn, Pb не реагируют Zn + 2 HOH = Zn(OH)2↓ + H 2↑ Zn(OH)2 + 2 Na. OH = Na 2[Zn(OH)4] Zn + 2 HOH + 2 Na. OH = Na 2[Zn(OH)4] + H 2↑
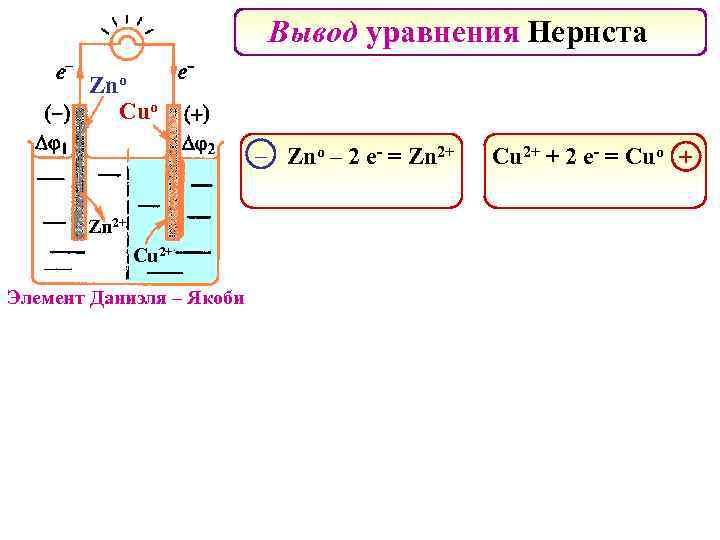 Вывод уравнения Нернста Znо Cuо – Zno – 2 e- = Zn 2+ Cu 2+ Элемент Даниэля – Якоби Cu 2+ + 2 e- = Cuo +
Вывод уравнения Нернста Znо Cuо – Zno – 2 e- = Zn 2+ Cu 2+ Элемент Даниэля – Якоби Cu 2+ + 2 e- = Cuo +
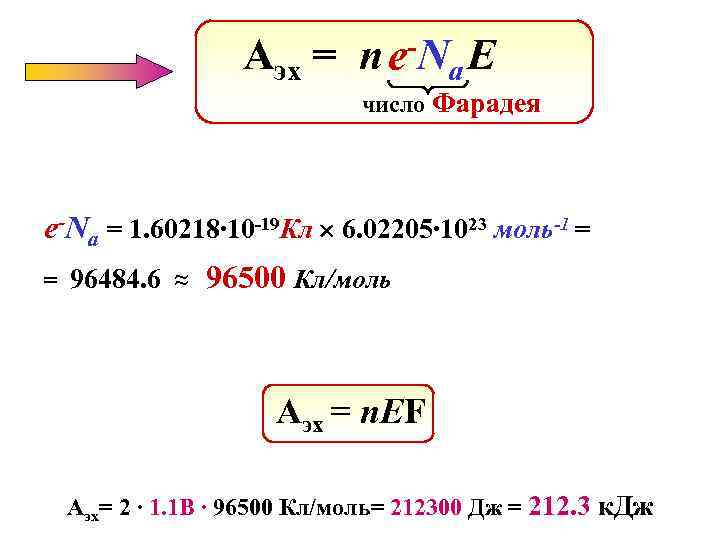 Аэх = -N nе a. E число Фарадея е-Na = 1. 60218∙ 10 -19 Кл 6. 02205∙ 1023 моль-1 = = 96484. 6 ≈ 96500 Кл/моль Аэх = n. EF Аэх= 2 ∙ 1. 1 B ∙ 96500 Кл/моль= 212300 Дж = 212. 3 к. Дж
Аэх = -N nе a. E число Фарадея е-Na = 1. 60218∙ 10 -19 Кл 6. 02205∙ 1023 моль-1 = = 96484. 6 ≈ 96500 Кл/моль Аэх = n. EF Аэх= 2 ∙ 1. 1 B ∙ 96500 Кл/моль= 212300 Дж = 212. 3 к. Дж
 ΔGo = - Аэх ΔGo = -n. FEo
ΔGo = - Аэх ΔGo = -n. FEo
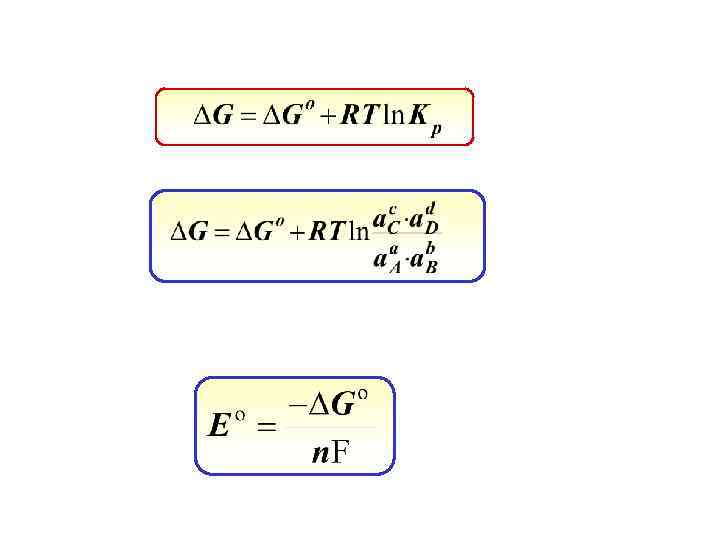
 Для активностей: Для концентраций:
Для активностей: Для концентраций:
 1) Fe 2+ + 2 e-→ Feо 2) Sn 4+ + 2 e-→ Sn 2+ 3) Cr 2 O 72 - + 14 H+ + 6 е- → 2 Cr 3+ + 7 H 2 O
1) Fe 2+ + 2 e-→ Feо 2) Sn 4+ + 2 e-→ Sn 2+ 3) Cr 2 O 72 - + 14 H+ + 6 е- → 2 Cr 3+ + 7 H 2 O
 = 0 В (р. Н 0), E = - 0. 059 p. H = -0. 41 В (р. Н 7), = -0. 82 В (р. Н 14)
= 0 В (р. Н 0), E = - 0. 059 p. H = -0. 41 В (р. Н 7), = -0. 82 В (р. Н 14)
 О 2 + 4 Н+ + 4 e-→ 2 Н 2 О = 1. 23 В (р. Н 0), E = 1. 228 - 0. 059 p. H = 0. 81 В (р. Н 7), = 0. 40 В (р. Н 14)
О 2 + 4 Н+ + 4 e-→ 2 Н 2 О = 1. 23 В (р. Н 0), E = 1. 228 - 0. 059 p. H = 0. 81 В (р. Н 7), = 0. 40 В (р. Н 14)
 2 Н+ + 2 е- → Н 2 Eo = 0. 000 B 2 Н 2 О + 2 е- → Н 2 + 2 ОН- Eo = -0. 828 B
2 Н+ + 2 е- → Н 2 Eo = 0. 000 B 2 Н 2 О + 2 е- → Н 2 + 2 ОН- Eo = -0. 828 B
 2 Н 2 О - 4 е- → О 2 + 4 Н+ Eo = 1. 229 B 4 ОН- - 4 е- → О 2 + 2 Н 2 О Eo = 0. 401 B Окисление: 4 K 2 Fe. O 4 + 10 H 2 O → 8 KOH + 4 Fe(OH)3 + 3 O 2 4 KMn. O 4 + 2 H 2 O → 4 Mn. O 2 + 4 KOH + 3 O 2 Восстановление: 4 Fe(OН)2 + O 2 + 2 H 2 O → 4 Fe(OH)3 Si + 4 KOH + H 2 O → K 2 Si. O 3 + 2 H 2
2 Н 2 О - 4 е- → О 2 + 4 Н+ Eo = 1. 229 B 4 ОН- - 4 е- → О 2 + 2 Н 2 О Eo = 0. 401 B Окисление: 4 K 2 Fe. O 4 + 10 H 2 O → 8 KOH + 4 Fe(OH)3 + 3 O 2 4 KMn. O 4 + 2 H 2 O → 4 Mn. O 2 + 4 KOH + 3 O 2 Восстановление: 4 Fe(OН)2 + O 2 + 2 H 2 O → 4 Fe(OH)3 Si + 4 KOH + H 2 O → K 2 Si. O 3 + 2 H 2

 Гальванический элемент Zn + Cu 2+ = Zn 2+ + Cu Zn – Red (анод) Zn – 2 e- = Zn 2+ Cu 2+ - Ox (катод) Cu 2+ + 2 e- = Cu
Гальванический элемент Zn + Cu 2+ = Zn 2+ + Cu Zn – Red (анод) Zn – 2 e- = Zn 2+ Cu 2+ - Ox (катод) Cu 2+ + 2 e- = Cu
![ΔE = E 0(Cu 2+|Cu) + 0, 029 lg[Сu 2+] (−)Cu | Cu. SO ΔE = E 0(Cu 2+|Cu) + 0, 029 lg[Сu 2+] (−)Cu | Cu. SO](https://present5.com/presentation/3/-29272521_22923438.pdf-img/-29272521_22923438.pdf-71.jpg) ΔE = E 0(Cu 2+|Cu) + 0, 029 lg[Сu 2+] (−)Cu | Cu. SO 4 | Cu(+) С 1 < С 2 Cu 2+ + 2 e− → Cu Cu − 2 e− → Cu 2+ ΔE = E 0(Cu 2+|Cu) + 0, 029 lg. С 2 − E 0(Cu 2+|Cu) − 0, 029 lg. С 1 = 0, 029 lg. С 2/С 1
ΔE = E 0(Cu 2+|Cu) + 0, 029 lg[Сu 2+] (−)Cu | Cu. SO 4 | Cu(+) С 1 < С 2 Cu 2+ + 2 e− → Cu Cu − 2 e− → Cu 2+ ΔE = E 0(Cu 2+|Cu) + 0, 029 lg. С 2 − E 0(Cu 2+|Cu) − 0, 029 lg. С 1 = 0, 029 lg. С 2/С 1
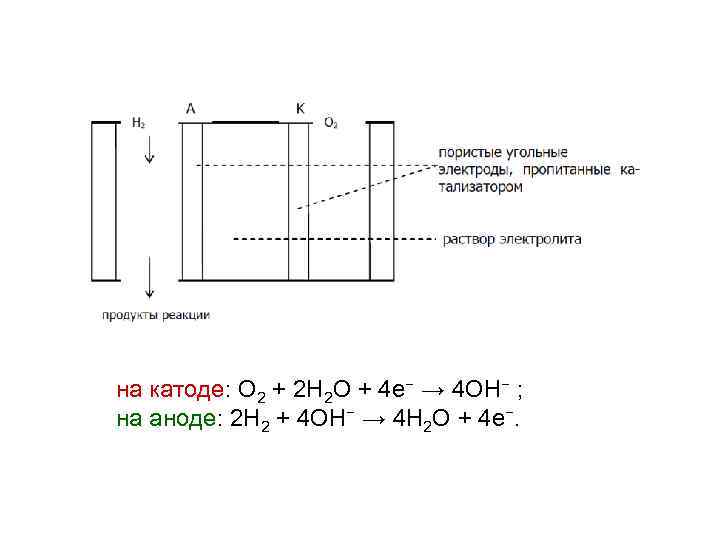 на катоде: O 2 + 2 H 2 O + 4 e− → 4 OH− ; на аноде: 2 H 2 + 4 OH− → 4 H 2 O + 4 e−.
на катоде: O 2 + 2 H 2 O + 4 e− → 4 OH− ; на аноде: 2 H 2 + 4 OH− → 4 H 2 O + 4 e−.
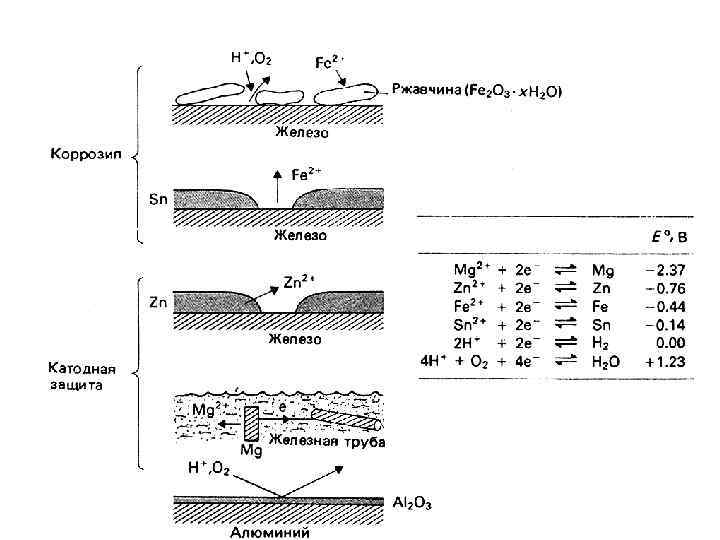
 Коррозия металлов Fe + O 2 → Fe. O + Fe 2 O 3 + Fe 3 O 4 Fe 3 С + O 2 → Fe + CO 2 Fe 3 С + H 2 → Fe + CH 4 - «окалина» - «обезуглероживание Пв» - «водородная хрупкость» стали
Коррозия металлов Fe + O 2 → Fe. O + Fe 2 O 3 + Fe 3 O 4 Fe 3 С + O 2 → Fe + CO 2 Fe 3 С + H 2 → Fe + CH 4 - «окалина» - «обезуглероживание Пв» - «водородная хрупкость» стали
 Электрохимическая коррозия металлов
Электрохимическая коррозия металлов
 (Bi … Rh) (Hg, Pd, Ir, Pt) (Au)
(Bi … Rh) (Hg, Pd, Ir, Pt) (Au)
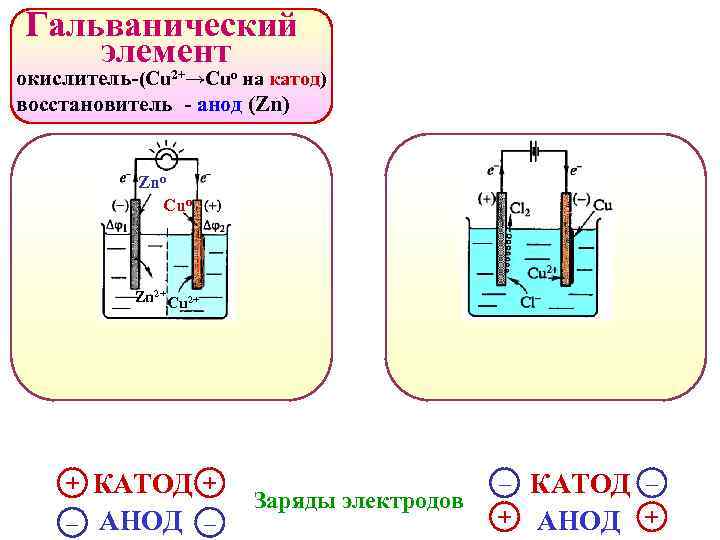 Гальванический элемент окислитель-(Cu 2+→Сuо на катод) восстановитель - анод (Zn) Znо Cuо Zn 2+ Cu 2+ + КАТОД + – АНОД – Заряды электродов – КАТОД – + АНОД +
Гальванический элемент окислитель-(Cu 2+→Сuо на катод) восстановитель - анод (Zn) Znо Cuо Zn 2+ Cu 2+ + КАТОД + – АНОД – Заряды электродов – КАТОД – + АНОД +
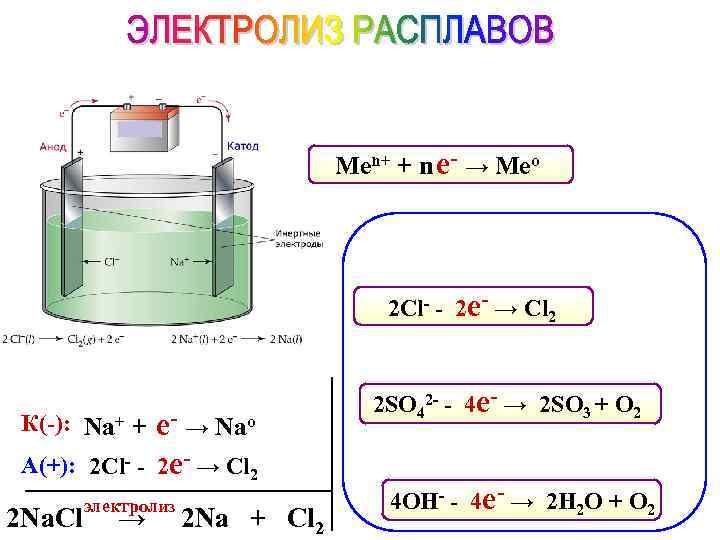 Men+ + n е- → Meo 2 Cl- - 2 е- → Cl 2 К(-): Na+ + е- → Nao А(+): 2 Cl- - 2 е- → Cl 2 2 Na. Cl электролиз → 2 Na + Cl 2 2 SO 42 - - 4 е- → 2 SO 3 + O 2 4 OH- - 4 е- → 2 H 2 O + O 2
Men+ + n е- → Meo 2 Cl- - 2 е- → Cl 2 К(-): Na+ + е- → Nao А(+): 2 Cl- - 2 е- → Cl 2 2 Na. Cl электролиз → 2 Na + Cl 2 2 SO 42 - - 4 е- → 2 SO 3 + O 2 4 OH- - 4 е- → 2 H 2 O + O 2
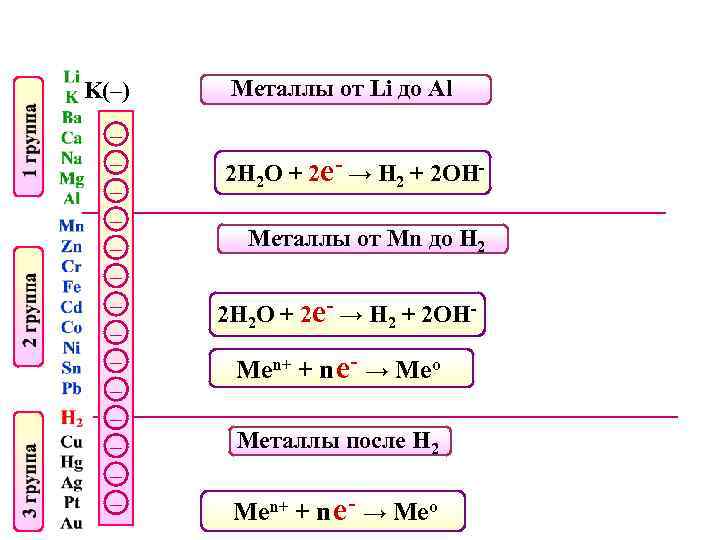 K(–) – – – – Металлы от Li до Al 2 Н 2 О + 2 е- → Н 2 + 2 ОНМеталлы от Mn до H 2 2 Н 2 О + 2 е- → Н 2 + 2 ОН- Men+ + n е- → Meo Металлы после H 2 Men+ + n е- → Meo
K(–) – – – – Металлы от Li до Al 2 Н 2 О + 2 е- → Н 2 + 2 ОНМеталлы от Mn до H 2 2 Н 2 О + 2 е- → Н 2 + 2 ОН- Men+ + n е- → Meo Металлы после H 2 Men+ + n е- → Meo
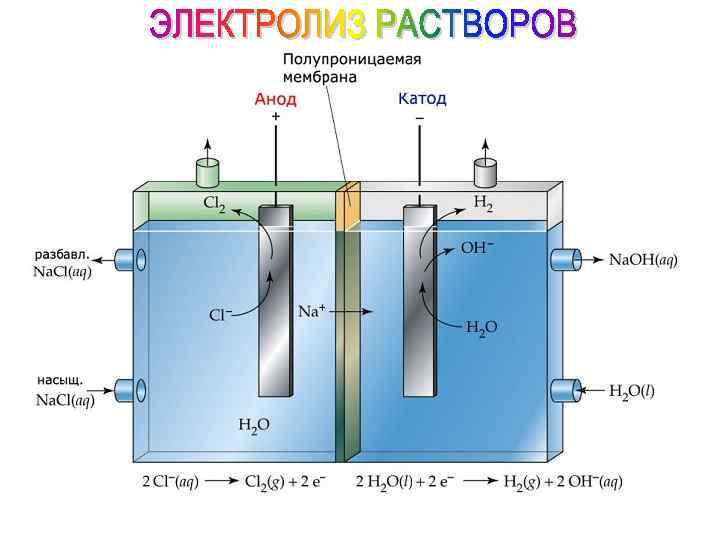
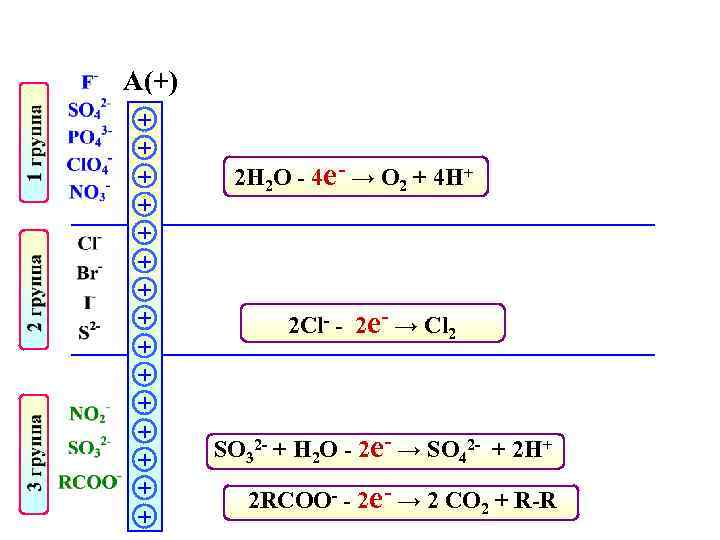 А(+) + + + + 2 Н 2 О - 4 е- → О 2 + 4 Н+ 2 Cl- - 2 е- → Cl 2 SO 32 - + Н 2 О - 2 е- → SO 42 - + 2 Н+ 2 RCOO- - 2 е- → 2 CO 2 + R-R
А(+) + + + + 2 Н 2 О - 4 е- → О 2 + 4 Н+ 2 Cl- - 2 е- → Cl 2 SO 32 - + Н 2 О - 2 е- → SO 42 - + 2 Н+ 2 RCOO- - 2 е- → 2 CO 2 + R-R
 Пример: Электролиз раствора Cu. SO 4 К(-): Cun+ + 2 е- → Cuo А(+): 2 Н 2 О - 4 е- → О 2 + 4 Н+ восстановление окисление электролиз 2 Cu. SO 4 + 2 H 2 O → 2 Cu + O 2 + 2 H 2 SO 4 КАТОД (-): АНОД (+):
Пример: Электролиз раствора Cu. SO 4 К(-): Cun+ + 2 е- → Cuo А(+): 2 Н 2 О - 4 е- → О 2 + 4 Н+ восстановление окисление электролиз 2 Cu. SO 4 + 2 H 2 O → 2 Cu + O 2 + 2 H 2 SO 4 КАТОД (-): АНОД (+):
 Законы М. ФАРАДЕЯ (XIX в. ) где М(В) –эквивалентная масса вещества В, I - сила тока, t - время, F - число Фарадея
Законы М. ФАРАДЕЯ (XIX в. ) где М(В) –эквивалентная масса вещества В, I - сила тока, t - время, F - число Фарадея
 ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА – АНОД + КАТОД Разряд Заряд – АНОД + КАТОД – КАТОД
ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА – АНОД + КАТОД Разряд Заряд – АНОД + КАТОД – КАТОД


