98f506a628fcf9c18110d7683779575a.ppt
- Количество слайдов: 132
 HACEK y Relacionados Dr Carlos A. Vay - Profesor Asociado Dpto. de Bioquímica Clínica. - Facultad de Farmacia y Bioquímica. UBA. - Jefe Asistencial. Laboratorio Bacteriología. Hospital de Clínicas. UBA. - Director Carrera de Especialización en Bacteriología Clínica. UBA. - Jefe Laboratorio de Microbiología. Sanatorio Mater Dei.
HACEK y Relacionados Dr Carlos A. Vay - Profesor Asociado Dpto. de Bioquímica Clínica. - Facultad de Farmacia y Bioquímica. UBA. - Jefe Asistencial. Laboratorio Bacteriología. Hospital de Clínicas. UBA. - Director Carrera de Especialización en Bacteriología Clínica. UBA. - Jefe Laboratorio de Microbiología. Sanatorio Mater Dei.
 • HACEK o ACEKS ? ? ?
• HACEK o ACEKS ? ? ?
 Grupo HACEK H. Haemophilus aphrophilus-paraphrophilus A. Actinobacillus actinomycetemcomitans C. Cardiobacterium hominis E. Eikenella corrodens K. Kingella kingae / Kingella denitrificans/K. oralis
Grupo HACEK H. Haemophilus aphrophilus-paraphrophilus A. Actinobacillus actinomycetemcomitans C. Cardiobacterium hominis E. Eikenella corrodens K. Kingella kingae / Kingella denitrificans/K. oralis
 Haemophilus aphrophilus, H. paraphrophilus, H. segnis y Actinobacillus actinomycetemcomitans: Aggregatibacter aphrophilus, A segnis y A. actinomycetemcomitans Narskov-Laurinsen et al, IJSEM, 2006 Kingella indologenes: Suttonella indologenes Dewhirst et al, IJSB, 1990
Haemophilus aphrophilus, H. paraphrophilus, H. segnis y Actinobacillus actinomycetemcomitans: Aggregatibacter aphrophilus, A segnis y A. actinomycetemcomitans Narskov-Laurinsen et al, IJSEM, 2006 Kingella indologenes: Suttonella indologenes Dewhirst et al, IJSB, 1990
 Microorganismos relacionados Capnocytophaga (DF-1 -DF-2) Leptotrichia buccalis Pasteurella/Actinobacillus (otros diferentes de A. actinomycetemcomitans) Disgonomonas (DF-3) Nesseria animaloris (Ef 4 -a) (N. zoodegmatis -EF 4 -b-: no fermentador) Neisseria weaveri (M 5) Neisseria elongata ss nitroreducens (M 6) Neisseria elongata ss elongata Neisseria elongata ss glycolytica Streptobacillus moniliformis Chromobacterium violaceum* Suttonella indologenes Bisgard taxon y grupo “SP”, DF 3 (like) Simonsiella muelleri
Microorganismos relacionados Capnocytophaga (DF-1 -DF-2) Leptotrichia buccalis Pasteurella/Actinobacillus (otros diferentes de A. actinomycetemcomitans) Disgonomonas (DF-3) Nesseria animaloris (Ef 4 -a) (N. zoodegmatis -EF 4 -b-: no fermentador) Neisseria weaveri (M 5) Neisseria elongata ss nitroreducens (M 6) Neisseria elongata ss elongata Neisseria elongata ss glycolytica Streptobacillus moniliformis Chromobacterium violaceum* Suttonella indologenes Bisgard taxon y grupo “SP”, DF 3 (like) Simonsiella muelleri
 Microorganismos relacionados Bartonella-Afipia ( crecimiento > 14 días) Spirillum minus Campylobacter Bordetella ( no fermentador) NO-1 ( no fermentador) Francisella spp (no fermentador) Brucella spp (no fermentador) Alkanindiges hongkongensis (no fermentador)
Microorganismos relacionados Bartonella-Afipia ( crecimiento > 14 días) Spirillum minus Campylobacter Bordetella ( no fermentador) NO-1 ( no fermentador) Francisella spp (no fermentador) Brucella spp (no fermentador) Alkanindiges hongkongensis (no fermentador)
 HACEK Lento desarrollo 48 - 72 hs colonias visibles Hemocultivos 2 - 5 días hasta 2 semanas. Requerimiento CO 2 Estímulo para el desarrollo Hemina exalta el crecimiento en el aislamiento inicial Alto inóculo para una apropiada identificación
HACEK Lento desarrollo 48 - 72 hs colonias visibles Hemocultivos 2 - 5 días hasta 2 semanas. Requerimiento CO 2 Estímulo para el desarrollo Hemina exalta el crecimiento en el aislamiento inicial Alto inóculo para una apropiada identificación
 HACEK Hemocultivos Automatizados Tiempo media: 3 días Ninguna Bacteriemia por HACEK se detectó con extendida incubación ( > 5 días) Petti C. et al; JCM; 2006
HACEK Hemocultivos Automatizados Tiempo media: 3 días Ninguna Bacteriemia por HACEK se detectó con extendida incubación ( > 5 días) Petti C. et al; JCM; 2006
 Grupo HACEK y Relacionados Son parásitos de los animales: mucosas No son microorganismos de vida libre, con excepción de C. violaceum HACEK: forman parte de los microorganismos de la cavidad oral humana HACEK: son agentes de endocarditis de evolución subaguda, grandes vegetaciones y tendencia a la embolización Actualmente se reconocen en un número muy variado de infecciones, aunque algunas especies están ligadas casi exclusivamente a la EI (Cardiobacterium hominis)
Grupo HACEK y Relacionados Son parásitos de los animales: mucosas No son microorganismos de vida libre, con excepción de C. violaceum HACEK: forman parte de los microorganismos de la cavidad oral humana HACEK: son agentes de endocarditis de evolución subaguda, grandes vegetaciones y tendencia a la embolización Actualmente se reconocen en un número muy variado de infecciones, aunque algunas especies están ligadas casi exclusivamente a la EI (Cardiobacterium hominis)
 Grupo HACEK Endocarditis Infecciosa: 2 -5 % ( con Hemocultivos positivos) Bacteriemia: 0. 1 % ( Hemocultivos Positivos) Petti et al, JCM, 2006
Grupo HACEK Endocarditis Infecciosa: 2 -5 % ( con Hemocultivos positivos) Bacteriemia: 0. 1 % ( Hemocultivos Positivos) Petti et al, JCM, 2006
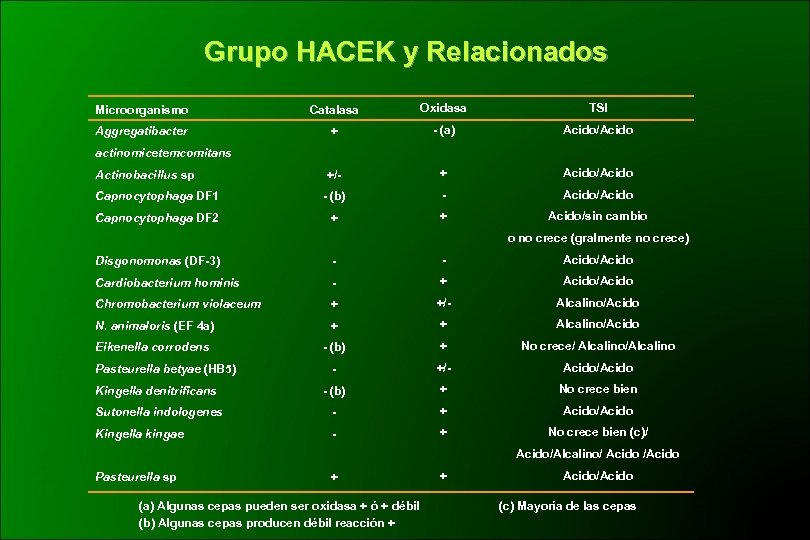 Grupo HACEK y Relacionados Microorganismo Catalasa Oxidasa TSI Aggregatibacter + - (a) Acido/Acido +/- + Acido/Acido Capnocytophaga DF 1 - (b) - Acido/Acido Capnocytophaga DF 2 + + Acido/sin cambio actinomicetemcomitans Actinobacillus sp o no crece (gralmente no crece) Disgonomonas (DF-3) - - Acido/Acido Cardiobacterium hominis - + Acido/Acido Chromobacterium violaceum + +/- Alcalino/Acido N. animaloris (EF 4 a) + + Alcalino/Acido Eikenella corrodens - (b) + No crece/ Alcalino/Alcalino - +/- Acido/Acido Kingella denitrificans - (b) + No crece bien Sutonella indologenes - + Acido/Acido Kingella kingae - + No crece bien (c)/ Pasteurella betyae (HB 5) Acido/Alcalino/ Acido /Acido Pasteurella sp + (a) Algunas cepas pueden ser oxidasa + ó + débil (b) Algunas cepas producen débil reacción + + Acido/Acido (c) Mayoría de las cepas
Grupo HACEK y Relacionados Microorganismo Catalasa Oxidasa TSI Aggregatibacter + - (a) Acido/Acido +/- + Acido/Acido Capnocytophaga DF 1 - (b) - Acido/Acido Capnocytophaga DF 2 + + Acido/sin cambio actinomicetemcomitans Actinobacillus sp o no crece (gralmente no crece) Disgonomonas (DF-3) - - Acido/Acido Cardiobacterium hominis - + Acido/Acido Chromobacterium violaceum + +/- Alcalino/Acido N. animaloris (EF 4 a) + + Alcalino/Acido Eikenella corrodens - (b) + No crece/ Alcalino/Alcalino - +/- Acido/Acido Kingella denitrificans - (b) + No crece bien Sutonella indologenes - + Acido/Acido Kingella kingae - + No crece bien (c)/ Pasteurella betyae (HB 5) Acido/Alcalino/ Acido /Acido Pasteurella sp + (a) Algunas cepas pueden ser oxidasa + ó + débil (b) Algunas cepas producen débil reacción + + Acido/Acido (c) Mayoría de las cepas
 Eikenella corrodens 1958 Eiken Bacteroides corrodens 1962 E. King: HB 1 1972 Jacson y Goodman: Bacteroides corrodens (Eiken) Nuevo género: Eikenella 1973 Riley, Tatum, Weaver: HB 1 = E. corrodens 1990 Dewhirst Eikenella Familia Neisseriaceae
Eikenella corrodens 1958 Eiken Bacteroides corrodens 1962 E. King: HB 1 1972 Jacson y Goodman: Bacteroides corrodens (Eiken) Nuevo género: Eikenella 1973 Riley, Tatum, Weaver: HB 1 = E. corrodens 1990 Dewhirst Eikenella Familia Neisseriaceae
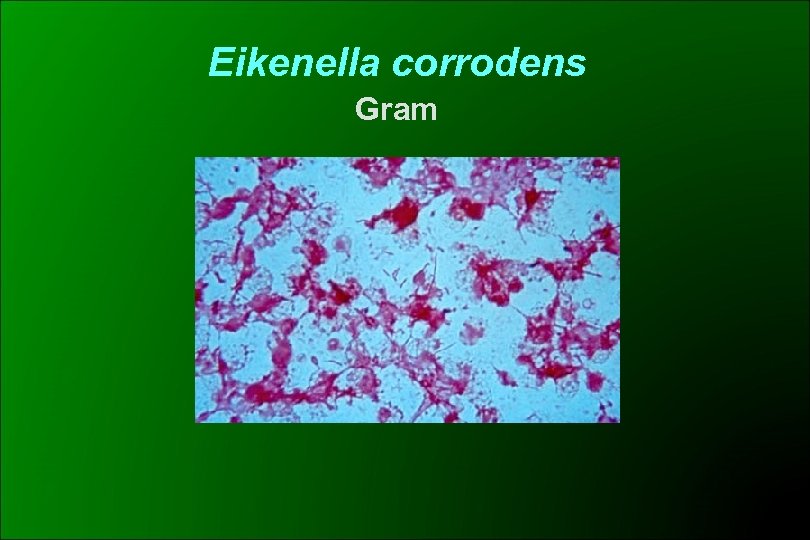
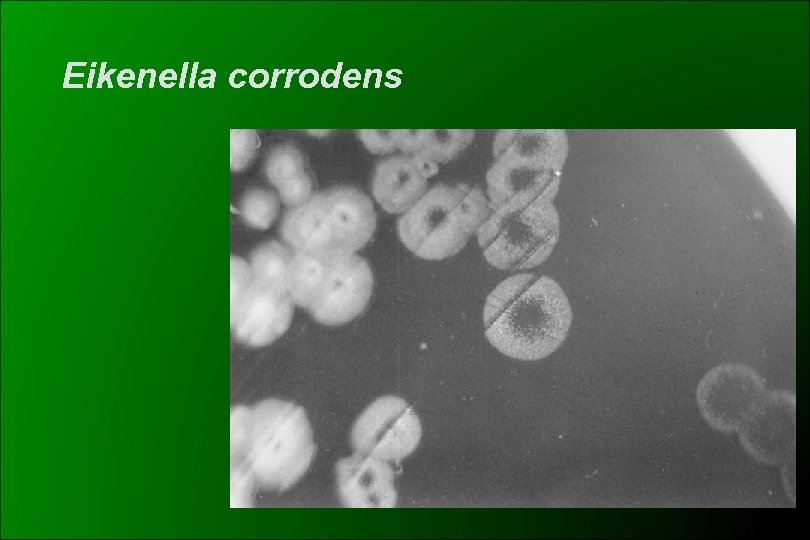
 Eikenella corrodens Características Bioquímicas Cocobacilos y bacilos gram negativos aerobios y anaerobios facultativos, extremos redondeados Dependiente del CO 2 Desarrollo lento Colonias pequeñas a las 48 hs, en AS ó ACH No todas las cepas “corroen” el agar (50%) Produce un olor a hipoclorito o a Pasteurella No utiliza carbohidratos Oxidasa +, catalasa - , NO 3 - a NO 2 - + Decarboxila lisina y ornitina
Eikenella corrodens Características Bioquímicas Cocobacilos y bacilos gram negativos aerobios y anaerobios facultativos, extremos redondeados Dependiente del CO 2 Desarrollo lento Colonias pequeñas a las 48 hs, en AS ó ACH No todas las cepas “corroen” el agar (50%) Produce un olor a hipoclorito o a Pasteurella No utiliza carbohidratos Oxidasa +, catalasa - , NO 3 - a NO 2 - + Decarboxila lisina y ornitina
 Eikenella corrodens Gram
Eikenella corrodens Gram
 Eikenella corrodens
Eikenella corrodens

 Eikenella corrodens Hábitat: mucosas (flora normal) Patología Infecciones (monomicrobianas y mixtas) Artritis Empiema pleural Endocarditis Osteomielitis Meningitis Neumonía Inf. Post-quirúrgica Abscesos de tejidos blandos (incluye A. cerebral) Abscesos e infecciones ginecológicas
Eikenella corrodens Hábitat: mucosas (flora normal) Patología Infecciones (monomicrobianas y mixtas) Artritis Empiema pleural Endocarditis Osteomielitis Meningitis Neumonía Inf. Post-quirúrgica Abscesos de tejidos blandos (incluye A. cerebral) Abscesos e infecciones ginecológicas
 Eikenella corrodens Primer aislamiento clínico Material quirúrgico de dedo de pulgar Dx: osteomielitis Coloración de Gram: regular cantidad de cocobacilos gram negativos, escasa cantidad de cocos gram positivos Leucocitos y piocitos: regular cantidad Cultivo: E. corrodens 90% S. aureus 10 %
Eikenella corrodens Primer aislamiento clínico Material quirúrgico de dedo de pulgar Dx: osteomielitis Coloración de Gram: regular cantidad de cocobacilos gram negativos, escasa cantidad de cocos gram positivos Leucocitos y piocitos: regular cantidad Cultivo: E. corrodens 90% S. aureus 10 %
 Eikenella corrodens Sensibilidad a los antibacterianos SENSIBLE VARIABLE RESISTENTE Tetraciclinas Cefalosporinas 1° G Lincosamidas (clindamicina Cloranfenicol Eritromicina y lincomicina) Cefoxitina, cefuroxima Aminoglucósidos Isoxazolilpenicilinas y y Cefalosporinas 3° G Penicilina y ampicilina Imipenem (la mayoría sensibles) Piperacilina Rifampicina Quinolonas meticilina
Eikenella corrodens Sensibilidad a los antibacterianos SENSIBLE VARIABLE RESISTENTE Tetraciclinas Cefalosporinas 1° G Lincosamidas (clindamicina Cloranfenicol Eritromicina y lincomicina) Cefoxitina, cefuroxima Aminoglucósidos Isoxazolilpenicilinas y y Cefalosporinas 3° G Penicilina y ampicilina Imipenem (la mayoría sensibles) Piperacilina Rifampicina Quinolonas meticilina
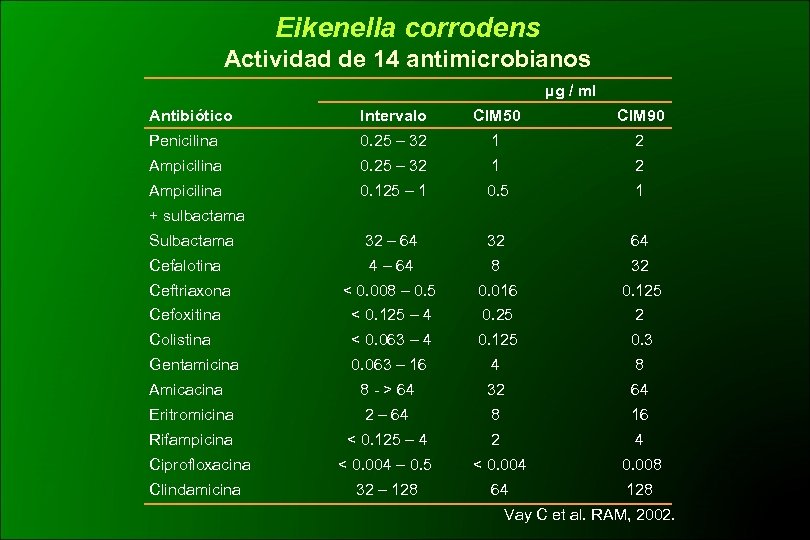 Eikenella corrodens Actividad de 14 antimicrobianos µg / ml Antibiótico Intervalo CIM 50 CIM 90 Penicilina 0. 25 – 32 1 2 Ampicilina 0. 125 – 1 0. 5 1 Sulbactama 32 – 64 32 64 Cefalotina 4 – 64 8 32 < 0. 008 – 0. 5 0. 016 0. 125 Cefoxitina < 0. 125 – 4 0. 25 2 Colistina < 0. 063 – 4 0. 125 0. 3 Gentamicina 0. 063 – 16 4 8 Amicacina 8 - > 64 32 64 Eritromicina 2 – 64 8 16 Rifampicina < 0. 125 – 4 2 4 < 0. 004 – 0. 5 < 0. 004 0. 008 32 – 128 64 128 + sulbactama Ceftriaxona Ciprofloxacina Clindamicina Vay C et al. RAM, 2002.
Eikenella corrodens Actividad de 14 antimicrobianos µg / ml Antibiótico Intervalo CIM 50 CIM 90 Penicilina 0. 25 – 32 1 2 Ampicilina 0. 125 – 1 0. 5 1 Sulbactama 32 – 64 32 64 Cefalotina 4 – 64 8 32 < 0. 008 – 0. 5 0. 016 0. 125 Cefoxitina < 0. 125 – 4 0. 25 2 Colistina < 0. 063 – 4 0. 125 0. 3 Gentamicina 0. 063 – 16 4 8 Amicacina 8 - > 64 32 64 Eritromicina 2 – 64 8 16 Rifampicina < 0. 125 – 4 2 4 < 0. 004 – 0. 5 < 0. 004 0. 008 32 – 128 64 128 + sulbactama Ceftriaxona Ciprofloxacina Clindamicina Vay C et al. RAM, 2002.
 Aggregatibacter (Haemophilus) aphrophilus (HB-2) CO 2 dependientes Adherencia al tubo en medios líquidos Colonias convexas, granular Pigmento amarillo Catalasa negativa NO 3 - a NO 2 - + 2 Biotipos ( NAD-Factor V- dependencia): - ex H. aphrophilus + ex H. paraphrophilus
Aggregatibacter (Haemophilus) aphrophilus (HB-2) CO 2 dependientes Adherencia al tubo en medios líquidos Colonias convexas, granular Pigmento amarillo Catalasa negativa NO 3 - a NO 2 - + 2 Biotipos ( NAD-Factor V- dependencia): - ex H. aphrophilus + ex H. paraphrophilus

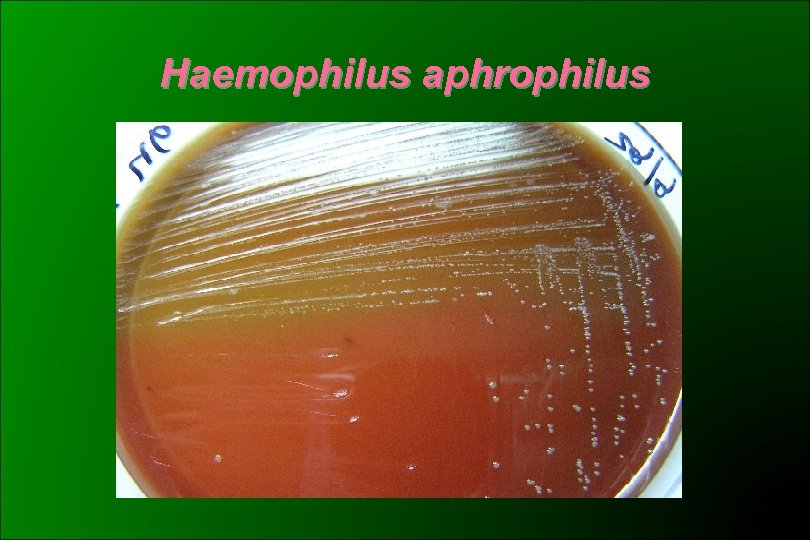 Haemophilus aphrophilus
Haemophilus aphrophilus

 Satelitismo
Satelitismo
 Aggregatibacter aphrophilus NAD dependiente Depende del Factor V (satelitismo) Diferenciar de Haemophilus parainfluenzae urea, I, ODC: V Aggregatibacter segnis lactosa -, manosa - Haemophilus parahaemolyticus urea +, ß, ox + manosa - H. parainfluenzae biotipo V: lactosa (ODC -, I -, urea -)
Aggregatibacter aphrophilus NAD dependiente Depende del Factor V (satelitismo) Diferenciar de Haemophilus parainfluenzae urea, I, ODC: V Aggregatibacter segnis lactosa -, manosa - Haemophilus parahaemolyticus urea +, ß, ox + manosa - H. parainfluenzae biotipo V: lactosa (ODC -, I -, urea -)
 Aggregatibacter (Haemophilus) aphrophilus Ex H. paraphrophilus - Microbiota normal del tracto respiratorio superior - Infecciones: Endocarditis (+ común) Sinusitis Otitis Neumonía/Empiema Artritis/Osteomielitis Abscesos cerebrales Laringoepiglotitis Inf. de heridas Celulitis e inf PPB en drogadictos endovenosos
Aggregatibacter (Haemophilus) aphrophilus Ex H. paraphrophilus - Microbiota normal del tracto respiratorio superior - Infecciones: Endocarditis (+ común) Sinusitis Otitis Neumonía/Empiema Artritis/Osteomielitis Abscesos cerebrales Laringoepiglotitis Inf. de heridas Celulitis e inf PPB en drogadictos endovenosos
 Aggregatibacter aphrophilus Son las especies del género más comunmente reconocidas en pacientes con endocarditis Endocarditis puede o no estar asociada con enfermedad valvular preexistente Embolismo arterial: mayor complicación de la endocarditis: 52% (86 casos): Parber et al (incluyendo la embolia cerebral) Factores predisponentes: Ø Lesión oral o dental: § Periodontitis § Placa dental § Trauma § Herida
Aggregatibacter aphrophilus Son las especies del género más comunmente reconocidas en pacientes con endocarditis Endocarditis puede o no estar asociada con enfermedad valvular preexistente Embolismo arterial: mayor complicación de la endocarditis: 52% (86 casos): Parber et al (incluyendo la embolia cerebral) Factores predisponentes: Ø Lesión oral o dental: § Periodontitis § Placa dental § Trauma § Herida
 Aggregatibacter aphrophilus Ø Manipulación dental Ø Cirugía oral Ø Enf. cardíaca valvular Ø Cirugía cardíaca q Afecta válvula nativa y protésica q Glomerulonefritis puede ser secundaria a la endocarditis q Incidencia endocarditis es más alta en individuos de mediana edad
Aggregatibacter aphrophilus Ø Manipulación dental Ø Cirugía oral Ø Enf. cardíaca valvular Ø Cirugía cardíaca q Afecta válvula nativa y protésica q Glomerulonefritis puede ser secundaria a la endocarditis q Incidencia endocarditis es más alta en individuos de mediana edad
 Endocarditis por otras especies de Haemophilus Ex H. paraphrophilus: 21 casos H. parainfluenzae: 66 casos (10% en pac c/ válvula protésica) embolia: 85% de los pacientes, desarrolla > 1 mes después de la manipulación dental. H. Influenzae: 13 casos Brouquit et al. CMR, 2001
Endocarditis por otras especies de Haemophilus Ex H. paraphrophilus: 21 casos H. parainfluenzae: 66 casos (10% en pac c/ válvula protésica) embolia: 85% de los pacientes, desarrolla > 1 mes después de la manipulación dental. H. Influenzae: 13 casos Brouquit et al. CMR, 2001
 Sensibilidad Antibiótica A. aphrophilus SENSIBLE Tetraciclinas VARIABLE Penicilina Cloranfenicol Aminoglucósidos Cefalosp. 3° G (CTX-CRO) Azalidos Fluor. Quinolonas Ampicilina
Sensibilidad Antibiótica A. aphrophilus SENSIBLE Tetraciclinas VARIABLE Penicilina Cloranfenicol Aminoglucósidos Cefalosp. 3° G (CTX-CRO) Azalidos Fluor. Quinolonas Ampicilina
 Aggregatibacter actinomycetemcomitans (CDC HB 3 y HB 4) 1985 Potts: Haemophilus actinomycetecomitans 1986 ICSB: rechazó la propuesta Similar a H. aphrophilus Cocobacilos gram negativos, subcultivos: filamentos Desarrollo lento (48 -72 hs) y CO 2 dependiente Colonias pequeñas, borde ligeramente irregular En 5 -7 días de incubación puede desarrollar una zona densa en el centro de la colonia con aspecto de estrella de 4 a 6 puntas Adherencia al tubo en medios líquidos Oxidasa – (aprox. 19% +) Catalasa + ONPG – Lactosa y sacarosa -
Aggregatibacter actinomycetemcomitans (CDC HB 3 y HB 4) 1985 Potts: Haemophilus actinomycetecomitans 1986 ICSB: rechazó la propuesta Similar a H. aphrophilus Cocobacilos gram negativos, subcultivos: filamentos Desarrollo lento (48 -72 hs) y CO 2 dependiente Colonias pequeñas, borde ligeramente irregular En 5 -7 días de incubación puede desarrollar una zona densa en el centro de la colonia con aspecto de estrella de 4 a 6 puntas Adherencia al tubo en medios líquidos Oxidasa – (aprox. 19% +) Catalasa + ONPG – Lactosa y sacarosa -
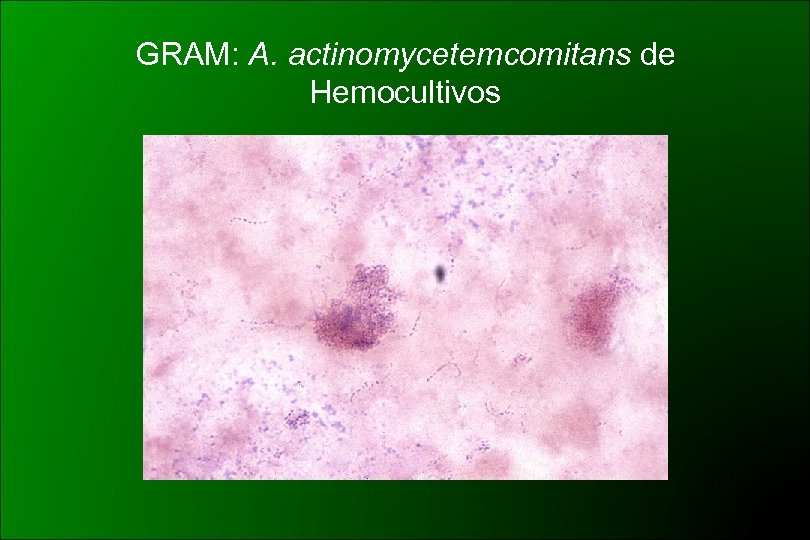 GRAM: A. actinomycetemcomitans de Hemocultivos
GRAM: A. actinomycetemcomitans de Hemocultivos
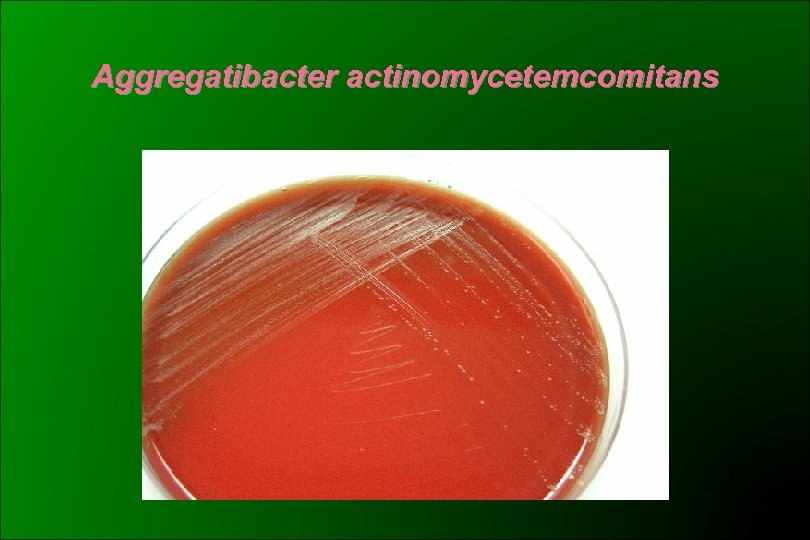 Aggregatibacter actinomycetemcomitans
Aggregatibacter actinomycetemcomitans
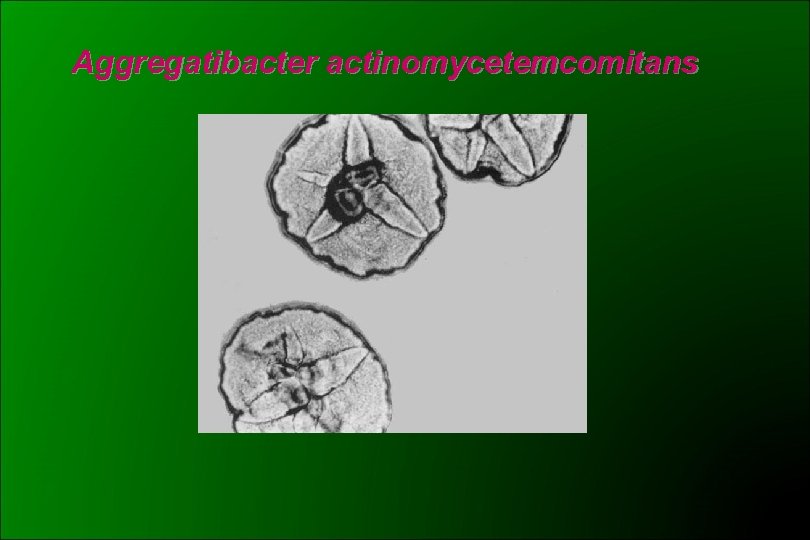 Aggregatibacter actinomycetemcomitans
Aggregatibacter actinomycetemcomitans
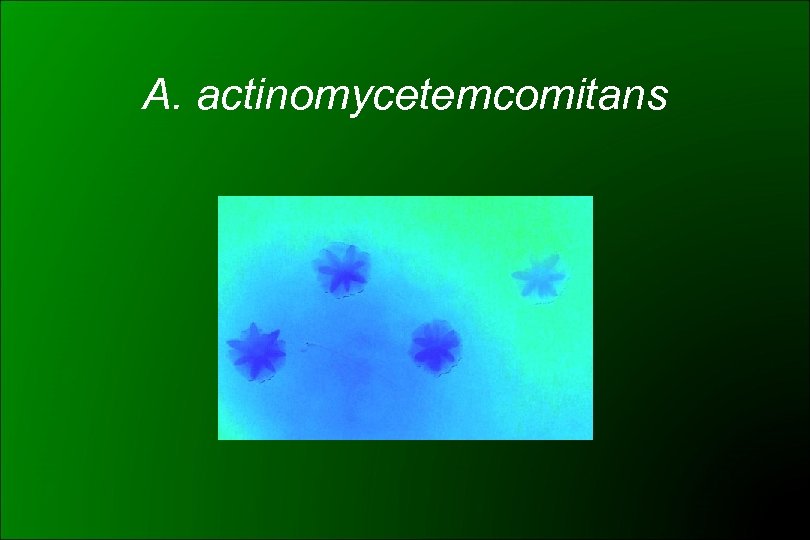 A. actinomycetemcomitans
A. actinomycetemcomitans
 Patologías Asociado con A. israeli en abscesos actinomicóticos Endocarditis (patología más frecuente): asociada con enfermedad cardiovascular subyacente ó a válvula protésica Infección dental: enfermedad periodontal en adultos jóvenes Otras infecciones: - Absceso cerebral - Celulitis - Abscesos subcutáneo - Absceso tiroideo - Osteomielitis - Neumonía - Ulcera de córnea - Infección urinaria Puertas de entrada: cavidad oral, abrasión de la piel, toracotomía, instrumentación urinaria
Patologías Asociado con A. israeli en abscesos actinomicóticos Endocarditis (patología más frecuente): asociada con enfermedad cardiovascular subyacente ó a válvula protésica Infección dental: enfermedad periodontal en adultos jóvenes Otras infecciones: - Absceso cerebral - Celulitis - Abscesos subcutáneo - Absceso tiroideo - Osteomielitis - Neumonía - Ulcera de córnea - Infección urinaria Puertas de entrada: cavidad oral, abrasión de la piel, toracotomía, instrumentación urinaria
 Aggregatibacter (Actinobacillus) actinomycetemcomitans Endocarditis 93 casos el más frecuente del grupo HACEK en EI Mayoría requirió más de 5 días de incubacuón. 46 % de los pacientes: enfermedad dental Ocurre en jóvenes de mediana edad 70% enfermedad cardíaca previa a la EI Válvula aórtica es la más afectada. 28% válvula protésica Reemplazo valvular requirió el 28% después de: falla cardíaca aguda, infección persistente o embolia sistémica Block et al Am J Med Sci, 1973 Chen et al Q J Med, 1991 Geraci et al Mayo Clin Proc, 1980 Carace et al Rev Infect Dis, 1988 Grand et al Arch Mal Coer Vaiss, 1994 Schack et al J Clin Microbiol, 1984 Paturet et al Clin Microbiol Infect, 2004
Aggregatibacter (Actinobacillus) actinomycetemcomitans Endocarditis 93 casos el más frecuente del grupo HACEK en EI Mayoría requirió más de 5 días de incubacuón. 46 % de los pacientes: enfermedad dental Ocurre en jóvenes de mediana edad 70% enfermedad cardíaca previa a la EI Válvula aórtica es la más afectada. 28% válvula protésica Reemplazo valvular requirió el 28% después de: falla cardíaca aguda, infección persistente o embolia sistémica Block et al Am J Med Sci, 1973 Chen et al Q J Med, 1991 Geraci et al Mayo Clin Proc, 1980 Carace et al Rev Infect Dis, 1988 Grand et al Arch Mal Coer Vaiss, 1994 Schack et al J Clin Microbiol, 1984 Paturet et al Clin Microbiol Infect, 2004
 Aggregatibacter (Actinobacillus) actinomycetemcomitans Endocarditis Infecciosa: Tiempo de detección Nº casos (55 Clínica Mayo) Tiempo 52 ( 1964 -1993) 7, 1 días 3 ( después de 1993) 2 días Paturel et al; Clin Microbiol Infect, 2004.
Aggregatibacter (Actinobacillus) actinomycetemcomitans Endocarditis Infecciosa: Tiempo de detección Nº casos (55 Clínica Mayo) Tiempo 52 ( 1964 -1993) 7, 1 días 3 ( después de 1993) 2 días Paturel et al; Clin Microbiol Infect, 2004.
 Aggregatibacter actinomycetemcomitans Sensibilidad Antibiótica SENSIBLE VARIABLE Tetraciclinas Penicilina Cloranfenicol Ampicilina Cefalosporinas de 3° Eritromicina Rifampicina Aminoglucósidos
Aggregatibacter actinomycetemcomitans Sensibilidad Antibiótica SENSIBLE VARIABLE Tetraciclinas Penicilina Cloranfenicol Ampicilina Cefalosporinas de 3° Eritromicina Rifampicina Aminoglucósidos
 Familia Cardiobacteriaceae Dewhirst y col 1990 Cardiobacterium hominis Suttonella indologenes
Familia Cardiobacteriaceae Dewhirst y col 1990 Cardiobacterium hominis Suttonella indologenes
 Cardiobacterium valvarum Ø Similar C. hominis Ø > Exigencia Ø Colonia < diámetro Ø Bacilos regulares Ø Manitol, matosa y sacarosa: negativos Han X et al. JCM; 2004
Cardiobacterium valvarum Ø Similar C. hominis Ø > Exigencia Ø Colonia < diámetro Ø Bacilos regulares Ø Manitol, matosa y sacarosa: negativos Han X et al. JCM; 2004
 Cardiobacterium hominis Desarrollo lento No produce cambios visibles en los hemocultivos Se recupera a partir de subcultivos BACTEC 3 - 5 días Gram de hemocultivos (BACTEC) +: no revela a menudo al microorganismo Sensibilidad c/centrifugación Gram V: extremos bulbosos y otro angular (chupetín-lágrima) y tendencia a la formación de rosetas Crece AS y Ach CO 2 5 - 7 % 48 -72 hs Puede horadar el agar a Kingella y Eikenella Indol + !
Cardiobacterium hominis Desarrollo lento No produce cambios visibles en los hemocultivos Se recupera a partir de subcultivos BACTEC 3 - 5 días Gram de hemocultivos (BACTEC) +: no revela a menudo al microorganismo Sensibilidad c/centrifugación Gram V: extremos bulbosos y otro angular (chupetín-lágrima) y tendencia a la formación de rosetas Crece AS y Ach CO 2 5 - 7 % 48 -72 hs Puede horadar el agar a Kingella y Eikenella Indol + !
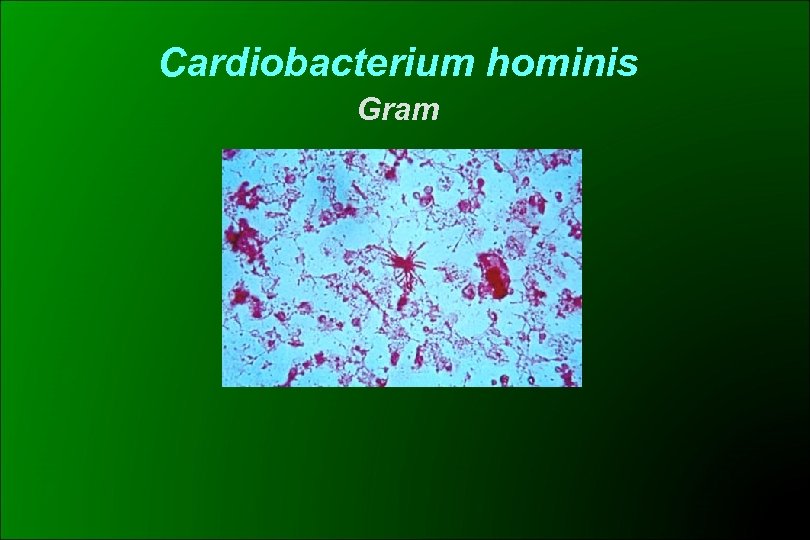 Cardiobacterium hominis Gram
Cardiobacterium hominis Gram
 Cardiobacterium hominis
Cardiobacterium hominis
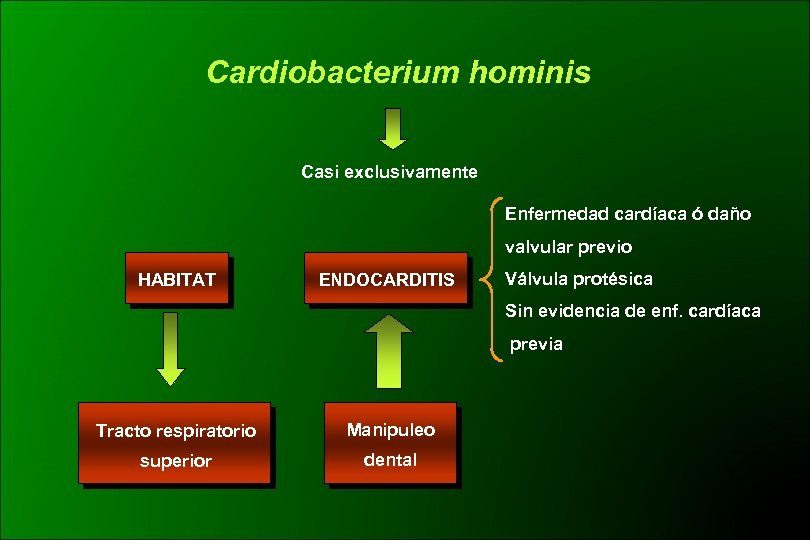 Cardiobacterium hominis Casi exclusivamente Enfermedad cardíaca ó daño valvular previo HABITAT ENDOCARDITIS Válvula protésica Sin evidencia de enf. cardíaca previa Tracto respiratorio Manipuleo superior dental
Cardiobacterium hominis Casi exclusivamente Enfermedad cardíaca ó daño valvular previo HABITAT ENDOCARDITIS Válvula protésica Sin evidencia de enf. cardíaca previa Tracto respiratorio Manipuleo superior dental
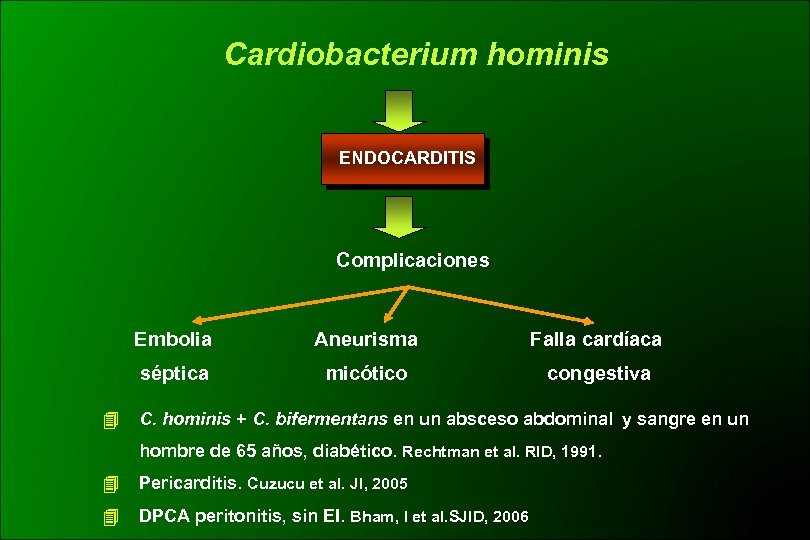 Cardiobacterium hominis ENDOCARDITIS Complicaciones Embolia Falla cardíaca séptica Aneurisma micótico congestiva C. hominis + C. bifermentans en un absceso abdominal y sangre en un hombre de 65 años, diabético. Rechtman et al. RID, 1991. Pericarditis. Cuzucu et al. JI, 2005 DPCA peritonitis, sin EI. Bham, I et al. SJID, 2006
Cardiobacterium hominis ENDOCARDITIS Complicaciones Embolia Falla cardíaca séptica Aneurisma micótico congestiva C. hominis + C. bifermentans en un absceso abdominal y sangre en un hombre de 65 años, diabético. Rechtman et al. RID, 1991. Pericarditis. Cuzucu et al. JI, 2005 DPCA peritonitis, sin EI. Bham, I et al. SJID, 2006
 Suttonella indologenes • Endocarditis: 1 caso • Infección ocular ( úlcera de córnea) • Infección ocular (úlcera de córnea) Jenny et al Rev Infect Dis, 1987 Sutton et al J Med Microbiol, 1972 Barberis et al Clin Microbiol News, 2007.
Suttonella indologenes • Endocarditis: 1 caso • Infección ocular ( úlcera de córnea) • Infección ocular (úlcera de córnea) Jenny et al Rev Infect Dis, 1987 Sutton et al J Med Microbiol, 1972 Barberis et al Clin Microbiol News, 2007.
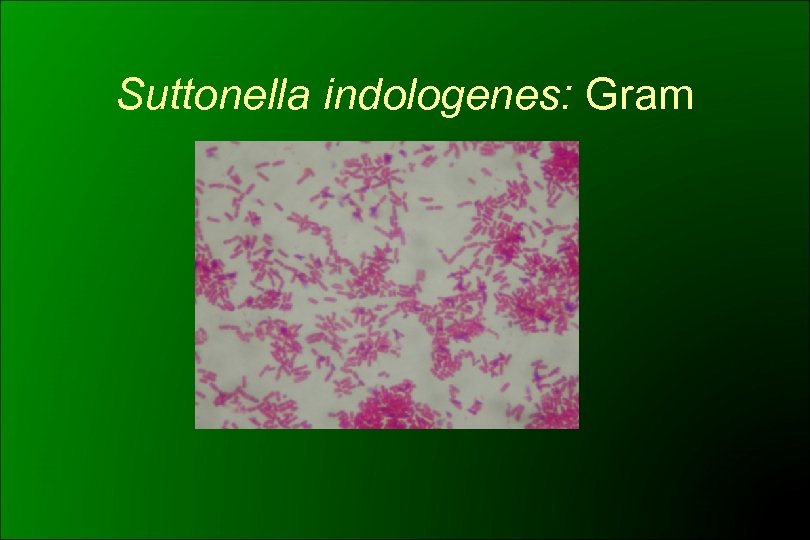 Suttonella indologenes: Gram
Suttonella indologenes: Gram

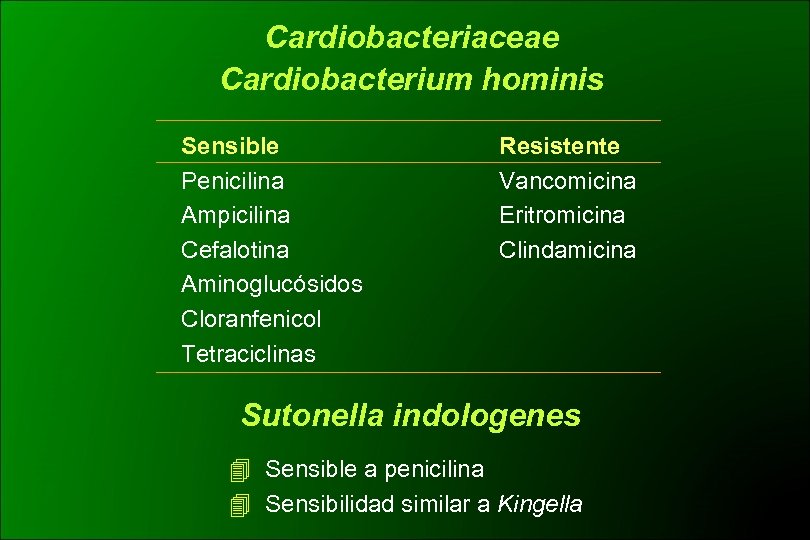 Cardiobacteriaceae Cardiobacterium hominis Sensible Penicilina Ampicilina Cefalotina Aminoglucósidos Cloranfenicol Tetraciclinas Resistente Vancomicina Eritromicina Clindamicina Sutonella indologenes Sensible a penicilina Sensibilidad similar a Kingella
Cardiobacteriaceae Cardiobacterium hominis Sensible Penicilina Ampicilina Cefalotina Aminoglucósidos Cloranfenicol Tetraciclinas Resistente Vancomicina Eritromicina Clindamicina Sutonella indologenes Sensible a penicilina Sensibilidad similar a Kingella
 Cardiobacterium hominis Beta-lactamasa Lu et al J Clin Microbiol, 2000 CIM 1 ug/ml CRO ? Le Quellec et al, Clin Infect Dis, 1994
Cardiobacterium hominis Beta-lactamasa Lu et al J Clin Microbiol, 2000 CIM 1 ug/ml CRO ? Le Quellec et al, Clin Infect Dis, 1994
 Tratamiento de Endocarditis por grupo HACEK Produce la cura de 82 - 87% de los pacientes (incluyendo el tratamiento quirúrgico). Berboni et al. Mayo Clinic Proc. , 1997 Ampicilina + gentamicina Ceftriaxona American Heart Association: 4 semanas: válvula nativa 6 semanas: válvula protésica Consenso argentino: - Ampicilina: + gentamicina: 4 semanas - Ceftriaxona 1 dosis diaria, 4 semanas. 6 semanas si la válvula es protésica. R. A. Cardiología. Vol. 7 (55), 2002.
Tratamiento de Endocarditis por grupo HACEK Produce la cura de 82 - 87% de los pacientes (incluyendo el tratamiento quirúrgico). Berboni et al. Mayo Clinic Proc. , 1997 Ampicilina + gentamicina Ceftriaxona American Heart Association: 4 semanas: válvula nativa 6 semanas: válvula protésica Consenso argentino: - Ampicilina: + gentamicina: 4 semanas - Ceftriaxona 1 dosis diaria, 4 semanas. 6 semanas si la válvula es protésica. R. A. Cardiología. Vol. 7 (55), 2002.
 HACEK Criterios CLSI M 45 -P, 2006 Condiciones del ensayo Antibióticos recomendados Dilución: Caldo MH Ceftriaxona-cefotaxima 2, 5 -5 % sangre equina lisada Ampicilina Inóculo: 0, 5 Mc Farland Amoxicicilina-ác clavulánico Incubación: 35ºC; CO 2 Imipenem 24 -48 hs Ciprofloxacina-levofloxacina TMS Beta-lactamasa
HACEK Criterios CLSI M 45 -P, 2006 Condiciones del ensayo Antibióticos recomendados Dilución: Caldo MH Ceftriaxona-cefotaxima 2, 5 -5 % sangre equina lisada Ampicilina Inóculo: 0, 5 Mc Farland Amoxicicilina-ác clavulánico Incubación: 35ºC; CO 2 Imipenem 24 -48 hs Ciprofloxacina-levofloxacina TMS Beta-lactamasa
 HACEK Criterios CLSI M 45 -P, 2006 Antibióticos PUNTOS DE CORTE Penicilina/Ampicilina S ≤ 1 ug/ml; I =2 ug/ml; R > 4 ug/ml AMS S ≤ 2/1 ug/ml; R ≥ 4/2 ug/ml CRO/CTX S ≤ 2 ug/ml Imipenem/Meropenem (Aggregatibacter) S ≤ 4 ug/ml; I = 8 ug/ml; R≥ 16 ug/ml (otros microorg) S ≤ 0, 5 ug/ml ; I = 1 ug/ml; R≥ 2 ug/ml Ciprofloxacina S ≤ 1 ug/ml; I=2 ug/ml; R≥ 4 ug/ml Levofloxacina S ≤ 2 ug/ml; I=4 ug/ml; R≥ 8 ug/ml Azitromicina S ≤ 4 ug/ml Tetraciclina S ≤ 2 ug/ml; I= 4 ug/ml; R ≥ 8 ug/ml TMS S ≤ 0, 5/9, 5 ug/ml; I= 1/19 -2/38; R ≥ 4/76 ug/ml
HACEK Criterios CLSI M 45 -P, 2006 Antibióticos PUNTOS DE CORTE Penicilina/Ampicilina S ≤ 1 ug/ml; I =2 ug/ml; R > 4 ug/ml AMS S ≤ 2/1 ug/ml; R ≥ 4/2 ug/ml CRO/CTX S ≤ 2 ug/ml Imipenem/Meropenem (Aggregatibacter) S ≤ 4 ug/ml; I = 8 ug/ml; R≥ 16 ug/ml (otros microorg) S ≤ 0, 5 ug/ml ; I = 1 ug/ml; R≥ 2 ug/ml Ciprofloxacina S ≤ 1 ug/ml; I=2 ug/ml; R≥ 4 ug/ml Levofloxacina S ≤ 2 ug/ml; I=4 ug/ml; R≥ 8 ug/ml Azitromicina S ≤ 4 ug/ml Tetraciclina S ≤ 2 ug/ml; I= 4 ug/ml; R ≥ 8 ug/ml TMS S ≤ 0, 5/9, 5 ug/ml; I= 1/19 -2/38; R ≥ 4/76 ug/ml
 Kingella kingae: patógeno emergente en la década del 90? Aumento de publicaciónes en Europa, Norte América, Sudamérica, Australia y Oriente medio: Responden a la optimización de los método microbiológicos de detección y la capacidad Laboratorio de microbiología de reconocer este agente.
Kingella kingae: patógeno emergente en la década del 90? Aumento de publicaciónes en Europa, Norte América, Sudamérica, Australia y Oriente medio: Responden a la optimización de los método microbiológicos de detección y la capacidad Laboratorio de microbiología de reconocer este agente.

 Kingella kingae Bacilos gram negativos grandes, en grupos, pares ó cadenas cortas Colonias pequeñas de diferentes tamaños Hemólisis V (b) Puede picar el agar No crecen en TSI Fermentan glucosa Oxidasa + Catalasa -
Kingella kingae Bacilos gram negativos grandes, en grupos, pares ó cadenas cortas Colonias pequeñas de diferentes tamaños Hemólisis V (b) Puede picar el agar No crecen en TSI Fermentan glucosa Oxidasa + Catalasa -
 Haemophilus haemolyticus
Haemophilus haemolyticus
 A quienes afecta? Niños sanos * Adultos con factores predisponentes: LES, Cirrois, AR, DBT, IRC, Anemia, Tx renal, Ca, OH, SIDA.
A quienes afecta? Niños sanos * Adultos con factores predisponentes: LES, Cirrois, AR, DBT, IRC, Anemia, Tx renal, Ca, OH, SIDA.
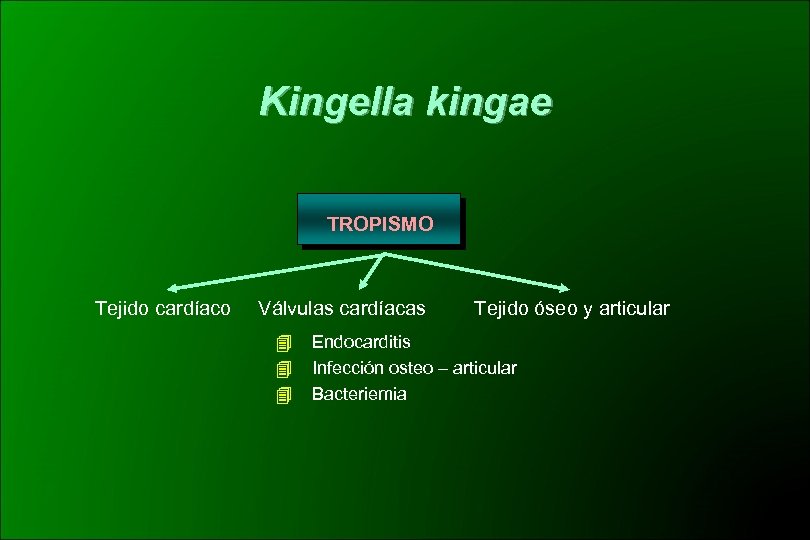 Kingella kingae TROPISMO Tejido cardíaco Válvulas cardíacas Tejido óseo y articular Endocarditis Infección osteo – articular Bacteriemia
Kingella kingae TROPISMO Tejido cardíaco Válvulas cardíacas Tejido óseo y articular Endocarditis Infección osteo – articular Bacteriemia
 Patogenia Puerta de entrada Endógena – En algunos pacientes se ha notado: – Ruptura de la mucosa orofaríngea – Pobre higiene oral – Faringitis – Ulceración de la mucosa (radioterapia) – Gastroenteritis aguda – Mayor Evidencia: Interacción con infección viral
Patogenia Puerta de entrada Endógena – En algunos pacientes se ha notado: – Ruptura de la mucosa orofaríngea – Pobre higiene oral – Faringitis – Ulceración de la mucosa (radioterapia) – Gastroenteritis aguda – Mayor Evidencia: Interacción con infección viral
 Kingella kingae Artritis séptica Hematógena Forma clínica más frecuente < 4 años Más frecuente microorganismo en niños < 3 años, después de la vacuna Hib (Lundy, J Pediatric. Orthop, 1998). Fiebre: 84% (Gutzanis; Pediatric Infect Dis, 1993) < 50. 000 GB/mm 3: 25 % (de Groot, RID, 1988)
Kingella kingae Artritis séptica Hematógena Forma clínica más frecuente < 4 años Más frecuente microorganismo en niños < 3 años, después de la vacuna Hib (Lundy, J Pediatric. Orthop, 1998). Fiebre: 84% (Gutzanis; Pediatric Infect Dis, 1993) < 50. 000 GB/mm 3: 25 % (de Groot, RID, 1988)
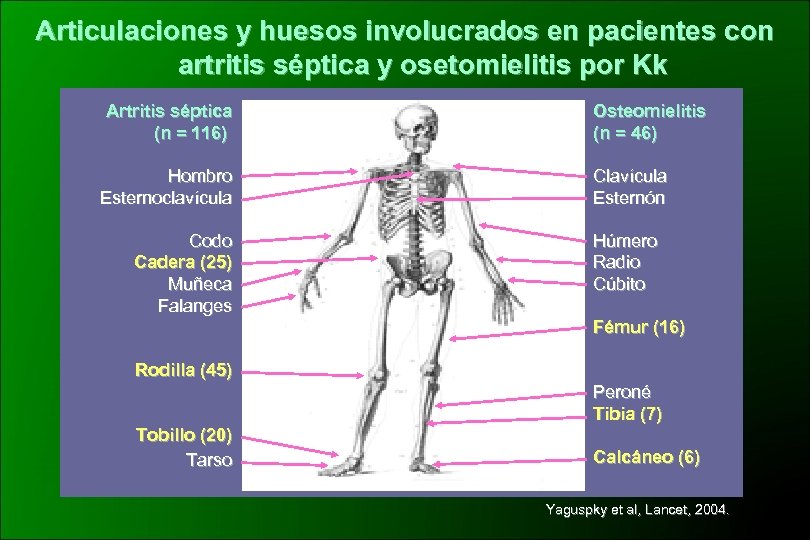 Articulaciones y huesos involucrados en pacientes con artritis séptica y osetomielitis por Kk Artritis séptica (n = 116) Hombro Esternoclavícula Codo Cadera (25) Muñeca Falanges Osteomielitis (n = 46) Clavícula Esternón Húmero Radio Cúbito Fémur (16) Rodilla (45) Peroné Tibia (7) Tobillo (20) Tarso Calcáneo (6) Yaguspky et al, Lancet, 2004.
Articulaciones y huesos involucrados en pacientes con artritis séptica y osetomielitis por Kk Artritis séptica (n = 116) Hombro Esternoclavícula Codo Cadera (25) Muñeca Falanges Osteomielitis (n = 46) Clavícula Esternón Húmero Radio Cúbito Fémur (16) Rodilla (45) Peroné Tibia (7) Tobillo (20) Tarso Calcáneo (6) Yaguspky et al, Lancet, 2004.
 Endocarditis: Kingella kingae (HACEK) 3 -5% de las EI Factores predisponentes - Enfermedad cardíaca previa: - Malformación congénita - Fiebre reumática - Prolapso de válvula mitral - Prótesis cardíaca - Disrupción de la mucosa orofaríngea, manipuleo dental, gingivitis, lesiones orales La endocarditis en pacientes sin antecedentes de enfermedad cardíaca también ha sido descripta El inmunocompromiso se presentó en 6 de 24 casos (además de la enf. cardíaca preexistente o la disrupción de la mucosa): - LES 2; Cirrosis 1; IS corticoides 1; IRC 1; SIDA 1 El rol de la inmunosupresión en la endocarditis por K. kingae no ha sido claramente definido
Endocarditis: Kingella kingae (HACEK) 3 -5% de las EI Factores predisponentes - Enfermedad cardíaca previa: - Malformación congénita - Fiebre reumática - Prolapso de válvula mitral - Prótesis cardíaca - Disrupción de la mucosa orofaríngea, manipuleo dental, gingivitis, lesiones orales La endocarditis en pacientes sin antecedentes de enfermedad cardíaca también ha sido descripta El inmunocompromiso se presentó en 6 de 24 casos (además de la enf. cardíaca preexistente o la disrupción de la mucosa): - LES 2; Cirrosis 1; IS corticoides 1; IRC 1; SIDA 1 El rol de la inmunosupresión en la endocarditis por K. kingae no ha sido claramente definido
 Bacteriemia Kingella kingae La presentación clínica: Bacteriemia sin evidencia de EI: > niños/ < adultos Puede mimetizar la infección sistémica por Neisseria: meningococcemia e infección gonocócica diseminada: lesiones en piel, articulación involucrada, meningitis aguda, petequias y rash Bacteriemia por K. kingae ha sido comunicada como causa inmediata de muerte en un paciente con SIDA Recientemente se describieron 2 casos de bacteriemia: ambos pacientes eran hemodializados por enfermedad renal terminal
Bacteriemia Kingella kingae La presentación clínica: Bacteriemia sin evidencia de EI: > niños/ < adultos Puede mimetizar la infección sistémica por Neisseria: meningococcemia e infección gonocócica diseminada: lesiones en piel, articulación involucrada, meningitis aguda, petequias y rash Bacteriemia por K. kingae ha sido comunicada como causa inmediata de muerte en un paciente con SIDA Recientemente se describieron 2 casos de bacteriemia: ambos pacientes eran hemodializados por enfermedad renal terminal
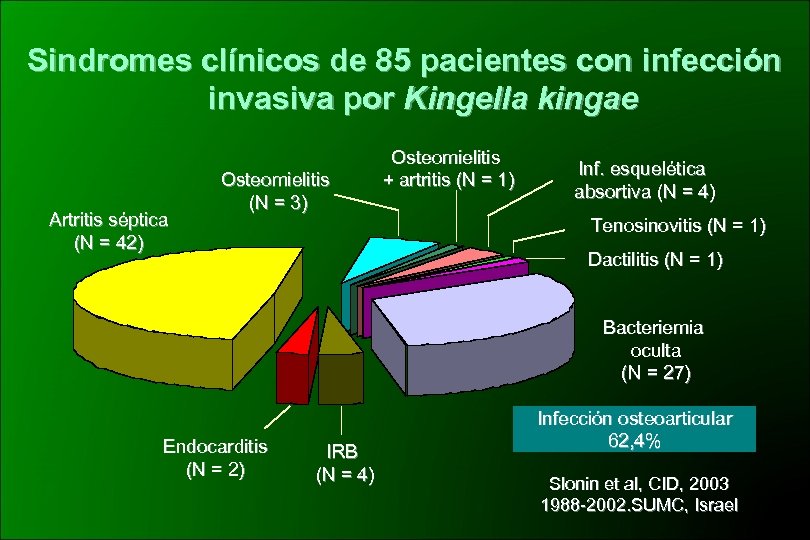 Sindromes clínicos de 85 pacientes con infección invasiva por Kingella kingae Artritis séptica (N = 42) Osteomielitis (N = 3) Osteomielitis + artritis (N = 1) Inf. esquelética absortiva (N = 4) Tenosinovitis (N = 1) Dactilitis (N = 1) Bacteriemia oculta (N = 27) Endocarditis (N = 2) IRB (N = 4) Infección osteoarticular 62, 4% Slonin et al, CID, 2003 1988 -2002. SUMC, Israel
Sindromes clínicos de 85 pacientes con infección invasiva por Kingella kingae Artritis séptica (N = 42) Osteomielitis (N = 3) Osteomielitis + artritis (N = 1) Inf. esquelética absortiva (N = 4) Tenosinovitis (N = 1) Dactilitis (N = 1) Bacteriemia oculta (N = 27) Endocarditis (N = 2) IRB (N = 4) Infección osteoarticular 62, 4% Slonin et al, CID, 2003 1988 -2002. SUMC, Israel
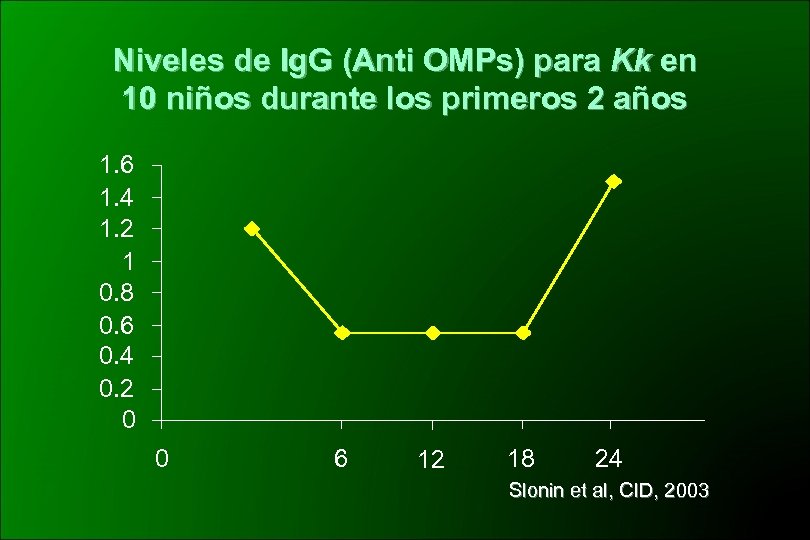 Niveles de Ig. G (Anti OMPs) para Kk en 10 niños durante los primeros 2 años 1. 6 1. 4 1. 2 1 0. 8 0. 6 0. 4 0. 2 0 0 6 12 18 24 Slonin et al, CID, 2003
Niveles de Ig. G (Anti OMPs) para Kk en 10 niños durante los primeros 2 años 1. 6 1. 4 1. 2 1 0. 8 0. 6 0. 4 0. 2 0 0 6 12 18 24 Slonin et al, CID, 2003
 Aspectos microbiológicos Ø Crecen en BACTEC y Bact / Alert (24 - 48 hs. ). Ø Crecen en AS, ACh. , MH - sangre (+ 24 hs. ). Ø No requieren CO 2 Ø BACTEC - Líq. articular y otros sistemas (más sensible que placa de AS) mejoran la recuperación de Kingella (Yagupsky et al. J. Clin. Microbiol. , 1992). Ø Kk causó 19 de 40 episodios documentados (48%) en niños de < 2 años cuando se implementó el cultivo en Fr de HC. (Yagupsky, Arch Pediatric Adolesc Med, 1995) Ø OJO! Sistemas automatizados de identificación: APINH – VITEK MICROSCAN. No contienen los biocódigos de K. k. en su base de datos Ø VITEK 2 : n= 188 HACEK+Capnocytophaga+Moraxella+Neisseria+Campylobacter : 91% correcto sin pruebas adicionales em 6 hs. Valenza et al. JCM, 2007
Aspectos microbiológicos Ø Crecen en BACTEC y Bact / Alert (24 - 48 hs. ). Ø Crecen en AS, ACh. , MH - sangre (+ 24 hs. ). Ø No requieren CO 2 Ø BACTEC - Líq. articular y otros sistemas (más sensible que placa de AS) mejoran la recuperación de Kingella (Yagupsky et al. J. Clin. Microbiol. , 1992). Ø Kk causó 19 de 40 episodios documentados (48%) en niños de < 2 años cuando se implementó el cultivo en Fr de HC. (Yagupsky, Arch Pediatric Adolesc Med, 1995) Ø OJO! Sistemas automatizados de identificación: APINH – VITEK MICROSCAN. No contienen los biocódigos de K. k. en su base de datos Ø VITEK 2 : n= 188 HACEK+Capnocytophaga+Moraxella+Neisseria+Campylobacter : 91% correcto sin pruebas adicionales em 6 hs. Valenza et al. JCM, 2007
 Kingella Sensibilidad antibiótica SENSIBLE VARIABLE RESISTENTE Penicilina Eritromicina Clindamicina Ampicilina Oxacilina (distinto Eikenella) Cefalosporinas (1°, 2° y 3°) Cloranfenicol Aminoglucósidos TMS Lincomicina
Kingella Sensibilidad antibiótica SENSIBLE VARIABLE RESISTENTE Penicilina Eritromicina Clindamicina Ampicilina Oxacilina (distinto Eikenella) Cefalosporinas (1°, 2° y 3°) Cloranfenicol Aminoglucósidos TMS Lincomicina
 Kingella kingae • 145 aislamientos de Kk • Ninguno fue resistente a penicilina • CIM 90 Penicilina 0, 047 ug/ml • Beta-lactamasa: Negativa • Beta-lactamasa: +, es excepcional (Birgisson et al, SJID, 1997 / Sordillo et al CID, 1993) • Todas las cepas fueron S eritromicina, gentamicina y ciporofloxacina. Yagupsky et al. J A C, 2001
Kingella kingae • 145 aislamientos de Kk • Ninguno fue resistente a penicilina • CIM 90 Penicilina 0, 047 ug/ml • Beta-lactamasa: Negativa • Beta-lactamasa: +, es excepcional (Birgisson et al, SJID, 1997 / Sordillo et al CID, 1993) • Todas las cepas fueron S eritromicina, gentamicina y ciporofloxacina. Yagupsky et al. J A C, 2001
 Capnocytophaga Ø 1956 - Prevot - Fusobacterium nucleatum var. ochraceus Ø Década 60’ - King - DF 1 (BGN fusiformes, CO 2 dependientes) Ø 1976 - Primer hallazgo de DF 2 en sangre y LCR, seguido de mordedura de perro Ø 1979 - Leadbetter y col. Socransky y col. DF 1 Capnocytophaga Williams y col. Ø 1984 - Clark y col. DF 3 Ø 1989 - Brenner, Hollis y Weaver: DF 2 y DF 2 like Capnocytophaga: C. canimorsus y C. cynodegmi
Capnocytophaga Ø 1956 - Prevot - Fusobacterium nucleatum var. ochraceus Ø Década 60’ - King - DF 1 (BGN fusiformes, CO 2 dependientes) Ø 1976 - Primer hallazgo de DF 2 en sangre y LCR, seguido de mordedura de perro Ø 1979 - Leadbetter y col. Socransky y col. DF 1 Capnocytophaga Williams y col. Ø 1984 - Clark y col. DF 3 Ø 1989 - Brenner, Hollis y Weaver: DF 2 y DF 2 like Capnocytophaga: C. canimorsus y C. cynodegmi
 Género Capnocytophaga Ø Ø Ø C. ochracea C. gingivalis C. sputigena C. haemolytica C. granulosa Ø C. canimorsus Ø C. cynodegmi Ø Dysgonomonas (DF 3) Ø DF 3 - like DF 1 DF 2 - like
Género Capnocytophaga Ø Ø Ø C. ochracea C. gingivalis C. sputigena C. haemolytica C. granulosa Ø C. canimorsus Ø C. cynodegmi Ø Dysgonomonas (DF 3) Ø DF 3 - like DF 1 DF 2 - like
 Capnocytophaga DF 1 Características bioquímicas Ø Desarrollo lento (después de las 48 hs. ) Ø Requerimiento de CO 2 Ø Colonias pigmentadas (amarillo - pardo - anaranjado rosado) Ø Movilidad deslizante Ø Fusiformes, extremos aguzados y bulbosos, filamentos Ø Masa celular amarilla Ø Oxidasa – Catalasa – ADH –
Capnocytophaga DF 1 Características bioquímicas Ø Desarrollo lento (después de las 48 hs. ) Ø Requerimiento de CO 2 Ø Colonias pigmentadas (amarillo - pardo - anaranjado rosado) Ø Movilidad deslizante Ø Fusiformes, extremos aguzados y bulbosos, filamentos Ø Masa celular amarilla Ø Oxidasa – Catalasa – ADH –
 Coloración de Gram: Capnocytophaga
Coloración de Gram: Capnocytophaga
 Capnocytophaga spp
Capnocytophaga spp
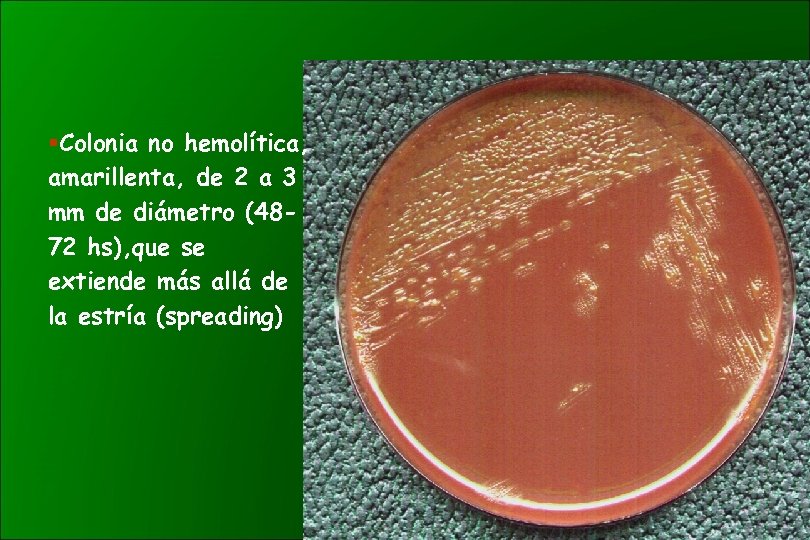 §Colonia no hemolítica, amarillenta, de 2 a 3 mm de diámetro (4872 hs), que se extiende más allá de la estría (spreading)
§Colonia no hemolítica, amarillenta, de 2 a 3 mm de diámetro (4872 hs), que se extiende más allá de la estría (spreading)

 Gram: Muy importante para orientar el género
Gram: Muy importante para orientar el género

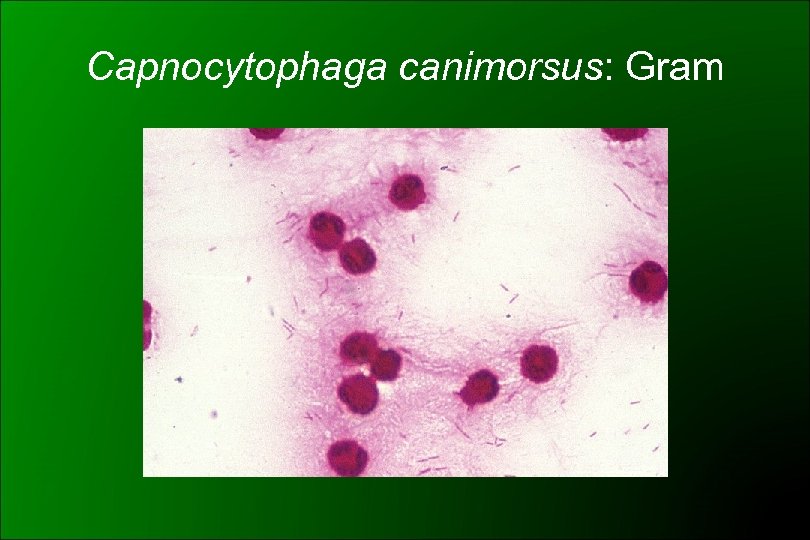
 Capnocytophaga DF 2: C. canimorsus DF 2 - like: C. cynodegmi Características bioquímicas Ø Desarrollo lento Ø Requerimiento de CO 2 Ø Fusiformes, extremo puntiagudo y el otro bulboso Ø Exigente: agar cerebro-corazón y suero de conejo Ø Movilidad deslizante Ø No desarrollan, la mayoría, en agar TSI Ø Oxidasa + Catalasa + ADH +
Capnocytophaga DF 2: C. canimorsus DF 2 - like: C. cynodegmi Características bioquímicas Ø Desarrollo lento Ø Requerimiento de CO 2 Ø Fusiformes, extremo puntiagudo y el otro bulboso Ø Exigente: agar cerebro-corazón y suero de conejo Ø Movilidad deslizante Ø No desarrollan, la mayoría, en agar TSI Ø Oxidasa + Catalasa + ADH +
 Capnocytophaga canimorsus: Gram
Capnocytophaga canimorsus: Gram
 Diferenciación bioquímica de los grupos de bacilos gram negativos pertenecientes al género Capnocytophaga y relacionados Capnocytophaga Dysgonomonas Característica Bioquímica Capnocytophaga canimorsus y (DF 1) C. cynodegmi (DF 3) (DF 2 - DF 2 like) Catalasa - + - Oxidasa - + - ADH - + - Xilosa - - +
Diferenciación bioquímica de los grupos de bacilos gram negativos pertenecientes al género Capnocytophaga y relacionados Capnocytophaga Dysgonomonas Característica Bioquímica Capnocytophaga canimorsus y (DF 1) C. cynodegmi (DF 3) (DF 2 - DF 2 like) Catalasa - + - Oxidasa - + - ADH - + - Xilosa - - +
 Capnocytophaga DF 1 Patología Ø Periodontitis juvenil Ø Sepsis: a) Asociada a enfermedades malignas: - Agranulocitopenia - Leucemia - Mieloma múltiple - Enfermedad de Hodgkin - Adenocarcinomas b) Puerta de entrada: ulceración oral Ø Otros: Endocarditis - Empiema - Abscesos - I. Heridas
Capnocytophaga DF 1 Patología Ø Periodontitis juvenil Ø Sepsis: a) Asociada a enfermedades malignas: - Agranulocitopenia - Leucemia - Mieloma múltiple - Enfermedad de Hodgkin - Adenocarcinomas b) Puerta de entrada: ulceración oral Ø Otros: Endocarditis - Empiema - Abscesos - I. Heridas
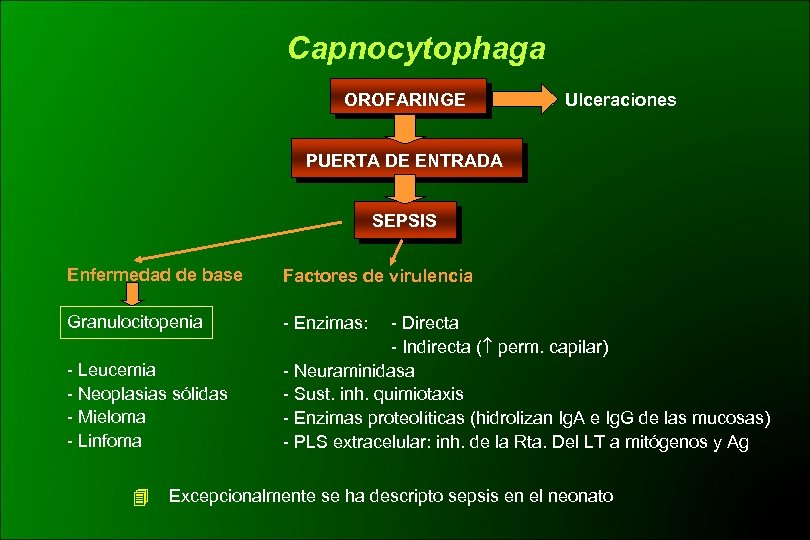 Capnocytophaga OROFARINGE Ulceraciones PUERTA DE ENTRADA SEPSIS Enfermedad de base Factores de virulencia Granulocitopenia - Enzimas: - Leucemia - Neoplasias sólidas - Mieloma - Linfoma - Directa - Indirecta ( perm. capilar) - Neuraminidasa - Sust. inh. quimiotaxis - Enzimas proteolíticas (hidrolizan Ig. A e Ig. G de las mucosas) - PLS extracelular: inh. de la Rta. Del LT a mitógenos y Ag Excepcionalmente se ha descripto sepsis en el neonato
Capnocytophaga OROFARINGE Ulceraciones PUERTA DE ENTRADA SEPSIS Enfermedad de base Factores de virulencia Granulocitopenia - Enzimas: - Leucemia - Neoplasias sólidas - Mieloma - Linfoma - Directa - Indirecta ( perm. capilar) - Neuraminidasa - Sust. inh. quimiotaxis - Enzimas proteolíticas (hidrolizan Ig. A e Ig. G de las mucosas) - PLS extracelular: inh. de la Rta. Del LT a mitógenos y Ag Excepcionalmente se ha descripto sepsis en el neonato
 Capnocytophaga canimorsus Capnocytophaga cynodegmi Patología Ø Asociado a mordedura de perro Ø Infecciones en pacientes con enfermedad de base: a) Enfermedad hepática secundaria al alcoholismo b) Esplenectomía c) Otras: Enf. Hodgkin, fibrosis pulmonar, EPOC, úlcera péptica, uso de corticoides Ø Celulitis - Meningitis - Sepsis - Endocarditis - Artritis séptica Ulcera de córnea
Capnocytophaga canimorsus Capnocytophaga cynodegmi Patología Ø Asociado a mordedura de perro Ø Infecciones en pacientes con enfermedad de base: a) Enfermedad hepática secundaria al alcoholismo b) Esplenectomía c) Otras: Enf. Hodgkin, fibrosis pulmonar, EPOC, úlcera péptica, uso de corticoides Ø Celulitis - Meningitis - Sepsis - Endocarditis - Artritis séptica Ulcera de córnea
 Bacteriemia por Capnocytophaga y Enfermedad neoplásica Adaptado de: J. Beebe and E. Koneman, 1995. Clin. Microbiol. Rev. N° total Pacientes 42 48 2 Total=92 n° pac. cáncer 33 12 2 47 N° de pac. Con enf. Neoplásica Leucemia Linfoma Otros 25 5 1 31 2 5** 7 6 2 1 9 Especie ó grupo DF-1 DF-2 * DF-3 - * Habitualmente los factores predisponentes fueron: alcoholismo, esplenectomía y enf. pulmonar crónica ** Enf. Hodgkin Puertas de entrada C. òchracea Lesiones Orales DF-1: C. gingivalis C. sputigena Mordedura de animales (perro) - C. canimorsus - C. cynodegmi
Bacteriemia por Capnocytophaga y Enfermedad neoplásica Adaptado de: J. Beebe and E. Koneman, 1995. Clin. Microbiol. Rev. N° total Pacientes 42 48 2 Total=92 n° pac. cáncer 33 12 2 47 N° de pac. Con enf. Neoplásica Leucemia Linfoma Otros 25 5 1 31 2 5** 7 6 2 1 9 Especie ó grupo DF-1 DF-2 * DF-3 - * Habitualmente los factores predisponentes fueron: alcoholismo, esplenectomía y enf. pulmonar crónica ** Enf. Hodgkin Puertas de entrada C. òchracea Lesiones Orales DF-1: C. gingivalis C. sputigena Mordedura de animales (perro) - C. canimorsus - C. cynodegmi
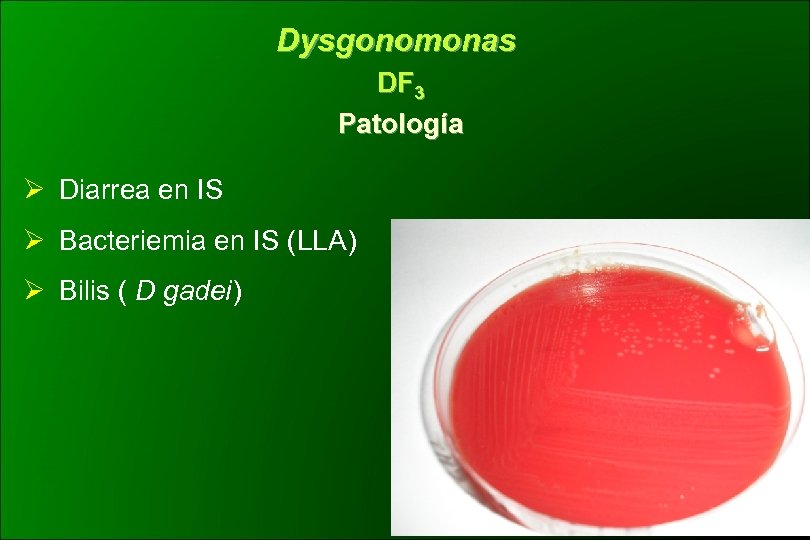 Dysgonomonas DF 3 Patología Ø Diarrea en IS Ø Bacteriemia en IS (LLA) Ø Bilis ( D gadei)
Dysgonomonas DF 3 Patología Ø Diarrea en IS Ø Bacteriemia en IS (LLA) Ø Bilis ( D gadei)

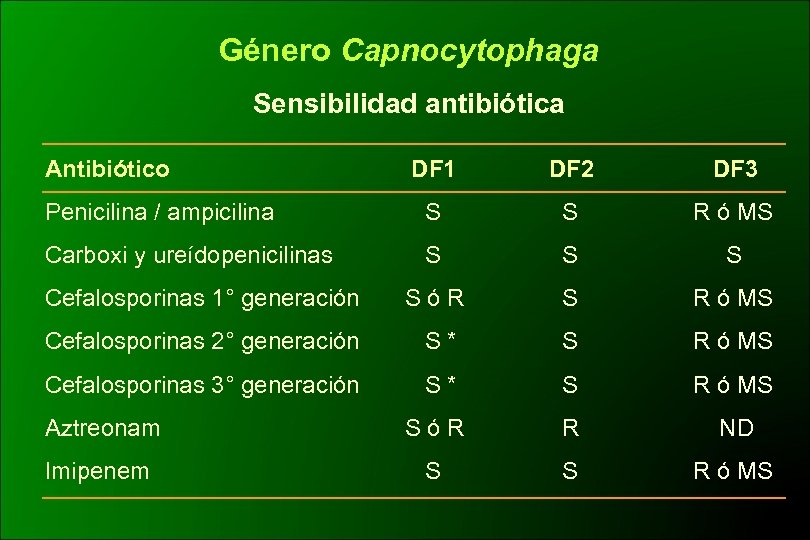 Género Capnocytophaga Sensibilidad antibiótica Antibiótico DF 1 DF 2 DF 3 Penicilina / ampicilina S S R ó MS Carboxi y ureídopenicilinas S S S Cefalosporinas 1° generación SóR S R ó MS Cefalosporinas 2° generación S* S R ó MS Cefalosporinas 3° generación S* S R ó MS Aztreonam SóR R ND Imipenem S S R ó MS
Género Capnocytophaga Sensibilidad antibiótica Antibiótico DF 1 DF 2 DF 3 Penicilina / ampicilina S S R ó MS Carboxi y ureídopenicilinas S S S Cefalosporinas 1° generación SóR S R ó MS Cefalosporinas 2° generación S* S R ó MS Cefalosporinas 3° generación S* S R ó MS Aztreonam SóR R ND Imipenem S S R ó MS
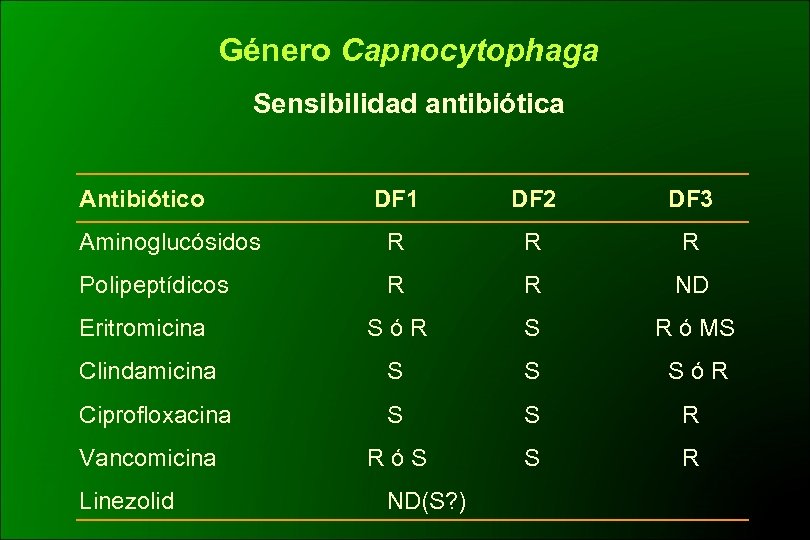 Género Capnocytophaga Sensibilidad antibiótica Antibiótico DF 1 DF 2 DF 3 Aminoglucósidos R R R Polipeptídicos R R ND Eritromicina SóR S R ó MS Clindamicina S S SóR Ciprofloxacina S S R RóS S R Vancomicina Linezolid ND(S? )
Género Capnocytophaga Sensibilidad antibiótica Antibiótico DF 1 DF 2 DF 3 Aminoglucósidos R R R Polipeptídicos R R ND Eritromicina SóR S R ó MS Clindamicina S S SóR Ciprofloxacina S S R RóS S R Vancomicina Linezolid ND(S? )
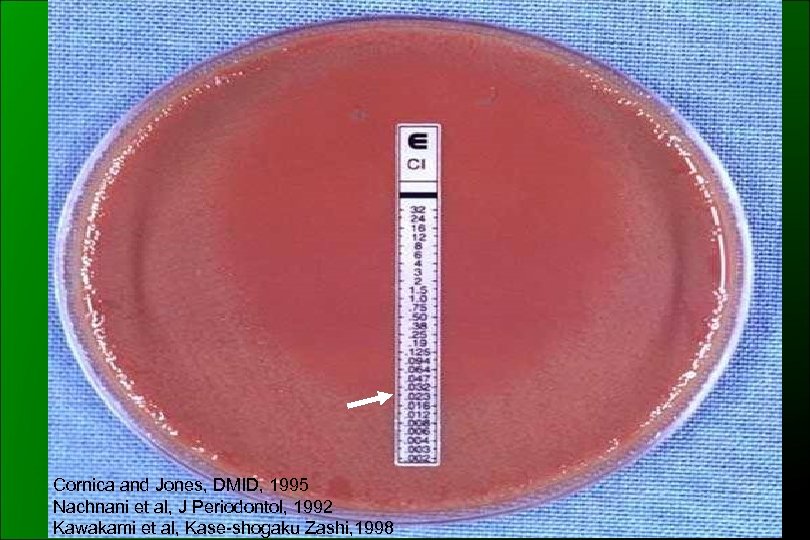 Cornica and Jones, DMID, 1995 Nachnani et al, J Periodontol, 1992 Kawakami et al, Kase-shogaku Zashi, 1998
Cornica and Jones, DMID, 1995 Nachnani et al, J Periodontol, 1992 Kawakami et al, Kase-shogaku Zashi, 1998
 Pruebas de Sensibilidad • Metódo: dilución en agar • Agar base Columbia suplementado con: 1% Polivitex 1% Hemoglobina § Incubación: 2 días/35º/10% CO 2 Otros Agar base: Wilkins-Chalgren, Schoedler, GC, Brucella, BHI agar, MH JL Rummens et al. AAC. Nov, 1986, p. 739 -742
Pruebas de Sensibilidad • Metódo: dilución en agar • Agar base Columbia suplementado con: 1% Polivitex 1% Hemoglobina § Incubación: 2 días/35º/10% CO 2 Otros Agar base: Wilkins-Chalgren, Schoedler, GC, Brucella, BHI agar, MH JL Rummens et al. AAC. Nov, 1986, p. 739 -742
 - lactamasas: Se incrementó en los últimos 15 años Kinder describió la primera beta-lactamasa en Capnocytophaga y luego Rummers en un aislamiento Multi R ( JCM, 1986 y AACh, 1986) Ø 32% (+): Roscoe y col. , AAC, Oct. 1992, p. 2197 -2200 Ø 73% (+): Maury y col. , CID, 1999, p. 1172 -1174 Ø 79% (+): Jolivet-Gougeon y col, AAC, Nov. 2000, p. 31863188 Ø 70% (+): Jolivet-Gougeon y col, BMC Infectious Diseases, 2005
- lactamasas: Se incrementó en los últimos 15 años Kinder describió la primera beta-lactamasa en Capnocytophaga y luego Rummers en un aislamiento Multi R ( JCM, 1986 y AACh, 1986) Ø 32% (+): Roscoe y col. , AAC, Oct. 1992, p. 2197 -2200 Ø 73% (+): Maury y col. , CID, 1999, p. 1172 -1174 Ø 79% (+): Jolivet-Gougeon y col, AAC, Nov. 2000, p. 31863188 Ø 70% (+): Jolivet-Gougeon y col, BMC Infectious Diseases, 2005
 & TEM-17, BLEE (Rosenau y col, AAC, Mar 2000, p. 760 -762) & Genes Cfx. A 2 y Cfx. A 3 de origen plásmidico ó cromosómico. (Handal y col. , AAC, Sep 2005, p. 3940 -3943)
& TEM-17, BLEE (Rosenau y col, AAC, Mar 2000, p. 760 -762) & Genes Cfx. A 2 y Cfx. A 3 de origen plásmidico ó cromosómico. (Handal y col. , AAC, Sep 2005, p. 3940 -3943)
 Capnocytophaga y Quinolonas • Mayoría Sensibles • R a ácido nalidíxico ( Sutter et al, AACh, 1981) • C ochracea R norfloxacina y ciprofloxacina( Baquero et al, RID, 1990) • C sputigena CIM CIP de 16 ug/ml (Gomez. Garcés et al, JCM, 1994)
Capnocytophaga y Quinolonas • Mayoría Sensibles • R a ácido nalidíxico ( Sutter et al, AACh, 1981) • C ochracea R norfloxacina y ciprofloxacina( Baquero et al, RID, 1990) • C sputigena CIM CIP de 16 ug/ml (Gomez. Garcés et al, JCM, 1994)
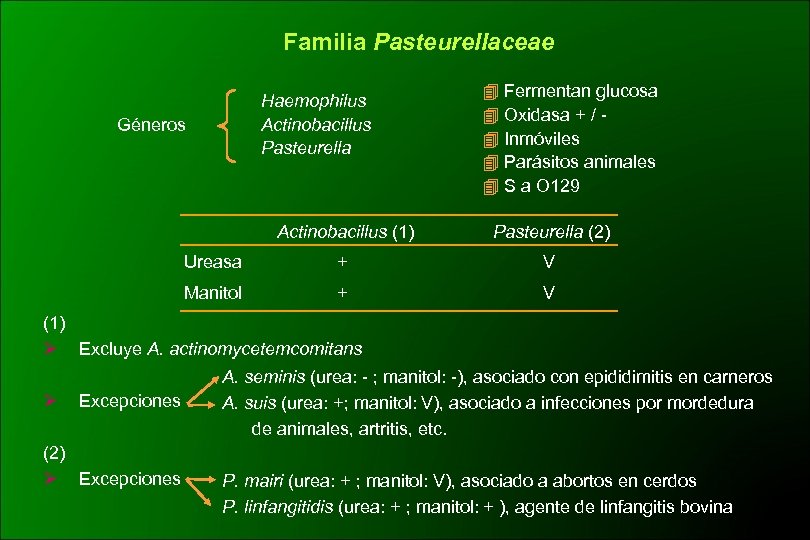 Familia Pasteurellaceae Haemophilus Actinobacillus Pasteurella Géneros Fermentan glucosa Oxidasa + / Inmóviles Parásitos animales S a O 129 Actinobacillus (1) Pasteurella (2) Ureasa + V Manitol + V (1) Ø Excluye A. actinomycetemcomitans Ø Excepciones (2) Ø Excepciones A. seminis (urea: - ; manitol: -), asociado con epididimitis en carneros A. suis (urea: +; manitol: V), asociado a infecciones por mordedura de animales, artritis, etc. P. mairi (urea: + ; manitol: V), asociado a abortos en cerdos P. linfangitidis (urea: + ; manitol: + ), agente de linfangitis bovina
Familia Pasteurellaceae Haemophilus Actinobacillus Pasteurella Géneros Fermentan glucosa Oxidasa + / Inmóviles Parásitos animales S a O 129 Actinobacillus (1) Pasteurella (2) Ureasa + V Manitol + V (1) Ø Excluye A. actinomycetemcomitans Ø Excepciones (2) Ø Excepciones A. seminis (urea: - ; manitol: -), asociado con epididimitis en carneros A. suis (urea: +; manitol: V), asociado a infecciones por mordedura de animales, artritis, etc. P. mairi (urea: + ; manitol: V), asociado a abortos en cerdos P. linfangitidis (urea: + ; manitol: + ), agente de linfangitis bovina
 Taxonomía: Pasteurella spp Ø Avibacterium: P gallinarum, P avium, P volantium. Blackall et al, IJSEM, 2005. Ø Gallibacterium: P anatis Christensen et al, IJSEM, 2003 Ø Volucribacter: Bigaard taxon 33 Christensen et al, IJSEM, 2004. Ø Mannheimia: Complejo Pasteurella haemolytica Angeno et al, IJSB, 1999.
Taxonomía: Pasteurella spp Ø Avibacterium: P gallinarum, P avium, P volantium. Blackall et al, IJSEM, 2005. Ø Gallibacterium: P anatis Christensen et al, IJSEM, 2003 Ø Volucribacter: Bigaard taxon 33 Christensen et al, IJSEM, 2004. Ø Mannheimia: Complejo Pasteurella haemolytica Angeno et al, IJSB, 1999.
 Pasteurella multocida Ø Cocobacilos gram negativos muy pequeños Ø Haemophilus en agar chocolate Ø Olor espermático Ø Indol + Ø ODC + / Urea -
Pasteurella multocida Ø Cocobacilos gram negativos muy pequeños Ø Haemophilus en agar chocolate Ø Olor espermático Ø Indol + Ø ODC + / Urea -
 Gram: Pasteurella
Gram: Pasteurella
 Pasteurella multocida
Pasteurella multocida
 Pasteurella multocida Patologías a) En animales: - cólera en aves de orral - septicemia hemorrágica - mastitis - pleuroneumonía séptica b) En humanos: - Infección localizada (mordedura de animales) - Celulitis - Abscesos - Osteomielitis - Sepsis, meningitis, abscesos cerebrales, artritis séptica, peritonitis, endocarditis, conjuntivitis, endoftalmitis - Infección pulmonar crónica: asociada a otro patógeno
Pasteurella multocida Patologías a) En animales: - cólera en aves de orral - septicemia hemorrágica - mastitis - pleuroneumonía séptica b) En humanos: - Infección localizada (mordedura de animales) - Celulitis - Abscesos - Osteomielitis - Sepsis, meningitis, abscesos cerebrales, artritis séptica, peritonitis, endocarditis, conjuntivitis, endoftalmitis - Infección pulmonar crónica: asociada a otro patógeno
 Pasteurella multocida Puertas de entrada: - Herida por mordedura de animales Factores predisponentes: - Enfermedad hepática (cirrosis) - Neoplasias sólidas y oncohematológicas - LES - HIV Ø Signos y síntomas de sepsis pueden aparecer después de una mordedura o arañazo “inofensivo” Ø Diseminación hematógena ocurre en el 75% de los pacientes con bacteriemia Meningitis – Artritis y Bursitis – Neumonía – Infección abdominal – Osteomielitis vertebral Válvula nativa Ø Endocarditis RARA Válvula protésica Ø Sepsis por mordedura puede ocurrir en pacientes inmunocompetentes
Pasteurella multocida Puertas de entrada: - Herida por mordedura de animales Factores predisponentes: - Enfermedad hepática (cirrosis) - Neoplasias sólidas y oncohematológicas - LES - HIV Ø Signos y síntomas de sepsis pueden aparecer después de una mordedura o arañazo “inofensivo” Ø Diseminación hematógena ocurre en el 75% de los pacientes con bacteriemia Meningitis – Artritis y Bursitis – Neumonía – Infección abdominal – Osteomielitis vertebral Válvula nativa Ø Endocarditis RARA Válvula protésica Ø Sepsis por mordedura puede ocurrir en pacientes inmunocompetentes
 Pasteurella multocida Sensibilidad antibiótica Antibióticos más activos Antibióticos menos activos Penicilina G y sus derivados Cefalosporinas 1° generación Cefalosporinas de 2° y 3°a gen. Aminoglucósidos Imipenem / meropenem Eritromicina Tetraciclinas Vancomicina (R) Cloranfenicol Quinolonas TMS Azitromicina
Pasteurella multocida Sensibilidad antibiótica Antibióticos más activos Antibióticos menos activos Penicilina G y sus derivados Cefalosporinas 1° generación Cefalosporinas de 2° y 3°a gen. Aminoglucósidos Imipenem / meropenem Eritromicina Tetraciclinas Vancomicina (R) Cloranfenicol Quinolonas TMS Azitromicina
 Pasteurella spp Criterios CLSI M 45 -P, 2006 Condiciones del ensayo Antibióticos recomendados Dilución: Caldo MH Penicilina 2, 5 -5 % sangre equina lisada Aminipenicilinas Difusión: Agar MH B-lactámico+inhibidor 5% sangre ovina Cefalosporinas(CRO) Inóculo: 0, 5 Mc Farland FQ Incubación: 35ºC; atm ambiente Tetraciclinas 18 -24 hs Macrólidos Si requiere CO 2: No difusión! TMS
Pasteurella spp Criterios CLSI M 45 -P, 2006 Condiciones del ensayo Antibióticos recomendados Dilución: Caldo MH Penicilina 2, 5 -5 % sangre equina lisada Aminipenicilinas Difusión: Agar MH B-lactámico+inhibidor 5% sangre ovina Cefalosporinas(CRO) Inóculo: 0, 5 Mc Farland FQ Incubación: 35ºC; atm ambiente Tetraciclinas 18 -24 hs Macrólidos Si requiere CO 2: No difusión! TMS
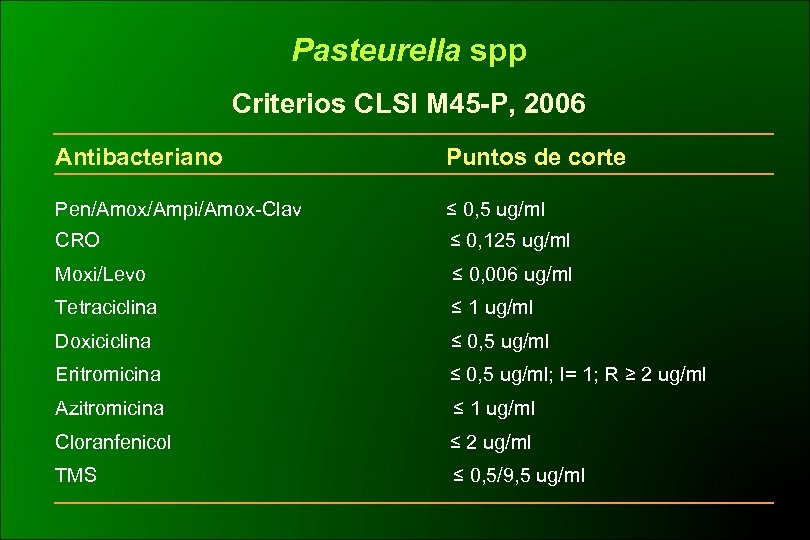 Pasteurella spp Criterios CLSI M 45 -P, 2006 Antibacteriano Puntos de corte Pen/Amox/Ampi/Amox-Clav ≤ 0, 5 ug/ml CRO ≤ 0, 125 ug/ml Moxi/Levo ≤ 0, 006 ug/ml Tetraciclina ≤ 1 ug/ml Doxiciclina ≤ 0, 5 ug/ml Eritromicina ≤ 0, 5 ug/ml; I= 1; R ≥ 2 ug/ml Azitromicina ≤ 1 ug/ml Cloranfenicol ≤ 2 ug/ml TMS ≤ 0, 5/9, 5 ug/ml
Pasteurella spp Criterios CLSI M 45 -P, 2006 Antibacteriano Puntos de corte Pen/Amox/Ampi/Amox-Clav ≤ 0, 5 ug/ml CRO ≤ 0, 125 ug/ml Moxi/Levo ≤ 0, 006 ug/ml Tetraciclina ≤ 1 ug/ml Doxiciclina ≤ 0, 5 ug/ml Eritromicina ≤ 0, 5 ug/ml; I= 1; R ≥ 2 ug/ml Azitromicina ≤ 1 ug/ml Cloranfenicol ≤ 2 ug/ml TMS ≤ 0, 5/9, 5 ug/ml
 Pasteurella spp. • Beta lactamasa: excepcional • CIM penicilina, ampicilina, amoxicilina > 0, 5 ug/ml CLSI, 2006.
Pasteurella spp. • Beta lactamasa: excepcional • CIM penicilina, ampicilina, amoxicilina > 0, 5 ug/ml CLSI, 2006.
 Prueba de Sensibilidad por disfusión Puntos de corte: en mm ANTIBACTERIAN O ampicilina 10 ug penicilina 10 UI amoxi-clav 20/10 ug ceftriaxona 30 ug moxifloxacina 5 ug levofloxacina 5 ug doxiciclina 30 ug tetraciclina 30 ug eritromicina 15 ug azitromicina 15 ug cloranfenicol 30 ug TMS 1, 25/23, 75 ug Resistente Intermedio Sensible ≤ 24 - 25 -26 - ≥ 27 ≥ 25 ≥ 27 ≥ 34 ≥ 28 ≥ 23 ≥ 27 ≥ 20 ≥ 28 ≥ 24
Prueba de Sensibilidad por disfusión Puntos de corte: en mm ANTIBACTERIAN O ampicilina 10 ug penicilina 10 UI amoxi-clav 20/10 ug ceftriaxona 30 ug moxifloxacina 5 ug levofloxacina 5 ug doxiciclina 30 ug tetraciclina 30 ug eritromicina 15 ug azitromicina 15 ug cloranfenicol 30 ug TMS 1, 25/23, 75 ug Resistente Intermedio Sensible ≤ 24 - 25 -26 - ≥ 27 ≥ 25 ≥ 27 ≥ 34 ≥ 28 ≥ 23 ≥ 27 ≥ 20 ≥ 28 ≥ 24
 Pasteurella multocida y taxones relacionados Sensibilidad cuantitativa de 12 aislamientos Antibióticos Valores extremos de CIM (mg / l) Penicilina Ampicilina Cefalotina Cefotaxima Minociclina Gentamicina Amikacina Rifampicina Eritromicina Colistina TMS Cloranfenicol Ciprofloxacina 0. 032 – 0. 25 0. 063 – 0. 25 0. 5 – 32 0. 002 – 0. 5 0. 002 – 0. 032 0. 25 – 8 0. 032 – 0. 5 0. 25 – 8 0. 063 – 4 0. 032 - 0. 25 – 2 0. 004 – 0. 125 Vay y col. 1993. Hospital de Clínicas. UBA.
Pasteurella multocida y taxones relacionados Sensibilidad cuantitativa de 12 aislamientos Antibióticos Valores extremos de CIM (mg / l) Penicilina Ampicilina Cefalotina Cefotaxima Minociclina Gentamicina Amikacina Rifampicina Eritromicina Colistina TMS Cloranfenicol Ciprofloxacina 0. 032 – 0. 25 0. 063 – 0. 25 0. 5 – 32 0. 002 – 0. 5 0. 002 – 0. 032 0. 25 – 8 0. 032 – 0. 5 0. 25 – 8 0. 063 – 4 0. 032 - 0. 25 – 2 0. 004 – 0. 125 Vay y col. 1993. Hospital de Clínicas. UBA.
 Otros agentes causales de infecciones por mordedura o arañazo Ø Ø Ø Ø Ø S. aureus y S. intermedius Streptococcus b hemolíticos Otros estreptococos Eikenella corrodens Capnocytophaga canimorsus y Capnocytophaga cynodegmi Neisseria elongata spp nitroreducens Neisseria weaveri Micrococcus spp E. C. Negativa Enterobacteriaceae (Proteus - Enterobacter) P. fluorescens Otras especies de Pasteurella Actinobacillus spp Neiiseria animaloris y N zoodegmatis (EF 4) Bergeyella zoohelcum (II j) NO - 1 Bacterias anaerobias: - Porphyromonas asaccharolyticus - Prevotella bivia y P. melaninogenica - Fusobacterium spp - Veillonella parvula - Leptotrichia buccalis
Otros agentes causales de infecciones por mordedura o arañazo Ø Ø Ø Ø Ø S. aureus y S. intermedius Streptococcus b hemolíticos Otros estreptococos Eikenella corrodens Capnocytophaga canimorsus y Capnocytophaga cynodegmi Neisseria elongata spp nitroreducens Neisseria weaveri Micrococcus spp E. C. Negativa Enterobacteriaceae (Proteus - Enterobacter) P. fluorescens Otras especies de Pasteurella Actinobacillus spp Neiiseria animaloris y N zoodegmatis (EF 4) Bergeyella zoohelcum (II j) NO - 1 Bacterias anaerobias: - Porphyromonas asaccharolyticus - Prevotella bivia y P. melaninogenica - Fusobacterium spp - Veillonella parvula - Leptotrichia buccalis
 Infecciones por mordedura 1% de las consultas hospitalarias La mayoría ocasionados por animales domésticos (perros y gatos) Mordeduras de perro Mordeduras de gato Ø Ø Ø 80% de las mordeduras 15 - 20% se infectan 90% de las heridas clínicamente infectadas y 80% de las heridas tempranas < 8 hs. después de la injuria: presentan bacterias potencialmente patógenas. Etiología: - Anaerobios 30 - 40% de las mordeduras de perro (cultivos mixtos) - P. multocida es el principal agente etiológico Ø > 50% se infectan Más fácil de penetrar en hueso o articulación artritis-osteomielitis Etiología - P. multocida 50 -70% de los casos
Infecciones por mordedura 1% de las consultas hospitalarias La mayoría ocasionados por animales domésticos (perros y gatos) Mordeduras de perro Mordeduras de gato Ø Ø Ø 80% de las mordeduras 15 - 20% se infectan 90% de las heridas clínicamente infectadas y 80% de las heridas tempranas < 8 hs. después de la injuria: presentan bacterias potencialmente patógenas. Etiología: - Anaerobios 30 - 40% de las mordeduras de perro (cultivos mixtos) - P. multocida es el principal agente etiológico Ø > 50% se infectan Más fácil de penetrar en hueso o articulación artritis-osteomielitis Etiología - P. multocida 50 -70% de los casos
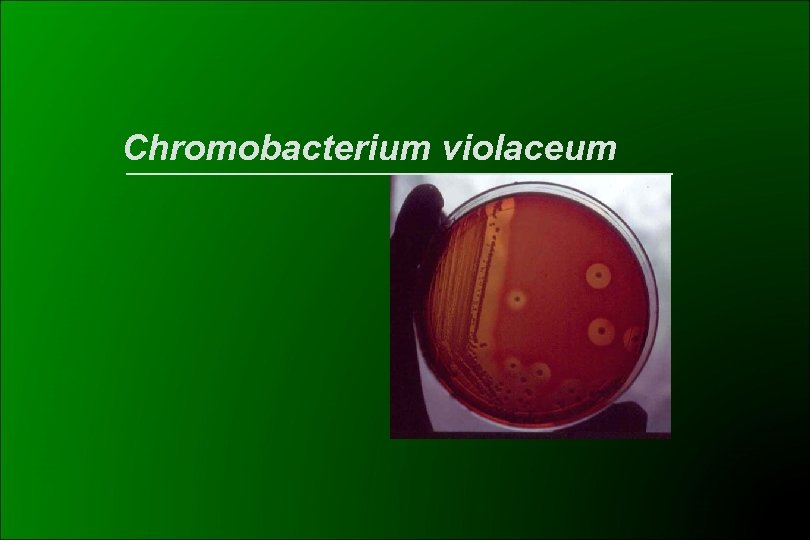
 Chromobacterium violaceum Familia Neisseriaceae Ø Bacilos gram negativos, facultativos Ø Móviles Ø No exigente Ø Colonia similar a Enterobacteria Ø Olor a cianuro de amonio Ø b hemolíticos Ø Pigmento violeta (violaceína): no difusible Ø Cepas no pigmentadas Indol + : se confunden con Aeromonas si Ox + y Enterobacteriaceae si Ox – Ø Dnasa + : Aeromonas Serratia Ø Pruebas diferenciales: ONPG - , crece en EMB Levine, Maltosa -
Chromobacterium violaceum Familia Neisseriaceae Ø Bacilos gram negativos, facultativos Ø Móviles Ø No exigente Ø Colonia similar a Enterobacteria Ø Olor a cianuro de amonio Ø b hemolíticos Ø Pigmento violeta (violaceína): no difusible Ø Cepas no pigmentadas Indol + : se confunden con Aeromonas si Ox + y Enterobacteriaceae si Ox – Ø Dnasa + : Aeromonas Serratia Ø Pruebas diferenciales: ONPG - , crece en EMB Levine, Maltosa -
 Chromobacterium violaceum
Chromobacterium violaceum
 Chromobacterium violaceum
Chromobacterium violaceum
 Chromobacterium violaceum Ø Suelo y agua, clima tropical y subtropical Ø Poco frecuente Ø Puerta de entrada: lesión en piel infección herida Ø Sepsis fulminante en pacientes con disfunción de neutrófilos Ø Infección ocular Ø Bacteriemia asociada a catéter (2 casos) Ø Resistente a cefalosporinas Ø Sensibilidad V a aminoglucósidos Ø Sensible: quinolonas, TMS, tetraciclinas, imipenem
Chromobacterium violaceum Ø Suelo y agua, clima tropical y subtropical Ø Poco frecuente Ø Puerta de entrada: lesión en piel infección herida Ø Sepsis fulminante en pacientes con disfunción de neutrófilos Ø Infección ocular Ø Bacteriemia asociada a catéter (2 casos) Ø Resistente a cefalosporinas Ø Sensibilidad V a aminoglucósidos Ø Sensible: quinolonas, TMS, tetraciclinas, imipenem
 CASO CLÍNICO q Paciente de sexo masculino, 46 años de edad, oriundo de Chaco. q Antecedentes: Mieloma Múltiple. q Recibió tratamiento quimiterápico a través de un catéter implantable ( Porth-a-cath). q Presentó fiebre de tres días de evolución, escalofríos y diarrea. q Laboratorio: Hto 33%, GB: 15. 600/mm 3, 78 PMN.
CASO CLÍNICO q Paciente de sexo masculino, 46 años de edad, oriundo de Chaco. q Antecedentes: Mieloma Múltiple. q Recibió tratamiento quimiterápico a través de un catéter implantable ( Porth-a-cath). q Presentó fiebre de tres días de evolución, escalofríos y diarrea. q Laboratorio: Hto 33%, GB: 15. 600/mm 3, 78 PMN.
 ESTUDIO MICROBIOLÓGICO q 3 Hemocultivos A) Transcatéter B) 2 Periféricos Igual volúmen de sangre al mismo tiempo. q Urocultivo-Coprocultivo.
ESTUDIO MICROBIOLÓGICO q 3 Hemocultivos A) Transcatéter B) 2 Periféricos Igual volúmen de sangre al mismo tiempo. q Urocultivo-Coprocultivo.
 RESULTADOS q Hemocultivo transcatéter +: 7 hs. q Un hemocultivo periférico +: 14 hs. q Tiempo diferencial > 2 hs. bacteriemia asociada a catéter. q Coloración de Gram: bacilos gram-negativos. q Subcultivo en agar sangre: colonias definidas a las 24 hs. Con beta-hemólisis. q Urocultivo y coprocultivo: Negativos.
RESULTADOS q Hemocultivo transcatéter +: 7 hs. q Un hemocultivo periférico +: 14 hs. q Tiempo diferencial > 2 hs. bacteriemia asociada a catéter. q Coloración de Gram: bacilos gram-negativos. q Subcultivo en agar sangre: colonias definidas a las 24 hs. Con beta-hemólisis. q Urocultivo y coprocultivo: Negativos.


 Oxidasa
Oxidasa
 q Se informa: Aeromonas sp q Se observó desarrollo en EMB de Levine.
q Se informa: Aeromonas sp q Se observó desarrollo en EMB de Levine.
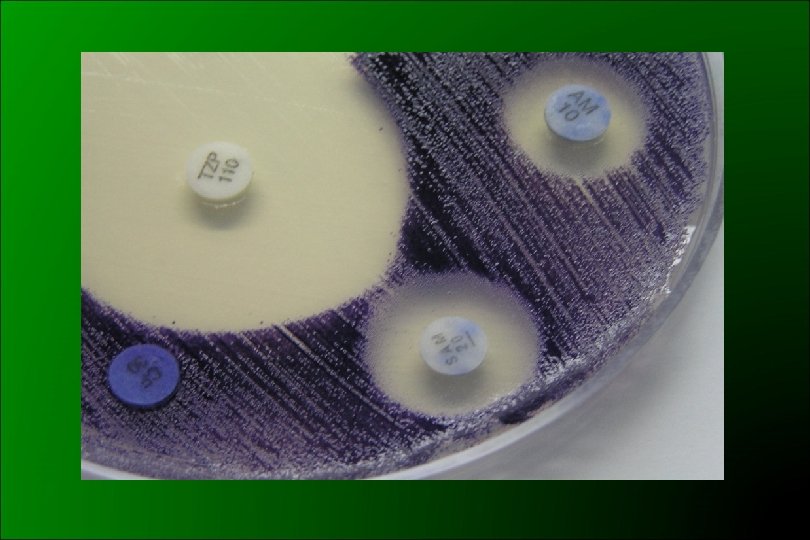
 IDENTIFICACIÓN DEFINITIVA q DNAsa: + q O 129: R q Cl. Na 0% +; 6% q ADH: positiva q LDC y ODC: negativa. q VP: negativo. q Esculina: q Indol: positivo q movilidad: Positiva
IDENTIFICACIÓN DEFINITIVA q DNAsa: + q O 129: R q Cl. Na 0% +; 6% q ADH: positiva q LDC y ODC: negativa. q VP: negativo. q Esculina: q Indol: positivo q movilidad: Positiva
 IDENTIFICACIÓN DEFINITIVA Se Informó : Aeromonas caviae
IDENTIFICACIÓN DEFINITIVA Se Informó : Aeromonas caviae
 Es correcto? Olor: cianuro de amonio ONPG: Negativo Manitol: Negativo Urea: Positivo
Es correcto? Olor: cianuro de amonio ONPG: Negativo Manitol: Negativo Urea: Positivo
 IDENTIFICACIÓN DEFINITIVA q Chromobacterium violaceum (No pigmentado: Agar Trip-Agar Tyr)
IDENTIFICACIÓN DEFINITIVA q Chromobacterium violaceum (No pigmentado: Agar Trip-Agar Tyr)
 Evolución q Tratamiento: ciproflocacina IV q Evolución favorable. Alfonso, Nacinovich, Lopez Reyes, Daher, Famiglietti, Vay. VIII Congreso Argentino de Microbiología. 1998.
Evolución q Tratamiento: ciproflocacina IV q Evolución favorable. Alfonso, Nacinovich, Lopez Reyes, Daher, Famiglietti, Vay. VIII Congreso Argentino de Microbiología. 1998.
 Evolución
Evolución
 Evolución
Evolución
 Sensibilidad a los ATM • Sensible: Fluorquinolonas TMS Tetraciclinas Imipenem • Resistente: Aminopenicilinas Cefalosporinas 1ª G Cefalosporinas 3ª G Cefoxitina • Variable: Aminoglucósidos
Sensibilidad a los ATM • Sensible: Fluorquinolonas TMS Tetraciclinas Imipenem • Resistente: Aminopenicilinas Cefalosporinas 1ª G Cefalosporinas 3ª G Cefoxitina • Variable: Aminoglucósidos


