
ГРУППА VIB IV П Е Р И О Д Cromium Cr № 24 51, 996 Хром 54 s 1 [Ar] 3 d

Крокоит Pb. Cr. O 4 «сибирский красный свинец» В 1766 ГОДУ НАЙДЕН ПОД ЕКАТЕРИНБУРГОМ

Луи Никола Воклен (16 мая 1763— 14 ноября 1829) французский химик В 1797 открыл в сибирской красной свинцовой руде новый элемент хром. В 1798 получил его в свободном состоянии

Месторождения хрома: ЮАР (1 место в мире), Казахстан Россия (Урал) Зимбабве Мадагаскар


е ы н в о лы н а с О нер : а и ом м р х

маг нох ром , Fe ит )C (Mn r 2 O 4

Ал юм охр , M g)(C оми (Fe r, A l)2 O 4 т

хро (M мп g, F ик e)(C оти r, A l)2 O 4 т


Получение хрома: 1) сплавляют хромит железа с карбонатом натрия на воздухе: 4 Fe(Cr. O 2)2 + 8 Na 2 CO 3 + 7 O 2 → 8 Na 2 Cr. O 4 + 2 Fe 2 O 3 + 8 CO 2↑ 2) растворяют хромат натрия и отделяют его от оксида железа; 3) переводят хромат в дихромат, подкисляя раствор и выкристаллизовывая дихромат; 4) получают чистый оксид хрома восстановлением дихромата углём: Na 2 Cr 2 O 7 + 2 C → Cr 2 O 3 + Na 2 CO 3 + CO↑ 5) с помощью алюминотермии получают металлический хром: Cr 2 O 3+ 2 Al → Al 2 O 3 + 2 Cr + 130 ккал

Физические свойства

твёрдый металл голубоватобелого цвета

Степень окисления от +1 до +6
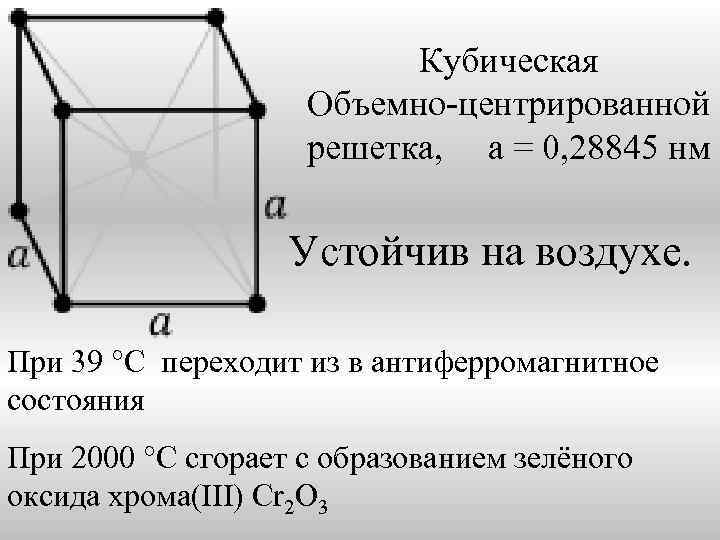
Кубическая Объемно-центрированной решетка, а = 0, 28845 нм Устойчив на воздухе. При 39 °C переходит из в антиферромагнитное состояния При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr 2 O 3

Химические свойства • Сплавляя Cr 2 O 3 со щелочами получают хромитыю • При термическом разложении карбонила хрома Cr(СО)6 получают красный основной оксид хрома(II) Cr. O. • С конц серной кислотой образуются красные или фиолетово-красные кристаллы оксида хрома(VI) Cr. O 3 • С барием: Ba 2+ + Cr. O 42− → Ba. Cr. O 4↓. Благодаря пленке оксида хрома, хром корозийно-стойкий. Азотная кислота пассивирует хром

Применение • Хромирование стальных изделий для повышения устойчивости к коррозиям • Важный компонент во многих легированных сталях и др споавах • Производства сопел мощных плазмотронов и в авиакосмической промышленности.