Lektsia_6_Steriln_LS.ppt
- Количество слайдов: 41

ГП «Межведомственный научный центр криобиологии и криомедицины НАН и АМН МОЗ Украины» Производство стерильных лекарственных средств в соответствии с действующими требованиями GMP Директор по качеству – Уполномоченное лицо Заболотная Элла Вадимовна

РУКОВОДСТВА • Документы PIC/S • Документы GMP EC, ВОЗ • Фармакопеи: EP, USP Название предприятия и отдела 2

ОСНОВНЫЕ ПРИНЦИПЫ • Дополнительные требования к основным требованиям GMP, но не замена их • Минимизация риска контаминации микроорганизмами, частицами, пирогенами • Валидированные способы, процедуры • Отсутствие единственного фактора, удостоверяющего качество продукта Отдел проверки соответствия GMP 3

ТИПЫ ПРОДУКЦИИ • Продукция, подлежащая стерилизации • Продукция, произведенная в асептических условиях Отдел проверки соответствия GMP 4

ОБЩИЕ ТРЕБОВАНИЯ • Чистые зоны с воздушными шлюзами • Классификация чистых зон (классы чистоты) • Соответствие технологической операции и класса чистоты рабочей зоны Отдел проверки соответствия GMP 5
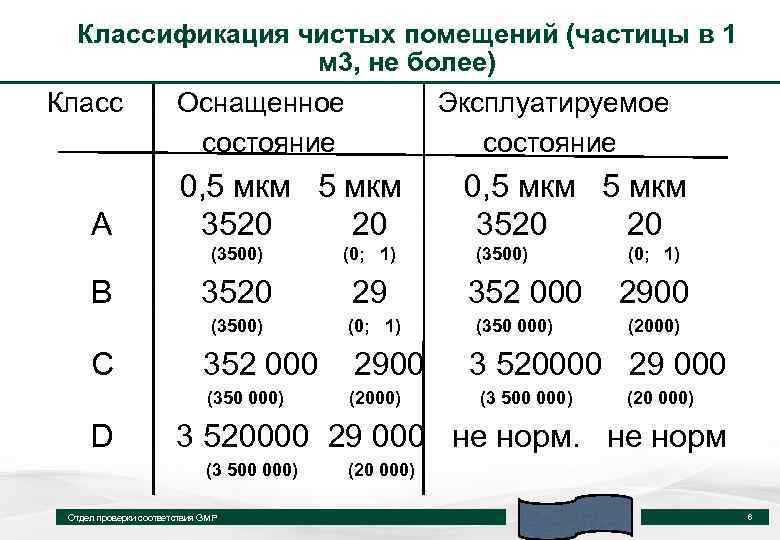
Классификация чистых помещений (частицы в 1 м 3, не более) Класс А Оснащенное состояние Эксплуатируемое состояние 0, 5 мкм 3520 20 (3500) С 3520 29 (3500) В (0; 1) 2900 (350 000) D 352 000 (2000) 0, 5 мкм 3520 20 (3500) 352 000 (350 000) (0; 1) 2900 (2000) 3 520000 29 000 (3 500 000) (20 000) 3 520000 29 000 не норм (3 500 000) Отдел проверки соответствия GMP (20 000) 6

МОНИТОРИНГ СИСТЕМ ВОЗДУХОПОДГОТОВКИ • Уровни частиц/ микроорганизмов • Разница давлений • Воздухообмен • Температура и влажность Отдел проверки соответствия GMP 7

МОНИТОРИНГ СИСТЕМ ВОЗДУХОПОДГОТОВКИ • Предупреждающие пределы (alert limits) • Пределы, требующие (action limits) незамедлительных действий • Современное состояние: документ ICH Q 10 (Pharmaceutical Quality System): Corrective action and preventive action (CAPA) system (Система корректирующих и предупреждающих мероприятий) Отдел проверки соответствия GMP 8

ПОМЕЩЕНИЯ • Конструкция • Материалы поверхностей • Воздушные шлюзы • Комплектация Обслуживание Функционирование/ обработка Очистка/ санитарные условия Мониторинг ALARM- системы Отдел проверки соответствия GMP 9

ОБОРУДОВАНИЕ • Конструкция • Защита • Обслуживание • Границы разделения зон Отдел проверки соответствия GMP 10

Технологический процесс • • • Подготовка производства Приготовление/ обработка Фильтрация Фасовка Укупорка Стерилизация продуктов в первичной (конечной) упаковке • Упаковка, маркировка • Очистка оборудования • Протоколирование Отдел проверки соответствия GMP 11

Общие требования 1 • Предотвращение контаминации • Помещения по видам продукции • Минимизация деятельности и передвижения персонала • Соответствующие сырье и материалы Отдел проверки соответствия GMP 12

Общие требования 2 • Частицы • Риск повторной контаминации • Валидация процессов и методик Отдел проверки соответствия GMP 13

Стерилизуемая продукция ■ Класс D - приготовление растворов - подготовка компонентов первичной упаковки ■ Класс С - приготовление растворов при повышенном риске контаминации - фасовка ■ Класс А в классе С - фасовка продукции при повышенном риске контаминации Отдел проверки соответствия GMP 14

Асептическая продукция 1 • Класс D • Подготовка компонентов первичной упаковки после мойки • Другие подготовительные и заключительные операции Отдел проверки соответствия GMP 15

Асептическая продукция 2 • Класс С • Приготовление растворов, подлежащих стерилизующей фильтрации • Вспомогательные операции (шлюзы, прачечная т. д. ) Отдел проверки соответствия GMP 16

Асептическая продукция 3 Зона А в классе В: • Обработка стерильного сырья и компонентов первичной упаковки • Приготовление (растворов смесей) • Фасовка продукции • Передача (транспортирование) неокончательно укупоренных первичных упаковок Отдел проверки соответствия GMP 17

СПЕЦИАЛЬНЫЕ ТЕХНОЛОГИИ 1 Изолирующая • Конструкция изолятора • Требования к рабочей и окружающей зонам • Передаточные устройства – риск загрязнения! • Валидация, допуск, мониторинг, контроль герметичности Отдел проверки соответствия GMP 18

Специальные технологии 2 Технология • • • Выдувания/дозирования/герметизации Автоматический комплекс – непрерывный процесс: Требования к рабочей и окружающей зоне Конструкция и квалификация оборудования Валидация процесса Методики очистки Персонал и контроль доступа в зону Отдел проверки соответствия GMP 19

ПЕРСОНАЛ • Минимальное, но достаточное количество • Обучение (в т. ч. началам микробиологии) • Избежание перекрестной контаминации • Гигиена персонала • Правила формы одежды Отдел проверки соответствия GMP 20

САНИТАРИЯ • Очистка • • Помещения Оборудования Технологическая одежда Руки персонала Дезинфекция Обеззараживание (фумигация) Мониторинг Отдел проверки соответствия GMP 21

САНИТАРНЫЕ ЗОНЫ • Персонал • Различные этапы переодевания • Воздушные шлюзы • Подача очищенного воздуха • Блокировка дверей Материалы Различные этапы подготовки Воздушные шлюзы Наполнение очищенным воздухом Блокировка дверей Отдел проверки соответствия GMP 22

ВИДЫ СТЕРИЛИЗАЦИИ • Основные аспекты Отдел проверки соответствия GMP 23

Общие требования • Валидация всех процессов • Соответствие и пригодность • Химические и биологические индикаторы • Маркировка и дифференциация • Протоколы циклов стерилизации Отдел проверки соответствия GMP 24

Виды стерилизации • Термическая стерилизация влажный жар сухой жар • Стерилизующая фильтрация • Стерилизация облученикм • Стерилизация оксидом этилена Отдел проверки соответствия GMP 25

Влажный жар (пар) • Объекты, режимі и степень надежности • Регулирующие и контролирующие приборы (t и P и время) • Качество пара • Способы загрузки • Протоколирование Отдел проверки соответствия GMP 26

Сухой жар (1) • Тип оборудования • Помещения под тип оборудования • Воздушные шлюзы в месте выхода транспортера Отдел проверки соответствия GMP 27

Сухой жар (2) • Воздух: Фильтрация и Циркуляция • Избыточное давление воздуха изнутри • Общие требования к стерилизации • Протоколирование Отдел проверки соответствия GMP 28

Стерилизующая фильтрация • Объекты • Качество фильтров (0, 22 мкм !!!) • Подготовка фильтров • Место и временные интервалы • Валидация: учет рисков Отдел проверки соответствия GMP 29

Стерилизация облучением • Объекты • Типы излучений (α, β, ɣ, УФ-волны) • Вредное воздействие • Пригодность процесса • Дозы и контроль • Валидация Отдел проверки соответствия GMP 30

Стерилизация окисью этилена • В крайнем случае !!! • Включения микробных клеток • Температура, влажность • Контроль и протоколы • Валидация продукция не повреждается остаточные количества газа Отдел проверки соответствия GMP 31

ВАЛИДАЦИЯ АСЕПТИЧЕСКИХ ПРОЦЕССОВ • Основные аспекты Отдел проверки соответствия GMP 32

ВАЛИДАЦИЯ АСЕПТИЧЕСКИХ ПРОЦЕССОВ • В случаях, когда для производства стерильных продуктов нельзя использовать финишную стерилизацию, GMP требует, чтобы процедуры приготовления и наполнения проводились в асептических условиях, которые относятся к технологически наисложнейшим в фармацевтическом производстве Отдел проверки соответствия GMP 33

ПРОЦЕДУРЫ ТЕСТА ИМИТАЦИИ ПРОЦЕССА • “Media Fill Test” (далее - MFT) должен имитировать асептический процесс полностью, так, чтобы была возможность оценить достоверность стерильности процесса. • Имитация предоставляет доказательство того, что регулярное производство серий постоянно и надежно дает конечную продукцию требуемого качества. Отдел проверки соответствия GMP 34

Минимальное количество наполняемых единиц по Приложению 1 GMP ЕС после 2009 г. • В случае небольших серий количество контейнеров должно соответствовать размеру промышленной серии. • Во всех остальных случаях минимальное количество наполняемых контейнеров – 5000 (до 2009 г требовалось не менее 3000) • Критерий приемлемости: ни одна единица после наполнения не должна обнаруживать рост микроорганизмов Отдел проверки соответствия GMP 35

Количество наполняемых единиц по Приложению 1 GMP ЕС после 2009 г. • В случае наполнения от 5000 до 10000 единиц: • Одна контаминированная единица – расследование, повторная фасовка питательных сред • Две контаминированные единицы – расследование, ревалидация Отдел проверки соответствия GMP 36

Количество наполняемых единиц по Приложению 1 GMP ЕС после 2009 г. • В случае наполнения более 10000 единиц: • Одна контаминированная единица основание для расследования – • Две контаминированные единицы расследование, ревалидация – Отдел проверки соответствия GMP 37

РЕКОМЕНДАЦИИ PI 007 -6 (1) (Методики испытаний путем моделирования процесса) • • Жидкие препараты (флаконы, ампулы, др) Порошкообразные препараты Лиофилизированные препараты Мягкие препараты (стерильные мази) Отдел проверки соответствия GMP 38

РЕКОМЕНДАЦИИ PI 007 -6 (2) • Препараты для клинических испытаний (малые серии) • Биологические и биотехнологические препараты • Стерильные не расфасованные препараты Отдел проверки соответствия GMP 39

КОНТРОЛЬ КАЧЕСТВА • Тесты на стерильность – только завершающий этап в серии контрольных операций! • Отбор проб – специальные требования • Способы и целостность упаковки • Механические включения Отдел проверки соответствия GMP 40

Современные требования GMP EC Спасибо за внимание! Отдел проверки соответствия GMP 41
Lektsia_6_Steriln_LS.ppt