Буферные системы.ppt
- Количество слайдов: 37

ГОУ ВПО ПГМА Росздрава Буферные системы

Буферными называют растворы, которые сохраняют практически постоянное значение р. Н при добавлении к ним небольших количеств кислоты или щелочи и при разбавлении.

Буферное действие растворов обусловлено наличием в них кислотно-основного равновесия общего типа: n Слабая кислота (донор протонов) + Сопряженное основание (акцептор протонов) n Слабое основание (акцептор протонов) Сопряженная кислота (донор протонов) + n Сопряженные кислотно-основные пары и называют буферными системами.

По принадлежности слабого электролита к классу кислот или оснований буферные системы делятся на : n кислотные основные n амфолиты n
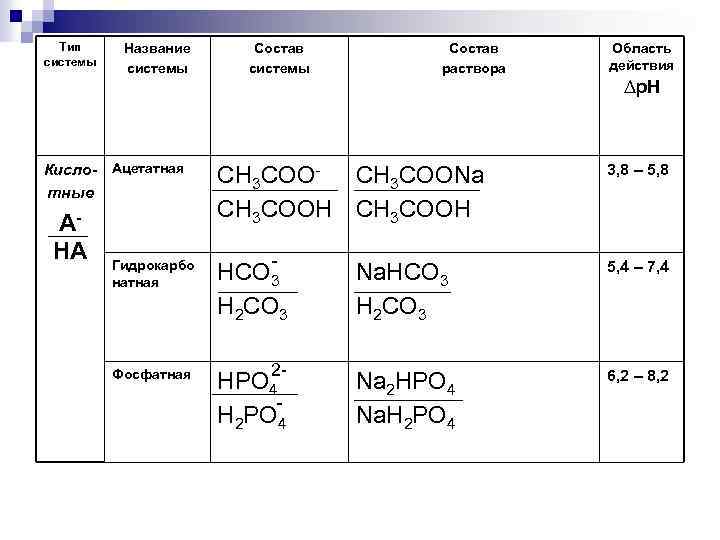
Тип системы Название системы Кисло- Ацетатная тные AHA Состав системы Состав раствора CH 3 COO- CH 3 COONa CH 3 COOH Область действия ∆р. Н 3, 8 – 5, 8 - Na. HCO 3 H 2 CO 3 5, 4 – 7, 4 2 - Na 2 HPO 4 Na. H 2 PO 4 6, 2 – 8, 2 Гидрокарбо натная HCO 3 H 2 CO 3 Фосфатная HPO 4 H 2 PO 4
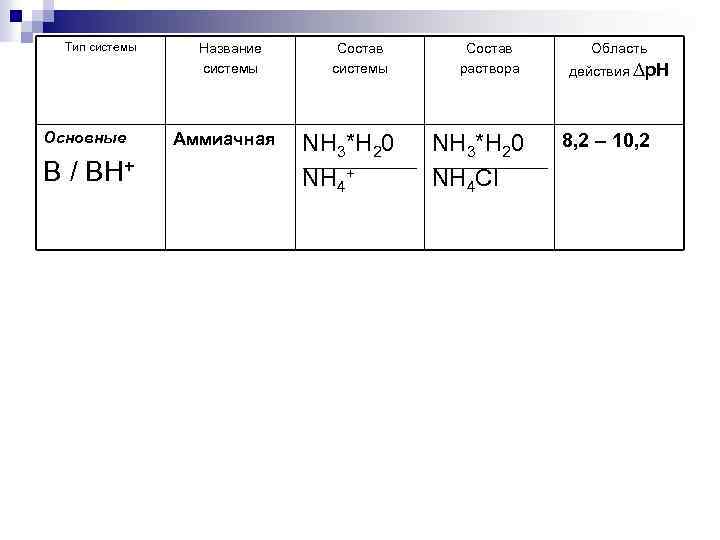
Тип системы Основные B / BH+ Название системы Аммиачная Состав системы NH 3*H 20 NH 4+ Состав раствора NH 3*H 20 NH 4 Cl Область действия ∆р. Н 8, 2 – 10, 2

Тип системы Название системы Амфолиты Белковая и аминокисло тная (содержат кислотную и основную группы) Состав раствора Область действя р. Н соль белка-кислоты H 3 N + белок-кислота p. H<6, 0 - Prot - COO - / H 3 N + - Prot - COOH (A ) (HA) H 2 N- Prot- COОН белок-основание основания - Prot NH 2 (B) соль белка- - COO - / H 3 N + p. H>6, 0 - Prot - COO (BH + ) -

Механизм защитного действия буферных систем по поддержанию постоянства р. Н среды сводится к связыванию добавляемых в раствор ионов H+ и OH- компонентами буферной системы в малодиссоциирующие соединения.

Механизм действия ацетатного буфера CH 3 COONa/CH 3 COOH При добавлении к буферному раствору сильной кислоты протоны связываются ацетат-ионами в слабую уксусную кислоту: H + + CH 3 COO - ® CH 3 COOH

при добавлении щелочей ионы OHнейтрализует уксусная кислота, связывая их в молекулы воды: OH + CH 3 COOH ® H 2 O + CH 3 COO Концентрации компонентов буферной системы и их отношение меняются незначительно, поэтому р. Н раствора остается практически постоянным.
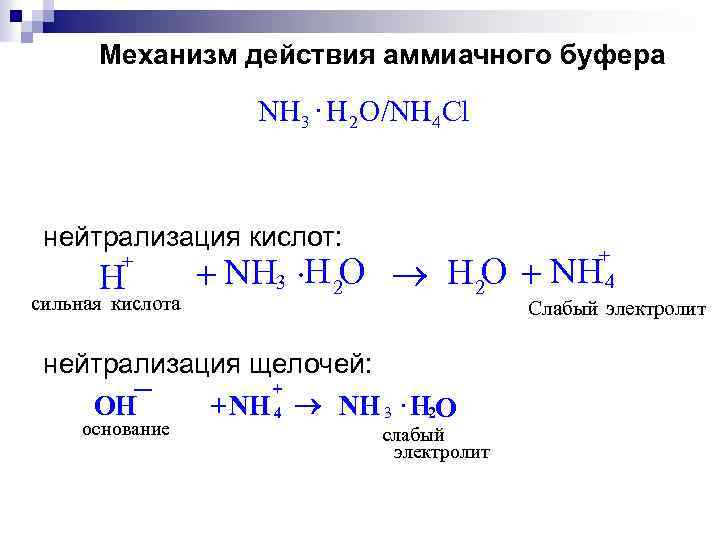
Механизм действия аммиачного буфера NH 3 × H 2 O/NH 4 Cl нейтрализация кислот: + H сильная кислота + 4 + NH 3 ×H 2 O ® H 2 O + NH Слабый электролит нейтрализация щелочей: + + NH 4 ® NH 3 × H 2 O OH основание слабый электролит

р. Н буферных растворов рассчитывают по уравнению Гендерсона-Гассельбаха. В основе расчета р. Н буферных систем лежит закон действующих масс для кислотно-основного равновесия.

Вывод уравнения Гендерсона-Гассельбаха для кислотных буферных систем на примере ацетатного буферного раствора. В кислотных буферных системах всегда наблюдаются два процесса: обратимый – диссоциация слабой кислоты: Ka + CH 3 COOH Û H + CH 3 COO - необратимый – диссоциация соли (сильного электролита): + CH 3 COONa ® Na + CH 3 COO -
![Константа диссоциации уксусной кислоты: Ka = _ [H+] * [CH 3 COO ] [CH Константа диссоциации уксусной кислоты: Ka = _ [H+] * [CH 3 COO ] [CH](https://present5.com/presentation/18788323_135632262/image-14.jpg)
Константа диссоциации уксусной кислоты: Ka = _ [H+] * [CH 3 COO ] [CH 3 COOH] Откуда [H+] -Lg [H+]= = Ka [CH 3 COOH ] _ [CH 3 COO ] -Lg. Ka - Lg p. H= p. Ka - Lg [Кислота] [Соль] p. H= p. Ka + Lg [Соль] [Кислота]

Вывод уравнения Гендерсона – Гассельбаха для аммиачного буферного раствора При взаимодействии слабого основания с водой последняя, выступая донором H+, способствует ионизации этого основания: Kв + NH 3 + H 2 O ® NH 3 × H 2 O ® NH 4 + OH ¬ ¬ Отсюда: [OH−]= Или [OH−]= Прологарифмировав, получаем

р. Н буферных растворов зависит: n от константы диссоциации слабой кислоты (Ка и р. Ка) или основания (Кв и р. Кв) n от отношения концентраций компонентов буферной системы n практически не зависит от разбавления раствора

Способность буферных растворов сохранять р. Н ограничена. Прибавлять кислоту и щелочь, существенно не меняя р. Н буферного раствора, можно лишь в небольших количествах. Величина, характеризующая способность буферного раствора противодействовать смещению реакции среды при добавлении кислот и щелочей, называется буферной емкостью.

Буферная емкость (В) измеряется количеством моль или ммоль эквивалента кислоты или щелочи, добавление которого к 1 л буферного раствора изменяет р. Н на 1. Различают буферную емкость по кислоте (Вк) и буферную емкость по основанию (Вщ): 1 c( z к) * Vк Вк = |р. Н-р. Н 0| * Vбр c( 1 щ) * Vщ z Вщ = |р. Н-р. Н 0| * Vбр 1 1 с( щ) где с ( z к ) и z – молярные концентрации эквивалента кислоты или щелочи соответственно, ммоль/л (моль/л); и – объемы добавленных кислоты или щелочи, л; – объем буферного раствора, л; │р. Н-р. Но│– разность р. Н буферного раствора после и до добавления сильного электролита по модулю.

Буферная емкость зависит от: n концентрации компонентов буферного раствора n отношения концентраций компонентов При отношении 1: 1 р. Н=р. Ка буферная емкость максимальна n Интервал р. Н=р. Ка± 1 называется зоной буферного действия

Буферные системы организма Гидрокарбонатная гемоглобиновая фосфатная белковая. Все эти системы имеются в крови, где с их помощью особенно строго поддерживается р. Н=7, 4± 0, 05, несмотря на поступление в кровь из кишечника и тканей значительного количества кислот и небольшого - оснований.

Гидрокарбонатная буферная система 3 HCO / H 2 CO 3 Соотношение 20: 1 (р. Н = 7, 4) Уравнение Гендерсона – Гассельбаха: - [HCO 3 ] р. Н = р. Ка (H 2 CO 3 ) + Lg [H 2 CO 3 ] Вк > Вщ

Механизм действия Нейтрализация кислот: + _ H + HCO 3 H 2 O + CO 2 Слабая Выводится через легкие нестойкая кислота Нейтрализация оснований: _ _ OH + H 2 CO 3 HCO 3 + H 2 O Слабый электролит Система быстрого эффективного реагирования. Длительность восстановления соотношения 10 - 15 мин.

Фосфатная буферная система 2 - - HPO 4 / H 2 PO 4 Соотношение 4: 1 (р. Н = 7, 4) Содержится в крови, клеточной жидкости тканей, особенно почек. Уравнение Гендерсона – Гассельбаха: - р. Н = р. Ка (H 2 PO 4 ) + Lg Вк > Вщ [HPO 24 - ] [H 2 PO 4 ]

Механизм действия Нейтрализация кислых продуктов (прием мясных продуктов) 24 + - H + HPO H 2 PO 4 выводится почками моча кислая Нейтрализация оснований (употребление растительной пищи) - - OH + H 2 PO 4 H 2 O + HPO 24 удаляется почками моча щелочная Система консервативна Длительность восстановления соотношения (4: 1) 2 - 3 суток

Белковые буферные системы бывают анионного и катионного типов, в зависимости от кислотно-основных свойств белка, характеризуются его изоэлектрической точкой (р. I). При р. Н>р. I эти белки существуют в анионной форме, а при р. Н<р. I - катионной.

Анионный белковый буфер работает в крови (р. Н>6). Он состоит из белка-основания (анионная форма белка ― акцептор Н+ ) и сопряженной кислоты (диполярный ион ― донор Н+): H 2 N - Prot - COO - + H 3 N - Prot - COO + (B) белок-основание (В), Механизм действия: H + + Ý кислые продукты - + H 3 N ОН Ý основные продукты (BH ) белок-соль ― сопряженная кислота ( ¾ H 2 N - Prot - COO - ¾ ® + - Prot - COO - - H 3 N + - ) Prot - COO Ý слабый электролит ¾ ¾® H 2 N - Prot - COO - + Н 2 О Ý слабый электролит

Катионная белковая буферная система обычно поддерживает величину р. Н в физиологических средах с р. Н<6. Она состоит из белка-кислоты (катион белка-донор Н+) и сопряженного основания (диполярный ион ― акцептор Н+): + H 3 N - Prot - COOH белок-кислота (НА) Механизм действия H + + Ý кислые продукты H 3 N + + H 3 N - Prot - COO белок-соль ― сопряженное основание (А-) : - - Prot - COO ¾ ® H 3 N + - Prot ¾ COOH Ý слабый электролит + Н 2 О ¾® H 3 N + - Prot - COO ОН + H 3 N - Prot - COOН ¾ Ý + Ý основные слабый продукты электролит

Гемоглобиновая и оксигемоглобиновая (Нв. O - /НHв. О ) 2 2 буферные системы _ мощные системы эритроцитов. В качестве донора выступают две слабые кислоты: гемоглобин и оксигемоглобин. Роль акцептора выполняют сопряженные этим кислотам основания, т. е. их анионы и. Механизм буферного действия гемоглобиновых систем основан на следующих реакциях: + Нв ® ННв; ОН + ННв ® Нв + Н 2 О; + Нв. О 2 ® ННв. О 2 ; ОН + ННв. О 2 ® Нв. О 2 + Н 2 О . (нейтрализация кислот) (нейтрализация оснований) Гемоглобиновые системы крови эффективно функционируют только в сочетании с другими буферными системами крови.

Совместное действие гемоглобинового и гидрокарбонатного буфера - Нв. О 2/ННв. O 2 (р. Kа = 6, 95); В легких р. О 2 > р. СО 2 , поэтому поступающая венозная кровь насыщается кислородом, ННв + О 2 ® ННв. О 2 более сильная кислота, чем HHв Однако кровь в легочных капиллярах не закисляется, т. к. подключается гидрокарбонатный буфер: карбоангидраза ННв. О 2 + НСО 3 ® Нв. О 2 + Н 2 СО 3 ¾¾ ¾ ¾¾® Н 2 О + СО 2 (выдох) Кровь очищается от летучей кислоты через легкие. Ион с артериальной кровью поступает в ткани.

В тканях р. СО 2 >> р. О 2 и отдает в ткани : 2 ® Нв- + О 2 – идет на биологическое окисление. Нв. О В процессе метаболизма в тканях накапливается CO 2 : CO 2 + Н 2 О ® Н 2 CО 3 Закисления крови не происходит, т. к. H 2 CO 3 нейтрализуется гемоглобиновым буфером: Н 2 СО 3 + Нв - ® НСО 3 + СО 2 + ННв ¾ ¾¾ ® ННв. СО 2 и НСО 3 с венозной кровью переносятся в легкие и через 23 мин. цикл повторяется.

Таким образом, буферные системы крови в сочетании друг с другом участвуют сразу в нескольких важнейших физиологических процессах организма: дыхании, транспорте кислорода в ткани и поддержании постоянства р. Н в крови.
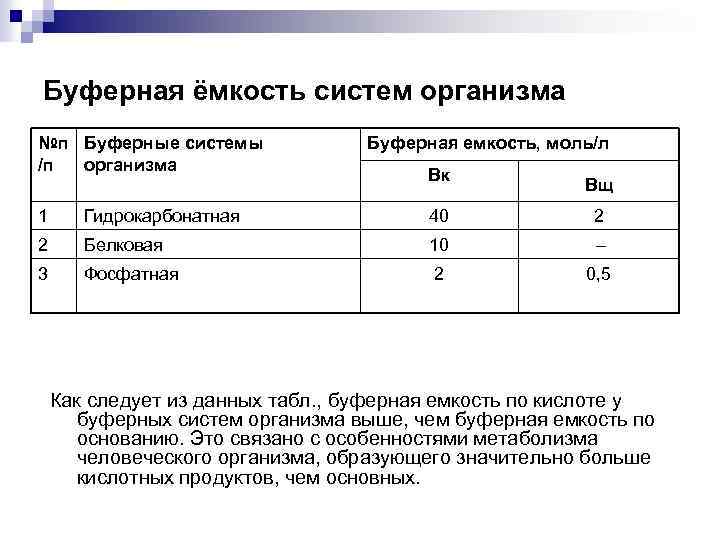
Буферная ёмкость систем организма №п Буферные системы /п организма Буферная емкость, моль/л Вк Вщ 1 Гидрокарбонатная 40 2 2 Белковая 10 – 3 Фосфатная 2 0, 5 Как следует из данных табл. , буферная емкость по кислоте у буферных систем организма выше, чем буферная емкость по основанию. Это связано с особенностями метаболизма человеческого организма, образующего значительно больше кислотных продуктов, чем основных.

Кислотно-основное состояние (КОС) организма КОС(КЩР) – медики оценивают по уравнению Г - Г для гидрокарбонатного буфера. _ [HCO 3 ] р. Нплазмы=р. К(H 2 CO 3) + Lg р. СO 2 КОС крови в норме: р. Нплазмы = 7, 4 ± 0, 05 _ [HCO 3]= 24, 4 ± 3 моль/л - щелочной резерв крови р. CO 2 = 40 мм. рт. ст.

Небольшие изменения р. Н крови компенсируются смещением К 0 равновесия _ между СО 2 в лёгких и НСО 3 в плазме. CO 2 (г) CO 2 (р) + H 2 O H 2 CO 3 + _ H + HCO 3 легкие Плазма Для компенсации р. Н, легкие либо задерживают, либо выводят СО 2

При патологии 7, 0 р. Н ацидоз 7, 4 р. Н алкалоз 7, 8 р. Н Смещение р. Н на 0, 1 – патология на 0, 4– 0, 5 - смерть
![Ацидоз : [Н+] р. Н << 7, 4 р. CO 2 > 40 мм. Ацидоз : [Н+] р. Н << 7, 4 р. CO 2 > 40 мм.](https://present5.com/presentation/18788323_135632262/image-36.jpg)
Ацидоз : [Н+] р. Н << 7, 4 р. CO 2 > 40 мм. рт. ст. [HCO 3 ] Диабет, ИБС, ШОК, пневмония, астма, бронхит, гиповентиляция легких, язва, диарея. Коррекция: 4%р-р Na. HCO 3, 11%р-р лактата Na, 3, 66%р-р трисамина
![+ Алкалоз: [Н ] р. Н>> 7, 4 - [HCO 3 ] р. СО + Алкалоз: [Н ] р. Н>> 7, 4 - [HCO 3 ] р. СО](https://present5.com/presentation/18788323_135632262/image-37.jpg)
+ Алкалоз: [Н ] р. Н>> 7, 4 - [HCO 3 ] р. СО 2 < 40 мм. рт. ст. Рвота, кишечная непроходимость, истерия, гипервентиляция легких, прием щелочных минеральных вод. Коррекция: 5%р-р аскорбиновой к-ты.
Буферные системы.ppt